L-茶氨酸(以下简称茶氨酸)是存在于茶树植物中的一种特殊氨基酸,约占茶叶总游离氨基酸含量的60%~70%,占茶叶干重的1%~2%。茶氨酸最早由日本学者从玉露绿茶中分离得到并将其命名,其化学名称为N-乙基-γ-谷氨酰胺。茶氨酸赋予茶叶鲜美的味道和独特的风味,其在茶叶中的含量会在一定程度上影响茶的质量和价格[1]。除了独特的风味之外,茶氨酸对人体健康有许多有益作用,如缓解压力、改善睡眠质量、调节神经递质的传递、抑制高血压、抗氧化、抗肿瘤以及提高记忆力等[2]。1964年,日本批准茶氨酸作为食品添加剂使用,在使用过程中不作限制用量[3]。1985年,美国食品药品监督管理局确认茶氨酸是一般公认为安全的物质(generally recognized as safe,GRAS),在食品中使用没有特定用量限制[3]。2014年,我国批准茶叶茶氨酸为新食品原料。
茶氨酸主要应用于食品和饮料,其次是保健品和药品。根据恒州博智(QYResearch)的统计,2021年全球茶氨酸市场销售额达到了0.6亿美元,预计2028年将达到0.9亿美元,年复合增长率为6.6%。鉴于茶氨酸的应用价值和市场潜力,本文结合近几年国内外相关的研究报道及课题组的工作,对植物中茶氨酸的合成途径以及茶氨酸的生产技术研究进展进行综述,并对生物法制备的茶氨酸在食品行业中的应用进行了展望。
1 茶氨酸在植物中的合成途径
1.1 茶氨酸在茶树(Camellia sinensis)中的合成
在C.sinensis中,茶氨酸是以谷氨酸和乙胺为底物在茶氨酸合成酶(theanine synthetase,TS)的作用下合成的,反应需要消耗ATP[4],如图1所示。SASAOKA等[5]最早从C.sinensis幼苗中提取了TS,并配制了含有14C标记的乙胺、谷氨酸、MgCl2、ATP、磷酸肌酸和磷酸肌酸激酶的反应体系,确定TS具有合成茶氨酸的活性。谷氨酸作为一种重要底物,主要通过氨的同化合成。与其他植物一样,C.sinensis中![]() 在谷氨酰胺合成酶和谷氨酸合成酶或者谷氨酸脱氢酶的作用下转化为谷氨酸[6]。乙胺作为另一种重要底物,可以通过丙氨酸的脱羧反应合成。研究人员已在C.sinensis的根中发现了丙氨酸脱羧酶(alanine decarboxylase,CsAlaDC)并证实其表达水平与乙胺和茶氨酸浓度正相关[4]。但FU等[7]研究表明,丙氨酸和CsAlaDC位于根细胞的不同部位,尽管CsAlsDC在体外能够催化乙胺形成,但是在茶树中可能无法提供相同的功能。进一步通过稳定同位素标记追踪发现,丙氨酸并没有参与C.sinensis中乙胺的合成而是参与谷氨酸的合成。因此,C.sinensis中乙胺的合成途径仍有待进一步探究。
在谷氨酰胺合成酶和谷氨酸合成酶或者谷氨酸脱氢酶的作用下转化为谷氨酸[6]。乙胺作为另一种重要底物,可以通过丙氨酸的脱羧反应合成。研究人员已在C.sinensis的根中发现了丙氨酸脱羧酶(alanine decarboxylase,CsAlaDC)并证实其表达水平与乙胺和茶氨酸浓度正相关[4]。但FU等[7]研究表明,丙氨酸和CsAlaDC位于根细胞的不同部位,尽管CsAlsDC在体外能够催化乙胺形成,但是在茶树中可能无法提供相同的功能。进一步通过稳定同位素标记追踪发现,丙氨酸并没有参与C.sinensis中乙胺的合成而是参与谷氨酸的合成。因此,C.sinensis中乙胺的合成途径仍有待进一步探究。
茶氨酸主要是在C.sinensis的根中合成,这里也是冬季茶氨酸的临时贮存场所。当春季到来,茶氨酸就被运输到幼芽中[8]。茶氨酸的合成受到氨态氮(NH4-N)、硝态氮(NO3-N)、光、温度和盐等非生物因素的影响。悬浮培养茶叶细胞实验表明,氮素绝对量以及NH4-N和NO3-N的比值对茶氨酸合成的影响最大[9]。此外,茶氨酸可以被茶氨酸氨基水解酶水解,产生谷氨酸和乙胺。水解反应主要发生在叶片中[10]。
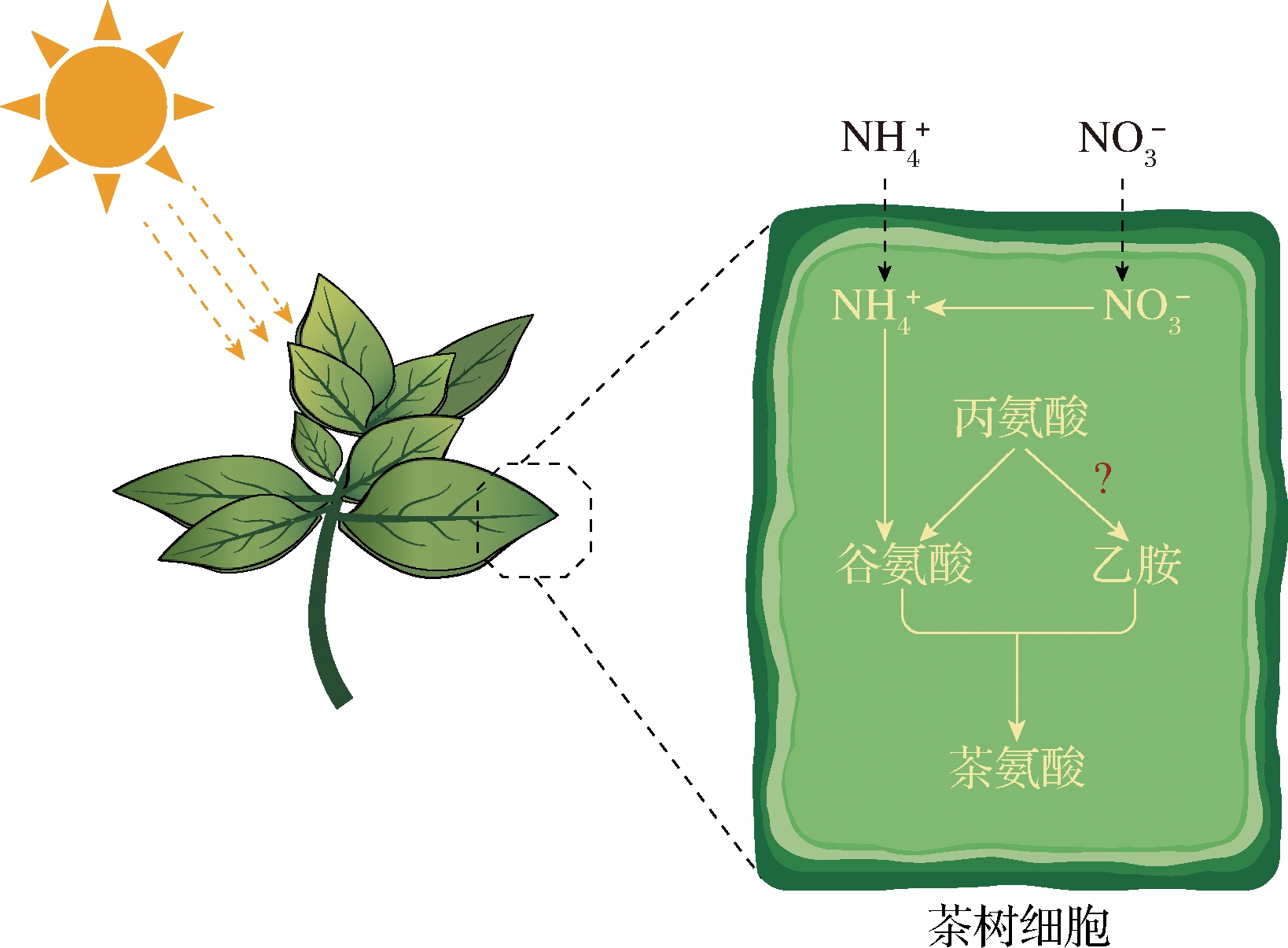
图1 茶树中茶氨酸的合成途径
Fig.1 Pathway of theanine synthesis in Camellia sinensis
1.2 茶氨酸在其他植物中的合成
C.sinensis和少数植物能够完全依靠自身代谢合成茶氨酸,而其他植物只能利用外源底物合成茶氨酸。CHENG等[11]考察了茶树(C.sinensis)、金花茶(C.nitidissima)、山茶(C.japonica)、玉米(Zea mays)、鼠耳芥(Arabidopsis thaliana)和番茄(Solanum lycopersicum)中的代谢物。结果表明,上述植物中都有谷氨酸的积累,但只有茶树属植物(Camellia)和玉米(Z.mays)中有乙胺和茶氨酸的积累,且C.sinensis中茶氨酸的积累量最多。如果将同位素标记的乙胺供给上述植物的根和叶,那么在这些植物中都可以检测到茶氨酸。因此,这些植物中都存在能够催化茶氨酸合成的酶。
由于茶氨酸与谷氨酰胺的结构非常相似,TS与L-谷氨酰胺合成酶(L-glutamine synthetase,GS)两种酶具有高度同源性。研究表明,C.sinensis 来源的TS1与GS3的同源性为99%,TS2与GS1的同源性为97%,而TS1和TS2之间的同源性仅为83%[12]。随后,研究人员分别从Z.mays[13],A.thaliana[14]和S.lycopersicum[15]中克隆并鉴定了GS编码基因,其中A.thaliana中的GS具有合成谷氨酰胺和茶氨酸的活性,说明在底物合适的情况下,一些植物可以通过GS合成茶氨酸。
2 茶氨酸生产技术研究进展
2.1 植物提取法
从茶叶或茶渣中直接提取、分离和纯化茶氨酸是最直接、有效和安全的生产方式,也能最大程度上保持茶氨酸的天然活性和功能。茶氨酸的提取方法主要包括沉淀法、离子交换树脂法及膜分离法。沉淀法是利用茶氨酸可溶于水的特点,先用热水浸提茶叶,再将醋酸铅加入浸提液中沉淀除去蛋白质、多酚和一部分色素,最后过滤、浓缩和精制后获得天然茶氨酸产品[16]。这种方法产品得率低,容易引入大量重金属离子,操作复杂,易造成茶氨酸的损失。离子交换树脂法是利用茶氨酸两性电解质的特性,采用强酸性阳离子对其进行分离纯化的过程[17]。将茶叶浸提物经絮凝和沉淀除去蛋白质和一些色素,再通过吸附进一步除去色素、多酚等大分子有机物,然后将滤液通过离子交换树脂获得粗品茶氨酸,粗产物最后用无水乙醇重结晶获得纯度大于90%的产品。这种方法收率很低,而且原料成本很高。膜分离法富集茶氨酸是利用不同孔径大小的膜将茶氨酸与杂质分离,从而达到富集和初步纯化茶氨酸的效果[18]。通过该方法获得的产品纯度和得率较低,仅适用于茶氨酸生产的初步分离。
目前我国已经批准茶叶茶氨酸作为新食品原料,但茶叶中茶氨酸的含量仅为7~12 mg/g干重,且采用提取法制备的茶氨酸大多为黄色粉末,纯度普遍较低(>20%)。如需获得高纯度产品,需要增加繁琐的提取工序,如多步的树脂吸附及分离,从而显著增加了生产成本,影响了产品的终端应用。总体来说,利用提取法制备茶氨酸无法满足大规模生产和应用的要求。
2.2 化学合成法
化学合成法是获得高纯度茶氨酸的有效方法,也是近年来茶氨酸工业化生产的主要方法。以谷氨酸供体(主要是酯型谷氨酸供体或乙酰化谷氨酸供体)为原料,通过保护α-氨基和α-羧基、活化γ-羧基、与乙胺或乙胺供体反应、脱除保护基等步骤制备茶氨酸。化学合成法生产茶氨酸始于20世纪50年代,经不断的发展已经形成了包括焦谷氨酸法(L-吡咯烷酮酸法)[19]、N-取代谷氨酸γ-酯法[20]和N-取代谷氨酸酐法[21]在内的多种合成工艺。
化学合成茶氨酸具有成本低、纯度高、可大规模生产等特点。但是,化学合成产品易形成D、L-型消旋体,需要对其分离才能得到L型茶氨酸。日本学者在这一领域做了很多工作,成功通过固定化消旋酶技术分离了D、L-型茶氨酸,但分离成本较高,产品收率较低。此外,消费者难以接受化学合成的“非天然”茶氨酸,导致化学合成产品的应用局限在保健品和药品,无法应用于对安全性要求较高的食品和饮料中。
2.3 酶催化法
酶催化法制备茶氨酸具有立体选择性强、底物特异性强、催化时间短、产量高以及催化剂可再生等优势,已成为近年来的研究热点。国内外的研究表明共有5种微生物来源的酶可以催化茶氨酸的合成,包括γ-谷氨酰转肽酶(γ-glutamyltranspeptidase,GGT)、L-谷氨酰胺酶、GS、γ-谷氨酰甲胺合成酶(γ-glutamylmethylamide synthetase,GMAS) 以及γ-谷氨酰半胱氨酸合成酶(γ-glutamylcysteine synthetase,γ-GCS)。GGT和L-谷氨酰胺酶可以直接催化γ-谷氨酰基的转移反应,无需消耗ATP;GS,GMAS和γ-GCS能够以谷氨酸为底物合成茶氨酸,但需要消耗ATP。表1中列举了酶催化法制备茶氨酸的典型案例。
表1 酶催化法制备茶氨酸
Table 1 Enzymatic Synthesis of Theanine

酶来源菌株催化方式原料反应条件茶氨酸产率/(mmol·L-1)参考文献GGTE.coli纯酶催化200 谷氨酰胺, 1 500 mmol/L 乙胺pH 10, 37 ℃, 2 h120[22]E.coli纯酶催化100 mmol/L 谷氨酸甲酯, 1 000 mmol/L 乙胺pH 10, 45 ℃, 8 h95[23]E.coli点突变, 纯酶催化120 mmol/L 谷氨酰胺, 480 mmol/L 乙胺pH 9, 45 ℃, 8 h106.9[24]B.subtillis 168E.coli BL21表达, 纯酶催化1 000 mmol/L 谷氨酰胺, 2200 mmol/L 乙胺pH 10, 37 ℃, 5 h450[25]B.licheniformis ATCC 27811点突变, E.coli BL21表达, 纯酶催化250 mmol/L 谷氨酰胺, 600 mmol/L 乙胺pH 10.5, 37 ℃, 4 h235[26]B.amyloliquefaciens ZS5点突变, E.coli BL21表达, 纯酶催化200 mmol/L 谷氨酰胺, 2 000 mmol/L 乙胺pH 10, 55 ℃, 5 h166[27]L-glutaminaseP.nitroreducens IFO 12694纯酶催化700 mmol/L 谷氨酰胺, 1 500 mmol/L 乙胺pH 9, 30 ℃, 7 h270[28]P.nitroreducens SP.001纯酶催化750 mmol/L 谷氨酰胺, 2 500 mmol/L 乙胺pH 9.5, 30 ℃, 11 h490[29]Trichoderma koningii纯酶催化300 mmol/L 谷氨酰胺, 900 mmol/L 乙胺pH 8, 37 ℃43[30]GSP.taetrolens Y-30纯酶催化, 面包酵母再生ATP200 mmol/L 谷氨酸, 1 200 mmol/L 乙胺, 葡萄糖pH 7, 30 ℃, 24 h170[31]B.subtilisE.coli BL21表达, 粗酶催化, 面包酵母再生ATP200 mmol/L 谷氨酸, 1 300 mmol/L 乙胺, 葡萄糖pH 7.5, 37 ℃, 8 h87.8[32]GMASM.mays No.9纯酶催化,面包酵母再生ATP600 mmol/L 谷氨酸, 600 mmol/L 乙胺, 葡萄糖pH 7, 30 ℃, 48 h600[33]M.mays No.9E.coli BL21表达, 粗酶催化, 聚磷酸激酶再生200 mmol/L 谷氨酸, 200 mmol/L 乙胺, 5 mmol/L ATPpH 7, 37 ℃, 24 h172[34]γ-GCSE.coliE.coli BL21全细胞催化414 mmol/L 谷氨酸, 429 mmol/L 乙胺, 12 mmol/L ATP, 葡萄糖pH 7.2, 37 ℃, 18 h12.1[35]E.coli点突变, 纯酶催化, 聚磷酸激酶再生200 mmol/L 谷氨酸, 200 mmol/L 乙胺, 5 mmol/L ATPpH 8.5, 37 ℃, 2 h164.7[36]
2.3.1 GGT
GGT广泛存在于各种生物中,可以催化γ-谷氨酰肽中键的水解,并将γ-谷氨酰基转移到氨基酸或肽,即同时催化水解反应与转肽反应。细菌来源的GGT具有广泛的底物特异性,但只有E.coli和Bacillus species来源的GGT可以用于茶氨酸的合成。SUZUJI等[22]首次证明E.coli K-12来源的GGT(EcGGT)可催化谷氨酰胺和乙胺合成茶氨酸,转化率为60%。而使用谷氨酸γ-甲酯代替谷氨酰胺作为γ-谷氨酰基供体,EcGGT的酶活提高了1.2倍,转化率提高到95%[23]。进一步使用B-FITTER软件分析EcGGT中与温度因素相关的所有氨基酸残基,筛选出Glu387残基进行突变,突变体E387Q的反应温度提高了10 ℃,可以催化120 mmol/L谷氨酰胺产生106.9 mmol/L的茶氨酸,转化率为89.1%[24]。与E.coli相比,Bacillus species来源的GGT的催化活力更高。但使用9 U/mL B.subtillis 168来源的GGT催化1 mol/L谷氨酰胺产生450 mmol/L茶氨酸,但转化率只有45%[25]。通过对B.licheniformis来源的GGT(BlGGT)中Asn450残基进行突变,突变体N450A和N450D的催化效率从16.04 mmol/(L·s)提高到123.65 mmol/(L·s)以上,而且其转肽活性和水解活性的比例从3.5提高到7.6以上[37]。在使用25 μg/mL BlGGT/N450D催化250 mmol/L谷氨酰胺反应中,最终产生235 mmol/L的茶氨酸,转化率为94%[26]。LI等[27]从海洋细菌B.amyloliquefaciens中获得了耐盐的GGT(BaGGT),并通过易错PCR方法对其突变,突变体V319A/S437G转肽活性和水解活性的比例从1.6提高到35.6。使用20 μg/mL BaGGT/V319A/S437G催化200 mmol/L谷氨酰胺产生166 mmol/L茶氨酸,转化率为83%。
使用GGT催化的优势在于它并不依赖ATP,且反应条件温和,操作简便。但该酶也存在一个严重的缺点,在其反应过程中通常需要添加较高浓度的乙胺并控制pH值在适宜范围内,以防止底物谷氨酰胺的水解以及由于自转肽作用产生副产物γ-谷氨酰谷氨酰胺。
2.3.2 L-谷氨酰胺酶
L-谷氨酰胺酶属于一种酰胺基水解酶,在各类原核和真核生物中都有广泛分布。一些微生物来源的L-谷氨酰胺酶可以催化谷氨酰胺的γ-谷氨酰基向受体分子羟胺的转移反应,其中来源于Pseudomonas species的L-谷氨酰胺酶具有合成茶氨酸的活性。TACHIKI等[28]首次从P.nitroreducens IFO 12694中分离出L-谷氨酰胺酶,证明其可以分别以羟胺、甲胺和乙胺作为受体分子。使用0.5 U/mL该酶催化0.7 mol/L谷氨酰胺产生0.27 mol/L茶氨酸,转化率为54%。SHUAI等[29]利用15.5%蔗糖溶液处理P.nitroreducens SP.001细胞后,渗透冲激下L-谷氨酰胺酶酶活提高239%。使用1 U/mL该酶催化0.75 mol/L谷氨酰胺产生0.49 mol/L茶氨酸,转化率为66%。此外,真菌Trichoderma koningii来源的L-谷氨酰胺酶也可以催化茶氨酸的合成,但转化率较低[30]。
L-谷氨酰胺酶的性质与GGT相似,即不需要消耗ATP就可以合成茶氨酸,但对于底物浓度和pH等反应条件的要求较高。为了增强L-谷氨酰胺酶的稳定性和重复利用性,研究人员使用介孔二氧化硅(mesoporous silica,MPS)作为固定化载体来固定L-谷氨酰胺酶,并通过氧化锆对MPS进行表面修饰以提高载体在高pH值下的稳定性,从而增加了固定化酶在茶氨酸生产中的使用次数[38]。
2.3.3 GS
GS在ATP的存在下主要催化谷氨酸盐和游离氨合成谷氨酰胺,与生命系统中氮代谢和谷氨酰胺的合成息息相关。一些细菌来源的GS具有催化茶氨酸合成的能力。TACHIKI等[39]首次从Micrococcus glutamicus ATCC 13032中分离出GS,证明其可以分别以甲胺或乙胺为底物合成γ-谷氨酰甲胺和茶氨酸。随后,YAMAMOTO等[40]从Pseudomonas taetrolens Y-30中分离出GS(PtGS),证明其对乙胺的活性比氨高出7%。该酶的基因序列已被测出(GenBank No.AB233456),并在大肠杆菌中成功表达,重组GS显示出与原酶相同的特性,并且活力提升了30倍。
细菌来源的GS催化的连接反应需要连续供应ATP,因此ATP的再生对于GS的工业应用至关重要。在研究GS催化合成茶氨酸时,开发了一种使用面包酵母再生ATP的有效途径。该途径被称作“能量转移与发酵偶联”,即利用酵母代谢葡萄糖产生ATP,从而为酶催化反应提供能量。YAMAMOTO等[31]利用100 U/mL的PtGS和60 g/L的酵母细胞催化200 mmol/L谷氨酸可产生170 mmol/L茶氨酸,转化率为85%。而ZHOU等[32]使用0.1 mg/L B.subtillis 168来源的GS和30 g/L的酵母细胞催化200 mmol/L谷氨酸产生87.8 mmol/L茶氨酸,转化率为44%。
2.3.4 GMAS
GMAS在ATP的存在下主要催化谷氨酸和甲胺合成N-甲基-γ-谷氨酰胺(N-methyl-γ-glutamine,γ-GMA),在甲胺营养型细菌的碳代谢中发挥重要作用。KIMURA等[41]首次从Methylophaga sp. AA-30中分离出GMAS,该酶显示出较宽的底物特异性范围,并能以乙胺为底物合成茶氨酸。YAMAMOTO等[42]从Methylovorus mays No.9中也分离出GMAS(MmGMAS),该酶对乙胺具有极高的亲和力,在中性pH值条件下催化低浓度乙胺合成茶氨酸的效率比PtGS高出20倍。该酶的基因序列已被测出(GenBank No.AB333782),并在大肠杆菌中成功表达。重组GMAS显示出与原酶相同的特性,并且活力提升了23倍。
与GS相似的是,GMAS催化需要使用ATP。LIU等[33]利用聚磷酸激酶(polyphosphate kinase,PPK)再生ATP,使用30 U/mL的MmGMAS和8 U/mL的PPK催化400 mmol/L谷氨酸产生340 mmol/L茶氨酸,转化率达到84%。相比之下,利用“能量转移与发酵偶联”途径再生ATP[34],使用30 U/mL的MmGMAS和60 g/L的酵母细胞催化600 mmol/L谷氨酸产生约600 mmol/L茶氨酸,转化率为100%,显示出良好的工业应用前景。
2.3.5 γ-GCS
γ-GCS在ATP的存在下主要催化谷氨酸和半胱氨酸为合成γ-谷氨酰半胱氨酸,这是谷胱甘肽合成的第一步反应。MIYAKE等[35]指出大肠杆菌γ-GCS具有广泛的底物特异性,能够催化谷氨酸和脂肪胺类化合物生成γ-谷氨酰胺类化合物。利用大肠杆菌γ-GCS和自身糖代谢产生的ATP,可以催化414 mmol/L谷氨酸产生12.1 mmol/L茶氨酸,转化率只有3%。HIBI等[43]解析了大肠杆菌γ-GCS的晶体结构,三维模型显示出底物谷氨酸结合口袋具有高度专一性,而半胱氨酸结合口袋能够接受与半胱氨酸大小和极性相似的化合物,如乙胺、甘氨酸等,但是催化茶氨酸合成的活性较低。YAO等[36]采用随机突变方法对大肠杆菌γ-GCS定向进化,突变体γ-GCS13B6酶活力是野生型的14倍,可以催化200 mmol/L谷氨酸产生174 mmol/L茶氨酸,转化率达到87%。
2.4 微生物发酵法
从已报道的利用酶催化法制备茶氨酸的研究可以看出(表1),使用高度亲和乙胺的GMAS结合ATP再生系统是最有效的合成茶氨酸的手段。但是酶催化法也存在一些问题,如催化体系复杂、底物价格昂贵、酶制备和酶反应需要分步进行、设备占用率高等,因此生产成本明显高于化学法。虽然使用固定化方法能够减少酶的使用成本,但对于含有ATP再生系统的酶催化体系进行固定化难度较大,且不易放大到工业规模。与酶催化法相比,微生物发酵法路线简单、培养基原料价格低廉、设备占用率低,更适用于茶氨酸的工业化生产。表2中列举了发酵法制备茶氨酸的典型案例。
表2 发酵法制备茶氨酸
Table 2 Production of theanine by fed-batch fermentation
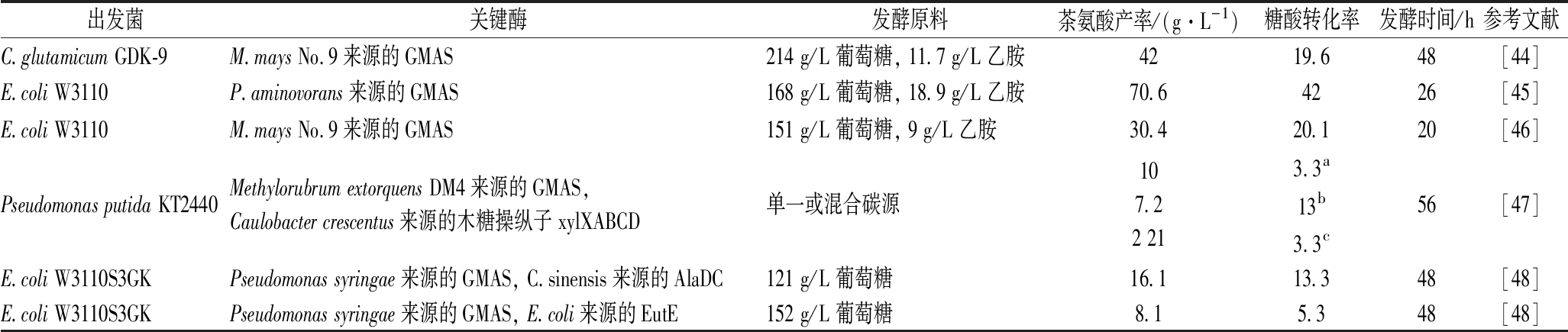
出发菌关键酶发酵原料茶氨酸产率/(g·L-1)糖酸转化率发酵时间/h参考文献C.glutamicum GDK-9M.mays No.9来源的GMAS214 g/L 葡萄糖, 11.7 g/L 乙胺4219.648[44]E.coli W3110P.aminovorans来源的GMAS168 g/L 葡萄糖, 18.9 g/L 乙胺70.64226[45]E.coli W3110M.mays No.9来源的GMAS151 g/L 葡萄糖, 9 g/L 乙胺30.420.120[46]Pseudomonas putida KT2440Methylorubrum extorquens DM4来源的GMAS, Caulobacter crescentus来源的木糖操纵子 xylXABCD单一或混合碳源107.22 213.3a13b3.3c56[47]E.coli W3110S3GKPseudomonas syringae来源的GMAS, C.sinensis来源的AlaDC121 g/L 葡萄糖16.113.348[48]E.coli W3110S3GKPseudomonas syringae来源的GMAS, E.coli来源的EutE152 g/L 葡萄糖8.15.348[48]
注:a表示葡萄糖和木糖作为碳源,b表示甘油作为碳源,c表示甘油和木糖作为碳源
2.4.1 乙胺流加发酵制备茶氨酸
GMAS以谷氨酸和乙胺为底物,且反应需要消耗ATP。考虑到谷氨酸为微生物的初级代谢产物,而ATP通过呼吸作用可以产生,因此理论上只需要在微生物细胞内构建谷氨酸到茶氨酸的代谢途径,增强葡萄糖到谷氨酸和茶氨酸的代谢通量,并在发酵过程中流加前体物乙胺,即可实现茶氨酸的发酵生产。
谷氨酸棒杆菌属于GRAS菌株,并且天然能够产生谷氨酸。本课题组以谷氨酸高产菌C.glutamicum GDK-9作为出发菌株构建茶氨酸生产菌株(图2)[44]。构建质粒pXTuf 在GDK-9中过表达MmGMAS,流加乙胺发酵检测到茶氨酸的产生,但还有大量谷氨酸的残留。敲除谷氨酸分泌蛋白基因Ncgl1221,重组菌株13032ΔNcgl1221/pXtuf-gmasMm在5 L发酵罐发酵48 h可以产生42 g/L茶氨酸,对葡萄糖的转化率达到19.6%,副产物丙氨酸和谷氨酸含量小于1 g/L,赖氨酸的含量为1.86 g/L。此外,尝试以基因组整合方式替代质粒表达MmGMAS,但是三拷贝tuf-gmasMm重组菌株的茶氨酸产量依然较低。

Ncgl1221-谷氨酸转运蛋白;GMAS-γ-谷氨酰甲胺合成酶
图2 代谢工程改造C. glutamicum构建茶氨酸生产菌
Fig.2 Metabolic engineering of C. glutamicum for theanine production
与谷氨酸棒杆菌相比,大肠杆菌具有生长周期短、营养需求低、基因表达元件丰富等特点。本课题组以野生型E.coli W3110作为出发菌株,构建无质粒的茶氨酸生产菌株[45-46]。首先引入Paracoccus aminovorans来源的GMAS,并使用“T7RNA聚合酶-T7启动子”系统控制并增强gmasPa的表达。其次,过表达内源的柠檬酸合酶基因gltA和C.glutamicum来源的谷氨酸脱氢酶基因cgl2079,增加前体物谷氨酸的合成。然后,敲除琥珀酰CoA合成酶基因sucCD,阻断三羧酸循环,让碳代谢更多流向茶氨酸合成,同时过表达C.glutamicum来源的丙酮酸羧化酶基因cgl0689,回补缺失的草酰乙酸。最后,过表达Mannheimia succiniciproducens来源的磷酸烯醇式丙酮酸羧激酶基因pckMs,减少羧化反应ATP的消耗。对5 L发酵罐中乙胺的流加方式进行了优化,在最优条件下,重组菌株E.coli TH11发酵26 h可以产生70.6 g/L茶氨酸,对葡萄糖的转化率达到42%,副产物乙酸的含量小于1 g/L,具有较好的工业应用前景。
恶臭假单胞菌是一种革兰氏阴性、非致病性的土壤细菌,具有鲁棒性强、营养需求低、生长迅速等特点。BENNINGHAUS等[47]以Pseudomonas putida KT2440为出发菌株构建茶氨酸生产菌株。首先,利用内源的Ptac控制的gdhA基因替换甘油代谢转录调节蛋白基因glpR,增强谷氨酸合成的同时,提高菌株对于甘油的利用率。然后,使用pEV1质粒过表达Methylorubrum extorquens DM4来源的GMAS,构建出茶氨酸的合成代谢通路。接着,使用pEV3质粒过表达Caulobacter crescentus来源的木糖操纵子xylXABCD,使菌株能够利用木糖作为碳源。在2 L发酵罐中,重组菌株Thea1能够利用葡萄糖和木糖产生10 g/L茶氨酸,对碳源的转化率为3.3%;能够利用甘油产生17.2 g/L茶氨酸,对甘油的转化率为13%。重组菌株TheaX能够利用甘油和木糖产生21 g/L茶氨酸,对碳源的转化率为3.3%。
2.4.2 葡萄糖从头发酵制备茶氨酸
尽管乙胺流加发酵可有效生产茶氨酸,但乙胺本身具有细胞毒性,其沸点为16.6 ℃,气化后对人体健康不利,对外部环境有害,因此需要特殊设备进行补料。此外,没有完全代谢的乙胺会在胞外大量积累,限制菌体生长,弱化ATP再生,从而抑制茶氨酸的合成。为减少乙胺使用过程中的危险性,直接利用葡萄糖从头发酵制备茶氨酸是有效的解决方案,但难点在于如何在细胞中构建高效的乙胺合成途径。
尚未报道微生物中存在乙胺的合成途径。在茶树中,乙胺主要通过丙氨酸的脱羧反应产生。BAI等[49]通过分析茶树根系中氨基酸含量和不同氮源引起的基因表达差异,首次解析了CsAlaDC编码基因。该酶与其他物种的丝氨酸脱羧酶高度同源,但对丙氨酸脱羧活性为丝氨酸脱羧活性的8~10倍。而FENG等[50]采用无细胞蛋白质合成系统同时表达CsAlaDC和PtGS,以丙氨酸和谷氨酸为底物产生3.82 mmol/L的茶氨酸,进一步说明CsAlaDC可以用于茶氨酸的合成。HAGIHARA等[48]通过在大肠杆菌中构建重组质粒, 共表达Pseudomonas syringae来源的PsGMAS、CsAlaDC、以及B.subtilis 168来源的丙酮酸脱氢酶BsAld,可实现从葡萄糖到茶氨酸的从头合成途径(图3)。此外,敲除了内源的GGT基因,减少茶氨酸的降解反应。重组菌株TEA6△ggt在3 L发酵罐中发酵48 h产生16.1 g/L茶氨酸,对葡萄糖的转化率为13.3%。
乙醛的胺化反应是乙胺合成的另一途径,反应效率取决于转氨酶的活性。HAGIHARA等[48]鉴定并筛选得到了一种来源于Pseudomonas putida KT2440的转氨酶(transaminase,PpTA8),能够有效催化乙醛的胺化反应。通过质粒共表达PsGMAS、BsAld、PpTA8以及内源的乙醛脱氢酶(acetaldehyde dehydrogenase,EutE),构建出全新的从葡萄糖到茶氨酸的从头合成途径(图3)。此外,在敲除了内源的GGT基因后,减少茶氨酸的降解反应。重组菌株TEA4△ggt在3 L发酵罐中发酵48 h产生8.1 g/L茶氨酸,对葡萄糖的转化率为5.3%。
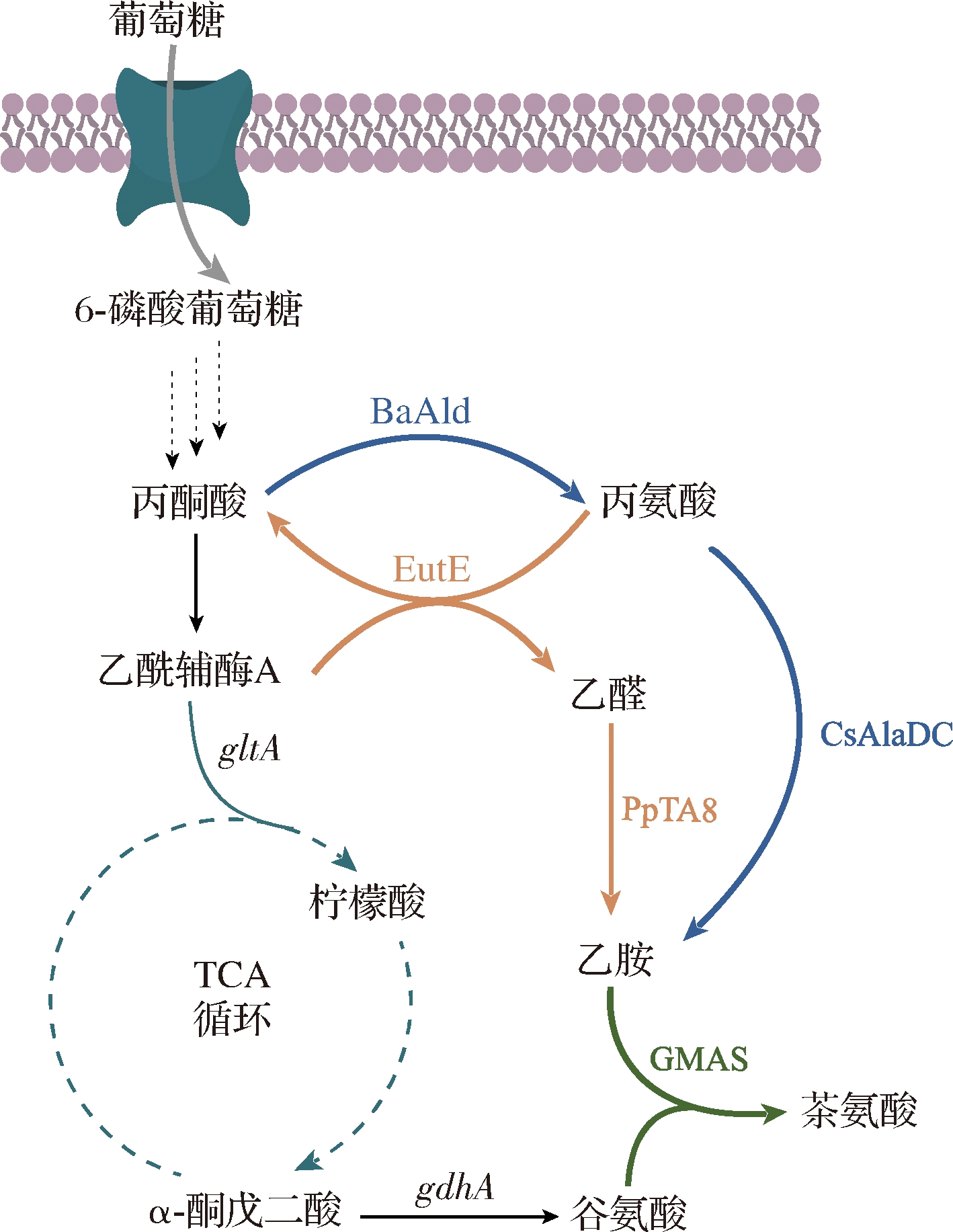
GMAS-γ-谷氨酰甲胺合成酶;EutE-乙醛脱氢酶;PpTa8-转氨酶;BsAld-丙氨酸脱氢酶; CsAlaDC-丙氨酸脱羧酶;gdhA-谷氨酸脱氢酶编码基因;gltA-柠檬酸合成酶编码基因
图3 代谢工程改造E.coli构建茶氨酸生产菌
Fig.3 Metabolic engineering of E.coli for theanine production
3 生物法制备的茶氨酸在食品行业中的应用展望
心理压力是抑郁症、情绪波动、免疫和年龄相关疾病、心血管疾病以及不同类型癌症的主要原因。茶氨酸作为一种新兴的食品添加剂,除了可以改善风味之外,更重要的是可以通过影响脑内神经递质(如γ-氨基丁酸和多巴胺)含量,缓解神经紧张,使人产生轻松感。茶氨酸作为天然镇静剂、抗抑郁剂在日本、美国的市场认可度较高,已形成上百种的功能食品、饮料以及保健品。虽然我国批准茶叶茶氨酸(以茶叶为原料,经提取、过滤、浓缩等工艺制成的茶氨酸)作为新食品原料[51],但通过植物提取法获得的茶叶茶氨酸收率低、成本高,已无法满足日益增长的市场需求。
健康意识的提高和紧张的生活方式使人们更加追求天然健康补充剂和添加剂,而不是合成产品。因此,使用生物法替代植物提取法生产茶氨酸是必然的趋势。目前,我国对于生物法制备的新食品原料具有严格的要求。以新食品原料γ-氨基丁酸[52]为例,其生产工艺是以L-谷氨酸钠为原料经希氏乳杆菌(Lactobacillus hilgardii)发酵、加热杀菌、冷却、活性炭处理、过滤、加入调配辅料(淀粉)、喷雾干燥等步骤而成。其中,L.hilgardii属于GRAS菌株,原料L-谷氨酸钠即味精是常见的食品添加剂。因此,菌种(发酵和产酶菌种)、原料以及工艺的安全性是新食品原料获批的关键。从生产技术的角度,酶催化法制备茶氨酸需要使用乙胺作为原料,而微生物发酵法能够以葡萄糖为原料直接制备茶氨酸。因此,微生物以糖质原料直接发酵制备的茶氨酸更有成为新食品原料的潜质,但要特别注意微生物及工艺的安全性评价[53]。目前,葡萄糖从头发酵制备茶氨酸的产量和转化率,与流加乙胺发酵相比还有很大差距。未来需要使用合成生物学方法,平衡前体物乙胺和谷氨酸的合成代谢,弱化前体物的支路代谢,筛选更高效的乙胺和茶氨酸合成用酶,构建高产茶氨酸的生物安全性微生物,推动生物法制备的茶氨酸在食品行业中的全面应用。
[1] YU Z M, YANG Z Y.Understanding different regulatory mechanisms of proteinaceous and non-proteinaceous amino acid formation in tea (Camellia sinensis) provides new insights into the safe and effective alteration of tea flavor and function[J].Critical Reviews in Food Science and Nutrition, 2020, 60(5):844-858.
[2] SAEED M, KHAN M S, KAMBOH A A, et al.L-theanine:An astounding Sui generis amino acid in poultry nutrition[J].Poultry Science, 2020, 99(11):5 625-5 636.
[3] 帅玉英, 沈宇峰, 黄海娟, 等.功能性配料茶氨酸的生产应用与法规情况简介[J].中国食品添加剂, 2013(S1): 215-219.
SHUAI Y Y, SHEN Y F, HUANG H J, et al.Applications and regulation of functional ingredient, L-theanine[J].China Food Additives, 2013(S1): 215-219.
[4] ZHU B Y, GUO J Y, DONG C X, et al.CsAlaDC and CsTSI work coordinately to determine theanine biosynthesis in tea plants (Camellia sinensis) and confer high levels of theanine accumulation in a non-tea plant[J].Plant Biotechnology Journal, 2021, 19(12):2 395-2 397.
[5] SASAOKA K, KITO M, INAGAKI H.Studies on the biosynthesis of theanine in tea seedlings synthesis of theanine by the homogenate of tea seedlings[J].Agricultural and Biological Chemistry, 1963, 27(6):467-468.
[6] LIU S H, LI J, HUANG J N, et al.New advances in genetic engineering for L-theanine biosynthesis[J].Trends in Food Science & Technology, 2021, 114:540-551.
[7] FU X M, LIAO Y Y, CHENG S H, et, al.Stable isotope-labeled precursor tracing reveals that L-Alanine is converted to L-theanine via L-glutamate not ethylamine in tea plants in vivo[J].Journal of Agricultural and Food Chemistry, 2021, 69(50):15 354-15 361.
[8] DONG C X, LI F, YANG T Y, et, al.Theanine transporters identified in tea plants (Camellia sinensis L.)[J].The Plant Journal, 2020, 101(1):57-70.
[9] MATSUURA T, KAKUDA T, KINOSHITA T, et, al.Theanine formation by tea suspension cells[J].Bioscience, Biotechnology, and Biochemistry, 1992, 56(8):1 179-1 181.
[10] FU X M, LIAO Y Y, CHENG S H, et, al.Nonaqueous fractionation and overexpression of fluorescent-tagged enzymes reveals the subcellular sites of L-theanine biosynthesis in tea[J].Plant Biotechnology Journal, 2021, 19(1):98-108.
[11] CHENG S H, FU X M, WANG X Q, et al.Studies on the biochemical formation pathway of the amino acid L-theanine in tea (Camellia sinensis) and other plants[J].Journal of Agricultural and Food Chemistry, 2017, 65(33):7 210-7 216.
[12] DENG W W, OGITA S, ASHIHARA H.Biosynthesis of theanine (γ-ethylamino-L-glutamic acid) in seedlings of Camellia sinensis[J].Phytochemistry Letters, 2008, 1(2):115-119.
[13] LI M G, VILLEMUR R, HUSSEY P J, et, al.Differential expression of six glutamine synthetase genes in Zea mays[J].Plant Molecular Biology, 1993, 23(2):401-407.
[14] ISHIYAMA K, INOUE E, WATANABE-TAKAHASHI A, et, al.Kinetic properties and ammonium-dependent regulation of cytosolic isoenzymes of glutamine synthetase in Arabidopsis[J].Journal of Biological Chemistry, 2004, 279(16):16 598-16 605.
[15] SCARPECI T E, MARRO M L, BORTOLOTTI S, et, al.Plant nutritional status modulates glutamine synthetase levels in ripe tomatoes (Solanum lycopersicum cv.Micro-Tom)[J].Journal of Plant Physiology, 2007, 164(2):137-145.
[16] 袁华, 高小红, 闫志国, 等.沉淀法从茶叶中提取茶氨酸[J].生物学通报, 2007, 42(5):46-48.
YUAN H, GAO X H, YAN Z G, et al.Extraction of theanine from tea by precipitation method[J].Bulletin of Biology, 2007, 42(5):46-48.
[17] VUONG Q V, STATHOPOULOS C E, GOLDING J B, et al.Optimum conditions for the water extraction of L-theanine from green tea[J].Journal of Separation Science, 2011, 34(18):2 468-2 474.
[18] 萧力争, 肖文军, 龚志华, 等.膜技术富集儿茶素渣中茶氨酸效应研究[J].茶叶科学, 2006, 26(1):37-41;64.
XIAO L Z, XIAO W J, GONG Z H, et al.Study on separation and concentration of theanine in de-catechined tea extracts by membrane system[J].Journal of Tea Science,2006, 26(1):37-41;64.
[19] YAN S H, DUFOUR J, MEURENS M.Synthesis and characterization of highly pure theanine[J].Journal of Tea Science,2003, 23:99-104.
[20] 陈银霞, 李博.L-茶氨酸的性能及合成研究[J].化工技术与开发, 2011, 40(3):14-16.
CHEN Y X, LI B.Synthesis of L-theanine and its performance study[J].Technology & Development of Chemical Industry, 2011, 40(3):14-16.
[21] 钱绍松, 陈然, 刘毅, 等.中试规模制备 L-茶氨酸及其衍生物[J].精细化工, 2005, 22(11):845-847.
QIAN S S, CHEN R, LIU Y, et al.Synthesis of L-theanine and its derivative on pilot-plant scale[J].Fine Chemicals, 2005, 22(11):845-847.
[22] SUZUKI H, IZUKA S, MIYAKAWA N, et, al.Enzymatic production of theanine, an “umami” component of tea, from glutamine and ethylamine with bacterial γ-glutamyltranspeptidase[J].Enzyme and Microbial Technology, 2002, 31(6):884-889.
[23] ZHANG F, ZHENG Q Z, JIAO Q C, et, al.Synthesis of theanine from glutamic acid γ-methyl ester and ethylamine catalyzed by Escherichia coli having γ-glutamyltranspeptidase activity[J].Biotechnology Letters, 2010, 32(8):1 147-1 150.
[24] XU L S, HAN F K, ZHANG X T, et, al.Ultrasound enhanced biosynthesis of L-theanine from L-glutamine and ethylamine by recombinant γ-glutamyltranspeptidase[J].Bioresource Technology, 2020, 307:123251.
[25] CHEN X Y, SU L Q, WU D, et, al.Application of recombinant Bacillus subtilis γ-glutamyltranspeptidase to the production of L-theanine[J].Process Biochemistry, 2014, 49(9):1 429-1 439.
[26] CHI M C, LIN M G, HUANG Y F, et, al.Enzymatic synthesis of L-theanine from L- glutamine and ethylamine by Bacillus licheniformis γ-glutamyltranspeptidase and its mutants specialized in transpeptidase activity[J].Biocatalysis and Agricultural Biotechnology, 2019, 22:101393.
[27] LI Z L, ZHU R T, LIU Y Q, et al.γ-Glutamyltranspeptidase from Bacillus amyloliquefaciens:Transpeptidation activity enhancement and L-theanine production[J].Enzyme and Microbial Technology, 2020, 140:109644.
[28] TACHIKI T, YAMADA T, MIZUNO K, et, al.γ-Glutamyl transfer reactions by glutaminase from Pseudomonas nitroreducens IFO 12694 and their application for the syntheses of theanine and γ-glutamylmethylamide[J].Bioscience, Biotechnology, and Biochemistry, 1998, 62(7):1 279-1 283.
[29] SHUAI Y Y, ZHANG T, JIANG B, et, al.An efficient method for the high-yield production of L-theanine using a newly isolated glutaminase-producing organism[J].Food Bioscience, 2019, 28:164-169.
[30] ALEMZADEH I, SAKHAEI M.Enzymatic synthesis of theanine in the presence of L-glutaminase produced by Trichoderma koningii[J].Applied Food Biotechnology, 2017;4(2):113-121.
[31] YAMAMOTO S, WAKAYAMA M, TACHIKI T.Theanine production by coupled fermentation with energy transfer employing Pseudomonas taetrolens Y-30 glutamine synthetase and baker′s yeast cells[J].Bioscience, Biotechnology, and Biochemistry, 2005, 69(4):784-789.
[32] ZHOU X, ZHANG Z P, JIA X H, et, al.Mn2+ enhances theanine-forming activity of recombinant glutamine synthetase from Bacillus subtilis in Escherichia coli[J].World Journal of Microbiology & Biotechnology, 2008, 24(8):1 267-1 272.
[33] LIU S, LI Y, ZHU J. Enzymatic production of L-theanine by γ-glutamylmethylamide synthetase coupling with an ATP regeneration system based on polyphosphate kinase[J]. Process Biochemistry, 2016, 51(10): 1 458-1 463.
[34] YAMAMOTO S, MORIHARA Y, WAKAYAMA M, et, al. Theanine production by coupled fermentation with energy transfer using γ-glutamylmethylamide synthetase of Methylovorus mays No.9[J]. Bioscience, Biotechnology, and Biochemistry, 2008, 72(5): 1 206-1 211.
[35] MIYAKE K, KAKITA S.A novel catalytic ability of γ-glutamylcysteine synthetase of Escherichia coli and its application in theanine production[J].Bioscience, Biotechnology, and Biochemistry, 2009, 73(12):2 677-2 683.
[36] YAO J, LI J, XIONG D D, et al.Development of a highly efficient and specific L-theanine synthase[J].Applied Microbiology and Biotechnology, 2020, 104(8):3 417-3 431.
[37] LIN M G, CHI M C, CHEN Y Y, et al.Site-directed mutagenesis of a conserved Asn450 residue of Bacillus licheniformis γ-glutamyltranspeptidase[J].International Journal of Biological Macromolecules, 2016, 91:416-425.
[38] MATSUURA S I, YOKOYAMA T, ISHII R, et, al.An enzyme-encapsulated microreactor for efficient theanine synthesis[J].Chemical Communications(Cambridge,England), 2012,48(56):7 058.
[39] TACHIKI T, SUZUKI H, WAKISAKA S, et al.Production of γ-glutamylmethylamide and γ-glutamtlethylamide by coupling of baker′s yeast preparations and bacterial glutamine synthetase[J].The Journal of General And Applied Microbiology, 1986, 32(6):545-548.
[40] YAMAMOTO S, WAKAYAMA M, TACHIKI T.Cloning and expression of Pseudomonas taetrolens Y-30 gene encoding glutamine synthetase:An enzyme available for theanine production by coupled fermentation with energy transfer[J].Bioscience, Biotechnology, and Biochemistry, 2006, 70(2):500-507.
[41] KIMURA T, SUGAHARA I, HANAI K, et, al.Purification and characterization of γ-glutamylmethylamide synthetase from Methylophaga sp. AA-30[J].Bioscience, Biotechnology, and Biochemistry, 1992, 56(5):708-711.
[42] YAMAMOTO S, WAKAYAMA M, TACHIKI T.Cloning and expression of Methylovorus mays no.9 gene encoding γ-glutamylmethylamide synthetase:An enzyme usable in theanine formation by coupling with the alcoholic fermentation system of baker′s yeast[J].Bioscience, Biotechnology, and Biochemistry, 2008, 72(1):101-109.
[43] HIBI T, NII H, NAKATSU T, et, al.Crystal structure of γ-glutamylcysteine synthetase:insights into the mechanism of catalysis by a key enzyme for glutathione homeostasis[J].Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(42):15 052-15 057.
[44] MA H K, FAN X G, CAI N Y, et, al.Efficient fermentative production of L-theanine by Corynebacterium glutamicum[J].Applied Microbiology and Biotechnology, 2020, 104(1):119-130.
[45] FAN X G, ZHANG T, JI Y Q, et, al.Pathway engineering of Escherichia coli for one-step fermentative production of L-theanine from sugars and ethylamine[J].Metabolic Engineering Communications, 2020, 11:e00151.
[46] 张通, 龙科艺, 曹华杰, 等.利用重组大肠杆菌发酵生产 L-茶氨酸[J].食品与发酵工业, 2019, 45(22):6-11.
ZHANG T, LONG K Y, CAO H J, et al.Production of L-theanine using recombinant Escherichia coli[J].Food and Fermentation Industries, 2019, 45(22):6-11.
[47] BENNINGHAUS L, WALTER T, MINDT M, et, al.Metabolic engineering of Pseudomonas putida for fermentative production of L-theanine[J].Journal of Agricultural and Food Chemistry, 2021, 69(34):9 849-9 858.
[48] HAGIHARA R, OHNO S, HAYASHI M, et, al.Production of L-theanine by Escherichia coli in the absence of supplemental ethylamine[J].Applied and Environmental Microbiology, 2021, 87(11):e00031-e00021.
[49] BAI P X, WEI K, WANG L, ZHANG F, et, al.Identification of a novel gene encoding the specialized alanine decarboxylase in tea (Camellia sinensis) plants[J].Molecules(Basel, Switzerland), 2019, 24(3):540.
[50] FENG J C, YANG C, ZHAO Z H, et, al.Application of cell-free protein synthesis system for the biosynthesis of L-theanine[J].ACS Synthetic Biology, 2021, 10(3):620-631.
[51] 食品安全标准与监测评估司. 关于批准茶叶茶氨酸为新食品原料等的公告: [2014]15号[EB/OL](2014-07-18)[2022-10-27].http://www.nhc.gov.cn/sps/s7890/201407/d388b72707 fa4e978bea6a222b920cbf.shtml.
[52] 食品安全标准与监测评估司. 关于批准γ-氨基丁酸、初乳碱性蛋白、共轭亚油酸、共轭亚油酸甘油酯、植物乳杆菌(菌株号ST-Ⅲ)、杜仲籽油为新资源食品的公告: [2009]12号[EB/OL]. (2009-09-27)[2022-10-27]. http://www.nhc.gov.cn/cms-search/xxgk/getManuscriptXxgk.htm?id=e2745a3bcfc14d2bad718325dc25c510.
[53] 陈潇,王君.我国食品用菌种安全性管理现状及国内外管理方式对比研究[J].食品科学技术学报, 2020, 38(1):117-126.
CHEN X, WANG J.Safety management of microbial food cultures in China and comparison of national and international management mode[J].Journal of Food Science and Technology, 2020, 38(1):117-126.