“民以食为天,食以安为先”,化学危害物对食品安全和人类健康危害极大,现场快速检测是控制外源化学物安全风险的有效途径,现有的免疫学和微生物学方法虽然具有良好的应用效果,但仍有不足之处,如免疫分析法易受外界环境的影响,抗原抗体制备复杂,检测过程干扰因素众多;微生物法的灵敏度较低,耗时较长[1-2]。因此,研究一种快速、准确、灵敏、稳定和价廉的新型分析方法已成为业内关注的热点问题。
借鉴生物学识别和检测原理,仿生构建相应的识别体系,不断提高分析方法的特异性、准确性和灵敏度,已成为解决上述问题的可行途径。上世纪40年代PAULING提出了以抗原为模板制备抗体的理论,据此相关学者提出了分子印迹技术(molecular imprinting technology,MIT),该技术是一种能特异性识别目标物质的聚合物制备技术,采用该方法制备的聚合物为分子印迹聚合物(molecularly imprinted polymers,MIPs),它不仅具有生物源抗体的特异性,还有聚合物优良的理化稳定性[3-4]。目前,依据仿生原理制备的MIPs已广泛用于传感器、固相萃取、色谱分离、模拟酶、模拟抗体、生物标志物、药物分析和环境风险物监测等领域[5]。将仿生印迹技术与高灵敏传感检测相结合的新型传感检测方法融合了二者的优点,能准确检测复杂基体中痕量物质的含量,为食品安全快速检测提供了新思路。本文以仿生印迹传感器为基础介绍其原理、构建及分类,综述不同类型仿生印迹传感器在食品安全快速检测中的应用,并对仿生印迹传感器的现状及前景进行总结和展望,为相关研究工作提供参考。
1 仿生印迹传感器的构建
仿生印迹传感器将识别元件固定于转换器上,与靶标结合后会产生特征信号,转换器将信号输出,实现定性定量检测。MIPs作为仿生印迹传感器的识别元件,与生物源识别元件相比,具有结构稳定性强、构效预定性好、识别特异性高及经济便捷等优势。研究发现MIPs的结构和性能对检测结果有重要影响,因此构建性能良好的MIPs膜是传感器特异性识别的关键[6]。目前MIPs膜的制备方法可分为直接法和间接法。间接法如涂覆法,先将MIPs颗粒分散在低沸点有机溶剂中,然后吸取少量悬浮液滴涂或旋涂在电极表面,溶剂挥发后即形成MIPs膜。该法制备的MIPs膜较为粗糙,厚度难以控制,从而导致传质受阻,响应时间长,容易脱落,识别性能较低。直接法如原位聚合法和溶胶-凝胶法,将预聚合液滴在电极表面,在热或光引发作用下进行聚合,通过这2种方法制备的MIPs膜不易脱落,不破坏识别位点结构,识别性能好,弥补了涂覆法的缺陷,但聚合物膜的交联度较高,不利于模板的洗脱。为解决上述问题,研究人员建立和发展了电聚合直接成膜法,应用电化学法在电极上沉积MIPs层,通过循环伏安法实现MIPs膜厚度的可控调节,能够制备超薄聚合物膜,有效促进模板的洗脱,改善传质受阻,但识别位点的均一性和有效性依然难以控制。
表面印迹法能在不同固相基体表面进行聚合反应,也是一种直接成膜法,它能在MIPs或固相基底表面形成均匀分布的识别位点,有效避免了传统MIPs识别位点包埋于内部的缺陷,具有更高地分离效率和更快地响应速度。EKMEN等[7]以Fe3O4磁性纳米微球为基底,通过表面印迹法制备MIPs膜,构建了仿生印迹表面增强拉曼散射传感器。该研究制备的MIPs膜超薄,识别位点均匀,促进了印迹活性位点与电极之间的电子转移,提高了靶标的识别效率和特异性。
2 仿生印迹传感器的分类
2.1 仿生印迹电化学传感器
仿生印迹电化学传感器基于目标物与电极表面MIPs的结合作用,并将此作用转换为电信号的一种传感检测器。该类传感器具有响应速度快、易于小型化和自动化等优势,但其灵敏度和稳定性有待提高。在电化学分析中,MIPs的导电性和稳定性是影响响应效果的关键因素。纳米材料具有较大的比表面积、良好的导电性及稳定性,可弥补MIPs均匀性差和电导率低的缺陷,改善其识别与响应性能,进而提高传感器的灵敏度。目前,碳纳米材料、金属纳米粒子和金属衍生纳米材料等已广泛用于MIPs的修饰[8]。LIU等[9]在多壁碳纳米管修饰的电极上制备MIPs,与裸电极相比,修饰电极的电流信号提高了约3倍,检出限可达1.5×10-9 mol/L。碳纳米管的多壁和多孔结构提供了较大的比表面积,改善了印迹活性位点分布,促进了MIPs膜与电极之间的电子转移,提高了传感器的检测性能。为进一步提高传感器的灵敏度,YE等[10]以金纳米掺杂的三维有机框架材料为基底,电聚合制备MIPs,修饰电极的表面积为未修饰电极的2.2倍,显著增加了印迹识别位点,对诺氟沙星的检出限可达1.3×10-11 mol/L。与单纳米材料相比,复合纳米材料的灵敏度提高了近100倍,具有更高的电化学稳定性和灵敏度,为仿生印迹电化学传感器的构建提供了新思路。此外,双响应仿生印迹传感器的信号输出不受外界环境的影响,避免了传感系统和背景信号的潜在影响,可以有效提高传感器的精确性和稳定性[11]。CHAI等[12]以双酚A为靶标,邻苯二胺为功能单体,构建了用于水中双酚A检测的双响应仿生印迹传感器。未来可以设计具有层层组装或核壳结构的新型多维MIPs,将2种或2种以上的电活性探针分别置入不同的层状或核壳结构中,构建新型多响应仿生印迹电化学传感器,并用于复杂食品样品中靶物质的检测。
2.2 仿生印迹光学传感器
仿生印迹光学传感器基于靶标的光学属性进行信号采集,可分为光化学和光电传感器2种类型。仿生印迹荧光传感器是光化学传感器中最常用的一种,通过荧光响应信号检测目标分析物[13]。目前,常用的荧光物质有荧光染料、量子点和碳点等[14]。与荧光染料相比,量子点和碳点具有高效的发光率与光稳定性,弥补了荧光染料背景信号高、易光漂白及稳定性差的缺陷。ZHOU等[15]开发了一种基于ZnSe量子点的MIPs纸基荧光传感器,在旋转纸基上制备MIPs,实现了水中重金属镉和铅的多路检测。该传感器具有便携和灵敏等优势,为食品危害物的现场检测提供了新思路。但该传感器只有1个荧光发射峰,在复杂基质中易受干扰,导致其灵敏度和选择性降低。为了减少基质效应的影响,研究人员开发了多通道仿生印迹荧光传感器,其发射峰为2个或2个以上,可自校准,避免了外界干扰,具有更高的灵敏度和准确性[16]。WANG等[17]构建了以红色CdTe量子点为响应信号、蓝色CdTe量子点为参考信号的印迹比率荧光纸基传感器,该方法是将蓝色CdTe量子点嵌入到二氧化硅中,以此为基底通过表面印迹法制备了含红色CdTe量子点的MIPs。当靶标存在时红色荧光猝灭,蓝色荧光不变,进而实现靶标的可视化检测。纸基传感器构建便捷,成本低廉,实用性强,可用于痕量物质的现场即时监测。
除上述外,光化学传感器还包括仿生印迹表面等离子共振和表面增强拉曼散射传感器,与荧光传感器相比,具有无标记、响应时间短及光稳定性好等优势。AKGÖNÜLLÜ等[18]将表面等离子共振技术和分子印迹技术结合,通过表面印迹法在金芯片表面制备MIPs,所构建的传感器可实时无标记监测受体和靶标的相互作用,实现了无花果中赭曲霉毒素的无标记检测。CHEN等[19]以ZnO@TiO2@Ag为基底,采用表面印迹法制备MIPs,构建了一种高灵敏检测发酵食品中组胺的表面增强拉曼散射传感器。该传感器无需任何标记即可测定靶标,缩短了分析时间,避免了标记物对检测方法的影响。
另一种仿生印迹光学传感器为光电传感器,它基于靶标和光电材料之间的相互作用进行检测,已有研究将其同智能手机和物联网相结合,CAPOFERRI等[20]基于氧化铱的电致变色特性,研制了一种用于毒死蜱检测的新型印迹光电传感器。氧化铱在氧化时变成蓝黑色,在还原时变成无色,通过智能手机成像实现靶标的定量检测,为食品中有害物质的快速检测提供了新思路。
2.3 仿生印迹质量传感器
仿生印迹质量传感器基于质量变化进行检测,具有快速、无标记和便携等优势。该传感器适用于不同种类的靶标,可实现光学或电化学非活性分析物的无标记检测,在一定情况下可替代光学或电化学传感器。CAKIR等[21]以2,4-二氯苯氧乙酸为靶标,构建了仿生印迹石英晶体微天平传感器,根据印迹膜表面的质量变化,实现了苹果中2,4-二氯苯氧乙酸的无标记检测。但个别靶标在识别元件表面的质量变化较小,传感信号较弱,导致检测结果不准确。有研究将石英晶体微天平与电化学方法结合,通过识别元件表面的电流响应或质量变化实现目标分析物的多通道监测,弥补了这一缺陷[22]。YUN等[23]构建了一种基于石英晶体微天平的仿生印迹电化学传感器,以金刚烷胺为靶标,邻氨基噻吩为功能单体,在石英晶体微天平上电聚合制备MIPs,通过电流和质量变化监测目标分析物,结果表明,在实际样品中的检出限可达5.4×10-9 mol/L,加标回收率为90.4%~94.7%,检测结果与高效液相色谱-串联质谱法高度一致。目前,关于界面变量影响信号传感的机理仍不清晰,未来应结合其他检测技术,构建多通道、灵敏及便携的仿生印迹质量传感器。
2.4 仿生印迹纳米酶传感器
纳米酶是一种具有类酶活性的物质,具有成本低、稳定性好及催化活性高等优势,可替代天然酶,已用于仿生印迹传感器的构建。WANG等[24]以MIPs为仿生抗体,铂纳米酶为标记物,建立了一种快速检测食品中组胺的直接竞争仿生免疫分析法。该方法合成的纳米酶,克服了天然酶稳定性差、印迹识别率低及成本高等不足,所构建的仿生印迹传感器可用于酱油、醋及虾中组胺的监测。LI等[25]提出了一种基于MIT和酶放大技术的仿生印迹电化学发光检测方法,如图1所示。该方法以氯霉素为靶标,将带有电化学发光基团的共价有机骨架和Co3O4纳米酶修饰于金电极表面,在磷酸缓冲液中制备MIPs,构建了用于鸡肉中氯霉素残留检测的仿生印迹传感器。其中,Co3O4纳米酶促进了H2O2的水解和电子的转移,增强了电致发光信号,实现了复杂基质中靶标的高灵敏和高特异性检测。未来仍需进一步探索纳米酶的构效关系及增敏特性,开发多功能及广泛适用性纳米酶,进一步充实传感信号放大理论内涵和技术实现途径。
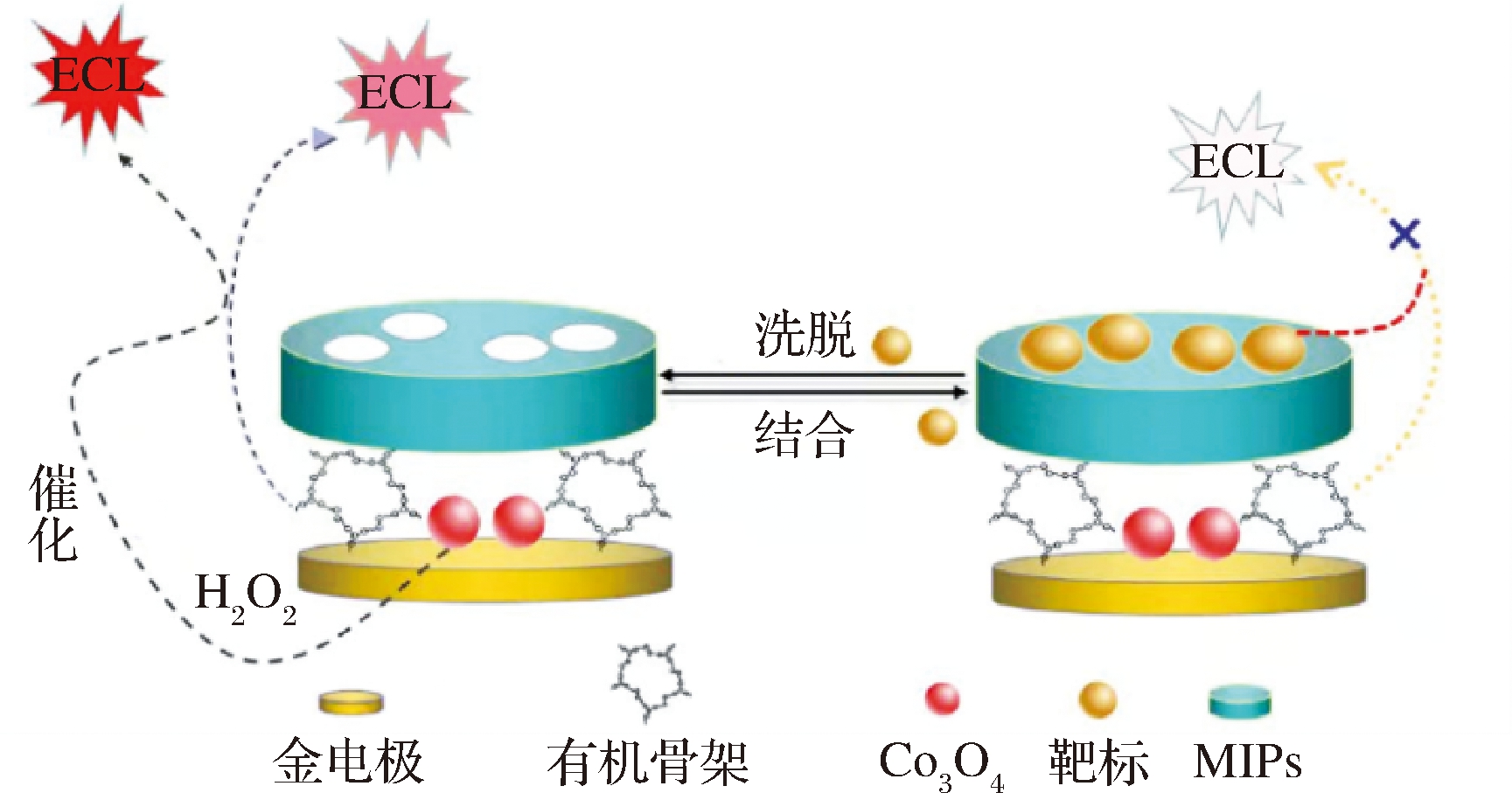
图1 仿生印迹纳米酶传感器的构建
Fig.1 Construction of biomimetic imprinted nanozyme sensor
上述几种仿生印迹传感器均通过MIPs识别元件进行靶标的识别和检测,但信号转换的原理和方式有所不同,具体的分类和构建模式如图2所示。仿生印迹电化学传感器将目标分析物与MIPs膜的相互作用转换成可测量的电信号,通过电容、电流、电位和电导率的变化测定靶标含量,如图2-a所示。仿生印迹光学传感器,通过识别前后光信号(包括荧光光谱、等离子体共振光谱、拉曼光谱和电化学发光等)的改变进行靶标的分析与检测,检测过程见图2-b。仿生印迹质量传感器依据目标分析物与MIPs结合后压电材料表面的质量变化进行测定,具体过程见图2-c。仿生印迹纳米酶传感器基于酶催化作用,放大检测体系的传感信号,实现靶标的测定,构建方法和模式如图2-d所示。

图2 仿生印迹传感器的构建模式及原理[7,26-28]
Fig.2 Construction models and principles of biomimetic imprinted sensors[7,26-28]
不同种类仿生印迹传感器的主要靶标、检测优势及实际样品如表1所示。其中仿生印迹电化学传感器的构建便捷,经济实用,适合靶标的现场即时检测;仿生印迹光学传感器检出限低、准确性高和抗干扰性强,在多通道和可视化检测方面报道较多;仿生印迹质量传感器在生物大分子的实时监控方面独具优势;仿生印迹纳米酶传感器能够高效和稳健地级联放大传感信号,有利于超痕量物质的即时检测。在食品安全快速检测中,要根据待测物的性质和检测环境,构建适宜的传感识别和信号放大模式,才能适应食品安全监控的需求,保障食用安全和人类健康[29-30]。
表1 不同种类仿生印迹传感器的比较
Table 1 Comparison of different types of biomimetic imprinted sensors

种类主要靶标优势样品基质电化学农药、兽药、真菌毒素、重金属和蛋白质响应快,易于生产,便携肉、蛋、奶、果蔬、谷类、水、酒、土壤和血浆光学 农药、兽药、真菌毒素、重金属、核酸、细菌、病毒和蛋白质灵敏度高,特异性强,可实现多通道和可视化监测肉、蛋、奶、果蔬、谷类、水、酒、血浆和血液质量 细胞、细菌、病毒和蛋白质无标记、实时和成本效益高肉、奶、果蔬、果汁、水、血液和气体纳米酶农药和兽药选择性和灵敏度超高肉、蛋、奶和果蔬
3 仿生印迹传感器的应用
3.1 仿生印迹传感器在肉品监测中的应用
肉类食品消费量大,危害物安全风险大,其中兽药及饲料添加剂残留最为常见。仿生印迹传感器在肉品危害物监测中的具体应用见表2。赵玲钰等[31]构建了用于肉品中磺胺嘧啶监测的仿生印迹电化学传感器,样品经乙腈提取,离心取上清液测定,结果表明其在猪肉和虾中的检出限为3.3×10-9 mol/L,加标回收率为83.5%~97.8%,相对标准偏差低于4.0%,与高效液相色谱-串联质谱法相比,检出限低了近40倍[32]。ZHANG等[33]以酪胺为靶标,氨基丙基三乙氧基硅烷为功能单体,制备了MIPs,以其为基础分别建立了仿生印迹传感和固相萃取-高效液相色谱检测方法,并对比了这2种方法在发酵肉制品中的检测性能。结果表明,二者的检测结果一致,在实际样品中的加标回收率分别为90.0%~114.0%和86.0%~93.0%,相对标准偏差分别为5.2%和1.2%。仿生印迹传感检测方法的样品前处理较为简便,较高效液相色谱法省略了3个处理步骤,具有便捷、特异和灵敏等优势,尤其适用于现场即时检测。
样品的前处理是仿生印迹传感检测的关键步骤。目前,相关的前处理过程主要包括提取和净化2个阶段,提取主要采用有机溶剂萃取,而后经离心、液液萃取或固相萃取等方法进行净化,一些靶物质的检测可以直接对提取液进行即时检测,避免了繁琐的样品净化过程,发挥了印迹传感识别的特异和快速等优势。在实际的应用过程中,也有个别方法对靶标的标准溶液检测效果好,对实际样品的监测效果不尽如人意。此类问题主要通过提高传感识别元件的特异性或优化样品净化过程来解决,如PENG等[39]使用分子印迹固相萃取柱处理样品,以减少样品基质和干扰物的影响,提高检测方法的特异性和灵敏度。此外,还可
表2 仿生印迹传感器在肉品检测中的应用
Table 2 Application of biomimetic imprinting sensor in the detection of meat products

模板分子功能单体识别元件处理方法加标回收率/%检出限/(mol·L-1)参考文献磺胺嘧啶邻氨基苯酚MIPs-AuNPs-CMWCNTs/GCE乙腈提取,离心83.5~97.83.3×10-9[31]酪胺APTESMIPs-CdSe-ZnS-COFs/GCE乙醇提取,过滤90.0~114.05.6×10-8[33]金刚烷胺邻氨基硫酚MIPs/AuE固相萃取92.0~97.53.1×10-12[34]莱克多巴胺APTESMIPs/GCE乙腈提取,离心75.9~93.31.1×10-9[35]喹乙醇邻氨基苯酚MIPs-AuNPs-GR/GCE乙腈提取,离心89.0~100.81.0×10-9[36]西马特罗邻苯二胺DNA/AuE乙酸乙酯提取,离心94.0~105.53.2×10-14[37]组胺2-乙烯基吡啶MIPs-Fe3O4-SiO2/GCE磁性印迹聚合物96.8~102.01.0×10-11[38]
注:APTES:3-氨丙基三乙氧基硅烷;AuNPs:金纳米粒子;CMWCNTs:羧基化多壁碳纳米管;GCE:玻碳电极;CdSe:硒化镉;ZnS:硫化锌;COFs:有机框架;GR:石墨烯;Fe3O4:四氧化三铁;SiO2:二氧化硅;AuE:金电极
以通过稀释样品提取液或建立样品校正曲线等方法消减肉品基质效应的干扰。未来,通过创新样品前处理方法,并不断提高仿生印迹传感检测方法的性能,可以实现肉品中危害物的高效监控。
3.2 仿生印迹传感器在蛋品监测中的应用
我国是养禽大国,禽蛋产量位居世界首位,蛋品质量安全问题已引起各方高度重视。仿生印迹传感器应用于蛋品危害物的监测,取得了良好的效果,具体应用见表3。HE等[40]建立了鸡蛋中苏丹红仿生印迹传感检测方法,样品均质后,经乙腈提取,离心取上清液测定。结果表明,该方法在鸡蛋样品中的检出限可达1.0 pg/mL,加标回收率为70.5%~92.2%,比高效液相色谱法的检出限低了近千倍。唐录华等[41]以己烯雌酚为靶标,对巯基苯胺为功能单体,建立了鸡蛋中己烯雌酚的仿生印迹电化学传感分析方法,样品经乙腈提取,离心取上清液,经稀释后即时检测。结果显示,实际样品中的检出限为3.3×10-10 mol/L,加标回收率为83.4%~98.2%,电极可连续使用20次,检测结果与仪器方法高度一致。尽管样品稀释在一定程度上减小了干扰物的浓度,但基质干扰依然会影响信号的感应与放大。因此,进一步优化样品的前处理方法,降低信号干扰水平,是提升检测方法性能的重要途径。YAN等[42]使用分子印迹基质固相分散技术处理样品,集样品均质、提取和纯化于一体,减少了萃取溶剂的使用量,降低了基质干扰,比未经其处理的检出限低了近2倍。该方法操作简便,提取率高,适合高黏度、高脂肪和高蛋白样品中靶物质的选择性提取。目前,仿生印迹传感检测过程中,主要通过有机溶剂提取、离心和理化方法除杂。今后,应充分研究靶标与蛋品组分的互作情况,结合仿生传感识别技术,研究和开发蛋品痕量危害物高效富集技术。
表3 仿生印迹传感器在蛋品检测中的应用
Table 3 Application of biomimetic imprinting sensor in the detection of egg products

模板分子功能单体识别元件处理方法加标回收率/%检出限/(mol·L-1)参考文献苏丹红甲基丙烯酸MIPs/GCE乙腈提取,离心70.5~92.23.6×10-12[40]己烯雌酚对巯基苯胺MIPs-AuNPs-CMWCNTs/GCE乙腈提取,离心83.4~98.23.3×10-10[41]妥曲珠利N,N-二甲基甲酰胺MIPs-TiO2-RGO/Pt乙腈和氯化钠提取,离心85.0~97.04.9×10-13[43]二甲硝咪唑精氨酸MIPs-P-Arg/GCE三氯乙酸提取,离心94.2~101.81.0×10-10[26]林可霉素4-乙烯基吡啶MIPs-MOFs/GCE乙腈提取,离心,浓缩88.0~97.21.7×10-8[44]桔霉素吡咯MIPs-PdNPs-GQDs/GCE磷酸盐缓冲液提取,离心95.4~103.12.0×10-10[45]
注:AuNPs:金纳米粒子;CMWCNTs:羧基化多壁碳纳米管;GCE:玻碳电极;Pt:铂电极;TiO2:二氧化钛;RGO:还原氧化石墨烯;P-Arg:聚精氨酸;MOFs:金属有机框架 PdNPs:钯纳米粒子;GODs:石墨烯量子点
3.3 仿生印迹传感器乳品监测中的应用
我国乳业发展迅速,是世界上乳制品消费最大的潜在市场,近年来的安全问题备受关注。仿生印迹传感器在乳品危害物监控中具有广阔的应用前景,在实际样品中的应用见表4。AKYILDIRIM等[46]构建了一种基于铂电极的仿生印迹电化学传感器,用于乳品中氯霉素的检测。样品经乙酸乙酯提取,离心后测定,在牛奶样品中的检出限为4.0×10-10 mol/L,加标回收率为97.0%~105.0%,相对标准偏差低于4.0%。通过改变识别元件的制备方法,构建双识别仿生传感体系,可进一步提升检测性能。ROUSHANI等[47]以氯霉素为模板分子,间苯二酚为功能单体,建立了仿生印迹适配体双识别电化学传感检测方法,样品经磷酸盐缓冲溶液提取后,直接测定。结果表明在牛奶样品中的检出限为3.0×10-13 mol/L,加标回收率为98.0%~105.0%,相对标准偏差为3.5%。与单识别模式相比,检出限低了近1 300倍。这说明在仿生印迹传感器的构建中引入新的识别元件,可以增强传感识别的特异性和准确性,减小基质效应对检测结果的影响。此外,还可以通过优化样品前处理过程,提高方法的特异性和灵敏度。LI等[48]以酪胺为靶标,玉米醇溶蛋白为交联剂,将分子印迹固相萃取与电化学检测技术结合,建立了用于牛奶中酪胺的仿生印迹传感检测方法。该方法通过分子印迹固相萃取柱选择性富集牛奶中的酪胺,有效避免了样品基质效应和其他物质的干扰,实际样品加标回收率达93.6%~102.4%。目前,乳品中危害物的存在形式和变化规律还需深入探讨,乳品基质干扰机理还不明确,对传感识别过程的影响还需进一步分析。今后,应进一步简化样品前处理过程,研究和开发适合乳品极性化学环境中靶标的直接监测技术。
表4 仿生印迹传感器在乳品检测中的应用
Table 4 Application of biomimetic imprinting sensor in the detection of dairy products

模板分子功能单体识别元件处理方法加标回收率/%检出限/(mol·L-1)参考文献氯霉素间苯二酚MIPs-AuNPs-RGO/GCE磷酸盐缓冲液稀释98.0~105.03.0×10-13[47]酪胺甲基丙烯酸MIPs-PEDOT:PSS AuNPs-1-m-4-MP/SPE分子印迹固相萃取93.6~102.42.3×10-9[48]红霉素甲基丙烯酸MIPs/AuE去离子水稀释98.2~102.01.6×10-9[49]双酚A4-氨基噻吩MIPs-AuNPs/GCE乙醇提取,离心97.6~106.51.1×10-9[50]三聚氰胺烯丙基-1,3,5-三嗪- 2,4,6-三酮MIPs/AuE乙腈提取,浓缩91.5~92.05.6×10-11[51]
注:AuNPs:金纳米粒子;RGO:还原氧化石墨烯;GCE:玻碳电极;PEDOT:聚 (3,4-乙二氧基噻吩);PSS:聚苯乙烯磺酸盐;1-m-4-MP:1-甲-4-巯基吡啶;SPE:印刷电极;AuE:金电极
3.4 仿生印迹传感器在果蔬监测中的应用
果蔬是人们日常生活中不可缺少的副食品,是仅次于粮食的重要农产品。仿生印迹传感识别方法在果蔬危害物监测中独具优势,具体应用见表5。NAGABOOSHANAM等[52]以毒死蜱为模板分子,吡咯为功能单体,构建了检测黄瓜和石榴中毒死蜱的仿生印迹电化学传感器。样品经粉碎和离心后,取上清液测定。结果表明,在实际样品中的检出限可达9.3×10-13 mol/L,加标回收率为91.0%~97.0%,相对标准偏差低于5.0%,比超高效液相色谱-串联质谱法的检出限低了近800倍[53]。仿生印迹传感识别方法的性能指标与样品前处理方法密切相关,选择合适的样品前处x理过程,减少干扰物和样品基质的影响,是提高方法特异性和灵敏度的通用方法。MIAO等[54]以多巴胺为功能单体,建立了萝卜中二氯二苯三氯乙烷监测的仿生印迹传感检测方法。样品提取液经分子印迹固相萃取柱富集和纯化后,实现了特异性净化和识别,避免了离心和过滤等操作步骤,具有操作简单、提取率高及可重复使用等优势。在实际样品中的加标回收率为89.0%~102.0%,相对标准偏差为3.9%~5.5%。当前,果蔬样品中危害物的分布及转化特征还需进一步深入研究,危害物与样品基质的相互作用仍需探讨。未来应在已有研究的基础上,构建果蔬原位采样和仿生印迹传感监测技术体系,推动果蔬产品安全的实时监控与追溯。
表5 仿生印迹传感器在果蔬检测中的应用
Table 5 Application of biomimetic imprinting sensor in the detection of fruits and vegetables

模板分子功能单体识别元件处理方法加标回收率/%检出限/(mol·L-1)参考文献毒死蜱吡咯MIPs/AuE磷酸盐缓冲液提取,离心91.0~97.09.3×10-13[52]二氯二苯三氯乙烷多巴胺MIPs-Fe3O4/GCE分子印迹固相萃取89.0~102.06.0×10-12[54]三氟氯氰菊酯邻苯二胺MIPs/GCE乙腈提取,离心84.8~94.73.0×10-8[55]棒曲霉素硫堇MIPs-PtNPs/GCE过滤、稀释99.8~113.06.5×10-12[56]甲基对硫磷甲基丙烯酸MIPs/CPE乙腈提取,离心95.2~104.53.4×10-13[57]乙烯利邻苯二胺MIPs-AuNPs/AuE丙酮提取,浓缩84.0~110.92.7×10-14[58]
注:GCE:玻碳电极;PtNPs:铂纳米粒子;CPE:碳糊电极;AuNPs:金纳米粒子;Fe3O4:四氧化三铁;AuE:金电极
3.5 仿生印迹传感器在微生物及其毒素监测中的应用
传统的微生物检测方法需要增菌培养,耗时长,成本高,仿生印迹传感器具有检测速度快,操作简单及实用性强等优势,已广泛用于细菌、病毒、真菌及其毒素的快速检测,具体应用见表6。IDIL等[59]构建了检测大肠杆菌的仿生印迹电化学传感器,样品稀释后直接测定,缩短了分析时间,检出限可达70.0 CFU/mL,实现了苹果汁中大肠杆菌的实时监测。微生物结构复杂多变,形貌多样,印迹困难,为了解决这一难题,可印迹相关的生物标志物进行间接识别。RAZIQ等[60]以新型冠状病毒核蛋白为靶标,构建了检测新型冠状病毒肺炎的仿生印迹电化学传感器。样品经裂解液提取稀释后测定,检出限为1.5×10-14 mol/L,检测过程还能与智能手机联用,为食源性新型冠状病毒肺炎的现场监控和智能分析提供了新思路。SERGEYEVA等[61]以2,4-二羟基苯甲酸环十二烷酯为虚拟模板,构建了玉米赤霉烯酮仿生印迹荧光传感器,建立了竞争和非竞争两种传感识别模式,样品经乙腈提取后测定,检出限依次为1.0 μg/mL和10.0 ng/mL,检测结果与高效液相色谱法高度一致。该研究通过改变传感识别模式,增强了传感检测方法的特异性和准确性,降低了交叉反应性和基质干扰,灵敏度提高了近100倍。目前,微生物及其毒素的印迹仍存在模板结构稳定性差,难以获取,影响因素多,印迹效率低,识别性能尚待提高等挑战。未来需深入研究微生物的印迹识别靶点和识别机理,寻找毒素的虚拟模板,推动食品中微生物及其毒素的实时和智能监控。
表6 仿生印迹传感器在微生物及其毒素检测中的应用
Table 6 Application of biomimetic imprinting sensor in the detection of microorganisms and toxins

模板分子功能单体识别元件处理方法加标回收率/%检出限参考文献大肠杆菌MAHMIPs/AuE稀释81.0~91.070.0 CFU/mL[59]伤寒沙门氏菌MAHMIPs/AuE稀释/1.4×106 CFU/mL[62]新型冠状病毒核蛋白间苯二胺MIPs/AuE裂解液提取,稀释/1.5×10-14 mol/L[60]猪瘟病毒甲基丙烯酸MIPs/QCM//1.7×10-6g/mL[27]2,4-二羟基苯甲酸环十二烷酯1-烯丙基哌嗪MIPs乙腈提取/1.0×10-8 g/mL[61]黄曲霉毒素MAPAMIPs-AuNPs/AuE甲醇提取,离心、稀释96.6~105.93.2×10-12 mol/L[63]脱氧雪腐镰刀菌烯醇精氨酸MIPs-CMWCNTs/GCE乙腈提取,离心85.1~86.87.0×10-8mol/L[64]
注:AuE:金电极;MAH:N-甲基丙烯酰基-(L)-组氨酸甲酯;QCM:石英晶体微天平;MAPA:N-甲基丙烯酰基-(L)-苯丙氨酸;AuNPs:金纳米粒子;GCE:玻碳电极;CMWCNTs:羧基化多壁碳纳米管;/:文章未标明
仿生印迹传感器在不同基质中危害物的快速监测中均有应用,已取得较大进展,但相关的识别机理、信号干扰的处理及危害物与基质的相互作用等方面还需深入探讨,相关的仿生识别技术和产品的开发及应用尚待进一步优化和孵化。随着信息技术和相关学科的发展,可视化、网络化、便携式及可大批量生产的仿生印迹传感器将会成为新的研究热点和发展方向。
4 结语
仿生印迹传感器作为一种新的检测平台,由于其检测速度快、操作简单以及成本低等优势,在食品安全检测中得到了快速发展和广泛应用。虽然仿生印迹传感器已用于不同食品中痕量物质的高灵敏检测,但在实际应用中仍面临一些问题和挑战,如:仿生印迹传感器的构建方法较为单一,高性能识别元件的研制困难,识别机理不明确;适用于水相的印迹识别体系还难以满足需求;信号放大及干扰处理技术还需深入研究;生物大分子仿生印迹与识别仍具有一定的挑战性。
今后,应继续研制和开发新型功能单体、交联剂和绿色反应介质,优化仿生印迹传感器的构建方法和检测条件,探讨传感识别机理与信号增强途径,改进样品前处理方法,实现高效、特异、灵敏和稳健监测,为食品安全和人类健康提供科学依据和技术支撑。
[1] ELFADIL D, LAMAOUI A, DELLA PELLE F, et al.Molecularly imprinted polymers combined with electrochemical sensors for food contaminants analysis[J].Molecules(Basel,Switzerland), 2021, 26(15):4 607.
[2] YANG H, LIU H B, TANG Z S, et al.Synthesis, performance, and application of molecularly imprinted membranes:A review[J].Journal of Environmental Chemical Engineering, 2021, 9(6):106352.
[3] 杜晓芳, 李兆周, 陈秀金, 等.喹诺酮类药物印迹仿生抗体的研制及应用进展[J].化工进展, 2020, 39(4):1 447-1 457.
DU X F, LI Z Z, CHEN X J, et al.Development and application progress of quinolone imprinted biomimetic antibody[J].Chemical Industry and Engineering Progress, 2020, 39(4):1 447-1 457.
[4] 李欣培, 王秀君, 徐斐, 等.组胺表面分子印迹聚合物的制备及其在酸奶中的应用[J].食品与发酵工业, 2021, 47(11):1-7.
LI X P, WANG X J, XU F, et al.Preparation of histamine surface molecularly imprinted polymer and its application in yoghurt[J].Food and Fermentation Industries, 2021, 47(11):1-7.
[5] 杨红, 刘晓艳, 白卫东, 等.分子印迹技术在食品安全检测中的应用进展[J].食品科学, 2022,43(1):362-371.
YANG H, LIU X Y, BAI W D, et al.Progress in application of molecular imprinting technology in food safety detection[J].Food Science, 2022,43(1):362-371.
[6] CRAPNELL R D, HUDSON A, FOSTER C W, et al.Recent advances in electrosynthesized molecularly imprinted polymer sensing platforms for bioanalyte detection[J].Sensors(Basel,Switzerland), 2019, 19(5):1 204-1 232.
[7] EKMEN E, BILICI M, TURAN E, et al.Surface molecularly-imprinted magnetic nanoparticles coupled with SERS sensing platform for selective detection of malachite green[J].Sensors and Actuators B:Chemical, 2020, 325:128787.
[8] MAHMOUDPOUR M, TORBATI M, MOUSAVI M M, et al.Nanomaterial-based molecularly imprinted polymers for pesticides detection:Recent trends and future prospects[J].TrAC Trends in Analytical Chemistry, 2020, 129:115943.
[9] LIU Z P, JIN M L, LU H, et al.Molecularly imprinted polymer decorated 3D-framework of functionalized multi-walled carbon nanotubes for ultrasensitive electrochemical sensing of norfloxacin in pharmaceutical formulations and rat plasma[J].Sensors and Actuators B:Chemical, 2019, 288:363-372.
[10] YE C Z, CHEN X G, ZHANG D, et al.Study on the properties and reaction mechanism of polypyrrole@ norfloxacin molecularly imprinted electrochemical sensor based on three-dimensional CoFe-MOFs/AuNPs[J].Electrochimica Acta, 2021, 379:138174.
[11] GUI R J, JIN H, GUO H J, et al.Recent advances and future prospects in molecularly imprinted polymers- based electrochemical biosensors[J].Biosensors and Bioelectronics, 2018, 100:56-70.
[12] CHAI R, KAN X W.Au-polythionine nanocomposites:A novel mediator for bisphenol A dual-signal assay based on imprinted electrochemical sensor[J].Analytical and Bioanalytical Chemistry, 2019, 411(17):3 839-3 847.
[13] MOEIN M M.Advancements of chiral molecularly imprinted polymers in separation and sensor fields:A review of the last decade[J].Talanta, 2021, 224:121794.
[14] LIU G Y, HUANG X D, LI L Y, et al.Recent advances and perspectives of molecularly imprinted polymer-based fluorescent sensors in food and environment analysis[J].Nanomaterials(Basel,Switzerland), 2019, 9(7):1 030-1 049.
[15] ZHOU J R, LI B W, QI A J, et al.ZnSe quantum dot based ion imprinting technology for fluorescence detecting cadmium and lead ions on a three-dimensional rotary paper-based microfluidic chip[J].Sensors and Actuators B:Chemical, 2020, 305:127462.
[16] 马嘉欣, 连子如, 何橙, 等.新型量子点基分子印迹荧光传感器在快速检测中的应用[J].色谱, 2021, 39(8):775-780.
MA J X, LIAN Z R, HE C, et al.Application of novel quantum dot-based molecularly imprinted fluorescence sensor in rapid detection[J].Chinese Journal of Chromatography, 2021, 39(8):775-780.
[17] WANG J X, DAI J D, XU Y Q, et al.Molecularly imprinted fluorescent test strip for direct, rapid, and visual dopamine detection in tiny amount of biofluid[J].Small(Weinheim an Der Bergstrasse,Germany), 2019, 15(1):e1803913.
[18] AKGÖNÜLLÜ S, ARMUTCU C, DENIZLI A.Molecularly imprinted polymer film based plasmonic sensors for detection of ochratoxin A in dried fig[J].Polymer Bulletin, 2022,79(6):4 049-4 067.
[19] CHEN C, WANG X M, WATERHOUSE G I N, et al.A surface-imprinted surface-enhanced Raman scattering sensor for histamine detection based on dual semiconductors and Ag nanoparticles[J].Food Chemistry, 2022, 369:130971.
[20] CAPOFERRI D,  LVAREZ-DIDUK R, DEL CARLO M, et al.Electrochromic molecular imprinting sensor for visual and smartphone-based detections[J].Analytical Chemistry, 2018, 90(9):5 850-5 856.
LVAREZ-DIDUK R, DEL CARLO M, et al.Electrochromic molecular imprinting sensor for visual and smartphone-based detections[J].Analytical Chemistry, 2018, 90(9):5 850-5 856.
[21] CAKIR O, BAKHSHPOUR M, YILMAZ F, et al.Novel QCM and SPR sensors based on molecular imprinting for highly sensitive and selective detection of 2,4-dichlorophenoxyacetic acid in apple samples[J].Materials Science and Engineering:C, 2019, 102:483-491.
[22] LI R F, FENG Y H, PAN G Q, et al.Advances in molecularly imprinting technology for bioanalytical applications[J].Sensors(Basel,Switzerland), 2019, 19(1):177-211.
[23] YUN Y G, PAN M F, FANG G Z, et al.An electrodeposited molecularly imprinted quartz crystal microbalance sensor sensitized with AuNPs and rGO material for highly selective and sensitive detection of amantadine[J].RSC Advances, 2018, 8(12):6 600-6 607.
[24] WANG X F, SONG X Q, SI L, et al.A novel biomimetic immunoassay method based on Pt nanozyme and molecularly imprinted polymer for the detection of histamine in foods[J].Food and Agricultural Immunology, 2020, 31(1):1 036-1 050.
[25] LI S H, MA X H, PANG C H, et al.Novel chloramphenicol sensor based on aggregation-induced electrochemiluminescence and nanozyme amplification[J].Biosensors and Bioelectronics, 2021, 176:112944.
[26] ZHAO X J, ZHANG Q M, CHEN H G, et al.Highly sensitive molecularly imprinted sensor based on platinum thin-film microelectrode for detection of chloramphenicol in food samples[J].Electroanalysis, 2017, 29(8):1 918-1 924.
[27] KLANGPRAPAN S, CHOKE-ARPORNCHAI B, LIEBERZEIT P A, et al.Sensing the classical swine fever virus with molecularly imprinted polymer on quartz crystal microbalance[J].Heliyon, 2020, 6(6):e04137.
[28] ZHANG Z P, LIU Y, HUANG P C, et al.Polydopamine molecularly imprinted polymer coated on a biomimetic iron-based metal-organic framework for highly selective fluorescence detection of metronidazole[J].Talanta, 2021, 232:122411.
[29] EMIR-DILTEMIZ S, KEÇILI R, ERSÖZ A, et al.Molecular imprinting technology in quartz crystal microbalance (QCM) sensors[J].Sensors(Basel,Switerland), 2017, 17(3):454-473.
[30] CAO Y R, FENG T Y, XU J, et al.Recent advances of molecularly imprinted polymer-based sensors in the detection of food safety hazard factors[J].Biosensors and Bioelectronics, 2019, 141:111447.
[31] 赵玲钰, 秦思楠, 高林, 等.磺胺嘧啶分子印迹电化学传感器的制备及其快速检测食品中磺胺嘧啶药物残留[J].食品科学, 2018, 39(22):319-327.
ZHAO L Y, QIN S N, GAO L, et al.Preparation and application of molecularly imprinted electrochemical sensor for rapid detection of sulfadiazine residues in foods[J].Food Science, 2018, 39(22):319-327.
[32] HAJRULAI-MUSLIU Z, UZUNOV R, JOVANOV S, et al.A new LC-MS/MS method for multiple residues/contaminants in bovine meat[J].BMC Chemistry, 2021, 15(1):62.
[33] ZHANG D W, LIU H L, GENG W T, et al.A dual-function molecularly imprinted optopolymer based on quantum dots-grafted covalent-organic frameworks for the sensitive detection of tyramine in fermented meat products[J].Food Chemistry, 2019, 277:639-645.
[34] YUN Y G, PAN M F, FANG G Z, et al.Molecularly imprinted electrodeposition o-aminothiophenol sensor for selective and sensitive determination of amantadine in animal-derived foods[J].Sensors and Actuators B:Chemical, 2017, 238:32-39.
[35] PAN M F, LI R, XU L L, et al.Reproducible molecularly imprinted piezoelectric sensor for accurate and sensitive detection of ractopamine in swine and feed products[J].Sensors(Basel,Switzerland), 2018, 18(6):1 870-1 882.
[36] 田景升, 李东东, 赵玲钰, 等.喹乙醇印迹传感器的制备及其在喹噁啉类药物残留快检中的应用[J].食品科学, 2021, 42(6):316-324.
TIAN J S, LI D D, ZHAO L Y, et al.Preparation and application of molecularly imprinted electrochemical sensor for rapid detection of quinoxaline drug residues[J].Food Science, 2021, 42(6):316-324.
[37] 张连明, 张东友, 曾英, 等.DNA辅助识别的西马特罗分子印迹传感器[J].分析化学, 2019, 46(11):1 770-1 777.
ZHANG L M, ZHANG D Y, ZENG Y, et al.A cimaterol molecularly imprinted sensor based on DNA-assisted recognition[J].Chinese Journal of Analytical Chemistry, 2018, 46(11):1 770-1 777.
[38] HASSAN A H A, SAPPIA L, MOURA S L, et al.Biomimetic magnetic sensor for electrochemical determination of scombrotoxin in fish[J].Talanta, 2018, 194:997-1 004.
[39] PENG D P, LI Z Z, WANG Y L, et al.Enzyme-linked immunoassay based on imprinted microspheres for the detection of sulfamethazine residue[J].Journal of Chromatography A, 2017, 1506:9-17.
[40] HE T, WANG G N, LIU J X, et al.Dummy molecularly imprinted polymer based microplate chemiluminescence sensor for one-step detection of Sudan dyes in egg[J].Food Chemistry, 2019, 288:347-353.
[41] 唐录华, 秦思楠, 高林, 等.基于对巯基苯胺膜的高灵敏己烯雌酚印迹传感器的制备及应用[J].化工进展, 2019, 38(11):5 074-5 083.
TANG L H, QIN S N, GAO L, et al.Preparation and application of sensitive diethylstilbestrol imprinting sensor based on p-aminothiophenol film[J].Chemical Industry and Engineering Progress, 2019, 38(11):5 074-5 083.
[42] YAN H Y, WANG H, QIAO J D, et al.Molecularly imprinted matrix solid-phase dispersion combined with dispersive liquid-liquid microextraction for the determination of four Sudan dyes in egg yolk[J].Journal of Chromatography A, 2011, 1218(16):2 182-2 188.
[43] HUANG X J, WEI S L, YAO S, et al.Development of molecularly imprinted electrochemical sensor with reduced graphene oxide and titanium dioxide enhanced performance for the detection of toltrazuril in chicken muscle and egg[J].Journal of Pharmaceutical and Biomedical Analysis, 2019, 164:607-614.
[44] ALI M R, BACCHU M S, DAIZY M, et al.A highly sensitive poly-arginine based MIP as an electrochemical sensor for selective detection of dimetridazole[J].Analytica Chimica Acta, 2020, 1121:11-16.
[45] WU P, DU Q Z, SUN Y Y, et al.MIP-coated Eu(BTC) for the fluorometric determination of lincomycin in eggs[J].Analytical Methods, 2019, 11(35):4 501-4 510.
[46] AKYILDIRIM O, KARDA F, BEYTUR M, et al.Palladium nanoparticles functionalized graphene quantum dots with molecularly imprinted polymer for electrochemical analysis of citrinin[J].Journal of Molecular Liquids, 2017, 243:677-681.
F, BEYTUR M, et al.Palladium nanoparticles functionalized graphene quantum dots with molecularly imprinted polymer for electrochemical analysis of citrinin[J].Journal of Molecular Liquids, 2017, 243:677-681.
[47] ROUSHANI M, RAHMATI Z, HOSEINI S J, et al.Impedimetric ultrasensitive detection of chloramphenicol based on aptamer MIP using a glassy carbon electrode modified by 3-ampy-RGO and silver nanoparticle[J].Colloids and Surfaces B:Biointerfaces, 2019, 183:110451.
[48] LI Y, HSIEH C H, LAI C W, et al.Tyramine detection using PEDOT:PSS/AuNPs/1-methyl-4- mercaptopyridine modified screen-printed carbon electrode with molecularly imprinted polymer solid phase extraction[J].Biosensors and Bioelectronics, 2017, 87:142-149.
[49] SHRIVASTAV A M, USHA S P, GUPTA B D.Highly sensitive and selective erythromycin nanosensor employing fiber optic SPR/ERY imprinted nanostructure:Application in milk and honey[J].Biosensors and Bioelectronics, 2017, 90:516-524.
[50] ZHAO W R, KANG T F, LU L P, et al.A novel electrochemical sensor based on gold nanoparticles and molecularly imprinted polymer with binary functional monomers for sensitive detection of bisphenol A[J].Journal of Electroanalytical Chemistry, 2017, 786:102-111.
[51] 张丽丽, 李洁, 陈长宝, 等.三聚氰胺分子印迹表面等离子体共振传感器的制备及分析应用[J].分析化学, 2018, 46 (1):88-93.
ZHANG L L, LI J, CHEN C B, et al.Preparation of melamine molecularly imprinted surface plasmon resonance sensor and its analytical application[J].Chinese Journal of Analytical Chemistry, 2018, 46 (1):88-93.
[52] NAGABOOSHANAM S, ROY S, DESHMUKH S, et al.Microfluidic affinity sensor based on a molecularly imprinted polymer for ultrasensitive detection of chlorpyrifos[J].ACS Omega, 2020, 5(49):31 765-31 773.
[53] 林涛, 陈兴连, 刘兴勇, 等.QuEChERS-三重四极杆串联质谱测定柑橘中农药基质效应的方法研究[J].果树学报, 2021, 38(4):613-622.
LIN T, CHEN X L, LIU X Y, et al.A study on matrix effect of QuEChERS-triple quadrupole tandem mass spectrometry in determination of pesticides in citrus[J].Journal of Fruit Science, 2021, 38(4):613-622.
[54] MIAO J N, LIU A R, WU L N, et al.Magnetic ferroferric oxide and polydopamine molecularly imprinted polymer nanocomposites based electrochemical impedance sensor for the selective separation and sensitive determination of dichlorodiphenyltrichloroethane (DDT)[J].Analytica Chimica Acta, 2020, 1095(C):82-92.
[55] 秦思楠, 唐录华, 高文惠.三氟氯氰菊酯分子印迹电化学传感器的制备及性能研究与应用[J].应用化学, 2019, 36(8):958-967.
QIN S N, TANG L H, GAO W H.Cyhalothrin molecularly imprinted electrochemical sensor:Preparation, performance and application[J].Chinese Journal of Applied Chemistry, 2019, 36(8):958-967.
[56] HUANG Q W, ZHAO Z H, NIE D X, et al.Molecularly imprinted poly(thionine)-based electrochemical sensing platform for fast and selective ultratrace determination of patulin[J].Analytical Chemistry, 2019, 91(6):4 116-4 123.
[57] LI Y G, LIU J, ZHANG Y, et al.A robust electrochemical sensing platform using carbon paste electrode modified with molecularly imprinted microsphere and its application on methyl parathion detection[J].Biosensors and Bioelectronics, 2018, 106:71-77.
[58] LI S H, PANG C H, MA X H, et al.A gold nanoparticle-loaded molecularly imprinted switch sensor with high sensitivity to ethephon[J].Microchemical Journal, 2020, 157:105025.
[59] IDIL N, HEDSTRÖM M, DENIZLI A, et al.Whole cell based microcontact imprinted capacitive biosensor for the detection of Escherichia coli[J].Biosensors and Bioelectronics, 2017, 87:807-815.
[60] RAZIQ A, KIDAKOVA A, BOROZNJAK R, et al.Development of a portable MIP-based electrochemical sensor for detection of SARS-CoV-2 antigen[J].Biosensors and Bioelectronics, 2021, 178:113029.
[61] SERGEYEVA T,YARYNKA D, DUBEY L, et al.Sensor based on molecularly imprinted polymer membranes and smartphone for detection of fusarium contamination in cereals[J].Sensors(Basel,Switzerland), 2020, 20(15):4 304-4 324.
[62] PERÇIN I, IDIL N, BAKHSHPOUR M, et al.Microcontact imprinted plasmonic nanosensors:Powerful tools in the detection of Salmonella paratyphi[J].Sensors(Basel,Switzerland), 2017, 17(6):1 375-1 392.
[63] AKGÖNÜLLÜ S, YAVUZ H, DENIZLI A.SPR nanosensor based on molecularly imprinted polymer film with gold nanoparticles for sensitive detection of aflatoxin B1[J].Talanta, 2020, 219:121219.
[64] LI W Q, DIAO K S, QIU D Y, et al.A highly-sensitive and selective antibody-like sensor based on molecularly imprinted poly(L-arginine) on COOH-MWCNTs for electrochemical recognition and detection of deoxynivalenol[J].Food Chemistry, 2021, 350:129229.