柑橘是我国第二大水果,其风味优良且营养丰富是世界上最重要的经济作物和最受欢迎的水果之一。柑橘果实在采后的贮藏过程中,由于呼吸、蒸腾等作用,会导致果实中营养物质消耗和水分散失,进而使得果实品质下降,极易发生侵染性病害而腐烂,造成严重的经济损失。因此,如何有效地维持柑橘的贮藏品质,延长贮藏期是柑橘产业亟待解决的问题。
采用抗菌剂对柑橘进行处理,可有效减少外界病原菌对果实的侵染,进而提高贮藏品质。由于化学杀菌剂存在易产生抗药性、具有药物残留风险等缺点,安全无毒的天然抗菌剂得到了越来越多的关注,是未来的发展方向之一。植物精油作为一种天然的植物源挥发物质,因其广谱的抑菌活性同时又具有安全、环境友好的特点,在采后农产品的抑菌保鲜上发挥重要作用,逐渐成为了食品保鲜领域的研究热点[1]。柠檬醛是一种开链单萜类化合物,来源广泛,天然存在于多种植物的叶子和果实中,是山苍子、柠檬草和马鞭草等多种草本植物精油的关键成分,具有杀虫趋避和广谱的抗微生物作用,是经美国食品和药品管理局认证的食品添加剂,我国也允许其作为食用香料芳香精油使用(GB 1886.191—2016《食品添加剂 柠檬醛》)。柠檬醛在果蔬贮藏保鲜领域已有广泛研究,例如,经柠檬醛处理后的猕猴桃显著降低了腐烂率并保持了采后果实的品质[2];经柠檬草精油处理过的巨峰葡萄也表现出较低的腐烂率和较好的果实品质,且其保鲜效果与精油浓度相关[3]。但是,由于精油的疏水性、易挥发性和气味强烈等特点,在食品中的应用仍然存在限制。因此,采用无毒无味的载体对其进行包封以制备微胶囊或纳米乳是目前较为有效的解决措施,不仅可提高精油的稳定性,减少其刺激性气味,而且可控制其释放速率,延长其作用时间。
纳米乳液由水相(壁材)、油相(芯材)、表面活性剂等构成,作为功能活性成分载体,可以显著提高芯材的溶解性、稳定性和生物利用度。包封有活性成分的纳米乳,不仅提高了活性成分的生物利用度,表现出显著增强的有效扩散性,而且加强了抗菌和抗氧化等作用[4-5],其还具有缓释性能[6]。研究发现,将肉桂醛纳米乳涂层应用于双孢菇,能抑制微生物生长,降低双孢菇的呼吸和失重,并较好地维持品质指标[7]。将柠檬醛纳米乳与可食性涂膜结合应用,可将鲜切菠萝的贮藏期从9 d延长至12 d,并提高其贮藏品质[8]。因此,本研究以海藻酸钠(sodium alginate)为壁材,柠檬醛为芯材,采用高压微射流技术制备水包油型(oil in water,O/W)纳米乳,并将其用于砂糖桔的保鲜,以评价柠檬醛纳米乳在采后柑橘保鲜中的应用价值。
1 材料与方法
1.1 材料与试剂
砂糖桔,重庆本地;柠檬醛(纯度为97%)、吐温20,上海迈瑞尔化学技术有限公司;玉米油(试剂级),上海麦克林生化科技有限公司;海藻酸钠(分析纯),成都市科隆化学品有限公司;丙三醇(分析纯),广东光华科技股份有限公司;聚乙烯袋,尺寸170 mm×140 mm、厚度3 μm,四川绿果林制袋有限公司;超氧化物歧化酶(superoxide dismutase, SOD)和苯丙氨酸解氨酶(phenylalamine ammonia lyase, PAL)活性检测试剂盒,北京索莱宝科技有限公司;其余试剂均为分析纯。
1.2 仪器与设备
XHF-D高速分散器,宁波新芝有限公司;M-110EH-30高压微射流均质机,加拿大Microfluidics公司;Nano-ZS90纳米粒度及Zeta电位分析仪,英国Malvern公司;Epoch2酶标仪,美国Gene有限公司;PAY CHECK Model 650顶空分析仪,美国MOCON公司;2 WAJ阿贝折射仪,上海光学仪器五厂;GY-4硬度计,乐清市艾德堡仪器有限公司;L530R台式冷冻离心机,湖南湘仪实验室仪器开发有限公司。
1.3 实验方法
1.3.1 柠檬醛纳米乳的制备与表征
(1)柠檬醛纳米乳的制备
称取1 g海藻酸钠分散于100 mL质量分数为0.5%的丙三醇水溶液中,70 ℃下搅拌3 h得到质量分数为1%海藻酸钠水相溶液。将溶液冷却至室温后在搅拌的同时,称取一定量的柠檬醛和玉米油(二者质量比为4∶7)作为油相缓慢加入其中,再加入与油相总质量比为1∶2的吐温20作为乳化剂。玉米油为成熟抑制剂,用于控制奥斯特瓦尔德熟化[9]。对上述水油混合物进行高速剪切(10 000 r/min、3 min)得到粗乳;再将粗乳进行微射流(150 MPa、3个循环)处理,得到柠檬醛最终含量分别为0.1%、0.3%、0.5%(质量分数)的纳米乳,于4 ℃冷藏备用。
称取一定量的柠檬醛分散于去离子水溶液中,进行高速剪切(10 000 r/min、3 min),得到质量分数为0.3%的柠檬醛溶液;纯海藻酸钠溶液按照上述纳米乳水相的制备方法进行制备。
(2)粒径、多分散系数和电位的测定
将制得的纳米乳用去离子水稀释50倍,采用纳米粒度及Zeta电位分析仪测定纳米乳液的粒径、多分散系数(polydispersity index, PDI)和Zeta电位。测定温度25 ℃,平衡时间120 s。
(3)微观形貌测定
将柠檬醛纳米乳稀释后进行负染色,使用JEM 1200EX透射电子显微镜(transmission electron microscope, TEM)观察样品的微观形貌。
1.3.2 采用柠檬醛纳米乳对砂糖桔进行处理
挑选质量、大小、成熟度一致,外观完好的砂糖桔果实,清水清洗外表皮后用体积分数为2%的次氯酸钠水溶液浸泡2 min,再用纯水润洗。自然晾干后,将其随机分为6组,每组约150个果实。对照组不再进行任何处理,记为BG;处理组分别在1%(质量分数)纯海藻酸钠涂膜液、0.3%(质量分数)柠檬醛溶液,以及柠檬醛含量为0.1%、0.3%和0.5%(质量分数)的纳米乳涂膜液中浸泡2 min,取出自然晾干,分别记为SA、0.3%C、0.1%C-NE、0.3%C-NE和0.5%C-NE。采用聚乙烯袋对各组果实进行单果套袋包装后,逐一称重,然后置于温度为(14±2) ℃、湿度为(60±5)%的环境下贮藏,每2天从每组中随机取出12个无损果实进行指标测定。
1.3.3 砂糖桔贮藏品质的测定
(1)失重率
每组取50个果实用于失重率的测定。通过公式(1)计算果实的失重率:
失重率![]()
(1)
式中:m0,第0天果实的质量;mt,贮藏至第t天时果实的质量。
(2)腐烂率
每2 d观察1次果实腐烂情况,记录各组果实的腐烂个数,通过公式(2)计算各组果实的累积腐烂率:
腐烂率![]()
(2)
式中:N0,该组果实总个数;Nt,该组果实贮藏至第t天时累积腐烂果实个数。
(3)呼吸强度
参考高燕利等[10]的方法测定,并进行适当修改。每组随机取12个果实,称重后放置于洁净干燥皿内,密封静置1 h后,将顶空分析仪探头小心插入干燥皿内测定CO2的体积分数,计算果实的呼吸强度,结果以mg CO2/(kg·h)表示。
(4)硬度
采用果实硬度计(探头直径为4 mm)在果实赤道部位取等距的3个位置,测定果实硬度,三点测得的平均值记为该果实的硬度。结果以N表示。
(5)可溶性固形物含量
将果肉榨汁后,经纱布过滤,采用阿贝折射仪测定果汁中的可溶性固形物含量。结果以%表示。
(6)可滴定酸含量
采用氢氧化钠溶液滴定法测定。称取20 g果肉浆,用超纯水定容至100 mL,摇匀,静置提取30 min后过滤得滤液。取20 mL滤液,加入2滴1%酚酞指示剂,用0.1 mol/L NaOH溶液滴定直至初显粉色,且在30 s内不褪色,记录此时消耗的溶液体积,通过公式(3)计算果肉中的可滴定酸含量:
可滴定酸含量![]()
(3)
式中:V,样品提取液总体积,mL;c,NaOH滴定液浓度,mol/L;V1,滴定滤液消耗的NaOH溶液体积,mL;V0,滴定蒸馏水消耗的NaOH溶液体积,mL;K,折算系数,以柠檬酸作标准,为0.064;V2,滴定时所取滤液体积;m,样品质量,g。
(7)抗坏血酸含量
采用2, 6-二氯酚靛酚滴定法测定,称取10 g果肉浆,用20 g/L草酸溶液定容至100 mL,摇匀,静置提取10 min后过滤得滤液。取10 mL滤液,用已标定的2, 6-二氯酚靛酚溶液滴定至出现微红色、且15 s不褪色,记下染料用量,同时以10 mL 20 g/L草酸溶液作为空白,按同样方法进行滴定。通过公式(4)计算果肉中的抗坏血酸含量:
抗坏血酸含量![]()
(4)
式中:V,样品提取液总体积,mL;V1,样品滴定消耗的染液体积,mL;V0,空白滴定消耗的染料体积,mL;ρ,1 mL染料溶液相当于抗坏血酸的质量,mg/mL;V2,滴定时所取样品溶液体积,mL;m,样品质量,g。
(8)总酚含量
参照余易琳等[11]的方法并加以改进,取0.5 g砂糖桔果肉样品,加入0.5 mL浓度为0.25 mol/L福林酚溶液(采用福林酚试剂用蒸馏水按1∶3体积比稀释),混匀后,静置3 min,加入1 mL质量体积为7.5%的碳酸钠溶液,混匀,静置30 min,取上清液测定该溶液在760 nm处的吸光度值,结果以ΔOD/g表示。
(9)丙二醛含量
将清洗晾干后的砂糖桔果皮研磨成粉,称取1 g果皮粉末,加入5 mL预冷后的三氯乙酸溶液(100 g/L),于4 ℃、4 000 r/min离心30 min,取2 mL上清液与2 mL质量浓度为6.7 g/L的硫代巴比妥酸溶液混合后,煮沸20 min,冷却后再次离心1次得待测液。果皮中丙二醛测定和计算方法参考余易琳等[11]的方法,结果以μmol/kg表示。
(10)酶活性测定
过氧化物酶(peroxidase, POD)活性检测:称取0.5 g果皮粉末,加入5 mL预冷的提取缓冲液(含0.1 mol/L、pH 5.5乙酸-乙酸钠缓冲液,1 mmol/L聚乙二醇6000,40 g/L的聚乙烯吡咯烷酮,10 g/L的Triton X-100)于4 ℃、4 000 r/min离心30 min;取0.5 mL上清液,加入3 mL愈创木酚溶液(25 mmol/L),200 μL H2O2溶液(0.5 mol/L)。果皮中POD活性的测定和计算方法参考曹建康等[12]的方法,结果以ΔOD470/(min·g)表示。
SOD和PAL活性参照相应的检测试剂盒说明书进行测定和计算。
1.3.4 数据处理
除特别指出外,各组样品的上述指标测定中均重复测定3次,数据采用平均值±均方差表示,采用ANOVA单因素方差分析和Duncan多重比较进行显著性分析,P<0.05表示组间差异显著。
2 结果与分析
2.1 柠檬醛纳米乳的表征
粒径是纳米乳的重要性质之一,其粒径越小,比表面积越高,则对活性物质的包封效率越高。由表1数据可知,经过微射流处理后,含0.1%~0.5%柠檬醛的混合溶液均能形成液滴直径为200 nm以下的纳米乳。当精油含量从0.1%提高至0.3%时,液滴粒径显著降低(P﹤0.05),但进一步增至0.5%时,则无显著变化(P﹥0.05)。在生姜精油纳米乳的制备中也出现了类似情况[13],可能是由于精油含量较低时,形成的纳米液滴数量较少,水相中过量的海藻酸钠吸附到液滴周围使其粒径变大。
PDI是液滴粒径分布的衡量指标,其值越接近于0则表示液滴尺寸分布越均匀,而其值越接近于1则表明液滴尺寸分布越不均匀。通常认为其值低于0.3时,纳米乳液液滴大小分布均匀。表1中列出的3种柠檬醛纳米乳的PDI值均小于0.3,且随柠檬醛含量的增加而降低,说明所制备的纳米乳粒径分布均匀,且柠檬醛含量的增加有助于提高其尺寸的均一性。
Zeta电位是预测纳米乳液稳定性的重要指标,通常认为当电位绝对值高于30 mV时,液滴间就具有足够大的静电排斥力来克服自然聚集的趋势,从而保持乳液的稳定[14-15]。表1数据表明,3种乳液均带负电,Zeta电位绝对值为50 mV左右,且组间无显著性差异(P﹥0.05),说明柠檬醛的浓度对纳米乳液滴的Zeta电位无显著影响(P﹥0.05)。通常,液滴的电荷是由吸附在油滴周围的表面活性剂所带电荷来决定[16]。本研究中所用的吐温20是非离子表面活性剂,液滴表面的负电位来源于在微射流的高压作用下芯材表面所吸附的海藻酸钠,因此所形成的纳米乳为水包油型。综合粒径、PDI、Zeta电位来看,所制备的纳米乳具有较高的稳定性且当柠檬醛浓度为0.3%或以上时,纳米乳的粒径较小且分布均匀。
表1 柠檬醛纳米乳的粒径、PDI和电位
Table 1 Diameter, PDI, and Zeta potential of citral nanoemulsions
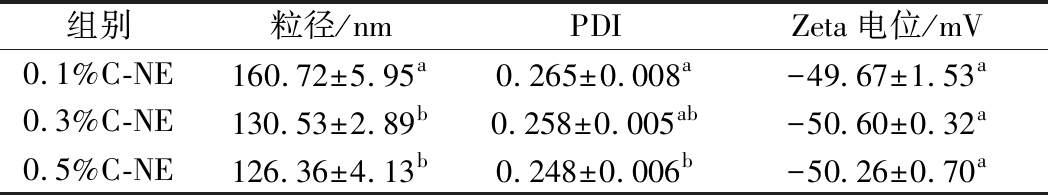
组别粒径/nmPDIZeta电位/mV0.1%C-NE160.72±5.95a0.265±0.008a-49.67±1.53a0.3%C-NE130.53±2.89b0.258±0.005ab-50.60±0.32a0.5%C-NE126.36±4.13b0.248±0.006b-50.26±0.70a
注:同列不同小写字母标注表示各组样品间存在显著性差异(P<0.05)
2.2 柠檬醛纳米乳微观形貌分析
图1为0.1%C-NE、0.3%C-NE和0.5%C-NE的TEM图。由图1可知,3种浓度的柠檬醛纳米乳中的液滴粒径均低于200 nm,形状为圆球形且呈单分散状态,与表1中所列数据一致,进一步证实通过高压微射流可成功制备粒径均一且尺寸为纳米级的O/W型乳液。

A-0.1%C-NE;B-0.3%C-NE;C-0.5%C-NE
图1 0.1%C-NE、0.3%C-NE和0.5%C-NE的TEM图
Fig.1 TEM images of 0.1%C-NE、0.3%C-NE and 0.5%C-NE
2.3 柠檬醛纳米乳涂膜对砂糖桔贮藏品质的影响
2.3.1 果实呼吸强度、失重率、腐烂率和硬度的变化
呼吸作用是砂糖桔采后主要的生理代谢活动,会消耗果实中的营养物质,导致果实品质降低并衰老。各组果实在贮藏期间的呼吸强度变化如图2-A所示。由图2-A可知,在贮藏第2天时,各组的呼吸强度均上升,保持一定平稳期后呈波动性下降。柑橘为非跃变型果实,出现采后呼吸增强的现象可能是该批果实在采摘时尚未完全成熟,在采后贮藏期间逐渐成熟而导致生理活动加剧[17]。在贮藏期的前6 d,0.3%C组呼吸强度显著高于其余组(P<0.05),可能是由于柠檬醛直接作用于果实,对果皮有一定的刺激与损伤,损伤部位通过呼吸作用的加强,迅速合成新细胞所需的组分,加速修补或恢复受损组织,从而表现出呼吸作用增强[17]。经纳米乳处理的各组果实其呼吸强度在贮藏期间均处于较低水平,尤其是0.3%C-NE组,说明纳米乳处理可有效降低果实的呼吸强度。其原因可能是以海藻酸钠为水相的纳米乳具有良好的成膜性,可在果实表面形成致密的薄膜,从而可减少果实的内外气体交换,降低其呼吸速率[18]。
砂糖桔的采后失重主要归因于果实的蒸腾作用导致水分散失,以及呼吸作用过程中有机养分的消耗。如图2-B所示,在整个贮藏期内,各组失重率均随着贮藏时间的延长而增加,其中BG和0.3%C组的失重率始终高于其余组。自贮藏第10天起,各柠檬醛纳米乳处理组的失重率均显著低于对照组和其他处理组(P<0.05),且纳米乳处理组之间无显著性差异(P>0.05),与呼吸强度的规律较为一致。一方面,可能是由于纳米乳处理降低了果实的呼吸作用,从而减少了营养物质的消耗;另一方面,纳米乳可在果实表面形成油性薄膜,具有较好的水蒸气阻隔性,进而减少了水分在果实表面的汽化蒸发。据报道,纳米乳运用于南丰蜜桔[19]、草莓[20]时,也可显著降低果实在贮藏期间的失重率。
各组果实在贮藏期间的腐烂率变化如图2-C所示。各组的腐烂率在第8天均无显著性差异(P>0.05),从第10天开始则出现分化。其中,BG组的腐烂率在第14天时急剧增加至34%,显著高于其余各组(P<0.05);其次为SA和0.5%C-NE组,其腐烂率均在第10天增加较快,至第12天时达到平稳,但仍然显著高于0.3%C和0.3%C-NE组(P<0.05);0.3%C和0.1%C-NE组在贮藏后期维持了较为接近且相对较低的腐烂率,说明纳米乳中即使包埋的柠檬醛浓度较低(0.1%),也可通过缓释延长其作用时间,达到与较高浓度柠檬醛(0.3%)直接作用时相近的效果;而整个贮藏期间内,0.3%C-NE组均未出现腐烂果实,说明该浓度的纳米乳对于抑制果实的腐烂具有非常良好的效果。以上结果表明,海藻酸钠基材虽然可在果实表面形成涂膜,但不具备抗菌性,且吸水性强,因此对果实腐烂的抑制作用较为有限(SA组),而将柠檬醛直接应用于果实时(0.3%C组),可能对果皮有不利影响且精油挥发速度快,抗菌效果无法持续[21]。柠檬醛纳米乳则可在果实表面形成一层含油相的薄膜,降低海藻酸钠的吸湿性,增强涂膜的稳定性,并且可持续释放出柠檬醛,发挥长效抗菌的作用[22],因此可显著地降低果实的腐烂率(P﹤0.05),但其效果与纳米乳中的柠檬醛浓度有关[23]。含量过低(0.1%)时,释放出来的柠檬醛浓度低,对果实的作用效果有限;而含量过高(0.5%)则可能在短时间内释放出高浓度的柠檬醛,对果皮有一定刺激作用[24],导致果实在贮藏后期的腐烂率迅速升高。适宜含量(0.3%)的纳米乳则可持续挥发出最佳浓度的柠檬醛,在不损伤果皮的前提下,发挥良好的抗菌作用,有效延缓了果实的腐烂。
果实硬度是衡量砂糖桔成熟度和贮藏品质的重要指标之一。如图2-D,在整个贮藏期间,果实的硬度是呈波动性下降的趋势,组间差异较小。在贮藏的中后期(第6~12天),BG组和0.5%C-NE组的果实硬度相对较低,可能是由于BG组成熟和衰老的进程较快,而0.5%C-NE组果实的果皮在高浓度柠檬醛的作用下发生损伤而软化。
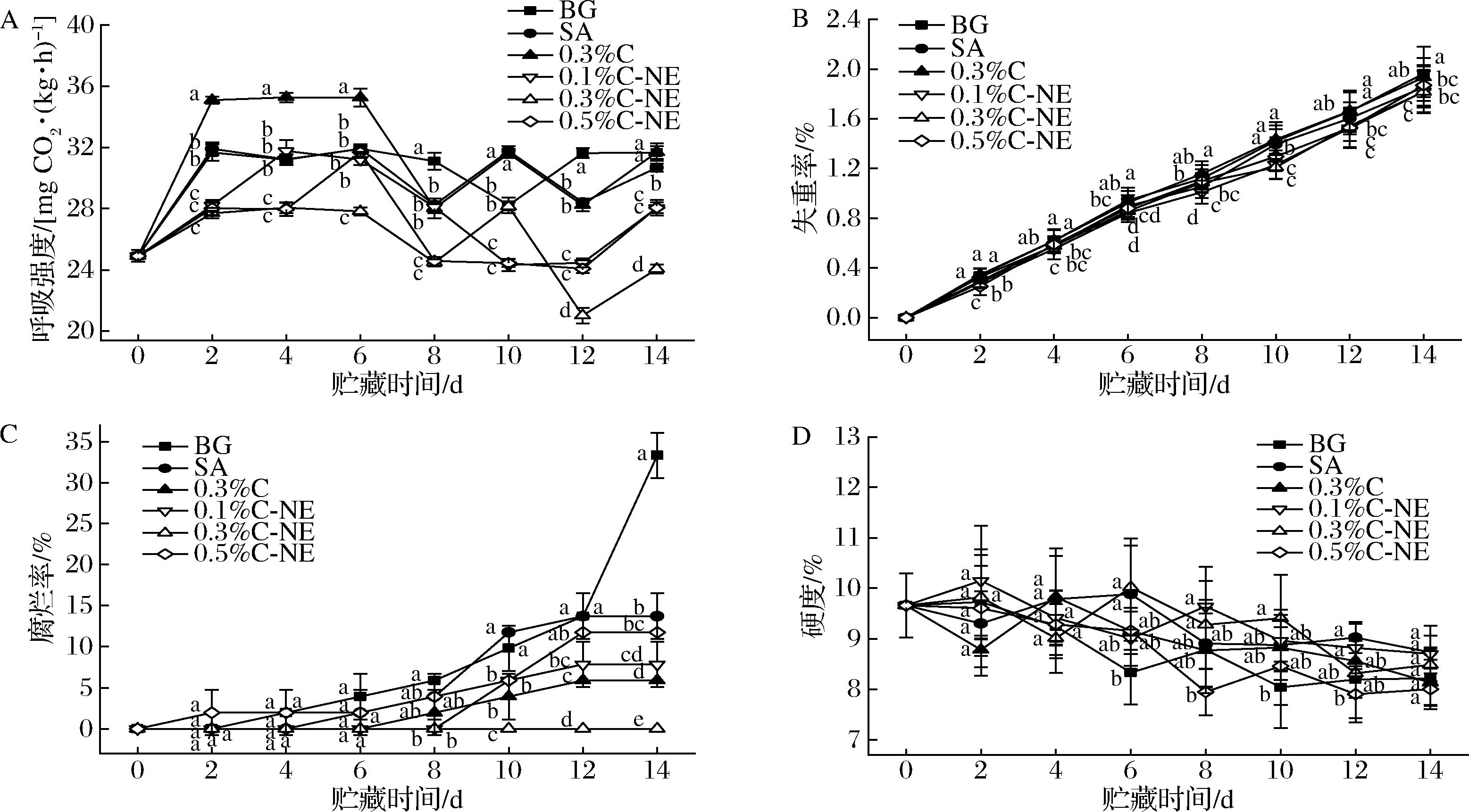
A-呼吸强度;B-失重率;C-腐烂率;D-硬度
图2 各组砂糖桔的呼吸强度、失重率、腐烂率和果实硬度随贮藏时间的变化
Fig.2 Variations of respiration rate, weight loss, rotting rate and firmness of shatangju during storage
注:相同贮藏时间的各组样品指标上所标注的小写字母不同则表示样品间存在显著性差异(P<0.05)(下同)
2.3.2 果实中营养物质含量的变化
可溶性固形物的主要成分是可溶性糖,果实贮藏过程中淀粉、半纤维素、果胶等物质的降解会导致其含量增加,而呼吸作用过程中糖的消耗则会降低其含量。可滴定酸的主要成分是有机酸,是果实重要的风味物质,也是果实呼吸作用的主要底物之一[25]。抗坏血酸是柑橘果实重要的营养物质之一,也是一种强抗氧化剂,能有效清除和减少自由基的积累,减少其对细胞膜的损伤[26]。如图3-A所示,在贮藏期间,各组果实的可溶性固形物含量在14%附近波动,其中BG组和0.5%C-NE组的波动最大,0.3%C-NE组的含量则相对稳定。图3-B所示为各组果实在贮藏期间的可滴定酸含量变化,在贮藏前期均波动较大,后期则0.1%C-NE组和0.3%C-NE组的含量相对稳定。果实中抗坏血酸含量的变化如图3-C所示,总体呈下降趋势,是由于随着果实在贮藏过程中的衰老,细胞中活性氧的增加,抗坏血酸逐渐被消耗所致。与BG组、SA组和0.3%C组相较而言,纳米乳处理组的抗坏血酸含量在贮藏期间波动较小,可能是由于柠檬醛纳米乳处理延缓了果实的衰老进程,使得果实中的活性氧较少,因而具有较为稳定的抗坏血酸含量。果实中的酚类物质与果实的色泽发育、品质和风味形成、成熟衰老过程、抗逆性和抗病性代谢等作用密切相关。如图3-D所示,各组果实的总酚含量呈波动性下降,且BG组的下降速率明显大于其余组,说明未处理果实的衰老进程较快。其余各组中,0.3%C-NE组的总酚含量在整个贮藏期间均维持着较高水平,进一步说明了柠檬醛含量为0.3%的纳米乳可较好地延缓果实老化,保持其贮藏品质。
综合而言,纳米乳处理组能较好地维持砂糖桔果实中的抗坏血酸含量和总酚含量,尤其是0.3%C-NE组能保持较高且较为稳定的营养物质含量,可能与其对果实呼吸强度的适当抑制以及持续的抗菌效果有关。
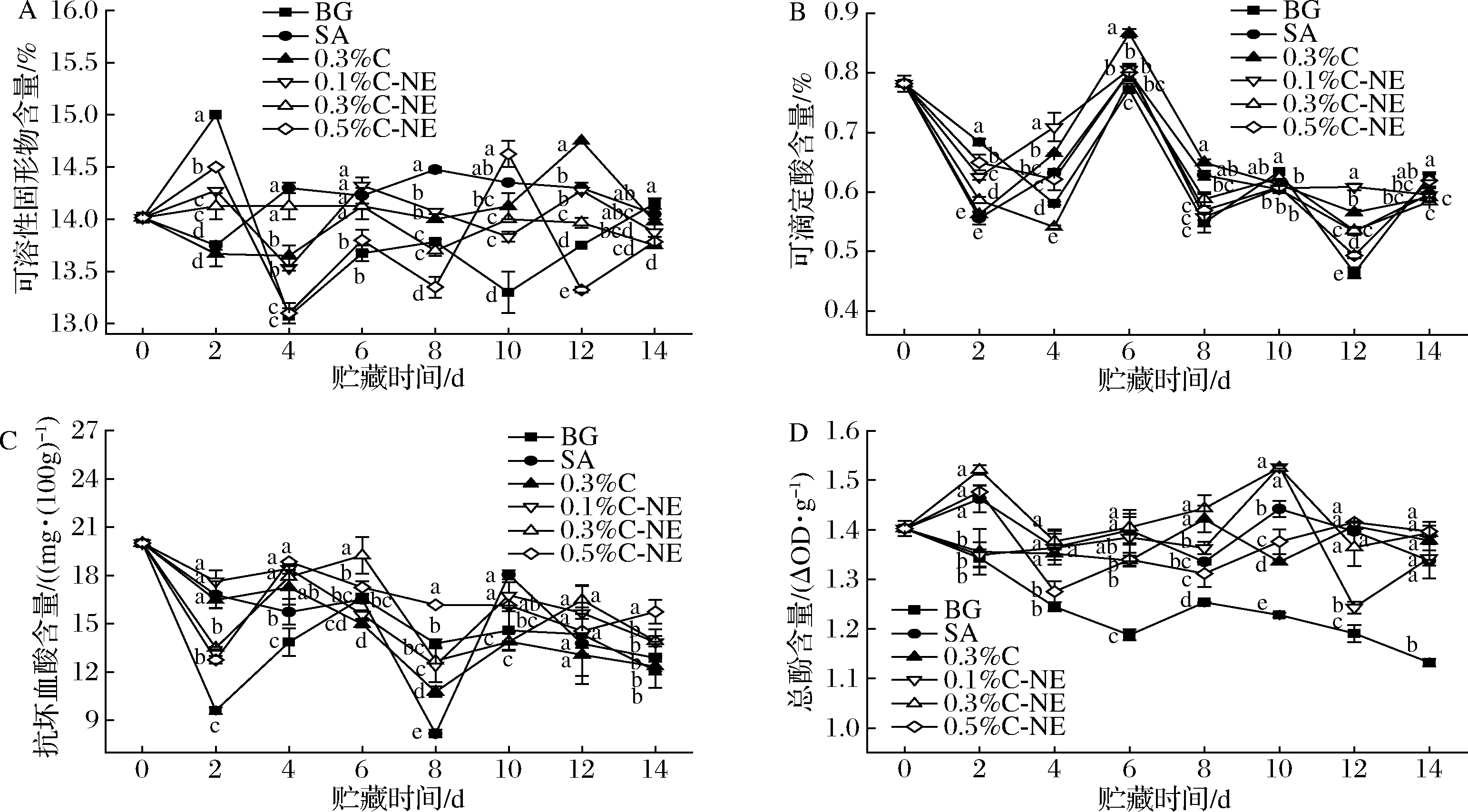
A-可溶性固形物;B-可滴定酸;C-抗坏血酸;D-总酚
图3 各组砂糖桔的可溶性固形物、可滴定酸、抗坏血酸和总酚随贮藏时间的变化
Fig.3 Variations of total soluble solid, titratable acidity, ascorbic acid, and total phenols of shatangju during storage
2.3.3 丙二醛含量与抗氧化酶活性变化
丙二醛是膜脂过氧化作用的主要产物之一,其在细胞中的累积会对果实细胞质膜和细胞器造成一定的伤害,从而加速果实衰老和腐烂。因此,通常以其含量作为脂质过氧化指标,衡量细胞膜脂的过氧化程度[27]。如图4-A所示,各组丙二醛含量均随贮藏时间的延长而升高,尤其是BG组在第4天便高达1.0 μmol/kg并显著高于其余各组(P<0.05)。SA组与0.3%C组的丙二醛含量呈波动变化,并分别于第10天、第6天达到峰值,而各纳米乳处理组在贮藏前4 d的丙二醛含量均显著低于其余组(P<0.05),之后0.5%C-NE组的含量有所上升,但0.3%C-NE组的丙二醛含量在整个贮藏期间除第0天、第12天外,均显著低于BG组(P<0.05)。进一步说明,纳米乳处理组尤其是0.3%C-NE组能够有效防止果实的膜脂受损,从而延缓果实的衰老。
采后柑橘果实在成熟衰老过程中,细胞中积累了大量的活性氧,而POD、SOD则是果实中重要的氧化自由基解毒酶,起着清除活性氧的作用,因此可用其活性来判断果实的衰老进程[28]。如图4-B所示,砂糖桔果皮中的POD活性整体呈波动性下降再上升的趋势。贮藏第2天,只有BG组的POD活性下降,其余组均呈上升趋势。0.3%C组贮藏第2~8天时的POD活性略高于0.3%C-NE组,在贮藏第10~14天时略低于0.3%C-NE组。由此推测,与柠檬醛溶液相比,柠檬醛纳米乳更有助于维持砂糖桔贮藏后期的POD活性,说明纳米乳能在果实贮藏期间发挥更为长效的作用。如图4-C所示,所有组的SOD在贮藏期间均呈波动性降低的趋势。其中BG组的SOD活性同样在贮藏第2天便迅速下降,且此后均保持较低水平。0.3%C-NE组的SOD活性在贮藏前4 d时均维持在与第0天接近的水平,而其余组均呈下降的趋势。一方面,纳米乳的抗菌和成膜作用,延缓了果实的衰老,减少了细胞中活性氧的产生,同时柠檬醛本身具有较强抗氧化能力,有较好的自由基清除能力,有助于清除果皮细胞中的活性氧,从而保持果皮细胞中的抗氧化酶活性。研究表明,精油纳米乳涂膜处理后的南丰蜜桔与对照组相比,同样具有较高的POD和SOD活性[19]。
PAL是苯丙烷代谢的关键酶,是黄酮类物质、酚类物质等许多植物次生物质生物合成途径,与植物的抗逆境胁迫和抗病性密切相关,在植物的正常生长发育和抵御病原菌侵害过程中起着重要作用。如图4-D所示,在整个贮藏期间各组PAL活性的波动相对较小。其中,BG组的PAL活性在贮藏期间先增加,在第4天时达到最大值,随后逐渐减小,在第12天时活性最低。其余各组在贮藏期间的组间差异较小,只有SA组的PAL活性在第10天时显著高于其余组,而0.3%C-NE组第14天时具有最高的PAL活性。再次证实纳米乳的作用效果较为持久,可在贮藏后期提高果实中的酶活性,增强果实抵御病原菌侵害的能力。

A-丙二醛含量;B-POD活性;C-SOD活性;D-PAL活性
图4 各组砂糖桔的丙二醛含量、POD活性、SOD活性和PAL活性随贮藏时间的变化
Fig.4 Variations of MDA content, POD activity, SOD activity, and PAL activity of shatangju during storage
3 结论
本研究采用微射流技术成功制备了柠檬醛含量为0.1%、0.3%和0.5%(质量分数)的纳米乳液,其粒径分布均匀且稳定性好。将不同含量的柠檬醛纳米乳用于采后砂糖桔的保鲜后发现,纳米乳处理可显著抑制果实的呼吸,降低其失重率。贮藏至第14天时,各组的腐烂率从高到低依次为:BG>SA>0.5%C-NE>0.1%C-NE>0.3%C>0.3%C-NE,其中0.3%C-NE组在贮藏结束时腐烂率仍为0,说明柠檬醛含量为0.3%的纳米乳可持续释放出适宜浓度的柠檬醛,以达到长效抗菌保鲜的目的。同时,0.3%C-NE组果实具有较为稳定的可溶性固形物含量,较高的抗坏血酸和总酚含量,果皮中具有较低的丙二醛含量,且可在贮藏后期较好维持POD、SOD、PAL活性。因此,浓度适宜的柠檬醛纳米乳在抑制果实腐烂、提高其贮藏品质方面表现出较好的优势,可作为一种安全长效的保鲜剂用于采后果蔬保鲜。
[1] 梁攀, 李悦妍, 黄少云, 等.柑橘类水果贮藏保鲜技术研究进展[J].包装工程, 2021, 42(13):57-66.
LIANG P, LI Y Y, HUANG S Y, et al.Research progress of postharvest storage and preservation technology of citrus fruits[J].Packaging Engineering, 2021, 42(13):57-66.
[2] WEI L, CHEN C Y, CHEN J Y, et al.Possible fungicidal effect of citral on kiwifruit pathogens and their mechanisms of actions[J].Physiological and Molecular Plant Pathology, 2021, 114:101631.
[3] 许泽文, 李环通, 王绮潼, 等.柠檬草精油成分分析、抑菌性及对巨峰葡萄保鲜研究[J].食品研究与开发, 2020, 41(1):51-59.
XU Z W, LI H T, WANG Q T, et al.Analysis of volatile components, antibacterial activity and perseveration on Kyoho grapes of lemongrass essential oil[J].Food Research and Development, 2020, 41(1):51-59.
[4] DONS F, CUOMO A, MARCHESE E, et al.Infusion of essential oils for food stabilization:Unraveling the role of nanoemulsion-based delivery systems on mass transfer and antimicrobial activity[J].Innovative Food Science & Emerging Technologies, 2014, 22:212-220.
F, CUOMO A, MARCHESE E, et al.Infusion of essential oils for food stabilization:Unraveling the role of nanoemulsion-based delivery systems on mass transfer and antimicrobial activity[J].Innovative Food Science & Emerging Technologies, 2014, 22:212-220.
[5] ACEVEDO-FANI A, SOLIVA-FORTUNY R, MART N-BELLOSO O.Nanoemulsions as edible coatings[J].Current Opinion in Food Science, 2017, 15:43-49.
N-BELLOSO O.Nanoemulsions as edible coatings[J].Current Opinion in Food Science, 2017, 15:43-49.
[6] 张晶琳. 生姜精油缓释体系构建及在果蔬保鲜上的应用[D].杭州:浙江科技学院, 2020.
ZHANG J L.Establishment of sustained release system of ginger essential oil and its application in fruits and vegetables preservation[D].Hangzhou:Zhejiang University of Science and Technology, 2020.
[7] LOUIS E, VILLALOBOS-CARVAJAL R, REYES-PARRA J, et al.Preservation of mushrooms (Agaricus bisporus) by an alginate-based-coating containing a cinnamaldehyde essential oil nanoemulsion[J].Food Packaging and Shelf Life, 2021, 28:100662.
[8] PRAKASH A, BASKARAN R, VADIVEL V.Citral nanoemulsion incorporated edible coating to extend the shelf life of fresh cut pineapples[J].LWT-Food Science and Technology, 2020, 118:108851.
[9] HAN S W, SONG H Y, MOON T W, et al.Influence of emulsion interfacial membrane characteristics on Ostwald ripening in a model emulsion[J].Food Chemistry, 2018, 242:91-97.
[10] 高燕利, 徐丹, 任丹, 等.纳米氧化锌复合涂膜中锌的迁移及其对采后红橘的影响[J].食品与发酵工业, 2020,46(15):154-161.
GAO Y L, XU D, REN D, et al.Migration of Zn in nano zinc oxide composite coatings and its effects on postharvest tangerine fruits[J].Food and Fermentation Industries, 2020, 46(15):154-161.
[11] 余易琳, 徐丹, 任丹, 等.纳米纤维素/壳聚糖复合涂膜在红桔保鲜中的应用[J].食品与发酵工业, 2020, 46(2):135-141.
YU Y L, XU D, REN D, et al.Effects of nanocrystal cellulose/chitosan composite coatings on red tangerine preservation[J].Food and Fermentation Industries, 2020, 46(2):135-141.
[12] 曹建康,姜微波,赵玉梅. 果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007.
CAO J K.Physiological and Biochemical Experiment Guidance for Postharvest Fruits and Vegetables[M].Beijing:China Light Industry Press, 2007.
[13] ALEXANDRE E M C, LOURENÇO R V, BITTANTE A M Q B, et al.Gelatin-based films reinforced with montmorillonite and activated with nanoemulsion of ginger essential oil for food packaging applications[J].Food Packaging and Shelf Life, 2016, 10:87-96.
[14] HEURTAULT B, SAULNIER P, PECH B, et al.Physico-chemical stability of colloidal lipid particles[J].Biomaterials, 2003, 24(23):4 283-4 300.
[15] MANZOOR S, GULL A, WANI S M, et al.Improving the shelf life of fresh cut kiwi using nanoemulsion coatings with antioxidant and antimicrobial agents[J].Food Bioscience, 2021, 41:101015.
[16] FARDOUS J, OMOSO Y, JOSHI A, et al.Development and characterization of gel-in-water nanoemulsion as a novel drug delivery system[J].Materials Science and Engineering:C, 2021, 124:112076.
[17] 潘永贵, 谢江辉.现代果蔬采后生理[M].北京:化学工业出版社, 2009.
PAN Y G, XIE J H.Postharvest Physiology of Modern Fruits and Vegetables[M].Beijing:Chemical Industry Press, 2009.
[18] AL-TAYYAR N A, YOUSSEF A M, AL-HINDI R R.Edible coatings and antimicrobial nanoemulsions for enhancing shelf life and reducing foodborne pathogens of fruits and vegetables:A review[J].Sustainable Materials and Technologies, 2020, 26:e00215.
[19] YANG R P, MIAO J Y, SHEN Y T, et al.Antifungal effect of cinnamaldehyde, eugenol and carvacrol nanoemulsion against Penicillium digitatum and application in postharvest preservation of citrus fruit[J].LWT-Food Science and Technology, 2021, 141:110924.
[20] CHU Y F, GAO C C, LIU X Y, et al.Improvement of storage quality of strawberries by pullulan coatings incorporated with cinnamon essential oil nanoemulsion[J].LWT, 2020, 122:109054.
[21] ALI A, NOH N M, MUSTAFA M A.Antimicrobial activity of chitosan enriched with lemongrass oil against anthracnose of bell pepper[J].Food Packaging and Shelf Life, 2015, 3:56-61.
[22] RADI M, AKHAVAN-DARABI S, AKHAVAN H R, et al.The use of orange peel essential oil microemulsion and nanoemulsion in pectin-based coating to extend the shelf life of fresh-cut orange[J].Journal of Food Processing and Preservation, 2018, 42(2):e13441.
[23] DONG F, WANG X L.Effects of carboxymethyl cellulose incorporated with garlic essential oil composite coatings for improving quality of strawberries[J].International Journal of Biological Macromolecules, 2017, 104:821-826.
[24] GUERREIRO A C, GAGO C M L, FALEIRO M L, et al.Raspberry fresh fruit quality as affected by pectin- and alginate-based edible coatings enriched with essential oils[J].Scientia Horticulturae, 2015, 194:138-146.
[25] XU D, QIN H R, REN D.Prolonged preservation of tangerine fruits using chitosan/montmorillonite composite coating[J].Postharvest Biology and Technology, 2018, 143:50-57.
[26] NAIR M S, SAXENA A, KAUR C.Effect of chitosan and alginate based coatings enriched with pomegranate peel extract to extend the postharvest quality of guava (Psidium guajava L.)[J].Food Chemistry, 2018, 240:245-252.
[27] XU W T, PENG X L, LUO Y B, et al.Physiological and biochemical responses of grapefruit seed extract dip on ‘Redglobe’ grape[J].LWT-Food Science and Technology, 2009, 42(2):471-476.
[28] XING Y G, YANG H L, GUO X L, et al.Effect of chitosan/Nano-TiO2 composite coatings on the postharvest quality and physicochemical characteristics of mango fruits[J].Scientia Horticulturae, 2020, 263:109135.