中华绒螯蟹,又称河蟹、大闸蟹或螃蟹,肉味鲜美,含有蟹红素、蟹黄素和多种维生素[1],经济价值高,是我国特色的淡水名优品种和出口创汇水产品。大闸蟹加工产业发展较为缓慢,大都活体销售,食用方法限于蒸煮或者腌制。而且大闸蟹的销售主要集中在沿海地区及大中城市,销售区域性较为明显,食蟹人群狭窄。在大闸蟹的养殖过程中,往往会出现性早熟的一龄河蟹以及小规格的二龄河蟹[2],通常被剥离蟹肉脱水炒制肉松[3]、挑出蟹黄制作蟹黄包、蟹黄面,或是以肝胰腺为原料提取蟹油[4]等,在这过程中会产生大量蟹腿、蟹壳等下脚料[5],其大部分以废料的方式被排放到环境中,浪费的同时引起一些环境问题,亟需相关研究来帮助推进大闸蟹下脚料的加工与利用[6]。
大闸蟹下脚料氨基酸种类齐全,组成比例和评分能满足人体营养需求。吴浩然等[7]发现大闸蟹碎肉、碎骨等中的蛋白质含量达到30%,含有17种氨基酸,其中必需氨基酸/氨基酸总量值为34.58%,鲜味氨基酸/氨基酸总量值为41.68%。另外,大闸蟹凭借其独特的口感风味,可以开发出具有地方特色的休闲即食食品,具有良好的市场前景和经济效益[8]。
从水产品中提取蛋白质是深加工的重要方面,蛋白水解产物可被广泛应用于食品添加剂、保健品、方便食品、调味品加工等领域。目前,提取方法大体有酸水解法、碱水解法和蛋白酶水解法。与酸法或碱法相比,蛋白酶水解效率高,反应条件温和,容易控制,不破坏氨基酸构型等优势[9]。因此,本实验将利用大闸蟹下脚料,探究蛋白酶水解大闸蟹下脚料的影响因素,同时确定其最佳工艺条件,并对水解产物的品质进行分析。
1 材料与方法
1.1 材料和试剂
大闸蟹下脚料(蟹脚),江苏常州诺亚方舟有限公司;中性蛋白酶、碱性蛋白酶、酪蛋白溶液、L-酪氨酸标准储备液、木瓜蛋白酶,北京索莱宝科技有限公司;胰蛋白酶、风味蛋白酶,上海沪试化工有限公司;氢氧化钠、盐酸、石油醚、硫酸铜、硫酸、硼酸、乙酸镁、乙醇、三氯乙酸、磷酸氢二钠、柠檬酸,国药集团化学试剂有限公司;甲基红指示剂,上海泰坦科技股份有限公司;溴甲酚绿指示剂,北京伊诺凯科技有限公司;盐酸滴定使用标准溶液,东莞市金智达科技有限公司。
1.2 仪器与设备
DHG-9030A热风干燥箱,上海一恒科学仪器有限公司;捣碎机,上海申略仪器设备有限公司;80目晒网,国药集团化学试剂有限公司;ME204E分析天平,梅特勒-托利多有限公司;HH-3A恒温水浴锅,常州国华电器有限公司,SER158-3/6全自动脂肪测定仪,意大利VELP公司;电陶炉,艾诗凯奇电器有限公司;马弗炉,天津市泰斯特仪器有限公司;H1650-W离心机,湖南湘仪离心机有限公司;SKD-200凯氏定氮仪,上海沛欧分析仪器有限公司;真空浓缩干燥仪,Eppendorf Concentrator。
1.3 实验方法
1.3.1 大闸蟹下脚料基本成分测定
大闸蟹下脚料水分采用直接干燥法测量[10],灰分采用高温灼烧法测量[11],脂肪采用索氏提取法测量[12],蛋白质采用凯氏定氮法测量[13]。氨基酸组成测定采用酸水解蛋白质法,参考GB5009.124—2016《食品安全国家标准 食品中氨基酸的测定》。
1.3.2 酶法水解工艺流程
大闸蟹下脚料先在烘箱75 ℃下烘干约5 h至恒重。冷却后取出用破壁机粉碎,过80目筛制成原料粉末,加入缓冲液,再在一定温度和pH下加入一定量的蛋白酶进行水解。水解完成后100 ℃灭酶10 min,待冷却至室温后置于离心机中1 200 r/min离心10 min,过滤取上清液即获得蛋白水解液。水解液先在真空浓缩干燥仪中60 ℃浓缩4.5 h,最后在冷冻干燥机中-60 ℃干燥8~10 h得到水解蛋白粉。
1.3.3 蛋白酶活测定及筛选
1.3.3.1 酶活力测定
采用紫外分光光度法[14],蛋白酶在一定的温度与pH下,水解酪素底物,加入三氯乙酸终止酶反应,并沉淀未水解的酪蛋白,在275 nm下测定吸光度,根据标准曲线得出稀释液的酶活力。酶活计算如公式(1)所示:
(1)
式中:X,样品的酶活力,U/g;X′,由标准曲线得出的样品最终稀释液的酶活力,U/mL;V,溶解样品所使用的容量瓶的体积,mL;n,稀释倍数;m,样品的质量,g。
1.3.3.2 蛋白酶筛选
综合考虑选用了5种常见的酶:中性蛋白酶,碱性蛋白酶,木瓜蛋白酶,风味蛋白酶,木瓜蛋白酶。在每种酶相对适合的条件下对底物进行水解,每隔0.5 h检测水解度。5种酶的水解条件见表1。
表1 单酶筛选水解条件
Table 1 Hydrolysis conditions for single enzyme screening
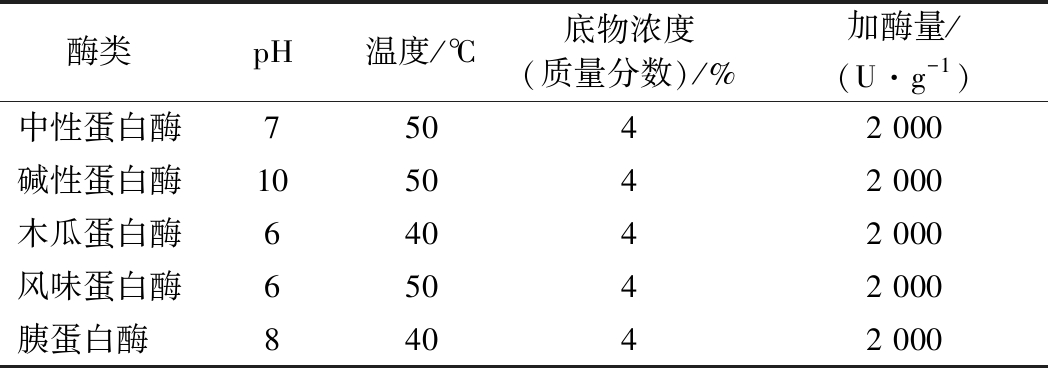
酶类pH温度/℃底物浓度(质量分数)/%加酶量/(U·g-1)中性蛋白酶75042 000碱性蛋白酶105042 000木瓜蛋白酶64042 000风味蛋白酶65042 000胰蛋白酶 84042 000
酶的水解度测定采取电位甲醛法[15],取样品处理液2.0 mL置于烧杯中,加20 mL水,开动磁力搅拌器,用0.05 mol/L NaOH标准溶液滴定至pH 8.2,加入5.0 mL中性甲醛溶液,摇匀,再用NaOH标准溶液继续滴定至pH 9.2,记录消耗NaOH标准溶液的体积;另取22 mL水先用NaOH溶液调至pH 8.2,再加入5.0 mL中性甲醛溶液,用NaOH标准溶液滴定至pH 9.2,作为试剂空白试验。氨基态氮按公式(2)进行计算:
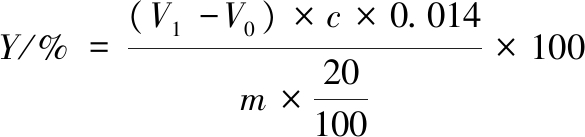
(2)
式中:Y,氨基态氮,g/100mL;V1,测定样品稀释液加入甲醛后消耗NaOH标准溶液的体积,mL;V0,测定空白加入甲醛后消耗NaOH标准溶液的体积,mL;c,NaOH标准溶液物质的量浓度,mol/L;m,样品质量或体积,g或mL。
水解度计算如公式(3)所示:
(3)
式中:DH,蛋白水解度,%;Y0,水解前溶液中的氨基态氮,g/100mL;Ym,原料中的总氮,g/100mL;Y1,水解液中氨基态氮,g/100mL。
1.3.4 单因素试验
采用不同温度(30、40、50、60、70 ℃),pH(7、8、9、10、11),料液比(6∶100、12∶100、18∶100、24∶100、30∶100,g∶mL),加酶量(1 000、1 250、1 500、1 750、2 000 U/g),研究这4种单因素对河蟹下脚料水解效果的影响。每0.5 h利用0.1 mol/L的盐酸以及氢氧化钠调节pH,3 h后测取水解度。
1.3.5 正交试验
在单因素实验的基础上,为了进一步提高水解度以及蛋白质回收率,以温度、pH、加酶量、时间等条件设计正交试验,以水解度为评价指标,筛选出最适合水解的条件组合。各因素水平见表2。
表2 正交设计因素水平表
Table 2 Factors and levels of orthogonal design
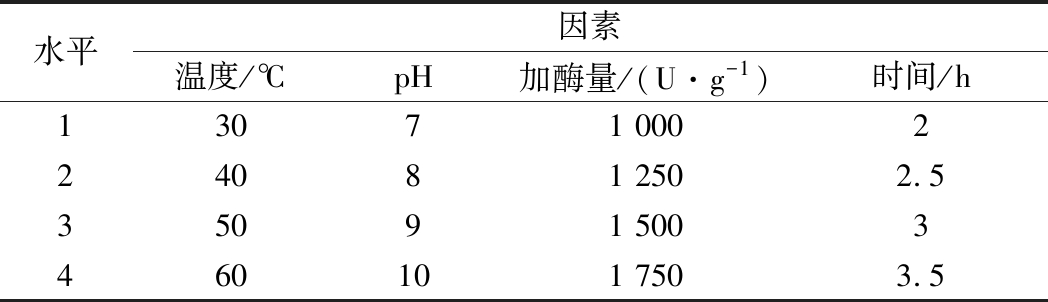
水平因素温度/℃pH加酶量/(U·g-1)时间/h13071 000224081 2502.535091 5003460101 7503.5
1.3.6 水解液氨基酸组成分析
将2 mL河蟹下脚料水解液过滤后放入水解管,然后加入1 mL 6 mol/L的HCl,并充氮3 min,拧紧水解管盖,放入120 ℃的烘箱中,水解22 h。将水解管样品全部转移到容量瓶中,加4.8 mL 10 mol/L的NaOH中和,用蒸馏水定容至25 mL,随后用双层滤纸过滤。取1 mL澄清滤液于1.5 mL离心管,在10 000 r/min下离心10 min。将滤液加入样品瓶,在全自动氨基酸检测仪中进行氨基酸检测[16]。
1.3.7 水解蛋白粉肽分布测定
参考GB/T 22492—2008 《大豆肽粉》对蛋白水解液进行肽分布测定。取10 mL水解液,加入少许流动相并超声10 min,用孔径0.45 μm有机相膜过滤,然后进行高效液相色谱检测。色谱柱:ACE 5 C18-300宽孔柱,4.6 mm×150 mm。流动相:4%~70%乙腈-0.1% 三氯乙酸体系,混合梯度洗脱120 min。
1.4 数据处理与统计学分析
实验设置3个平行样品,结合SPSS Statistics 17.0软件对得到的实验数据进行统计学分析,采用单因素方差分析(One-way ANOVA)DUNCAN检验进行显著性分析。
2 结果与分析
2.1 下脚料营养成分和氨基酸组成
由表3和表4可知,新鲜蟹脚蛋白质含量为5.54%(按干物质记占11.71%)、灰分为36.83%、脂肪仅为0.71%,蛋白质含量较高,而脂肪含量较低。共检测出17种氨基酸,其中包含7种必需氨基酸(占总量的34.58%)和4种鲜味氨基酸(占总量的41.68%)[17],且天冬氨酸、谷氨酸、丙氨酸含量均大于1 g/100g(表3)。蛋白质营养价值的评价一般是以氨基酸的组成和含量为依据,特别是8种必需氨基酸(色氨酸、苏氨酸、缬氨酸、甲硫氨酸、苯丙氨酸、异亮氨酸、亮氨酸、赖氨酸)含量的高低和构成比,而水产品的鲜度在一定程度上则取决于鲜味氨基酸的含量[18]。综上所述,蟹脚蛋白质氨基酸组成丰富,具有较高的营养价值,且味道鲜美,有极大的深加工利用价值。
表3 大闸蟹下脚料基本营养成分
Table 3 Basic nutrients in hairy crabs byproduct
水分灰分蛋白质脂肪含量/%41.65±0.6936.83±3.015.54±0.360.71±0.09
表4 大闸蟹下脚料水解氨基酸的组成和含量
Table 4 Composition and content of hydrolyzed amino acids in hairy crab byproduct
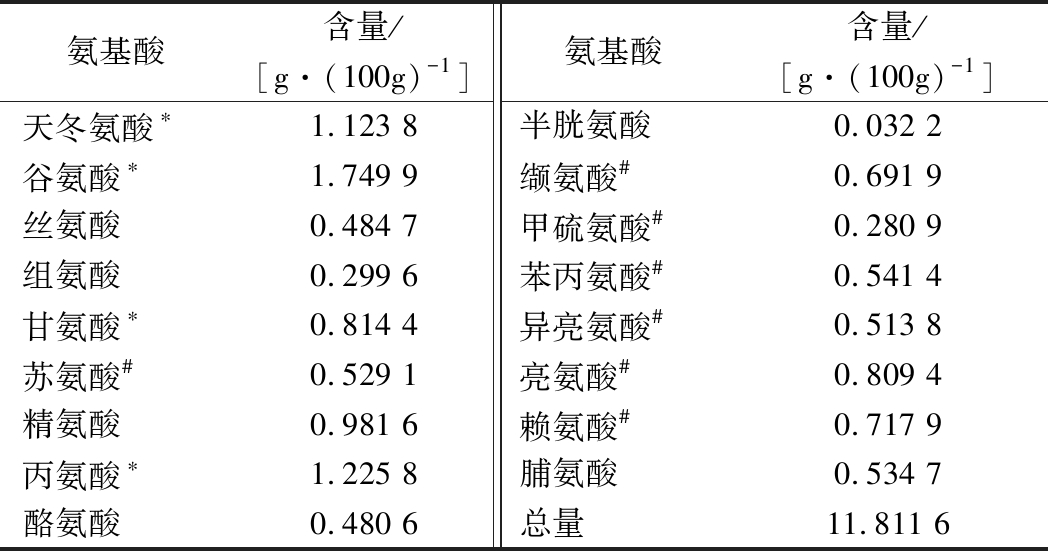
氨基酸含量/[g·(100g)-1]氨基酸含量/[g·(100g)-1]天冬氨酸∗1.123 8半胱氨酸0.032 2谷氨酸∗1.749 9缬氨酸#0.691 9丝氨酸0.484 7甲硫氨酸#0.280 9组氨酸0.299 6苯丙氨酸#0.541 4甘氨酸∗0.814 4异亮氨酸#0.513 8苏氨酸#0.529 1亮氨酸#0.809 4精氨酸0.981 6赖氨酸#0.717 9丙氨酸∗1.225 8脯氨酸0.534 7酪氨酸0.480 6总量11.811 6
注:*为鲜味氨基酸;#为人体必需氨基酸
2.2 蛋白酶活测定及筛选结果
5种酶活力测定结果如表5所示。
表5 酶活力测定结果
Table 5 Enzyme activity determination

组别标注酶活/(104 U·g-1)实测酶活/(104 U·g-1)风味蛋白酶31.19±0.32中性蛋白酶54.12±0.21胰蛋白酶 54.03±0.54碱性蛋白酶2015.23±0.76木瓜蛋白酶8067.21±0.46
由图1可知,5种酶的水解能力依次为:碱性蛋白酶>中性蛋白酶>风味蛋白酶>胰蛋白酶>木瓜蛋白酶。碱性蛋白酶和中性蛋白酶对本实验大闸蟹下脚料粉末具有较强水解能力。由于特定的酶拥有特定的酶切位点,对同一种底物来说,酶切位点越多,其表现的水解效果就越好。碱性蛋白酶,由于活性中心含有丝氨酸,故又称丝氨酸蛋白酶,是一种最适pH为碱性的蛋白酶,其水解时,要求在水解点羧基侧具有芳香族或疏水性氨基酸(如酪氨酸、苯丙氨酸、丙氨酸等),而特定的金属离子如Mn2+、Mg2+、Zn2+、Co2+、Fe2+等可以显著提高碱性蛋白酶的活性。碱性蛋白酶的水解产物疏水氨基酸大多位于肽链末端,因此可以缓解由疏水氨基酸产生的苦味,改善蛋白粉风味[19]。
此外,酶催化反应速率在1 h时最大,而后逐渐减缓,在第3 h后达到稳定。这主要是由于随着反应时间的延长,蛋白酶底物浓度逐渐降低,中间和最终产物逐渐增加,从而抑制蛋白酶的活性。而反应过程中环境条件如pH和金属离子的变化亦可以改变蛋白酶的酶解速率。

图1 不同蛋白酶水解能力
Fig.1 Hydrolytic capacity of different proteases
2.3 酶解单因素试验结果
由图2可知,随着pH值的升高,样品水解度先逐渐升高,在pH=8时水解度达到最大,随后逐渐下降,最终在pH=10和pH=11时趋于稳定。这是由于在不同环境下,蛋白酶及其底物的解离程度不同。pH值过高或过低均会导致蛋白酶构象发生改变,从而抑制蛋白酶的活性,降低水解度。随着温度的升高,样品水解度同样逐渐升高,在50 ℃达到最高值,随后急剧下降。这是因为提高温度可以增加水解反应的速率,提高蛋白酶的活性[20],但由于蛋白酶本身也是蛋白质,过高的温度会导致蛋白质变性,使蛋白酶构象发生不可逆改变,进而使其永久性失活。随着料液比的增大,样品水解度先逐渐升高,而后逐渐减小。这是因为在加酶量一定的情况下,过高的料液比会导致底物无法全部溶于溶剂中,造成底物分布不均匀,而过低的料液比虽然可以将底物充分均匀地分布于液相体系中,但底物浓度低,不能占据蛋白酶全部活性中心,导致反应效率下降。同时,在加酶量不超过1 500 U/g时,随着加酶量的增加,样品水解度逐步上升,但当加酶量超过1 500 U/g时,水解度逐渐趋于平缓,不再随加酶量的升高而升高。这主要是因为当加酶量较少时,过量的底物能够占据酶的全部活性中心[21],水解速率主要由酶的数量控制,因此水解度随加酶量增加而升高,而当加酶量超过一定限制时,底物不再过量,不能占据所有酶的活性中心,水解速率主要由底物的浓度控制,因此水解度不随加酶量的变化而变化。因此,pH=8,酶解温度50 ℃,料液比18∶100(g∶mL),加酶量1 500 U/g是碱性蛋白酶最佳水解条件。

a-pH-水解度关系曲线;b-温度-水解度关系曲线;c-料液比-水解度关系曲线;d-加酶量-水解度关系曲线
图2 单酶水解条件对水解度影响
Fig.2 Effect of single enzyme hydrolysis conditions on hydrolysis degree
2.4 正交实验结果
以水解度为评价指标,采用L16(44)进行正交试验,实验结果见表6。根据正交试验的结果,最适合酶解的条件为9号实验条件,即温度50 ℃,pH为7,加酶量1 500 U/g,时间3.5 h。对于酶解条件来说,温度是首要影响因素,50 ℃的环境非常适合酶进行水解。同时,pH为7的中性环境液更适合酶进行水解,若pH过于高,酶会因此而失活。在加酶量为1 500 U/g时,反应3.5 h,底物能与酶活性中心充分接触,水解反应达到最佳。所以,本实验确定的最适合酶反应的条件为:温度50 ℃,pH=7,料液比18∶100(g∶mL),加酶量1 500 U/g,时间3.5 h,此时的水解度为33%。
表6 酶解正交实验表
Table 6 Orthogonal experiment of enzymatic hydrolysis
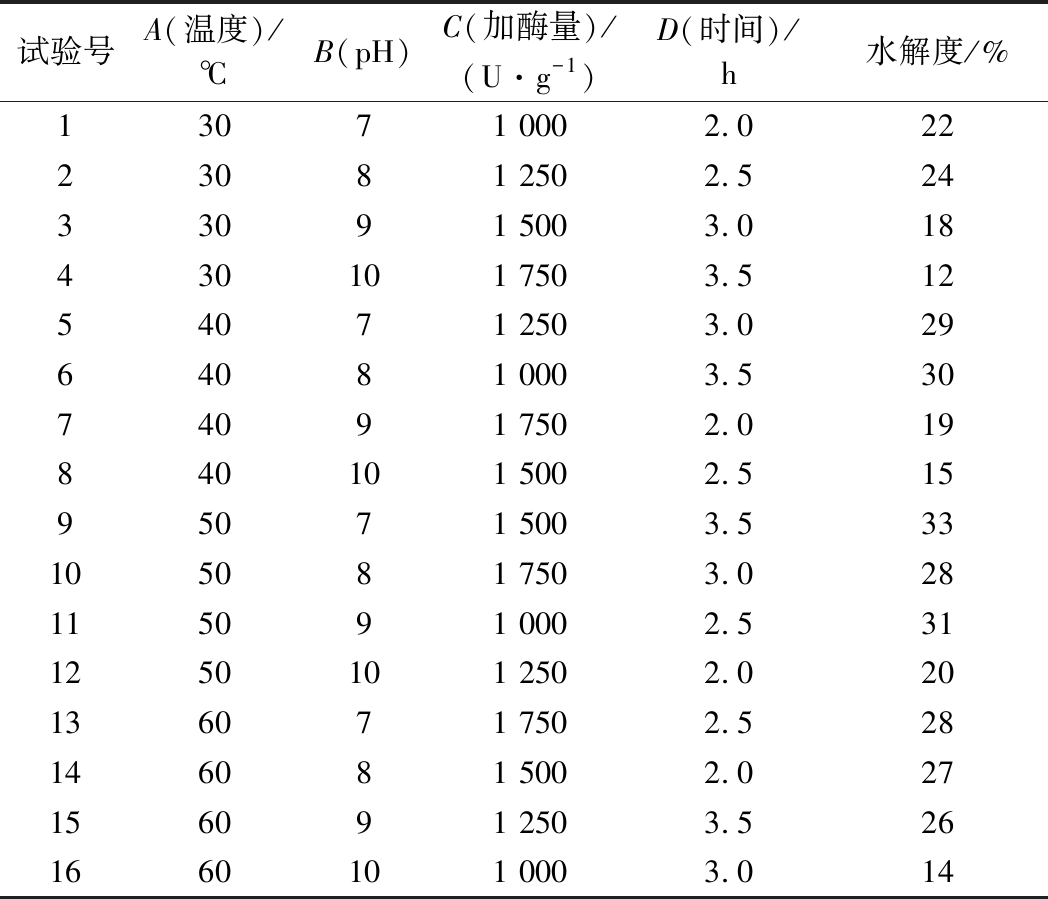
试验号A(温度)/℃B(pH)C(加酶量)/(U·g-1)D(时间)/h水解度/%13071 0002.02223081 2502.52433091 5003.018430101 7503.51254071 2503.02964081 0003.53074091 7502.019840101 5002.51595071 5003.533105081 7503.028115091 0002.5311250101 2502.020136071 7502.528146081 5002.027156091 2503.5261660101 0003.014
2.5 水解氨基酸组成
酶解液中共检测出17种氨基酸(表7),其中脯氨酸、谷氨酸、甘氨酸、丙氨酸是大闸蟹下脚料酶解液主要的氨基酸成分。必需氨基酸占氨基酸总量的58.85%,谷氨酸、丙氨酸等呈味氨基酸占39.12%,赋予蛋白粉浓郁的河蟹香味。
表7 氨基酸组成
Table 7 Amino acid composition
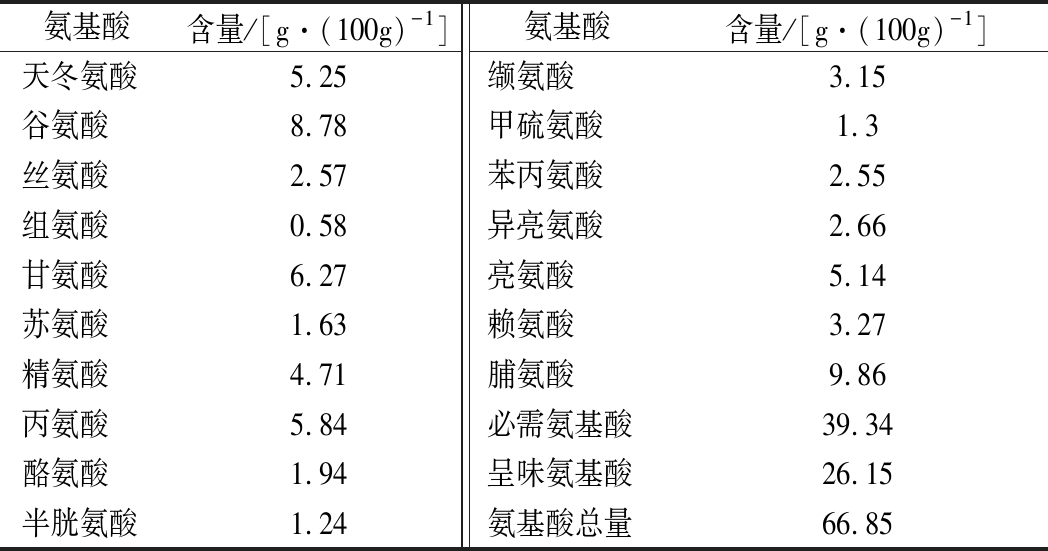
氨基酸含量/[g·(100g)-1]氨基酸含量/[g·(100g)-1]天冬氨酸5.25缬氨酸3.15谷氨酸8.78甲硫氨酸1.3丝氨酸2.57苯丙氨酸2.55组氨酸0.58异亮氨酸2.66甘氨酸6.27亮氨酸5.14苏氨酸1.63赖氨酸3.27精氨酸4.71脯氨酸9.86丙氨酸5.84必需氨基酸39.34酪氨酸1.94呈味氨基酸26.15半胱氨酸1.24氨基酸总量66.85
2.6 水解蛋白粉肽分布
由表8可知,在利用碱性蛋白酶在适宜酶解条件下酶解后,样品中分子质量<1 000 Da的肽段占89.61%,即酶解液中富含大量短肽分子。相比与大分子蛋白质,短肽分子具有溶解性高、黏度低、热稳定性好、吸收快、吸收利用率高等特点[22],对高血压、高血脂以及血栓的形成具有一定预防作用,同时还具有改善脂质代谢,提高免疫力等功能[23],对于营养吸收困难者或在短时间内急需大量氮源的运动人群具有重要意义[24]。
表8 肽分子质量分布
Table 8 Molecular weight distribution of peptides
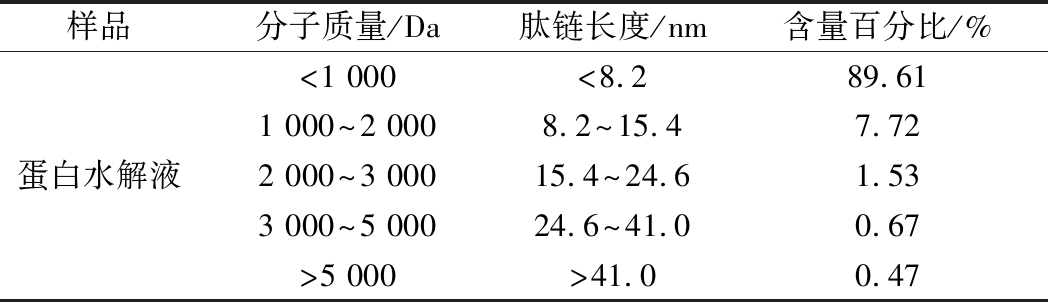
样品分子质量/Da肽链长度/nm含量百分比/%蛋白水解液<1 000<8.289.611 000~2 0008.2~15.47.722 000~3 00015.4~24.61.533 000~5 00024.6~41.00.67>5 000>41.00.47
3 结论
大闸蟹蛋白粉末的最佳水解酶为碱性蛋白酶,最适水解条件为pH 7,水解温度50 ℃,料液比18∶100(g∶mL),加酶量为1 500 U/g。水解得到的蛋白粉鲜味足、苦味低,完美保留大闸蟹特有的风味。同时蛋白粉氨基酸组成丰富,含量高达66.85 g/100g,分子质量小于1 000 Da的肽段占89.61%,8种必需氨基酸种类齐全,富含谷氨酸、丙氨酸等呈味氨基酸,总量为26.15 g/100g,占氨基酸总量的39.12%。这赋予了水解蛋白粉河蟹香味和较高的营养价值,并且能够加强对大闸蟹下脚料资源的回收利用,避免对环境的污染和浪费。
[1] CHENG H F, WU H R, LIANG F, et al.Comparison of the nutritional quality of three edible tissues from precocious and normal adult female chinese mitten crabs(Eriocheir sinensis)[J].Journal of Aquatic Food Product Technology, 2021, 30(1):49-61.
[2] WU H R, GE M T, ZHOU X H, et al.Nutritional qualities of normal and precocious adult male Chinese mitten crabs (Eriocheir sinensis)[J].Aquaculture Research, 2019, 50(8):2 267-2 275.
[3] 王枫雅, 林琳, 陆剑锋, 等.性早熟蟹蟹油与四种食用油组成和理化性质比较[J].食品与发酵工业, 2019, 45(10):225-232;240.
WANG F Y, LIN L, LU J F, et al.Comparison of physicochemical properties and compositions between oil of precocious crab and four kinds of edible oils[J].Food and Fermentation Industries, 2019, 45(10):225-232;240.
[4] 田孜敬, 朱亚军, 姜绍通, 等.微波干燥法加工性早熟蟹肉松的工艺条件研究[J].肉类工业, 2020(7):23-29.
TIAN Z J, ZHU Y J, JIANG S T, et al.Study on technological conditions of crab floss with precocious puberty processed by microwave drying[J].Meat Industry, 2020(7):23-29.
[5] 余辉, 陈小娥, 曾茂茂, 等 细点圆趾蟹含肉下脚料酶解物中抗氧化肽的分离与鉴定[J].中国食品学报, 2020, 20(9):241-247.
YU H, CHEN X E, ZENG M M, et al.Isolation and identification of antioxidant peptides derived from ovalipes punctatus waste containing meat scraps[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(9):241-247.
[6] 戴红君, 孙艺伟, 任妮, 等.我国中华绒螯蟹产业现状调查及发展对策分析[J].江苏农业科学, 2021, 49(18):248-252.
DAI H J, SUN Y W, REN N, et al.Investigation of Chinese hairy crab industry and analysis of development strategies[J].Jiangsu Agricultural Sciences, 2021, 49(18):248-252.
[7] 吴浩然, 林琳, 程华峰, 等.河蟹分割加工边角料的营养成分分析及品质评价[J].肉类工业, 2019(6):31-36;57.
WU H R, LIN L, CHENG H F, et al.The quality evaluation and analysis of the nutritional components in mitten crab scrap in segmentation processing[J].Meat Industry, 2019(6):31-36;57.
[8] XIE Q S, LIU Y R.Study on the nutritional quality of ecologically bred Chinese mitten crabs with different body weights[J].Aquaculture Research, 2020, 51(7):2 948-2 961.
[9] ZOU Y, ROBBENS J, HEYNDRICKX M, et al.Bioprocessing of marine crustacean side-streams into bioactives:A review[J].Journal of Chemical Technology & Biotechnology, 2021, 96(6):1 465-1 474.
[10] GU S Q, WANG X C, TAO N P, et al.Characterization of volatile compounds in different edible parts of steamed Chinese mitten crab (Eriocheir sinensis)[J].Food Research International, 2013, 54(1):81-92.
[11] LUO Z, LI X D, WANG W M, et al.Partial replacement of fish meal by a mixture of soybean meal and rapeseed meal in practical diets for juvenile Chinese mitten crab Eriocheir sinensis:Effects on growth performance and in vivo digestibility[J].Aquaculture Research, 2011, 42(11):1 615-1 622.
[12] 卜俊芝,徐迅,严利强.三疣梭子蟹脂肪提取工艺及其组成分析[J]〗食品工业科技,2020,41(13):72-78;84.
BU J Z, XU X, YAN L Q. Extraction technology and composition analysis of fat from Portunus trituberculatus[J]. Science and Technology of Food Industry, 2020,41(13):72-78;84.
[13] 崔爱秀, 张其标, 翁武银.亚临界水温度对梭子蟹下脚料萃取物性质的影响[J].食品工业科技, 2018, 39(13):234-237;286.
CUI A X, ZHANG Q B, WENG W Y.Effect of subcritical water temperature on properties of extracts from swimming crab waste[J].Science and Technology of Food Industry, 2018, 39(13):234-237;286.
[14] XIA H, GAO F, NI Z Y, et al.Analysis of antioxidant enzyme activity involved in ascorbate-glutathione cycle in green-flesh kiwifruits[J].IOP Conference Series:Materials Science and Engineering, 2018, 392:052016.
[15] 左继红, 刘丽丽, 崔政伟.微波辐射-蛋白酶耦合循环催化蛋白质反应器及工艺[J].食品工业, 2019, 40(5):41-45.
ZUO J H, LIU L L, CUI Z W.Microwave radiation protease coupled cycle catalytic protein reactor and process[J].The Food Industry, 2019, 40(5):41-45.
[16] 张高静, 韩丽萍, 孙剑锋, 等.南美白对虾营养成分分析与评价[J].中国食品学报, 2013, 13(8):254-260.
ZHANG G J, HAN L P, SUN J F, et al.Analysis and evaluation of nutritive composition in Penaeus vannamei[J].Journal of Chinese Institute of Food Science and Technology, 2013, 13(8):254-260.
[17] 陈晓婷, 林瑜, 路海霞, 等.4种石斑鱼肌肉中营养成分分析与评价[J].渔业研究, 2020, 42(5):463-472.
CHEN X T, LIN Y, LU H X, et al.Analysis and evaluation of nutritional components in the muscle of four grouper species[J].Journal of Fisheries Research, 2020, 42(5):463-472.
[18] WANG S H, LUO L, ZHANG R, et al.Comparison of edible yield and quality of female Chinese mitten crab between two-year-old and three-year-old[J].Journal of Food Composition and Analysis, 2022, 112:104678.
[19] 袁媛, 王蕾, 石亚伟.微生物来源碱性蛋白酶活性提高策略的研究进展[J].生物技术通报, 2021, 37(5):231-236.
YUAN Y, WANG L, SHI Y W.Research advances in strategies for improving the activity of microbial-derived alkaline proteases[J].Biotechnology Bulletin, 2021, 37(5):231-236.
[20] WANASUNDARA P K J P D, AMAROWICZ R, PEGG R B, et al.Preparation and characterization of hydrolyzed proteins from defibrinated bovine plasma[J].Journal of Food Science, 2002, 67(2):623-630.
[21] DUAN Z H, WANG J L, YI M H, et al.Recovery of proteins from silver carp by-products with enzymatic hydrolysis and reduction of bitterness in hydrolysate[J].Journal of Food Process Engineering, 2010, 33(5):962-978.
[22] 朱瀛, 赵改名, 柳艳霞, 等.中性蛋白酶水解鸡骨泥制备短肽工艺优化[J].农业工程学报, 2016, 32(12):309-314.
ZHU Y, ZHAO G M, LIU Y X, et al.Optimization of enzymatic hydrolysis of chicken bone protein for production of antioxidant peptides using nutrase[J].Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(12):309-314.
[23] LI T N, ZHANG X R, REN Y Y, et al.Antihypertensive effect of soybean bioactive peptides:A review[J].Current Opinion in Pharmacology, 2022, 62:74-81.
[24] FU Z R, AKULA S, THORPE M, et al.Marked difference in efficiency of the digestive enzymes pepsin, trypsin, chymotrypsin, and pancreatic elastase to cleave tightly folded proteins[J].Biological Chemistry, 2021, 402(7):861-867.