热加工是常见的食物加工方式,不同的热加工处理可能导致食物中蛋白质、多糖等化学成分发生显著变化,如蛋白质变性、多糖降解等,改变蛋白质及多糖的结构,从而影响其消化吸收[1]。水产品常见的热加工方式主要包括蒸制、油炸、烤制和煮制等,相关研究表明,不同热加工对水产品营养物质的变化损失、消化吸收和生物可利用性影响显著[2-3]。煮制热加工可使食物中可溶性糖浸出于汤汁中,导致其含量显著降低[4]。生鲜牡蛎经过蒸制和烤制热加工后,蛋白质的体外消化率均显著提高,营养价值得到改善[5]。蒸制热加工后鲟鱼蛋白消化特性增强,而烤制与油炸热加工降低其消化特性[6]。由此可见,热加工方式对不同类型水产品中蛋白、多糖营养物质变化和吸收利用有重要影响,其影响效果与热加工方式密切相关。
华贵栉孔扇贝(Chlamys nobilis, C.nobilis)是一种暖水性海洋经济贝类,主要分布于我国南海和东部沿海[7],富含蛋白质、必需氨基酸、多糖及硒等营养物质,营养价值高[8]。据统计[9],2020年全国扇贝海水养殖产量高于174万t,其中广东扇贝海水养殖产量约为11万t,而华贵栉孔扇贝是我国南方海域扇贝养殖中的重要品种,产量巨大。在日常饮食中,华贵栉孔扇贝主要通过烹饪加工后食用,不同的热加工处理使食物的蛋白、多糖消化吸收受到不同程度影响[10]。目前关于热加工处理对华贵栉孔扇贝蛋白与多糖结构及消化特性的影响鲜有研究报道,因此本研究采用蒸制、油炸及烤制3种常见热加工方式对华贵栉孔扇贝进行处理,研究分析不同热加工处理对华贵栉孔扇贝蛋白与多糖结构及消化特性的影响,以期为华贵栉孔扇贝的合理加工处理提供理论依据。
1 材料与方法
1.1 材料与试剂
华贵栉孔扇贝,购于广东湛江霞山水产品批发市场,采集于11月,其质量为(30.51±0.23) g,壳长为(69.42±0.80) mm,壳高为(63.91±1.42) mm。
氯化钠、硫酸铵、盐酸、硫酸、三氯甲烷、溴化钾,广州化学试剂厂;氯化钡、氢氧化钠、正丁醇,西陇科学股份有限公司;无水乙醇,广州光华科技股份有限公司;人工胃液、人工肠液,上海源叶生物科技有限公司;苯酚,上海阿拉丁生化科技股份有限公司;试剂均为分析纯。
1.2 仪器与设备
LEJ-18型真空冷冻干燥机,日本EYELA公司;PS-40A超声清洗机,济南鑫贝西生物技术有限公司;BRUKER TENSOR27傅里叶红外光谱仪,德国Bruker公司;N-1300真空旋转蒸发仪,上海爱朗仪器有限公司;SHY-2数显水浴恒温振荡器,常州普天仪器制造有限公司;UV2550紫外分光光度计,日本岛津公司;Sigma 300场发射扫描电镜,英国Zeiss公司;差示扫描量热仪(differential scanning calorimetry,DSC),南京大展检测仪器有限公司。
1.3 实验方法
1.3.1 扇贝前处理及热加工
将新鲜扇贝开壳取肉,清洗表面杂质污泥,去除内脏团并擦干水分,随机分成4组,其中3组分别进行蒸制、油炸及烤制热加工处理,1组为生鲜样作为对照。
蒸制处理:水加热至沸腾,扇贝装入器皿中置于蒸架上蒸5 min,移出备用;油炸处理:可控温炸锅中油温升至(150±2) ℃,稳定后放入扇贝炸2 min,沥干表面油分,移出备用;烤制处理:调节烤箱上、下火档为200 ℃,置于烤盘中烤制10 min,取出冷却备用。将生鲜及热加工处理后的扇贝匀浆,低温冷冻干燥,粉碎抽真空,于-20 ℃冻藏备用。
1.3.2 扇贝蛋白的提取
称取约5 g扇贝粉,加入125 mL超纯水,4 ℃振荡提取4 h,8 500 r/min离心15 min,取上清液,残渣重复上述操作1次,合并上清液,加入(NH4)2SO4至饱和,4 ℃静置10 h,离心收集沉淀,用少量超纯水溶解、透析(MWCO 3.5 kDa),直至饱和BaCl2溶液检验反应呈阴性,收集透析袋内的蛋白溶液,所得蛋白溶液冷冻干燥,即为水溶性蛋白。
在提取的残渣中加入0.5 mol/L NaCl溶液,4 ℃下振荡提取4 h,8 500 r/min离心15 min,取上清液,残渣重复上述操作1次,合并上清液,加入(NH4)2SO4至饱和,4 ℃静置10 h,离心收集沉淀,用0.5 mol/L NaCl溶液溶解、透析(MWCO 3.5 kDa),收集透析袋内的蛋白溶液,所得蛋白溶液冷冻干燥,即为盐溶性蛋白。
1.3.3 扇贝多糖的提取
参考金路等[11]的方法,并略有改动。称取约6 g扇贝粉,加入超纯水240 mL,40 ℃水浴浸提3 h,8 000 r/min 离心15 min,收集上清液,残渣重复上述操作1次,合并上清液。上清液旋蒸浓缩,可得多糖浓缩液,按4∶1体积比采用sevag法[V(氯仿)∶V(正丁醇)=4∶1]除蛋白,加入4倍体积无水乙醇醇沉,4 ℃ 静置10 h,离心收集沉淀,沉淀用超纯水溶解,冷冻干燥即为水溶性多糖。
在提取的残渣中加入120 mL 1%(质量分数)NaOH溶液,室温水浴振荡2 h,8 000 r/min离心15 min,收集上清液,残渣重复上述操作1次,合并上清液。于上清液中加HCl,使溶液呈中性,旋蒸浓缩,可得多糖浓缩液,按4∶1体积比采用sevag法除蛋白,加入4倍体积无水乙醇醇沉,4 ℃静置10 h,离心收集沉淀,沉淀用超纯水复溶,冷冻干燥后即为碱溶性多糖。
1.3.4 蛋白质含量测定
采用考马斯亮蓝G-250染色法测定蛋白质含量。
1.3.5 多糖含量测定
采用苯酚-硫酸法测多糖含量。
1.3.6 傅里叶红外光谱(Fourier transform infrared spectroscopy, FTIR)分析
采用溴化钾压片法,取约0.2 mg冷冻干燥后的蛋白、多糖样品与2 mg烘干后的溴化钾混合研磨,压成薄片,压片后在4 000~400 cm-1内扫描,并用OPUS软件对所得红外光谱图进行分析。
1.3.7 热特性分析
称取约5 mg冷冻干燥后的多糖样品放入氧化铝坩埚中,同时放入一个空坩埚作为空白对照,10 ℃/min的升温速率,在20~400 ℃内对样品进行差式扫描量热法分析。
1.3.8 微观结构分析
称取少量冷冻干燥后的样品均匀涂布于导电胶上,在10 mA电流下喷金后放置于扫描电镜样品室中,并在5 kV加速电压下对样品进行扫描分析。
1.3.9 体外消化特性分析
参考WU等[12]的方法测定华贵栉孔扇贝中多糖与蛋白质的体外消化率,并略有改动。
体外模拟胃消化:称取0.2 g样品以质量比1∶100加入人工胃液于50 mL离心管中,37 ℃恒温水浴以100 r/min振荡2 h,消化后样品置于冰浴中10 min灭酶,以4 000 r/min离心10 min,取上清液,于-20 ℃贮存,测样品中蛋白和多糖含量;
体外模拟肠消化:基于胃消化样品的条件上,用1% NaOH溶液调节消化液pH至7.0~7.5,添加5 mL人工肠液,混匀,37 ℃恒温水浴以100 r/min振荡4 h,置于冰浴中10 min灭酶,4 000 r/min离心10 min,取上清液,于-20 ℃贮存,测样品中蛋白和多糖含量。体外消化率计算如公式(1)所示:
体外消化率![]()
(1)
式中:W胃肠消化组分,胃肠消化组分多糖或蛋白质含量,mg/g;W样品组分,样品中多糖或蛋白质含量,mg/g。
1.3.10 数据处理
使用SPSS 21.0进行数据方差分析(One way ANOVA)和均值比较(Duncan多重比较法),以P<0.05作为显著性差异标准,采用Graphpad 8.0和Origin 2019作图,所有实验均平行重复3次。
2 结果与分析
2.1 不同热加工处理对扇贝蛋白含量的影响
扇贝经过不同热加工处理后,分级提取水溶性蛋白及盐溶性蛋白,测定热加工后蛋白含量变化如图1所示。与生鲜组相比,不同热加工处理后水溶性和盐溶性蛋白含量均显著减少(P<0.05)。其中,相对于水溶性蛋白,经蒸制、油炸及烤制热加工后蛋白含量分别降低49.69%、34.01%和50.36%;相对于盐溶性蛋白,热加工后蛋白含量均显著降低(P<0.05),可能是由于在热加工过程中蛋白发生不同程度热变性,疏水基团暴露,使其溶解度降低[13],此外,部分蛋白质也会随汁液流失或溶于加工介质中导致其损失[1]。
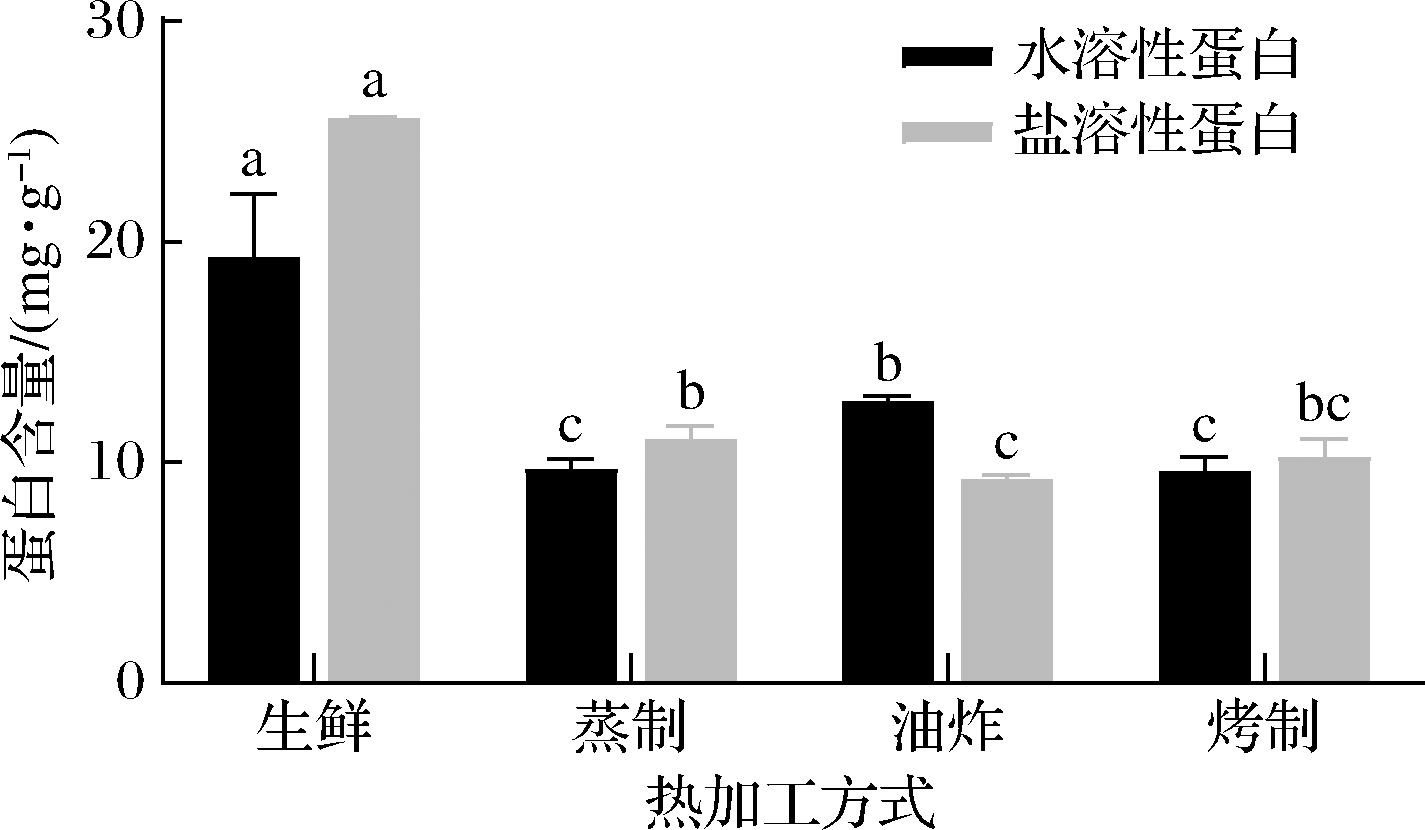
图1 不同热加工处理对华贵栉孔扇贝蛋白含量的影响
Fig.1 Effects of different thermal processing on the protein content of C.nobilis
注:不同字母表示同一类别组间具有显著差异(P<0.05)(下同)
2.2 不同热加工处理对扇贝多糖含量的影响
扇贝经过不同热加工处理后,分级提取水溶性多糖及碱溶性多糖,测定热加工处理后多糖含量变化如图2所示。由图2可知,生鲜扇贝水溶性多糖含量为(11.47±0.17) mg/g(以干基计,下同),其含量高于碱溶性多糖,可见扇贝中多糖以水溶性多糖为主体。热加工处理引起水溶性多糖及碱溶性多糖含量的显著变化(P<0.05),经蒸制、油炸热加工后水溶性多糖含量相较于生鲜组显著减少,分别下降21.07%和39.28%,烤制热加工后水溶性多糖含量增加23.27%,在烤制过程中可能与美拉德反应有关,使其含量有所增加,更易于提取[14];经不同热加工处理后碱溶性多糖含量显著增加(P<0.05),分别增加14.4%、22.44%和60.13%。可能是因为在热加工处理过程中由于温度升高促进分子的热运动性,从而使多糖的溶解度发生变化[15]。
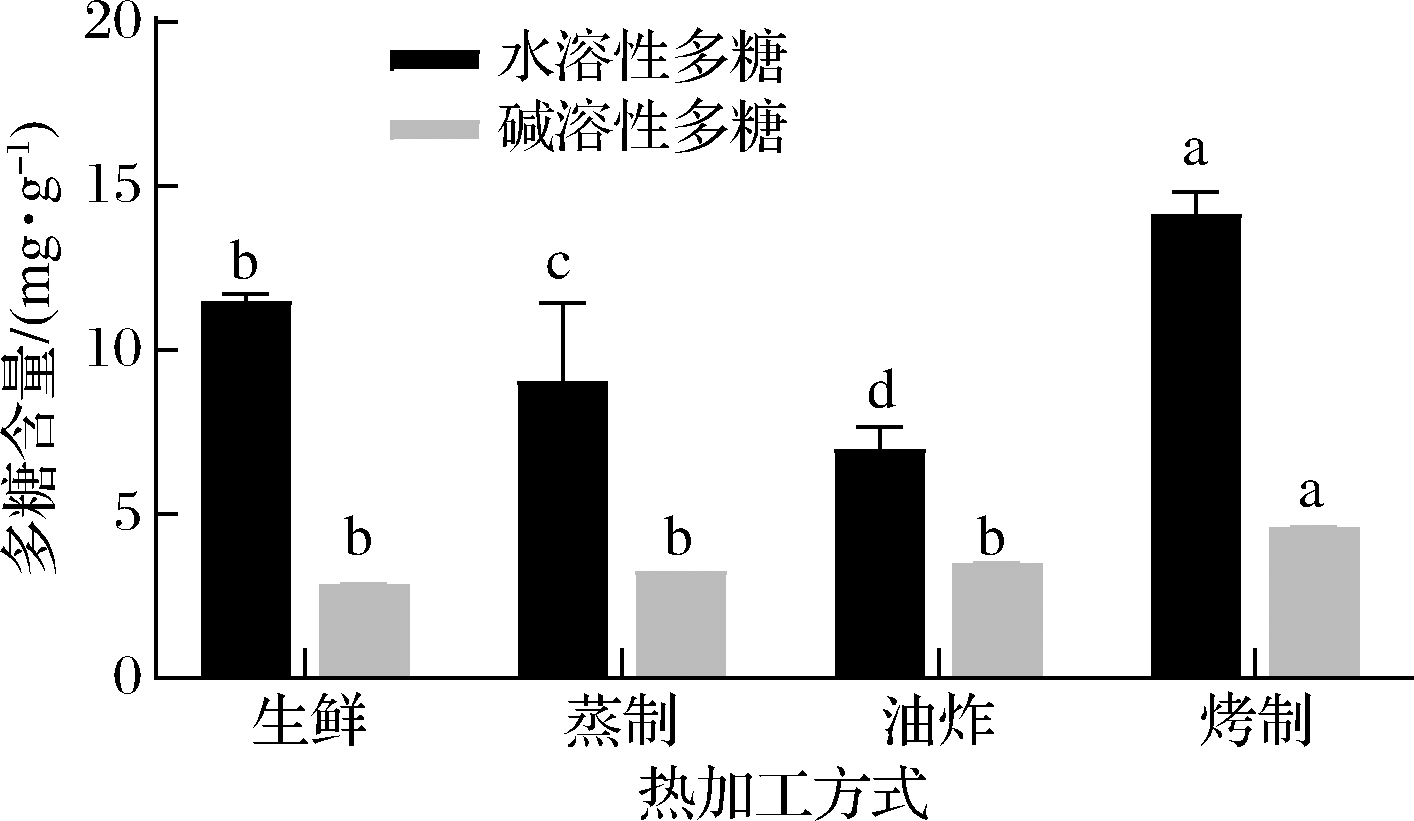
图2 不同热加工处理对华贵栉孔多糖含量的影响
Fig.2 Effects of different thermal processing on the polysaccharide content of C.nobilis
2.3 热加工处理前后扇贝蛋白的构象变化
红外光谱可扫描鉴定蛋白质中的特征官能团,分析热加工对蛋白质结构产生的影响,结果如图3所示。生鲜扇贝经蒸制、油炸及烤制热加工处理后其蛋白结构发生变化,水溶性及盐溶性蛋白在酰胺I带的振动区域(1 700~1 600 cm-1)内吸收峰均位于1 661 cm-1处,由C![]() O伸缩振动引起,热加工处理后其吸收峰发生红移;酰胺Ⅱ带的振动区域(1 600~1 500 cm-1)内吸收峰均位于1 536 cm-1处,由N—H面内弯曲振动及C—N伸缩振动引起,热加工后水溶
O伸缩振动引起,热加工处理后其吸收峰发生红移;酰胺Ⅱ带的振动区域(1 600~1 500 cm-1)内吸收峰均位于1 536 cm-1处,由N—H面内弯曲振动及C—N伸缩振动引起,热加工后水溶
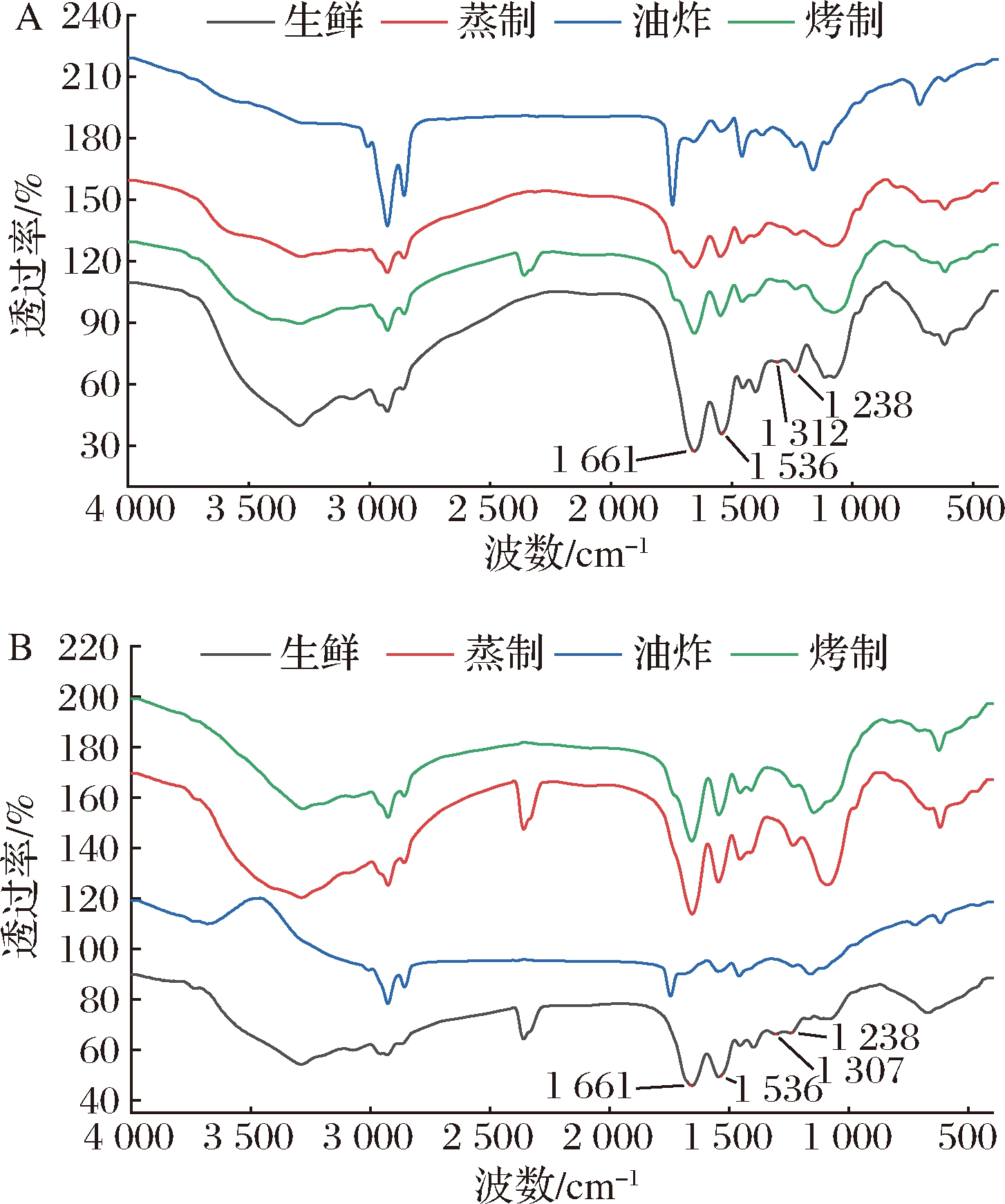
A-水溶性蛋白;B-盐溶性蛋白
图3 热加工处理前后蛋白红外光谱
Fig.3 Infrared spectra of protein before and after thermal processing
性蛋白吸收峰强度减弱;酰胺Ⅲ带(1 330~1 220 cm-1)分别位于1 312 cm-1及1 238 cm-1、1 307 cm-1及1 238 cm-1处,主要由同相N—H弯曲振动及C—N伸缩振动引起[16],热加工处理后各特征吸收峰强度均显著降低。其中蛋白质的酰胺I带是其结构的特有峰形[17],对主要由氢键维持的二级结构敏感,因此常用于分析蛋白质的二级结构[18]。
图4为生鲜扇贝水溶性蛋白和盐溶性蛋白经过傅里叶去卷积处理,二阶导数及Peakfit曲线拟合的酰胺I带图谱,结合表1可发现,扇贝水溶性蛋白二级结构主要以β-转角为主,占43.29%,其次是β-折叠及α-螺旋,没有无规卷曲结构。蒸制、油炸及烤制热加工后β-转角质量分数降低,分别降至40.38%、29.11%及34.48%,β-折叠质量分数增加,表明在热加工过程中水溶性蛋白的二级结构发生变化,由β-转角结构向β-折叠结构转变,β-折叠结构存在于蛋白聚集体内部中,热加工可能使水溶性蛋白产生聚集体,β-折叠质量分数增加与其形成有关[19];扇贝盐溶性蛋白二级结构主要以β-折叠为主,质量分数为37.24 %,热加工对扇贝中盐溶性蛋白二级结构的变化中,蒸制组和烤制组各结构的质量分数与生鲜组基本相似,而油炸组中β-转角质量分数显著增加至48.76%,说明在油炸热加工过程中α-螺旋和β-折叠结构向β-转角结构转变,蒸制和烤制热加工可能破坏盐溶性蛋白中的氢键,使蛋白质分子去折叠展开,α-螺旋和β-折叠质量分数减少。相关研究报道,蛋白形成的热聚集体分子间的β-折叠易转变为β-转角结构,从而使β-转角结构增加[19]。
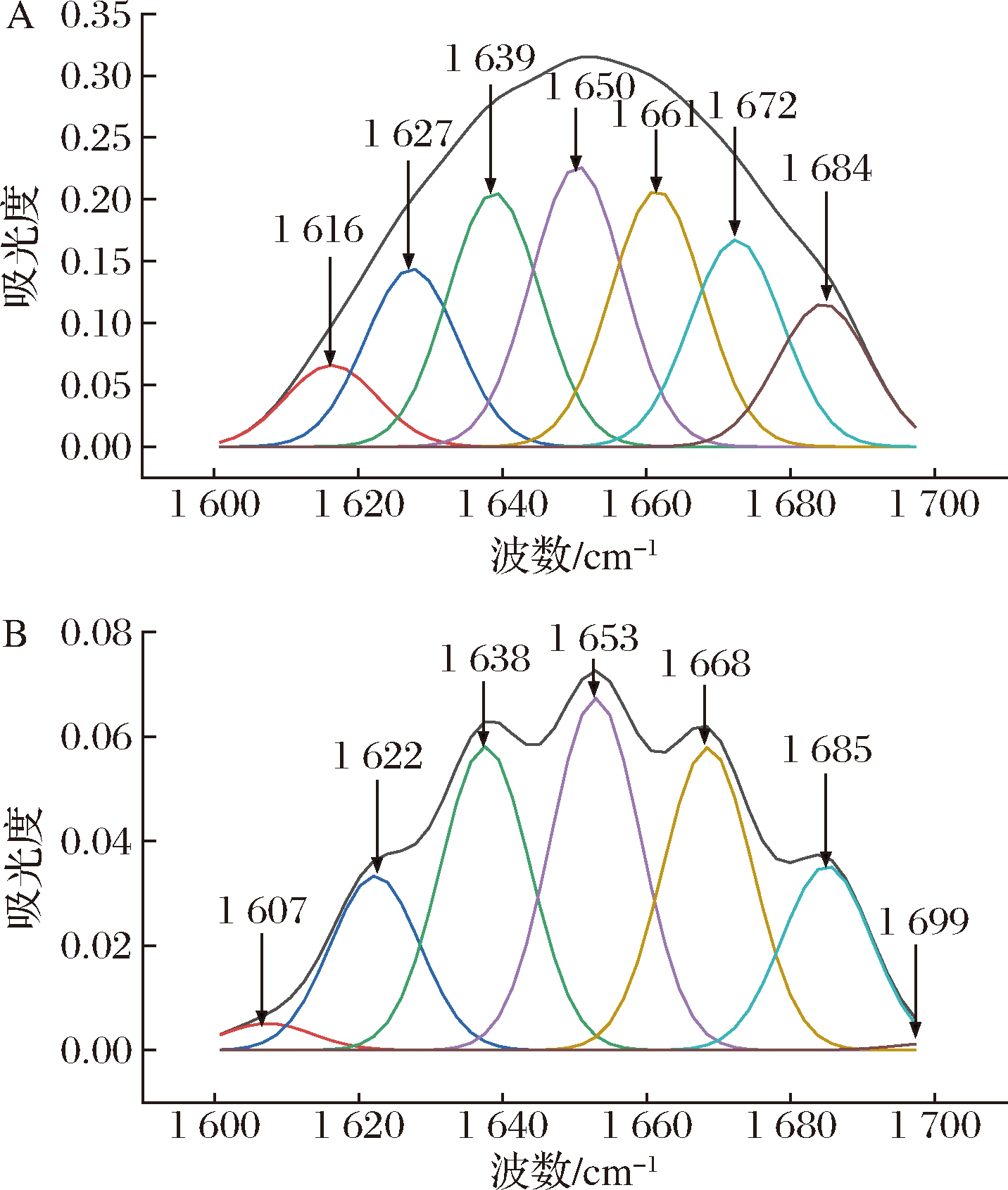
A-生鲜状态水溶性蛋白;B-生鲜状态盐溶性蛋白
图4 生鲜状态蛋白酰胺I带拟合曲线
Fig.4 I-band curve fitting of fresh protein amide in the fresh state
表1 不同热加工处理对蛋白二级结构的影响
Table 1 Effects of different thermal processing on the secondary structure of the proteins

类别加工方式α-螺旋/%β-转角/%β-折叠/%生鲜20.02±0.000 1b43.29±0.000 8a36.68±0.001 0b水溶性蛋白蒸制28.74±0.000 9a40.38±0.003 2b30.88±0.002 2c油炸29.28±0.015 4a29.11±0.024 7d41.61±0.009 3a烤制27.37±0.000 9a34.48±0.000 3c38.15±0.001 6b生鲜25.81±0.005 4b36.94±0.001 5b37.24±0.003 9b盐溶性蛋白蒸制 26.82±0.000 3ab33.31±0.000 5c39.86±0.000 2a油炸23.70±0.007 2c48.76±0.005 5a27.54±0.062 6c烤制27.59±0.000 1a35.17±0.000 3b37.24±0.000 3b
注:不同小写字母表示同一类别同一列差异显著(P <0.05)
2.4 热加工处理前后扇贝多糖的构象变化
不同热加工处理前后水溶性及碱溶性多糖的红外光谱图如图5所示,扇贝水溶性及碱溶性多糖分别在3 361、3 292 cm-1处出现由—OH伸缩振动引起的吸收峰;其—CH3的振动吸收均出现在3 072 cm-1处,—CH2的振动吸收出现在2 955、2 960 cm-1处,为典型的多糖特征吸收峰;在1 652、1 657 cm-1处分别出现—CHO中的C![]() O伸缩振动引起的吸收峰。此外,在波数1 200~1 000 cm-1内存在特征吸收峰,说明含有吡喃糖环[20],而在884、880 cm-1吸收峰表明存在α糖苷,多糖为α吡喃糖环。不同热加工处理后扇贝的水溶性及碱溶性多糖红外光谱无显著变化,表明热加工对扇贝水溶性及碱溶性多糖的特征官能团与化学键无显著影响。LI等[21]研究发现杏鲍菇煮制热处理后,
O伸缩振动引起的吸收峰。此外,在波数1 200~1 000 cm-1内存在特征吸收峰,说明含有吡喃糖环[20],而在884、880 cm-1吸收峰表明存在α糖苷,多糖为α吡喃糖环。不同热加工处理后扇贝的水溶性及碱溶性多糖红外光谱无显著变化,表明热加工对扇贝水溶性及碱溶性多糖的特征官能团与化学键无显著影响。LI等[21]研究发现杏鲍菇煮制热处理后,
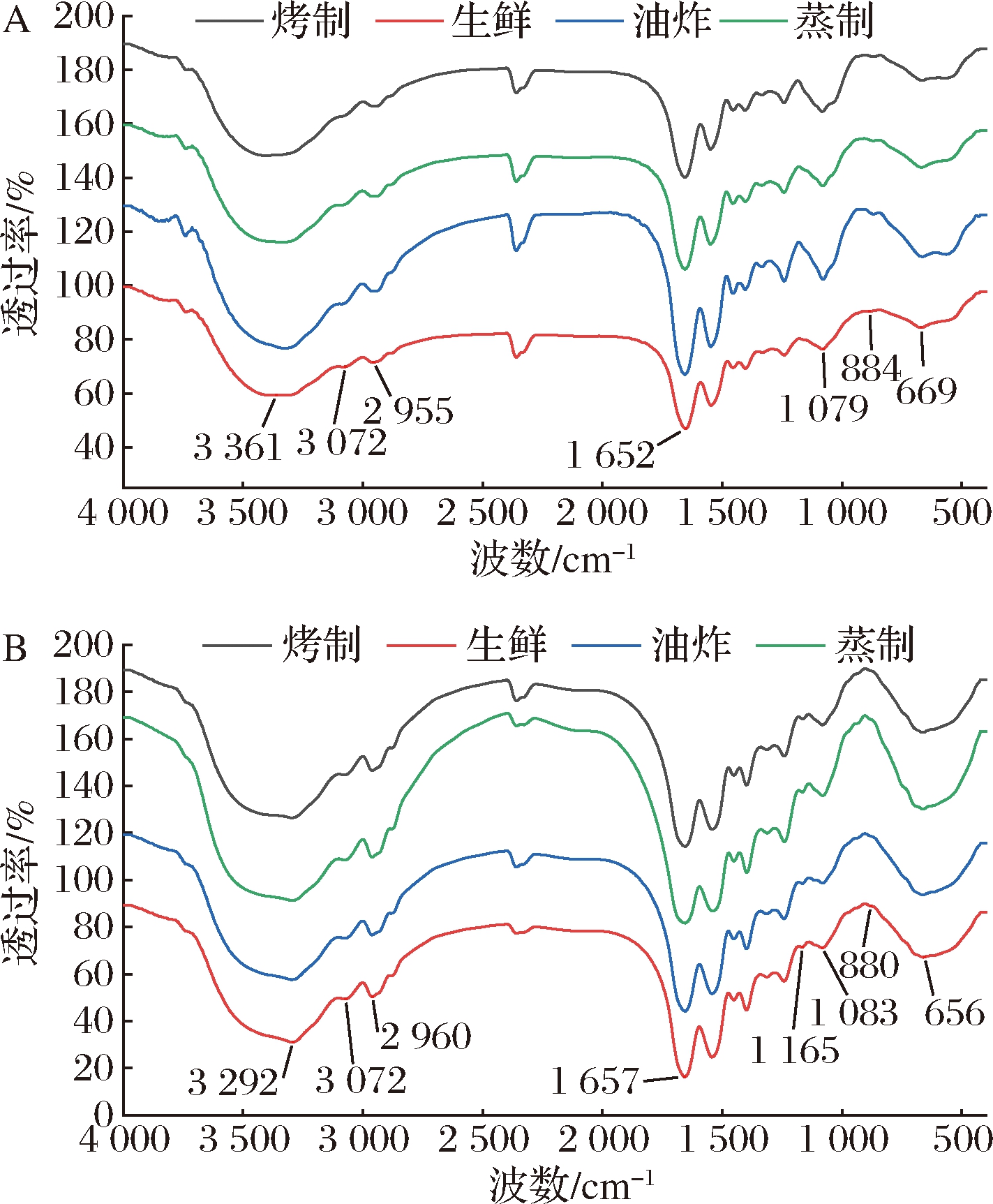
A-水溶性多糖;B-碱溶性多糖
图5 热加工处理前后多糖红外光谱
Fig.5 Infrared spectra of the polysaccharides before and after thermal processing
红外光谱显示多糖官能团与化学键无显著变化。DONG等[22]研究表明热加工处理前后燕麦葡聚糖红外光谱无明显差异,蒸制和微波处理没有改变其官能团。钟润芳等[23]研究发现经过蒸制、油炸及烤制热加工处理后牡蛎多糖的红外光谱没有显著变化,结果表明不同提热加工处理对其官能团无显著影响。
2.5 热加工处理前后扇贝多糖热特性分析
不同热加工处理后扇贝多糖的热特性分析结果见图6。由图6可知,生鲜扇贝水溶性多糖和碱溶性多糖分别在77.1、74.4 ℃出现吸热峰,焓值分别为170.11、191.95 J/g,在343.8、277 ℃出现放热峰,焓值分别为60.21、136.2 J/g,而碱溶性多糖在327.1 ℃出现第2个放热峰,焓值为41.01 J/g。经过不同热加工后扇贝多糖的热特性存在一定差异,其中水溶性多糖均出现2个吸热峰,可能是由于高温导致多糖中结合水与自由水蒸发。蒸制热加工后水溶性和碱溶性多糖分别在84.6、215、77.3 ℃出现吸热峰,焓值分别为209.49、14.11、298.08 J/g,在289.6、300.7、278.4、331 ℃出现放热峰,焓值分别为5.89、7.21、113.4、36.58 J/g,其吸热峰与放热峰峰值均高于生鲜扇贝多糖,表明蒸制热加工后扇贝多糖的热稳定性跟高。油炸热加工后分别在67.9、66.1 ℃出现吸热峰,焓值分别为289.79、312.61 J/g;在291.8、338.1、279.9、321.8 ℃出现放热峰,焓值分别为62.66、85.41、141.28、43.87 J/g。经烤制热加工后分别在67.7、66.3 ℃出现吸热峰,焓值分别为347.41、254.52 J/g;在335.9、282、326.9 ℃出现放热峰,焓值分别为94.63、116.18、63.63 J/g。经过油炸及烤制热加工后多糖吸热峰峰值与放热峰峰值与生鲜组相差不大,表明其热稳定性较好。

a-生鲜组;b-蒸制组;c-油炸组;d-烤制组
A-水溶性多糖;B-碱溶性多糖
图6 热加工处理前后多糖DSC图谱
Fig.6 DSC spectra of the polysaccharides before and after thermal processing
2.6 不同热加工处理对扇贝多糖和蛋白微观结构的影响
扫描电镜可用于观察分析多糖和蛋白质的表面形态[24-25]。相较于生鲜扇贝,烤制热加工后扇贝的水溶性和碱溶性多糖含量变化最显著(P< 0.05),而蒸制热加工后扇贝水溶性和盐溶性蛋白含量变化同样显著,因此分别选择烤制与蒸制热加工前后扇贝多糖、蛋白进行微观结构分析。通过扫描电镜观察热加工处理对扇贝水溶性多糖、碱溶性多糖、水溶性蛋白和盐溶性蛋白微观结构的影响,结果见图7。热加工处理对扇贝多糖与蛋白微观结构具有一定影响,生鲜扇贝水溶性多糖表面均匀平整,呈现纹路规整;而碱溶性多糖表面光滑平整,无明显的凹凸不平或不规整现象。经过烤制热加工处理后水溶性多糖呈现破碎的网状结构,表面凹凸不平;碱溶性多糖表面变得粗糙皱折,出现大小不一的孔洞。表明热加工处理可能破坏多糖结构,细胞壁破裂,从而导致营养物质的变性与损失。生鲜扇贝水溶性蛋白表面平整光滑,具有少许皱折,无明显的孔洞;而盐溶性蛋白表面较均匀,纹路规整,附着少许颗粒。经过蒸制热加工处理后水溶性蛋白变为许多小块组成,表面粗糙,出现较多孔洞;而盐溶性蛋白表面变得粗糙,坍塌破碎出现许多孔洞,可能由于热加工处理导致蛋白质结构遭受破坏,分子间相互作用力减弱,并使蛋白质的表面张力增大,形成多孔状的不规则表面[26]。

A-生鲜组水溶性多糖;B-烤制组水溶性多糖;C-生鲜组碱溶性多糖;D-烤制组碱溶性多糖;E-生鲜组水溶性蛋白;F-蒸制组水溶性蛋白;G-生鲜组盐溶性蛋白;H-蒸制组盐溶性蛋白
图7 热加工处理前后华贵栉孔扇贝多糖与蛋白扫描电镜图
Fig.7 Scanning electron microscopy of polysaccharides and proteins of C.nobilis before and after thermal processing
2.7 不同热加工处理对扇贝多糖和蛋白体外消化特性的影响
华贵栉孔扇贝进行不同热加工处理后,通过体外模拟消化实验测定多糖与蛋白的体外消化率,结果见图8。由图8-A可知,蒸制、油炸及烤制热加工处理对扇贝蛋白的体外消化率均具有显著影响(P<0.05),生鲜扇贝水溶性蛋白的体外消化率高于50%,经过蒸制和烤制热加工后体外消化率均显著提高(P<0.05),尤其是蒸制处理后体外消化率增幅最高,达到60%以上,在蒸制和烤制热加工过程中通过表面受热产生一层保护膜,避免蛋白质过度降解,热加工后使其体外消化率提高[27];相反,经过油炸热加工后水溶性蛋白体外消化率显著降低,低于50%。相对于盐溶性蛋白,未经加工处理前蛋白的体外消化率高于50%,经过蒸制、油炸及烤制3种热加工后体外消化率均显著提高(P<0.05),其中,油炸热加工后盐溶性蛋白的体外消化率明显提高,达70%以上。热加工处理破坏蛋白质的二级结构从而影响其体外消化性[28],且热加工导致二硫键、疏水键、氢键等断裂重排,一定程度上有利于蛋白质的消化吸收,提高蛋白质的营养价值[29]。
由图8-B可知,生鲜扇贝水溶性多糖和碱溶性多糖的体外消化率分别低于30%和20%,经过蒸制、油炸和烤制3种热加工处理后其体外消化率均无显著影响(P>0.05),可能是由于水溶性多糖和碱溶性多糖为非淀粉多糖,在胃肠消化中不易被胰淀粉酶水解[1],因此多糖的体外消化率较低,且表明热加工处理对扇贝水溶性多糖与碱溶性多糖的体外消化影响较小。

A-扇贝蛋白;B-扇贝多糖
图8 不同热加工处理对华贵栉孔扇贝蛋白和多糖体外消化率的影响
Fig.8 Effects of different thermal processing on in vitro digestibility of proteins and polysaccharides in C.nobilis
3 结论
本文通过蒸制、油炸及烤制热加工对华贵栉孔扇贝进行加工处理,探究3种热加工处理对华贵栉孔扇贝蛋白和多糖结构及其消化特性的影响,结果表明,本文所研究的热加工处理均导致华贵栉孔扇贝水溶性蛋白和盐溶性蛋白含量显著降低(P<0.05),以及使碱溶性多糖含量显著增加,蒸制和油炸热加工使水溶性多糖含量显著降低21.07%和39.28%,而烤制热加工使其显著提高23.27%(P<0.05)。红外光谱图显示,3种热加工处理对扇贝多糖的官能团与化学键无显著影响,但会破坏蛋白质的二级结构;热加工使蛋白与多糖的微观结构由均匀规整转变为多孔状。蒸制及烤制热加工处理显著提高水溶性蛋白和盐溶性蛋白的体外消化率,其中蒸制热加工后蛋白体外消化率分别达到68.81%和57.91%,利于水溶性蛋白和盐溶性蛋白的消化吸收。综上所述,蒸制热加工方式对华贵栉孔扇贝蛋白与多糖体外消化效果较好,有利于机体对其吸收利用,更适合华贵栉孔扇贝的热加工。本研究为华贵栉孔扇贝的合理热加工提供了参考依据。
[1] 周浩宇, 俞明君, 聂远洋, 等.热加工方式对香菇营养特性和抗氧化活性的影响[J].食品科学, 2021, 42(15):106-114.
ZHOU H Y, YU M J, NIE Y Y, et al.Effects of heat processing methods on nutritional properties and antioxidant activity of Lentinus edodes[J].Food Science, 2021, 42(15):106-114.
[2] JIANG S S, FENG X, ZHANG F, et al.Effects of cooking methods on the Maillard reaction products, digestibility, and mineral bioaccessibility of Pacific oysters (Crassostrea gigas)[J].LWT, 2021, 141:110943.
[3] LI Q Q, LU J, CHANG Y J, et al.Effect of different cooking methods on nutritional intake and different storage treatments on nutritional losses of abalone[J].Food Chemistry, 2022, 377:132047.
[4] YANG W J, LU X J, ZHANG Y, et al.Effect of cooking methods on the health-promoting compounds, antioxidant activity and nitrate of tatsoi (Brassica rapa L.ssp.narinosa)[J].Journal of Food Processing and Preservation, 2019, 43(8):e14008.
[5] 林玉锋, 黄后培, 刘嘉怡, 等.不同烹饪方式对牡蛎蛋白质营养品质的影响[J].食品科技, 2020, 45(7):143-151.
LIN Y F, HUANG H P, LIU J Y, et al.Effect of different cooking methods on the nutritional quality of oyster protein[J].Food Science and Technology, 2020, 45(7):143-151.
[6] 胡吕霖, 任思婕, 沈清, 等.不同烹饪方式及体外模拟消化环境对鲟鱼蛋白质氧化及消化性的影响[J].食品科学, 2018, 39(20):63-70.
HU L L, REN S J, SHEN Q, et al.Effect of different cooking treatments and in vitro digestion on protein oxidation and digestibility of sturgeon fillets[J].Food Science, 2018, 39 (20):63-70.
[7] 章超桦, 秦小明.贝类加工与利用[M].北京:中国轻工业出版社, 2014:5-6.
ZHANG C H, QIN X M.Processing and Utilization of Shellfish[M].Beijing:China Light Industry Press, 2014:5-6.
[8] VENUGOPAL V, GOPAKUMAR K.Shellfish:nutritive value, health benefits, and consumer safety[J].Comprehensive Reviews in Food Science & Food Safety, 2017, 16(6):1 219-1 242.
[9] 农业农村部渔业渔政管理局. 2021中国渔业统计年鉴[M].北京:中国农业出版社, 2021:39-49.
Bureau of Fisheries, Ministry of Agriculture and Rural Affairs.2021 China Fishery Statistics Yearbook[M].Beijing:China Agricultural Press, 2021:39-49.
[10] 李运东. 低温真空烹饪对扇贝丁营养物质及口感影响的研究[D].烟台:烟台大学, 2013.
LI Y D.Effect of sous vide cooking on nutrients and flavor of scallop[D].Yantai:Yantai University, 2013.
[11] 金路, 严鹏, 李红玉.栉孔扇贝多糖的提取及脱色[J].食品与发酵工业, 2015, 41(2):233-236.
JIN L, YAN P, LI H Y, et al.The optimization of polysaccharide extraction process from Chlamys farreri and its decolorization[J].Food and Fermentation Industries, 2015, 41(2):233-236.
[12] WU D, WU C, CHEN H, et al.Effect of ball mill treatment on the physicochemical properties and digestibility of protein extracts generated from scallops (Chlamys farreri)[J].International Journal of Molecular Sciences, 2018, 19(2):531.
[13] LUO J Q, TAYLOR C, NEBL T, et al.Effects of macro-nutrient, micro-nutrient composition and cooking conditions on in vitro digestibility of meat and aquatic dietary proteins[J].Food Chemistry, 2018, 254:292-301.
[14] GUO C, XIE Y J, ZHU M T, et al.Influence of different cooking methods on the nutritional and potentially harmful components of peanuts[J].Food Chemistry, 2020, 316:126269.
[15] 罗凡, 黄美群, 胡立松, 等.油茶籽热处理对油茶饼中多糖含量及其抗氧化性影响的研究[J].中国油脂, 2019, 44(8):41-45.
LUO F, HUANG M Q, HU L S, et al.Effect of heat treatment of oil-tea Camellia seed on content and antioxidant activity of polysaccharides in oil-tea Camellia cake[J].China Oils and Fats, 2019, 44(8):41-45.
[16] 马梦娇, 荆慧娟, 符安卫, 等.中华鳖腿肉蛋白的理化性质[J].食品与发酵工业, 2019, 45(22):110-116.
MA M J, JING H J, FU A W, et al.Physicochemical properties of Chinese soft-shelled turtle protein[J].Food and Fermentation Industries, 2019, 45(22):110-116.
[17] YAMPOLSKAYA G P, TARASEVICH B N, ELENSKII A A.Secondary structure of globular proteins in adsorption layers at the solution-air interface by the data of Fourier transform IR spectroscopy[J].Colloid Journal, 2005, 67(3):385-391.
[18] 刘紫薇, 朱明明, 王凤新, 等.高温湿热处理对大豆分离蛋白的结构及其功能特性的影响[J].食品与发酵工业, 2021, 47(15):157-164.
LIU Z W, ZHU M M, WANG F X, et al.Effect of high temperature hydrothermal treatment on structure and functional properties of soybean protein isolate[J].Food and Fermentation Industries, 2021, 47(15):157-164.
[19] LIU G, LI J, SHI K, et al.Composition, secondary structure, and self-assembly of oat protein isolate[J].Journal of Agricultural and Food Chemistry, 2009, 57 (11):4 552-4 558.
[20] ZHU Z Y, LIU F, GAO H, et al.Synthesis, characterization and antioxidant activity of selenium polysaccharide from Cordyceps militaris[J].International Journal of Biological Macromolecules, 2016, 93:1 090-1 099.
[21] LI S Q, SHAH N P.Characterization, antioxidative and bifidogenic effects of polysaccharides from Pleurotus eryngii after heat treatments[J].Food Chemistry, 2016, 197:240-249.
[22] DONG J L, YANG M, ZHU Y Y, et al.Comparative study of thermal processing on the physicochemical properties and prebiotic effects of the oat β-glucan by in vitro human fecal microbiota fermentation[J].Food Research International, 2020, 138:109818.
[23] 钟润芳, 曹文红, 陈忠琴, 等.热加工对牡蛎中锌元素存在形态的影响[J].食品与发酵工业, 2022, 48(7):166-172.
ZHONG R F, CAO W H, CHEN Z Q, et al.Effects of thermal processing on the existing form of zinc in oysters[J].Food and Fermentation Industries, 2022, 48(7):166-172.
[24] XU Y Q, LIU G J, YU Z Y, et al.Purification, characterization and antiglycation activity of a novel polysaccharide from black currant[J].Food Chemistry, 2016, 199:694-701.
[25] LONG G H, JI Y, PAN H B, et al.Characterization of thermal denaturation structure and morphology of soy glycinin by FTIR and SEM[J].International Journal of Food Properties, 2015, 18(4):763-774.
[26] DAI M, SU X R, WANG X, et al.Three zinc(Ⅱ) coordination polymers based on tetrakis(4- pyridyl)cyclobutane and naphthalenedicarboxylate linkers:solvothermal syntheses, structures, and photocatalytic properties[J].Crystal Growth & Design, 2014, 14(1):240-248.
[27] MENEZES E A, OLIVEIRA A F, FRANCA C J, et al.Bioaccessibility of Ca, Cu, Fe, Mg, Zn, and crude protein in beef, pork and chicken after thermal processing[J].Food Chemistry, 2018, 240:75-83.
[28] 郭蔚波, 赵燕, 徐明生, 等.不同处理方式下蛋白质结构变化与体外消化性关系研究进展[J].食品科学, 2019, 40(1):327-333.
GUO W B, ZHAO Y, XU M S, et al.Research progress in understanding the relationship between protein structure change and in vitro digestibility after different treatments[J].Food Science, 2019, 40(1):327-333.
[29] 马梦瑶, 谢岩黎, 范亭亭, 等.热加工对小麦蛋白结构和消化特性的影响[J].中国粮油学报, 2021, 36(12):50-55.
MA M Y, XIE Y L, FAN T T, et al.Effects of thermal processing on the structure and functional properties of wheat protein[J].Journal of the Chinese Cereals and Oils Association, 2021, 36(12):50-55.