肌氨酸氧化酶(sacrosine oxidase, SOX)可催化氧化肌氨酸上的N-甲基并生成甲醛、过氧化氢和甘氨酸,在多个领域均有应用。医疗上可偶联肌酐酶和肌酸酶用于人体血液或尿液中肌酐含量的测定[1],在食品工业上则可用于检测葡萄酒样品中甘油及有机酸的含量[2-3]。此外,由于SOX具备去N-甲基化的能力,使其在催化降解N-甲基类化合物方面具有潜在的应用前景。工业废水中的N-甲基类化合物因其化学稳定性难以有效降解,其过度积累会对人体的神经系统以及肝、肾造成严重损伤,同时对水生生物有毒害作用。针对该类污染,国内外常采用物化法及生物法进行处理[4],但在N-甲基化合物的酶法生物降解方面仍存在较大的空白。有研究已证实某些SOX除肌氨酸以外,对其他N-甲基化合物也存在降解作用。例如,来源于Bacillus sp.的SOX对N-甲基-DL-丙氨酸、N-甲基-DL-缬氨酸、N-甲基-L-亮氨酸有催化作用[5];来源于Corynebacterium sp.U-96的SOX对N-甲基-DL-丙氨酸、N-乙基-甘氨酸有催化作用[6];本实验室前期通过异源表达来自Thermomicrobium roseum DSM 5159的TrSOX,在定点突变后证实其对含N-甲基的有机氮类农药西维因、呋喃丹有降解作用[7]。尽管已经证实SOX对某些N-甲基化合物有催化降解能力,但一种来源的SOX往往只能针对为数不多的几种底物有催化效果,所以底物谱太窄仍是限制该类酶广泛运用的一类原因。如上述提到的Corynebacterium sp.U-96中的SOX,除已报道的底物,对其他N-甲基氨基酸类化合物均无活性[6]。
耐热酶的热稳定性好,最适反应温度在60 ℃以上,在实际生产应用中具有显著优势。耐热SOX能在常温下进行分离、提纯和包装运输且可长时间保持活性,对冷却系统的要求降低,从而极大地降低了能耗和成本;较高的反应温度可提高底物与水的相容性,能够加快动力学反应、提升催化效率[8];耐热SOX的有机溶剂耐受性往往也较强[9],这为催化降解工业废水中的N-甲基类化合物奠定了基础。根据现有报道,关于SOX的研究主要集中在细菌来源,如棒状杆菌属(Corynebacterium sp.)、假单胞菌(Pseudomonas)、链霉菌(Streptomyces)、芽孢杆菌(Bacillus)和节杆菌(Arthrobacter)等微生物[10-15],但其中大多数SOX热稳定性并不尽如人意,最适温度一般低于40 ℃,高于此温度酶活力则剧烈下降(表1)。来源于Thermomicrobium roseum DSM5159和Bacillus sp. BSD-8的SOX虽然热稳定性较好,能在50、60 ℃以下保持稳定,但仍存在分离纯化困难、酶活力低和可溶性表达困难等诸多问题[16-17]。相较于上述来源,古生菌大多存在于极端环境中,其体内的酶在热稳定性方面具有天然优势,同时由于祖先序列的高度保守性,对古生菌来源的酶进行结构和功能的解析可用做同类酶改造的重要参考[18]。
因此,本研究以来源于古生菌Archaea HR32(SAMD00093782)中预测的SOX为切入点,首先对其进行生物信息学分析,之后在B.subtilis WB600中表达,再通过热处理和镍柱亲和层析的方法获得纯酶。在此基础上对其进行酶学性质表征和酶动力学研究,本研究结果为深入解析来自古生菌的SOX提供翔实数据支撑,同时为利用SOX催化降解N-甲基类有害化合物奠定基础。
表1 不同来源SOX酶学性质比较
Table 1 Enzymatic properties of SOX from different sources
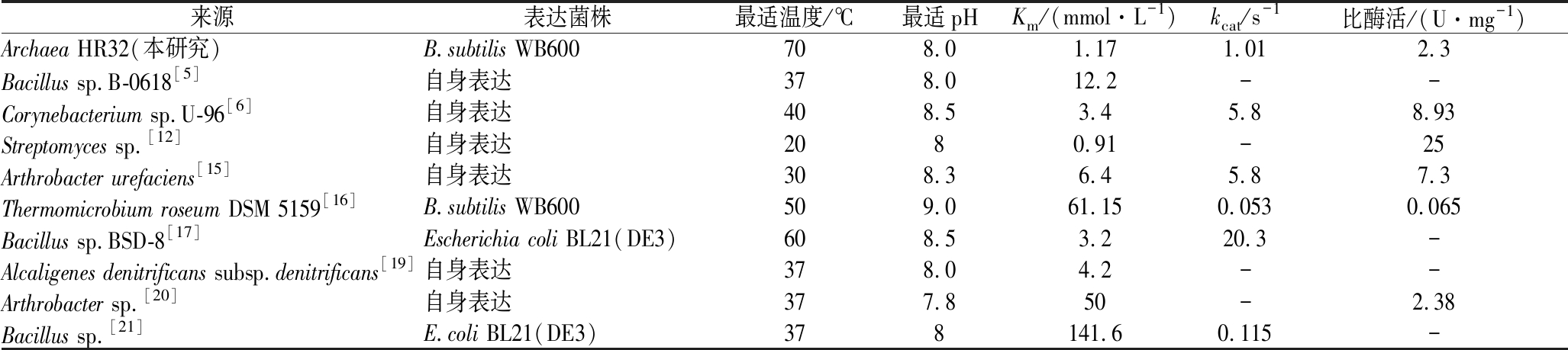
来源表达菌株最适温度/℃最适pHKm/(mmol·L-1)kcat/s-1比酶活/(U·mg-1)Archaea HR32(本研究)B.subtilis WB600708.01.171.012.3Bacillus sp.B-0618[5]自身表达378.012.2--Corynebacterium sp.U-96[6]自身表达408.53.45.88.93Streptomyces sp.[12]自身表达2080.91-25Arthrobacter urefaciens[15]自身表达308.36.45.87.3Thermomicrobium roseum DSM 5159[16]B.subtilis WB600509.061.150.0530.065Bacillus sp.BSD-8[17]Escherichia coli BL21(DE3)60 8.53.220.3-Alcaligenes denitrificans subsp.denitrificans[19]自身表达378.04.2--Arthrobacter sp.[20]自身表达377.850-2.38Bacillus sp.[21]E.coli BL21(DE3)378141.60.115-
注:“-”代表文献中并未对该参数进行测定
1 材料与方法
1.1 菌株和质粒
E. coli JM109、B. subtilis WB600和表达载体pMA5-Pxyl均由实验室保存。
1.2 试剂、仪器和培养基
Taq DNA聚合酶、10 000 bp DNA分子质量标准Marker、蛋白质分子质量标准Marker,TaKaRa公司;胶回收试剂盒、质粒提取试剂盒、同源重组试剂盒、氨苄青霉素、卡那霉素,南京诺唯赞生物科技有限公司;肌氨酸、红豆碱等其他底物,aladdin公司;其他试剂均为国产分析纯。
S100D PCR仪,美国BIO-RAD公司;MOS-450圆二色光谱仪,法国Bio-Logic公司;酶标仪,南京科麟得科学仪器有限公司;V-1200分光光度计,上海美普达仪器公司;Nano-DSC差示扫描微量热仪,美国Waters公司;SCG蛋白纯化系统,苏州赛谱仪器有限公司。
LB培养基(g/L):胰蛋白胨10,酵母粉5,NaCl 10,115 ℃ 灭菌20 min;TB培养基(g/L):酵母粉23.6,胰蛋白胨11.8,K2HPO4 9.4,KH2PO4 2.2,甘油5,115 ℃灭菌20 min。
1.3 实验方法
1.3.1 目的蛋白序列的生物信息学分析
氨基酸序列比对:借助DNAMAN软件对来源于古生菌Archaea HR和Bacilius sp.的SOX氨基酸序列进行同源性分析。
信号肽分析和结构域预测:使用SMART网站(http://smart.embl.de)进行蛋白质结构组件的分析。
理化性质预测:使用ExPASy(https://www.expasy.org)的ProtParam和ProtScale工具对蛋白进行等电点、分子质量和疏水性等理化性质分析。
三级结构预测:通过ExPASy上的SWISS-MODEL平台(https://swissmodel.expasy.org)进行预测,结果通过VMD软件进行可视化。
1.3.2 基因工程菌的构建
从NCBI网站上下载预测的SOX氨基酸序列(GenBank:GBD29370.1),送生工生物工程(上海)公司按照枯草芽孢杆菌的密码子偏好性进行序列优化并添加6×His tag。设计含pMA5-Pxyl同源臂的引物P1 (5′-ACCTAAAAAGGAGCGATTTAATGCATCATCA-TCATCAT-3′)、P2 (5′-TTCGACCTCTAGAACGCGTTTAT-AAGAAACGACGAAGGCT-3′),以合成的目的基因序列为模板,进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,获得sox基因片段。利用同源重组酶将sox片段与线性化质粒pMA5-Pxyl连接,构建重组质粒pMA5-Pxyl-sox。将重组质粒转化入E.coli JM109感受态细胞中,提取质粒双酶切验证及测序正确后转化入宿主菌B.subtilis WB600中进行表达。
1.3.3 目的蛋白的诱导表达、分离纯化与鉴定
将重组菌B.subtilis WB600/pMA5-Pxyl-sox和对照菌B.subtilis WB600/pMA5-Pxyl在含卡那霉素LB平板上划线,37 ℃培养16 h。挑选单菌落接种于15 mL LB液体培养基中,在37 ℃,200 r/min的条件下培养12 h,以5%的接种量转接至50 mL TB培养基中,相同条件下培养12 h后添加20 g/L木糖进行诱导表达,2 h后下摇床离心收集菌体。用20 mmol/L Tris-HCl(pH 7.4)洗涤并重悬菌体后加入终质量浓度为300 μg/mL 的溶菌酶,37 ℃孵育3 h后超声破碎,上清液即为粗酶液。取100 mL粗酶液于70 ℃孵育30 min,除去大部分杂蛋白,离心取上清液过5 mL镍柱,先用50 mmol/L咪唑洗去杂蛋白,再用120 mmol/L咪唑进行洗脱,收集纯化的酶液,超滤去除多余咪唑并将纯酶浓缩。考马斯亮蓝法测定蛋白含量,取粗酶液、热处理后酶液及纯化后酶液用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分析。回收10% SDS-PAGE凝胶重组蛋白rSOX的单一条带,用基质辅助激光解析电离串联飞行时间质谱(matrix-assisted laser desorption/ionization tandem time of flight mass spectrometry, MALDI-TOF-MS)进行鉴定。
1.3.4 圆二色谱(circular dichroism, CD)分析与Nano-DSC分析
将纯酶液(0.2 mg/mL)置于1 mm的比色皿中,在190~250 nm下扫描,3次测量取平均值,测定rSOX各类二级结构的含量[20]。利用Nano-DSC测定rSOX的变性温度(Tm)和焓变值(ΔH),缓冲液重复测定3次以平衡基线,之后取300 μL 1.0 mg/mL的rSOX放入样品池中测定,温度20~100 ℃,升温速率为1 ℃/min,实验结果用NanoAnalyze软件分析[9]。
1.3.5 重组SOX的酶活力测定
以肌氨酸为底物,参考文献[12]方法:取10 μL酶液,加入600 μL显色液(1 mmol/L的4-氨基安替比林、6 mmol/L的苯酚、7 000 U/L的辣根过氧化物酶、20 mmol/L的Tris-HCl缓冲液、pH 8.0),混匀后加入30 μL 0.2 mol/L肌氨酸,70 ℃反应30 min,100 ℃加热10 min终止反应,于500 nm处测定吸光度。酶活力单位定义为:在70 ℃,pH 8.0的条件下,将1 min反应生成1 μmol 过氧化氢所需的酶量定义为1个酶活力单位(U)。
1.3.6 重组SOX的酶学性质表征
1.3.6.1 最适温度及最适pH测定
在pH 7.0,0~90 ℃(间隔10 ℃)条件下,反应30 min测定酶活力,将测得的最高酶活力定义为100%,计算不同温度下重组酶的相对酶活力,确定最适温度。在70 ℃条件下,分别于pH 4.0~7.0(柠檬酸-磷酸氢二钠)、pH 7.0~9.0(Tris-HCl)、pH 9.0~10.5(碳酸钠-碳酸氢钠)、pH 10.5~12.0(磷酸氢二钠-氢氧化钠)的缓冲液中反应30 min测定酶活力,将测得的最高酶活力定义为100%,确定最适pH。
1.3.6.2 温度稳定性及 pH 稳定性测定
将rSOX于一系列不同温度(0~90 ℃,间隔10 ℃)下孵育12 h,在最适反应条件下测定酶活力,将测得的最高酶活力定义为100%,探究温度稳定性。将游离酶置于30 ℃环境下保藏,以初始酶活力为100%,每隔2 d 测1次酶活力,探究贮藏稳定性。在4 ℃条件下,将重组酶置于pH 4.0~12.0不同缓冲液中保存12 h后于最适反应条件下测定酶活力,将测得的最高酶活力定义为100%,考察pH稳定性。
1.3.6.3 金属离子和有机溶剂对酶活力的影响
在最适条件下,向反应体系中分别加入不同金属离子(Al3+、K+、Ca2+、Zn2+、Co2+、Mn2+、Mg2+、Fe3+、和Ni2+)至终浓度为0.2、0.5、1.0、3.0 mmol/L。以不添加金属离子的酶的酶活力作为100%,测定相对酶活力。将rSOX在12种lgP不同的有机溶剂中按照体积比1∶1进行孵育,以不加有机溶剂的酶活力作为100%,分别于2、4、6 h取样测定酶活力。
1.3.6.4 重组酶的底物特异性研究及酶动力学参数测定
将15种底物分别配制成不同浓度的溶液,在最适条件下与重组酶反应,测定酶活力。利用Origin软件中的Hill方程进行非线性曲线拟合,得到Km和Vm值,并计算kcat和kcat/Km值,确定rSOX对不同底物的亲和性以及催化效率。
2 结果与分析
2.1 重组蛋白rSOX的生物信息学分析
用DNAMAN软件进行氨基酸序列比对发现,Archaea HR32中的SOX与其他古生菌来源的SOX序列一致性为45%左右,而与Bacilius sp.来源的SOX一致性为34%左右,序列比对情况如图1所示。利用SMART进行蛋白质结构组件分析发现,重组蛋白rSOX包含Pfam DAO一个保守结构域(图2-a),无信号肽序列。该结构域被注释为是各种FAD依赖性氧化酶的保守结构域。参考文献[22]方法,推测本研究中的rSOX与FAD共价结合,实验证明向培养基中添加FAD的前体物质维生素B12对rSOX酶活力的提高有促进作用。ExPASy预测重组蛋白的分子质量为41 792.46 Da,等电点为6.37,在酵母细胞中的半衰期>20 h,在大肠杆菌中的半衰期>10 h;根据疏水性分析结果(图2-b),总平均亲水性为-0.183,表明该蛋白亲水性尚可。以7exs.1.A(PDB ID)为模板进行同源建模,其与rSOX的序列相似性达到51.64%,达到同源建模的要求。利用SWISS-MODEL网站进行建模分析结果如图2-c所示,模型预测rSOX具有α-螺旋,β-折叠及无规则卷曲等二级结构。此外,该模型可作为后期进行酶改造工作的重要参考。

图1 不同来源SOX氨基酸序列比对
Fig.1 Amino acid sequence alignment for SOX from different sources
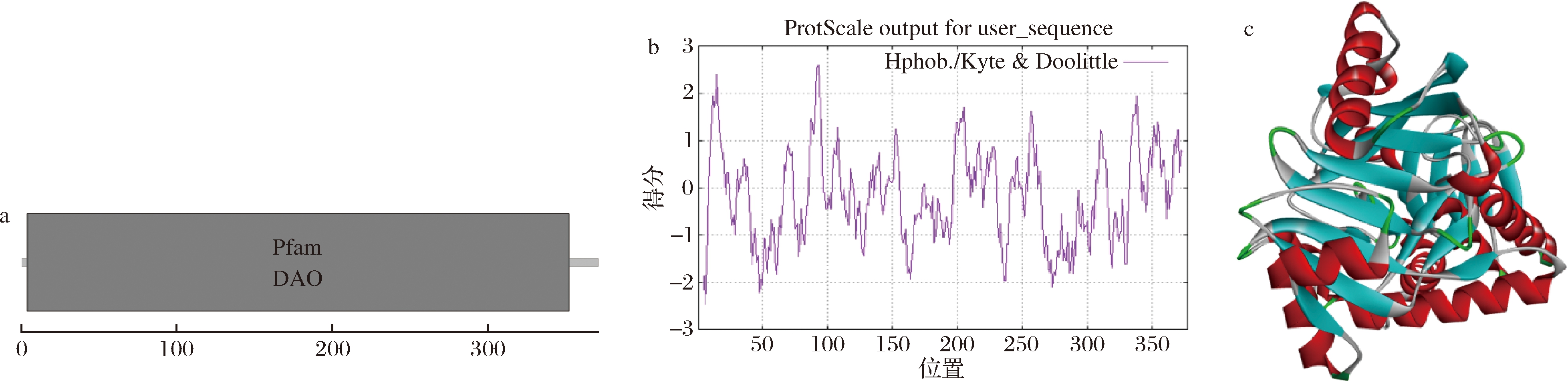
a-rSOX保守结构域预测;b-rSOX疏水性分析;c-rSOX的三级结构模型
图2 rSOX的保守结构域预测、疏水性分析和三级结构预测
Fig.2 Conserved domain prediction, hydrophobicity analysis and tertiary structure prediction of rSOX
2.2 重组质粒的构建与诱导表达
按照图3-a所示流程构建重组质粒pMA5-Pxyl-sox,图3-b为Nde Ⅰ 和Mlu Ⅰ 双酶切验证结果,泳道2可见清晰的两条带,表明重组质粒构建成功。SDS-PAGE分析结果如图3-c所示,纯化条带单一,位于45 kDa偏下方,与预测理论分子质量41 792.46 Da对应。经MALDI-TOF仪器分析鉴定,确认重组蛋白为来源于Archaea HR32假设的肌氨酸氧化酶。以上结果表明来源于古生菌的rSOX在B.subtilis WB600中实现了可溶性表达且经分离纯化后获得了纯酶。经测定,摇瓶水平rSOX的产量为15 mg/L,比酶活力为2.3 U/mg。值得一提的是,在本研究中曾尝试将该蛋白在E.coli BL21(DE3)和E.coli ROSETTA(DE3)中进行表达,均无法实现可溶性表达,且绝大部分蛋白以包涵体的形式存在,酶活力极低。类似的问题也出现在实验室表达另一耐热肌氨酸氧化酶的过程中[23]。原因可能是耐热肌氨酸氧化酶的天然生长环境苛刻,在大肠杆菌表达体系中无法完成蛋白质的折叠,不能形成具有酶活性的天然构象。

a-重组质粒构建流程; b-重组质粒酶切验证(M-Marker,1-7 089 bp和1 113 bp); c-重组蛋白rSOX的SDS-PAGE图
(1-粗酶液, 2-热处理后酶液, 3-纯酶) 图3 重组质粒的构建与表达
Fig.3 Construction and expression of the recombinant plasmid
2.3 rSOX的二级结构与Tm
CD检测结果表明重组SOX由35.0%的α-螺旋,11.1%的β-折叠,23.3% β-转角及31.6%的无规则卷曲组成(图4-a)。该二级结构组成与课题组此前表达的来源于TrSOX的接近[9],而TrSOX也具有不错的热稳定性。纯酶的Tm和ΔH分别为92.13 ℃和1 070 kJ/mol(图4-b),Tm越大表明蛋白质的热稳定性越好。在已有报道中,极少有肌氨酸氧化酶的Tm能达到90 ℃以上。这说明本研究中表达的rSOX在热稳定性方面具有显著优势。

a-rSOX的二级结构分析;b-热变性中点温度(Tm)分析
图4 rSOX的二级结构分析与热变性中点温度(Tm)分析
Fig.4 The secondary structure and thermal denaturation (Tm) analysis of rSOX
2.4 rSOX的酶学性质
2.4.1 温度与pH对rSOX的影响
由图5-a可知,rSOX的最适反应温度为70 ℃。低温时随温度上升反应速度加快,当温度到达70 ℃后,随反应温度的升高,rSOX构象发生改变,酶活力下降。如图5-b所示,rSOX在0~70 ℃孵育12 h仍保留85%以上的酶活力,80 ℃孵育12 h保留近50%的酶活力。将rSOX于30 ℃贮藏,第10天检测到剩余80%的酶活力,第26天降至初始酶活力的50%,到达该温度下的半衰期(图中未展示)。上述结果进一步说明rSOX具有十分优异的热稳定性,有望在工业应用领域发挥重要作用。rSOX的最适反应pH为8.0(图5-c),这和已知的大多数SOX的最适pH基本一致(表1),pH可能是通过改变底物的状态或酶的带电状态从而影响酶的活力。在pH 6.0~9.0孵育12 h,rSOX保留50%以上酶活力,在pH<5.5时,酶活力几乎完全丧失(图5-d),这说明rSOX适合在中性偏碱条件下保存。
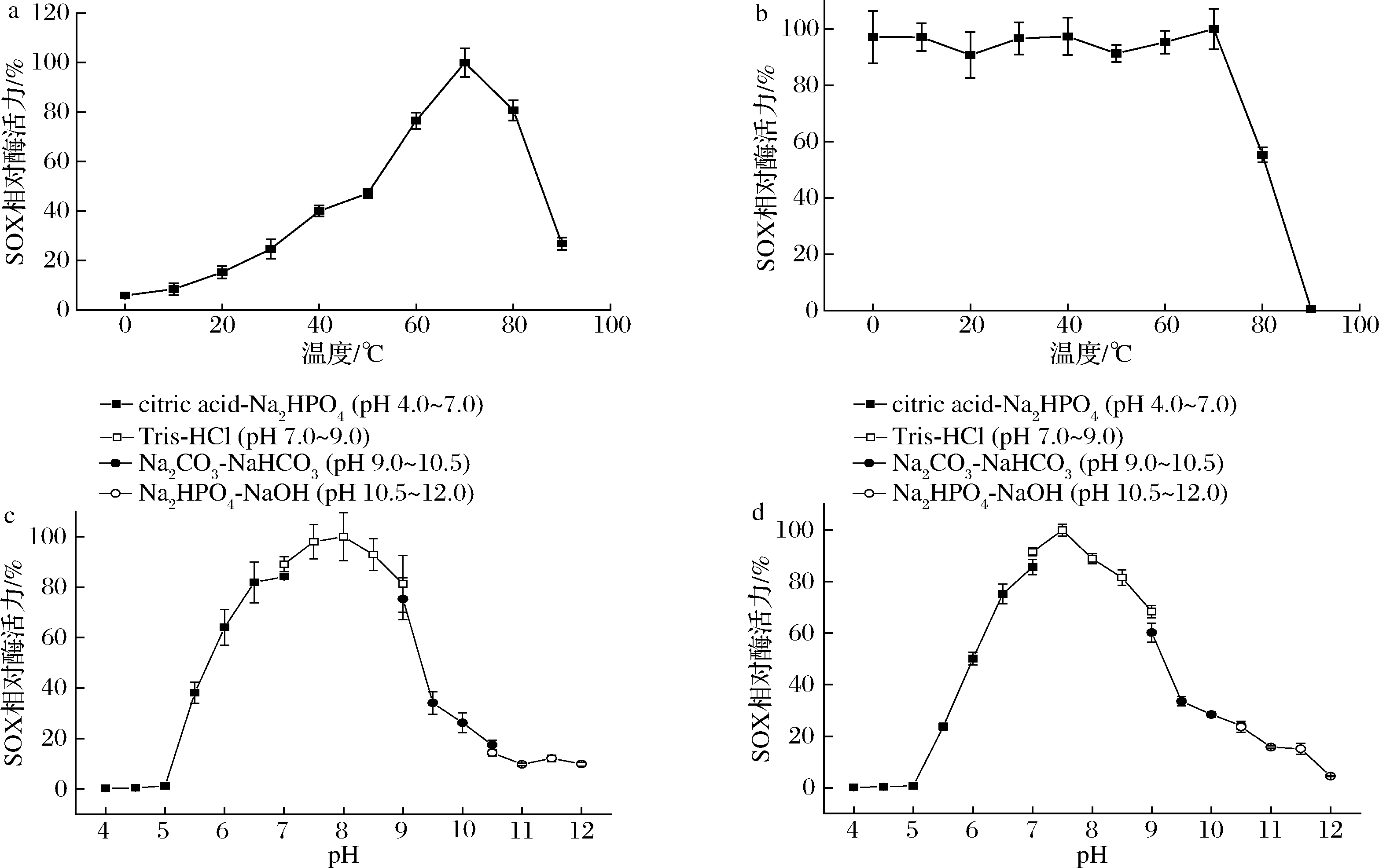
a-最适温度;b-温度稳定性;c-最适pH;d-pH稳定性
图5 温度与pH对rSOX的影响
Fig.5 Effect of temperture and pH on rSOX
2.4.2 金属离子与有机溶剂对rSOX的影响
由于肌氨酸氧化酶在使用过程中往往需要在含有机溶剂的体系中进行反应[2-3],因此,考察rSOX对常用有机溶剂的耐受性很有必要。如图6-a所示,除正丙醇、乙醇、二甲基甲酰胺对酶活力有比较明显的抑制外,其他有机溶剂对酶活力的影响均较小,即使随着孵育时间的延长,酶活力下降幅度也不大。SOX对lgP值大的有机溶剂如环己烷、甲苯、异辛烷等耐受能力较强,原因可能是极性有机溶剂能够溶解大量的水并可剥去酶必需水化层导致酶失活,相应的,疏水性有机溶剂较少能除去酶的必需水化层,因而对酶活力活影响不大[24]。同时酶动力学研究表明大部分有机溶剂的存在对rSOX的Km影响不大,即有机溶剂不太能够影响rSOX对底物的亲和性。以上结果表明rSOX耐受有机溶剂的能力较强,这为其在有机相中进行催化反应、拓宽应用情景提供了可能。由图6-b可知,不同金属离子对酶活力的影响不同,不同浓度的同种金属离子对酶活力的影响也不同。其中Co2+的加入使酶活力大大降低,终浓度为3.0 mmol/L Al3+、Fe3+、Zn2+的加入几乎使酶完全失活;Mn2+、Fe3+对酶活力也有一定的抑制作用,且离子浓度越高对酶活力的抑制越显著;0.2 mmol/L的Mg2+、Al3+、Ca2+、Ni2+和0.5 mmol/L的K+、Zn2+则对rSOX有激活作用,相对酶活力最高可达到135.5%,其中的Ca2+激活作用最强,且激活作用随着离子浓度的升高逐渐减小。上述现象可能是由于rSOX发挥催化作用需要辅因子FAD的参与,而金属离子对酶活力的激活效应可能与其在电子传递方面发挥作用有关[25]。

a-有机溶剂对rSOX的影响;b-金属离子对rSOX的影响
图6 有机溶剂及金属离子对rSOX的影响
Fig.6 Effect of organic solvent and metal ion on rSOX
2.4.3 rSOX的底物特异性和酶动力学参数分析
表2列出了经Hill方程非线性拟合后得到的rSOX对不同底物的酶动力学参数。rSOX对肌氨酸的Km值为1.17 mmol/L,低于表1中所列的绝大部分SOX的Km,表现出对肌氨酸更强的亲和性。此外,所有底物中rSOX对N-甲基-L-丙氨酸Km最小、kcat/Km最大,分别为0.35 mmol/L和215.12 L/(mmol·min),rSOX对N-甲基-L-丙氨酸具有最强的亲和性与最高的催化效率。从表2可以看出,rSOX对包括N-甲基-L-天冬氨酸、L-脯氨酸、高脯氨酸和有生物毒害作用的红豆碱等在内的9种N-甲基类化合物均具有催化活性,底物谱较为宽泛,但对于非N-甲基氨基酸类化合物如西维因和N-甲基吡咯烷酮则不具有催化活性。同时发现rSOX对D型底物几乎不显示活性,而对N-甲基-L型底物表现出明显的手性选择性(>100)。在此,底物特异性和酶动力学研究均表明rSOX的底物谱较广、手性选择性强,使其未来在化合物的手性拆分和降解N-甲基类有毒害物质方面具备潜在利用价值。
表2 rSOX对不同底物的酶动力学参数
Table 2 Catalytic kinetic constants of SOX for different substrates

底物Km/(mmol·L-1)kcat/min-1kcat/Km/[L·(min·mmol)-1]手性选择性肌氨酸1.1774.5963.78红豆碱0.9014.6616.30高脯氨酸0.5765.90114.90L-脯氨酸4.2024.475.83>100D-脯氨酸---N-甲基-L-苯丙氨酸1.0086.4687.17>100N-甲基-D-苯丙氨酸---N-甲基-L-亮氨酸0.4540.6591.15>100N-甲基-D-亮氨酸---N-甲基-L-丙氨酸0.3575.32215.201 105N-甲基-D-丙氨酸159.6333.810.212N-甲基-L-天冬氨酸127.5960.520.47>100N-甲基-D-天冬氨酸---N-甲基吡咯烷酮---西维因---
注:“-”代表该参数未能检测出
3 结论
肌氨酸氧化酶在临床诊断和食品工业领域虽已有应用,但热稳定性不高、底物谱窄依然是限制其拓展应用领域的重要因素。本研究中,我们首先对来源于古生菌Archaea HR32的新型肌氨酸氧化酶做了生物信息学分析,获得了分子质量、疏水性、结构域等基本信息,之后在B.subtilis WB600中实现了该酶的可溶性表达,经热处理和镍柱亲和层析获得了纯酶。酶学性质表征结果显示,重组蛋白rSOX的最适温度为70 ℃,Tm和ΔH分别为92.13 ℃和1 070 kJ/mol,80 ℃下半衰期为12 h,30 ℃下半衰期为26 d,表现出极好的热稳定性。同时发现,rSOX的最适pH值为8.0,Ca2+、K+、Al3+和Mg2+的添加对酶活力有明显促进作用,对多数有机溶剂表现出较强的耐受性。此外还发现rSOX对多种N-甲基氨基酸类底物均具有催化作用,底物谱宽泛,且对N-甲基-L型底物表现出显著的手性选择性。温和条件下的去N-甲基化反应在化学上一直是个难题[9],古生菌来源的rSOX所具备的上述这些显著性特征将推进酶法去N-甲基化的相关研究。
同时我们要看到,对rSOX的研究还存在一些问题,如可溶性表达量低满足不了大规模应用的需求、针对非N-甲基氨基酸类底物不显催化活性,今后的研究将着重解决上述2个问题。从蛋白质结构与功能的关系出发,通过定点突变的方法对某些关键位点的氨基酸进行更改可有效解决可溶性表达差、催化活性低的问题[9,26]。后续拟在前期构建好的rSOX的三级结构模型(图2-c)的基础上,尝试对rSOX的关键位点进行理性改造以达到我们的预期效果。此外可考虑通过发酵培养基和发酵工艺优化的方法提高rSOX的产量,本研究中使用的培养基为常见的TB培养基,并且尚未对发酵条件如诱导剂添加量、诱导温度等进行优化,经发酵优化后rSOX的产量有望再上一个台阶。
[1] CALISKAN S, YILDIRIM E, ANAKOK A, et al.Design of a new biosensor platform for creatinine determination[J].Journal of Solid State Electrochemistry, 2022:1-9.
[2] ZERAVIK J, FOHLEROVA Z, MILOVANOVIC M, et al.Various instrumental approaches for determination of organic acids in wines[J].Food Chemistry, 2016, 194:432-440.
[3] ![]() R, UKROPCOV
R, UKROPCOV D,
D, ![]() M, et al.Multienzymatic amperometric biosensor based on gold and nanocomposite planar electrodes for glycerol determination in wine[J].Analytical Biochemistry, 2012, 421(1):256-261.
M, et al.Multienzymatic amperometric biosensor based on gold and nanocomposite planar electrodes for glycerol determination in wine[J].Analytical Biochemistry, 2012, 421(1):256-261.
[4] 邓永飞, 刘涛, 吴海铨, 等.食品工业废水处理技术研究进展[J].工业水处理, 2021, 41(10):1-7;13.
DENG Y F, LIU T, WU H Q, et al.Research progress of wastewater treatment technology in food industry[J].Industrial Water Treatment, 2021, 41(10):1-7;13.
[5] MATSUDA Y, HOSHIKA H, INOUYE Y, et al.Purification and characterization of sarcosine oxidase of Bacillus origin[J].Chemical and Pharmaceutical Bulletin, 1987, 35(2):711-717.
[6] SUZUKI M.Purification and some properties of sarcosine oxidase from Corynebacterium sp.U-96[J].The Journal of Biochemistry, 1981, 89(2):599-607.
[7] 辛瑜,张梁.一种重组枯草芽孢杆菌细胞在酶法生物降解N-甲基有机氮农药中的应用:中国,CN202010020741.1[P].2020-05-08.
XIN Y, ZHANG L.Application of recombinant subcorporea cells in enzymatic biodegradable N-methyl organic nitrogen pesticides:China, CN202010020741.1[P].2020-05-08.
[8] TURNER P, MAMO G, KARLSSON E N.Potential and utilization of thermophiles and thermostable enzymes in biorefining[J].Microbial Cell Factories, 2007, 6(1):1-23.
[9] XIN Y, HAO M Y, FAN G M, et al.Soluble expression of Thermomicrobium roseum sarcosine oxidase and characterization of n-demethylation activity[J].Molecular Catalysis, 2019, 464:48-56.
[10] SAITO M, ITOH A, SUZUKI H.Deuterium kinetic isotope effects in heterotetrameric sarcosine oxidase from Corynebacterium sp.U-96:The anionic form of the substrate in the enzyme-substrate complex is a reactive species[J].The Journal of Biochemistry, 2012, 151(6):633-642.
[11] HASSAN-ABDALLAH A, ZHAO G H, ESCHENBRENNER M, et al.Cloning, expression and crystallization of heterotetrameric sarcosine oxidase from Pseudomonas maltophilia[J].Protein Expression and Purification, 2005, 43(1):33-43.
[12] INOUYE Y, NISHIMURA M, MATSUDA Y, et al. Purification and characterization of sarcosine oxidase of Streptomyces origin[J].Chemical & Pharmaceutical Bulletin, 1987, 35(10):4 194-4 202.
[13] WANG Q, XIN Y, YANG H, et al.Deflavination of Bacillus sp. sarcosine oxidase and reconstitution of flavoproteins[J].Journal of Food Science and Biotechnology, 2018, 37(9):909-914.
[14] LIU H, SUN G, MA X, et al.Purification and characterization of a sarcosine oxidase from Bacillus sp. BSD-8[J].Chinese Journal of Biotechnology, 2010, 26(3):335-340.
[15] OGUSHI S, NAGAO K, EMI S, et al.Sarcosine oxidase from Arthrobacter ureafaciens:Purification and some properties[J].Chemical and Pharmaceutical Bulletin, 1988, 36(4):1 445-1 450.
[16] 郑梦玲. 嗜热玫瑰红球菌肌氨酸氧化酶表达、结构及功能研究[D].无锡:江南大学, 2018.
ZHENG M L.Study on expression, structure and function of Thermomicrobium roseum SOX[D].Wuxi:Jiangnan University, 2018.
[17] GUO K P, MA X H, SUN G Q, et al.Expression and characterization of a thermostable sarcosine oxidase (SOX) from Bacillus sp.in Escherichia coli[J].Applied Microbiology and Biotechnology, 2006, 73(3):559-566.
[18] SCHRIEVER K, SAENZ-MENDEZ P, RUDRARAJU R S, et al.Engineering of ancestors as a tool to elucidate structure, mechanism, and specificity of extant terpene cyclase[J].Journal of the American Chemical Society, 2021, 143(10):3 794-3 807.
[19] KIM J M, SHIMIZU S, YAMADA H.Crystallization and characterization of sarcosine oxidase from Alcaligenes denitrificans subsp. denitrificans[J].Agricultural and Biological Chemistry, 1987, 51(4):1 167-1 168.
[20] PUNDIR C, CHAUHAN N, KUMARI G, et al.Immobilization of Arthrobacter sarcosine oxidase onto alkylamine and arylamine glass and its application in serum sarcosine determination[J].Indian Journal of Biotechnology, 2011, 10(2):219-223.
[21] XIN Y, ZHENG M, WANG Q, et al.Structural and catalytic alteration of sarcosine oxidase through reconstruction with coenzyme-like ligands[J].Journal of Molecular Catalysis B:Enzymatic, 2016, 133:S250-S258.
[22] 林荣, 宋祖坤, 张玲, 等.FAD为辅基的葡萄糖脱氢酶发酵、纯化及酶学性质[J].食品与生物技术学报, 2020, 39(2):104-111.
LIN R, SONG Z K, ZHANG L, et al.Enzyme characterization, fermentation and purification for FAD-conjugated glucose dehydrogenase[J].Journal of Food Science and Biotechnology, 2020, 39(2):104-111.
[23] ZHENG M L, HAO M Y, FAN G M, et al.Preparation, reconstruction, and characterization of a predicted Thermomicrobium roseum sarcosine oxidase[J].Molecular Catalysis, 2018, 455:132-142.
[24] GAO J X, OU X Y, XU P, et al.Cloning, overexpression, and characterization of a novel organic solvent-tolerant lipase from Paenibacillus pasadenensis CS0611[J].Chinese Journal of Catalysis, 2018, 39(5):937-945.
[25] 仝艳军, 辛瑜, 杨海麟, 等.肌氨酸氧化酶的酶学性质及失活机理[J].食品与生物技术学报, 2015, 34(12):1 239-1 247.
TONG Y J, XIN Y, YANG H L, et al.On the enzymatic properties and deactivation mechanism of sarcosine oxidase[J].Journal of Food Science and Biotechnology, 2015, 34(12):1 239-1 247.
[26] 高秋月. 嗜热玫瑰红球菌肌氨酸氧化酶的表达优化及催化Loop域的改造研究[D].无锡:江南大学, 2021.
GAO Q Y.Optimization of expression and modification of the catalytic loop domain of Thermomicrobium roseum sarcosine oxidase[D].Wuxi:Jiangnan University, 2021.