人体肠道菌群失调可能引起炎症性肠病、结直肠癌等代谢疾病[1]。大量临床试验表明,摄入益生菌和益生元具有预防和治疗多种人体常见病症的功能[2]。然而,益生菌进入肠道发挥益生作用需要克服胃酸、胆盐及各种胃肠道消化酶,同时应具备高存活率和强定植力的特性[3]。相较而言,益生元是一种不可消化的化合物,通过肠道微生物的代谢,调节肠道菌群的组成和/或活性,从而对宿主产生有益的生理影响[4]。因此,益生元的开发和应用更具普适性。
目前被证实的益生元物质的主要成分是不可消化的碳水化合物,例如功能性低聚糖、多糖类和天然植物提取物。SARIKAYA等[5]研究发现肠道微生物悬浮液可以发酵利用菊粉并促进乳酸杆菌和双歧杆菌的生长;SZO TYSIK等[6]研究表明密刺蔷薇提取物干粉能提高酸奶中益生菌含量。这些糖类能被益生菌特异表达的转运体或酶结合、摄取或利用,因此能选择性地促进益生菌的生长。然而,现有的益生元物质大都不含蛋白质来源。研究表明,蛋白质及某些氨基酸是肠道菌群重要的氮源和生长因子,因为摄入的蛋白质大多数被小肠吸收,导致结肠中氨基酸缺乏,从而限制益生菌的增殖[7]。2019年,SEIFERT等[8]基于化疗的主动靶向性首次提出蛋白质-寡糖美拉德反应产物(Maillard reaction products,MRPs)作为蛋白源益生元物质的构想并证明乳铁蛋白和低聚半乳糖MRPs干粉对干酪乳杆菌具有促生长作用。因此,通过美拉德反应(Maillard reaction,MR)开发蛋白源益生元物质是益生元研究的新方向。研究表明,乳蛋白及其多肽能显著促进双歧杆菌和乳酸杆菌的生长,乳蛋白的降解能产生益生菌生长必需的氨基酸,如亮氨酸、半胱氨酸、色氨酸和酪氨酸等[9]。蛋白质被MR修饰后在胃肠中的消化性显著降低,大部分MRPs不能被前端消化系统吸收而仅能被结肠微生物降解利用[10]。MR程度受还原糖浓度、温度和时间等因素的影响。同时,在热处理过程中乳脂肪发生脂肪氧化或分解,可能会对MR程度造成一定的影响。如果MR控制不当,5-羟甲基糠醛(5-hydroxymethylfurfural,5-HMF)等危害物过量生成,MRPs会引起强烈致癌的潜在食品安全风险[11]。本研究以脱脂牛乳为原料,系统优化了脱脂牛乳体系中美拉德反应产物(skim milk system-MRPs,SMS-MRPs)制备条件,获得SMS-MRPs冻干粉,分析5-HMF的含量,研究其浓度对4株测试乳酸菌的生长曲线、活菌数、菌体干重和产酸能力的影响,系统分析SMS-MRPs对4株测试菌的促生效果。以期为SMS-MRPs与肠道菌群体内试验的开展奠定理论基础,为评估其益生潜力提供数据支撑。
TYSIK等[6]研究表明密刺蔷薇提取物干粉能提高酸奶中益生菌含量。这些糖类能被益生菌特异表达的转运体或酶结合、摄取或利用,因此能选择性地促进益生菌的生长。然而,现有的益生元物质大都不含蛋白质来源。研究表明,蛋白质及某些氨基酸是肠道菌群重要的氮源和生长因子,因为摄入的蛋白质大多数被小肠吸收,导致结肠中氨基酸缺乏,从而限制益生菌的增殖[7]。2019年,SEIFERT等[8]基于化疗的主动靶向性首次提出蛋白质-寡糖美拉德反应产物(Maillard reaction products,MRPs)作为蛋白源益生元物质的构想并证明乳铁蛋白和低聚半乳糖MRPs干粉对干酪乳杆菌具有促生长作用。因此,通过美拉德反应(Maillard reaction,MR)开发蛋白源益生元物质是益生元研究的新方向。研究表明,乳蛋白及其多肽能显著促进双歧杆菌和乳酸杆菌的生长,乳蛋白的降解能产生益生菌生长必需的氨基酸,如亮氨酸、半胱氨酸、色氨酸和酪氨酸等[9]。蛋白质被MR修饰后在胃肠中的消化性显著降低,大部分MRPs不能被前端消化系统吸收而仅能被结肠微生物降解利用[10]。MR程度受还原糖浓度、温度和时间等因素的影响。同时,在热处理过程中乳脂肪发生脂肪氧化或分解,可能会对MR程度造成一定的影响。如果MR控制不当,5-羟甲基糠醛(5-hydroxymethylfurfural,5-HMF)等危害物过量生成,MRPs会引起强烈致癌的潜在食品安全风险[11]。本研究以脱脂牛乳为原料,系统优化了脱脂牛乳体系中美拉德反应产物(skim milk system-MRPs,SMS-MRPs)制备条件,获得SMS-MRPs冻干粉,分析5-HMF的含量,研究其浓度对4株测试乳酸菌的生长曲线、活菌数、菌体干重和产酸能力的影响,系统分析SMS-MRPs对4株测试菌的促生效果。以期为SMS-MRPs与肠道菌群体内试验的开展奠定理论基础,为评估其益生潜力提供数据支撑。
1 材料与方法
1.1 材料与试剂
副干酪乳杆菌L9(Lactobacillus paracasei L9)、鼠李糖乳杆菌G5(Lactobacillus rhamnosus G5)、罗伊氏乳杆菌G8(Lactobacillus royi G8)、嗜热链球菌Q2(Streptococcus thermophilus Q2)由甘肃农业大学食品科学与工程学院分离鉴定并保存;鲜牛奶,甘肃农业大学牛奶厂;市售褐色酸乳,当地超市购买;MRS培养基、GM17培养基,按实验室配方配制;无菌培养皿、96孔板,常德比克曼生物科技有限公司;5-HMF标准品,上海麦克林生化科技有限公司;D(+)-无水葡萄糖(分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
MCCWV1型乳成分分析仪,杭州麦力斯科技有限公司;SPectramax M2型酶标仪,美国美谷分子仪器有限公司;Ultimate 3000 高效液相色谱仪,美国Thermo Scientific公司;SCIENTZ-10 ND型真空冷冻干燥机,宁波新芝生物科技股份有限公司;TGL-29型高速台式冷冻离心机,长沙湘仪离心机仪器有限公司;RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂;TU-1810型紫外可见分光光度计,北京普析通用仪器有限责任公司;SW-CJ-2FD型超净工作台,苏州净化设备有限公司。
1.3 实验方法
1.3.1 脱脂牛乳制备
新鲜生牛乳(蛋白质3.02%;乳糖4.55%;脂肪3.63%)(质量分数)通过4层纱布过滤除杂,然后分装调平离心处理(5 000 r/min,4 ℃,20 min),纱布过滤截留上层脂肪凝块,收集下层脱脂乳(蛋白质3.22%;乳糖4.78%;脂肪0.00%)(质量分数),4 ℃下保存备用。
1.3.2 中间产物和褐变程度的测定
参考JIANG等[12]的方法完成。用蒸馏水将20 μL反应液稀释360倍,在294 nm处测定紫外吸光值,代表中间产物含量;移取200 μL反应液,用蒸馏水稀释36倍,在420 nm处测定吸光值,代表褐变程度。
1.3.3 单因素对脱脂牛乳MR程度的影响
用1 mol/L NaOH溶液调脱脂牛乳pH至9.0[13](预实验得出此碱性环境下MR程度最优)。在反应温度90 ℃,反应时间120 min下,考察葡萄糖质量浓度(0、15.0、30.0、60.0、90.0 g/L)对MR程度的影响;在葡萄糖质量浓度30.0 g/L,反应时间120 min下,考察反应温度(80、85、90、95、100 ℃)对MR程度的影响;在葡萄糖质量浓度30.0 g/L,反应温度90 ℃下,考察反应时间(60、90、120、150、180 min)对MR程度的影响。
1.3.4 响应面优化试验
在单因素试验基础上,应用Box-Behnken Design设计三因素三水平的响应面优化试验,因素与水平的具体参数见表1。
表1 响因面优化试验因素水平编码表
Table 1 Codes levels and corresponding actual levels of independent variables used for response surface analysis
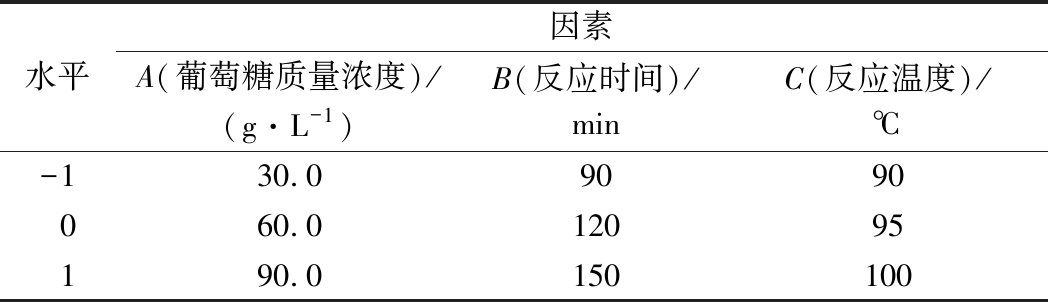
水平因素A(葡萄糖质量浓度)/(g·L-1)B(反应时间)/minC(反应温度)/℃-130.09090060.012095190.0150100
1.3.5 SMS-MRPs干粉制备
优化工艺下制备脱脂牛乳反应液,待冰水冷却后反应液经旋转蒸发(50 ℃,45 r/min)至原体积的1/4,真空冷冻干燥处理24 h得SMS-MRPs冻干粉,密封后放入干燥器内备用。
1.3.6 5-HFM含量的测定
参照 NY/T 1332—2007 《乳与乳制品中 5-羟甲基糠醛含量的测定 高效液相色谱法》完成生牛乳、SMS-MRPs干粉及市售褐色酸乳中5-HMF含量的测定。
1.3.7 菌种活化
移取10 mL液体培养基至具塞试管,密封后放入灭菌锅灭菌(0.1 MPa,121 ℃,20 min)。待冷却至室温,在超净工作台中将200 μL脱脂乳甘油保存的菌液接入试管并密封,37 ℃恒温培养12 h或16 h,重复上述步骤将菌液活化3代后使用。副干酪乳杆菌L9、鼠李糖乳杆菌G5和罗伊氏乳杆菌G8采用MRS培养基培养,嗜热链球菌Q2采用GM17培养基培养。
1.3.8 SMS-MRPs对乳酸菌生长的影响
参考DE A MØLLER等[14]的方法并作修改。移取20 mL液体培养基至具塞试管,密封后放入灭菌锅灭菌。待冷却后,在超净工作台中将SMS-MRPs冻干粉按不同添加量(0、0.5、0.9、1.8、3.7、7.5、15 g/L)加入试管并涡旋溶解。分别移取10 μL菌液和250 μL 含不同浓度SMS-MRPs的液体培养基至96孔板,以未添加SMS-MRPs的液体培养基作对照;在650 nm(200~800 nm扫描得出,此波长下各浓度SMS-MRPs溶液紫外吸收较弱)下用酶标仪测吸光值,测定间隔为2 h,测前微摇30 s,测定过程中确保无杂菌污染。
1.3.9 SMS-MRPs对活菌数的影响
参照 GB 4789.2—2016 《食品微生物学检验 菌落总数测定》的方法。根据1.3.8选定7.5、15.0 g/L作为测试质量浓度。移取9 mL液体培养基至具塞试管,密封后放入灭菌锅灭菌。待冷却后,在超净工作台中将SMS-MRPs冻干粉按7.5、15.0 g/L的添加量加入试管并涡旋溶解。移取1 mL菌液至试管混匀,以未添加SMS-MRPs的液体培养基作对照,密封后37 ℃恒温培养至对数生长末期。取菌液梯度稀释后,用倾注法倒平板,37 ℃恒温培养48 h后测算活菌数。在10-7稀释度下,4株菌的活菌数均在适宜计数范围。
1.3.10 SMS-MRPs对菌体干重的影响
参考XU等[15]的方法并作修改。根据1.3.8选定3.7、7.5 g/L作为测试质量浓度。移取10 mL液体培养基至具塞试管,密封后放入灭菌锅灭菌。待冷却后,在超净工作台中将SMS-MRPs冻干粉按3.7、7.5 g/L的添加量加入试管并涡旋溶解。移取200 μL菌液至试管混匀,以未添加SMS-MRPs的液体培养基作对照,密封后恒温振荡培养(37 ℃,200 r/min)至对数生长末期,菌液离心处理(8 000 r/min,4 ℃,15 min),弃上清液,菌体用磷酸盐缓冲液(10 mmol/L,pH 8.0)重悬洗涤离心3次,冷冻干燥后称重。
1.3.11 SMS-MRPs对菌株产酸能力的影响
参考张宸瑞等[16]的方法并作修改。根据1.3.8选定7.5 g/L作为测试质量浓度。移取10 mL液体培养基至具塞试管,密封后放入灭菌锅灭菌。待冷却后,在超净工作台中将SMS-MRPs冻干粉按7.5 g/L的添加量加入试管并涡旋溶解。移取200 μL菌液至试管混匀,以未添加SMS-MRPs的液体培养基作对照,密封后恒温振荡培养(37 ℃,200 r/min)16 h,每2 h取菌液检测酸度。
1.3.12 数据分析
上述测定至少重复3次,全部数据采用Excel 2016计算平均值和标准误,采用SPSS 26.0完成Duncan′s显著性分析,响应面试验设计与分析通过Design Expert 10.0.7完成。
2 结果与分析
2.1 单因素试验结果分析
294、420 nm处吸光值分别代表5-HMF等中间产物和类黑精等终产物的含量。由图1-a可知,葡萄糖能显著提高中间产物和类黑精的产量(P<0.05),同时类黑精受葡萄糖质量浓度的影响更明显,呈先升高后下降的趋势。原因是加入葡萄糖构成了反应体系的“拥挤效应”,但浓度过高会降低反应体系的流动性[17]。葡萄糖质量浓度为60 g/L时,中间产物和类黑精的产量均较高,故葡萄糖质量浓度确定为60 g/L。由图1-b可知,中间产物与类黑精的产量随反应时间的延长整体呈显著增加的趋势(P<0.05),但反应150 min时,中间产物降至最低点,延长至180 min,MRPs产量显著增加(P<0.05)。原因是提高MR的连续性有利于中间产物向终产物的转化和积累。但时间过长造成能耗成本增大,故反应时间选择120 min。如图1-c所示,中间产物与类黑精的产量随反应温度的升高整体均显著上升(P<0.05),但反应温度为90 ℃时,褐变程度显著下降(P<0.05),随后MRPs产量显著上升(P<0.05)。原因是温度升高逐渐加剧蛋白质向亚基或多肽解离的程度,可为葡萄糖提供更多的结合位点。反应温度为95 ℃时,MRPs产量较高且平稳上升,故反应温度选择95 ℃。同时,随葡萄糖质量浓度增大、反应时间延长和反应温度升高,体系pH显著下降(P<0.05)。原因是碱性环境加剧了MR,羰基消耗大量氨基,并且体系pH接近中性,使中间产物优先转化为甲酸、乙酸、羟甲基糠醛等酸性物质[18]。该结果与倪孔巍等[13]和依胜男等[19]的研究结果类似。
2.2 MRPs制备条件优化结果
2.2.1 响应面试验设计及回归模型的建立
以单因素试验结果为基础(选取的因素水平下,中间产物和褐变程度整体的变化趋势一致),确定褐变程度作为响应值,使用Design-Expert 10.0.7软件设计三因素三水平的响应面试验,结果见表2。
对表2数据进行分析,得到褐变程度的二次多项回归方程为Y=0.84-0.014A-0.025B-0.031C+0.035AB-0.017AC+0.047BC-0.070A2-0.011B2-0.15C2。

a-葡萄糖质量浓度;b-反应时间;c-反应温度
图1 葡萄糖质量浓度、反应时间和反应温度对MR程度及体系pH的影响
Fig.1 Effect of glucose concentration, reaction temperature, and reaction time on MR degree and system pH
注:不同小写字母表示差异显著(P<0.05)(下同)
表2 响应面优化试验设计及结果
Table 2 Response surface optimization design and results

试验号A(葡萄糖质量浓度)/(g·L-1)B(反应时间)/minC(反应温度)/℃Y(褐变程度)101-10.56620000.85730000.82740000.8635-1010.64660000.83871010.5658-1100.6069-10-10.6511010-10.638110000.829120-110.519131-100.658140-1-10.69915-1-100.737160110.575171100.666
由表3可知,该优化模型极显著(P<0.000 1),失拟项不显著![]() 表示模型拟合程度较高,可以很好地分析预测各因素与褐变程度之间的关系。该模型中一次项B和交互项AB对褐变程度的影响显著(P<0.05),一次项C、交互项BC和二次项A2、B2、C2对褐变程度的影响极显著(P<0.01),因此,其对模型贡献大。根据F值得出各因素对脱脂牛乳体系中褐变程度的影响依次为:C(反应温度)>B(反应时间)>A(葡萄糖质量浓度)。
表示模型拟合程度较高,可以很好地分析预测各因素与褐变程度之间的关系。该模型中一次项B和交互项AB对褐变程度的影响显著(P<0.05),一次项C、交互项BC和二次项A2、B2、C2对褐变程度的影响极显著(P<0.01),因此,其对模型贡献大。根据F值得出各因素对脱脂牛乳体系中褐变程度的影响依次为:C(反应温度)>B(反应时间)>A(葡萄糖质量浓度)。
表3 回归方程方差分析表
Table 3 Variance analysis table of regression equation

项目平方和自由度均方F值P值显著性模型0.205 390.022 851.143<0.000 1∗∗A0.001 610.001 63.5790.100 4B0.005 010.005 011.2120.012 3∗C0.007 810.007 817.3790.004 2∗∗AB0.004 810.004 810.8320.013 3∗AC0.001 210.001 22.5920.151 4BC0.008 910.008 920.0260.002 9∗∗A20.020 910.020 946.7960.000 2∗∗B20.047 010.047 0105.391<0.000 1∗∗C20.091 510.091 5205.144<0.000 1∗∗残差0.003 170.000 4失拟项0.002 030.000 72.5460.194 2净误差0.001 140.000 3总离差0.208 416
注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05)
2.2.2 响应面试验设计及回归模型的建立
响应曲面越陡表明其自变量间对响应值的影响越大。通过分析图2可知,交互项BC的曲面弧度较陡,表明反应时间(B)和反应温度(C)的交互作用对褐变程度的影响最显著,与方差分析结果一致。
2.2.3 最优工艺的预测及验证
由表4可知,通过回归模型预测的最优值为葡萄糖质量浓度56.22 g/L,反应时间114.998 min,反应温度94.774 ℃,此时褐变程度为0.848。结合实际情况,将各参数调整为葡萄糖质量浓度60.0 g/L,反应温度95 ℃,反应时间120 min,在此条件下重复3次试验,得褐变吸光值为0.843,证实了该模型的可靠性。
2.3 各样品中5-HFM含量分析
由表5可知,生牛乳、SMS-MRPs干粉及市售褐色酸乳的加标回收率分别为75.0%、98.8%、100.7%,并且这3种样品中5-HMF含量的相对标准偏差均<5%,说明检测结果较可靠。同时,生牛乳中的含量低于检出限,SMS-MRPs干粉中5-HMF的含量为(8.40±0.64) mg/L,市售褐色酸乳的5-HMF含量为(10.31±0.85) mg/L。SMS-MRPs干粉中5-HMF含量低于市售褐色酸奶,同时低于儿童果汁中5-HMF强制性标准20 mg/L与建议标准5~10 mg/L[20]。因此,SMS-MRPs干粉是符合安全标准的。

a-反应时间与葡萄糖质量浓度;b-反应温度与葡萄糖质量浓度;c-反应温度与反应时间
图2 各因素交互作用对褐变程度的影响
Fig.2 Effect of interaction of factors on browning degree
表4 响应面优化结果
Table 4 Response surface optimization results

葡萄糖质量浓度/(g·L-1)反应时间/min反应温度/℃目标优化值验证值56.22114.99894.7740.8480.843
表5 各样品中5-HMF含量测定结果
Table 5 Results of the determination of 5-HMF content in each sample

样品本底值/(mg·L-1)加标量/(mg·L-1)加标后测定值/(mg·L-1)回收率/%相对标准偏差/%生牛乳未检出0.30.23±0.0175.04.68SMS-MRPs干粉8.40±0.649.017.29±0.5298.82.99市售褐色酸乳10.31±0.859.019.37±0.92100.74.74
2.4 MRPs对乳酸菌生长趋势的影响
由图3-a可知,SMS-MRPs质量浓度为0.5 g/L时,对副干酪乳杆菌L9生长的促进作用不显著(P>0.05),而质量浓度达到15.0 g/L时,其OD650峰值为1.206,较对照组的OD650峰值0.521显著上升(P<0.05)。如图3-b所示,SMS-MRPs质量浓度为15.0 g/L时,鼠李糖乳杆菌G5在8 h进入稳定期,此时OD650值是1.539,较对照组14 h的OD650峰值0.626显著上升(P<0.05)。由图3-c可知,SMS-MRPs质量浓度为15.0 g/L时,罗伊氏乳杆菌G8在8 h进入稳定期,其OD650值为1.589,较对照组10 h的OD650峰值0.555显著升高(P<0.05)。如图3-d所示,SMS-MRPs质量浓度为0.5 g/L时,嗜热链球菌Q2的OD650值已整体高于对照组,当SMS-MRPs质量浓度为15.0 g/L时,嗜热链球菌Q2的OD650峰值1.534是对照组OD650峰值0.541的近3倍(P<0.05)。结果表明,SMS-MRPs的促生长作用随浓度的增大而显著增强,嗜热链球菌Q2对SMS-MRPs的益生刺激较敏感,且SMS-MRPs加快了鼠李糖乳杆菌G5和罗伊氏乳杆菌G8的生长速度。该结果与SEIFERT等[8]发现乳铁蛋白水解物和半乳糖寡糖制备的MRPs干粉具有良好的模拟胃肠通过率且添加到培养基能显著促进干酪乳杆菌的生长,其生长速度是单独添加乳铁蛋白水解物或半乳糖寡糖生长速度的2倍的研究结果相似。
2.5 活菌数的分析
由表6可知,SMS-MRPs质量浓度为15.0 g/L时,副干酪乳杆菌L9的活菌数(1.076×109 CFU/mL)较对照组的活菌数(4.53×108 CFU/mL)增加1个数量级(P<0.05),7.5 g/L的SMS-MRPs添加量对副干酪乳杆菌L9生长的促进作用不显著(P>0.05)。鼠李糖乳杆菌G5的SMS-MRPs处理组的活菌数均高于对照组,且质量浓度为15.0 g/L的活菌数(1.240×109 CFU/mL)比对照组的活菌数(6.20×108 CFU/mL)增加1个数量级(P<0.05)。罗伊氏乳杆菌G8的SMS-MRPs处理组的活菌数分别为9.13×108、1.313×109 CFU/mL,均显著高于对照组活菌数(4.83×108 CFU/mL)(P<0.05),且SMS-MRPs处理组间的活菌数差异显著(P<0.05)。嗜热链球菌Q2的SMS-MRPs处理组的活菌数分别为1.386×109、9.85×108 CFU/mL(P<0.05),较对照组的活菌数5.43×108 CFU/mL均显著增长(P<0.05)。结果表明,SMS-MRPs对4株乳酸菌的活菌数具有显著的增殖作用,且SMS-MRPs的增殖效果随浓度的增大而增强。该结果与JIMÉNEZ-ZAMORA等[21]发现咖啡中不同分子质量的MRPs成分均表现出益生元活性,其中质量浓度为1、10 g/L的咖啡类黑精显著增加了乳酸杆菌和双岐杆菌活菌数的研究结果类似。

a-副干酪乳杆菌L9;b-鼠李糖乳杆菌G5;c-罗伊氏乳杆菌G8;d-嗜热链球菌Q2
图3 SMS-MRPs对副干酪乳杆菌L9、鼠李糖乳杆菌G5、罗伊氏乳杆菌G8和嗜热链球菌Q2生长的影响
Fig.3 Effects of SMS-MRPs on the growth of Lactobacillus paracasei L9, Lactobacillus rhamnosus G5, Lactobacillus royi G8, and Streptococcus thermophilus Q2
表6 SMS-MRPs对4株乳酸菌活菌数的影响 单位:108 CFU/mL
Table 6 Effect of SMS-MRPs on viable counts of four lactic acid bacteria

菌种0 g/L MRPs7.5 g/L MRPs15.0 g/L MRPs副干酪乳杆菌L94.53±1.25b6.80±0.85b10.76±2.20a鼠李糖乳杆菌G56.20±2.42b8.86±1.21ab12.40±2.33a罗伊氏乳杆菌G84.83±0.70c9.13±2.00b13.13±1.79a嗜热链球菌Q2 5.43±1.80c9.85±1.40b13.86±2.12a
注:不同小写字母表示差异显著(P<0.05)
2.6 菌体干重的分析
如图4所示,SMS-MRPs质量浓度为3.8、7.5 g/L时,副干酪乳杆菌L9、鼠李糖乳杆菌G5、罗伊氏乳杆菌G8和嗜热链球菌Q2的菌体干重较对照组均显著增大,副干酪乳杆菌L9的菌体干重分别增加了2.25倍(P<0.05)和1.55倍(P<0.05),鼠李糖乳杆菌G5的菌体干重分别增加了1.53倍(P<0.05)和1.35倍(P<0.05),罗伊氏乳杆菌G8的菌体干重分别增加了1.71倍(P<0.05)和1.43倍(P<0.05),嗜热链球菌Q2的菌体干重分别增加了3.13倍(P<0.05)和2.28倍(P<0.05)。同时,SMS-MRPs处理组之间菌体干重差异显著(P<0.05)。结果表明,乳酸菌可能具有降解利用SMS-MRPs作为碳源和氮源以促进其生长和代谢的能力。该结果与ZHANG等[22]发现大豆肽MRPs干粉具有显著改善肠道菌群组成和代谢水平的能力,益生菌可以利用其作为发酵底物,提高产短链脂肪酸(short chain fatty acids,SCFAs)细菌的丰度和多样性,从而显著增加SCFAs等菌体代谢物产量的结果类似。

图4 SMS-MRPs对4株乳酸菌菌体干重的影响
Fig.4 Effect of SMS-MRPs on dry weight of four lactic acid bacteria
2.7 产酸能力的分析
由图5可知,副干酪乳杆菌L9、鼠李糖乳杆菌G5和罗伊氏乳杆菌G8的SMS-MRPs处理组发酵液的pH较对照组未显著降低(P>0.05),而嗜热链球菌Q2的SMS-MRPs处理组发酵液的pH发酵6 h以后极显著地低于对照组(P<0.01)。结果表明,嗜热链球菌Q2能降解SMS-MRPs产生酸性物质,4株乳酸菌代谢SMS-MRPs产酸的能力存在差异,该结果与DELGADO-ANDRADE等[23]发现肠道微生物可以发酵利用MRPs及其不同分子质量的组分来显著提高甲酸、醋酸、丙酸和丁酸等酸性物质代谢水平的结果相似。同时,刘欣等[24]研究发现乳酸菌生成酸性代谢产物的种类和含量比例,与细菌种属遗传稳定性相关,并且不同乳酸菌发酵液中酸性物质的代谢量与乳酸菌的生长能力无直接相关性。综上,MRPs含有某些具备益生元效应的聚合物(类黑精等),其可以被结肠微生物作为碳源和氮源,促进乳酸菌生长,调节SCFAs的产生方式,发挥MRPs的益生元活性,但MRPs的复杂性导致其益生元活性不稳定[25]。所以,SMS-MRPs对肠道菌群的益生元效应还需进一步验证,应深入研究体内环境下SMS-MRPs与肠道菌群的量效、构效、组效及相互作用机制。
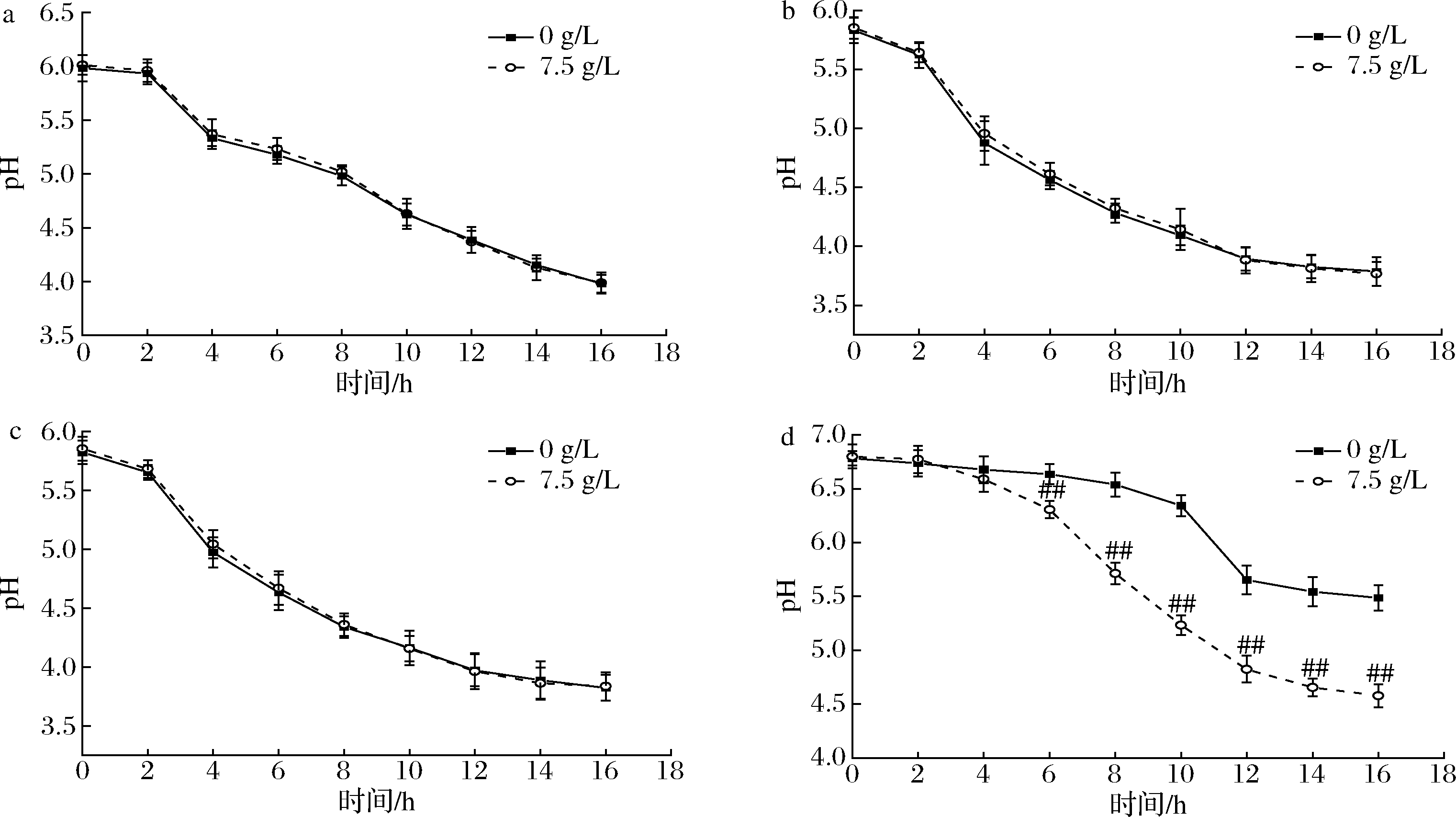
a-副干酪乳杆菌L9;b-鼠李糖乳杆菌G5;c-罗伊氏乳杆菌G8;d-嗜热链球菌Q2
图5 SMS-MRPs对副干酪乳杆菌L9、鼠李糖乳杆菌G5、罗伊氏乳杆菌G8和嗜热链球菌Q2产酸能力的影响
Fig.5 Effect of SMS-MRPs on acid production of Lactobacillus paracasei L9, Lactobacillus rhamnosus G5, Lactobacillus royi G8, and Streptococcus thermophilus Q2
注:#表示同一时间不同处理组间差异显著(P<0.05),##表示同一时间不同处理组间差异极显著(P<0.01)
3 结论
本研究通过单因素试验和响应面试验优化得出,脱脂牛乳体系中MR褐变程度的最优工艺参数是葡萄糖质量浓度60.0 g/L,反应时间120 min和反应温度95 ℃,此条件下SMS-MRPs积累最多且SMS-MRPs干粉中5-HMF的含量符合安全标准。SMS-MRPs添加量为7.5 g/L时,4株菌的菌体干重均显著大于对照组,仅嗜热链球菌Q2的产酸能力极显著提高。SMS-MRPs添加量为15.0 g/L时,4株菌的活菌数均显著增加,鼠李糖乳杆菌G5和罗伊氏乳杆菌G8的生长速度显著提升。SMS-MRPs表现出优良的增菌效果,乳酸菌降解利用SMS-MRPs能不同程度地促进其生长和代谢能力。SMS-MRPs具备开发为一种蛋白源益生元物质的潜在价值。
[1] NOGACKA A M, G MEZ-MART
MEZ-MART N M, SU
N M, SU REZ A, et al.Xenobiotics formed during food processing:Their relation with the intestinal microbiota and colorectal cancer[J].International Journal of Molecular Sciences, 2019, 20(8):2 051.
REZ A, et al.Xenobiotics formed during food processing:Their relation with the intestinal microbiota and colorectal cancer[J].International Journal of Molecular Sciences, 2019, 20(8):2 051.
[2] LAVELLE A, SOKOL H.Gut microbiota-derived metabolites as key actors in inflammatory bowel disease[J].Nature Reviews Gastroenterology & Hepatology, 2020, 17(4):223-237.
[3] YAO M F, WU J, LI B, et al.Microencapsulation of Lactobacillus salivarious Li01 for enhanced storage viability and targeted delivery to gut microbiota[J].Food Hydrocolloids, 2017, 72:228-236.
[4] BINDELS L B, DELZENNE N M, CANI P D, et al.Towards a more comprehensive concept for prebiotics[J].Nature Reviews Gastroenterology & Hepatology, 2015, 12(5):303-310.
[5] SARIKAYA H, ASLIM B, YUKSEKDAG Z.Assessment of anti-biofilm activity and bifidogenic growth stimulator (BGS) effect of lyophilized exopolysaccharides (l-EPSs) from Lactobacilli strains[J].International Journal of Food Properties, 2017, 20(2):362-371.
[6] SZO TYSIK M, KUCHARSKA A Z, SOK
TYSIK M, KUCHARSKA A Z, SOK
 -
-
![]() TOWSKA A, et al.The effect of Rosa spinosissima fruits extract on lactic acid bacteria growth and other yoghurt parameters[J].Foods, 2020, 9(9):1 167.
TOWSKA A, et al.The effect of Rosa spinosissima fruits extract on lactic acid bacteria growth and other yoghurt parameters[J].Foods, 2020, 9(9):1 167.
[7] MA N, TIAN Y N, WU Y, et al.Contributions of the interaction between dietary protein and gut microbiota to intestinal health[J].Current Protein and Peptide Science, 2017, 18(8):795-808.
[8] SEIFERT A, FREILICH S, KASHI Y, et al.Protein-oligosaccharide conjugates as novel prebiotics[J].Polymers for Advanced Technologies, 2019, 30(10):2 577-2 585.
[9] INAY O M, DA SILVA A S, HONJOYA E R, et al.Action of lactoferrin on the multiplication of Lactobacillus casei in vitro and in Minas fresh cheese[J].Semina:Ciências Agrárias, 2012, 33(Suppl 2):3 153-3 162.
[10] ALJAHDALI N, CARBONERO F.Impact of Maillard reaction products on nutrition and health:Current knowledge and need to understand their fate in the human digestive system[J].Critical Reviews in Food Science and Nutrition, 2019, 59(3):474-487.
[11] FARAG M R, ALAGAWANY M, BIN-JUMAH M, et al.The toxicological aspects of the heat-borne toxicant 5-hydroxymethylfurfural in animals:A review[J].Molecules, 2020, 25(8):1 941.
[12] JIANG W, CHEN Y X, HE X X, et al.A study of the tyramine/glucose Maillard reaction:Variables, characterization, cytotoxicity and preliminary application[J].Food Chemistry, 2018, 239:377-384.
[13] 倪孔巍, 张萌, 徐大伦, 等.花蟹肉酶解物美拉德反应产物的抗氧化性[J].食品与生物技术学报, 2015, 34(3):239-245.
NI K W, ZHANG M, XU D L, et al.Antioxidant activity of Maillard reaction products derived from enzymolysis product of Portunus pelagicus meat with reducing sugars[J].Journal of Food Science and Biotechnology, 2015, 34(3):239-245.
[14] DE A MØLLER C O, CHRISTENSEN B B, RATTRAY F P.Modelling the biphasic growth of non-starter lactic acid bacteria on starter-lysate as a substrate[J].International Journal of Food Microbiology, 2021, 337:108937.
[15] XU J, XIE Y C, PAUL N C, et al.Water sorption characteristics of freeze-dried bacteria in low-moisture foods[J].International Journal of Food Microbiology, 2022, 362:109494.
[16] 张宸瑞, 薛桥丽, 白彬阳, 等.云南牟定酸浆水中优势产酸菌的分离鉴定及生长特性[J].食品科学, 2021, 42(20):75-82.
ZHANG C R, XUE Q L, BAI B Y, et al.Isolation, identification and growth characteristics of dominant acid producing bacteria from fermented soy whey from sufu production in Mouding, Yunnan[J].Food Science, 2021, 42(20):75-82.
[17] CHENG Y H, MU D C, FENG Y Y, et al.Glycosylation of rice protein with dextran via the Maillard reaction in a macromolecular crowding condition to improve solubility[J].Journal of Cereal Science, 2022, 103:103374.
[18] WANG H X, YANG J T, YANG M, et al.Antioxidant activity of Maillard reaction products from a Yak casein-glucose model system[J].International Dairy Journal, 2019, 91:55-63.
[19] 依胜男, 芦晶, 逄晓阳, 等.热处理对牛乳美拉德反应程度及挥发性成分的影响[J].食品科学, 2021, 42(14):9-15.
YI S N, LU J, PANG X Y, et al.Effect of heat treatment on Maillard reaction degree and volatile components of milk[J].Food Science, 2021, 42(14):9-15.
[20] 薛瑞琪, 夏小乐.褐色发酵乳中5-羟甲基糠醛相关性分析及应用[J].食品与发酵工业, 2021, 47(19):79-83.
XUE R Q, XIA X L.Correlation analysis of 5-hydroxymethylfurfural in brown fermented milk[J].Food and Fermentation Industries, 2021, 47(19):79-83.
[21] JIMÉNEZ-ZAMORA A, PASTORIZA S, RUFI N-HENARES J A.Revalorization of coffee by-products.Prebiotic, antimicrobial and antioxidant properties[J].LWT-Food Science and Technology, 2015, 61(1):12-18.
N-HENARES J A.Revalorization of coffee by-products.Prebiotic, antimicrobial and antioxidant properties[J].LWT-Food Science and Technology, 2015, 61(1):12-18.
[22] ZHANG Z Y, HE S D, CAO X D, et al.Potential prebiotic activities of soybean peptides Maillard reaction products on modulating gut microbiota to alleviate aging-related disorders in D-galactose-induced ICR mice[J].Journal of Functional Foods, 2020, 65:103729.
[23] DELGADO-ANDRADE C, PASTORIZA DE LA CUEVA S, PEINADO M J, et al.Modifications in bacterial groups and short chain fatty acid production in the gut of healthy adult rats after long-term consumption of dietary Maillard reaction products[J].Food Research International, 2017, 100(Part 1):134-142.
[24] 刘欣, 陈梅春, 刘芸, 等.乳酸菌发酵过程发酵液脂肪酸组生态位的异质性[J].食品科学, 2021, 42(14):110-120.
LIU X, CHEN M C, LIU Y, et al.Heterogeneity of ecological niche for fatty acid lipidomics in fermentation broth during fermentation process of lactic acid bacteria[J].Food Science, 2021, 42(14):110-120.
[25] 欧阳宇, 赵扩权, 冯莹娜, 等.美拉德反应产物的生物学活性和潜在健康风险[J].食品科学, 2021, 42(17):350-362.
OUYANG Y, ZHAO K Q, FENG Y N, et al.A review of the biological activities and potential health risks of Millard reaction products[J].Food Science, 2021, 42(17):350-362.