虎奶菇(Pleurotus tuber-regium),是一种能产生大型菌核和子实体的食药用真菌,广泛分布于热带和亚热带地区,在我国江西、云南等地也有发现和种植。虎奶菇的子实体和菌核富含挥发油、氨基酸以及多糖类物质,在民间被用于治疗头痛、胃痛、哮喘、天花、高血压等多种疾病[1]。虎奶菇不同发育阶段的细胞壁组成及含量差异很大,其中菌核细胞壁含量高达(78.4±0.7)%干重,远高于菌丝体和子实体[2-4]。菌核细胞壁的主要成分为超支化β-葡聚糖,主要由β-1,4-D-Glcp主链和β-1,6-D-Glcp支链构成,并有少量β-1,3-D-Glcp残基存在于支链中,其分支位点主要在主链葡萄糖的O-6位,分支度从63%~70%不等[5]。作为一类特殊的β-葡聚糖,该多糖不仅有良好的膳食纤维和益生元功能,还具有免疫调节和直接杀伤肿瘤细胞的活性[6]。菌核良好的药理活性(如抗癌、免疫调节、抗炎等),也被认为与其特有的超支化β-1,4,6-葡聚糖含量高有关[7-8]。
菌核是真菌菌丝在缺乏营养或不利环境中继续分化形成的一种致密坚硬的休眠器官[9],具有抵御不良环境并贮存营养的功能。研究表明,食用菌的菌核可以在干旱、低温、微生物攻击等恶劣环境中休眠,并在适宜的环境下萌发形成菌丝或子实体[10]。目前,虎奶菇菌核的生成还是通过袋料培养,其具体的形成机制还不明确。由于生长缓慢(菌丝长满袋料后3个月左右)且对环境条件要求严苛[11],虎奶菇菌核发育的基础研究相对困难,菌核的人工栽培和代谢机制研究也受到了较大限制,这一现状也严重影响了其中超支化β-葡聚糖和糖蛋白等活性成分的研究与开发。因此,通过更为简便快捷的培养方式获得虎奶菇菌核,并解析影响菌核生成的关键因素,是深入开发虎奶菇菌核资源及其超支化β-葡聚糖等高附加值产品的基础。
本研究采用平板培养的方式,探索影响虎奶菇菌核生成的影响因素。首先,比较温度、pH等因素对虎奶菇菌核形成的影响,基于活性氧(reactive oxygen species ,ROS)诱发菌核生成理论测定胞内过氧化氢的变化,进而通过在培养基中添加过氧化氢和抗坏血酸探讨氧化剂和还原剂对虎奶菇细胞分化形成菌核的影响,结合实时荧光定量PCR(real-time quantitative polymerase chain reaction,RT-qPCR)验证过氧化氢在虎奶菇菌核形成中的作用。
1 材料与方法
1.1 试验材料
1.1.1 材料与试剂
虎奶菇(Pleurotus tuber-regium)菌种,香港中文大学Cheung, Chi Keung Peter教授赠予。培养基为PDA培养基(g/L):马铃薯:200、葡萄糖20、琼脂20;过氧化氢检测试剂盒(S0038)、过氧化氢酶检测试剂盒(S0051),上海碧云天生物技术有限公司;RNAprep Pure植物总RNA提取试剂盒,天根生化科技(北京)有限公司;PrimeScriptTMRT reagent Kit with gDNA Eraser,TaKaRa;ChamQTM Universal SYBR qPCR Master Mix,Vazyme。
1.1.2 仪器与设备
Enspire 2300型酶标仪,美国PerkinElmer公司;FA1004型电子天平,上海舜宇恒平科学仪器有限公司;SW-CJ-IF型超净工作台,苏州净化设备有限公司;LDZX-40BI型高压蒸汽灭菌锅,上海申安医疗器械厂;PB-10型pH计,季尔国际贸易上海有限公司;SPX-252B-Z型生化培养箱,上海博讯实业有限公司;StepOnePlus型实时荧光定量PCR仪,美国应用生物系统公司。
1.2 试验方法
1.2.1 虎奶菇菌丝体的培养
将虎奶菇菌种接种在PDA平板上,30 ℃恒温培养7 d,4 ℃保藏,定期进行转接。
1.2.2 菌核生成的影响
1.2.2.1 温度对虎奶菇菌核形成的影响
将虎奶菇菌种接种于PDA平板上,置于30 ℃培养7 d至菌丝长满平板,分别放置于15、20、25、30 ℃培养,观察菌核形成情况。
1.2.2.2 pH对虎奶菇菌核形成的影响
配制PDA培养基,分别用盐酸和氢氧化钠调节pH值为4、5、6、7、8、9。接种虎奶菇菌种,于30 ℃培养至菌丝长满平板,转至25 ℃培养,观察菌核形成情况,取培养30 d的菌丝和菌核测量过氧化氢含量和过氧化氢酶活力。
1.2.2.3 过氧化氢对虎奶菇菌核形成的影响
用无菌水将30%(体积分数)过氧化氢梯度稀释至1、10-1、10-2、10-3 mol/L,用0.22 μm微孔滤膜过滤除菌。配制PDA培养基,灭菌后冷却至65 ℃添加上述4种浓度的过氧化氢溶液至培养基中,使过氧化氢终浓度分别为10-2、10-3、10-4、10-5 mol/L,混合均匀后倒平板,冷却后接种虎奶菇菌种,于30 ℃培养至菌丝长满平板,转至25 ℃继续恒温培养,观察菌核形成情况,取培养30 d的菌丝和菌核测量过氧化氢含量和过氧化氢酶活力。
1.2.2.4 抗坏血酸对虎奶菇菌核形成的影响
用无菌水溶解抗坏血酸后,将质量浓度梯度稀释至0.3、0.1、0.01 g/L,用0.22 μm微孔滤膜过滤除菌。配制PDA培养基,灭菌后冷却至65 ℃添加上述抗坏血酸溶液,使抗坏血酸终质量浓度为0.003、0.001、0.000 1 g/L,混合均匀后倒平板,冷却后接种虎奶菇菌种,于30 ℃培养至菌丝长满平板,转至25 ℃继续恒温培养,观察菌核形成情况,取培养30 d的菌丝和菌核测量过氧化氢含量和过氧化氢酶活力。
1.2.3 测定指标及方法
1.2.3.1 菌丝生长速度测定
因前3 d菌丝主要处于萌发阶段,生长缓慢,因此从培养4 d后,每天采用十字交叉法测定菌落直径。根据公式(1)计算菌丝生长速度:
菌丝生长速度![]()
(1)
1.2.3.2 菌核形成量测定
观察菌核形成时间,对生长至30 d的培养皿进行拍照记录,用灭菌后的镊子挑取出平板上的菌核,并小心剥离去除菌核周围的菌丝,余下的致密坚硬部分即为菌核,进行称重测定。
1.2.3.3 过氧化氢含量及过氧化氢酶活力的测定
分别挑取各处理组中正在形成的菌核及其周边未分化的菌丝,参考过氧化氢检测试剂盒(S0038)、过氧化氢酶检测试剂盒(S0051)的使用说明,分别测定过氧化氢含量和过氧化氢酶的活力。
1.2.4 RT-qPCR验证
挑取培养基中含10-2 mol/L过氧化氢培养条件下的菌核和未分化的菌丝,按照RNAprep Pure植物总RNA提取试剂盒提取RNA,采用PrimeScriptTM RT reagent Kit with gDNA Eraser合成cDNA,候选基因和内参基因的引物采用Beacon Designer V7.9设计(表1),采用ChamQTM Universal SYBR qPCR Master Mix进行试验。具体条件:95 ℃变性30 s,95 ℃(10 s),60 ℃(1 min),循环40次。以18S基因为内参,通过2-ΔΔCT方法计算基因的相对表达量。
2 结果与分析
2.1 菌核形成的最适温度
菌核作为虎奶菇应对不良环境的休眠体,温度对其形成具有重要影响。通过前期温度对菌核形成的影响实验发现,30 ℃时菌丝长满平板的时间为7 d,25 ℃时菌丝长满平板为14 d左右,15 ℃及20 ℃下菌丝生长过于缓慢,需4周及以上。虎奶菇主要生长于热带和亚热带地区,其菌丝体适宜生长温度为 28~32 ℃,在平板培养和液态发酵时的最适温度为30 ℃[12]。因此,选择在30 ℃时待菌丝铺满平板,再分别置于30、25、20、15 ℃恒温培养箱中继续培养。由图1可知,30 ℃平板中有明显菌丝集结,25 ℃培养的平板中可见明显的小菌核生成,而20 ℃和15 ℃平板无明显菌丝聚集和菌核形成现象。分别挑取30 ℃和25 ℃培养出的菌核进行称量和观测,30 ℃培养的菌核产量[(30.19±3.32) mg]显著低于25 ℃培养时[(76.03±8.45) mg],且形成的菌核不如25 ℃时形成的致密。由于30 ℃为虎奶菇菌丝体生长的最适温度,更多的营养成分用于菌丝体的生长蔓延;而在25 ℃时,适当的低温胁迫促进了菌丝的分化,更利于菌核的形成。继续降低温度则会显著减缓菌丝的生长,其原因可能为温度降低后细胞内的各种酶活力也随之受到抑制,菌体代谢活动减弱,不利于菌核形成。因此,后续选择25 ℃作为菌核的培养条件,这与袋料培养阶段菌核最适宜的温度为23~28 ℃相吻合[11]。
表1 RT-qPCR的候选基因及内参基因
Table 1 Candidate genes and reference genes of RT-qPCR

目的基因基因功能引物名称引物序列(5′→3′)GME1020_gfungal-type cell wallGME1020_g-FCAACCCCATTTCTGTTATTGGME1020_g-RGAGACGATGCCATTGAATGME9903_gfungal-type cell wallGME9903_g-FGCAACAGCTCTCAAGATGGME9903_g-RGCCCAAGTGGACTATACCGME2693_gcatalaseGME2693_g-FTCCCATCTTCTTCATCAGGME2693_g-RCATCCTTCAAGTGAGTCTGME4097_gcatalaseGME4097_g-FTTATGCCGTCGTCACTACGME4097_g-RTTCCAATCTTCAATACCATCTTCGME7057_gmitogen-activated protein kinase 7GME7057_g-FCTTATTATCACGGATGCTATGME7057_g-RCAAGTATGGATGGTTCAGGME11266_gmitosis inhibitor protein kinase SWE1GME11266_g-FGTCTTCCTTACTGGCTCAAGME11266_g-RGCAACCTCCTCTTCCTTAT内参18S18S-FTAGAGTCGCCGTAATGAT18S-RGCAGTAGTTGGTCTTGAG

a-15 ℃;b-20 ℃;c-25 ℃;d-30 ℃
图1 温度对菌核形成的影响
Fig.1 The impact of temperature on sclerotia formation
2.2 pH对虎奶菇菌核形成的影响
由图2-a可知,中性及偏碱性的pH值(pH 7~9)对菌丝生长无明显影响,酸性环境则会显著抑制菌丝的生长(pH 4~6)。如图2-b及图2-c所示,在pH值为5时,菌核形成最多,随着pH的升高(pH值为7除外),菌核形成量减少,而pH值为4时,菌核形成量最低。因此,弱酸性环境(pH值为5)更利于菌核的形成,而过度的外界酸碱胁迫则不利于菌核的形成。这可能是因为pH过低会导致细胞内酶活力受到抑制,因此代谢活动减弱,不利于菌丝的生长和分化。
ROLLINS等[13]研究表明环境pH值在核盘菌菌核发育中起着重要的调节作用,且发现存在一个保守的pH值依赖信号通路在真菌中起作用,酸性环境有利于菌核发育,中碱性环境则抑制菌核发育,但是具体机制仍不明确。ROS诱发菌核生成理论认为菌核的分化是由氧化胁迫造成,即外界不良环境会引起丝状真菌细胞内氧化应激反应的发生,导致过氧化氢、超氧阴离子等活性氧物质的爆发及脂质过氧化浓度的升高,从而诱导细胞分化形成菌核[14]。过氧化氢是氧化应激的直接信号分子,还参与细胞的增殖与分化过程[15]。过氧化氢酶则是一种典型的ROS清除剂,在生物体内参与防御反应并控制细胞内的氧化还原平衡[16]。因此,通过测定未分化的菌丝和分化的菌核中过氧化氢含量以及过氧化氢酶活力,有助于分析pH值在菌核分化中对细胞的影响。
如图2-d所示,所有pH值下未分化的菌丝中过氧化氢含量均显著高于菌核,且pH值为5时菌核中过氧化氢含量最低(0.046 mol/g)。此外,所有pH值下菌核中过氧化氢酶活力均显著高于菌丝体(图2-e),且酶活力的变化趋势与菌核产量较为一致(图2-b)。产生菌核较多的pH 5、pH 7和对照组(CK)中过氧化氢酶活力与菌丝中差异更大,而pH值为4时其过氧化氢酶活力均偏低。由此可以推断,pH值的变化会引起菌丝细胞内过氧化氢的变化,当积累的过氧化氢含量超过其所能降解的量时,细胞内产生氧化应激,促进菌丝分化形成菌核,一方面分泌更多的过氧化氢酶,用以分解过氧化氢,减少其对细胞的损害;另一方面使细胞壁增厚以抵御外界不良环境。

a-菌丝生长速度;b-菌核的质量;c-菌核表型观察;d-过氧化氢含量;e-过氧化氢酶活力
图2 pH对菌核形成的影响
Fig.2 Effect of pH on sclerotia formation
2.3 过氧化氢对虎奶菇菌核形成的影响
由于过氧化氢在虎奶菇菌丝分化形成菌核的过程中起着重要作用,因此,通过外源添加不同浓度的过氧化氢以测定其对菌核形成的影响。如图3-a所示,当培养基中添加的过氧化氢浓度达到10-3 mol/L时,开始对菌丝的生长产生轻微的抑制作用;浓度为10-2mol/L时,则能够显著抑制菌丝的生长。由图3-b可知,过氧化氢浓度为10-2mol/L时,形成菌核的质量最高,随着过氧化氢浓度的降低,形成菌核的质量随之降低。PAPAPOSTOLOU等[15]研究发现,在Sclerotium rolfsii和Sclerotinia sclerotiorum中,较高浓度的过氧化氢会促进其菌核的分化,这与本研究的结果一致。
与pH值对菌核生成影响的试验中测定的结果一致,菌丝中的过氧化氢含量均显著高于菌核,而菌核中的过氧化氢酶活力均明显高于菌丝(图3-d和图3-e)。当添加的过氧化氢浓度为10-2mol/L时,其菌核产量最高,菌丝细胞内过氧化氢含量最高,菌核及菌丝的过氧化氢酶活力相对偏高,且发现添加过氧化氢的菌核中过氧化氢酶活力均略高于未添加组。这表明,细胞的分化与胞内过氧化氢含量和过氧化氢酶活力的变化密切相关,外界添加的过氧化氢亦是通过刺激生物体内的氧化应激反应进而触发菌丝细胞的分化和菌核的形成。
2.4 抗坏血酸对虎奶菇菌核形成的影响
抗坏血酸又名维生素C,是一种在代谢中能够有效清除生物体内ROS的抗氧化剂。在PDA培养基中添加抗坏血酸进行虎奶菇培养发现,抗坏血酸非常不利于菌丝分化形成菌核。如图4-a所示,当抗坏血酸质量浓度为10-4 g/L时,对菌丝的生长影响较小,随着质量浓度的增高,对菌丝的生长抑制越大。对菌核的分化亦如此,当抗坏血酸质量浓度为10-4 g/L时,细胞分化情况与对照组相比明显减少,当抗坏血酸质量浓度为10-3 g/L和3×10-3 g/L时,则完全抑制菌核的分化(图4-b)。GEORGIOU等[17]发现菌核分化可能受到真菌自身抗氧化反应的调节,而外源添加的抗坏血酸可以通过降低胞内ROS和脂质过氧化物浓度从而抑制菌核分化。由较高浓度的过氧化氢促进菌核形成和抗坏血酸抑制菌核形成的结果,可推断氧化应激是虎奶菇菌核分化的触发机制。由于抗坏血酸基本抑制菌核的分化,无法收集菌核称重比较和测定相关参数,故只能测定菌丝的过氧化氢浓度和过氧化氢酶活力。由图4-c和图4-d所示,菌丝的过氧化氢含量随着抗坏血酸含量的升高略有降低,而过氧化氢酶活力并无显著性差别,这是由于添加的抗坏血酸起到了外加抗氧化剂的作用,可降低胞内过氧化氢浓度,但对胞内过氧化物酶则无影响。

a-菌丝生长速度;b-菌核的质量;c-菌核表型观察;d-过氧化氢含量;e-过氧化氢酶活力
图3 过氧化氢对菌核形成的影响
Fig.3 Effect of hydrogen peroxide concentration on sclerotia formation
根据ROS诱发菌核形成理论,真菌受到温度、pH值、ROS等外界环境的刺激,造成氧化胁迫,引起细胞内氧化应激进而分化形成菌核[9]。在该过程中,过氧化氢等ROS会大量沉积在菌丝细胞壁上和细胞器膜周围[18],产生的氧化应激信号可通过多种信号通路从细胞表面传导到细胞核[19],进而触发菌丝细胞的分化和菌核的形成。此外,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路参与氧化应激信号的传递,调节细胞壁蛋白的糖基化,从而促进菌丝形态的改变,形成菌核[20-21]。我们前期研究也发现,菌核的细胞壁含量显著高于子实体以及菌丝体的细胞壁含量[2-4]。因此,筛选过氧化氢酶、MAPK通路以及细胞壁合成相关基因(表1)进行RT-qPCR验证。如图5所示,参与细胞壁合成的基因GME1020_g、GME9903_g以及与过氧化氢酶相关的基因GME2693_g、GME4097_g表达量均显著上调(Log2FC>1.4),且菌核中GME1020_g、GME9903_g表达量的Log2FC>5,影响更为显著,该结果与菌核细胞壁增厚和上述过氧化氢酶活力增加的结果相符。但是,涉及MAPK通路的基因GME11266_g和GME7057_g分别有所上调和下调,表明MAPK通路在菌核分化中有所作用,但具体的作用方式还有待深入研究。
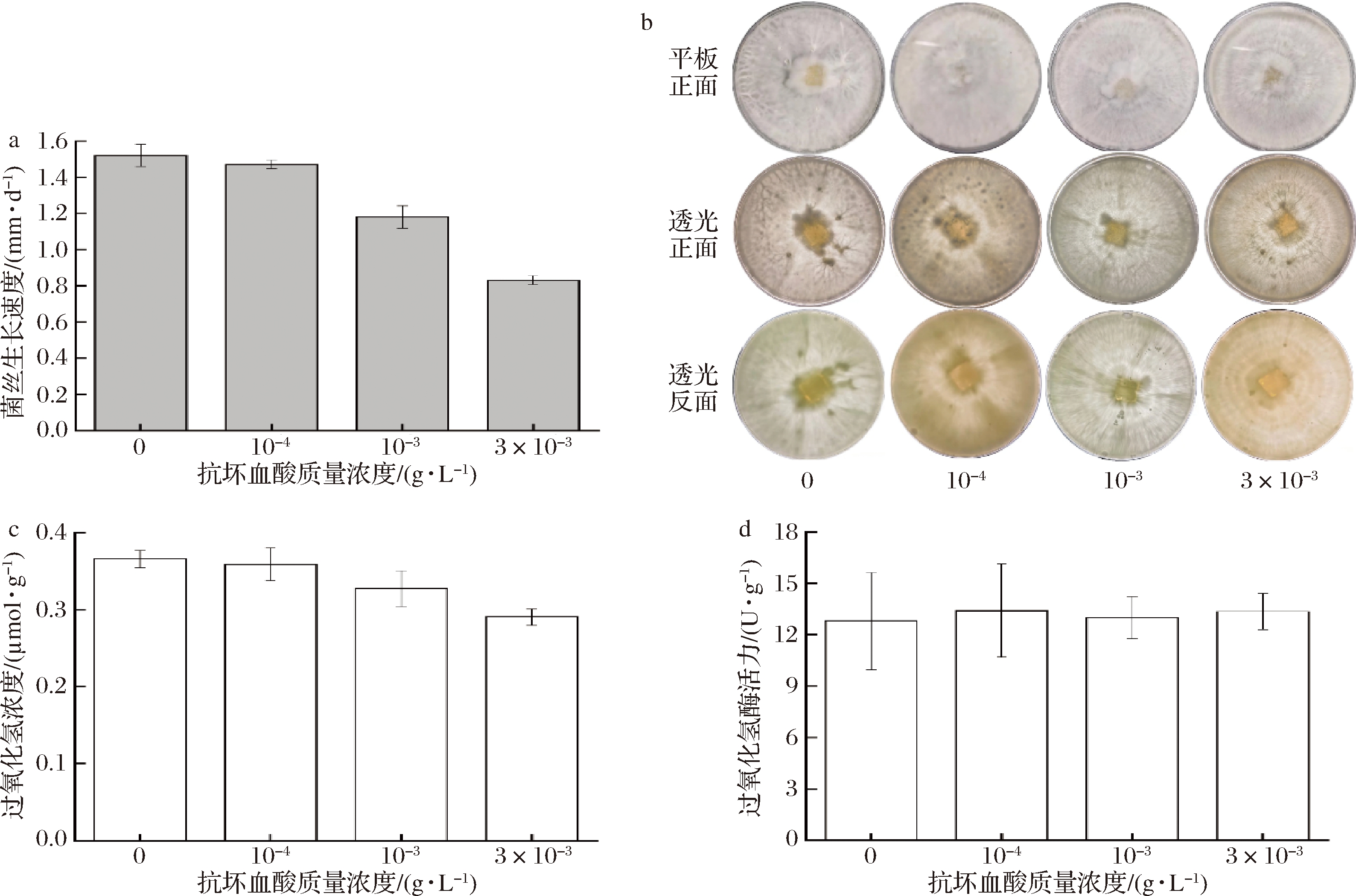
a-菌丝的生长速度;b-菌核表型观察;c-过氧化氢含量;d-过氧化氢酶活力
图4 抗坏血酸浓度对菌核形成的影响
Fig.4 Effect of ascorbic acid concentrations on sclerotia formation
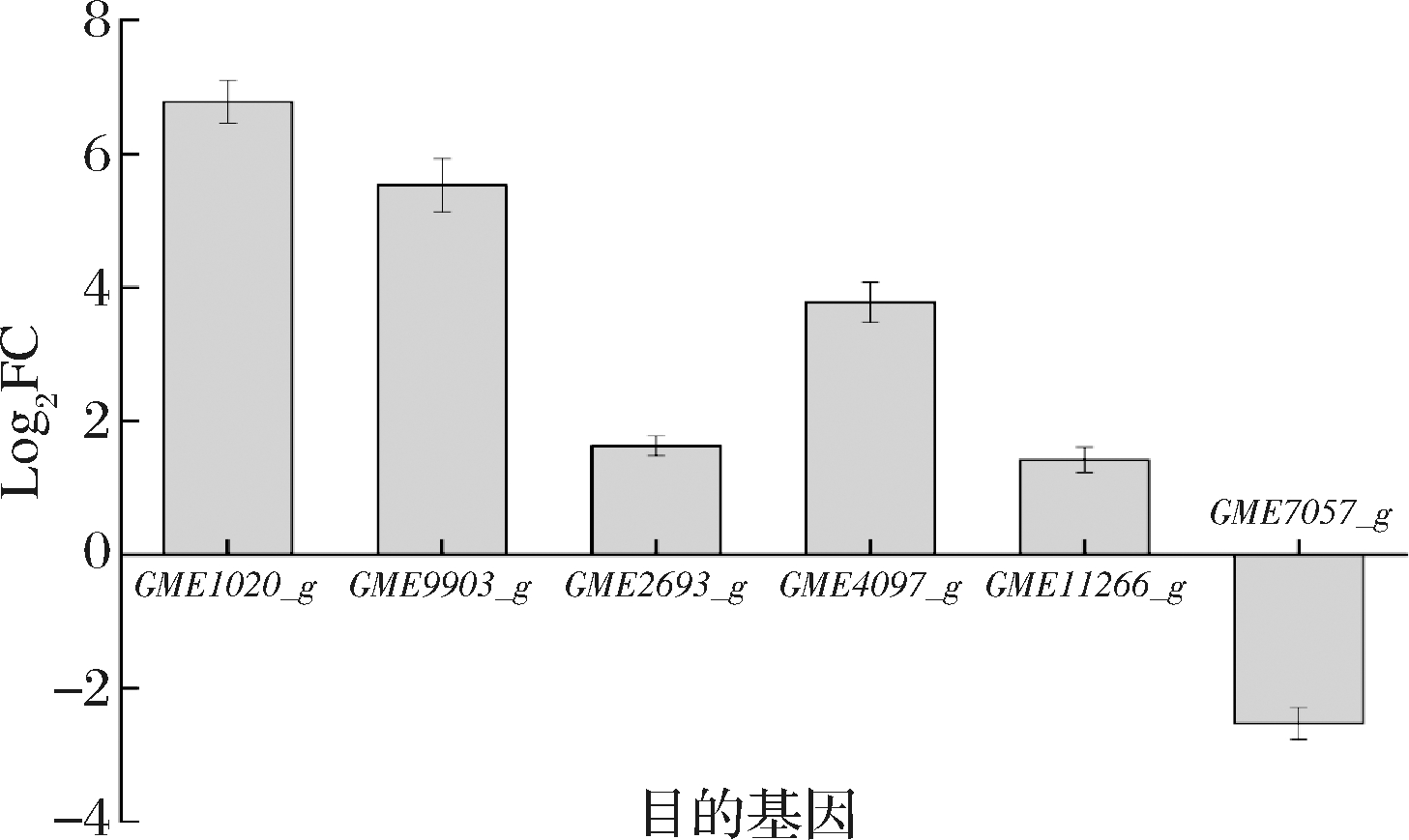
图5 菌核相对菌丝的目的基因表达量
Fig.5 Target gene expression of sclerotia relative to mycelia
3 结论
该研究采用PDA培养基平板恒温培养的方法实现了虎奶菇菌核的简便快捷培养,具体条件为调节培养基pH值为5,接种后30 ℃预培养至菌丝长满平板,然后转移至25 ℃恒温培养30 d,可产生明显的菌核。在25 ℃条件下更有利于虎奶菇菌核形成,而温度过高(30 ℃)更适于菌丝生长,温度过低则会显著抑制菌核形成。通过测定培养基pH对菌核形成的影响发现,弱酸性环境(pH 5)会轻微抑制菌丝生长,但有利于菌核形成。不同pH培养条件下菌丝中的过氧化氢含量均显著高于菌核,但过氧化氢酶活力则显著低于菌核,后者的变化趋势与菌核形成较为一致。在培养基中添加不同浓度的过氧化氢和抗坏血酸后发现,适当浓度的过氧化氢(10-2 mol/L)有利于菌核形成,但抗坏血酸则会抑制菌丝细胞分化形成菌核。RT-qPCR结果显示,在菌核形成过程中,过氧化氢酶和细胞壁合成相关基因的表达量均显著上调,而MAPK途径也参与了氧化还原信号的转导。结合前期研究结果和文献报道可知,外界的温度、pH和氧化还原环境等变化会产生氧化应激信号或引起菌丝细胞内ROS浓度的升高,当升高至一定量时,胞内产生氧化应激,细胞核做出反应,触发菌丝细胞的分化和菌核的形成,一方面分泌更多的过氧化氢酶等抗氧化酶,用以分解ROS,减少其对细胞的损害;另一方面使细胞壁增厚以抵御外界不良环境。
[1] 黄飞龙. 虎奶菇多糖提取和抗胃癌活性研究及产品开发[D].南昌:南昌大学, 2018.
HUANG F L.The extraction and anti-gastric cancer activity of polysaccharide from Pleurotus tuber regium and product development[D].Nanchang:Nanchang University, 2018.
[2] CHEN L, XU W W, LIN S L, et al.Cell wall structure of mushroom sclerotium (Pleurotus tuber regium):Part 1.Fractionation and characterization of soluble cell wall polysaccharides[J].Food Hydrocolloids, 2014,36:189-195.
[3] CHEN L, CHEUNG P C K.Mushroom dietary fiber from the fruiting body of Pleurotus tuber-regium:Fractionation and structural elucidation of nondigestible cell wall components[J].Journal of Agricultural and Food Chemistry, 2014,62(13):2 891-2 899.
[4] 葛梦蝶, 代安然, 杨崇婧, 等.虎奶菇菌丝体细胞壁成分分析及多糖结构表征[J].食品与发酵工业, 2020,46(6):41-48.
GE M D, DAI A R, YANG C J, et al.Analysis on cell wall components of Pleurotus tuber regium mycelium and characterization of its polysaccharide structure[J].Food and Fermentation Industries, 2020,46(6):41-48.
[5] CHEN L, ZHANG B B, CHEN J L, et al.Cell wall structure of mushroom sclerotium (Pleurotus tuber-regium):Part 2.Fine structure of a novel alkali-soluble hyper-branched cell wall polysaccharide[J].Food Hydrocolloids, 2014,38:48-55.
[6] WONG S M, WONG K K, CHIU L C M, et al.Non-starch polysaccharides from different developmental stages of Pleurotus tuber-regium inhibited the growth of human acute promyelocytic leukemia HL-60 cells by cell-cycle arrest and/or apoptotic induction[J].Carbohydrate Polymers, 2007,68(2):206-217.
[7] CHEUNG P C, LEE M Y.Fractionation and characterization of mushroom dietary fiber (nonstarch polysaccharides) as potential nutraceuticals from sclerotia of Pleurotus tuber-regium (Fries) singer[J].Journal of Agricultural and Food Chemistry, 2000,48(8):3 148-3 151.
[8] ZHANG M, CHEUNG P C K, OOI V E C, et al.Evaluation of sulfated fungal β-glucans from the sclerotium of Pleurotus tuber-regium as a potential water-soluble anti-viral agent[J].Carbohydrate Research, 2004,339(13):2 297-2 301.
[9] SUN X Y, LIU D M, WANG Y Y, et al.Biogenesis of macrofungal Sclerotia:Influencing factors and molecular mechanisms[J].Applied Microbiology and Biotechnology, 2020,104(10):4 227-4 234.
[10] SMITH M E, HENKEL T W, ROLLINS J A.How many fungi make sclerotia?[J].Fungal Ecology, 2015,13:211-220.
[11] BAMIGBOYE C O, OLOKE J K, DAMES J F.Development of high yielding strain of Pleurotus tuber-regium:Fructification, nutritional and phylogenetic studies[J].Journal of Food Science and Technology, 2019,56(8):3 597-3 608.
[12] ROGER B, LUYEYE FELICIEN L, NGIALA GÉDÉON B, et al.Cultivation trial of an edible and medicinal mushroom species, Pleurotus tuber-regium (Rumph.ex Fr.) Singer 1951 (strain 190212) on various lignocellulosic substrates[J].Open Journal of Agricultural Research, 2021,1(2):84-93.
[13] ROLLINS J A, DICKMAN M B.pH signaling in Sclerotinia sclerotiorum:Identification of a pacC/RIM1 homolog[J].Applied and Environmental Microbiology, 2001,67(1):75-81.
[14] LIU H H, HUANG C C, LIN Y H, et al.Superoxide initiates the hyphal differentiation to microsclerotia formation of Macrophomina phaseolina[J].Microbiology Spectrum, 2022,10(1):e208421.
[15] PAPAPOSTOLOU I, SIDERI M, GEORGIOU C D.Cell proliferating and differentiating role of H2O2 in Sclerotium rolfsii and Sclerotinia sclerotiorum[J].Microbiological Research, 2014, 169(7-8):527-532.
[16] 汪浩德. 立枯丝核菌菌核形成过程中H2O2的作用及CAT的功能分析[D].沈阳:沈阳农业大学, 2018.
WANG H D.Role of H2O2 and function analysis of CAT in the sclerotia formation of Rhizoctonia solani[D].Shenyang:Shenyang Agricultural University, 2018.
[17] GEORGIOU C D, ZERVOUDAKIS G, PETROPOULOU K P.Ascorbic acid might play a role in the sclerotial differentiation of Sclerotium rolfsii[J].Mycologia, 2003,2(95):308-316.
[18] XING Y M C J S C.Nox gene expression and cytochemical localization of hydrogen peroxide in Polyporus umbellatus sclerotial formation[J].International Journal of Molecular Sciences, 2013,11(14):22 967-22 981.
[19] LI B, TIAN X, WANG C, et al.Swath label-free proteomics analyses revealed the roles of oxidative stress and antioxidant defensing system in sclerotia formation of Polyporus umbellatus[J].Scientific Reports, 2017,7:41283.
[20] CHEN C, HAREL A, GOROVOITS R, et al.MAPK regulation of sclerotial development in Sclerotinia sclerotiorum is linked with pH and cAMP sensing[J].Molecular Plant-Microbe Interactions, 2004,4(17):404-413.
[21] LI B, SUN L, XING Y, et al.Cell wall strengthening and remodeling provide new insights on sclerotia development of medicinal fungus Polyporus umbellatus[J].Research Square, 2020.DOI:10.21203/rs.3.rs-122799/v1.