随着经济发展和收入水平的不断提高,我国居民的肉类消费结构逐步优化,牛肉消费量逐年上升[1],2018年我国牛肉总供给量为747.9万t,2019年增至764.27万t,到2020年778.57万t[2]。牛肉与其他肉类相比营养丰富,胆固醇含量低,蛋白质含量较高,氨基酸的比例更接近人体需求[3]。牛肉制品种类很多,根据制品工艺特点可分为酱卤(白煮肉类、糟肉类)、罐藏(硬罐头、软罐头)、调理(牛肉酱,调理牛排等)、香肠(中式香肠、熏煮香肠、发酵香肠、生鲜香肠)、脱水(肉干、肉松、肉脯)、油炸(酥牛肉、牛肉丝)、熏烧烤(烧烤牛肉、熏烤牛肉)、腌腊(咸肉、腊肉、风干肉)8个类型[4],大部分类型以大块牛肉为加工原料,而以牛肉糜为原料制作的乳化肉糜类产品较少。乳化肉糜类制品是以脂肪、肌肉和水为主要原料,通过斩拌、罐装、熟制和冷却等工艺制成的一种肉制品,借助于该产品类型可以将脂肪充分利用,避免原料浪费,同时也拓宽了我国肉制品的种类[5]。
肌原纤维蛋白是肌肉中的主要蛋白质,占总蛋白的50%~60%,在牛肉蛋白中能达到70%,是乳化肉糜类制品制作过程中不可缺少的主要成分[6]。在乳化肉糜类制品加工过程中,互不相溶的牛脂肪与瘦肉中的水分在肌肉中的肌原纤维蛋白作为乳化剂的作用下,通过斩拌的方式形成了稳定的乳化体系[7],其生产的关键在于能够最大限度地保留水分和原料肉当中附带的脂肪,而肌原纤维蛋白对保留水和脂肪起到了非常重要的作用,对其乳化特性是非常关键的加工特性之一,能够给予乳化肉糜类制品较为理想的物理化学性质和感官特性[5]。也会对后续的凝胶制品的质构和保水特征造成直接影响[8],因而备受关注。对于肌原纤维蛋白的乳化特性的研究大多则集中在猪肉中,对牛肉肌原纤维蛋白的乳化特性研究较少。乳化特性的差异不仅体现在不同种类的肉中,也表现在同种肉的不同部位中。其中肌原纤维蛋白在乳化稳定性和乳化活性的不同都是导致乳化特性不同的重要原因[9]。国内外对乳化活性的研究主要以乳化活性指数为参考,涉及肉类蛋白的研究很少[10]。本文拟以生产中最常使用的牛霖肉、牛肩颈肉、牛腩肉为研究对象,通过测定并比较其中肌原纤维蛋白乳化特性的差异,蛋白分子间作用力含量比较,蛋白二级结构的差异以及牛肉匀浆物乳化能力的比较,探讨不同取样部位牛肉肌原纤维蛋白在乳化特性和二级结构方面的差异,以期为乳化牛肉糜类制品原料选择提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
从市场购买巴西进口牛霖肉、牛肩颈肉和牛腩肉,分别分割后装入保鲜袋,处于0~4 ℃的条件下运输至实验室,置于-20 ℃冰柜中保存。
NaCl、Na2HPO4、NaH2PO4、MgCl2、三氯乙酸(trichloroacetic acid,TCA)、β-巯基乙醇、KCl、CuSO4·5H2O、NaKC4H4O6·4H2O、NaOH、尿素(均为分析纯),购于国药控股化学试剂有限公司(上海);十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、乙二醇二乙醚二胺四乙酸(ethylene glycol tetraacetic acid,EGTA)、Triton-100、牛血清蛋白标准品,购于索莱宝科技有限公司(北京);大豆油,市售金龙鱼牌大豆油。
1.2 仪器与设备
AL-104电子分析天平,上海梅特勒-托利多公司;JR17-300绞肉机,苏泊尔电器公司;35172-BRUZ均质器,法国梅里埃公司;EC-215电导率仪,德国Hanna公司;高速分散器,德国IKA公司;HH.S21-6数显恒温水浴锅,上海博讯有限公司;UV-2600紫外分光光度计,岛津企业有限公司;NEO-1600高速冷冻离心机,香港利康生物医疗公司;LABRAM HR Evolution激光共聚焦拉曼光谱仪,HORIBA上海茂培科技有限公司。
1.3 实验方法
1.3.1 原料预处理
将-20 ℃冷冻下的牛霖肉、牛肩颈肉、牛腩肉在4 ℃冷库中解冻24 h,剔除筋膜后,用绞肉机将肉绞成肉糜。
1.3.2 肌原纤维蛋白提取
参照PARK等[11]和夏天兰[12]的方法做适当修改,取纯瘦肉糜50 g,加入4倍体积的分离缓冲液Ⅰ(0.1 mol/L NaCl、2 mmol/L MgCl2、1 mmol/L的EGTA溶解至0.2 mol/L、pH 6.5的磷酸缓冲液),均质180 s,3 000×g、4 ℃离心13 min,取沉淀,此过程重复2次。取沉淀加入4倍体积分离缓冲液Ⅱ(0.1 mol/L NaCl、2 mmol/L MgCl2、1% Triton-100、1 mmol/L EGTA溶解至0.2 mol/L、pH 6.5的磷酸盐缓冲液),匀浆1 min,过滤,3 000×g、4 ℃离心13 min,此过程重复1次。沉淀加入4倍分离缓冲液Ⅰ,匀浆1 min,3 000×g、4 ℃离心13 min。取沉淀继续加入4倍分离缓冲液Ⅲ(0.1 mol/L NaCl),匀浆1 min,3 000×g、4 ℃离心13 min,此过程重复3次。此后可直接以同等条件重复离心直至未有溶液离出。用双缩脲法测定蛋白质量浓度。
1.3.3 肌原纤维蛋白质量浓度测定
用pH 6.5磷酸盐缓冲液将样品稀释至10 mg/mL左右,蛋白样品与双缩脲试剂按照体积比1∶4混合,常温下反应30 min,在540 nm下测定吸光度。
1.3.4 肌原纤维蛋白乳化活性测定
采用离心法并稍作修改[13],测定3个部位的肌原纤维蛋白乳化活性。将蛋白稀释至5 mg/mL,取1 mL蛋白液加入10 mL大豆色拉油、10 mL蒸馏水,高速分散器2档(10 000 r/min)匀浆1 min,1 300×g、4 ℃离心5 min。乳化活性的计算如公式(1)所示:
乳化活性![]()
(1)
1.3.5 肌原纤维蛋白乳化稳定性测定
采用离心法并稍作修改[14],测定3个不同部位的肌原纤维蛋白乳化稳定性。将蛋白稀释至5 mg/mL,取1 mL蛋白液加入10 mL大豆色拉油、10 mL蒸馏水,高速分散器2档(10 000 r/min)匀浆1 min。80 ℃水浴30 min,自来水冷却15 min,1 300×g、离心5 min。乳化稳定性的计算如公式(2)所示:
乳化稳定性![]()
(2)
1.3.6 肌原纤维蛋白化学作用力测定
参照杨慧娟[15]的方法测定蛋白化学作用力。
1.3.7 肌原纤维蛋白二级结构及含量测定
参照CAO等[16]的方法并加以修改。将样品均匀涂在载玻片上,使用拉曼光谱仪,用545 nm处的激光进行测量,仪器功率为25 mW。仪器使用单晶硅校准,单晶硅有1个520 nm的发射峰。使用200 mHz狭缝宽度、600 g/mm的光栅、2 cm-1的分辨率和60 s的积分时间来测量样品的发射。样品在400~4 000 cm-1内扫描3次。使光谱平滑化并创建一个平缓的基线,通过归一化进行二阶曲线拟合,得出所需要峰的面积,计算每个结构的百分比。
1.3.8 牛肉乳化能力测定
参照郝婉名等[17]的方法并加以修改,50 g肉糜加入800 mL 0.6 mol/L NaCl、0.05 mol/L Na2HPO4溶液,高速分散器6档(24 000 r/min)匀浆2 min,4 ℃放置24 h后过滤。取16个50 mL离心管均加入15 mL匀浆液,依次加入0~15 mL大豆色拉油,在冰水浴中,高速分散器2档(10 000 r/min)匀浆10 s,得乳状液后迅速将其移至已标记10 mL刻度的试管中,测定电导率值,进行3次平行实验,分别记录每组数据。乳化能力的计算如公式(3)所示:
乳化能力=Aσ
(3)
式中:A为换算系数,取0.937 5;σ为电导率值。
1.3.9 数据处理
采用SPSS 16.0软件进行单因素方差分析(one-way analysis of variance,ANOVA)、相关性分析(Pearson),P<0.05为差异显著。每组试验均重复3次。
2 结果与分析
2.1 不同部位牛肉肌原纤维蛋白质量浓度比较
不同取样部位牛肉纯瘦肉中提取的肌原纤维蛋白质量浓度如表1所示。由表1可知,去除筋膜和脂肪的牛肩颈肉中的肌原纤维蛋白质量浓度最高,牛腩次之,牛霖肉最低。蛋白质量浓度越高,单位体积的分子数越多,分子间的作用力就更强。WANG等[18]通过研究发现,在1~8 mg/mL蛋白质量浓度的范围内,蛋白质量浓度越高,形成的乳液中参与乳化的蛋白分子数量就越多。为了考察不同部位肌原纤维蛋白自身的乳化特征,消除因蛋白质量浓度差异而造成的影响,本文关于肌原纤维蛋白的其他指标均在同一浓度下测定。
表1 不同样品部位牛肉肌原纤维蛋白乳化指标测定结果
Table 1 Emulsification index of beef myofibrillar protein from different sampling sites

部位质量浓度/(mg·mL-1)乳化活性/%乳化稳定性/%牛霖 94.67±0.07c45.93±0.34b45.09±0.66ab牛肩颈111.87±0.06a48.53±0.03a46.76±0.69a牛腩 107.67±0.06b44.34±0.25c44.11±0.14b
注:平均值±标准差,同列均值有共同上标字母者表示差异不显著(P>0.05),同列均值有不同上标字母者表示差异显著(P<0.05)(下同)
2.2 不同部位牛肉肌原纤维蛋白乳化活性和乳化稳定性分析
不同取样部位牛肉肌原纤维蛋白乳化活性和乳化稳定性如表1所示。由表1可知,牛霖肉和牛肩颈肉的蛋白乳化活性均显著高于牛腩肉(P<0.05),牛肩颈肉的蛋白乳化稳定性显著高于牛腩肉(P<0.05),但与牛霖肉无显著差异。蛋白乳化活性指单位质量的蛋白质可以稳定水油界面的体积,反映了肌原纤维蛋白乳化能力的趋势[13]。蛋白乳化稳定性指蛋白质保持乳化物体系稳定的能力[14]。ZORBA等[19]研究发现同一种动物不同部位肉的肌原纤维蛋白在同一浓度下的乳化活性也存在差异,一方面是因为蛋白质的特异性差异所导致,另一方面是因为肉的蛋白种类特性及成分不同。郝婉名等[17]的研究显示,西门塔尔杂交牛的牛肩肉的乳化稳定性较好,这与本研究结果基本一致。
为了探讨蛋白自身特性对其乳化活性和乳化稳定性的影响,本研究测定了肌原纤维蛋白的化学作用力和二级结构。
2.3 不同部位牛肉肌原纤维蛋白化学作用力分析
不同取样部位牛肉肌原纤维蛋白化学作用力如表2所示。由表2可知,不同取样部位的化学作用力含量均存在显著性差异(P<0.05)。实验所测定的蛋白化学作用力中的氢键,离子键、二硫键和疏水相互作用力指的是蛋白分子间的作用力,该作用力的含量越多说明蛋白分子间结合越紧密,蛋白自身越稳定,这反而使得蛋白与外界物质的结合作用减弱[20]。乳化是蛋白与外界物质水和油的反应,蛋白与水和油的结合越弱,其乳化特性就越弱[20-21]。结果表明,牛腩肉的肌原纤维蛋白中氢键,离子键,疏水相互作用及二硫键含量最多(P<0.05),这与其蛋白的乳化活性和乳化稳定性最弱是一致的;牛霖肉肌原纤维蛋白的氢键,离子键,疏水相互作用及二硫键含量最低,但其乳化稳定性较高。
在蛋白肽链主链(骨架)中,局部肽段蛋白依靠氢键维持的具有周期性的结构构象就是蛋白质二级结构,WALTERS等[22]发现氢键越多,二级结构越稳定,维持α-螺旋稳定性的主要作用力就是氢键。离子键虽然不是蛋白质折叠的主要作用力,但对蛋白质的稳定性起到了重要作用,其中形成离子键的静电作用在蛋白质折叠中起到了很大的稳定作用[21]。疏水相互作用会影响蛋白质的三维结构的构象,有研究发现疏水相互作用越多,整个蛋白质折叠体系的稳定性也会变强[20]。二硫键虽不对蛋白结构起到主要作用,但能够维持蛋白质的热稳定性[21]。
牛肉肌原纤维蛋白乳化特性与化学作用力的相关性分析如表3所示,肌原纤维蛋白的乳化稳定性与离子键含量呈正相关,与氢键含量,疏水相互作用,二硫键含量呈负相关,但均未达到显著水平;乳化活性与化学作用力呈显著负相关(**)。肌原纤维蛋白的乳化稳定性和乳化活性呈显著正相关,相关系数达到0.489(**)。
表2 不同样品部位牛肉肌原纤维蛋白化学作用力含量测定结果
Table 2 Determination of chemical force content of beef myofibrillar protein from different sampling sites
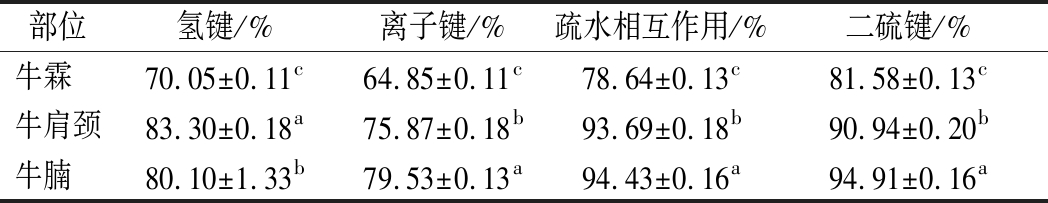
部位氢键/%离子键/%疏水相互作用/%二硫键/%牛霖 70.05±0.11c64.85±0.11c78.64±0.13c81.58±0.13c牛肩颈83.30±0.18a75.87±0.18b93.69±0.18b90.94±0.20b牛腩 80.10±1.33b79.53±0.13a94.43±0.16a94.91±0.16a
表3 不同样品部位牛肉肌原纤维蛋白乳化特性与化学作用力的相关性分析
Table 3 Correlation analysis of emulsifying properties and chemical forces of beef myofibrillar protein from different sampling sites

指标乳化活性/%氢键/%离子键/%疏水相互作用/%二硫键/%乳化稳定性/%0.489∗-0.3210.041-0.181-0.371乳化活性/%-0.982∗∗-0.81∗-0.936∗∗-0.989∗∗氢键/%0.8860.98∗∗0.998∗∗离子键/%0.959∗∗0.859∗∗疏水相互作用/%0.968∗∗
注:**表示在0.01水平相关性显著(双尾);*表示在0.05水平相关性显著(双尾)
2.4 不同部位牛肉肌原纤维蛋白二级结构及含量分析
不同取样部位牛肉肌原纤维蛋白拉曼光谱如图1所示,由图1可知,3个部位均在酰胺Ⅲ带区间1 200~1 300 cm-1内出现明显波峰,此谱带主要是由α-螺旋结构引起的,在此范围内的相对强度均逐渐上升,在酰胺Ⅰ带区间1 600~1 700 cm-1内的相对密度急剧下降,且三者下降幅度有差异,此时酰胺Ⅰ中的β-转角结构和无规则卷曲结构含量改变明显[5]。
不同取样部位二级结构含量如图2所示,3个部位的蛋白二级结构均存在显著性差异。无规则卷曲结构,也称自由卷曲,是除有规则的二级结构以外,主链骨架的其他未明确的二级结构的蛋白质肽段,大多数既非随意卷曲,也非完全无规。无规卷曲柔性较大,虽存在一定任意性,但有明确而稳定的结构,这类有序的非重复性结构常构成酶的活性部位和其他蛋白质特异的功能部位,同时能够增大蛋白质的柔韧性[23],能够暴露更多的疏水性基团,使得蛋白与外界物质,如油的结合作用加强,从而增强了蛋白的乳化能力,牛肩颈肉无规则卷曲结构含量最多,其在3个部位中也表现出最好的乳化活性及乳化稳定性。β-转角是蛋白质结构中数量最多最大的转角结构,由4个氨基酸的分子内氢键形成,结构内的180°回折能够稳定转折结构[24],使得蛋白结构更加稳定,与外界物质油和水的结合作用变弱,本研究中牛腩肉肌原纤维蛋白的α-螺旋结构含量较高,且存在一定含量的β-转角结构,由此反应出牛腩肉肌原纤维蛋白的乳化特性最差。
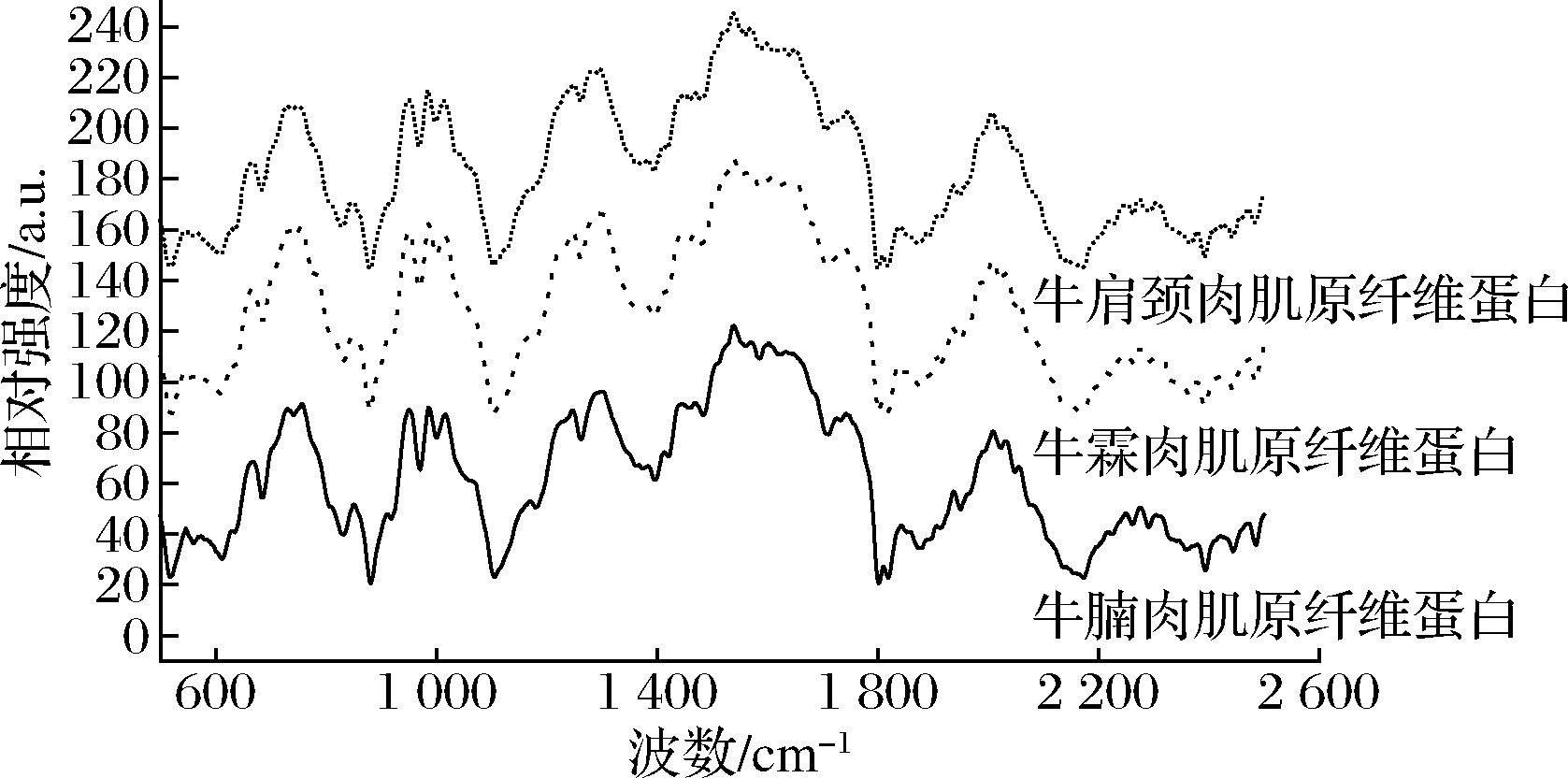
图1 不同样品部位牛肉肌原纤维蛋白拉曼光谱
Fig.1 Raman spectra of beef myofibrillar protein from different sampling sites
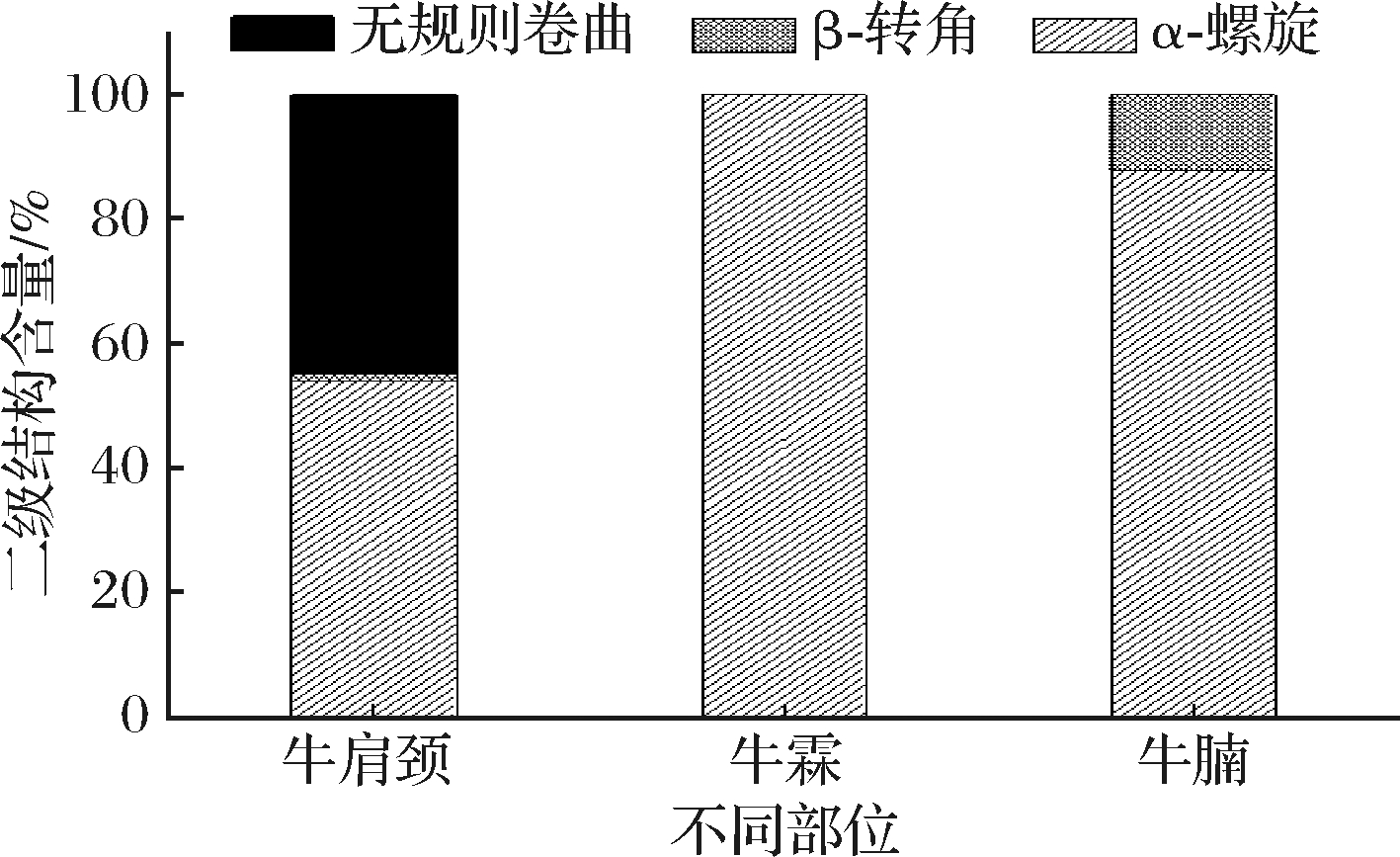
图2 不同样品部位牛肉肌原纤维蛋白二级结构含量
Fig.2 Secondary structure content of myofibrillar protein in beef from different sampling sites
2.5 不同部位牛肉匀浆物乳化能力分析
不同取样部位牛肉匀浆物乳化能力如图3所示。由图3可知,不同取样部位牛肉匀浆物乳化能力存在显著性差异(P<0.05)。其中,牛霖肉匀浆物乳化能力最强,虽与牛肩颈肉差异不显著(P>0.05),但显著高于牛腩肉。这与前文牛霖肉肌原纤维蛋白的乳化活性和乳化稳定性均较高的结果是一致的,其原因可能是由于牛霖肉肌原纤维蛋白自身化学作用力整体最弱,故而在加工体系中,其与油、水的结合力可能更强,这与赵改名等[25]对新疆褐牛不同部位匀浆物的乳化能力测定时所发现的牛霖肉匀浆物乳化能力最强的结果一致。
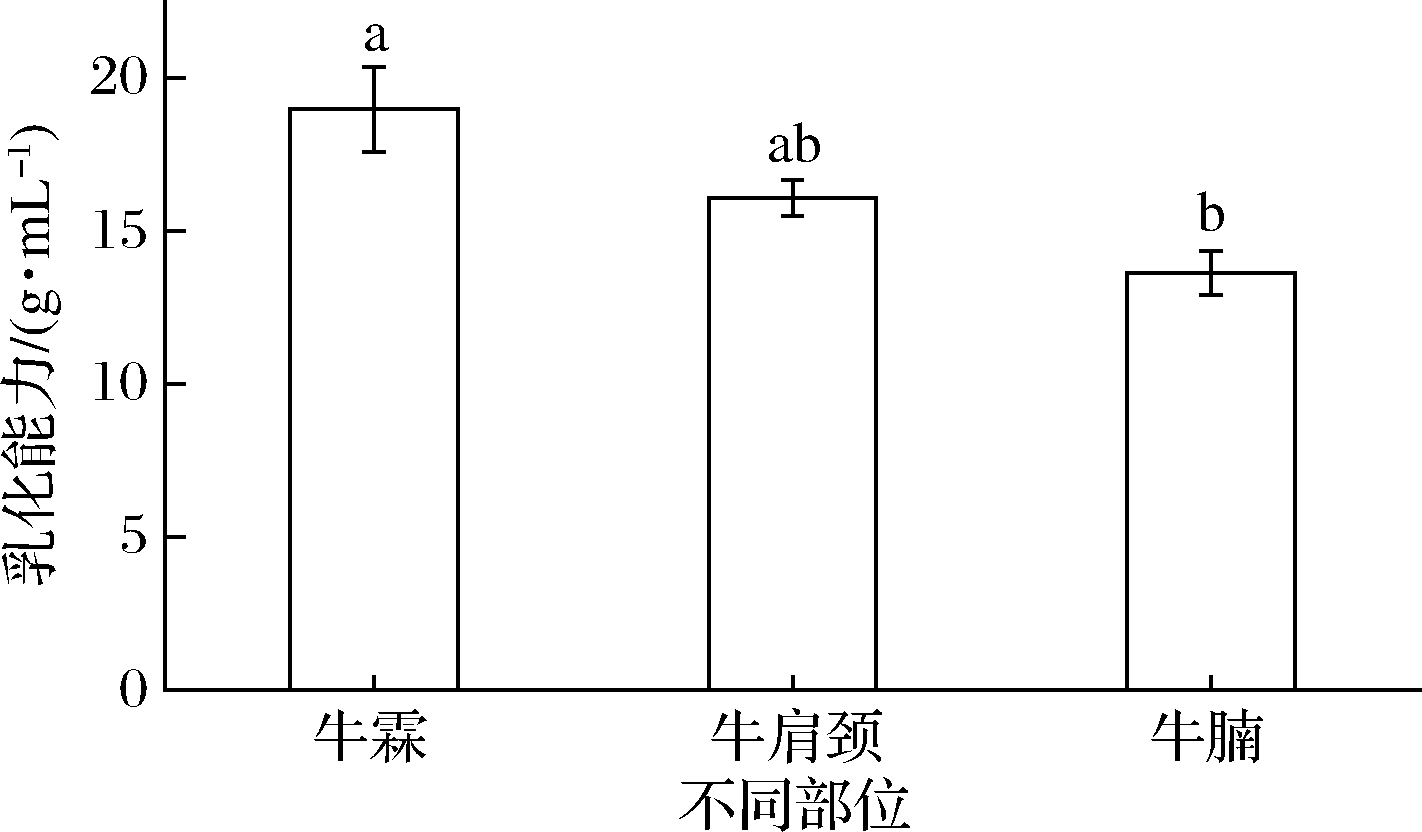
图3 不同样品部位牛肉匀浆物乳化能力
Fig.3 Emulsification ability of beef homogenate content at different sampling sites
3 结论
在蛋白质量浓度相同的条件下,由于牛肩颈肉和牛霖肉肌原纤维蛋白的氢键含量、离子键含量、疏水相互作用、二硫键含量低于牛腩肉肌原纤维蛋白,导致牛霖肉和牛肩颈肉肌原纤维蛋白的乳化稳定性和乳化活性较高(P<0.05),且在牛肉匀浆物乳化能力中也表现出较好的乳化特性。牛肩颈肉肌原纤维蛋白的α-螺旋结构含量低于牛霖肉,无规则卷曲的含量高于牛霖肉,二级结构的测定反映出牛肩颈肉肌原纤维蛋白的乳化特性较好,但由于牛肩颈部位的筋膜较多,在生产加工中需要花费大量的人力和时间进行处理,牛霖部位的筋膜很少且几乎没有多余脂肪,对于工艺优化及规模化生产更有利。因此,综合各项指标可知,牛霖肉更适合进行牛肉乳化肉糜类制品的加工,希望本研究结果可以为牛肉乳化肉糜类制品的生产及原料选择应用提供一定的数据支撑。
[1] 宝音都仍, 王星星.我国肉牛生产现状及未来展望[J].中国饲料, 2021(2):122-124.
BAOYIN D R, WANG X X.Beef cattle production status and future prospects in China[J].China Feed, 2021(2):122-124.
[2] 石自忠, 王明利, 胡向东.中国牛肉市场模型构建与基础模拟[J].中国农业大学学报, 2015, 20(3):278-290.
SHI Z Z, WANG M L, HU X D.A study on beef market partial equilibrium model in China[J].Journal of China Agricultural University, 2015, 20(3):278-290.
[3] 李绚, 康芳娥.浅述养牛业的发展前景及建议[J].畜牧兽医科技信息, 2021(4):122.
LI X, KANG F E.The development prospect and suggestion of cattle raising industry are described briefly[J].Chinese Journal of Animal Husbandry and Veterinary Medicine, 2021(4):122.
[4] 王可, 祝超智, 赵改名, 等.牛肉制品加工现状与发展趋势[J].食品科技, 2019, 44(10):122-129.
WANG K, ZHU C Z, ZHAO G M, et al.Overview of beef product processing and development[J].Food Science and Technology, 2019, 44(10):122-129.
[5] 魏朝贵. KCl和MgCl2部分替代NaCl条件下猪肉肌原纤维蛋白乳化特性及其应用研究[D].南京:南京农业大学, 2014.
WEI C G.Emulsion properties and application of pork myofibriliar protein in the condition of partial substituting NaCl with KCl and MgCl2[D].Nanjing:Nanjing Agricultural University, 2014.
[6] 蔡梦洁. 恒功率微波处理牛肉肌原纤维蛋白对风味物质吸附能力研究[D].广州:华南理工大学, 2019.
CAI M J.Effects of constant power microwave on the binding ability of myofibrillar protein from beef to flavor compounds[D].Guangzhou:South China University of Technology, 2019.
[7] 高晓光, 任媛媛, 冯随, 等.斩拌条件对乳化型香肠品质的影响研究[J].食品科技, 2019, 44(3):118-123.
GAO X G, REN Y Y, FENG S, et al.The effect of chopping conditions on the quality of emulsion type sausage[J].Food Science and Technology, 2019, 44(3):118-123.
[8] 倪韵晨. 茶叶、茶汤中氟虫腈及其代谢物残留量的测定及浸出率研究[D].杭州:浙江工业大学, 2019.
NI Y C.Determination of fipronil and its metabolites in tea and tea infusion and study of the leaching rate[D].Hangzhou:Zhejiang University of Technology, 2019.
[9] 吴菊清. 猪肉肌原纤维蛋白乳化特性研究[D].南京:南京农业大学, 2015.
WU J Q.Emulsifying properties of myofibrillar protein of pork[D].Nangjing:Nanjing Agricultural University, 2015.
[10] MIEDZIANKA J, P![]() KSA A.Effect of pH on phosphorylation of potato protein isolate[J].Food Chemistry, 2013, 138(4):2 321-2 326.
KSA A.Effect of pH on phosphorylation of potato protein isolate[J].Food Chemistry, 2013, 138(4):2 321-2 326.
[11] PARK D, XIONG Y L, ALDERTON A L.Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J].Food Chemistry, 2007, 101(3):1 239-1 246.
[12] 夏天兰. 鸡胸肉肌原纤维蛋白氧化对其热凝胶特性及储藏稳定性影响研究[D].南京:南京农业大学, 2015.
XIA T L.Effect of protein oxidation on properties and storage stability of heat-induced chicken breast myofibrillar proteins gels[D].Nangjing:Nanjing Agricultural University, 2015.
[13] PEARCE K N, KINSELLA J E.Emulsifying properties of proteins:Evaluation of a turbidimetric technique[J].Journal of Agricultural and Food Chemistry, 1978, 26(3):716-723.
[14] 苗颖, 马俪珍, 孙贵宝, 等.人造肥牛脂肪稳定性及贮藏性研究[J].食品与机械, 2009, 25(2):23-25;37.
MIAO Y, MA L Z, SUN G B, et al.The study of stability and storage property of artificial beef fat[J].Food & Machinery, 2009, 25(2):23-25;37.
[15] 杨慧娟. 超高压处理改善低脂低盐猪肉糜制品乳化凝胶特性研究[D].南京:南京农业大学, 2017.
YANG H J.High pressure processing alters the emulsifying and gel properties of pork meat batters with low-fat and low-salt[D].Nangjing:Nanjing Agricultural University, 2017.
[16] CAO M J, CAO A L, WANG J,et al.Effect of magnetic nanoparticles plus microwave or far-infrared thawing on protein conformation changes and moisture migration of red seabream (Pagrus Major) fillets[J].Food Chemistry, 2018, 266(15):498-507.
[17] 郝婉名, 祝超智, 赵改名, 等.西门塔尔杂交牛不同部位肉间的差异性[J].肉类研究, 2019, 33(1):14-18.
HAO W M, ZHU C Z, ZHAO G M, et al.Differences in meat quality among different parts of crossbred simmental cattle[J].Meat Research, 2019, 33(1):14-18.
[18] WANG J C, KINSELLA J E.Functional properties of novel proteins:Alfalfa leaf protein[J].Journal of Food Science, 1976, 41(2):286-292.
[19] ZORBA Ö, KURT  , GENÇCELEP H, et al.The effects of different levels of skim milk powder and whey powder on apparent yield stress and density of different meat emulsions[J].Food Hydrocolloids, 2005, 19(1):149-155.
, GENÇCELEP H, et al.The effects of different levels of skim milk powder and whey powder on apparent yield stress and density of different meat emulsions[J].Food Hydrocolloids, 2005, 19(1):149-155.
[20] 张兴, 杨玉玲, 马云, 等.pH对肌原纤维蛋白及其热诱导凝胶非共价键作用力与结构的影响[J].中国农业科学, 2017, 50(3):564-573.
ZHANG X, YANG Y L, MA Y, et al.Effects of pH on the non-covalent forces and structure of myofibrillar protein and heat induced gel[J].Scientia Agricultura Sinica, 2017, 50(3):564-573.
[21] LIU Z M, FU X D, YUAN M X,et al.Surface charged amino acid-based strategy for rational engineering of kinetic stability and specific activity of enzymes:Linking experiments with computational modeling[J].International Journal of Biological Macromolecules, 2021, 182:228-236.
[22] WALTERS B T, MAYNE L, HINSHAW J R,et al.Folding of a large protein at high structural resolution[J].Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(47):18 898-18 903.
[23] 刁小琴, 关海宁, 李杨, 等.高压均质对肌原纤维蛋白乳化特性及结构的影响[J].食品与发酵工业, 2019, 45(18):107-112.
DIAO X Q, GUAN H N, LI Y, et al.Effects of high pressure homogenization on emulsifying properties and structure of myofibrillar protein[J].Food and Fermentation Industries, 2019, 45(18):107-112.
[24] 赵润泽, 蒋将, 李进伟, 等.烘烤对核桃蛋白二级结构、表面疏水性及乳化性的影响[J].食品工业科技, 2016, 37(16):157-160;166.
ZHAO R Z, JIANG J, LI J W, et al.Influence of roast processing on secondary structure, surface hydrophobicity and emulsifying properties of walnut protein[J].Science and Technology of Food Industry, 2016, 37(16):157-160;166.
[25] 赵改名, 张桂艳, 茹昂, 等..新疆褐牛不同部位肉品质特性差异分析[J].现代食品科技, 2021, 37(2):261-267;137.
ZHAO G M, ZHANG G Y, RU A, et al.Analysis of differences in meat quality characteristics of meat from different parts of Xinjiang brown cattle[J].Modern Food Science and Technology, 2021, 37(2):261-267;137.