咖啡是世界上三大无酒精饮料之一,是仅次于石油的第二大交易品[1]。咖啡生产过程中产生的咖啡果皮果肉废料,相当于生产等量的咖啡豆;随着咖啡豆需求量增大,咖啡果皮果肉废料越来越多[2],咖啡废料的回收利用逐渐被重视。此前已有研究探讨了咖啡果皮果肉废料的用途,TORRES-VALENZUELA等[3]通过利用超分子溶剂对咖啡果肉内的生物活性物质进行提取,并对其提取物质进行活性分析;REICHEMBACH等[4]从阿拉比卡咖啡果皮中提取果胶;SANTOS等[5]利用固态发酵处理咖啡浆,生产绿原酸。咖啡果皮果肉中含有大量的生物活性物质,例如绿原酸、芦丁、芒果苷、葫芦巴碱、花色苷等[6],这些物质具有良好的抗氧化活性[7]、抗炎活性[8]、抑菌活性[9],是制作功能性食品较为良好的原料。此外,咖啡果皮果肉中还含有某些能与药物共同反应生成具有良好的护肝、减脂、降压作用的物质[10]。已有大量将咖啡果肉应用于食品加工的研究,前人已检验面包[11]、酸奶[12]、茶叶[13]、饮料[14]的加工效果,但鲜有研究果酱工艺对咖啡果皮的影响。
果酱是全球最受欢迎的水果蜜饯食品之一[15]。果酱加工能够较好地保存水果中的营养。不同的果酱原料、加工工艺、加工温度、糖添加量对果酱成品的食用价值、功能价值都有一定的影响[16]。KAMILOGLU等[17]利用果酱工艺对黑胡萝卜进行果酱加工,有效提高了黑胡萝卜中多酚物质的可回收率和抗氧化能力。ADEOTI等[18]将生姜加入到西瓜果酱和菠萝果酱的加工生产中,可减少加工过程中营养物质的损失,且能够被大众接受。这些研究表明其他食品原料也可以利用果酱工艺加工或作为辅料添加,并取得很好的加工效果。基于此,本实验以咖啡果皮为原料,采用不同加热时间(10、20、30 min)和初始糖含量(66.67%、50.00%、33.33%,质量分数)完全组合的9种加工工艺制备咖啡果皮酱,对咖啡果皮酱理化性质、生物活性物质含量、抗氧化活性及贮存稳定性进行比较,分析加热时间和初始糖含量对咖啡果皮酱品质的影响,以期生产出具有良好品质的咖啡果皮酱,为咖啡果皮这一优质副产物资源的高值开发利用提供参考依据。
1 材料与方法
1.1 材料与试剂
咖啡浆果采自云南保山,咖啡品种为阿拉比卡;咖啡果皮自制,为咖啡浆果湿法脱皮后的副产物;蔗糖,云南阿鹏哥商贸有限公司;果胶、柠檬酸、山梨酸钾,永信食品配料有限公司;福利酚试剂,北京鼎国昌盛生物技术有限责任公司;DPPH,上海麦克林生化科技有限公司;芦丁、没食子酸,北京索莱宝科技有限公司;咖啡因、绿原酸,成都曼斯特生物科技有限公司。
1.2 仪器与设备
HBS-1096A酶标分析仪,南京德铁试验设备有限公司;ATC自动温度补偿手持折光仪,艾普计量仪器有限公司;101A-3型电热鼓风恒温干燥箱,上海市崇明试验仪器厂;KS-300D超声波清洗机,宁波海曙科生超声设备有限公司;UV-1600紫外可见分光光度计,上海美谱达仪器有限公司;MJ-WBL2501C便捷式搅拌机,广东美的生活电器制造有限公司;pH-280笔式酸度计,杭州陆恒生物科技有限公司;DTT-A+200电子天平,福州华志科学仪器有限公司。
1.3 实验方法
1.3.1 咖啡果皮酱生产工艺
咖啡果酱生产工艺及配料如图1和表1所示。
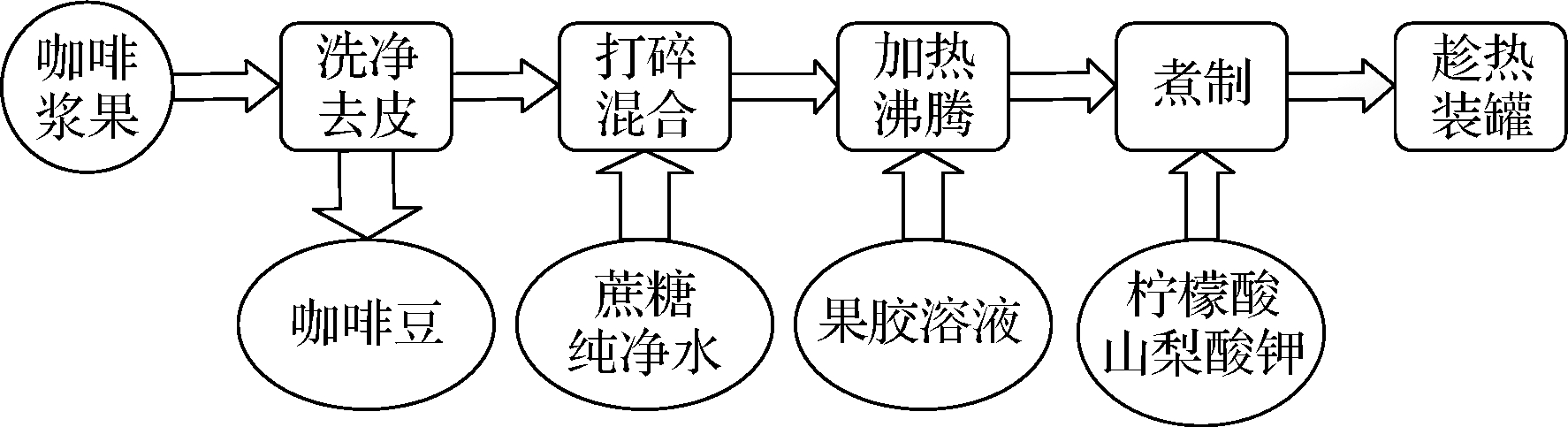
图1 咖啡果皮酱加工流程
Fig.1 Flow chart for processing coffee peel jam
表1 咖啡果皮酱的配料及工艺
Table 1 Formulation and technology of coffee peel jam

编号果皮量/g糖量/g果胶/g柠檬酸/g山梨酸钾/g加热时间/minH160030082.5110H260030082.5120H360030082.5130M145045082.5110M245045082.5120M345045082.5130L130060082.5110L230060082.5120L330060082.5130
1.3.2 咖啡果皮酱理化性质的测定
可溶性固体含量测定:使用折光仪进行测定可溶性固体含量测定;水分含量:参考GB 5009.3—2016《食品安全国家标准 食品中水分的测定》;酸碱度测定:使用带有温度探头的pH计测量pH;酸度测定:用0.1 mol/L氢氧化钠滴定测定酸度。
1.3.3 酚类化合物的提取
咖啡果皮酱中酚类化合物的提取参考RABABAH等[19]的方法并做了修改。用25 mL酸化甲醇提取每种果酱5 g,样品在40 ℃下超声提取30 min,定性滤纸过滤每种提取物并配制至25 mL,在进行测定前贮存在-20 ℃环境中。用作花色苷、总多酚、总黄酮含量以及抗氧化活性的测定。
1.3.4 花色苷含量的测定
利用酸碱度差法测定咖啡果皮酱中花色苷含量,用缓冲液(pH=1或pH=4.5)将50 μL甲醇提取物稀释到250 μL,在室温下反应1 h后,用紫外-可见分光光度计在530、657 nm测量吸光度。结果以每100 g果酱所含花色苷的质量表示,单位为mg/100g。
1.3.5 总多酚含量的测定
利用福林酚法测定咖啡果皮酱中总酚含量,利用96孔板分析,按照KAMILOGLU等[17]的方法并做了修改。将25 μL提取物加到200 μL新制备的福林酚试剂中,让混合物静置10 min,然后向混合物中加入25 μL 5%(质量分数)碳酸钠溶液。在室温下孵育30 min后,用酶标仪在760 nm处读数。使用没食子酸绘制标准曲线,结果以每100 g果酱所含没食子酸的质量表示,单位为mg/100g。
1.3.6 总黄酮含量的测定
根据PÉREZ-HERRERA等[20]的方法测定咖啡果皮酱中总黄酮含量,并做了修改。利用96孔板分析,将120 μL提取物加到10 μL 10%(质量分数)硝酸铝溶液中,静置6 min后加入120 μL 4%(质量分数)氢氧化钠溶液,静置15 min后在510 nm处测量吸光度。使用芦丁绘制标准曲线,结果以每100 g果酱所含芦丁的质量表示,单位为mg/100g。
1.3.7 绿原酸和咖啡因含量的测定
咖啡果皮酱中绿原酸与咖啡因的含量检测参考KHOCHAPONG等[2]的方法,并做了修改。首先用25 mL水溶解果酱,超声混匀30 min,定性滤纸过滤并定容到25 mL。将此液体与二氯甲烷液体以体积比1∶1混合振荡10 min。用分液漏斗分离绿原酸和咖啡因,分别得到上层和下层液体。样品提取3次,每次用25 mL二氯甲烷。以蒸馏水为空白,用分光光度法在324 nm处测定绿原酸(溶于蒸馏水中)的吸光度。咖啡因提取物(溶于二氯甲烷)在274 nm处进行分光光度测定,使用二氯甲烷作为空白。分别用绿原酸和咖啡因标准品溶于蒸馏水和二氯甲烷作标准曲线。结果以每100 g果酱所含绿原酸和咖啡因的质量表示,单位为mg/100g。
1.3.8 抗氧化活性的测定
咖啡果皮酱中生物活性物质抗氧化活性能力的检测参考MARTINSEN等[21]的方法,并做了一些修改,采用96孔板进行测定。将10 μL甲醇提取物加入到240 μL DPPH溶液中,立即记录吸光度(515 nm)。在下一次测量(515 nm)之前,样品在室温下保持黑暗120 min,以确保吸光度的降低。抗氧化活性以Trolox当量抗氧化能力表示,单位为μmol TE/100g。
1.4 数据处理与分析
使用SPSS 26.0和Origin 9.65进行数据统计分析,制图;采用单因素分析(ANOVA)和Tukey事后检验分析各组之间的显著差异,P<0.05表示有明显差异。
2 结果与分析
2.1 咖啡果皮酱的理化性质
表2显示9种咖啡果皮酱的4种理化指标,其中L3的可溶性固体含量最高,H1最低;L1的pH最高,H3最低;H3的酸度最高,L1最低;H1的水分含量最高,L3最低。咖啡果皮酱的可溶性固体含量由于糖添加量不同导致具有显著(P<0.05)差异,加热时长对咖啡果皮酱可溶性固体含量影响不显著(P>0.05)。原料比例不同是造成咖啡果皮酱pH差异的主要原因。此外,加热时长也对咖啡果皮酱的pH造成了一定影响。咖啡果皮酱的pH随着果皮添加量增多和加热时间延长而变小。咖啡果皮酱可滴定酸含量与咖啡果皮添加量成正比关系,这可能与咖啡果皮中含有某些果酸物质有关。咖啡果皮酱水分含量与咖啡果皮添加量成正比关系、与加热时长成反比关系。咖啡果皮酱中水分来源之一是咖啡果皮中的水分,加热过程中水分蒸发流失导致咖啡果皮酱的水分含量减少。
表2 咖啡果皮酱的理化指标
Table 2 Physical and chemical indexes of coffee peel jam
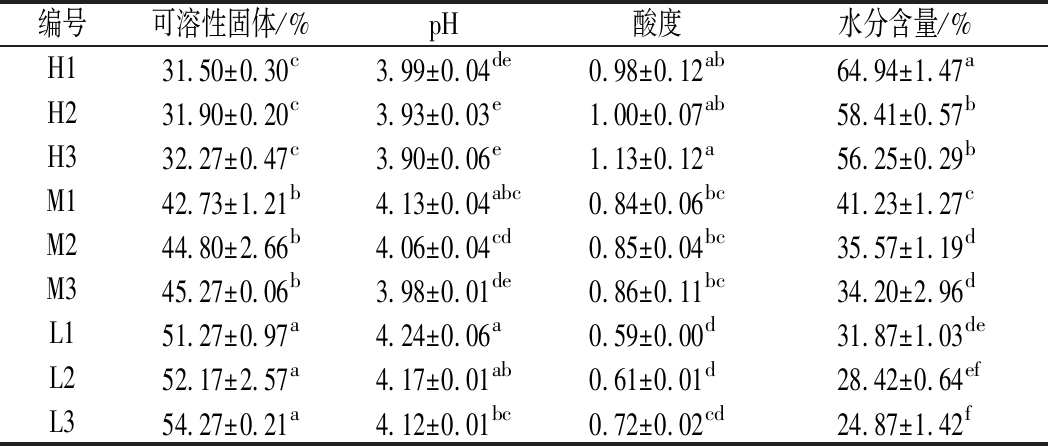
编号可溶性固体/%pH酸度水分含量/%H131.50±0.30c3.99±0.04de0.98±0.12ab64.94±1.47aH231.90±0.20c3.93±0.03e1.00±0.07ab58.41±0.57bH332.27±0.47c3.90±0.06e1.13±0.12a56.25±0.29bM142.73±1.21b4.13±0.04abc0.84±0.06bc41.23±1.27cM244.80±2.66b4.06±0.04cd0.85±0.04bc35.57±1.19dM345.27±0.06b3.98±0.01de0.86±0.11bc34.20±2.96dL151.27±0.97a4.24±0.06a0.59±0.00d31.87±1.03deL252.17±2.57a4.17±0.01ab0.61±0.01d28.42±0.64efL354.27±0.21a4.12±0.01bc0.72±0.02cd24.87±1.42f
注:同一列数据后不同字母表示在P<0.05水平上的显著性差异(下同)
2.2 咖啡果皮酱生物活性物质
由图2可知,加热时间长短对咖啡果皮酱花色苷含量有显著影响(P<0.05),加热时长为10 min的3种果酱花色苷含量平均为56.52 mg/100g,加热时长为20 min的3种果酱花色苷含量平均为50.67 mg/100g,加热时长为30 min的3种果酱花色苷含量平均为43.54 mg/100g,可得出加热时间越长,花色苷含量越低。其原因是咖啡果皮中花色苷在受热情况下会分解为其他物质,受热时间越长,咖啡果皮中花色苷分解越多。每100 g咖啡果皮在低、中、高糖含量的加热过程中,花色苷分别降解42.44、43.23、26.98 mg;与低糖和中糖含量相比,高糖含量的咖啡果皮酱在加热过程中咖啡果皮内的花色苷更稳定。这一结果与![]() 等[22]研究蓝莓果酱的结果相似。花色苷不稳定是由其结构组成中黄酮核缺乏电子所引起的,而糖可以吸收黄酮离子,以此来稳定花色苷;在高糖含量下,水活性被降低,形成氧气屏障,使花色苷能够稳定保留[23]。此外,低糖含量下美拉德反应产物也会对花色苷的稳定造成影响,加快花色苷的降解速度[24]。
等[22]研究蓝莓果酱的结果相似。花色苷不稳定是由其结构组成中黄酮核缺乏电子所引起的,而糖可以吸收黄酮离子,以此来稳定花色苷;在高糖含量下,水活性被降低,形成氧气屏障,使花色苷能够稳定保留[23]。此外,低糖含量下美拉德反应产物也会对花色苷的稳定造成影响,加快花色苷的降解速度[24]。

图2 不同工艺对花色苷含量的影响
Fig.2 Effect of processes on the content of anthocyanins
由图3可知,加热时间长短对咖啡果皮酱绿原酸含量有显著影响(P<0.05),加热时长为10 min的3种果酱绿原酸含量平均为77.22 mg/100g,加热时长为20 min的3种果酱绿原酸含量平均为66.78 mg/100g,加热时长为30 min的3种果酱绿原酸含量平均为61.11 mg/100g;可得出加热时间越长,绿原酸含量越低。绿原酸不稳定是因为其分子骨架中具有醋键和多元酚结构,醋键易水解,而多元酚易被氧化[25]。每100 g咖啡果皮在低、中、高糖含量的加热过程中,绿原酸分别降解63.26、38.02、44.52 mg;与中糖和高糖含量相比,低糖含量的咖啡果皮酱在加热过程中咖啡果皮内的绿原酸更易降解。咖啡果皮中绿原酸在中糖和高糖含量中稳定的原因可能是蔗糖被咖啡果皮中果酸物质催化水解成单糖,单糖在高温下发生焦糖化反应,达到与β-环糊精形成包合物稳定绿原酸一样的效果[26]。
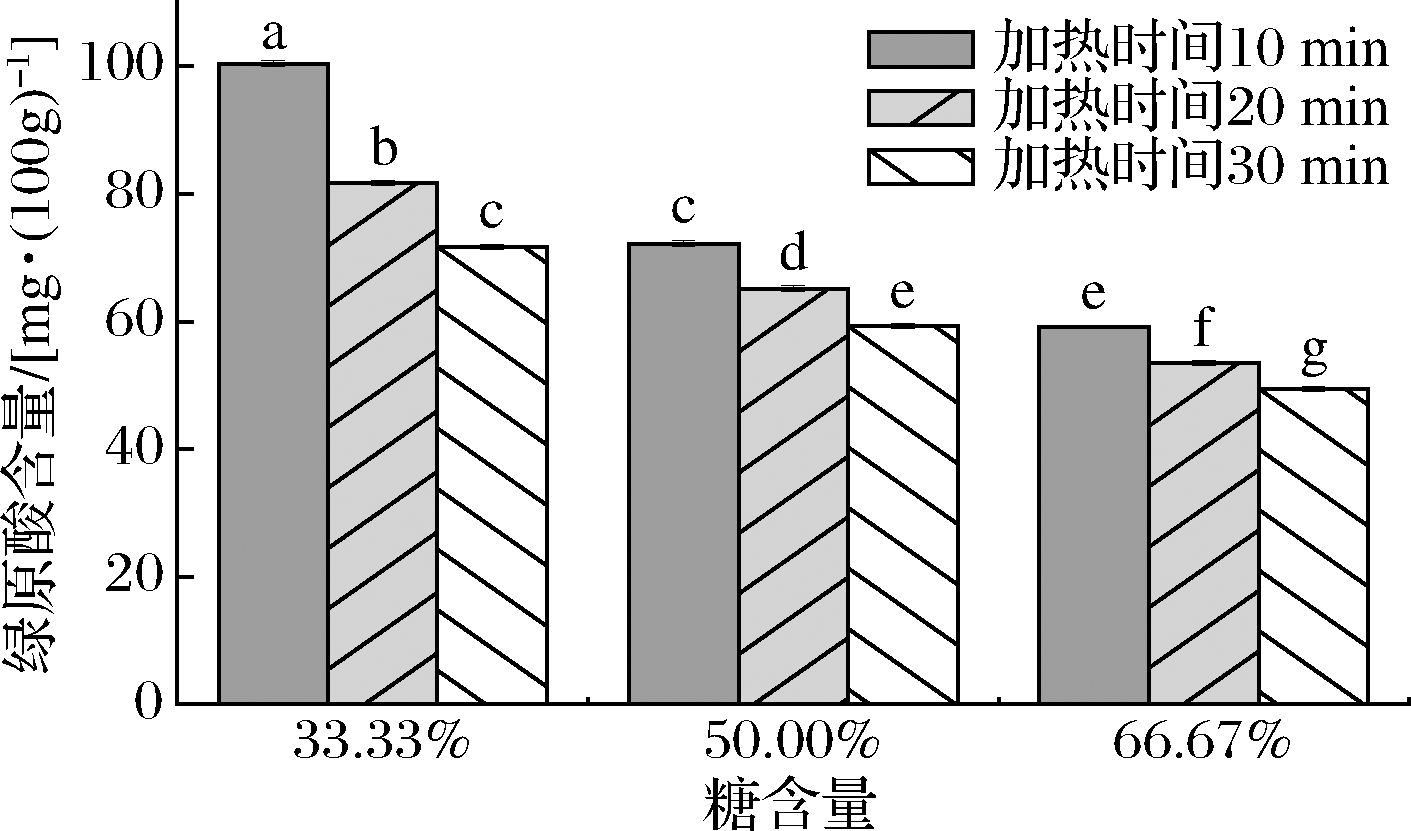
图3 不同工艺对绿原酸含量的影响
Fig.3 Effect of processes on the content of chlorogenic acid
由图4可知,咖啡因含量在咖啡果皮酱中受加热时间长短的影响不显著(P>0.05),加热时长为10 min 的3种果酱咖啡因含量平均为6.64 mg/100g,加热时长为20 min的3种果酱咖啡因含量平均为6.58 mg/100g,加热时长为30 min的3种果酱咖啡因含量平均为6.5 mg/100g。在不同糖含量下咖啡因含量的变化趋势大致相同,既不迅速增加,也不迅速减少,咖啡因含量大致维持不变的原因可能与咖啡因的结构组成有关。咖啡因又称1,3,7-三甲基黄嘌呤,是一种生物碱化合物,只有在200 ℃以上的温度环境中才会分解[27],而在进行咖啡果皮酱加工的过程中,咖啡果皮酱沸腾时其温度低于200 ℃,无法对咖啡因造成显著影响,导致咖啡果皮酱中咖啡因含量在受热过程中可能达到趋于稳定的状态。
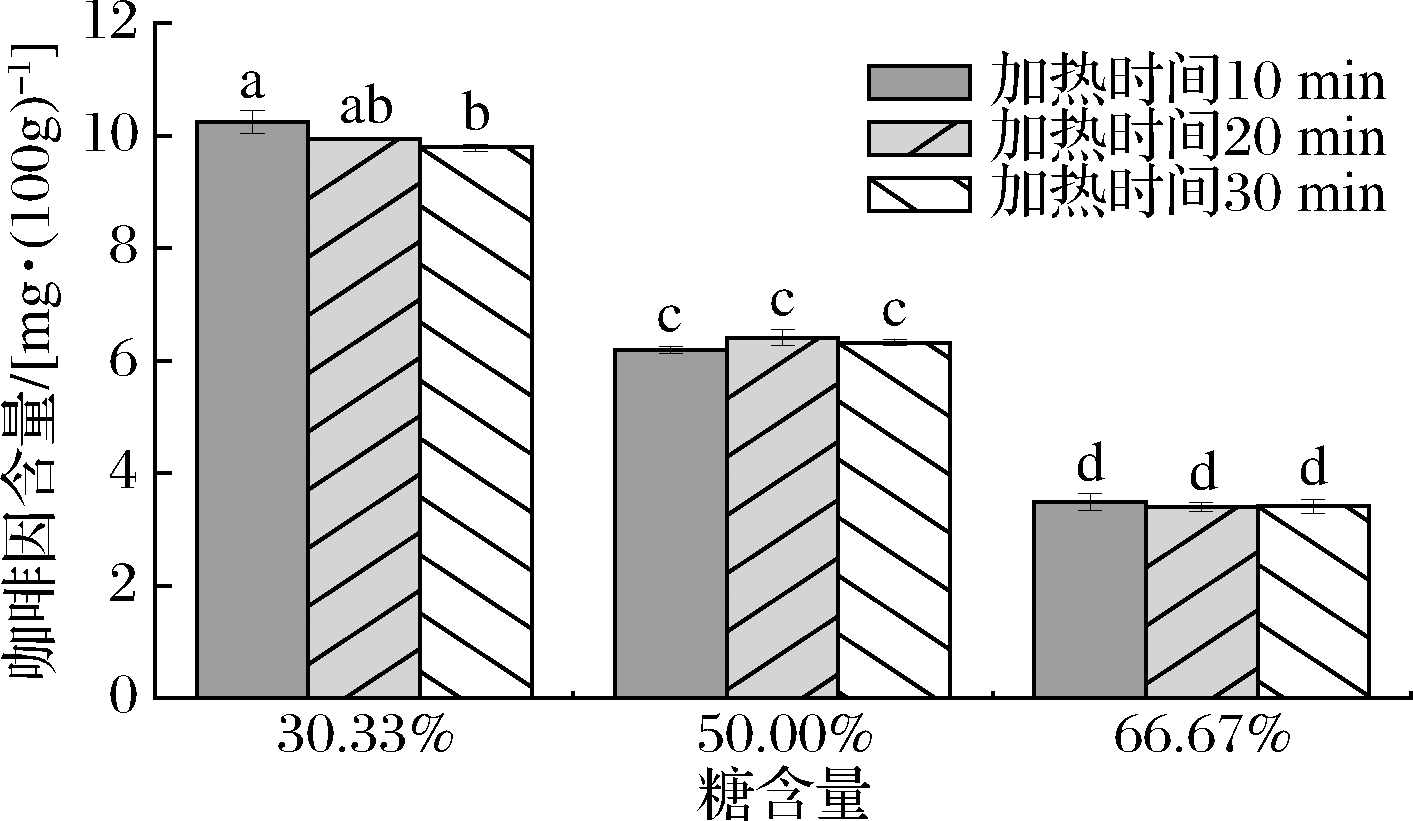
图4 不同工艺对咖啡因含量的影响
Fig.4 Effect of processes on the content of caffeine
由图5可知,加热时间长短对咖啡果皮酱总多酚含量有显著影响(P<0.05),加热时长为10 min的3种果酱总多酚含量平均为119.89 mg/100g,加热时长为20 min的3种果酱总多酚含量平均为109.11 mg/100g,加热时长为30 min的3种果酱总多酚含量平均为101.78 mg/100g;可得出加热时间越长,总多酚含量越低。每100 g咖啡果皮在低、中、高糖含量的加热过程中,总多酚分别降解25.49、56.57、111.65 mg;可以推断:在一定糖含量范围内,随着咖啡果皮酱中糖含量的增加,加热过程中果皮总多酚降解速度变快。这一结果与KOPJAR等[28]对草莓果酱加工的研究结果类似。果酱中总多酚含量减少主要是因为水果的细胞结构在果酱加工过程中被破环,发生非酶促氧化。果酱中多酚物质在加热过程中受糖含量的影响机制依旧是难题,且在不同果酱中是不一样的,![]() 等[22]对高从蓝莓果酱的研究和KAMILOGLU等[17]对黑胡萝卜果酱的研究都表明了高糖含量的果酱在加热过程中能够更好地保持总多酚物质,然而本研究和KOPJAR等[28]的研究都表明了低糖含量的果酱在加热过程中能够更好地维持果酱中总多酚含量。
等[22]对高从蓝莓果酱的研究和KAMILOGLU等[17]对黑胡萝卜果酱的研究都表明了高糖含量的果酱在加热过程中能够更好地保持总多酚物质,然而本研究和KOPJAR等[28]的研究都表明了低糖含量的果酱在加热过程中能够更好地维持果酱中总多酚含量。

图5 不同工艺对总多酚含量的影响
Fig.5 Effect of processes on the content of polyphenols
由图6可知,咖啡果皮酱中总黄酮含量受制作咖啡果皮酱加热时间长短的影响不显著(P>0.05)。加热时长为10 min的3种果酱总黄酮含量平均为1.79 mg/100g,加热时长为20 min的3种果酱总黄酮含量平均为1.76 mg/100g,加热时长为30 min的3种果酱总黄酮含量平均为1.73 mg/100g。每100 g咖啡果皮在低、中、高糖含量的加热过程中,总黄酮分别降解0.15、0.24、0.31 mg,由此可以推断,在一定糖含量范围内,随着咖啡果皮酱中糖含量的增加,加热过程中果皮中总黄酮降解速度变快。
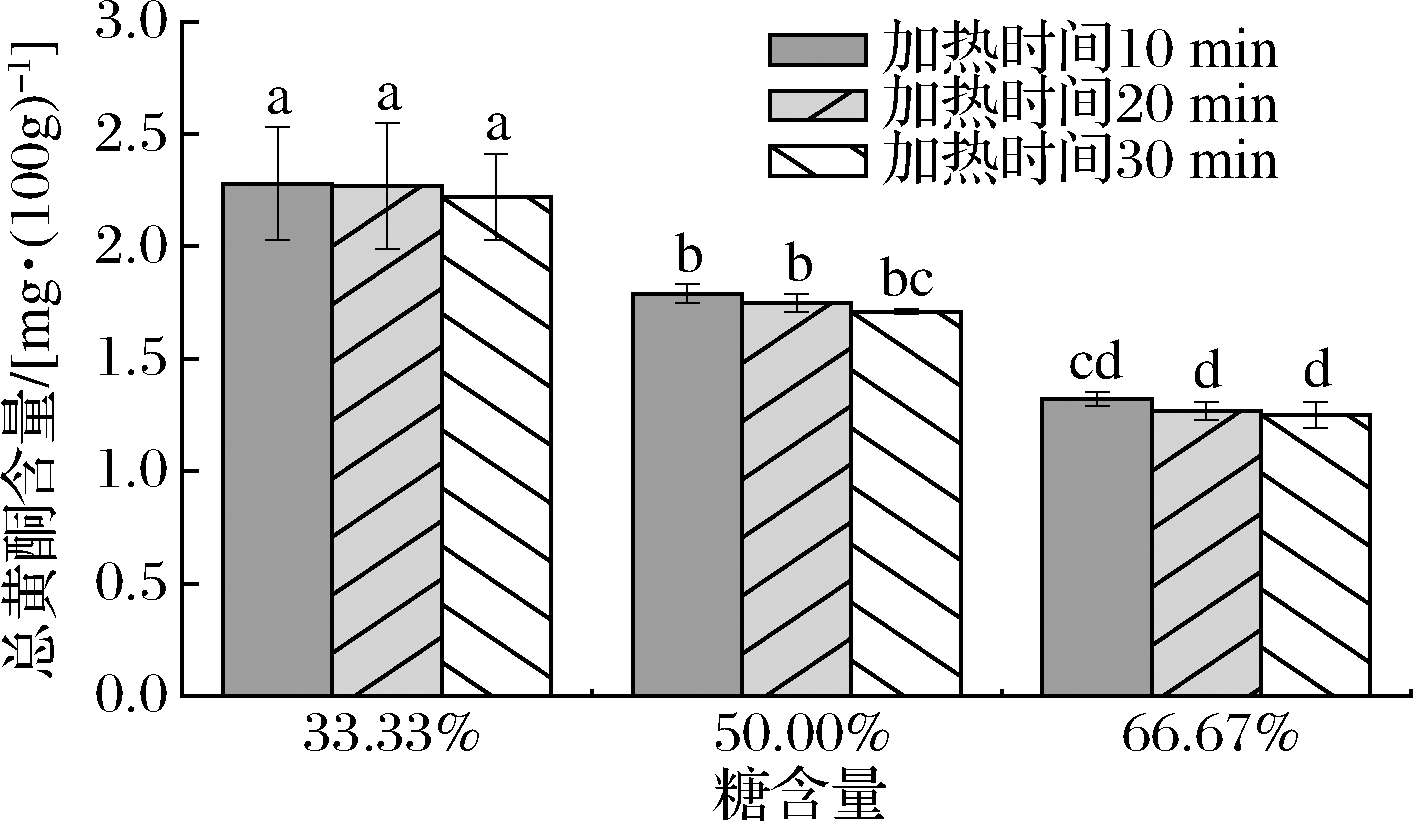
图6 不同工艺对总黄酮含量的影响
Fig.6 Effect of processes on the content of flavonoids
由图7可知,加热时间长短对咖啡果皮酱抗氧化活性强弱有显著影响(P<0.05),加热时长为10 min的3种果酱抗氧化活性平均为842.03 μmol TE/100g,加热时长为20 min的3种果酱抗氧化活性平均为802.90 μmol TE/100g,加热时长为30 min的3种果酱抗氧化活性平均为755.87 μmol TE/100g;可得出加热时间越长,抗氧化活性越弱。每100 g咖啡果皮在低、中、高糖含量的加热过程中,抗氧化性分别减弱394.19、263.42、113.16 μmol TE;可以推断:在一定糖含量范围内,随着咖啡果皮酱中糖含量的增加,加热过程中果皮的抗氧化活性减弱速度变慢。这一现象是由于高糖含量在加热条件下形成酸性更低的环境,使得果酱中生物活性物质得到保护,降解速率变慢[29],从而导致抗氧化活性减弱变慢。

图7 不同工艺对抗氧化活性的影响
Fig.7 Effect of processes on the antioxidant activity
2.3 不同贮存条件的影响
如图8所示,低温贮存能够有效抑制咖啡果皮酱中酚类化合物的降解。低温贮存环境下,9种果酱总酚含量平均降低了9.56%;常温贮存环境下,9种果酱总酚含量平均降低了16.98%。果酱中多酚物质在贮存期的降解主要是由果酱中残留的多酚氧化酶造成的[30],低温环境抑制酶活性,减少了酚类化合物发生反应降解。加热时长为10 min的3种果酱总酚含量平均降低了14.89%,加热时长为20 min的3种果酱总酚含量平均降低了15.70%,加热时长为30 min的3种果酱总酚含量平均降低了14.42%。加热时间为10、20 min的咖啡果皮酱在贮存期开始阶段总多酚含量都呈现了微小的上升趋势。这可能与咖啡果皮酱中某些物质的降解有关,这种物质降解过程中会生成多酚类物质导致总多酚含量上升;而加热时间为30 min的咖啡果酱总多酚含量在贮存期开始时就呈现下降趋势,是由于上述物质在加热时就已经降解丢失,导致贮存过程中没有这种物质的降解,总酚含量不会上升。这一现象在MAZUR等[31]的研究中出现过,其研究中这种物质是鞣花单宁。若没有这种物质的影响,则说明加热时间较长的咖啡果皮酱比加热时间较短的咖啡果皮酱更能够有效保留多酚物质。在整个贮藏过程中,低、中、高糖含量果酱中果皮的总酚含量分别平均降低了21.16%、29.54%、32.76%,因此,低糖含量的咖啡果皮酱能够在贮存过程中有效地保留咖啡果皮中的总酚。
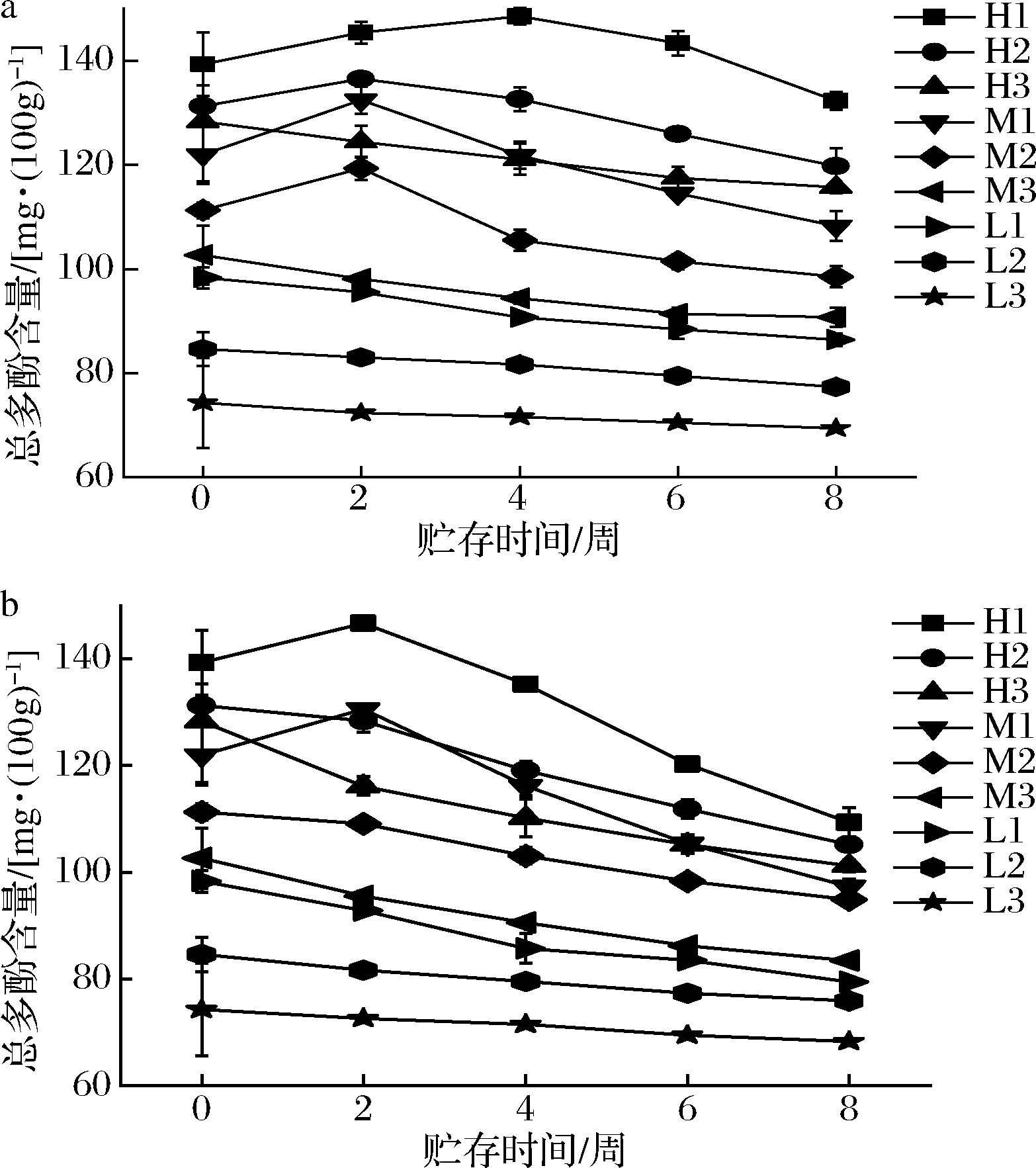
a-4 ℃贮存环境;b-23 ℃贮存环境
图8 贮存过程中总多酚含量的变化
Fig.8 Change of polyphenols content during storage
如图9所示,低温贮存环境和常温贮存环境下,咖啡果皮酱中花色苷含量都呈现下降趋势。低温贮存环境下,9种果酱花色苷含量平均降低了20.42%;常温贮存环境下,9种果酱花色苷含量平均降低了38.72%。表明在低温贮存环境中,咖啡果皮酱中花色苷更稳定,这一结果与MARTINSEN等[21]对草莓果酱和蓝莓果酱的研究结果相似。贮存过程中果酱中花色苷降解主要是由于糖苷酶和多酚氧化酶的作用[30],低温环境更利于咖啡果皮酱中花色苷保存的原因可能是这2种酶在低温环境中的活性被抑制,无法发挥作用。加热时长为10 min的3种果酱花色苷含量平均降低了32.56%,加热时长为20 min的3种果酱花色苷含量平均降低了29.96%,加热时长为30 min 的3种果酱花色苷含量平均降低了26.19%,表明制作过程中加热时间越长的咖啡果皮酱越能在贮存过程中更有效地保留花色苷,这也与糖苷酶和多酚氧化酶存在一定的关系。在前期制作过程中,加热时间越长,咖啡果皮酱中这2种酶失活越多,让花色苷能够稳定保存。在整个贮藏过程中,低、中、高糖含量果酱中果皮的花色苷含量分别平均降低了49.64%、59.08%、78.25%;表明低糖含量的咖啡果皮酱能够在贮存过程中有效地保留咖啡果皮中的花色苷。在贮存期开始阶段,4、23 ℃环境中,花色苷含量下降都较为迅速,而到贮存后期,花色苷含量下降都变得较为缓慢,其原因可能是咖啡果皮酱中各种花色苷的稳定性不太相同。在贮存期开始阶段,不稳定的花色苷开始降解;在贮存阶段后期,不稳定的花色苷已经降解完全,剩下的花色苷较为稳定,造成贮存后期花色苷降解速度变慢。

a-4 ℃贮存环境;b-23 ℃贮存环境
图9 贮存过程中花色苷含量的变化
Fig.9 Change of anthocyanins content during storage
如图10所示,低温贮存环境和常温贮存环境下,咖啡果皮酱绿原酸含量都呈现下降趋势。低温贮存环境下,9种果酱绿原酸含量平均降低了3.67%;常温贮存环境下,9种果酱绿原酸含量平均降低了7.04%。表明低温贮存更能保留咖啡果皮酱绿原酸含量。加热时长为10 min的3种果酱绿原酸含量平均降低了6.08%,加热时长为20 min的3种果酱绿原酸含量平均降低了5.45%,加热时长为30 min的3种果酱绿原酸含量平均降低了4.53%,表明制作过程中加热时间越长的咖啡果皮酱越能够在贮存过程中有效地保留绿原酸含量。在整个贮藏过程中,低、中、高糖含量果酱中果皮的绿原酸含量分别平均降低了8.54%、10.54%、15.00%;表明低糖含量的咖啡果皮酱能够在贮存过程中有效地保留咖啡果皮中的绿原酸。
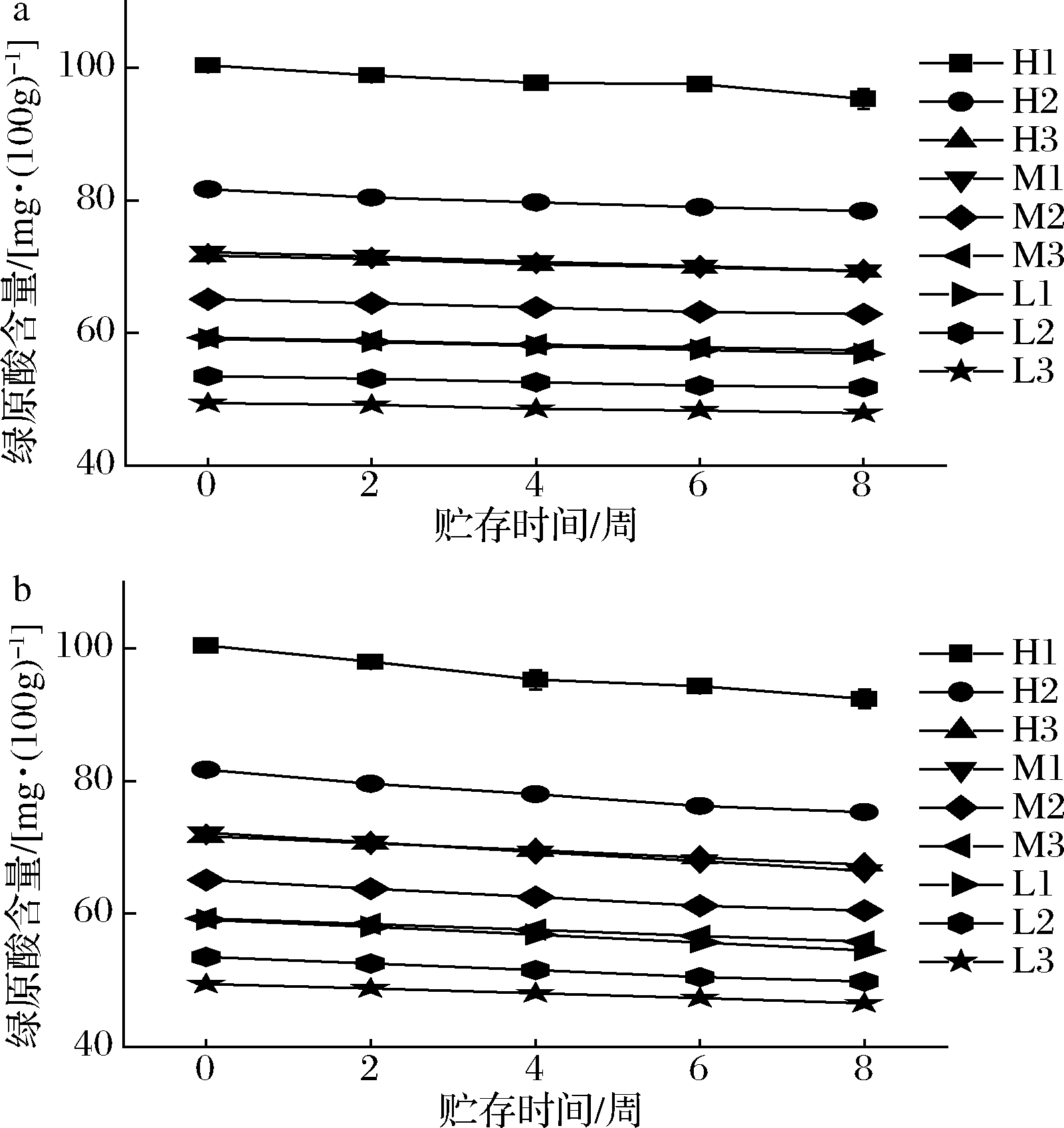
a-4 ℃贮存环境;b-23 ℃贮存环境
图10 贮存过程中绿原酸含量的变化
Fig.10 Change of chlorogenic acid content during storage
如图11所示,低温贮存环境和常温贮存环境下,咖啡果皮酱的抗氧化活性都呈现降低趋势。低温贮存环境下,9种果酱抗氧化活性平均降低了9.57%;常温贮存环境下,9种果酱抗氧化活性平均降低了14.02%。表明低温贮存更能保留咖啡果皮酱抗氧化活性。加热时长为10 min的3种果酱抗氧化活性平均降低了13.88%,加热时长为20 min的3种果酱抗氧化活性平均降低了10.96%,加热时长为30 min的3种果酱抗氧化活性平均降低了7.82%。表明制作过程中加热时间越长的咖啡果皮酱越能够在贮存过程中有效地保留抗氧化活性。在整个贮藏过程中,低、中、高糖含量果酱中果皮的抗氧化活性分别平均降低了17.49%、11.57%、6.34%;表明高糖含量的咖啡果皮酱能够在贮存过程中有效地保留抗氧化活性,可能是因为在高糖含量的咖啡果皮酱中,抗氧化活性可以由聚合花色苷或美拉德反应产物来补偿[32]。

a-4 ℃贮存环境;b-23 ℃贮存环境
图11 贮存过程中抗氧化活性的变化
Fig.11 Change of antioxidant activity during storage
3 结论
加热时长和糖含量对小粒咖啡果皮酱品质都有一定的影响,短时加热可有效保留咖啡果皮酱中的生物活性物质,但残留的酶活性较高,不利于贮存;长时加热能够有效降低咖啡果皮酱中的酶活性,但在加工工程中导致生物活性物质大量降解。在加热过程中,糖含量对咖啡果皮中的生物活性物质的降解影响规律各不相同;在贮存过程中,低糖含量咖啡果皮酱更能保留果皮中的生物活性物质,高糖含量咖啡果皮酱更能保留抗氧化活性。综上所述,在该实验中利用加热时长为20 min和50%糖含量工艺加工可得到品质较好且贮存期较为稳定的咖啡果皮酱。咖啡果皮酱是一种新型食品,它利用了咖啡加工的副产物(咖啡果皮),有助于减少环境污染,提高农业经济。该试验为咖啡果皮的处理提供新思路,但对于咖啡果皮酱的工业生产还需要进一步研究。
[1] CHEN X M, MA Z L, KITTS D D.Effects of processing method and age of leaves on phytochemical profiles and bioactivity of coffee leaves[J].Food Chemistry,2018,249:143-153.
[2] KHOCHAPONG W, KETNAWA S, OGAWA Y, et al.Effect of in vitro digestion on bioactive compounds, antioxidant and antimicrobial activities of coffee (Coffea arabica L.) pulp aqueous extract[J].Food Chemistry,2021,348:129094.
[3] TORRES-VALENZUELA L S, BALLESTEROS-GóMEZ A, RUBIO S.Supramolecular solvent extraction of bioactives from coffee cherry pulp[J].Journal of Food Engineering,2020,278:109933.
[4] REICHEMBACH L H, DE OLIVEIRA PETKOWICZ C L.Extraction and characterization of a pectin from coffee (Coffea arabica L.) pulp with gelling properties[J].Carbohydrate Polymers,2020,245:116473.
[5] SANTOS DA SILVEIRA J, DURAND N, LACOUR S, et al.Solid-state fermentation as a sustainable method for coffee pulp treatment and production of an extract rich in chlorogenic acids[J].Food and Bioproducts Processing,2019,115:175-184.
[6] GEMECHU F G.Embracing nutritional qualities, biological activities and technological properties of coffee byproducts in functional food formulation[J].Trends in Food Science & Technology,2020,104:235-261.
[7] IRIONDO-DEHOND A, APARICIO GARC A N, FERNANDEZ-GOMEZ B, et al.Validation of coffee by-products as novel food ingredients[J].Innovative Food Science & Emerging Technologies,2019,51:194-204.
A N, FERNANDEZ-GOMEZ B, et al.Validation of coffee by-products as novel food ingredients[J].Innovative Food Science & Emerging Technologies,2019,51:194-204.
[8] REBOLLO-HERNANZ M, ZHANG Q Z, AGUILERA Y, et al.Phenolic compounds from coffee by-products modulate adipogenesis-related inflammation, mitochondrial dysfunction, and insulin resistance in adipocytes, via insulin/PI3K/AKT signaling pathways[J].Food and Chemical Toxicology,2019,132:110672.
[9] COLLAZO-BIGLIARDI S, ORTEGA-TORO R, CHIRALT A.Improving properties of thermoplastic starch films by incorporating active extracts and cellulose fibres isolated from rice or coffee husk[J].Food Packaging and Shelf Life,2019,22:100383.
[10] ONTAWONG A, BOONPHANG O, PASACHAN T, et al.Hepatoprotective effect of coffee pulp aqueous extract combined with simvastatin against hepatic steatosis in high-fat diet-induced obese rats[J].Journal of Functional Foods,2019,54:568-577.
[11] RIOS M B, IRIONDO-DEHOND A, IRIONDO-DEHOND M, et al.Effect of coffee cascara dietary fiber on the physicochemical, nutritional and sensory properties of a gluten-free bread formulation[J].Molecules(Basel,Switizerland),2020,25(6):1 358.
[12] IRIONDO-DEHOND M, IRIONDO-DEHOND A, HERRERA T, et al.Sensory acceptance, appetite control and gastrointestinal tolerance of yogurts containing coffee-cascara extract and inulin[J].Nutrients,2020,12(3):627.
[13] 何红艳, 程金焕, 黄家雄,等.咖啡果茶的制作工艺研究[J].农产品加工,2020(6):21-22;28.
HE H Y,CHENG J H,HUANG J X, et al.Study on the production technology of coffee peel tea[J].Farm Products Processing,2020(6):21-22;28.
[14] HEEGER A, ![]() A, CANTERGIANI E, et al.Bioactives of coffee cherry pulp and its utilisation for production of cascara beverage[J].Food Chemistry,2017,221:969-975.
A, CANTERGIANI E, et al.Bioactives of coffee cherry pulp and its utilisation for production of cascara beverage[J].Food Chemistry,2017,221:969-975.
[15] ABID M, YAICH H, HIDOURI H, et al.Effect of substituted gelling agents from pomegranate peel on colour, textural and sensory properties of pomegranate jam[J].Food Chemistry,2018,239:1 047-1 054.
[16] 郑炯,陈琪,曾瑞琪,等.竹笋膳食纤维对黄桃果酱品质的影响[J].食品与发酵工业,2019,45(5):177-184.
ZHENG J,CHEN Q,ZENG R Q, et al.Effect of dietary fiber from bamboo shoots on the quality of yellow peach jam[J].Food and Fermentation Industries,2019,45(5):177-184.
[17] KAMILOGLU S, PASLI A A, OZCELIK B, et al.Influence of different processing and storage conditions on in vitro bioaccessibility of polyphenols in black carrot jams and marmalades[J].Food Chemistry,2015,186:74-82.
[18] ADEOTI O A, ALABI A O, ELUTILO O O.Physicochemical, anti-oxidant and sensory characteristics of spiced jam from blends of selected tropical fruits[J].Asian Food Science Journal,2021:28-40.
[19] RABABAH T M, AL-MAHASNEH M A, KILANI I, et al.Effect of jam processing and storage on total phenolics, antioxidant activity, and anthocyanins of different fruits[J].Journal of the Science of Food and Agriculture,2011,91(6):1 096-1 102.
[20] PÉREZ-HERRERA A, MART NEZ-GUTIÉRREZ G A, LE
NEZ-GUTIÉRREZ G A, LE N-MART
N-MART NEZ F M, et al.The effect of the presence of seeds on the nutraceutical, sensory and rheological properties of Physalis spp.Fruits jam:A comparative analysis[J].Food Chemistry,2020,302:125141.
NEZ F M, et al.The effect of the presence of seeds on the nutraceutical, sensory and rheological properties of Physalis spp.Fruits jam:A comparative analysis[J].Food Chemistry,2020,302:125141.
[21] MARTINSEN B K, AABY K, SKREDE G.Effect of temperature on stability of anthocyanins, ascorbic acid and color in strawberry and raspberry jams[J].Food Chemistry,2020,316:126297.
[22] ![]() I, MITEK M.Effect of processing and storage conditions on phenolic compounds and antioxidant capacity of highbush blueberry jams[J].Polish Journal of Food and Nutrition Sciences,2009,59(1):45-52.
I, MITEK M.Effect of processing and storage conditions on phenolic compounds and antioxidant capacity of highbush blueberry jams[J].Polish Journal of Food and Nutrition Sciences,2009,59(1):45-52.
[23] SHINWARI K J, RAO P S.Stability of bioactive compounds in fruit jam and jelly during processing and storage:A review[J].Trends in Food Science & Technology,2018,75:181-193.
[24] FERNANDES A, BR S N F, MATEUS N, et al.Understanding the molecular mechanism of anthocyanin binding to pectin[J].Langmuir: the ACS Journal of Surfaces and Colloids,2014,30(28):8 516-8 527.
S N F, MATEUS N, et al.Understanding the molecular mechanism of anthocyanin binding to pectin[J].Langmuir: the ACS Journal of Surfaces and Colloids,2014,30(28):8 516-8 527.
[25] SATO Y, ITAGAKI S, KUROKAWA T, et al.In vitro and in vivo antioxidant properties of chlorogenic acid and caffeic acid[J].International Journal of Pharmaceutics,2011,403(1-2):136-138.
[26] 沈奇, 吴晓慧, 王敏,等.蒲公英绿原酸β-环糊精包合物的鉴定及抗氧化作用的研究[J].食品科学,2007,28(3):30-34.
SHEN Q,WU X H,WANG M, et al.Study on identification and anti-lipid peroxidation effects of β-cyclodextrin inclusion of chlorogenic acid extracted from dandelion[J].Food Science, 2007,28(3):30-34.
[27] REZAEI H, RAHIMPOUR E, ZHAO H K, et al.Solubility measurement and thermodynamic modeling of caffeine in N-methyl-2-pyrrolidone isopropanol mixtures at different temperatures[J].Journal of Molecular Liquids,2021,336:116519.
[28] KOPJAR M, ![]() V, TIBAN N N, et al.Strawberry jams:Influence of different pectins on colour and textural properties[J].Czech Journal of Food Sciences,2009,27:20-28.
V, TIBAN N N, et al.Strawberry jams:Influence of different pectins on colour and textural properties[J].Czech Journal of Food Sciences,2009,27:20-28.
[29] ISTRATI D, VIZIREANU C, IORDACHESCU G, et al.Physico-chemical characteristics and antioxidant activity of goji fruits jam and jelly during storage[J].Annals of the University Dunarea de Jos of Galati,2013,37(2):100-110.
[30] RAWSON A, PATRAS A, TIWARI B K, et al.Effect of thermal and non thermal processing technologies on the bioactive content of exotic fruits and their products:Review of recent advances[J].Food Research International,2011,44(7):1 875-1 887.
[31] MAZUR S P, NES A, WOLD A B, et al.Effect of genotype and storage time on stability of colour, phenolic compounds and ascorbic acid in red raspberry (Rubus idaeus L.) jams[J].Acta Agriculturae Scandinavica, Section B-Soil & Plant Science,2014,64(5):442-453.
[32] HOWARD L R, CASTRODALE C, BROWNMILLER C, et al.Jam processing and storage effects on blueberry polyphenolics and antioxidant capacity[J].Journal of Agricultural and Food Chemistry,2010,58(7):4 022-4 029.