明胶是食品工业中重要的添加剂,其凝胶具有热可逆性的独特优势,同时具有良好的乳化性和起泡性,广泛应用于各类食品的生产。食用明胶通常源自猪、牛、禽等动物,但疯牛病等疫病的蔓延使消费者对这些明胶的安全性产生质疑,同时宗教文化如穆斯林、印度教、犹太教规定也使得哺乳动物明胶的应用受到限制[1-2]。与之相反,鱼类明胶安全性高,应用不受宗教文化限制,我国拥有大量的鱼类胶原资源,鱼皮明胶的开发具有巨大的潜力。然而,鱼皮明胶的脯氨酸和羟脯氨酸含量显著低于哺乳动物明胶,导致其凝胶强度、成胶融胶温度较低,制约了鱼皮明胶在食品中的应用[3]。马哈鱼是冷水性鱼类,前期研究显示马哈鱼鱼皮明胶中羟脯氨酸比例较低,凝胶性能较差[4-5],马哈鱼鱼皮明胶的食品化应用急需有效提升其凝胶性能的技术。
近年来,多酚类物质以安全性高、有益于健康、接受度高的特点成为食品添加剂的发展方向。酚类化合物富含酚羟基,可与蛋白质分子形成共价或非共价作用,促使蛋白质发生交联[6-7],同时还可能氧化形成醌类物质并进一步与蛋白质形成醌类蛋白质加和物,提高蛋白质的凝胶性能[8]。有学者发现椰子壳和腰果树皮的粗多酚提取物可提升鱼皮明胶的凝胶强度[9-13]。CAO等[14]发现阿魏酸和单宁酸可通过与明胶交联改善凝胶的机械性能。尚美君[5]发现适量单宁和芦丁以及氧化单宁、氧化芦丁可提升河豚鱼皮明胶凝胶性能。然而基于酚类物质提升鱼类明胶凝胶性能的报道仍相对较少,效应与机制有待进一步研究。为此,本文以马哈鱼鱼皮明胶为原料,考察单宁酸、芦丁及二者的氧化态对马哈鱼明胶凝胶特性的影响,包括凝胶强度、色差、微观结构、二级结构和蛋白形式,旨在为改善其明胶凝胶性能,拓展应用空间提供方法。
1 材料与方法
1.1 原料与设备
原材料:马哈鱼鱼皮,辽宁远洋渔业公司提供(鱼皮解冻,剔尽鱼肉,冰水冲洗,剪成0.5 cm×0.5 cm小块,封于自封袋中,-20 ℃储存备用)。单宁酸、芦丁(分析纯),上海生工生物工程公司。
仪器设备:TA质构仪,英国SMS公司;UltraScan色差仪,美国HunterLab公司;ATTO垂直电泳系统,日本ATTO公司;Nicolet iS20红外光谱仪,美国赛默飞公司;低场核磁分析仪,苏州纽迈公司;JSM-7800F扫描电镜,日本电子公司。
1.2 实验方法
1.2.1 多酚溶液和鱼皮明胶胶冻的制备
多酚溶液制备方法参照TENDEE等[10]。称取2份相同质量的单宁酸(tannin acid,T)或芦丁(rutin,R),分别溶于60 ℃水中,并调节pH至8,即得多酚溶液;另一份多酚溶液中由氮吹仪控制通入流速0.5 L/min的O2[5],于40 ℃氧化1 h,即得氧化多酚溶液(oxidized tannin acid,OT和oxidized rutin,OR)。
马哈鱼皮明胶提取参照刘洋等[4]的方法,采用0.05 mol/L NaOH溶液碱洗,0.1 mol/L H3PO4溶胀,用热水法于40 ℃提取,明胶溶液纱布过滤后,冻干制备鱼皮明胶。称取一定量明胶冻干粉溶于36 ℃水中,加入一定量多酚或氧化多酚溶液,使其为明胶质量的2%、4%、6%、8%(质量分数),调总体积至明胶质量分数6.67%,然后分别移入小烧杯中,于4 ℃冷却24 h,获得明胶胶冻。
1.2.2 明胶胶冻凝胶强度测定
明胶胶冻的凝胶强度参照课题组前期方法[4-5],通过质构仪获取。质构仪操作参数为:P/5探头,测前速度1.00 mm/s,测试速度0.5 mm/s,测后速度10 mm/s,穿透4 mm,测试距离15 mm。
1.2.3 明胶胶冻色差测定
明胶胶冻的色差由测色仪测定。仪器校准后,采用L*值(亮度)、a*值(红-绿)和b*(黄-蓝)值表示[4-5]。
1.2.4 明胶胶冻水分分布测定
鱼皮明胶胶冻的水分分布参照DONG等[11]方法测定。将胶冻样品置于一个直径25 mm的圆柱形玻璃管,插入到环境温度为4 ℃的核磁共振探头中,收集脉冲序列(carr-purcell-meiboom-gill,CPMG)衰变信号,分析自旋弛豫时间(T2)[5]。扫描次数:4次,回声数据:5 000次,反演得到横向弛豫时间。
1.2.5 鱼皮明胶胶冻的微观结构观察
将明胶胶冻于冰温案板上切割成1 mm厚的小薄片,迅速固定于涂有导电胶的冷场电镜样品台中,并采用液氮雪泥立即冰冻,传输至冷场样品制备腔中冷台后进行淬断,并于-60 ℃升华15 min,最后传输进扫描电镜进行微观结构观察并拍照。
1.2.6 明胶胶冻蛋白条带分析
参考LAEMMLI等[12]的方法,采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)法对明胶胶冻蛋白条带进行分析。将胶冻放置室温下缓化1 h,混匀后稀释10倍,85 ℃水浴加热1 h,离心(3 500×g)5 min,上清液与上样缓冲溶液(0.5 mol/L Tris-HCl-2% SDS-25%甘油,pH 6.8)以体积比1∶1混合,沸水浴4 min。电泳仪条件为:浓缩胶5%,分离胶10%,上样量10 μL,浓缩胶和分离胶电流分别为15和30 mA[5]。经考马斯亮蓝R-250染色,脱色后凝胶成像仪拍照观察蛋白条带。
1.2.7 鱼皮明胶胶冻二级结构分析
采用傅里叶变换红外光谱(Fourier transform infrared,FTIR)仪分析鱼皮明胶胶冻结构。将冻干胶冻样品与溴化钾制成薄片,再由夹具放入FTIR红外光谱仪中进行测量。在400~4000 cm-1扫描,扫描次数为32次,分辨率为4 cm-1,室内温度为25 ℃[5]。
1.3 数据统计
试验数据通过SPSS 16.0软件分析,以平均值±标准偏差表示。采用单因素方差法以及Duncan法进行多重比较差异分析(P<0.05)。
2 结果与分析
2.1 鱼皮明胶胶冻的凝胶强度
图1-a中,与对照组相比,单宁酸添加组胶冻的凝胶强度显著改善,并在2%~6%的区间呈现剂量效应,添加质量分数为8%凝胶强度不再增加,与6%添加组持平,接近200 g。氧化单宁酸添加组凝胶强度也显著增加,但不存在剂量效应,添加量为4%时最高,为198 g。单宁酸与氧化单宁酸组凝胶强度差异不大,仅T-6、OT-6与T-8和OT-8组轻微差异。以上结果表明,单宁酸能够显著提升马哈鱼鱼皮明胶的凝胶强度,最大增幅接近85%,这与不少多酚与鱼明胶互作的研究结果相一致[8,13]。单宁酸含有大量的酚羟基,可能与明胶蛋白相互作用形成氢键,故能提高明胶的凝胶性能。也有研究发现多酚氧化后形成的醌类物质可与蛋白分子的巯基、氨基等基团发生反应[5],形成加和物也可促进蛋白质的凝胶性能[7,14]。本研究发现单宁酸与氧化单宁酸的作用效果区别不大,表明单宁酸对马哈鱼鱼皮明胶凝胶强度的提升主要源于蛋白分子与单宁酸较弱的非共价作用,可能主要是氢键键合效应。AEWSIRI等[13]也发现,单宁酸与乌贼明胶的非共价交联作用比氧化单宁酸与乌贼明胶的共价作用更强烈,对于明胶的界面特性影响更大。
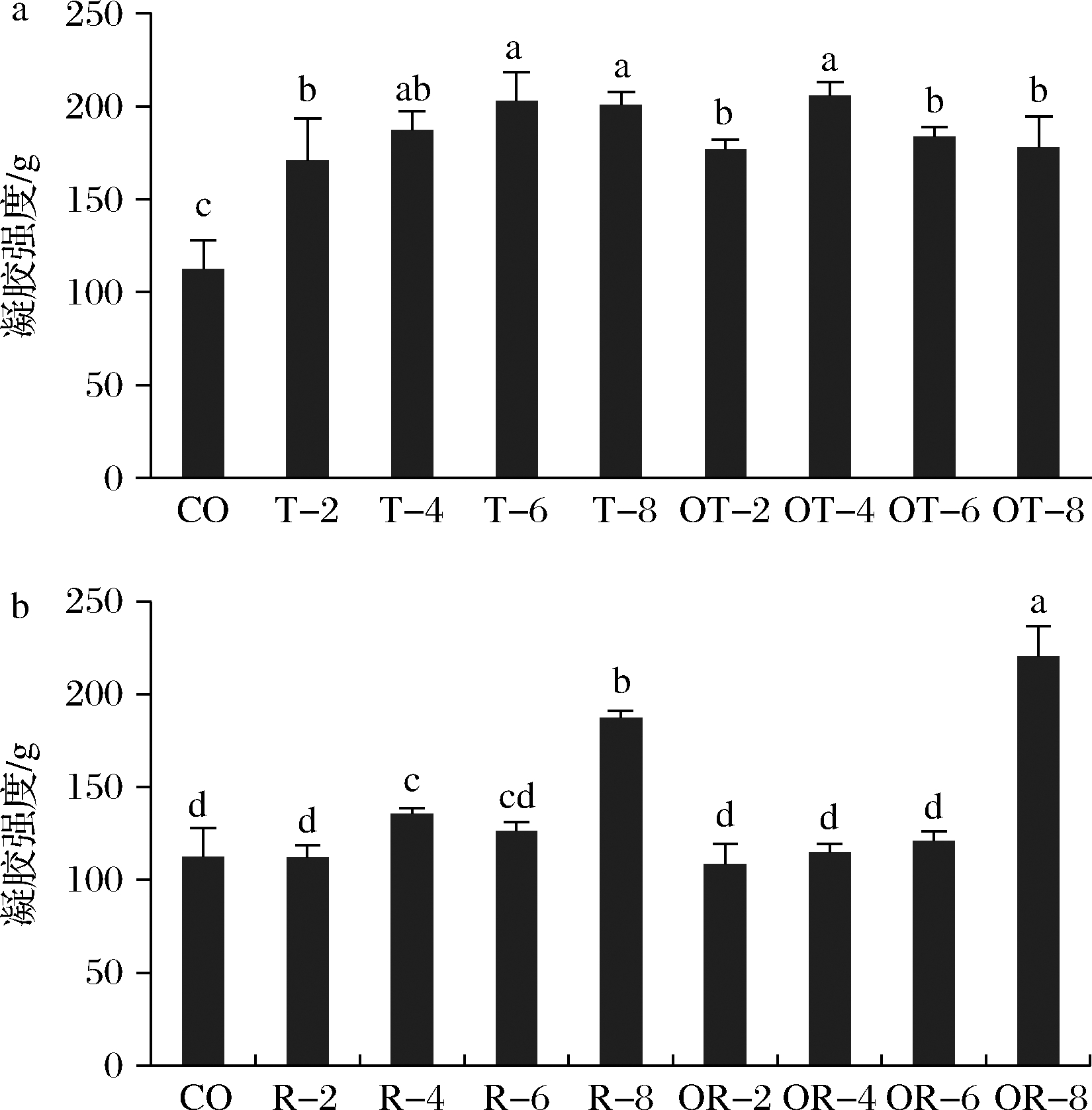
a-2%~8%单宁酸和氧化单宁酸;b-2%~8%芦丁和氧化芦丁 CO-对照;T-单宁酸;OT-氧化单宁酸;R-芦丁;OR-氧化芦丁;2%~8%单宁酸和氧化单宁酸分别标记为T-2、T-4、T-6、T-8、OT-2、OT-4、OT-6和OT-8(a);2%~8%芦丁和氧化芦丁分别标记为R-2、R-4、R-6、R-8、 OR-2、OR-4、OR-6和OR-8(b)
图1 单宁酸、氧化单宁酸和芦丁、氧化芦丁对马哈鱼 鱼皮明胶胶冻凝胶强度的影响
Fig.1 Gel strength of gelatin from chum salmon skin with oxidized and non-oxidized tannin acid and rutin
注:不同小写字母表示具有显著差异(P<0.05)(下同)
图1-b显示,与对照组相比,添加质量分数2%芦丁后鱼皮明胶凝胶强度无明显变化,当添加4%和8%芦丁后,鱼皮明胶凝胶强度有所增加(P<0.05);添加低剂量氧化芦丁(2%~6%)对于鱼皮明胶凝胶强度影响不大(P>0.05),而当加入8%氧化芦丁后鱼皮明胶凝胶强度显著增加(P<0.05)。与氧化芦丁相比,芦丁对于马哈鱼鱼皮明胶凝胶强度改善效应相对较好。本研究中芦丁或者氧化芦丁添加质量分数至8%时马哈鱼鱼皮明胶凝胶强度均能提升>70%,尤其是OR-8组,这与YAN等[15]的结果一致。同时,各浓度的芦丁与氧化芦丁结果相近,只有OR-8凝胶强度略高于R-8。以上结果表明低浓度的芦丁对马哈鱼鱼皮明胶的凝胶特性作用不大,高浓度的则可显著提升凝胶强度,氧化与否对于芦丁的凝胶增强效应影响不大,这也表明芦丁对鱼皮明胶的作用主要是较弱的非共价形式。与单宁酸相比,相同浓度的芦丁对鱼皮明胶的凝胶增强效果较弱,可能由于芦丁的酚羟基个数相对单宁较少,产生的蛋白与多酚氢键作用相对较弱,故单宁的凝胶改善效果更显著。
2.2 鱼皮明胶胶冻的颜色特征
表1展示了单宁酸、氧化单宁酸和芦丁、氧化芦丁对马哈鱼鱼皮明胶胶冻颜色性质的影响。与对照组相比,添加单宁酸或氧化单宁酸后胶冻L*值降低,a*和b*值有轻微升高,尤其T-8最显著。L*值随添加剂量升高而降低,a*和b*值随添加剂量升高而升高。以上结果表明,单宁酸的添加轻微降低了明胶胶冻的亮度,并略微加深了红色和黄色。单宁酸在偏碱性条件下可部分氧化转变成醌,此过程伴随颜色的加深。由于本实验中并非真空环境,可能单宁有部分氧化转变成醌,导致a*上升,即轻微变红,图2的凝胶颜色图片证实了该结果。同时,T组与OT组颜色差异不大,可能在pH 8时单宁酸的氧化进程不强烈,对颜色干涉作用不显著。
表1 添加单宁酸、芦丁及其氧化态后马哈鱼鱼皮明胶的色差
Table 1 Colour differences of chum salmon skin gelatin after addition with tannin acid,rutin and their oxidized products
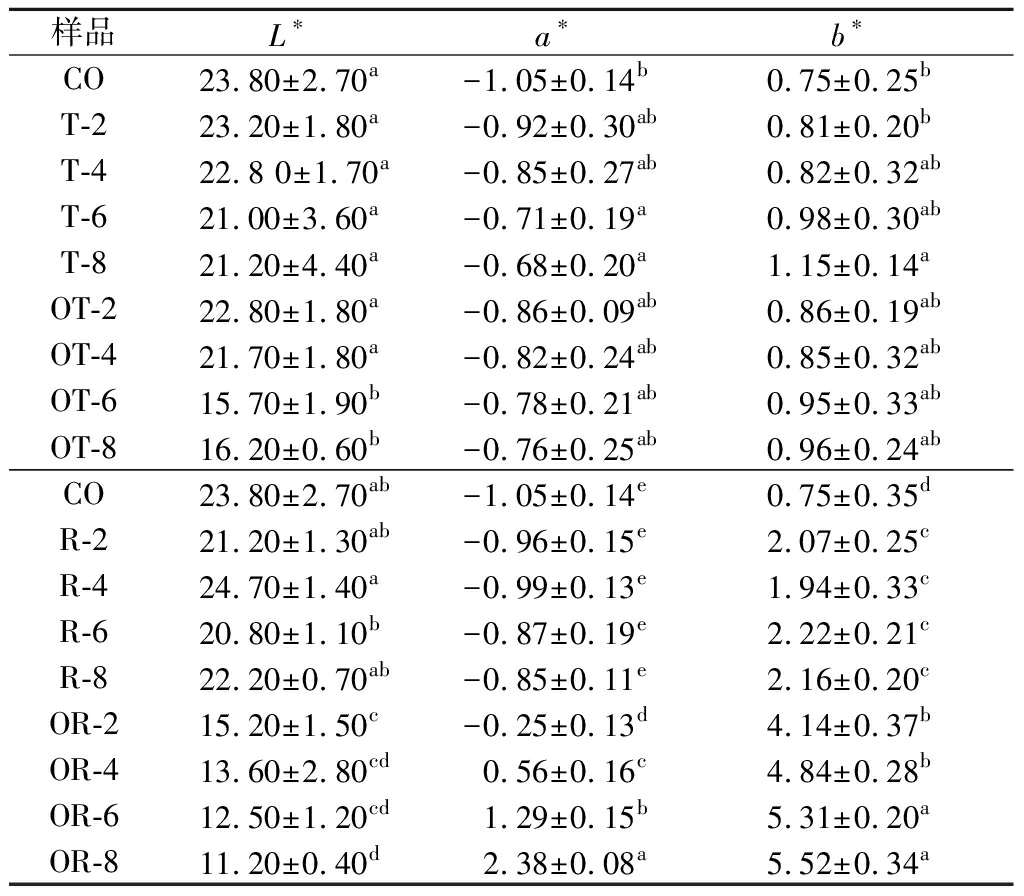
样品L∗a∗b∗CO23.80±2.70a-1.05±0.14b0.75±0.25bT-223.20±1.80a -0.92±0.30ab0.81±0.20bT-422.8 0±1.70a-0.85±0.27ab0.82±0.32abT-621.00±3.60a-0.71±0.19a0.98±0.30abT-821.20±4.40a -0.68±0.20a1.15±0.14aOT-222.80±1.80a-0.86±0.09ab0.86±0.19abOT-421.70±1.80a-0.82±0.24ab0.85±0.32abOT-615.70±1.90b-0.78±0.21ab0.95±0.33abOT-816.20±0.60b-0.76±0.25ab0.96±0.24abCO23.80±2.70ab-1.05±0.14e0.75±0.35dR-221.20±1.30ab-0.96±0.15e2.07±0.25cR-424.70±1.40a-0.99±0.13e1.94±0.33cR-620.80±1.10b-0.87±0.19e2.22±0.21cR-822.20±0.70ab-0.85±0.11e2.16±0.20cOR-215.20±1.50c-0.25±0.13d4.14±0.37bOR-413.60±2.80cd0.56±0.16c4.84±0.28bOR-612.50±1.20cd1.29±0.15b5.31±0.20aOR-811.20±0.40d2.38±0.08a5.52±0.34a
与对照相比,加入芦丁后明胶胶冻L*值稍有下降,而a*、b*值呈现增加,趋势不太显著。然而,氧化芦丁组L*值显著低于对照组,a*、b*值高于对照组。以上结果表明芦丁轻微增加了胶冻的颜色,但氧化芦丁则显著降低了马哈鱼鱼皮明胶胶冻的亮度,大幅度增加了胶冻的红色与黄色。图2直观地展示了芦丁、氧化芦丁添加组的颜色差异,与各值相对应。可能由于pH 8时芦丁易氧化,形成大量醌类物质,呈深棕色。类似的多酚引起的蛋白凝胶颜色加深现象在TEMDEE等[10]和KAEWDANG等[9]的研究中也有报道,但影响程度有所差异,这与多酚的性质和胶冻母体蛋白性质有关。以上结果表明,添加单宁酸对明胶胶冻色差影响不大,而加入氧化芦丁对胶冻黄度和红度影响较大。

图2 添加单宁酸、芦丁及其氧化态后马哈鱼 鱼皮明胶外观颜色图
Fig.2 Appearance photos of chum salmon skin gelatin after addition with tannin acid,rutin and their oxidized products
2.3 鱼皮明胶凝胶水分分布
采用低场核磁分析了马哈鱼鱼皮胶冻在单宁酸、氧化单宁酸和芦丁、氧化芦丁作用下的水分分布。如图3所示,胶冻显示多个T2弛豫时间峰,但主峰T22均处在100~1 000 ms。T2弛豫图谱表示母体中质子的分布,由于样品中不存在脂肪,故本研究中主要代表明胶胶冻的水分分布,主峰T22则代表胶冻网络结构中的可移动水。与对照组相比,添加单宁或氧化单宁的明胶胶冻增加T22弛豫主峰由464 ms向更短弛豫时间迁移,尤其T-8左移到403 ms,OT-4则为351 ms。同时,添加芦丁和氧化芦丁的各组T22弛豫主峰由最初的613 ms向更短弛豫时间迁移,其中T-8变为533 ms,OT-8缩短为464 ms。一般来说,较短的弛豫时间意味着水的流动性差,水分与母体物料结合较紧密,而较长的弛豫时间表明水的流动性强,水分与母体物料结合较弱[16-17]。以上结果表明,在单宁酸、氧化单宁酸和芦丁、氧化芦丁的作用下,马哈鱼明胶中的水分更为稳定,这与单宁酸、芦丁及二者氧化态添加后的凝胶强度增强相一致,侧面反映了凝胶性能的改善。

a-单宁酸;b-氧化单宁酸;c-芦丁;d-氧化芦丁
图3 添加单宁酸、芦丁及其氧化态后马哈鱼鱼皮明胶水分分布(T2弛豫时间谱图)
Fig.3 Water status (T2 relaxation time spectra) of chum salmon skin gelatin after addition with tannin acid,rutin and their oxidized products
2.4 鱼皮明胶凝胶微观结构
为了直观解析胶冻的凝胶性能改变,采用扫描电镜分析了几组代表性样品——添加4%和8%的单宁酸、芦丁及其氧化态后的马哈鱼鱼皮胶冻的显微结构(图4)。所有胶冻样品显示出典型的海绵状多孔、网状结构,对照组胶冻的网状结构孔隙较大,R-4和OR-4组与其微观结构类似,孔洞较大,但R-8和OR-8组胶冻孔洞显著变小,尤其OR-8组,微观结构非常致密。与此同时,T-4、T-8和OT-8胶冻孔洞与对照组相比略微变小,OT-4组则明显变小,孔洞较致密。胶冻微观结构与各自对应的胶冻凝胶强度一致,尤其是OR-8和OT-4,致密微观结构与二者较高的凝胶强度相吻合。类似结果在KAEWDANG等[9]椰子壳提取物和LEE等[18]单宁酸促明胶改善的研究中都有观察到。明胶的凝胶强度直接取决于明胶胶冻的微观结构,后者又主要取决明胶基质中蛋白质分子的排列和缔合程度[19]。研究结果表明,单宁酸、氧化单宁酸和芦丁、氧化芦丁可能改变鱼皮明胶的交联效率,改善三维网络结构,增强凝胶性能,单宁酸作用效果总体略优于芦丁。

图4 添加单宁酸、芦丁及其氧化态后马哈鱼鱼皮明胶 扫描电镜图(放大倍数2 000×)
Fig.4 SEM micrographs of chum salmon skin gelatin after addition with tannin acid,rutin and their oxidized products (magnification 2 000×)
2.5 鱼皮明胶凝胶蛋白形式
多酚类物质改善蛋白质的凝胶性能存在着多种途径,一般认为多酚可与肌原纤维蛋白[20]、胶原蛋白[21]等通过共价与非共价方式形成交联[22]。具体何种作用方式占主导取决于蛋白所处的多酚环境。为了探究单宁、芦丁对马哈鱼鱼皮明胶凝胶特性的作用机制,分析了添加单宁酸、氧化单宁酸和芦丁、氧化芦丁的鱼皮明胶胶冻的蛋白形式,结果如图5所示。所有的胶冻样品都有3条较清晰的α1、α2和β链,并且在顶端都有一定量的聚合物产生。图5明胶蛋白条带并未因其单宁酸、芦丁及其氧化态介入而有较大变化,主体条带灰度和蛋白条带数量都较稳定,这表明胶冻并未发生蛋白质间的共价交联或降解,凝胶强度提升不是因为共价键蛋白分子聚集造成,而是明胶蛋白分子间氢键,疏水作用或静电作用等引起[5]。本文结果与KAEWDANG等[9],LEE等[18]和YASIN等[23]的研究结果不同,但与ANVARI等[24]的结论相似。根据电泳与凝胶强度结果推断,低浓度单宁酸因羟基增多可能增加与蛋白质间的氢键键合,促进凝胶改善,但高浓度单宁酸尤其氧化单宁酸可能因其结构过大,破坏了稳定凝胶的静电作用,使得明胶蛋白共价交合区域的形成受到抑制,反而未能增加单宁酸或氧化单宁酸的蛋白共价交联效应,促凝胶作用与低浓度相差不大。芦丁酚羟基少于单宁酸,因此促氢键键合作用一般,低浓度下凝胶增强效果不显著。高浓度的芦丁和氧化芦丁则可能增加了氢键键合作用,并未破坏明胶分子间静电作用,因此凝胶强度显著增加。
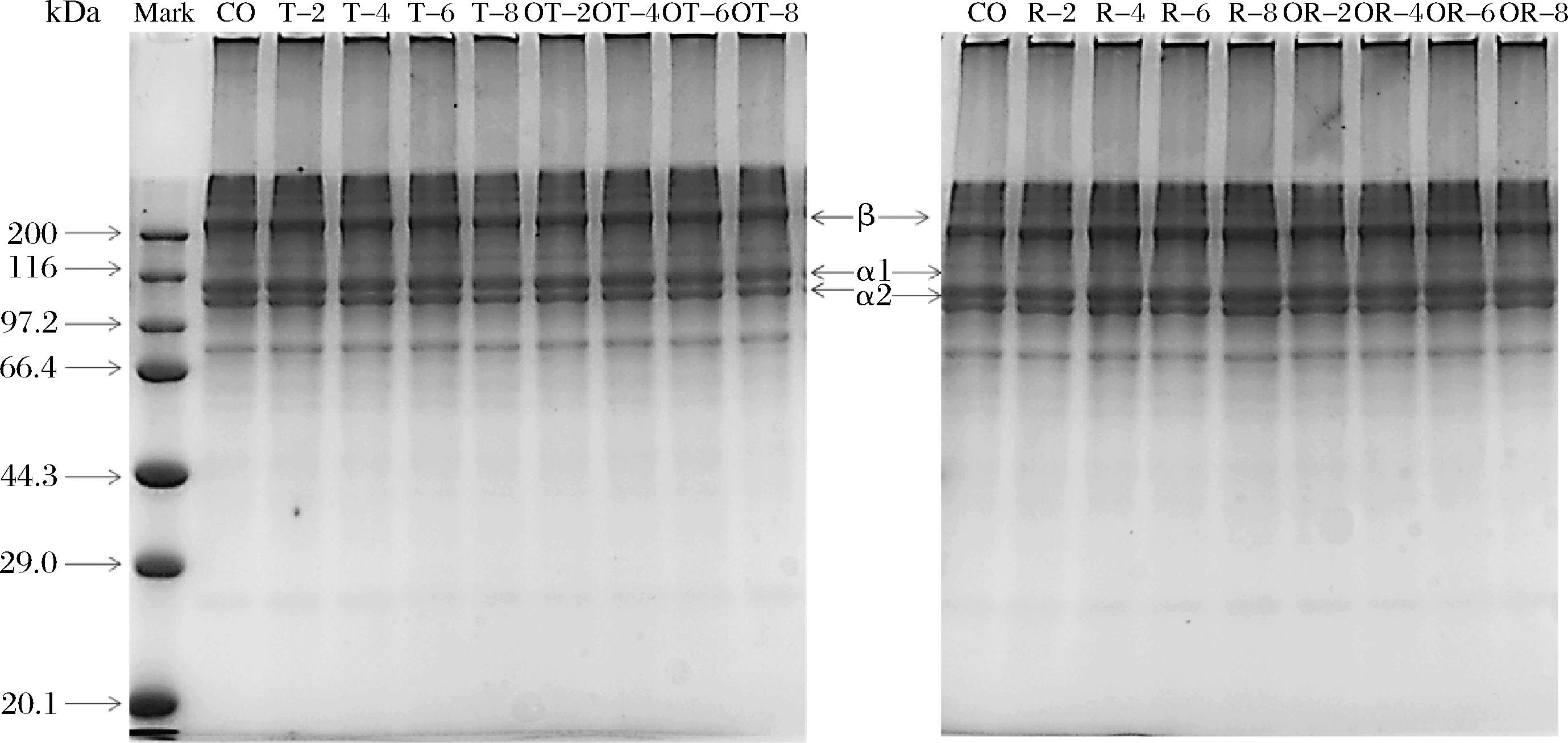
图5 添加单宁酸、芦丁及其氧化态后马哈鱼鱼皮明胶SDS-PAGE电泳图
Fig.5 SDS-PAGE spectrum of of chum salmon skin gelatin after addition with tannin acid,rutin and their oxidized products
2.6 鱼皮明胶凝胶蛋白二级结构
进一步分析了马哈鱼鱼皮胶冻在单宁酸和芦丁及其二者氧化形式下的红外光谱,结果如图6所示。本研究发现明胶样品较相近的红外光谱特征,其中特征结构如酰胺-Ⅰ,酰胺-Ⅱ,酰胺-Ⅲ,酰胺-A和酰胺-B构成。酰胺I波段被认为是C![]() O拉伸振动,与氢键结合[5,25]。在对照组、2%、4%、6%和8%(单宁酸)组分别出现在1 664~1 665、1 665~1 668、1 673~1 675、1 667~1 669、1 666~1 667 cm-1处;2%、4%、6%、8%(芦丁)组分别出现在1 667~1 669、1 664~1 666、1 670~1 673、1 669~1 672 cm-1处;在2%、4%、6%、8%(氧化单宁酸)组分别出现在1 666~1 669、1 667~1 668、1 669~1 670、1 665~1 667 cm-1;而在2%、4%、6%、8%(氧化芦丁)组分别出现在1 663~1 665、1 666~1 668、1 671~1 672、1 668~1 669 cm-1处。这提示单宁酸及芦丁的加入使胶冻的酰胺-Ⅰ带向高波数方向移动,其中添加单宁酸的移动幅度最大[5]。原因可能是单宁酸中富含酚羟基,经氧化形成醌类衍生物,导致大量的C
O拉伸振动,与氢键结合[5,25]。在对照组、2%、4%、6%和8%(单宁酸)组分别出现在1 664~1 665、1 665~1 668、1 673~1 675、1 667~1 669、1 666~1 667 cm-1处;2%、4%、6%、8%(芦丁)组分别出现在1 667~1 669、1 664~1 666、1 670~1 673、1 669~1 672 cm-1处;在2%、4%、6%、8%(氧化单宁酸)组分别出现在1 666~1 669、1 667~1 668、1 669~1 670、1 665~1 667 cm-1;而在2%、4%、6%、8%(氧化芦丁)组分别出现在1 663~1 665、1 666~1 668、1 671~1 672、1 668~1 669 cm-1处。这提示单宁酸及芦丁的加入使胶冻的酰胺-Ⅰ带向高波数方向移动,其中添加单宁酸的移动幅度最大[5]。原因可能是单宁酸中富含酚羟基,经氧化形成醌类衍生物,导致大量的C![]() O基团暴露,从而增强酰胺-Ⅰ带的信号强度[5]。酰胺-Ⅱ带由C—N基团的向外伸缩振动和肽平面内N—H的形变所引起[25]。所有明胶样品的酰胺-Ⅱ带出现在1 438~1 440 cm-1,没有较大的变化。所有明胶样品的酰胺-Ⅱ带出现在1 438~1 440 cm-1,没有较大的变化。对照组及单宁酸(氧化前与氧化后)的酰胺-A带分别位于3 329、3 326~3 328、3 327~3 329 cm-1,添加氧化与未氧化芦丁的胶冻样品的酰胺-A带出现在3 326~3 327 cm-1。所有胶冻样品的酰胺-A带与对照相比向低波数方向移动,说明多酚的加入可增加样品中氢键的数量[5]。
O基团暴露,从而增强酰胺-Ⅰ带的信号强度[5]。酰胺-Ⅱ带由C—N基团的向外伸缩振动和肽平面内N—H的形变所引起[25]。所有明胶样品的酰胺-Ⅱ带出现在1 438~1 440 cm-1,没有较大的变化。所有明胶样品的酰胺-Ⅱ带出现在1 438~1 440 cm-1,没有较大的变化。对照组及单宁酸(氧化前与氧化后)的酰胺-A带分别位于3 329、3 326~3 328、3 327~3 329 cm-1,添加氧化与未氧化芦丁的胶冻样品的酰胺-A带出现在3 326~3 327 cm-1。所有胶冻样品的酰胺-A带与对照相比向低波数方向移动,说明多酚的加入可增加样品中氢键的数量[5]。

a-氧化芦丁、芦丁;b-氧化单宁酸、单宁酸
图6 添加单宁酸、芦丁及其氧化态后马哈鱼鱼皮明胶 傅里叶变换红外光谱
Fig.6 Fourier transform infrared spectrum of of chum salmon skin gelatin after addition with tannin acid, rutin and their oxidized products
酰胺-A带反应N—H的伸缩振动,其吸收峰位置与氢键缔合程度及三螺旋结构有序性密切相关[26-27]。酰胺-B带反映的是肽链中CH2与NH3基团间的相互作用[27-28],本研究中基本所有的明胶样品都位于2 936~2 941 cm-1,区别不大。
3 结论
通过向马哈鱼皮明胶中添加2种多酚(单宁酸、芦丁)及其氧化态,结果表明:(1)单宁酸和氧化单宁酸(2%~8%)可与马哈鱼鱼皮明胶蛋白形成更多氢键,促进有序凝胶网络结构的形成,并改善凝胶强度,二者作用无显著区别;(2)芦丁对马哈鱼鱼皮明胶凝胶强度改善作用不显著,只有高剂量8%芦丁和氧化芦丁能显著增强马哈鱼鱼皮明胶凝胶强度,作用方式主要也是氢键键合;(3)单宁酸、氧化单宁酸和芦丁对鱼皮明胶的颜色性质影响不大,但氧化芦丁显著降低了明胶胶冻亮度值,增强了红度与黄度值。单宁酸和芦丁合理使用可以增强马哈鱼鱼皮明胶的凝胶强度。
[1] PAN J F,LI Q,JIA H,et al.Physiochemical and functional properties of tiger puffer (Takifugu rubripes) skin gelatin as affected by extraction conditions[J].International Journal of Biological Macromolecules,2018,109:1 045-1 053.
[2] LIN L,REGENSTEIN J M,LV S,et al.An overview of gelatin derived from aquatic animals:Properties and modification[J].Trends in Food Science and Technology,2017,68:102-112.
[3] HUANG T,TU Z C,SHANGGUAN X C,et al.Fish gelatin modifications:A comprehensive review[J].Trends in Food Science & Technology,2019,86:260-269.
[4] 刘洋.马哈鱼鱼皮明胶制备与性质表征及其可食用膜的研究[D].大连:大连工业大学,2017.
LIU Y.Preparation and characterization of skin gelatin from chum salmon (Oncorhynchus keta) and its edible film study[D].Dalian:Dalian Polytechnic University,2017.
[5] 尚美君.单宁酸、芦丁对马哈鱼和河鲀鱼鱼皮明胶凝胶特性的改善[D].大连:大连工业大学,2019.
SHANG M J.Improvement of gel properties of chum salmon (Oncorhynchus keta) and puffer fish (Takifugu rubripes) skin gelatin by tannin and rutin[D].Dalian:Dalian Polytechnic University,2019.
[6] GUDMUNDSSON M,HAFSTEINSSON H.Gelatin from cod skins as affected by chemical treatments[J].Journal of Food Science,1997,62(1):37-39.
[7] CHOI S S,REGENSTEIN J M.Physicochemical and sensory characteristics of fish gelatin[J].Journal of Food Science,2000,65(2):194-199.
[8] PAN J F,LIAN H L,JIA H,et al.Ultrasound treatment modified the functional mode of gallic acid on properties of fish myofibrillar protein[J].Food Chemistry,2020,320:126637.
[9] KAEWDANG O,BENJAKUL S.Effect of ethanolic extract of coconut husk on gel properties of gelatin from swim bladder of yellowfin tuna[J].LWT-Food Science and Technology,2015,62(2):955-961.
[10] TEMDEE W,BENJAKUL S.Effect of oxidized kiam wood and cashew bark extracts on gel properties of gelatin from cuttlefish skins[J].Food Bioscience,2014,7:95-104.
[11] DONG X P,LI Y,LI Y,et al.Combination of NMR and MRI techniques for non-invasive assessment of sea cucumber (Stichopus japonicas) tenderization during low-temperature heating process[J].Food Analytical Methods,2017,10(7):2 207-2 216.
[12] LAEMMLI U K.Most commonly used discontinuous buffer system for SDS electrophoresis[J].Nature,1970,227:680-688.
[13] AEWSIRI T,BENJAKUL S,VISESSANGUAN W,et al.Antioxidative activity and emulsifying properties of cuttlefish skin gelatin-tannic acid complex as influenced by types of interaction[J].Innovative Food Science and Emerging Technologies,2010,11(4):712-720.
[14] CAO N,FU Y H,HE J H.Mechanical properties of gelatin films cross-linked,respectively,by ferulic acid and tannin acid[J].Food Hydrocolloids,2007,21(4):575-584.
[15] YAN M Y,LI B F,ZHAO X,et al.Physicochemical properties of gelatin gels from walleye pollock (Theragra chalcogramma) skin cross-linked by gallic acid and rutin[J].Food Hydrocolloids,2011,25(5):907-914.
[16] ARNESEN J A,GILDBERG A.Extraction and characterisation of gelatine from Atlantic salmon (Salmo salar) skin[J].Bioresource Technology,2007,98(1):53-57.
[17] MUYONGA J H,COLE C G B,DUODU K G.Extraction and physico-chemical characterisation of Nile perch (Lates niloticus) skin and bone gelatin[J].Food Hydrocolloids,2004,18(4):581-592.
[18] LEE H Y,HWANG C H,KIM H E,et al.Enhancement of bio-stability and mechanical properties of hyaluronic acid hydrogels by tannic acid treatment[J].Carbohydrate Polymers,2018,186:290-298.
[19] BENJAKUL S,OUNGBHO K,VISESSANGUAN W,et al.Characteristics of gelatin from the skins of bigeye snapper, Priacanthus tayenus and Priacanthus macracanthus[J].Food Chemistry,2009,116(2):445-451.
[20] PAN J F,LIAN H L,JIA H,et al.Dose affected the role of gallic acid on mediating gelling properties of oxidatively stressed Japanese seerfish myofibrillar protein[J].LWT-Food Science and Technology,2020,118:108849.
[21] STRAUSS G,GIBSON S M.Plant phenolics as cross-linkers of gelatin gels and gelatin-based coacervates for use as food ingredients[J].Food Hydrocolloids,2004,18(1):81-89.
[22] MAQSOOD S,BENJAKUL S,SHAHIDI F.Emerging role of phenolic compounds as natural food additives in fish and fish products[J].Critical Reviews in Food Science and Nutrition,2013,53(2):162-179.
[23] YASIN H,BABJI A S,NORRAKIAH A S.Modification of chicken feet gelatin with aqueous sweet basil and lemongrass extract[J].LWT-Food Science and Technology,2017,77:72-79.
[24] ANVARI M,CHUNG D.Dynamic rheological and structural characterization of fish gelatin-Gum arabic coacervate gels cross-linked by tannic acid[J].Food Hydrocolloids,2016,60:516-524.
[25] BANDEKAR J.Amide modes and protein conformation[J].Biochimica et Biophysica Acta,1992,1 120(2):123-143.
[26] 李季衡,李洋,李国英.戊二醛对胶原溶液热稳定性的影响[J].皮革科学与工程,2009,19(1):14-17.
LI J H,LI Y,LI G Y.Thermal properties of collagen cross-linked by glutaraldehyde[J].Leather Science and Engineering,2009,19(1):14-17;26.
[27] 金文刚,郭思琪,肖苗.大鲵皮明胶-茶多酚复合膜液理化性质及功能性研究[J].食品与发酵工业,2019,45(17):85-90.
JIN W G,GUO S Q,XIAO M.Physicochemical and functional properties of Chinese giant salamander skin gelatin-tea polyphenol composite film liquids[J].Food and Fermentation Industries,2019,45(17):85-90.
[28] 刘洋,夏俪宁,贾慧,等.马哈鱼鱼皮明胶提取温度和甘油质量浓度对其成膜特性的影响[J].食品科学,2018,39(7):236-242.
LIU Y,XIA L N,JIA H,et al.Effects of extraction temperature of chum salmon (Oncorhynchus keta) skin gelatin and glycerol content on its film-forming properties[J].Food Science,2018,39(7):236-242.