香菇(Lentinus edodes)是中国栽培面积和产量最大的食用菌[1]。香菇不仅富含营养物质,还含有大量多糖、酚酸类以及活性蛋白等生物大分子而具有药用保健功效[2]。香菇柄是香菇商品化处理中的副产物,约占香菇总重的20%~30%[3-4],由于其呈纤维化,适口性差,大部分被废弃,造成了极大的资源浪费。香菇柄同菌盖一样由菌丝组成,同样含有丰富的碳水化合物、蛋白质、氨基酸等[5]。
多糖具有提高免疫力、抗病毒等多种生物活性,其活性的发挥与结构、化学基团等密切相关,而将某些化学基团引入到多糖大分子链中,不仅可改变多糖的理化性质、增强生物活性,而且还可以产生新的活性,如乙酰化青钱柳多糖可激活树突细胞,提高抗突变能力[6];硫酸化修饰枸杞多糖可显著促进免疫淋巴细胞增殖,提高免疫力[7]等。目前,常用的多糖化学修饰方法有乙酰化、硫酸酯化、羧甲基化等[8-12]。多糖经过乙酰化修饰后生物活性显著提高[8,13-14]。TANG等[15]研究发现羊肚菌多糖经乙酰化修饰后的抗氧化活性以及对肝癌细胞和结肠癌细胞的抑制活性高于其硫酸化修饰多糖和羧甲基化修饰多糖。本文以香菇柄为原料,经水提醇沉等工艺制得香菇柄多糖,对其进行乙酰化(乙酸酐法)修饰,通过控制修饰试剂的比例(使用量)分别制备3种乙酰化多糖,考察了修饰试剂的比例(使用量)对化学修饰香菇柄多糖取代度、多糖和蛋白质含量的影响,并用紫外光谱、红外光谱和刚果红试剂对乙酰化修饰前后香菇柄多糖进行初步结构分析,最后对乙酰化修饰前后多糖的抗氧化活性进行评价,为香菇柄多糖抗氧化活性的构效关系研究和香菇柄资源开发利用提供参考。
1 材料与方法
1.1 材料与仪器
香菇柄购自郑州信基调味品市场,经50 ℃烘干至含水率低于8%后,粉碎过40目筛后备用。
重蒸酚、DPPH、葡萄糖、无水乙醇、三氯化铁、硫酸亚铁、甲醇、氢氧化钠等均为国产分析纯。
FA2004C型分析天平,上海越平科学仪器有限公司;UV-1800 型紫外可见分光光度计,岛津仪器(苏州)有限公司;RV8V-C型旋转蒸发仪,德国IKA 集团;LD-Y300A型高速万能粉碎机,上海顶帅电器有限公司;DF-10型恒温磁力搅拌器,巩义市予华仪器有限公司;H2050R型台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;Nicolet iS5傅里叶变换红外光谱仪,美国Thermo Fisher Scientific公司。
1.2 实验方法
1.2.1 香菇柄多糖的制备及多糖和蛋白质含量的测定
1.2.1.1 香菇柄多糖的制备
将香菇柄粉与蒸馏水按照料液比1∶15(g∶mL)混匀,沸水浸提2次,每次2 h,上清液经浓缩、醇沉、干燥后即为香菇柄多糖。
1.2.1.2 多糖和蛋白质含量的测定
采用苯酚-硫酸法[16]测定多糖含量;采用考马斯亮蓝G-250法[17]测定蛋白质含量。
1.2.2 香菇柄多糖的乙酰化修饰
1.2.2.1 NaOH-乙酸酐法修饰多糖
参照文献[18]方法对多糖进行乙酰化修饰,乙酸酐用量分别为1、5、10 mL,反应结束后经透析、醇沉、干燥,即为乙酰化多糖,分别标记为NaOH乙酰化多糖1、NaOH乙酰化多糖5、NaOH乙酰化多糖10,用于后续测定。
1.2.2.2 甲酰胺-乙酸酐法修饰多糖
参照文献[8,19]方法进行多糖乙酰化修饰,乙酸酐用量分别为1、5、10 mL,经透析、醇沉、干燥,即为乙酰化多糖,分别标记为甲酰胺乙酰化多糖1、甲酰胺乙酰化多糖5、甲酰胺乙酰化多糖10,用于后续测定。
1.2.3 测定方法
乙酰基取代度的测定:采用酸碱滴定法测定乙酰化取代度[20]。
紫外光谱分析:将香菇柄多糖及其乙酰化多糖制成0.2 mg/mL水溶液,于190~800 nm下进行扫描。
红外光谱分析:称取香菇柄多糖及其乙酰化多糖样品各5 mg,与200 mg经过干燥的溴化钾在玛瑙研钵中研磨均匀,压片后用傅里叶红外光谱仪在4 000~400 cm-1进行光谱扫描。
刚果红实验:参照文献[21]测定三螺旋结构。
抗氧化活性测定:参照文献[8]对DPPH自由基清除率和还原能力进行测定。
1.3 数据分析
所有实验重复3次,用平均值±标准偏差(mean±SD)表示。采用SPSS软件进行差异显著性分析,GraphPad Prism软件绘图。
2 结果与分析
2.1 香菇柄乙酰化多糖的制备
香菇柄多糖乙酰化修饰的乙酰基取代度如表1所示,香菇柄多糖提取物中的多糖含量为36.42 g/100 g,经乙酰化修饰后,随着乙酸酐用量的增加,NaOH体系乙酰化修饰的多糖含量逐渐增大,而甲酰胺体系乙酰化修饰的多糖含量显著减小(P<0.05);蛋白质含量为17.12 g/100 g,经乙酰化修饰后,随着乙酸酐用量的增加,NaOH体系和甲酰胺体系乙酰化修饰多糖中的蛋白质含量均显著减少(P<0.05),与MA等[22]报道的桦褐孔菌多糖化学修饰后蛋白质含量下降的结果一致。随着乙酸酐用量的增加,NaOH体系和甲酰胺体系乙酰化多糖的取代度均呈上升趋势,并且NaOH体系乙酰化多糖的取代度及其增幅显著高于甲酰胺体系乙酰化多糖。邵珠领等[20]对桦褐孔菌多糖进行了乙酰化修饰,发现桦褐孔菌多糖乙酰基的取代度随乙酰化修饰试剂用量增大呈上升趋势,与本结果相似。在乙酸酐用量为5 mL时,NaOH体系和甲酰胺体系乙酰化多糖均可获得较好的取代度,分别为0.31和0.14。这一结果说明乙酸酐用量对香菇柄多糖的乙酰基取代有重要影响。
表1 香菇柄多糖乙酰化修饰取代度及多糖和蛋白质含量
Table 1 Substitution degree and contents of polysaccharide and protein of acetylated modification of L.edodes stipe polysaccharide
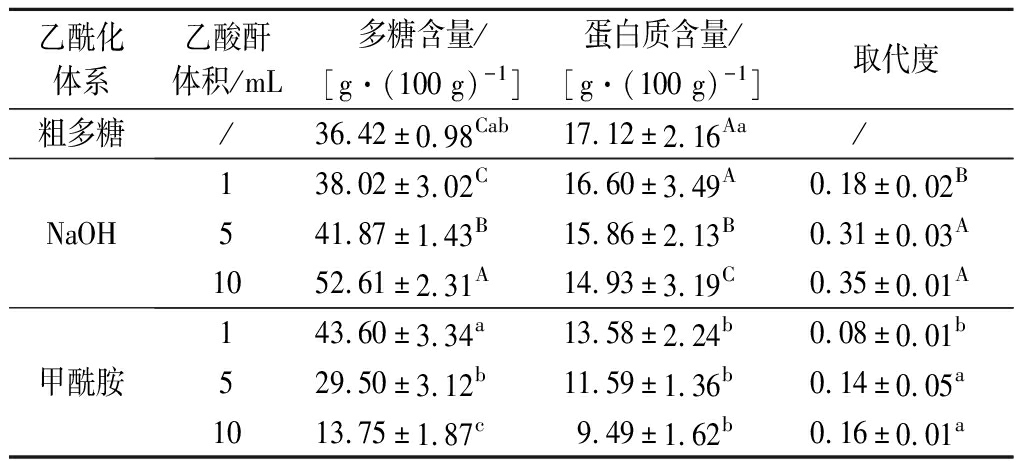
乙酰化体系乙酸酐体积/mL多糖含量/[g·(100 g)-1]蛋白质含量/[g·(100 g)-1]取代度粗多糖/36.42±0.98Cab17.12±2.16Aa/NaOH138.02±3.02C16.60±3.49A0.18±0.02B541.87±1.43B15.86±2.13B0.31±0.03A1052.61±2.31A14.93±3.19C0.35±0.01A甲酰胺143.60±3.34a13.58±2.24b0.08±0.01b529.50±3.12b11.59±1.36b0.14±0.05a1013.75±1.87c9.49±1.62b0.16±0.01a
注:同列不同大写字母表示NaOH体系处理间差异显著(P<0.05);同列不同小写字母表示甲酰胺体系处理间差异显著(P<0.05)
2.2 紫外光谱和红外光谱分析
由图1可知,与粗多糖相比,NaOH体系乙酰化多糖和甲酰胺体系乙酰化多糖在260和280 nm处的紫外吸光值均呈现出明显的下降趋势,并且随着乙酸酐用量的增加,在260和280 nm处的紫外吸光值越小,表明乙酰化过程对脱除多糖中的蛋白质具有一定的作用。这一结果与表1中蛋白质含量测定结果一致。

a-NaOH体系乙酰化多糖;b-甲酰胺体系乙酰化多糖
图1 香菇柄多糖及其乙酰化多糖的紫外扫描图谱
Fig.1 The UV spectra of L.edodes stipe polysaccharide and its acetylated polysaccharide
从图2可以看出,香菇柄多糖及NaOH体系乙酰化多糖和甲酰胺体系乙酰化多糖都具有多糖的特征吸收峰。3 416 cm-1左右为糖分子内或分子间氢键O—H伸缩振动峰,2 932 cm-1为次甲基(—CH2—)中的C—H的伸缩振动的吸收峰。
与香菇柄多糖的红外光谱相比,NaOH体系乙酰化多糖和甲酰胺体系乙酰化多糖在1 730和1 230 cm-1处均出现了香菇柄多糖中没有的酯基C![]() O和C—O的伸缩振动峰,该组峰为乙酰基的特征吸收峰[6,11,23],说明香菇柄多糖已成功进行了乙酰化修饰。1 078 cm-1吸收峰减弱,1 038 cm-1吸收峰增强,1 365~1 380 cm-1(δSCH3)强吸收峰随着乙酰化试剂用量的增大而增强。甲酰胺体系中乙酰化多糖5和10的透过率明显低于香菇柄多糖和乙酰化多糖1,而NaOH体系对乙酰化多糖的透过率无明显改变。
O和C—O的伸缩振动峰,该组峰为乙酰基的特征吸收峰[6,11,23],说明香菇柄多糖已成功进行了乙酰化修饰。1 078 cm-1吸收峰减弱,1 038 cm-1吸收峰增强,1 365~1 380 cm-1(δSCH3)强吸收峰随着乙酰化试剂用量的增大而增强。甲酰胺体系中乙酰化多糖5和10的透过率明显低于香菇柄多糖和乙酰化多糖1,而NaOH体系对乙酰化多糖的透过率无明显改变。

a-NaOH体系乙酰化多糖;b-甲酰胺体系乙酰化多糖
图2 香菇柄多糖及其乙酰化多糖的红外光谱图
Fig.2 The FT-IR spectra of L.edodes stipe polysaccharide and its acetylated polysaccharide
2.3 刚果红实验
刚果红是一种酸性染料,可与具有三螺旋链构象的多糖形成配合物,配合物的最大吸收波长与刚果红相比发生红移[21]。香菇柄多糖及其乙酰化多糖与刚果红在不同NaOH浓度下溶液的最大吸收波长λmax的变化如图3所示。香菇柄多糖及NaOH体系乙酰化多糖与刚果红的混合溶液λmax均发生了红移,表明NaOH体系乙酰化多糖具有三螺旋结构;甲酰胺体系乙酰化多糖1与刚果红的混合溶液λmax发生了轻微的红移,其余甲酰胺乙酰化多糖与刚果红的混合溶液及刚果红对照溶液的λmax均没有发生红移,表明甲酰胺体系乙酰化多糖不具有三螺旋结构,造成这一现象的原因可能是由于甲酰胺体系乙酰化过程中未对溶液pH值进行调整,溶液pH值较小,多糖的三螺旋结构在酸性条件下被破坏;而NaOH体系乙酰化多糖在乙酰化过程中pH值始终保持在8~9,没有破坏多糖的三螺旋结构。出现这一结果可能与分子间氢键是否被破坏有关[11]。
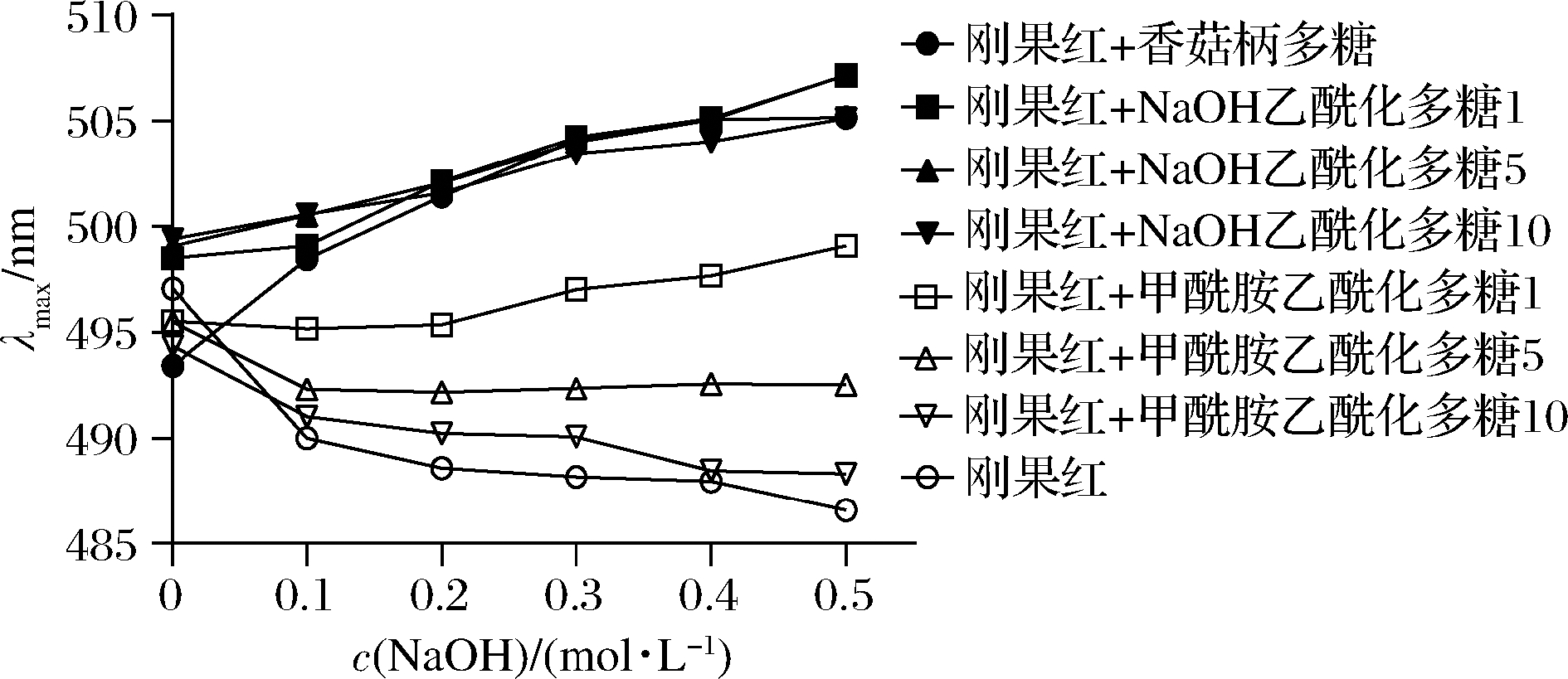
图3 不同NaOH浓度下香菇柄多糖及其乙酰化多糖与 刚果红配合物的λmax变化
Fig.3 λmax changes of Congo with L.edodes stipe polysaccharide and its acetylated polysaccharide complex under various concentrations of sodium hydroxide
2.4 乙酰化修饰对香菇柄多糖体外抗氧化活性的影响
从图4-a可以看出,在实验浓度范围内,随着多糖浓度的增大,香菇柄多糖及NaOH体系和甲酰胺体系乙酰化多糖对DPPH自由基清除率均呈增强趋势。在多糖质量浓度小于4 mg/mL时,香菇柄多糖和NaOH乙酰化多糖1对DPPH自由基清除率高于NaOH乙酰化多糖5和10,之后继续增大多糖浓度,则低于NaOH乙酰化多糖5和10对DPPH自由基的清除率;在多糖质量浓度为8 mg/mL时,NaOH乙酰化多糖1、5和10对DPPH自由基清除率比香菇柄多糖(41.76%)分别高4.51%、11.15%和12.29%。而甲酰胺乙酰化多糖对DPPH自由基清除率则低于香菇柄多糖,且取代度越大,清除能力越弱;在多糖质量浓度为8 mg/mL时,甲酰胺乙酰化多糖1、5和10对DPPH自由基清除率比香菇柄多糖分别低3.39%、12.42%和15.84%。相关研究表明,多糖经乙酰化修饰后其抗氧化活性表现不一,如邵珠领等[20]研究发现乙酰化桦褐孔菌多糖对DPPH自由基清除能力高于未乙酰化修饰多糖。而徐田甜等[18]研究发现乙酰化松树蕈多糖对DPPH自由基清除活性比未修饰的活性低。出现这一现象可能是因为乙酰化修饰之所以能够对多糖活性产生影响,不仅与取代度有关,还与取代位置、以及反应过程中多糖结构是否被破坏有关[6,18,24]。

a-DPPH清除能力;b-还原力
图4 香菇柄多糖及其乙酰化多糖对DPPH自由基的清除 作用及还原力的影响
Fig.4 Scavenging capacities of L.edodes stipe polysaccharide and its acetylated polysaccharide on DPPH free radicals and its reducing power
根据还原能力的测定方法,在波长700 nm测定的吸光值越大,则表明样品的还原能力越强。由图4-b可知,在实验所测定的浓度范围内,NaOH乙酰化多糖的还原能力高于香菇柄多糖,且随着乙酰化试剂用量的增大,多糖的还原能力增强;而甲酰胺乙酰化多糖的还原能力低于香菇柄多糖,并且随着乙酰化试剂用量的增大,还原能力逐渐减弱。
HU等[8]研究发现经甲酰胺体系乙酰化修饰后的藤五加多糖的还原能力弱于未乙酰化修饰多糖,与本研究结果相似。出现这一现象可能是由于乙酰化修饰改变了多糖分子的定向性和横向次序,从而改变糖链的空间排布,减少了活性羟基的密度进而阻止了乙酰基与金属离子的结合,进而降低了还原能力[8,20]。
3 结论
随着乙酸酐用量增加,NaOH体系和甲酰胺体系乙酰化修饰香菇柄多糖的乙酰化取代度均呈上升趋势,乙酰化取代度与乙酸酐用量呈正相关。在乙酸酐用量为5 mL时,可以得到较好的取代度。紫外光谱表明,香菇柄多糖乙酰化修饰前后基本趋势一致。红外光谱表明,乙酰化修饰香菇柄多糖除具有多糖特征峰外,还出现了乙酰基的特征吸收峰,表明香菇柄多糖的乙酰化修饰成功。NaOH体系乙酰化修饰后多糖仍然具有三螺旋结构,而甲酰胺体系乙酰化修饰后多糖的三螺旋结构被破坏。随着多糖浓度的增加,香菇柄多糖及NaOH体系和甲酰胺体系乙酰化多糖的抗氧化能力均增强。且NaOH体系乙酰化多糖的抗氧化活性强于香菇柄多糖,甲酰胺体系乙酰化多糖的抗氧化活性弱于香菇柄多糖。
[1] 中国食用菌协会.2019年度全国食用菌统计调查结果分析[A/OL].[2020-12-22].https://mp.weixin.qq.com/s/uJgpEP5 sG3-lf2ebgbWrcg.
[2] 李顺峰,刘丽娜,王安建,等.分级醇沉香菇柄多糖及其抗氧化活性研究[J].包装与食品机械,2020,38(4):10-15.
LI S F,LIU L N,WANG A J,et al.Study on gradient ethanol precipitation of Lentinula edodes stipe polysaccharide and their antioxidant activities[J].Packaging and Food Machinery,2020,38(4):10-15.
[3] 刘丽娜,王安建,李顺峰,等.乳酸菌发酵香菇柄产γ-氨基丁酸培养基的优化[J].保鲜与加工,2020,20(1):109-114.
LIU L N,WANG,A J,LI S F,et al.Optimization on culture medium for producingγ-aminobutyric acid from Lentinus edodes stem by lactic acid bacteria[J].Storage and Process,2020,20(1):109-114.
[4] LI S F,WANG A J,LIU L N,et al.Extraction of polysaccharides under vacuum condition from Lentinus edodes stipe and their antioxidant activities in vitro[J].Food Science and Biotechnology,2019,28(3):759-767.
[5] LI S F,WANG A J,LIU L N,et al.Evaluation of nutritional values of shiitake mushroom (Lentinus edodes) stipes[J].Journal of Food Measurement and Characterization,2018,12(3):2 012-2 019.
[6] MENG-ZHAO,YI-HAN,LI J E,et al.Structural characterization and antioxidant activity of an acetylated Cyclocarya paliurus polysaccharide (Ac-CPP0.1)[J].International Journal of Biological Macromolecules,2021,171:112-122.
[7] WANG J M,HU Y L,WANG D Y,et al.Sulfated modification can enhance the immune-enhancing activity of Lycium barbarum polysaccharides[J].Cellular Immunology,2010,263(2):219-223.
[8] HU H B,LI H M,HAN M H,et al.Chemical modification and antioxidant activity of the polysaccharide from Acanthopanax leucorrhizus[J].Carbohydrate Research,2020,487:107890.
[9] 徐兵,陆灏钰,徐倩,等.银耳多糖乙酰化修饰及其抗氧化活性[J].食品研究与开发,2019,40(18):18-24.
XU B,LU H Y,XU Q,et al.Acetylation modification and antioxidant activity of polysaccharides from Tremella fuciformis[J].Food Research and Development,2019,40(18):18-24.
[10] 郭浩杰,杨严格,安乐,等.中药多糖的分子修饰及其药理活性研究进展[J].中草药,2015,46(7):1 074-1 080.
GUO H J,YANG Y G,AN L,et al.Research progress in molecular modification and pharmacological activity of Chinese materia medica polysaccharides[J].Chinese Traditional and Herbal Drugs,2015,46(7):1 074-1 080.
[11] REN Y Y,SUN P P,JI Y P,et al.Carboxymethylation and acetylation of the polysaccharide from Cordyceps militaris and their α-glucosidase inhibitory activities[J].Natural Product Research,2020,34(3):369-377.
[12] XU Y Q,GAO Y K,LIU F,et al.Sulfated modification of the polysaccharides from blackcurrant and their antioxidant and α-amylase inhibitory activities[J].International Journal of Biological Macromolecules,2018,109:1 344-1 354.
[13] SONG X L,ZHANG J J,LI J,et al.Acetylated polysaccharides from Pleurotus geesteranus alleviate lung injury via regulating NF-κB signal pathway[J].International Journal of Molecular Sciences,2020,21(8):2810.
[14] YANG Y X,CHEN J L,LEI L,et al.Acetylation of polysaccharide from Morchella angusticeps peck enhances its immune activation and anti-inflammatory activities in macrophage RAW 264.7 cells[J].Food and Chemical Toxicology,2019,125:38-45.
[15] TANG Y,CHEN J L,LI F H,et al.Antioxidant and antiproliferative activities of modified polysaccharides originally isolated from Morchella angusticepes peck[J].Journal of Food Science,2019,84(3):448-456.
[16] DUBOIS M,GILLES K A,HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356.
[17] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1-2):248-254.
[18] 徐田甜,陈义勇.松树蕈多糖乙酰化修饰工艺及其抗氧化活性[J].食品与发酵工业,2017,43(4):164-170.
XU T T,CHEN Y Y.Acetylated modification and antioxidant activity of polysaccharides from Tricholoma matsutake[J].Food and Fermentation Industries,2017,43(4):164-170.
[19] 杨春瑜,杨春莉,刘海玲,等.乙酰化黑木耳多糖的制备及其抗氧化活性研究[J].食品工业科技,2015,36(23):105-110;115.
YANG C Y,YANG C L,LIU H L,et al.Study on the Acetylated polysaccharide preparation and oxidation resistance of Auricularia auricular[J].Science and Technology of Food Industry,2015,36(23):105-110;115.
[20] 邵珠领,吴艳丽,张宇,等.桦褐孔菌多糖的乙酰化修饰及其抗氧化活性[J].食品工业科技,2019,40(9):73-77.
SHAO Z L,WU Y L,ZHANG Y,et al.Acetylated modification and antioxidant activity of polysaccharides from Inonotus obliquus[J].Science and Technology of Food Industry,2019,40(9):73-77.
[21] 徐雅琴,付雪婷,王丽波,等.乙酰化修饰对黑穗醋栗果实多糖结构特性及活性的影响[J].精细化工,2019,36(12):2 467-2 475.
XU Y Q,FU X T,WANG L B,et al.Effects of acetylation modification on structural characteristics and bioactivities of polysaccharides from black currant[J].Fine Chemicals,2019,36(12):2 467-2 475.
[22] MA L S,CHEN H X,ZHANG Y,et al.Chemical modification and antioxidant activities of polysaccharide from mushroom Inonotus obliquus[J].Carbohydrate Polymers,2012,89(2):371-378.
[23] 李银莉,张安勇,牛庆川,等.马齿苋多糖的乙酰化修饰及其抗氧化活性[J].现代食品科技,2020,36(12):84-91;110.
LI Y L,ZHANG A Y,NIU Q C,et al.Acetylation modification of the polysaccharides from Portulaca oleracea L.and their antioxidant activities[J].Modern Food Science and Technology,2020,36(12):84-91;110.
[24] 贾红倩,刘嵬,颜军,等.杏鲍菇多糖的分离纯化、乙酰化修饰及其抗氧化活性[J].食品工业科技,2018,39(3):39-44.
JIA H Q,LIU W,YAN J,et al.Isolation and purification,acetylation modification and antioxidant activity of polysaccharides of Pleurotus eryngii Quel[J].Science and Technology of Food Industry,2018,39(3):39-44.