菊粉(inulin,IN),又名菊糖,一种天然的线性果聚糖,存在于菊苣根、大丽花块茎、洋葱、香蕉等多种水果和蔬菜中,工业上常用菊苣根提取天然IN[1]。IN主要是由D-呋喃果糖分子以β-(2→1)键连接而成,末端通过α-(1←→2)键与最后1个果糖相连,链长从2~60个单位不等[2]。研究表明,天然IN具有调节血糖、降脂、刺激肠道菌群、预防和缓解便秘、降低胃肠道疾病风险等功效[3-4]。近年来,IN因为显著的功能特性,被广泛的应用于食品加工行业,为功能性食品的研发提供新的方向。
小麦淀粉(wheat starch,WS)作为食品加工的原材料,价格低廉,被广泛应用于面条、饼干、面包、蛋糕等产品中。然而,天然淀粉由于稳定性差、易老化、易膨胀等固有缺陷,无法满足某些食品的加工要求[5]。目前,淀粉与非淀粉多糖复配体系受到了广泛的关注。大量研究表明,非淀粉多糖与不同淀粉复配,可对复配体系的糊化、流变以及消化特性有显著的影响。LUO等[6]发现凉粉草多糖可以促进玉米淀粉的糊化,增强复配体系的黏弹性。DARTOIS等[7]研究了淀粉-瓜尔豆胶复配体系的体外消化性,结果表明瓜尔豆胶的添加有效抑制淀粉酶的消化,且抗性淀粉(resistant starch,RS)含量升高。但目前未见将天然IN与WS复配体系的研究报道。
本文选用不同浓度的IN,制备IN-WS复配体系,研究其糊化、流变、消化等理化特性,同时进一步分析复配体系中IN与WS间的相互作用,旨在扩大WS的应用,为IN-淀粉基产品的开发提供研究数据。
1 材料与方法
1.1 材料与仪器
天然IN(含量>88%,食品级),比利时Beneo公司;WS(水分含量13%,食品级),河南恩苗食品有限公司;葡糖氧化酶/过氧化物酶试剂(glucose oxidase/peroxidase reagent,GOPOD)(食品级),爱尔兰Megazyme公司;淀粉葡萄糖苷酶(A709,分析纯)、猪胰酶(P7545,分析纯),美国Sigma公司;溴化钾(光谱纯),天津科密欧化学试剂有限公司;无水乙醇(分析纯),天津市精细化工有限公司;氯化钠,尿素(分析纯),天津市大茂化学试剂厂。
4500快速黏度分析仪(rapid visco analyzer,RVA),美国Perten公司;Q20差示扫描量热仪(differential scanning calorimeter,DSC)、DHR-1旋转流变仪,美国TA公司;Vertex70傅里叶变换红外光谱仪(Fourier transform infrared spectroscopy,FT-IR),德国Bruker公司。
1.2 实验方法
1.2.1 IN-WS悬浮液的制备
准确称取不同质量的IN分散溶解在25 mL的蒸馏水中,磁力搅拌30 min,得到质量浓度0、50、100、150、200 g/L的多糖溶液。随后向多糖的水溶液中缓慢加入2.5 g(100 g/L)的WS,并继续搅拌30 min,得到悬浮样品。
1.2.2 IN-WS复配体系糊化特性的测定
使用RVA测得IN-WS复配体系的糊化参数。取1.2.1方法制备的悬浮样品25 mL至RVA专用测试铝盒中,调用RVA标准程序1进行测试。具体程序如下:开始在50 ℃下保持1 min,升温至95 ℃,保持2.5 min,然后再以相同速率降温至50 ℃,保持2 min。
1.2.3 IN-WS复配体系热力学特性的测定
使用DSC测试IN对WS热力学特性的影响。参考张明月等[8]的方法并稍作改动。取5 μL不同浓度的IN水溶液和2.5 mg(干基)WS到铝盘中,压盖密封,并在室温下平衡12 h。将样品盘从20 ℃加热至120 ℃。使用密封的空盘作为参考,记录样品的起始温度(To),峰值温度(TP),终止温度(Tc)和糊化焓(ΔH)。
1.2.4 IN-WS复配体系流变学特性的测定
使用旋转流变仪(Discovery HR-1)测试IN-WS复配体系的流变学特性。参考REN等[9]的方法并稍作修改。将1.2.2方法制备的糊化样品于4 ℃下平衡24 h,以充分完成水合。随后将样品转移到旋转流变仪上,平板直径400 mm,间隙500 mm。
稳态流变特性的测定:以0.1~100 s-1测定样品的稳态流变特性。通过连续剪切试验确定表观黏度与剪切速率之间的关系,测试温度保持在25 ℃。
动态流变特性的测定:以1~25 Hz测定样品的动态流变特性。通过振荡频率的变化测定样品的储能模量(G′)、损耗模量(G″)和损耗因子(tan σ),测试应变为1%,温度保持在25 ℃。
1.2.5 IN-WS复配体系体外消化特性的测定
IN-WS复配体系的消化特性参照景悦等[10]的方法。取1.2.2方法制备的糊化样品,冷冻干燥,过100目筛,再准确称取200 mg干燥样品,加入4 mL的醋酸钠缓冲溶液和1 mL胰α-淀粉酶和淀粉葡萄糖苷酶复配液,37 ℃下振荡水解。在20和120 min时取0.1 mL水解液,加乙醇灭酶,离心后再取0.1 mL的上清液,加入3 mL GOPOD,水浴显色,记录510 nm处吸光值。另取0.1 mL标准葡萄糖溶液和蒸馏水分别作为标准和空白对照。根据样品的吸光值,计算快速消化淀粉(rapidly digestible starch,RDS),慢消化淀粉(slowly digestible starch,SDS)和RS的含量。RDS、SDS和RS计算如公式(1)~公式(3)所示:
(1)
(2)
RS/%=[1-(RSD+SDS)]×100
(3)
式中:G20和G120分别为水解20和120 min后的葡萄糖含量;m,复合体系样品的质量;FG为酶水解处理前WS中游离葡萄糖含量,FG=0。
1.2.6 IN-WS复配体系相互作用力的测定
参考REN等[11]的方法并稍作修改,探究IN-WS复配体系的相互作用力。将2 g WS和1 g IN混合粉末分别溶解在0、0.2、0.6、1.0 mol/L的氯化钠和尿素中。将制备好的样品在95 ℃下水浴20 min,冷却至25 ℃。随后在1~25 Hz进行频率扫描测试,测试应变保持在1%。
1.2.7 IN-WS复配体系FT-IR扫描
使用FT-IR测定IN-WS复配体系的结构。取1.2.2方法制备的糊化样品,趁热冷冻干燥,粉碎过100目筛。按照1∶100(g∶g)称取一定量的样品与溴化钾,充分研磨后压片。测试光谱范围为4 000~400 cm-1,分辨率为4 cm-1。
1.3 数据处理
所有试验均重复3次。所有数据采用IBM SPSS Statistics 26.0软件程序进行差异显著性分析,P<0.05表示差异显著。采用Origin 9.0软件绘图。
2 结果与分析
2.1 糊化特性
淀粉的糊化是淀粉颗粒受热吸水、膨胀并失去原有晶体结构的过程[12]。添加不同浓度IN的WS复配体系RVA糊化曲线如图1所示,糊化参数如表1所示。添加不同浓度IN后复配体系的糊化温度从91.55 ℃增加到95.35 ℃。结果表明IN延迟了复配体系的糊化,造成这种现象主要是因为IN具有较强的吸湿性,在糊化过程中与WS争夺糊化所需的水分,使得糊化难度增大,糊化温度增高[13]。

图1 IN-WS复配体系糊化曲线
Fig.1 Pasting curve of the IN-WS blended systems
由表1可知,IN-WS复配体系的峰值黏度、谷黏度以及最终黏度都随着IN浓度的增加而不断降低,呈现出浓度依赖性。这种现象主要是由于IN分子具有吸湿性,导致支链淀粉不能充分吸收水分,无法形成完全的黏性物质[11]。此外,IN分子作为一种非淀粉多糖也是引起淀粉黏度下降的原因之一。LIU等[14]试验结果表明多糖可抑制淀粉颗粒的膨胀,导致黏度降低。这与本试验的研究结果相一致。
崩解值反映淀粉颗粒对抗热和剪切的稳定性[14],崩解值越小,表明在受热过程中淀粉颗粒的结构越稳定。从表1中可以发现,IN的添加使复配体系的崩解值显著降低(P<0.05)。试验结果表明,IN提高了WS的热稳定性。另外,在回生值中也观察到了一样的趋势。回生值代表淀粉糊的短期老化,与直链淀粉的重排有关[15]。表1中,随着IN添加量的增高,回生值逐渐降低,当IN添加量为20%时,复配体系的回生值达到最低。结果表明添加IN抑制了WS复配体系的短期老化,且IN添加量越高抑制效果越强。这种现象可能是因为IN分子与浸出的直链淀粉相互作用,从而抑制直链淀粉的重排[14]。
表1 IN-WS复配体系糊化特征参数
Table 1 Pasting parameters of IN-WS blended systems
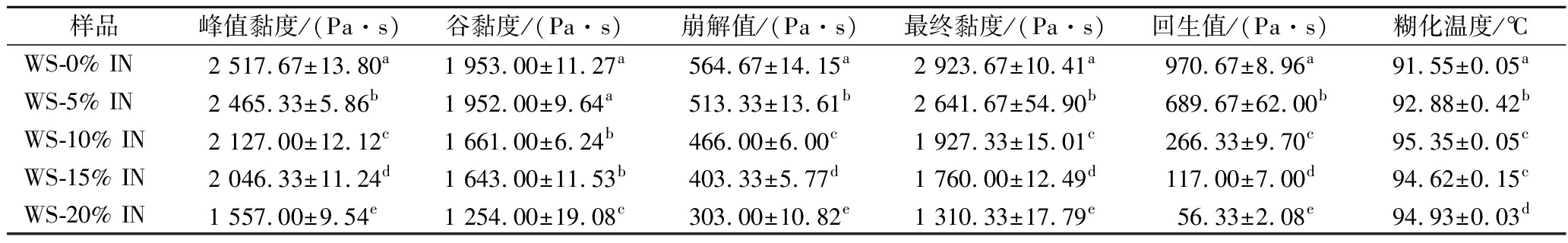
样品峰值黏度/(Pa·s)谷黏度/(Pa·s)崩解值/(Pa·s)最终黏度/(Pa·s)回生值/(Pa·s)糊化温度/℃WS-0% IN2 517.67±13.80a1 953.00±11.27a564.67±14.15a2 923.67±10.41a970.67±8.96a91.55±0.05aWS-5% IN2 465.33±5.86b1 952.00±9.64a513.33±13.61b2 641.67±54.90b689.67±62.00b92.88±0.42bWS-10% IN2 127.00±12.12c1 661.00±6.24b466.00±6.00c1 927.33±15.01c266.33±9.70c95.35±0.05cWS-15% IN2 046.33±11.24d1 643.00±11.53b403.33±5.77d1 760.00±12.49d117.00±7.00d94.62±0.15cWS-20% IN1 557.00±9.54e1 254.00±19.08c303.00±10.82e1 310.33±17.79e56.33±2.08e94.93±0.03d
注:不同字母表示不同样品间差异显著(P<0.05)(下同)
2.2 热特性
IN-WS复配体系热特征参数如表2所示,IN-WS复配体系的起始温度(To)从56.95 ℃增加到62.74 ℃,峰值温度(TP)从63.04 ℃增加到69.88 ℃,以及终止温度(Tc)从75.65 ℃增加到82.82 ℃。起始、峰值和终止温度水平与淀粉的玻璃化转变密切相关。它们随着IN浓度的增加而增加,表明IN的存在延迟了WS的糊化,这与RVA试验结果相符。糊化焓(ΔH)与支链淀粉在颗粒内发生糊化所需的能量有关。由表2观察到,随着IN的添加,WS的糊化焓从10.07降低到7.68 J/g。
表2 IN-WS复配体系热力学参数
Table 2 Thermal parameters of IN-WS blended systems
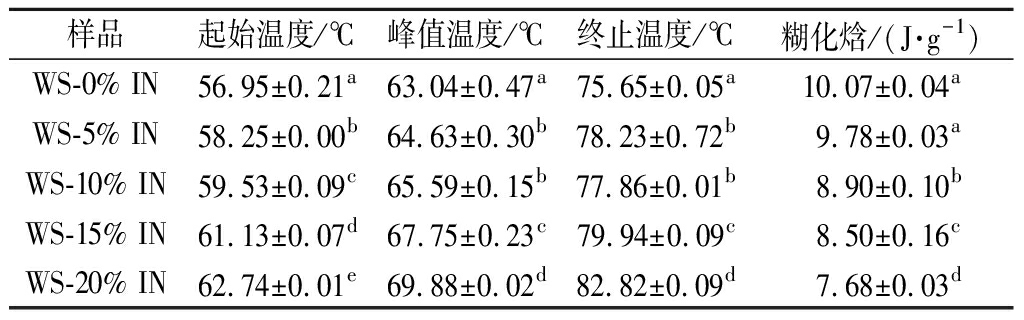
样品起始温度/℃峰值温度/℃终止温度/℃糊化焓/(J·g-1)WS-0% IN56.95±0.21a63.04±0.47a75.65±0.05a10.07±0.04aWS-5% IN58.25±0.00b64.63±0.30b78.23±0.72b9.78±0.03aWS-10% IN59.53±0.09c65.59±0.15b77.86±0.01b8.90±0.10bWS-15% IN61.13±0.07d67.75±0.23c79.94±0.09c8.50±0.16cWS-20% IN62.74±0.01e69.88±0.02d82.82±0.09d7.68±0.03d
糊化温度的增高和糊化焓的降低可能是由于IN具有较强的吸水能力,可以与淀粉竞争有效水分子,限制了WS体系中的水分利用率,从而推迟糊化过程,同时也会引起WS的不完全糊化,降低糊化焓[16]。SUN等[17]在研究魔芋多糖对大米、马铃薯和豌豆淀粉的理化特性影响时也发现,魔芋多糖可抑制3种不同晶型淀粉的糊化过程。
2.3 流变特性
添加不同IN浓度后WS复配体系的稳态剪切和动态流变结果分别由图2和图3所示。
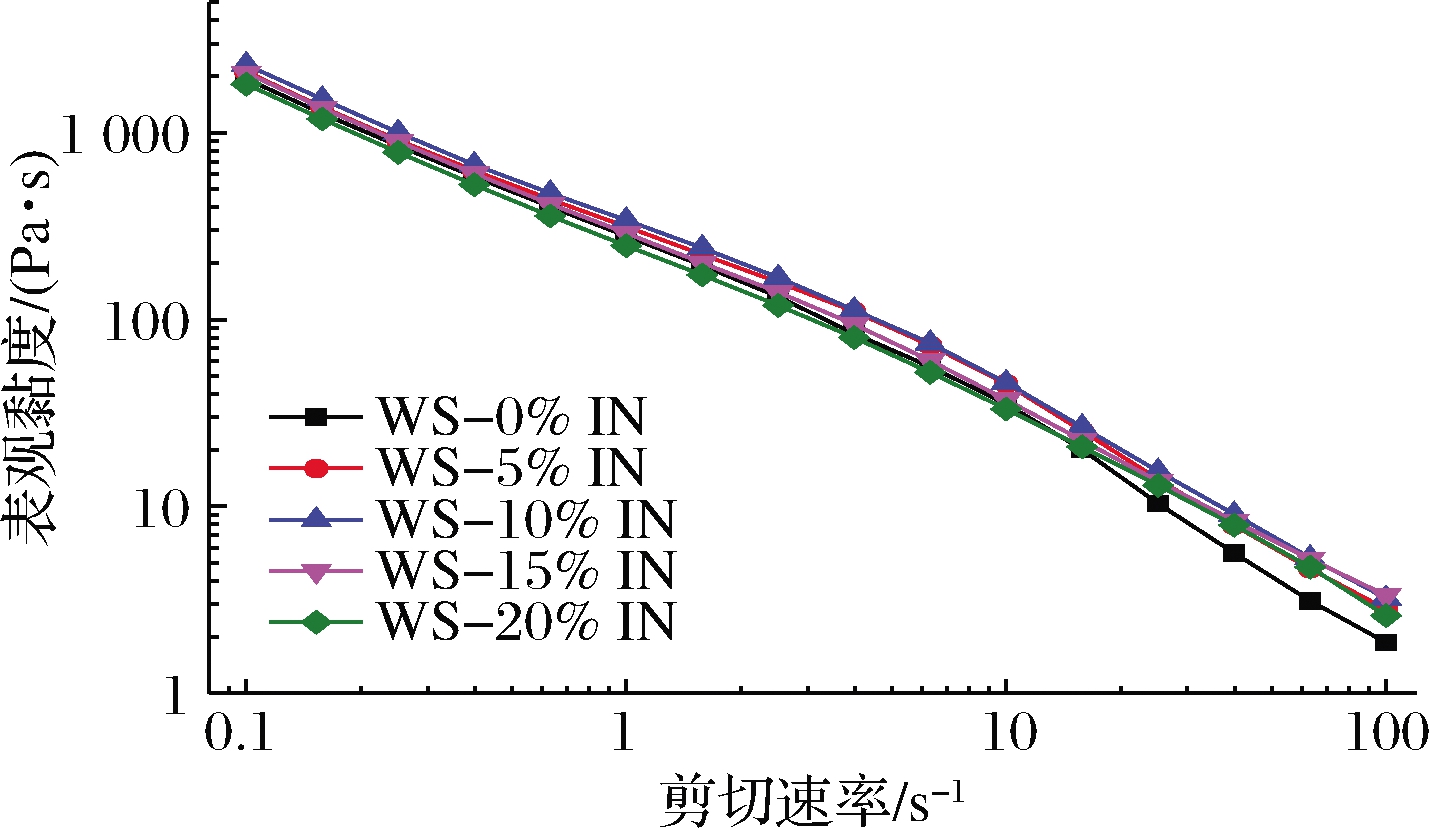
图2 IN-WS复配体系表观黏度曲线
Fig.2 Apparent viscosity of the IN-WS blended systems
由图2可以看出,所有样品的表观黏度随剪切速率的增高而不断降低,表现为剪切稀化行为,这表明添加IN的WS复配体系是典型的非牛顿流体[18]。IN的添加也增加了复配体系的表观黏度,但是各浓度之间并没有明显的差异。由图3-a和图3-b观察到所有复配体系的储能模量(G′)和损耗模量(G″)随着频率的增加而增大,IN的添加增大了WS糊的动态模量(G′,G″)。此试验结果与REN等[19]在凉草多糖对大米淀粉流变特性影响研究的结果一致。此外,所有样品的G′显著高于G″,这一结果表明添加IN的WS复配体系具有典型弱凝胶的类固体行为[9]。由图3-c可知,所有样品的损耗因子(tan σ)均<1且随着频率的增高而增大。复配体系的损耗因子随着IN添加量的增加呈现出先降低后增大的趋势,这表明IN可以使复配体系的凝胶结构由类固态向类液态转变[20]。这些结果表明,IN的添加能显著的影响WS糊的流变特性。

a-储能模量;b-损耗模量;c-损耗因子
图3 IN-WS复配体系动态黏弹性曲线
Fig.3 Dynamic viscoelasticity of the IN-WS blended systems
2.4 体外消化特性
IN-WS复配体系中RDS、SDS和RS的含量如表3所示。RDS的含量随着IN添加量的增大而显著降低,表明IN可抑制WS的消化。当IN浓度高于10%时,SDS的含量变化不明显(P>0.05),说明IN只有在较低的浓度下对SDS的抑制作用较强。另外,IN的添加增大了WS中RS的含量并且具有浓度依赖性,这进一步说明了IN对WS的消化具有明显的抑制作用。KONG等[21]在冬虫夏草多糖对WS体外消化的影响研究中得到了相似的结果。引起这种抑制作用的原因可能有2个方面。一方面,IN分子与WS对有效水的竞争,抑制了淀粉的膨胀,导致部分淀粉颗粒的不完全糊化,使得消化变得困难[18]。另一面,IN可能会包裹在淀粉颗粒表面,限制了消化酶进入到淀粉颗粒内部[22]。
表3 IN-WS复配体系RDS、SDS和RS的含量
Table 3 Content of RDS,SDS,and RS of IN-WS blended systems
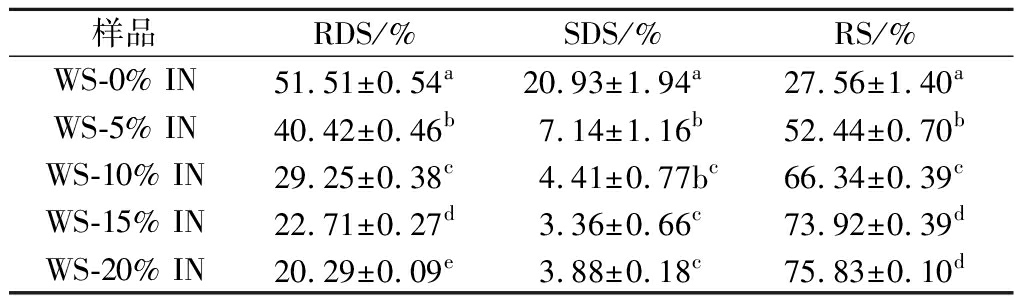
样品RDS/%SDS/%RS/%WS-0% IN51.51±0.54a20.93±1.94a27.56±1.40aWS-5% IN40.42±0.46b7.14±1.16b52.44±0.70bWS-10% IN29.25±0.38c4.41±0.77bc66.34±0.39cWS-15% IN22.71±0.27d3.36±0.66c73.92±0.39dWS-20% IN20.29±0.09e3.88±0.18c75.83±0.10d
2.5 相互作用力
一般来说,非淀粉多糖和淀粉的复配体系中存在的相互作用力通常包括静电力、氢键、疏水的相互作用和范德华力[23]。从分子的结构特征来看,IN和WS分子中存在大量的亲水基团—羟基,因此氢键和静电相互作用最有可能是多糖与淀粉相互作用的主要作用力。氯化钠主要干扰静电相互作用,对氢键影响作用不大,而尿素主要破坏氢键作用,对静电作用没有影响。因此,通过向多糖与淀粉复配体系中添加氯化钠和尿素来探究IN与WS间的相互作用力。如图4-a所示,随着氯化钠浓度的增加,IN-WS复配体系的储能模量略有变化,但是总体上变化较小。
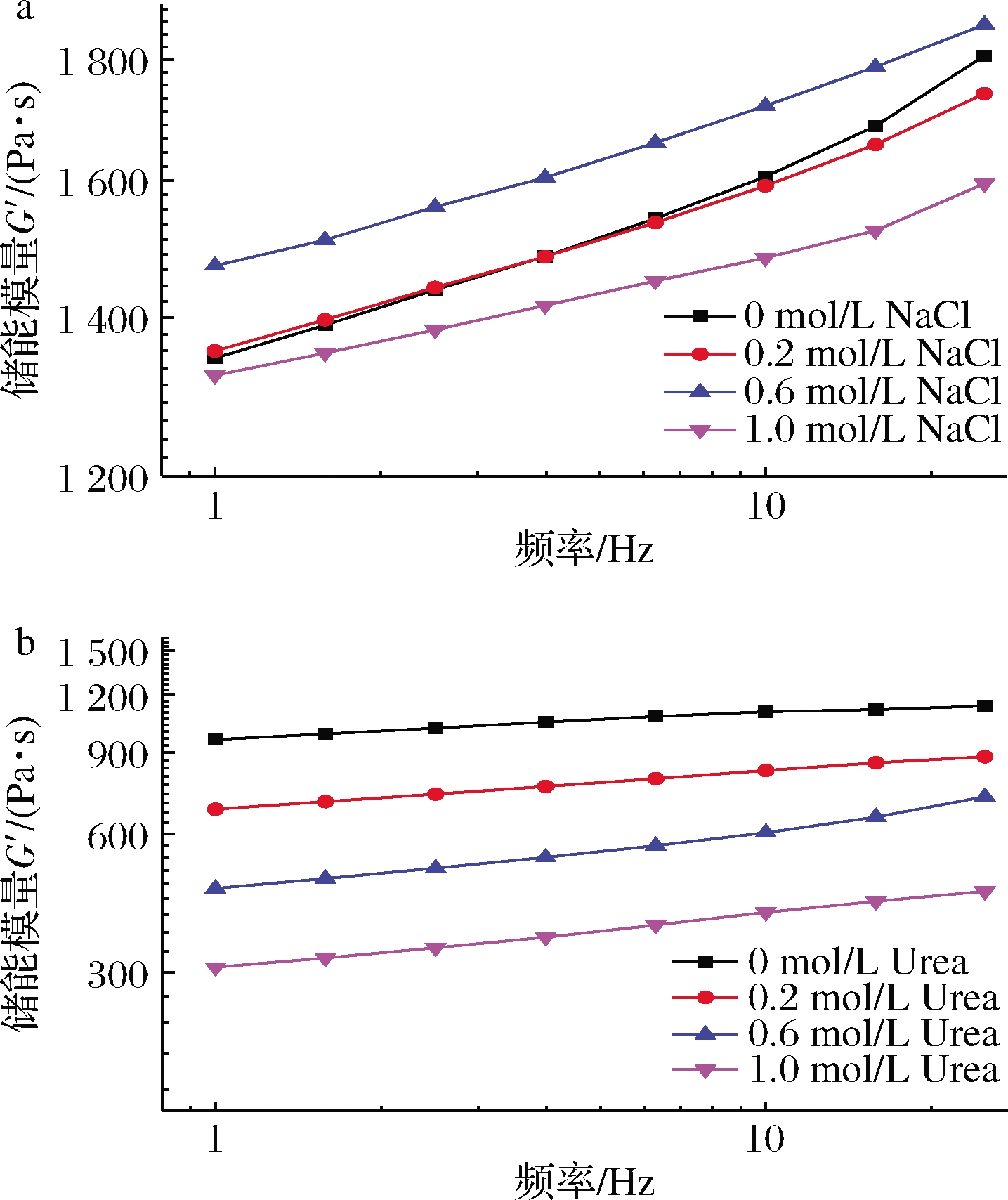
a-NaCl;b-尿素
图4 不同浓度NaCl和尿素对IN-WS复配体系的 储能模量曲线
Fig.4 Storage modulus (G′) curves of IN-WS blended systems with different concentrations of NaCl and Urea
由此可以推测IN与淀粉分子间的相互作用不是静电力。如图4-b所示,随着尿素的不断添加,IN-WS复配体系的储能模量不断下降,这表明尿素的添加破坏了IN与淀粉分子间的氢键作用。综上说明,氢键可能是维持IN与WS分子间的主要力量。LI等[24]也报道了氢键是淀粉-多糖体系中的主要作用力。
2.6 FT-IR
图5为IN-WS复配体系在4 000~400 cm-1的FT-IR图。与原WS相比,添加IN后复配体系的吸收峰基本相同,并没有出现新的吸收峰,说明IN与淀粉分子之间没有形成新的共价键。IN-WS复配体系在3 400和2 900 cm-1左右出现的吸收峰分别与O—H和C—H的伸缩振动有关。其中,3 400 cm-1左右的吸收峰为典型的多聚体分子间缔合羟基的特征峰[25],说明IN与WS分子间存在氢键的作用力,与相互作用试验结果相一致。IN的添加使WS在3 429 cm-1处的吸收峰向3 446 cm-1处移动,但随着IN添加量的增大,IN-WS复配体系的吸收峰又逐渐向低波数方向移动,说明复配体系分子间的氢键作用力逐渐增强。在1 647 cm-1处的吸收峰与样品的含水量有关,对应于淀粉无定形区域结合水的O—H弯曲振动[26]。在1 021 cm-1处的吸收峰与C—O键的伸缩有关。929 cm-1处的吸收峰与整个无水葡萄糖环的拉伸振动有关[27]。
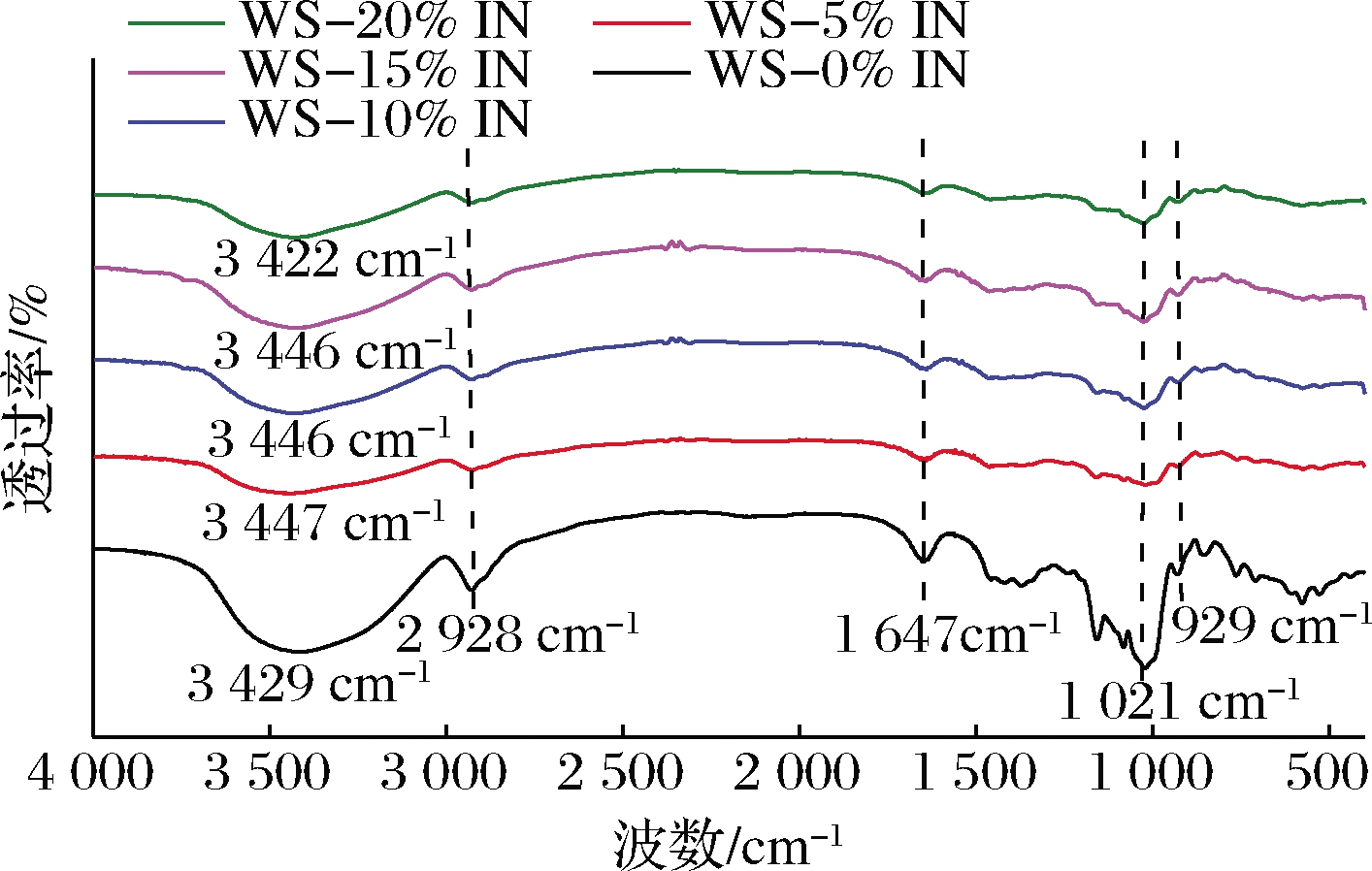
图5 IN-WS复配体系FT-IR图
Fig.5 FT-IR spectra of IN-WS blended systems
3 结论
本文研究表明,IN的添加对IN-WS复配体系的糊化,流变和体外消化特性有显著的影响。IN-WS复配体系的黏度、崩解值、回生值显著降低,且具有浓度依赖性。IN的添加延迟了复配体系的糊化,降低了糊化焓。IN-WS复配体系为典型的非牛顿流体,具有剪切稀化行为。随着IN浓度的添加,IN-小麦复配体系凝胶结构由类固态向类液态转变。体外消化试验结果表明IN的存在抑制WS的水解,提高了SDS的含量。IN与WS间主要发生氢键的相互作用,并没有新的基团产生。目前的研究结果表明,IN的添加改善了WS的加工特性,为开发IN-淀粉基产品提供新的思路。
[1] NIETO-NIETO T V,WANG Y X,OZIMEK L,et al.Inulin at low concentrations significantly improves the gelling properties of oat protein-A molecular mechanism study[J].Food Hydrocolloids,2015,50:116-127.
[2] CHIAVARO E,VITTADINI E,CORRADINI C.Physicochemical characterization and stability of inulin gels[J].European Food Research and Technology,2007,225(1):85-94.
[3] SHOAIB M,SHEHZAD A,OMAR M,et al.Inulin:Properties,health benefits and food applications[J].Carbohydrate Polymers,2016,147:444-454.
[4] COXAM V.Inulin-type fructans and bone health:State of the art and perspectives in the management of osteoporosis[J].The British Journal of Nutrition,2005,93(Suppl 1):S111-S123.
[5] 李妍,崔维建,赵城彬,等.玉米淀粉-玉木耳多糖复配体系理化及结构性质[J].食品科学,2021,42(4):58-64.
LI Y,CUI W J,ZHAO C B,et al.Physicochemical and structural properties of corn starch-Auricularia cornea Ehrenb.polysaccharide blends[J].Food Science,2021,42(4):58-64.
[6] LUO Y,SHEN M Y,LI E P,et al.Effect of Mesona chinensis polysaccharide on pasting,rheological and structural properties of corn starches varying in amylose contents[J].Carbohydrate Polymers,2020,230:115713.
[7] DARTOIS A,SINGH J,KAUR L,et al.Influence of guar gum on the in vitro starch digestibility—rheological and microstructural characteristics[J].Food Biophysics,2010,5(3):149-160.
[8] 张明月,杨留枝,史苗苗,等.超声辅助预处理法制备小麦淀粉-单甘酯复合物[J].食品科技,2019,44(11):279-284.
ZHANG M Y,YANG L Z,SHI M M,et al.Study on ultrasonic-assisted preparation of wheat starch-monoglyceride complex[J].Food Science and Technology,2019,44(11):279-284.
[9] REN Y M,XIAO W H,RONG L Y,et al.The role of alkali in sweet potato starch-Mesona chinensis Benth polysaccharide gels:Gelation,rheological and structural properties[J].International Journal of Biological Macromolecules,2021,170:366-374.
[10] 景悦,王文星,杨留枝,等.抗性淀粉和聚葡萄糖对馒头品质的影响[J].食品工业科技,2020,41(7):76-81.
JING Y,WANG W X,YANG L Z,et al.Effect of resistant starch and polydextrose on the quality of steamed bread[J].Science and Technology of Food Industry,2020,41(7):76-81.
[11] REN Y M,JIANG L,WANG W J,et al.Effects of Mesona chinensis Benth polysaccharide on physicochemical and rheological properties of sweet potato starch and its interactions[J].Food Hydrocolloids,2020,99:105371.
[12] MA S P,ZHU P L,WANG M C.Effects of konjac glucomannan on pasting and rheological properties of corn starch[J].Food Hydrocolloids,2019,89:234-240.
[13] HAGER A S,RYAN L A M,SCHWAB C,et al.Influence of the soluble fibres inulin and oat β-glucan on quality of dough and bread[J].European Food Research and Technology,2011,232(3):405-413.
[14] LIU S C,LIN L H,SHEN M Y,et al.Effect of Mesona chinensis polysaccharide on the pasting,thermal and rheological properties of wheat starch[J].International Journal of Biological Macromolecules,2018,118:945-951.
[15] 王宏伟,许可,张艳艳,等.淀粉老化的影响因素及其检测技术研究进展[J].轻工学报,2021,36(1):17-29.
WANG H W,XU K,ZHANG Y Y,et al.An review on the factors affecting starch retrogradation and progress in detecting techniques[J].Journal of Light Industry,2021,36(1):17-29.
[16] LUO D L,LI Y,XU B C,et al.Effects of inulin with different degree of polymerization on gelatinization and retrogradation of wheat starch[J].Food Chemistry,2017,229:35-43.
[17] SUN Y,WANG M C,MA S P,et al.Physicochemical characterization of rice,potato,and pea starches,each with different crystalline pattern,when incorporated with konjac glucomannan[J].Food Hydrocolloids,2020,101:105499.
[18] CHEN L,TONG Q Y,REN F,et al.Pasting and rheological properties of rice starch as affected by pullulan[J].International Journal of Biological Macromolecules,2014,66:325-331.
[19] REN Y M,RONG L Y,SHEN M Y,et al.Interaction between rice starch and Mesona chinensis Benth polysaccharide gels:Pasting and gelling properties[J].Carbohydrate Polymers,2020,240:116316.
[20] HESARINEJAD M A,KOOCHEKI A,RAZAVI S M A.Dynamic rheological properties of Lepidium perfoliatum seed gum:Effect of concentration,temperature and heating/cooling rate[J].Food Hydrocolloids,2014,35:583-589.
[21] KONG X R,ZHU Z Y,ZHANG X J,et al.Effects of Cordyceps polysaccharides on pasting properties and in vitro starch digestibility of wheat starch[J].Food Hydrocolloids,2020,102:105604.
[22] SASAKI T,KOHYAMA K.Effect of non-starch polysaccharides on the in vitro digestibility and rheological properties of rice starch gel[J].Food Chemistry,2011,127(2):541-546.
[23] YANG C H,ZHONG F,DOUGLAS GOFF H,et al.Study on starch-protein interactions and their effects on physicochemical and digestible properties of the blends[J].Food Chemistry,2019,280:51-58.
[24] LI Q Q,WANG Y S,CHEN H H,et al.Retardant effect of sodium alginate on the retrogradation properties of normal cornstarch and anti-retrogradation mechanism[J].Food Hydrocolloids,2017,69:1-9.
[25] SUN Y K,WU Z W,HU B,et al.A new method for determining the relative crystallinity of chickpea starch by Fourier-transform infrared spectroscopy[J].Carbohydrate Polymers,2014,108:153-158.
[26] MOR N J I,CYRAS V P,V
N J I,CYRAS V P,V ZQUEZ A.Preparation and characterization of three different derivatized potato starches[J].Journal of Polymers and the Environment,2013,21(2):395-404.
ZQUEZ A.Preparation and characterization of three different derivatized potato starches[J].Journal of Polymers and the Environment,2013,21(2):395-404.
[27] YE J P,YANG R,LIU C M,et al.Improvement in freeze-thaw stability of rice starch gel by inulin and its mechanism[J].Food Chemistry,2018,268:324-333.