柚子,属于芸香科柑橘属,因其酸甜、凉润的口感且集药食为一体的特点深受人们喜爱[1]。随着柚子产业的发展,产生了大量的加工副产品,其中大部分被当作废弃物处理。研究发现,柚子中含有几十种对人体有益的生理活性成分,如果能将废弃物作为功能原料被综合利用,既可以减少资源浪费,又可以保护环境[2]。
近年来,由于膳食纤维具有降低血脂和血糖水平,减少心血管和结直肠癌疾病的功效[3],受到了研究人员、食品行业和消费者的广泛关注。膳食纤维根据溶解性不同,划分为不溶性膳食纤维(insoluble dietary fiber,IDF)和水溶性膳食纤维(soluble dietary fiber,SDF)[4]。与谷物相比,来自柚子皮的膳食纤维的主要优势在于其含有更多的酚类物质[5]。这对于开发含纤维产品非常重要,因为功能性膳食纤维更有利于人体吸收。与SDF相比,IDF不仅占据天然纤维的2/3,还在预防和缓解便秘、糖尿病、结肠癌、肥胖、高血压等有方面发挥了重要的作用[6-7]。
研究表明,不同的提取方法会影响IDF的结构、功能和理化活性。蒋纬等[8]认为微波法所提取的野木瓜IDF和SDF能够较好保持其还原能力和抗氧化能力;王曦璠等[9]认为,碱提取法的香菇膳食纤维平均产率高于酶解法;孟怡璠等[10]认为,碱提取法的南瓜膳食纤维的阳离子交换能力和水合性质更强。物理方法在一定程度上不能完全提取出膳食纤维,碱法在提取的过程中会增加环境的二次污染[11]。因此,亟待开发高效、绿色的柚皮海绵层IDF提取工艺。
因此,本文采用超声法、复酶法、酶碱法和超声辅助复酶法提取柚皮海绵层中的IDF,比较IDF的表观结构、理化特性和体外抗氧化能力的差异,以期为柚子皮的精深加工及功能性食品添加剂的研制提供理论依据。
1 材料与方法
1.1 材料与试剂
将新鲜柚子去皮,留下海绵层,切成均匀的(3±0.5)cm小块,经鼓风干燥机60 ℃完全干燥后,粉碎过80目筛,存于4 ℃冰箱备用。
磷酸氢二钠、磷酸二氢钠、氢氧化钠(均为分析纯)、α-淀粉酶(4 000 U/g)、糖化酶(100 000 U/g)、中性蛋白酶(100 000 U/g),上海源叶生物科技有限公司;ABTS法和铁离子还原能力(ferric reducing ability of plasma,FRAP)法总抗氧化能力检测试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
Mx5百万分之一电子天平,Mettler Toledo;UV-1800型紫外分光光度计,日本岛津公司;PB-10型pH计,Sartorius公司;Infinite M200 PRO酶标仪,瑞士TECAN公司。
1.3 实验方法
1.3.1 膳食纤维提取方法
1.3.1.1 复合酶法工艺流程
柚皮海绵层粉末2 g→加入20倍体积水→调pH 6.0→1.5%混合酶[m(α-淀粉酶)∶m(糖化酶)=1∶1]70 ℃酶解60 min→灭酶10 min→冷却→调pH 7.0→1%中性蛋白酶50 ℃酶解60 min→灭酶→5 000 r/min离心10 min→过滤→滤渣→干燥→IDF。
1.3.1.2 酶碱法工艺流程
柚皮海绵层粉末2 g→加入20倍体积水→调pH 6.0→0.4%混合酶[m(α-淀粉酶)∶m(糖化酶)=1∶1]→60 ℃酶解50 min→灭酶10 min→冷却至60 ℃→5% NaoH溶液(NaOH浓度1 mol/L)→60 ℃碱解30 min→5 000 r/min离心10 min→过滤→滤渣→干燥→IDF。
1.3.1.3 超声法工艺流程
柚皮海绵层粉末2 g→加入20倍体积水→调pH 6.0→超声30 min、40 ℃、400 W→5 000 r/min离心10 min→过滤→滤渣→干燥→IDF。
1.3.1.4 超声辅助复酶法工艺流程
柚皮海绵层粉末2 g→加入20倍体积水→调pH 6.0→超声30 min、40 ℃、400 W→1.5%混合酶[m(α-淀粉酶)∶m(糖化酶)=1∶1]70 ℃酶解60 min→灭酶10 min→冷却→调pH 7.0→1%中性蛋白酶50 ℃酶解60 min→灭酶→5 000 r/min离心10 min→过滤→滤渣→干燥→IDF。
1.3.2 柚皮海绵层IDF物化性质的测定
1.3.2.1 持水力
参考LI等[12]的研究方法略作修改。将0.5 g样品与25 mL蒸馏水混合1 h后,于4 000 r/min下离心10 min,除去上清液,称重沉淀物。持水力计算如公式(1)所示:
持水性![]()
(1)
式中:m1,沉淀物减去样品的质量,g;m,样品的质量,g。
1.3.2.2 持油力
根据KUREK等[13]的研究方法略作修改。将0.5 g样品和25 mL葵花籽油混合1 h后,于5 000 r/min下离心10 min。弃去上清液,称重残余物。持油性计算如公式(2)所示:
持油性![]()
(2)
式中:m1,样品湿重,g;m2,样品干重,g。
1.3.2.3 膨胀性
参考ROBERTSON等[14]的研究方法略作修改。将0.3 g样品转入量筒中,记下样品初始体积。将5 mL的蒸馏水倒入量筒内,混合24 h,读取样品最终的体积。膨胀性计算如公式(3)所示:
膨胀性![]()
(3)
式中:V1,样品最终的体积,mL;V2,样品初始的体积,mL;m,样品的质量,g。
1.3.2.4 阳离子交换能力的测定
参照BENITEZ等[15]的研究方法略作修改。0.5 g样品和10 mL 0.1 mol/L的HCl溶液混合,放置24 h后过滤,将残渣与100 mL 15%NaCl溶液混合,用0.1 mol/L的NaOH溶液进行滴定,测定样品消耗NaOH溶液体积,同时用蒸馏水代替HCl溶液,测定空白样品消耗NaOH溶液体积。阳离子交换能力计算如公式(4)所示:
阳离子交换能力![]()
(4)
式中:V1,测定样品消耗NaOH溶液体积,mL;V0,测定空白样品消耗NaOH溶液体积,mL。
1.3.3 扫描电镜(scanning electron microscope,SEM)分析
将微量样品固定于导电胶带观察台上,用离子溅射的方法进行喷金处理,以5.00 kV的加速电压于SEM观察台上收集并观察图像,放大倍数为800倍。
1.3.4 生物活性化合物溶出的测定
1.3.4.1 总酚、总黄酮的提取
根据庄远红等[16]的研究方法略作修改。取0.5 g样品,加入10 mL 60%乙醇于室温下超声10 min,在4 000 r/min下离心10 min,收集上清液,再加10 mL 60%乙醇重复提取2次,合并上清液并定容至25 mL,于-20 ℃贮存。
1.3.4.2 总黄酮、总酚含量的测定
膳食纤维的黄酮和总酚含量用分光光度仪测定,具体方法见文献[17-18]。
1.3.5 体外抗氧化性分析
1.3.5.1 ABTS阳离子自由基的清除作用
采用总抗氧化能力检测试剂盒(ABTS法)测定样品的自由基清除能力。在室温条件下取待测样品溶液10 μL加入20 μL的酶溶液和170 μL ABTS工作液中。室温孵育6 min后于405 nm处测定吸光度,以蒸馏水作空白对照。
1.3.5.2 FRAP的测定
采用总抗氧化能力检测试剂盒(FRAP法)测定样品的FRAP。在室温条件下取待测样品溶液5 μL加入180 μL FRAP工作液中。37 ℃孵育5 min后于593 nm处测定吸光度,以蒸馏水作空白对照。
1.4 数据分析
每组实验做3个平行,计算平均值和标准偏差,数据以平均值±SD的形式表示;采用Origin 20.0,SPSS 16.0等软件对数据进行绘图以及ANOVA差异性分析。
2 结果与分析
2.1 理化性质分析
持水性与膨胀性可以反映膳食纤维水合性质优劣的重要指标,其与IDF的表面积、质量分数和分子间的结构有关[10]。4种不同方法提取的柚皮海绵层IDF的水合性质如图1所示。在持水性方面,样品的持水性值为9.85~12.70 g/g,以酶碱法(12.70 g/g)最佳,超声辅助复酶法(10.64 g/g)和超声法(10.52 g/g)次之,复酶法(9.85 g/g)最差;膨胀性上,4种提取方法的柚皮海绵层IDF具有显著性差异(P<0.05)。超声辅助复酶法>酶碱法>复酶法>超声法。酶碱法和超声辅助复酶法提取IDF水合性质较好,可能与碱和超声对纤维结构的破坏有关。总之,高持水性和膨胀性的膳食纤维更有利于食物的膨胀,增加人体的饱腹感。
膳食纤维分子表面的活性基团不仅可以吸附人体的油脂,还可以在烘焙中防止脂肪流失。持油性又与水胶体的表面性质和分子间空隙的结合度有关。如图1所示,超声辅助复酶法提取IDF持油性含量最高(8.92 g/g),复酶法(5.78 g/g)和酶碱法(4.97 g/g)次之,超声法(3.24 g/g)最低。
超声辅助复酶法的IDF持油性和膨胀性都优于其他3个样品,这可能是该方法下IDF的结构更松散。酶碱法提取的IDF持水性高,但是由于强碱在某种程度上破坏了IDF的结构,使其持油性较差。
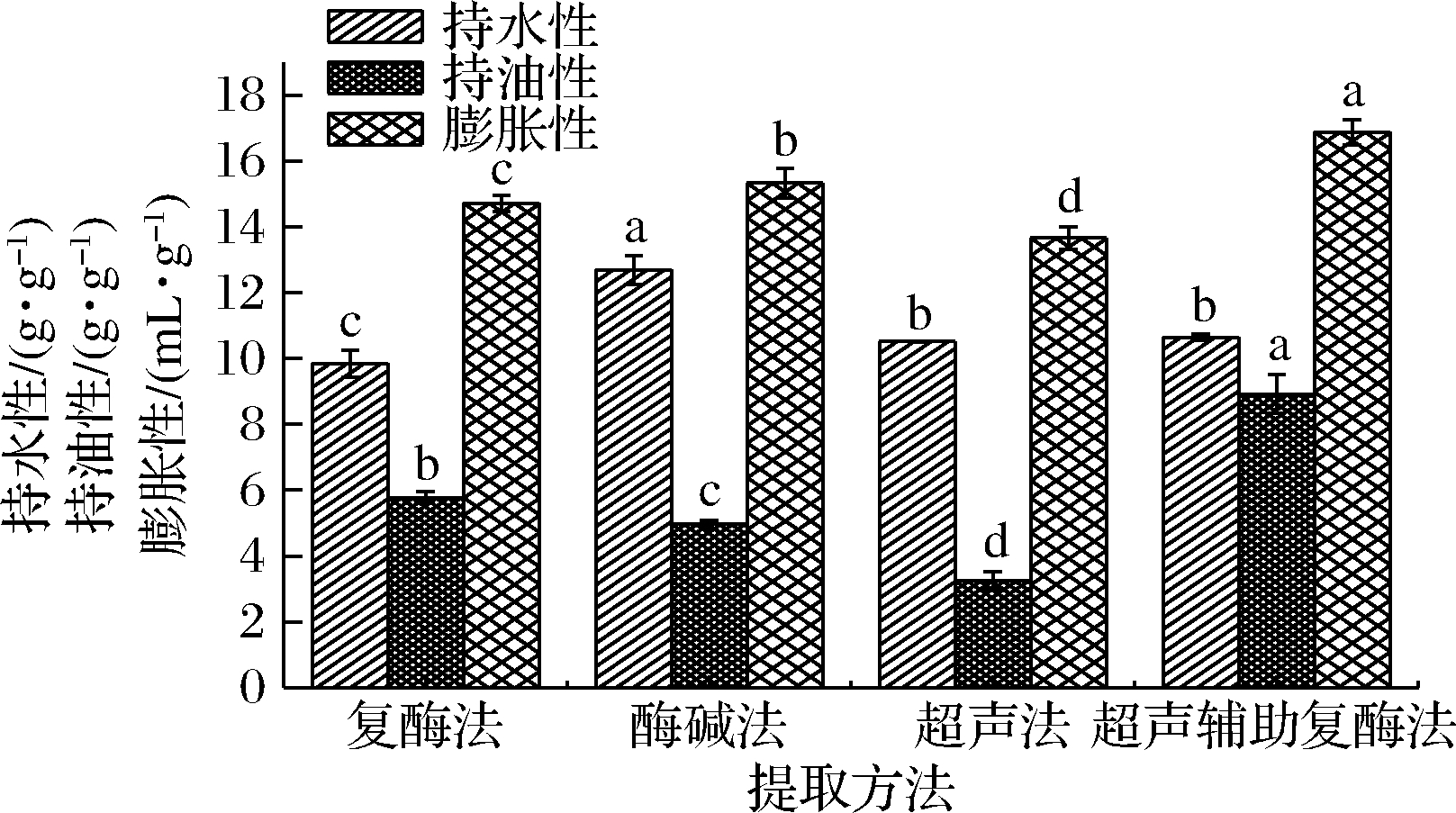
图1 不同提取方法的IDF的持水性、持油性、膨胀性
Fig.1 The water-holding,oil-holding and expansion of IDF in different extracted methods
注:不同字母表示差异显著(P<0.05)(下同)
2.2 阳离子交换能力
膳食纤维分子结构中存在氨基、羟基等活性基团。这些基团与Zn2+、Cu2+等离子进行交换时,可以改变人体消化道的pH和渗透压,降低Na+/K+比值,产生降血压作用[19]。由图2可知,4种提取方法下的阳离子交换能力由大到小依次为:酶碱法>超声辅助复酶法>复酶法>超声法,其中酶碱法与复酶法、超声法存在显著性差异(P<0.05)。酶碱法和超声辅助复酶法提取的IDF的阳离子交换能力高,其原因可能与蛋白质、淀粉的清除率有关。

图2 不同提取方法下IDF阳离子交换能力
Fig.2 The cation exchange capacity of IDF in different extraction methods
2.3 SEM分析
本研究采用SEM研究不同提取方法下的IDF的显微结构。由图3可知,4种IDF颗粒表面有皱褶,呈疏松的海绵状且网眼较大,没有球形颗粒结构,说明4种IDF产品中不含淀粉等杂质[20]。酶碱法表面孔隙比复酶法多,这可能是因为氢氧化钠在提取过程中使IDF的微观结构和粒径大小发生改变,导致聚合度下降;复酶法的结构比超声法更平坦,可能是超声波的空化作用使膳食纤维的结构完整性被破坏,呈现带有裂缝的片状结构[3]。超声辅助复酶法的孔隙比酶碱法更致密、更规则,可能是超声波与酶结合,使IDF的结构更为疏松,提高IDF理化特性,使其发挥更好的生理功能。复酶法、酶碱法和超声法均影响了IDF的微观结构。空间结构较松散的IDF与其持水性和膨胀性等理化指标有相关关系。因此,SEM结果表明,提取方法可能会改变柚皮海绵层膳食纤维样品的功能特性。

a-超声法;b-复酶法;c-酶碱法;d-超声辅助复酶法
图3 不同提取方法下IDF的SEM图
Fig.3 The SEM of IDF under different extraction methods
2.4 柚皮海绵层IDF生物活性物质溶出量
有研究发现,膳食纤维的抗氧化性、降血糖、减肥、减少慢性胃肠道紊乱等功效与其中含有的酚类和黄酮类密切相关。黄酮类和酚类化合物分别是通过自由基和细胞的氧化能力来实现抗氧化作用[21-22]。如图4所示,4种方法提取的柚皮海绵层IDF黄酮含量为4.04~6.62 mg/g,其中复酶法、酶碱法和超声辅助复酶法提取的黄酮含量没有显著性差异(P>0.05),而超声法下IDF黄酮含量(4.04 mg/g)最少。4种方法提取柚皮海绵层的IDF总酚含量为2.34~2.80 mg/g,酶碱法和超声辅助复酶法提取IDF的总酚含量高于复酶法和超声法提取IDF的总酚含量。由以上结果可知,总酚和总黄酮含量因提取方法的不同而有所差异,酶碱法和超声辅助复酶法提取的生物活性物质高可能与其有效去除原料中淀粉、蛋白质等物质有关[23]。
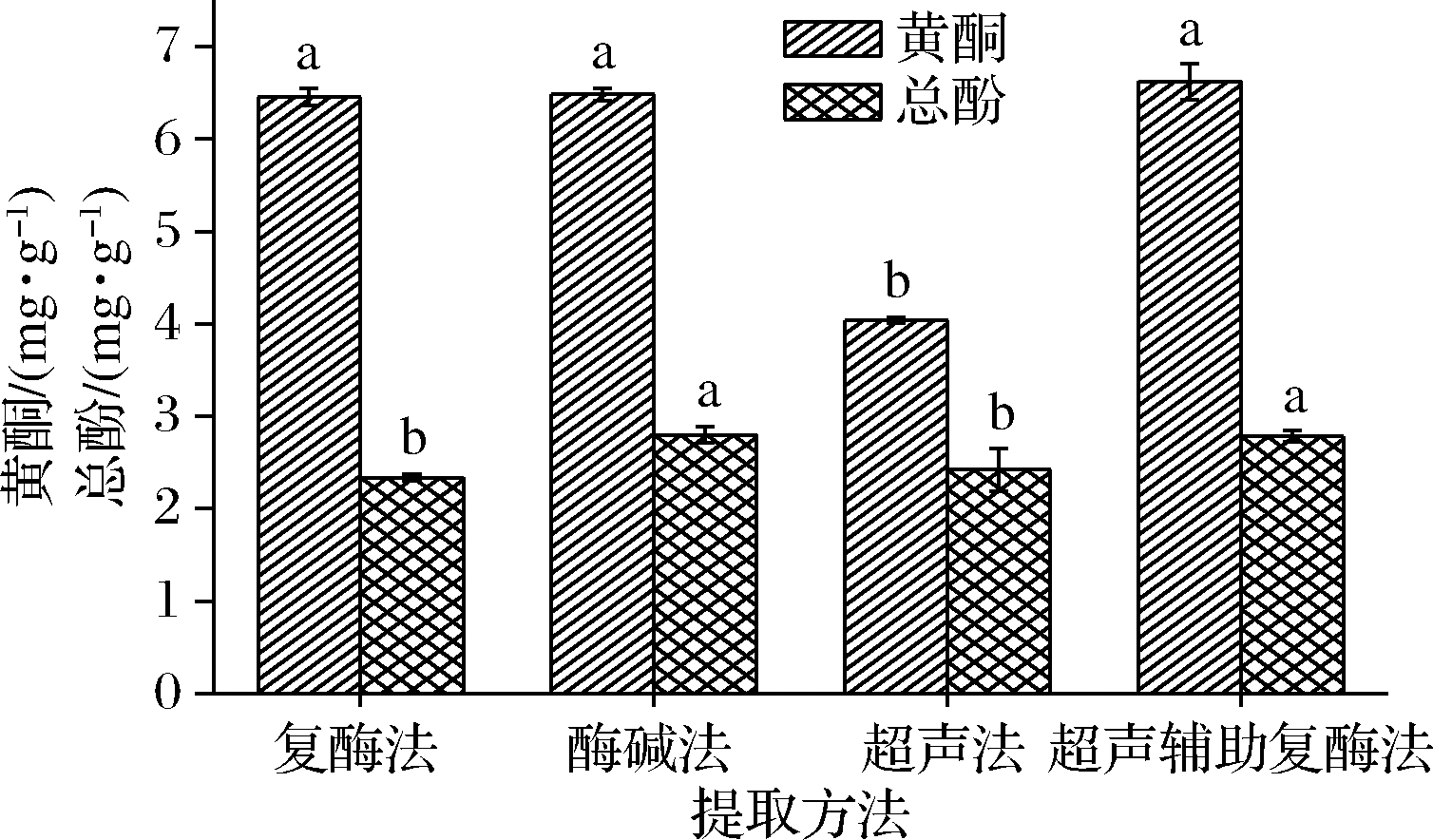
图4 不同提取方法的IDF的总酚和总黄酮含量测定
Fig.4 The total phenols and total flavones of IDF in different extraction methods
2.5 不同提取方法对IDF抗氧化活性的影响
本文通过测定FRAP和ABTS阳离子自由基清除能力,分析了4种提取方式下IDF体外抗氧化活性的差异。由图5可知,4种IDF的FRAP为20.52~29.84 mmol/L,其中酶碱法(29.84 mmo/L)最高,超声辅助复酶法(24.38 mmo/L)和复酶法(22.57 mmol/L)次之,超声法(20.52 mmol/L)最低;超声辅助复酶法的ABTS阳离子自由基清除能力(42.98 mmol/L)显著高于其他3种提取方法(P<0.05)。2种抗氧化方法所测出4种IDF抗氧化顺序存在一定的差异,可能与其自由基和反应离子有关。
虽然2种抗氧化能力所测结果存在差异,但不影响柚皮海绵层IDF抗氧化能力的总体趋势,即酶碱法和超声辅助复酶法>复酶法和超声法。酶碱法和超声辅助复酶法有较强的抗氧化能力,这可能是因为这2种提取方法下的IDF结构疏松,空隙较大,更有利于提供电子和氢原子,这与之前的研究具有一致性[24]。
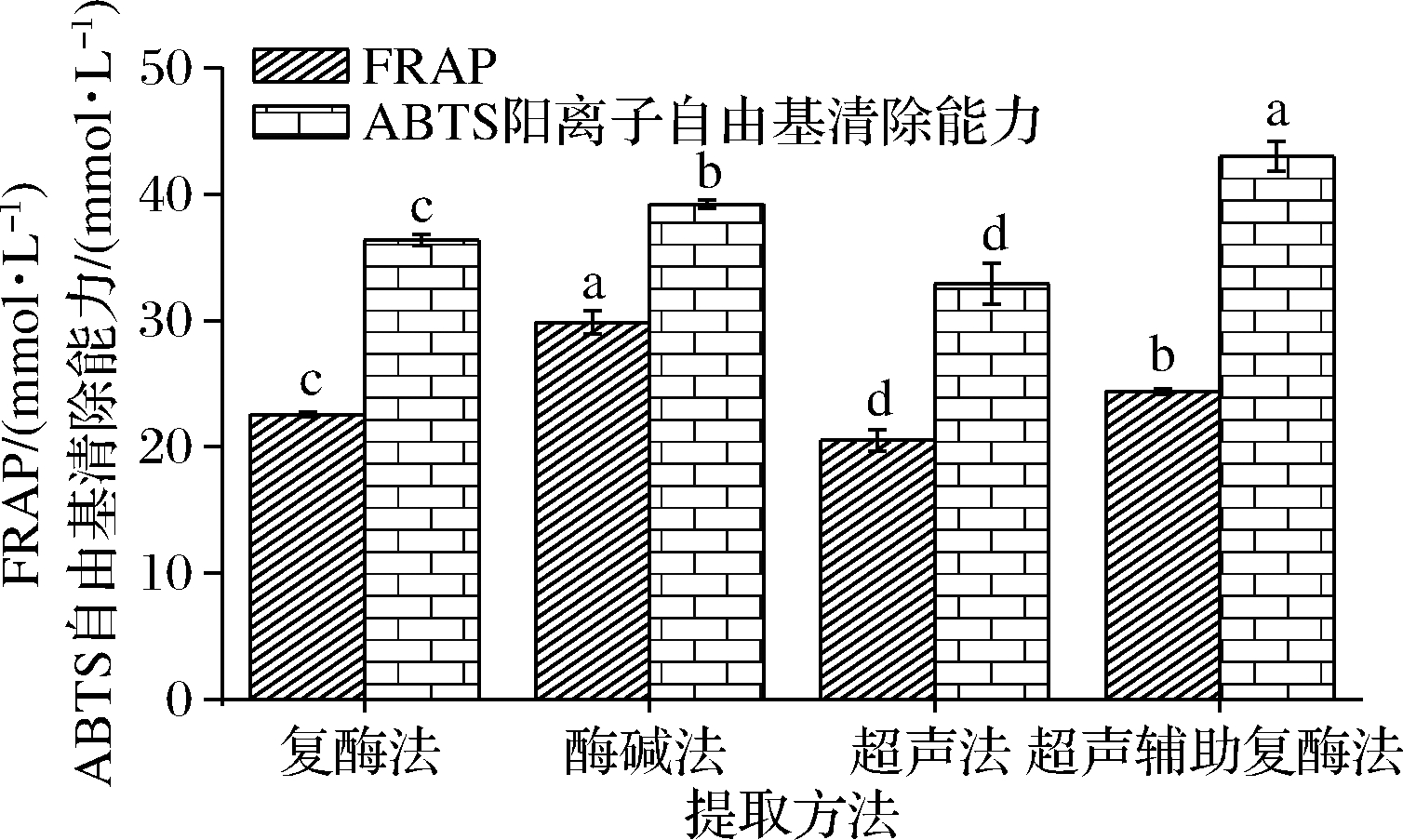
图5 不同提取方法下IDF的FRAP和ABTS 阳离子自由基清除能力
Fig.5 The FRAP and ABTS cationic free radical scavenging ability of IDF in different extraction methods
2.6 IDF抗氧化活性与总酚、黄酮之间的相关性
酚类物质是膳食纤维中主要活性成分,是膳食纤维品质及生物学活性评价的主要指标,柚皮抗氧化活性与总酚含量密切相关[25]。结果如表1所示,2种抗氧化能力均与总酚含量呈显著正相关(P<0.05);与黄酮呈正相关,相关性不显著(P>0.05);且不同提取方法下IDF的抗氧化活性与总酚的含量趋势相同,即抗氧化能力随着总酚含量的多少而变化。
表1 抗氧化能力与多酚、黄酮类物质相关性
Table 1 Correlation of antioxidant capacity with polyphenols and flavonoids
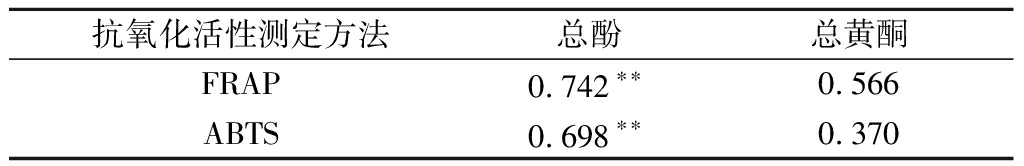
抗氧化活性测定方法总酚总黄酮FRAP0.742∗∗0.566ABTS0.698∗∗0.370
注:**表示相关性在0.01水平上极显著
3 结论
本文对比研究了超声法、复酶法、酶碱法和超声辅助复酶法4种提取方法对柚皮海绵层IDF的理化性质、功能和结构的差异。在理化性质方面,超声波辅助复酶法提取IDF的持油性(8.92 g/g)和膨胀性(16.89 mL/g)含量最高,而酶碱法提取IDF以持水性(12.70 g/g)含量和阳离子交换能力最高。结构上,超声辅助复酶法提取的IDF表面的空隙更小、更紧密。提取方式不仅影响IDF的结构表征,还会影响其功能特性。酶碱法提取的柚皮海绵层中IDF的总酚含量(2.80 g/g)和FRAP(39.18 mmol/L)最高;超声辅助复酶法以黄酮含量(6.62 mg/g)和ABTS阳离子自由基清除能力(42.98 mmo/L)最高。因此,超声辅助复酶法可作为一种绿色的提取膳食纤维的工艺,对功能性膳食纤维的开发和柚皮产业的附加值利用提供科学依据。
[1] 李靓,朱涵彬,李长滨,等.柚子营养成分及保健功能研究[J].现代食品,2020,12(24):45-47.
LI J,ZHU H B,LI C B,et al.Study on nutritional composition and healthy function of pomelo[J].Modern Food,2020,12(24):45-47.
[2] 唐海珊,陈佩瑶,丁晴,等.超声辅助酶法提取柚子皮水溶性膳食纤维及其抗氧化活性研究[J].保鲜与加工,2016,16(6):103-106.
TANG H S,CHEN P Y,DING Q,et al.Extraction of soluble dietary fiber from pomelo peel by ultrasonic assisted enzymatic method and its antioxidant activity[J].Storage and Process,2016,16(6):103-106.
[3] 潘利华,徐学玲,罗建平.超声辅助提取水不溶性大豆膳食纤维及其物理特性[J].农业工程学报,2011,27(9):387-392.
PAN L H,XU X L,LUO J P.Ultrasound-assisted extraction of insoluble dietary fiber from soybean and its physical properties[J].Transactions of the Chinese Society of Agricultural Engineering,2011,27(9):387-392.
[4] ANDERSON J W,BAIRD P,DAVIS J R R H,et al.Health benefits of dietary fiber[J].Nutrition Reviews,2009,67(4):188-205.
[5] 宁芯,农丽红,莫紫梅,等.果蔬膳食纤维代餐粉的研制[J].食品工业,2021,42(2):91-95.
NING X,NONG L H,MO Z M,et al.Preparation of dietary fiber meal replacement powder with fruits and vegetables processing by-products[J].The Food Industry,2021,42(2):91-95.
[6] XU Z H,XIONG X,ZENG Q Z,et al.Alterations in structural and functional properties of insoluble dietary fibers-bound phenolic complexes derived from lychee pulp by alkaline hydrolysis treatment[J].LWT,2020,127:109 335.
[7] 李琦,曾凡坤,华蓉,等.麦麸膳食纤维理化特性、制备方法及应用研究进展[J].食品工业科技,2020,41(17):352-357;367.
LI Q,ZENG F K,HUA R,et al.Research progress on the physicochemical properties,preparation methods and application of wheat bran dietary fiber[J].Science and Technology of Food Industry,2020,41(17):352-357;367.
[8] 蒋纬,王嘉莹,何鸿.不同提取方法对野木瓜膳食纤维提取及其抗氧化特性的影响研究[J].农产品加工,2019(24):28-31.
JIANG W,WANG J Y,HE H.Effects of different extraction methods on dietary fiber extraction and antioxidant properties of wild papaya[J].Farm Products Processing,2019(24):28-31.
[9] 王曦璠,李家宇,汤婉婷,等.碱提法、酶解法提取香菇膳食纤维的工艺优化及差异性研究[J].湖南中医药大学学报,2019,39(12):1 525-1 528.
WANG X F,LI J Y,TANG W T,et al.Study on technological optimization and difference of extraction of Lentinus edodes dietary fiber by alkali extraction and enzymatic hydrolysis[J].Journal of Hunan University of Chinese Medicine,2019,39(12):1 525-1 528.
[10] 孟怡璠,金晖,郑鸯鸯,等.不同工艺南瓜膳食纤维的理化特性研究[J].中国食品添加剂,2012(4):122-126.
MENG Y F,JIN H,ZHENG Y Y,et al.Studies on physico-chemical properties of the dietary fiber prepared from pumpkin with different treatments[J].China Food Additives,2012(4):122-126.
[11] 曲鹏宇,李丹,李志江,等.膳食纤维功能、提取工艺及应用研究进展[J].食品研究与开发,2018,39(19):218-224.
QU P Y,LI D,LI Z J,et al.Research progress on function,extraction process and application of dietary fiber[J].Food Research and Development,2018,39(19):218-224.
[12] LI B,YANG W,NIE Y Y,et al.Effect of steam explosion on dietary fiber,polysaccharide,protein and physicochemical properties of okara[J].Food Hydrocolloids,2019,94:48-56.
[13] KUREK M A,KARP S,WYRWISZ J,et al.Physicochemical properties of dietary fibers extracted from gluten-free sources:Quinoa (Chenopodium quinoa),amaranth (Amaranthus caudatus) and millet (Panicum miliaceum)[J].Food Hydrocolloids,2018,85:321-330.
[14] ROBERTSON J A,DE MONREDON F D,DYSSELER P,et al.Thibault hydration properties of dietary fibre and resistant starch:A European collaborative study[J].LWT,2000,33(2):72-79.
[15] BENíTEZ V,MOLLá E,MARTíN-CABREJAS M A,et al.Effect of sterilization on dietary fiber and physico-chemical properties of onion by-products[J].Food Chemistry,2011,127(2):501-507.
[16] 庄远红,刘静娜,费鹏,等.柚子不同部位多酚和矿物质与抗氧化能力相关性研究[J].食品科学技术学报,2019,37(2):82-87.
ZHUANG Y H,LIU J N,FEI P,et al.Study on correlations between polyphenols,mineral elements and antioxidant capacities in different parts of pomelo[J].Journal of Food Science and Technology,2019,37(2):82-87.
[17] 朱丹,杨菁,李林龙,等.龙胆中黄酮化合物含量测定的方法学研究[J].安徽农业科学,2017,45(14):113-114.
ZHU D,YANG J,LI L L,et al.Methodological study of the determination of flavonoids from Radix gentianae[J].Journal of Anhui Agricultural Sciences,2017,45(14):113-114.
[18] 邢佳,陆文娟,赵云霞,等.石榴叶多酚的纯化及抗氧化活性研究[J].南京师大学报(自然科学版),2015,38(3):84-90.
XING J,LU W J,ZHAO Y X,et al.Purification and antioxidant activity of polyphenols from Punica granatum L.[J].Journal of Nanjing Normal University (Natural Science edition),2015,38(3):84-90.
[19] 王卓,顾正彪,洪雁.不同工艺条件制备的马铃薯膳食纤维的物化性能比较[J].食品科学,2007,28(8):236-240.
WANG Z,GU Z B,HONG Y.Physical properties of three kinds of dietary fibers from potato pulp[J].Food Science,2007,28(8):236-240.
[20] 郭翠翠.甜荞麦皮粉膳食纤维的制备及其物化特性研究[D].西安:陕西科技大学,2013.
GUO C C.Study on preparation and physicochemical characteristics of dietary fiber from buckwheat bran[D].Xi’an:Shaanxi University of Science and Technology,2013.
[21] 石秀梅,雷激,梁爱华,等.3种来源膳食纤维抗氧化特性比较[J].食品科技,2013,38(1):71-75.
SHI X M,LEI J,LIANG A H,et al.Comparison of antioxidant properties among there dietary fibers[J].Food Science and Technology,2013,38(1):71-75.
[22] 覃思,蒋立文,侯德兴.膳食多酚生理功能的营养基因组学研究现状与展望[J].中国食品学报,2011,11(9):155-169.
QIN S,JIANG L W,HOU D X.Research status and viewpoint on functionality of dietary polyphenols[J].Journal of Chinese Institute of Food Science and Technology,2011,11(9):155-169.
[23] 赵丽,宋一茉,朱丹实,等.不同提取方法对鲜食大豆荚膳食纤维抗氧化特性的影响[J].食品工业科技,2015,36(20):155-158.
ZHAO L,SONG Y M,ZHU D S,et al.Effect of different extraction methods on antioxidant properties of dietary fiber from vegetable soybean pods[J].Science and Technology of Food Industry,2015,36(20):155-158.
[24] YAN J K,WU L X,CAI W D,et al.Subcritical water extraction-based methods affect the physicochemical and functional properties of soluble dietary fibers from wheat bran[J].Food Chemistry,2019,298:124987.
[25] 尹培培,刘昌衡,赵鲁豫,等.芦笋膳食纤维及酚类物质的抗氧化活性[J].食品工业,2019,40(7):190-194.
YIN P P,LIU C H,ZHAO L Y,et al.Antioxidant activity of dietary fibers and phenolic compounds in asparagus[J].The Food Industry,2019,40(7):190-194.