猕猴桃,又名奇异果、阳桃,富含维生素C、维生素A、氨基酸、可溶性膳食纤维、矿物质等营养成分,具有抗氧化、抗衰老、预防心血管疾病等多种功能,素有“水果之王”美称[1]。猕猴桃果酒作为猕猴桃精深加工产品之一,具有独特的风格和保健功能,市场前景广阔。但由于受发酵菌种、工艺技术等的影响,猕猴桃酒存在风味淡薄、果香酯香不突出等问题[2]。
近年来,非酿酒酵母与酿酒酵母混合发酵果酒受到研究者的关注。非酿酒酵母在发酵过程产生多种胞外酶,与香气前体物质相互作用产生酯类、酸类、醇类、萜类化合物等代谢产物,对果酒增香、丰富口感具有举足轻重的作用[3]。葡萄园有孢汉逊酵母(Hanseniaspora vineae)是一种用于酿酒的非酿酒酵母,因能产生2-苯乙酸乙酯、2-苯乙醇、乙酸乙酯等关键的芳香化合物,与酿酒酵母共培养增加果酒复杂性,能显著影响果酒感官特性开始受到研究者关注[4-6]。葡萄园有孢汉逊酵母与酿酒酵母连续接种发酵可以提高霞多丽葡萄酒香气强度和酒体复杂性,香蕉、梨、柠檬果香显著提高,葡萄酒酒体丰满、香味浓郁、回味绵长、口感更佳[7]。在白葡萄酒及红葡萄酒酿造中应用葡萄园有孢汉逊酵母,发现其与酿酒酵母顺序接种对苯类化合物苯丙烷类、乙酸酯类的生成优于酿酒酵母发酵,且无论顺序接种还是同时接种感官评价均高于酿酒酵母酿造果酒[8]。亦有研究发现葡萄园有孢汉逊酵母与酿酒酵母混合顺序接种发酵维达布兰科冰酒,能够产生更多与果香、花香、甜香有关的挥发物,如乙酸酯、顺式玫瑰氧化物等,感官香气得到显著提升[9]。
目前,关于猕猴桃果酒研究多集中在酵母筛选[10]、香气分析[11]、单一菌种发酵工艺优化、抗氧化活性等方面[12],混菌发酵猕猴桃果酒也开始受到关注。使用不同酿酒酵母与非酿酒酵母共发酵猕猴桃果酒,发现不同酿酒酵母与非酿酒酵母酿造果酒品质不一,酵母菌共培养技术对获得高品质猕猴桃酒具有一定的裨益[13]。尹雪林等[14]使用戴尔有孢圆酵母与酿酒酵母混菌发酵猕猴桃果酒,发现混酵中挥发性香气成分种类多于单菌发酵,特别是顺序接种发酵提高了酒中苯乙酸乙酯、苯乙醇、β-大马士酮等物质含量。
非酿酒酵母在果酒酿造中发挥越来越重要的作用,非酿酒酵母种类较多,使用葡萄园有孢汉逊酵母与酿酒酵母混合培养猕猴桃果酒的工艺优化、体外抗氧化能力的探究鲜有报道。安琪果酒酵母在果酒酿造中广泛使用,具有较强的耐酒精能力且酿造果酒品质较好。因此本试验将葡萄园有孢汉逊酵母与安琪果酒酵母混合接种于猕猴桃汁中进行发酵,设计单因素与正交试验确定混菌发酵猕猴桃酒最适发酵工艺,同时对混菌发酵果酒、安琪果酒酵母发酵果酒、非酿酒酵母发酵果酒、果汁的抗氧化活性进行探究,以期为非酿酒酵母应用于猕猴桃果酒提供理论依据。
1 材料与方法
1.1 材料
猕猴桃采于河南内乡,品种“徐香”;果胶酶、偏重亚硫酸钾,食品级,烟台帝伯仕自酿机有限公司;白砂糖,市售。酿酒酵母(SY),安琪酵母股份有限公司;葡萄园有孢汉逊酵母(Hanseniaspora vineae,CGMCC 2.3268),中国普通微生物菌种保藏管理中心。
1.2 仪器与设备
CD14RDII台式高速冷冻离心机,上海天美生化仪器设备有限公司;TU—1901紫外可见分光光度计,北京普析通用仪器有限责任公司;MJ-54A高压灭菌锅,施都凯仪器设备(上海)有限公司;PAL-1数显糖度计,日本爱拓公司;多功能酶标仪,PerkinElmer公司。
1.3 试验方法
1.3.1 猕猴桃酒工艺流程
猕猴桃→挑选→清洗→去皮榨汁→添加偏重亚硫酸钾、果胶酶→酶解→4层纱布过滤→调整糖度→灭菌→接种酵母→前发酵→过滤澄清→后发酵→灭菌→密封装瓶
1.3.2 猕猴桃酒工艺优化单因素试验
1.3.2.1 接种方式对猕猴桃酒的影响
在SO2质量浓度60 mg/L、初始糖度20 °Brix、接种量2%、接种比1∶1(体积比)的条件下,将酿酒酵母提前48 h接入、酿酒酵母提前24 h接入、非酿酒酵母与酿酒酵母同时接入、非酿酒酵母提前24 h接入、非酿酒酵母提前48 h接入猕猴桃果汁,25 ℃恒温发酵7 d。
1.3.2.2 接种量对猕猴桃酒的影响
在SO2质量浓度60 mg/L、初始糖度20 °Brix、接种体积比为1∶1、非酿酒酵母提前24 h 接入的条件下,调整不同酵母接种量(2%、3%、4%、5%、6%)接入猕猴桃果汁,25 ℃恒温发酵7 d。
1.3.2.3 接种比例对猕猴桃酒的影响
在SO2质量浓度60 mg/L、初始糖度20 °Brix、接种量4%、非酿酒酵母提前24 h 接入的条件下,调整酿酒酵母∶非酿酒酵母接种比例分别为1∶1、1∶2、2∶1、1∶3、3∶1(体积比)接入猕猴桃果汁,25 ℃恒温发酵7 d。
1.3.2.4 初始糖度对猕猴桃酒的影响
在SO2质量浓度60 mg/L、接种量4%、非酿酒酵母提前24 h 接入、接种比例1∶1(体积比)的条件下,调整猕猴桃果汁糖度分别为18、20、22、24、26 °Brix,25 ℃恒温发酵7 d。
1.3.2.5 发酵温度对猕猴桃酒的影响
在SO2质量浓度60 mg/L、接种量4%、非酿酒酵母提前24 h接入、接种比例1∶1(体积比)、初始糖度26°Brix的条件下,调整发酵温度分别为 19、21、23、25、27 ℃发酵7 d。
1.3.2.6 发酵时间对猕猴桃酒的影响
在SO2质量浓度60 mg/L、接种量4%、非酿酒酵母提前24 h接入、接种比例1∶1(体积比)、初始糖度26 °Brix的条件下,调整发酵时间分别为7、9、11、13、15 d,25 ℃恒温发酵。
1.3.3 猕猴桃酒工艺优化正交试验
在单因素试验的基础上,挑选对猕猴桃酒影响较大的因素设计正交试验方案,进行综合研究分析,并确定最佳工艺条件组合。正交试验因素与水平见表1。
表1 正交试验因素与水平表
Table 1 Factors and levels of orthogonal test

水平A接种顺序B接种量/%C接种比例/SY∶H.vineaeD初始糖度/°Brix1H.vineae提前接种12 h3.51.5∶1242H.vineae提前接种24 h4 1∶1253H.vineae提前接种36 h4.5 1∶1.526
1.3.4 混菌发酵猕猴桃果酒抗氧化活性分析
以0.2% 维生素C溶液为阳性对照,测定混菌发酵工艺优化后的果酒、SY酿酒酵母发酵果酒、H.vineae非酿酒酵母发酵果酒、果汁的·OH、DPPH自由基、ABTS阳离子自由基清除能力和铁离子还原能力,探究抗氧化活性。
1.3.4.1 ·OH清除能力测定
采用羟自由基反应试剂盒测定。
1.3.4.2 DPPH自由基清除能力测定
参考吴均等[15]的测定方法,略作改动。以无水乙醇与0.2 mmol/L DPPH溶液各2 mL混合后的吸光度值为A0,然后取样品各0.02、0.04、0.06、0.08、0.10、0.12、0.16 mL于试管中,用纯水稀释至2 mL,加入0.2 mmol/L DPPH溶液2 mL,混匀避光30 min,于517 nm处测定吸光度值Ai;同时测定0.02、0.04、0.06、0.08、0.10、0.12、0.16 mL样品与无水乙醇各2 mL混合后的吸光度值Aj。DPPH自由基清除率计算公式如(1)所示:
DPPH自由基清除率![]()
(1)
1.3.4.3 ABTS阳离子自由基清除能力测定
参考秦晋颖等[16]的测定方法,略作改动。分别取0.02、0.04、0.06、0.08、0.10、0.12、0.16 mL的果酒于试管中,用纯水补充至2 mL,加入ABTS阳离子自由基工作液2 mL,摇匀,避光静置30 min,于734 nm处测定吸光度值Ai;以纯水替代样品为空白对照,测得吸光度值为A0。ABTS阳离子自由基清除率计算公式如公式(2)所示:
ABTS阳离子自由基清除率![]()
(2)
1.3.4.4 铁离子还原能力测定
参考BENZI等[17]的测定方法,略作改动。制备铁离子还原能力(ferric reducing ability of plasma,FRAP)工作液,于37 ℃恒温水浴锅中贮藏备用。分别取0.01、0.02、0.03、0.04、0.05、0.06、0.08 mL果酒于试管中,用纯水补充至2 mL,取稀释好的果酒6 μL,加入预热至37 ℃的FRAP工作液180 μL、超纯水18 μL,避光精确反应5 min,酶标仪测定593 nm吸光度,双蒸水为空白对照。以0.2~1.6 mmol/L处FeSO4溶液做标准曲线:y=0.370 4x+0.139 6(R2=0.999 3),根据标曲计算硫酸亚铁的浓度(mmol/L)。
1.4 检测方法
1.4.1 理化指标的测定
总酸、维生素C含量测定均参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》;总酚采用Folin-Ciocalte 比色方法测定[12];酒精度采用重铬酸钾氧化法测定[14];还原糖含量采用3,5-二硝酸水杨酸法测定[18];可溶性固形物含量采用手持糖度计测定。
1.4.2 感官评定
分别选择男女专家共8人组成品评组,感官评分参考葡萄酒与果酒评分标准。评分细则见表2。
表2 感官评分表
Table 2 Standard for sensory evaluation

项目评分标准得分/分外观(25分)色泽翠绿,澄清透明,有光泽20~25色泽浅绿带黄,较澄清透明,无明显悬浮物15~20色泽淡黄,有少量悬浮物或沉淀10~15色泽呈深黄或褐色或过浅,浑浊5~10香气(30分)酒香、果香浓郁,花香明显,香气柔协,具有愉悦感25~30酒香淡雅,具有较明显花果香20~25酒香较淡,果香不明显15~20酒香微弱,有杂味溢出,香气不协调5~15滋味(30分)酸味清爽可口,酒味柔顺,口感醇厚,回味悠长25~30酸味明显,回味较长,无其他异味20~25口感偏酸,有轻微苦味,口感较为不适15~20有明显苦味、酸味,有异味,口感不适5~15典型性(15分)各个条件协调,风格独特10~15较协调,风格不太明显6~10一般协调,风格不明显3~6不协调,无风格0~3
1.5 数据分析
使用Excel 2010整合试验数据,每组试验重复3次;使用SPSS 25.0软件进行统计分析,利用方差分析(analysis of variance,ANOVA)与Duncan检验进行差异显著性检验,P<0.05表示差异显著;使用Origin 2021软件作图。
2 结果与分析
2.1 混菌发酵猕猴桃果酒工艺优化
2.1.1 不同接种方式对猕猴桃酒发酵效果的影响
由表3可知,酿酒酵母提前48 h接入,果酒酒精度较高,与其他接种方式具有显著差异,此时酿酒酵母有足够的生长空间与营养,代谢活跃[19],但果酒口感寡淡,果香花香单薄;随着H.vineae接入时间的提前,酒精度呈现降低趋势,非酿酒酵母消耗营养物质,影响酒精生成[20];接种顺序对总酸、可溶性固形物影
表3 不同接种方式发酵猕猴桃果酒指标
Table 3 Indexes of fermented kiwi fruit wine with different inoculation methods

指标接种方式F1F2F3F4F5酒精度/%12.45±0.20a11.24±0.49b11.21±0.15b11.11±0.28b10.87±0.24b总酸/(g·L-1)18.25±0.23ab18.12±0.08b18.47±0.16a18.62±0.29a18.68±0.18a还原糖/(g·L-1)5.63±0.05b5.58±0.20b7.39±0.55a5.70±0.06b5.69±0.07b可溶性固形物/°Brix8.60±0.08ab8.63±0.05ab8.40±0.09b8.60±0.12ab8.80±0.08a总酚/(mg·L-1)724.04±6.98c674.79±10.09d824.19±15.82a777.37±16.94b805.89±16.54ab维生素C/(mg·L-1)252.15±0.84c267.95±1.33c463.10±3.37b535.90±0.50a478.77±1.92b感官评分60.00±1.25c70.00±0.82ab67.00±1.62b72.00±1.41a67.00±0.47b
注:F1-SY提前接种48 h;F2-SY提前接种24 h;F3-SY与H.vineae同时接种;F4-H.vineae提前接种24 h;F5-H.vineae提前接种48 h;同行不同小写字母表示显著性差异,P<0.05(下同)
响不大,对残糖有一定的影响;酿酒酵母的提前接入对果酒营养成分损害较为严重,而H.vineae 提前接入可以较好保存维生素C、多酚,将H.vineae提前24 h 接入,所得果酒口感醇厚,稍有回味,花果香明显,感官评分较高。
2.1.2 不同接种量对猕猴桃酒发酵效果的影响
果酒发酵过程中,酵母接种量影响酵母的发酵速率、呼吸产能。如表4所示,随着接种量的逐步增大,酒精度先增大后趋于平缓,总酸在接种量4%时最小;接种量对还原糖影响不显著,可溶性固形物稍有变化;总酚随着接种量增大而减小,可能是随着接种量增大,酵母代谢产物增多,有氧化酶作用于多酚[21];接种量4%时,维生素C含量最高,所酿果酒酒香舒适,酸味清爽,口感醇厚。
表4 不同接种量发酵猕猴桃果酒指标
Table 4 Indexes of fermented kiwi fruit wine with different inoculum amounts

指标接种量/%23456酒精度/%10.91±0.27b12.59±0.19a12.43±0.25a12.24±0.25a12.23±0.17a总酸/(g·L-1)18.62±0.3a17.58±0.49b16.33±0.26c16.69±0.39bc16.91±0.63bc还原糖/(g·L-1)5.70±0.06a5.80±0.10a5.89±0.12a5.77±0.08a5.85±0.13a可溶性固形物/°Brix8.60±0.12c9.10±0.05a9.00±0.05ab8.70±0.14c8.80±0.14bc总酚/(mg·L-1)777.37±16.94a650.38±10.74b676.60±11.53b650.50±14.50b647.91±4.77b维生素C/(mg·L-1)424.45±4.20b268.34±3.03d549.83±2.13a331.20±1.64cd406.68±0.52bc感官评分70.33±1.70b66.33±1.87b73.33±1.03a70.00±1.27b70.30±1.62b
2.1.3 不同初始糖度对猕猴桃酒发酵效果的影响
由表5可知,随着初始糖度的增大,酒精度、还原糖、可溶性固形物呈现出增大的趋势,符合猕猴桃果酒发酵特点[21-22];总酸与维生素C含量呈现先减小后增大的趋势,多酚则呈现出先增大后减小的趋势,初始糖度在26 °Brix时,果酒草木香明显、花香果香浓郁,入口醇厚,回味悠长,这可能是糖类物质为非酿酒酵母提供了充足的底物,生成的代谢产物酶类有助于香气的生成。由于过高的糖度会造成资源浪费,综合考虑,选用24、25、26 °Brix做正交优化试验。
表5 不同初始糖度发酵猕猴桃果酒指标
Table 5 Indexes of fermented kiwi fruit wine with different initial sugar content
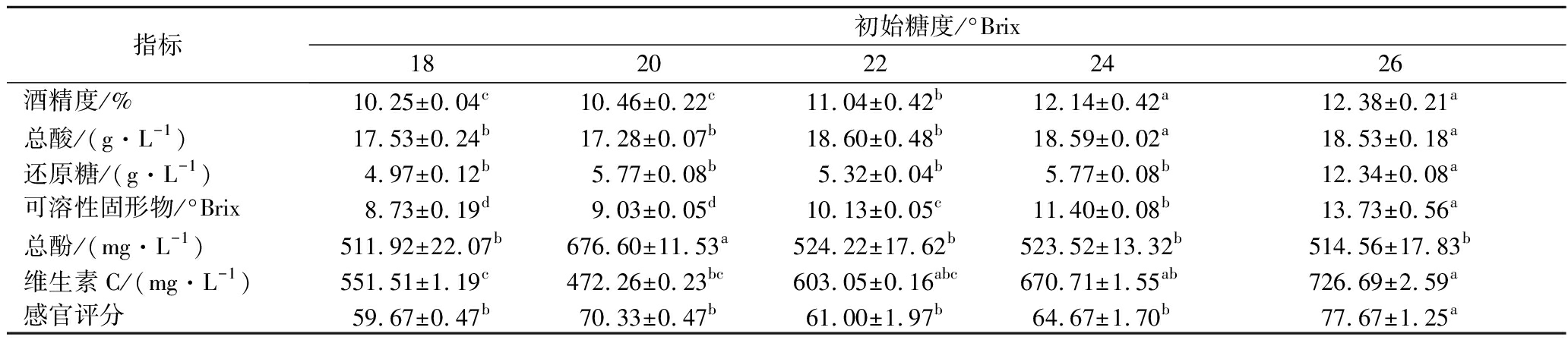
指标初始糖度/°Brix1820222426酒精度/%10.25±0.04c10.46±0.22c11.04±0.42b12.14±0.42a12.38±0.21a总酸/(g·L-1)17.53±0.24b17.28±0.07b18.60±0.48b18.59±0.02a18.53±0.18a还原糖/(g·L-1)4.97±0.12b5.77±0.08b5.32±0.04b5.77±0.08b12.34±0.08a可溶性固形物/°Brix8.73±0.19d9.03±0.05d10.13±0.05c11.40±0.08b13.73±0.56a总酚/(mg·L-1)511.92±22.07b676.60±11.53a524.22±17.62b523.52±13.32b514.56±17.83b维生素C/(mg·L-1)551.51±1.19c472.26±0.23bc603.05±0.16abc670.71±1.55ab726.69±2.59a感官评分59.67±0.47b70.33±0.47b61.00±1.97b64.67±1.70b77.67±1.25a
2.1.4 不同接种比例对猕猴桃酒发酵效果的影响
酿酒酵母与非酿酒酵母的接种比例是影响果酒风味品质的重要因素[23]。如表6 所示,不同接种比例(SY∶H.vineae)发酵果酒酒精度无显著差异;接种比例1∶1时总酸最小;还原糖与可溶性固形物随着H.vineae接入比例的增大而增大,随SY接入比例的增大而减小,呈现出显著差异;多酚含量变化较为平缓,在接种比例1∶3时最高;维生素C含量在H.vineae比例上升时呈现出增大趋势。
表6 不同接种比例发酵猕猴桃果酒指标
Table 6 Indexes of fermented kiwi fruit wine with different inoculation ratios
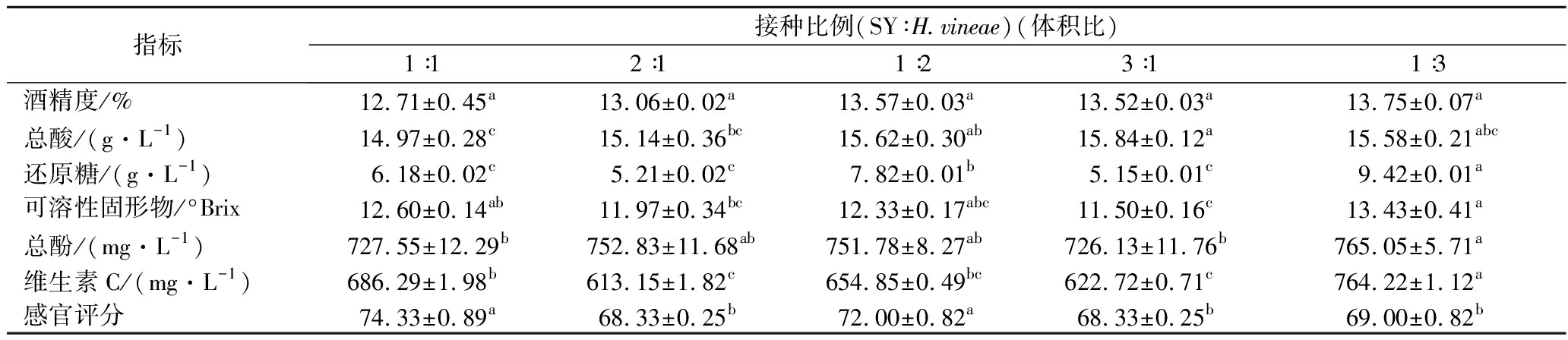
指标接种比例(SY∶H.vineae)(体积比)1∶12∶1 1∶2 3∶1 1∶3酒精度/%12.71±0.45a13.06±0.02a13.57±0.03a13.52±0.03a13.75±0.07a总酸/(g·L-1)14.97±0.28c15.14±0.36bc15.62±0.30ab15.84±0.12a15.58±0.21abc还原糖/(g·L-1)6.18±0.02c5.21±0.02c7.82±0.01b5.15±0.01c9.42±0.01a可溶性固形物/°Brix12.60±0.14ab11.97±0.34bc12.33±0.17abc11.50±0.16c13.43±0.41a总酚/(mg·L-1)727.55±12.29b752.83±11.68ab751.78±8.27ab726.13±11.76b765.05±5.71a维生素C/(mg·L-1)686.29±1.98b613.15±1.82c654.85±0.49bc622.72±0.71c764.22±1.12a感官评分74.33±0.89a68.33±0.25b72.00±0.82a68.33±0.25b69.00±0.82b
尽管H.vineae比例较大时有利于营养成分保存,但非酿酒酵母占比过高导致果酒酒香变弱,并有杂味溢出。在接种比例1∶1时,果酒感官评分最高,酸度适中,这与总酸含量一致,酒香中掺杂独特果香,舒适度较高。
2.1.5 不同发酵温度对猕猴桃酒发酵效果的影响
微生物拥有自身适合的生存温度,温度影响其生长和代谢产物的合成,从而影响果酒的感官品质。从表7可以看出,随发酵温度升高,酒精度逐渐降低,还原糖与可溶性固形物逐渐减小,且差异显著,按照发酵规律,酒精度降低可溶性固形物应该升高,与本研究呈现出的结果不符,可能因为酿酒酵母与非酿酒酵母相互作用导致的结果,这有待进一步探究;发酵温度对总酸、多酚含量的影响不大;维生素C含量随着温度升高而降低。25 ℃发酵果酒酒体丰厚,果香浓郁,感官舒适,本研究选用25 ℃作为最适发酵温度。
表7 不同发酵温度发酵猕猴桃果酒指标
Table 7 Indexes of fermented kiwi fruit wine at different fermentation temperatures

指标发酵温度/℃1921232527酒精度/%13.67±0.93a11.49±0.72b11.37±0.15b11.66±0.15b10.45±0.68b总酸/(g·L-1)15.50±0.47a15.33±0.54a15.47±0.15a15.86±0.63a15.94±0.16a还原糖/(g·L-1)23.77±0.05a14.62±0.06b11.92±0.06b6.99±0.03c6.59±0.01c可溶性固形物/°Brix13.90±0.08a12.17±0.42b11.90±0.16b11.17±0.24c10.03±0.25d总酚/(mg·L-1)890.37±8.87a885.58±43.63a895.45±12.51a879.58±10.07a891.33±4.13a维生素C/(mg·L-1)712.27±1.37a718.43±0.58a694.75±0.45ab675.67±0.40bc663.65±0.55c感官评分68.67±2.62b69.67±0.94b73.67±0.47a76.67±1.25a57.33±1.89c
2.1.6 不同发酵时间对猕猴桃酒发酵效果的影响
如表8所示,随着发酵时间的延长酒精度先升高后降低,第9天为峰值,总酸则呈现出逐渐增大的趋势,这可能与葡萄园有孢汉逊酵母高产乙酸的特性有关[24];发酵时间越长,还原糖增加,可溶性固形物越低;总酚含量先升高后降低;发酵时间越长维生素C损失越严重;第9天时发酵所得果酒酒香浓郁,具有优雅的花香,口感醇厚,回味悠长,感官评分80.67分,综合考虑,将9 d选为最适发酵时间。
表8 不同发酵时间发酵猕猴桃果酒指标
Table 8 Indexes of fermented kiwi fruit wine with different fermentation time
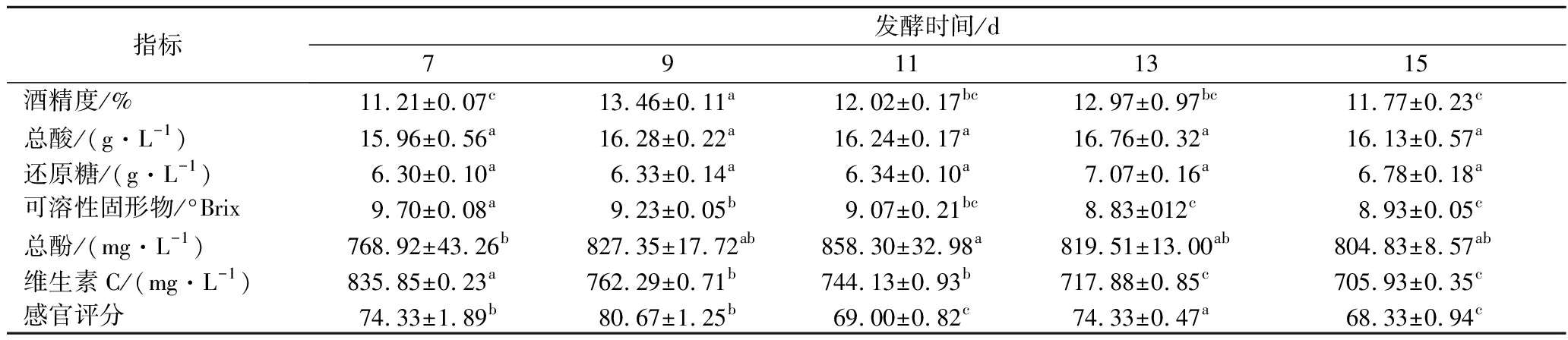
指标发酵时间/d79111315酒精度/%11.21±0.07c13.46±0.11a12.02±0.17bc12.97±0.97bc11.77±0.23c总酸/(g·L-1)15.96±0.56a16.28±0.22a16.24±0.17a16.76±0.32a16.13±0.57a还原糖/(g·L-1)6.30±0.10a6.33±0.14a6.34±0.10a7.07±0.16a6.78±0.18a可溶性固形物/°Brix9.70±0.08a9.23±0.05b9.07±0.21bc8.83±012c8.93±0.05c总酚/(mg·L-1)768.92±43.26b827.35±17.72ab858.30±32.98a819.51±13.00ab804.83±8.57ab维生素C/(mg·L-1)835.85±0.23a762.29±0.71b744.13±0.93b717.88±0.85c705.93±0.35c感官评分74.33±1.89b80.67±1.25b69.00±0.82c74.33±0.47a68.33±0.94c
2.2 混菌发酵猕猴桃果酒工艺优化正交试验与结果分析
正交试验选用维生素C含量、感官评分及酒精度作为综合评价指标。如表9所示,当以维生素C含量做评价指标时,各因素对猕猴桃果酒维生素C含量的影响次序为接种顺序>初始糖度>接种量>接种比例,表明接种顺序对维生素C含量影响最大,最优发酵工艺参数为A3B1C3D1;当以感官评分做评价指标时,各因素影响次序为接种量>接种比例>接种时间>初始糖度,最优发酵工艺为A3B2C3D2;当以酒精度为评价指标时,各因素的影响次序为初始糖度>接种量>接种顺序>接种比例,最优发酵工艺为A3B1C2D1或A3B1C2D2。综合评价,接种量对果酒影响较大,因此选择A3B2C3D2与A3B1C3D1分别做验证试验。A3B2C3D2,即H.vineae提前36 h接种,接种量4%,接种比例1∶1.5,初始糖度25 °Brix,25 ℃发酵9 d,此条件下发酵猕猴桃果酒酒精度13.83%、维生素C含量726.15 mg/L、感官分值83.34;A3B1C3D1,即H.vineae提前36 h接种,接种量3.5%,接种比例1∶1.5,初始糖度24 °Brix,25 ℃发酵9 d,此条件下发酵猕猴桃果酒酒精度12.71%、维生素C质量浓度668.94 mg/L、感官分值81.67。综上,选择A3B2C3D2为最适发酵工艺,在此条件下发酵果酒酒液澄清透亮,无悬浮沉淀,酒香浓郁,花香果香舒适,酒体丰厚但口感稍酸,回味悠长。
表9 混菌发酵猕猴桃果酒工艺优化正交试验结果与分析
Table 9 Orthogonal test results and analysis of kiwi fruit wine fermentation process optimization by mixed bacteria

试验号ABCD维生素C/(mg·L-1)感官评分酒精度/%11111680.7582.0013.2921222638.5581.6713.4631333605.2671.0013.1742123673.6073.3313.6352231725.7583.0013.0462312654.5170.3313.3373132747.6084.6713.8083213726.8483.0013.3293321743.9268.6713.05维生素C含量k1641.52700.65687.37716.81k2684.62697.05685.36680.22k3739.45667.90692.87668.57R97.9332.757.5148.24感官评分k178.2280.0078.4477.89k275.5682.5674.5678.89k378.7870.0079.5675.78R3.2212.565.003.11酒精度k113.3113.5713.3113.13 k213.3313.2713.3813.53 k313.3913.1813.3413.53 R0.080.390.060.41
2.3 混菌发酵果酒与单菌发酵果酒抗氧化能力比较分析
2.3.1 SY单菌、H.vineae单菌、混菌发酵果酒及果汁中总酚含量比较
如图1所示,SY单菌、H.vineae单菌、混菌发酵果酒与果汁的总酚质量浓度分别为752.35、804.44、823.18、1 025.56 mg/L,安琪果酒酵母发酵的猕猴桃果酒多酚含量最低,与混菌发酵果酒和果汁比较具有显著差异,而果酒酿造对多酚损失具有一定的作用,多酚含量显著降低,这可能与酿造温度和微生物代谢有关,本试验选用发酵温度25 ℃和4%接种量,高温和过高的接种量可能不利于多酚的保存。
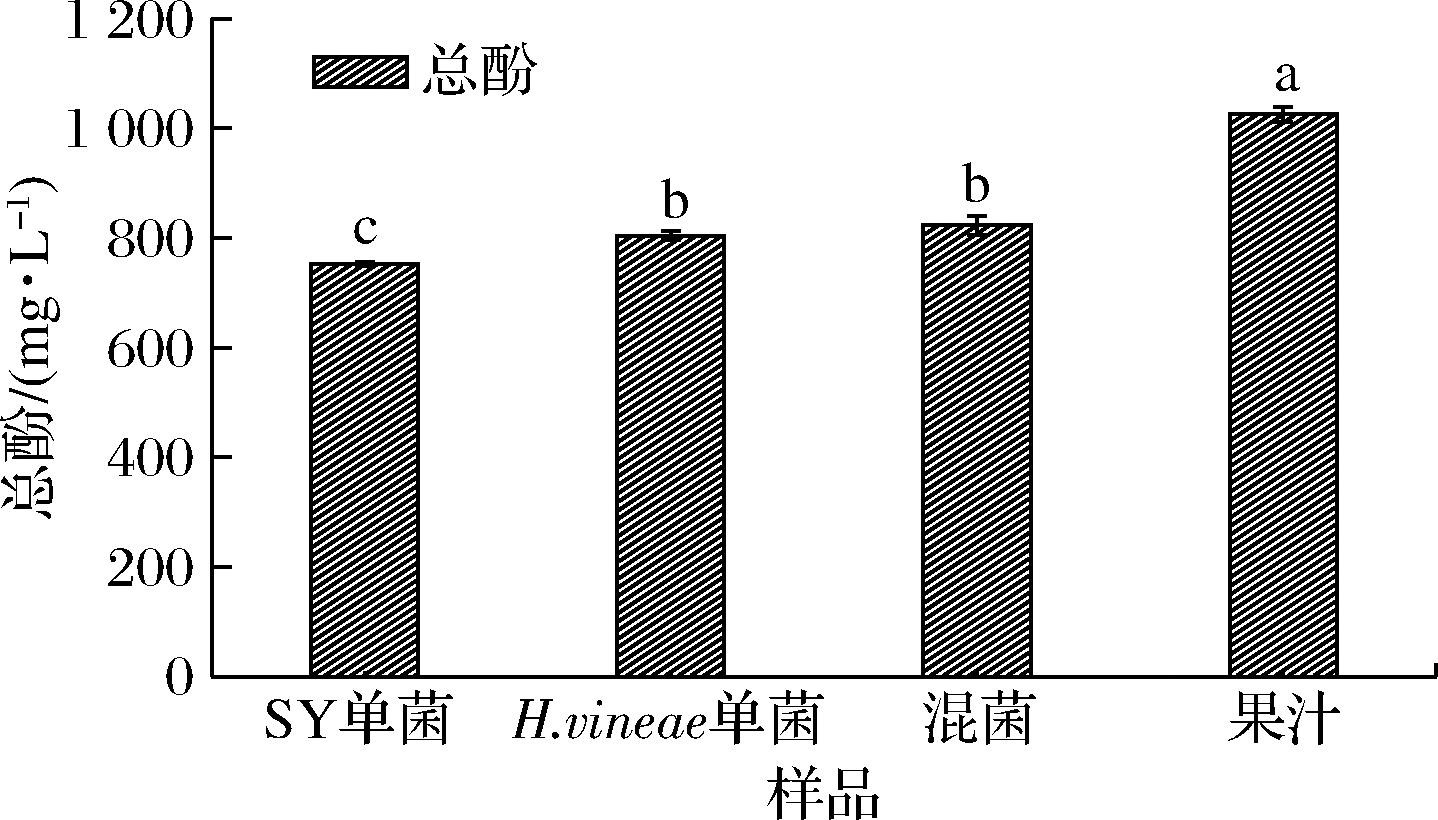
图1 总酚含量
Fig.1 Total phenol content
2.3.2 ·OH清除能力比较
如图2所示,混菌发酵、SY单菌、H.vineae单菌发酵果酒、果汁及维生素C溶液的·OH清除率随着样品用量增大呈现出增大的趋势。当样品量在0.02~0.06 mL时,果汁、混菌、SY单菌的·OH清除率快速上升,而后缓慢增长,在样品用量0.06 mL时,清除率分别为91.16%、92.32%和91.51%,此时自由基清除效果较好。H.vineae单菌发酵果酒整体清除能力较弱,维生素C溶液对·OH清能力均优于4种样品,·OH清除率大小依次为混菌、SY单菌、果汁、H.vineae单菌。

图2 ·OH清除能力比较
Fig.2 Comparison of scavenging ability of ·OH
2.3.3 DPPH自由基清除能力比较
由图3可知,DPPH自由基清除效果随着4种样品及维生素C溶液用量的增大呈现出增强的趋势。用量0.04 mL时,混菌发酵果酒、H.vineae单菌发酵果酒、果汁和维生素C的自由基清除水平已较高,清除率分别为93.58%、94.71%、94.73%和94.66%,随着体积继续增大,DPPH自由基的清除率缓慢上升。而SY单菌发酵果酒到0.04 mL时才达到79.72%,再增大用量才能具有较高的DPPH自由基的清除能力。维生素C溶液DPPH自由基的清除能力优于4种样品。综合整体趋势,4种样品对DPPH自由基清除效果最好的是混菌发酵果酒,而后是果汁、H.vineae单菌,SY单菌发酵果酒最次,这与多酚呈现出了相同的趋势,在王冬伟等[12]的研究中表明,自由基清除率与酚类物质具有一定的关联。
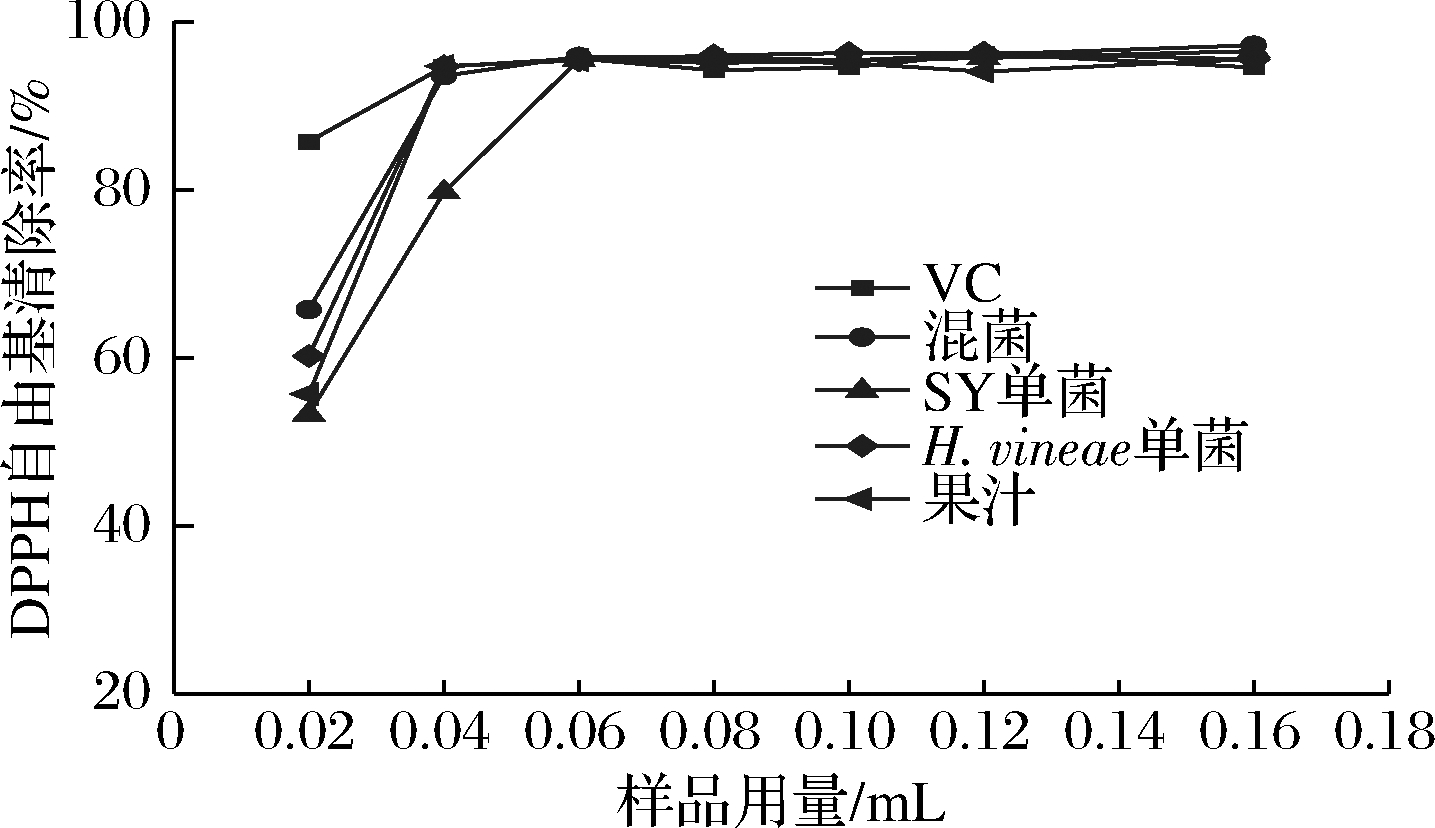
图3 DPPH自由基清除能力比较
Fig.3 Comparison of scavenging ability of DPPH free radical
2.3.4 ABTS阳离子自由基清除能力比较
由图4可知,随样品用量的增加,4种样品及维生素C的ABTS阳离子自由基清除率随之增大。在用量为0.04 mL时,果汁和维生素C溶液对应的自由基清除率分别为94.50%、93.87%,达到较高的自由基清除效果,此时混菌发酵、SY单菌、H.vineae单菌发酵果酒分别为87.15%、83.02%、69.72%,而后随着样品量增大清除能力均达到90%以上。混菌发酵果酒整体ABTS阳离子自由基清除能力优于单菌发酵果酒。
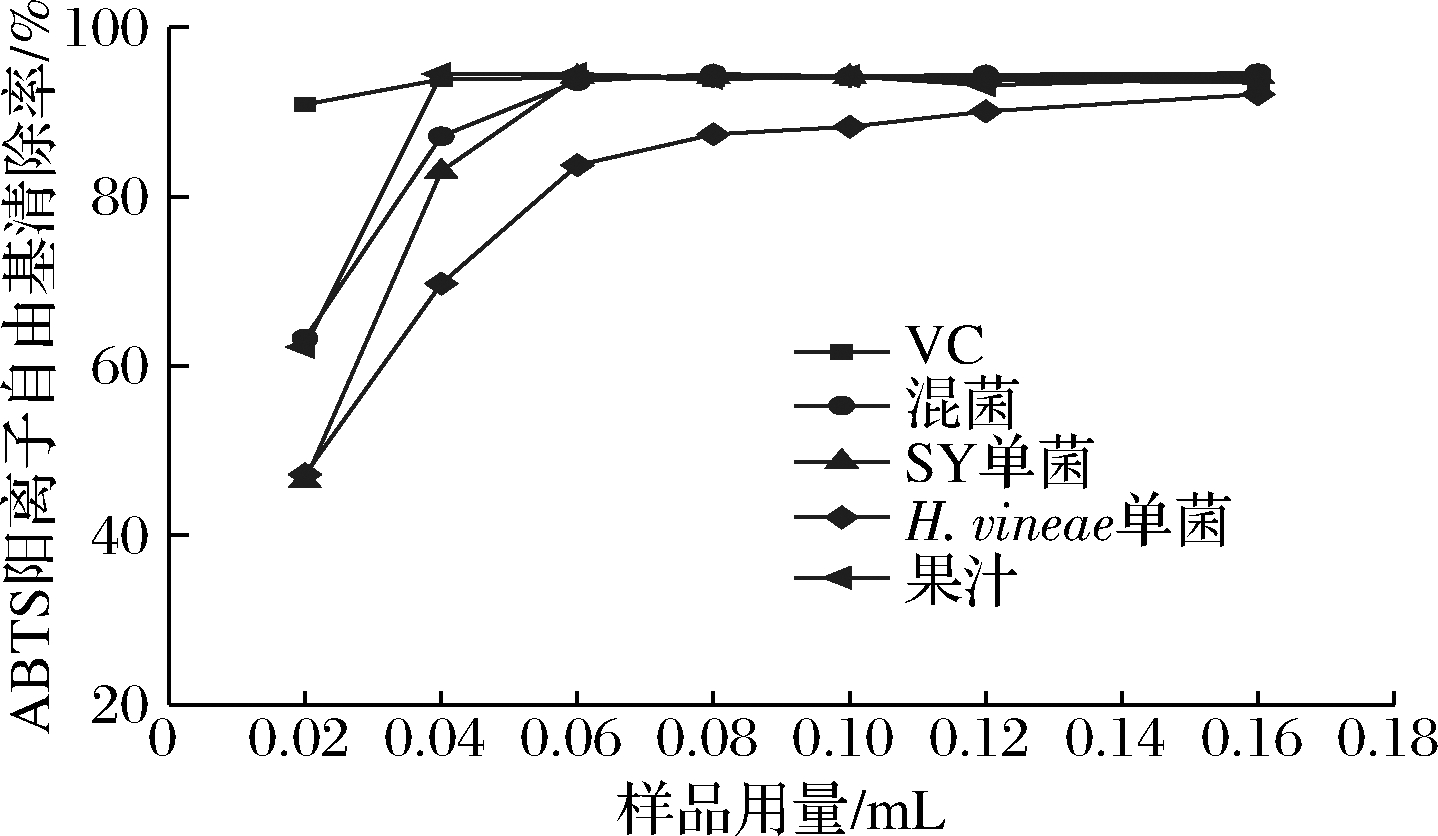
图4 ABTS阳离子清除能力比较
Fig.4 Comparison of scavenging ability of ABTS cationic radical
2.3.5 铁离子还原能力比较
如图5所示,4种样品及维生素C的铁离子还原能力随样品用量的增加而增大。在4种样品及维生素C用量为0.01 mL时,混菌、SY单菌、H.vineae单菌、果汁及维生素C的铁离子还原能力为27.97、28.54、40.19、38.03及48.91 mmol Fe2+/L,而后随着样品用量的增大均快速增大,在样品用量0.08 mL时分别达到123.65、104.04、120.47、126.10、116.87 mmol Fe2+/L。综合整体趋势,果汁的铁离子还原能力优于果酒,H.vineae单菌发酵果酒铁离子还原能力较强,混菌发酵果酒优于SY单菌发酵果酒。

图5 铁离子还原能力分析
Fig.5 Ferric reducing ability of plasma
3 结论
本研究运用单因素试验与正交设计分析得出了葡萄园有孢汉逊酵母与安琪果酒酵母混合发酵猕猴桃果酒的最优工艺参数:H.vineae提前36 h接种;接种量4%;酿酒酵母与非酿酒酵母接种比例1∶1.5(体积比);初始糖度25°Brix;发酵温度25 ℃;发酵时间9 d,此条件下得到的酒香浓郁、伴随花果香、入口稍酸但口感醇厚、回味悠长的猕猴挑果酒,感官评分83.34分,酒精含量13.84%。同时对果汁、混菌、SY 单菌、H.vineae单菌发酵果酒的体外抗氧化能力通过4个抗氧化体系(·OH、DPPH自由基、ABTS阳离子自由基、FRAP)进行了探究,结果表明自由基清除能力与铁离子还原能力均随样品用量增大而增大,混菌发酵果酒抗氧化活性优于单菌发酵果酒。总体而言,混菌发酵果酒不仅可以改善果酒品质,而且抗氧化能力较单菌发酵果酒更优,整体功能性有所提升。该研究为非酿酒酵母应用于猕猴桃果酒、提升猕猴桃果酒品质提供参考,葡萄园有孢汉逊酵母与安琪果酒酵母混合发酵对猕猴桃果酒风味物质的影响尚待进一步探究。
[1] 戢小梅,翟敬华,陈志伟,等.猕猴桃的营养成分与保健功能[J].湖北农业科学,2020,59 (1):386-388;420.
JI X M,ZHAI J H,CHEN Z W,et al.The nutritional components and health function of kiwifruit[J].Hubei Agricultural Sciences,2020,59(1):386-388;420.
[2] 刘晓翠,王丽,黎星辰,等.响应面优化猕猴桃酒混合发酵工艺[J].食品工业科技,2019,40(18):65-71;77.
LIU X C,WANG L,LI X C,et al.Optimization of mixed fermentation technology of kiwi wine by response surface methodology[J].Science and Technology of Food Industry,2019,40(18):65-71;77.
[3] VAN WYK N,GROSSMANN M,WENDLAND J,et al.The whiff of wine yeast innovation:Strategies for enhancing aroma production by yeast during wine fermentation[J].Journal of Agricultural and Food Chemistry,2019,67(49):13 496-13 505.
[4] GIORELLO F,VALERA M J,MARTIN V,et al.Genomic and phenomic analysis of Hanseniaspora vineae provides insights for understanding yeast fermentation flavours that contribute to wine quality[J].Applied and Environmental Microbiology,2018,85(1).DOI:10.1128/AEM.01 959-18.
[5] YAN G L,ZHANG B Q,JOSEPH L,et al.Effects of initial oxygenation on chemical and aromatic composition of wine in mixed starters of Hanseniaspora vineae and Saccharomyces cerevisiae[J].Food Microbiology,2020,90:103460.
[6] WEI J P,ZHANG Y X,WANG Y W,et al.Assessment of chemical composition and sensorial properties of ciders fermented with different non-Saccharomyces yeasts in pure and mixed fermentations[J].International Journal of Food Microbiology,2020,318:108471.
[7] MEDINA K,BOIDO E,FARI A L,et al.Increased flavour diversity of Chardonnay wines by spontaneous fermentation and co-fermentation with Hanseniaspora vineae[J].Food Chemistry,2013,141(3):2 513-2 521.
A L,et al.Increased flavour diversity of Chardonnay wines by spontaneous fermentation and co-fermentation with Hanseniaspora vineae[J].Food Chemistry,2013,141(3):2 513-2 521.
[8] MARTIN V,FARINA L,MEDINA K,et al.Oenological attributes of the yeast Hanseniaspora vineae and its application for white and red winemaking[J].BIO Web of Conferences,2019,12:02010.
[9] ZHANG B Q,SHEN J Y,DUAN C Q,et al.Use of indigenous Hanseniaspora vineae and Metschnikowia pulcherrima Co-fermentation with Saccharomyces cerevisiae to improve the aroma diversity of vidal Blanc icewine[J].Frontiers in Microbiology,2018,9:2 303.
[10] 韦婷,何靖柳,杨冬雪,等.一种猕猴桃果酒专用酵母的高效筛选方法[J].中国酿造,2020,39(5):115-119.
WEI T,HE J L,YANG D X,et al.High-efficiency screening method of special yeast for kiwi fruit wine[J].China Brewing,2020,39(5):115-119.
[11] L PEZ-V
PEZ-V ZQUEZ C,GARC
ZQUEZ C,GARC A-LLOBODANIN L,PÉREZ-CORREA J R,et al.Aromatic characterization of pot distilled kiwi spirits[J].Journal of Agricultural and Food Chemistry,2012,60(9):2 242-2 247.
A-LLOBODANIN L,PÉREZ-CORREA J R,et al.Aromatic characterization of pot distilled kiwi spirits[J].Journal of Agricultural and Food Chemistry,2012,60(9):2 242-2 247.
[12] 王东伟,黄燕芬,肖默艳,等.猕猴桃果酒发酵条件优化及其抗氧化特性研究[J].食品安全质量检测学报,2019,10(6):1 619-1 625.
WANG D W,HUANG Y F,XIAO M Y,et al.Optimization of fermentation conditions and research on the antioxidant properties of kiwi fruit wine[J].Journal of Food Safety & Quality,2019,10(6):1 619-1 625.
[13] LIU J,LIU M,YE P,et al.Characterization of major properties and aroma profile of kiwi wine co-cultured by Saccharomyces yeast (S.cerevisiae,S.bayanus,S.uvarum) and T.delbrueckiin[J].European Food Research and Technology,2020,246(4):807-820.
[14] 尹雪林,龚丽娟,钟武,等.戴尔有孢圆酵母与酿酒酵母混合发酵对猕猴桃酒香气的影响[J/OL].食品科学,2021.http://kns.cnki.net/kcms/detail/11.2206.ts.20201120.1500.069.html.
YIN X L,GONG L J,ZHONG W,et al.Effect of mixed fermentation of Saccharomyces cerevisiae and Torulaspora delbrueckii on thearoma of kiwifruit wine[J/OL].Food Science,2021.http://kns.cnki.net/kcms/detail/11.2206.ts.20201120.1500.069.html.
[15] 吴均,黄传书,赵珮,等.响应面试验优化桑葚果酒发酵工艺及其品质分析[J].中国酿造,2021,40(1):98-104.
WU J,HUANG C H,ZHAO P,et al.Optimization of fermentation technology of mulberry wine by response surface methodology and quality analysis[J].China Brewing,2021,40(1):98-104.
[16] 秦晋颖,谢晓林,朱燕,等.红心猕猴桃果酒抗氧化及抑制人肝癌HepG2细胞增殖活性研究[J].酿酒科技,2020(11):36-39.
QIN J Y,XIE X L,ZHU Y,et al.Antioxidant and anti-proliferation activity of HepG2 cells by kiwifruit wine extract[J].Liquor-making Science & Technology,2020(11):36-39.
[17] BENZIE I F F,STRAIN J J.The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”:The FRAP assay[J].Analytical Biochemistry,1996,239(1):70-76.
[18] 王靖,李智敏,谢纯良,等.毕赤酵母发酵不同单糖产乙醇的研究[J].湖北农业科学,2016,55(3):716-719.
WANG J,LI Z M,XIE C L,et al.Study on Scheffersomyces stipites fermentation of different monosaccharide to produce ethanol[J].Hubei Agricultural Sciences,2016,55(3):716-719.
[19] NISSEN P,NIELSEN D,ARNEBORG N.Viable Saccharomyces cerevisiae cells at high concentrations cause early growth arrest of non-Saccharomyces yeasts in mixed cultures by a cell-cell contact-mediated mechanism[J].Yeast,2003,20(4):331-341.
[20] 袁晓龙,边名鸿,刘茗铭,等.酿酒酵母与产香酵母混合发酵鸭梨酒工艺条件优化[J].食品与发酵工业,2020,46(6):184-190.
YUAN X L,BIAN M H,LIU M M,et al.Optimization of fermentation conditions of Yali wine with Saccharomyces cerevisiae co-inoculated with aroma-producing yeast[J].Food and Fermentation Industries,2020,46(6):184-190.
[21] 张晶,左勇,谢光杰,等.发酵条件对猕猴桃果酒中多酚含量的影响[J].食品工业科技,2017,38(9):160-163;167.
ZHANG J,ZUO Y,XIE G J,et al.Influence of fermentation conditions on the yield of polyphenols in kiwi fruit wine[J].Science and Technology of Food Industry,2017,38(9):160-163;167.
[22] 唐雪,曹宁,周景瑞.贵长猕猴桃酒酿造工艺研究[J].酿酒科技,2017(12):50-54.
TANG X,CAO N,ZHOU J R.Production of Guichang kiwifruit wine[J].Liquor-Making Science & Technology,2017(12):50-54.
[23] LEE P R,KHO S H C,YU B,et al.Yeast ratio is a critical factor for sequential fermentation of papaya wine by Williopsis saturnus and Saccharomyces cerevisiae[J].Microbial Biotechnology,2013,6(4):385-393.
[23] LEE P R,KHO S H C,YU B,et al.Yeast ratio is a critical factor for sequential fermentation of papaya wine by Williopsis saturnus and Saccharomyces cerevisiae[J].Microbial Biotechnology,2013,6(4):385-393.
[24] VALERA M J,BOIDO E,DELLACASSA E,et al.Comparison of the glycolytic and alcoholic fermentation pathways of Hanseniaspora vineae with Saccharomyces cerevisiae wine yeasts[J].Fermentation,2020,6(3):78.