风味是评价干酪品质最重要的指标之一[1]。辅助发酵剂是一类可以提高干酪风味或加快干酪成熟的微生物制剂[2],对于改善干酪的风味具有重要意义[3]。目前常见的辅助发酵剂多为非发酵剂乳酸菌[4]。某些酵母菌可以作为辅助发酵剂对成熟过程中干酪的风味形成产生积极影响[5-7],如乳酸克鲁维酵母(Kluyveromyces lactis)、发酵毕赤酵母(Pichia fermentans)、汉逊德巴利酵母(Debaryomyces hansenii)等。
酿酒酵母(Saccharomyces cerevisiae)是蓝纹干酪、卡门贝尔干酪等干酪中较为常见的酵母菌[8]。HANSEN等[9]将酿酒酵母FB7用于蓝纹干酪中,发现酿酒酵母FB7能够促进青霉菌的生长、加速成熟过程中蛋白质的分解、改善干酪的风味。SØRENSEN等[10]在干酪模型中添加酿酒酵母D7能够显著增加干酪中酯类化合物的含量。
切达干酪是世界上销量最大的干酪品种之一,成熟期长,是研究外源物质对干酪成熟过程中风味影响的最佳模型之一[11]。在前期研究中,我们采用单因素和正交实验,以感官评价和干酪产量为主要评定指标,优化了添加酿酒酵母的切达干酪的加工工艺。在此基础上,本研究选定了3种加工工艺制作添加酿酒酵母的切达干酪,并通过顶空固相微萃取和气相色谱-质谱联用技术确定产品中挥发性风味化合物的组成,通过感官评价方法评定消费者对产品的接受度,通过聚类分析探究干酪的挥发性风味化合物与成熟期之间的关系,为新型风味干酪的开发提供技术支持。
1 材料与方法
1.1 材料与试剂
蛋白质含量为2.97%~3.05%,脂肪含量为3.71%~3.94%,抗生素检测为阴性的新鲜牛乳,蒙牛乳业(北京)有限责任公司;蔗糖,广州福正东海食品有限公司;活性干酿酒酵母,安琪酵母股份有限公司;CHY-MAX powder Extra NB凝乳酶、R-704直投式干酪发酵剂,科汉森(中国)有限公司。
CaCl2、NaCl等均为分析纯,北京化工厂。
1.2 仪器与设备
DK-8B水浴锅,中国精宏实验设备有限公司;干酪槽和干酪压榨器,实验室自制;DSHZ-300A水浴恒温振荡器,苏州培英实验设备有限公司;ME204分析天平,梅特勒-托利多国际贸易(上海)有限公司;CJ78-1磁力搅拌器,常州市金坛大地自动化仪器厂;PHB-4精密酸度计,上海仪电科学仪器有限公司;7890A-5975C气相色谱-质谱联机,美国Agilent公司。
1.3 实验方法
1.3.1 干酪制作工艺
添加蔗糖的原料乳于90 ℃加热灭菌15 min,然后冷却至23 ℃,接种0.2 g/L酿酒酵母发酵72 h。酒精发酵结束后升温至32 ℃,接种干酪发酵剂发酵30 min,加入CaCl2和凝乳酶进行凝乳,到达凝乳终点后用干酪刀切割凝块排出乳清,以5 min/℃的速度匀速升温至39 ℃并进行堆叠。当pH下降至5.5时将凝块进行盐渍、压榨,压榨压力为120 kg,时间为12 h,真空包装,并在4 ℃下成熟90 d,分别于第1、30、60、90天取样分析。
KY组(正交实验中以感官评分为指标优化得到的理论最优干酪):蔗糖添加量50 g/L,干酪发酵剂添加量0.02 g/L,凝乳酶添加量0.1 g/L;KH组(正交实验中感官评分最高的干酪):蔗糖添加量50 g/L,干酪发酵剂添加量0.02 g/L,凝乳酶添加量0.2 g/L;KC组(正交实验中产量最高的干酪):蔗糖添加量40 g/L,干酪发酵剂添加量0.02 g/L,凝乳酶添加量0.1 g/L。
1.3.2 顶空固相微萃取和气相色谱-质谱联用技术
称取5 g切碎的干酪样品于20 mL顶空玻璃瓶中,密封并在50 ℃平衡10 min。插入顶空微萃取针吸附40 min,将吸附后萃取头插入气质联用仪进样口,250 ℃下解吸5 min。色谱条件:DB-WAX毛细管柱(30.0 m×250 μm×0.25 μm),起始温度35 ℃保持2 min,3 ℃/min升温至150 ℃,再以10 ℃/min升温至230 ℃保持5 min,载气为He,流速为1.2 mL/min。质谱条件:电离方式为电子电离(electronic ionization,EI),电子能量70 eV,扫描范围为12~550 amu,离子源温度为230 ℃,四极杆温度为150 ℃,界面温度为280 ℃。
1.3.3 感官评价
参照BIAGIOTTI等[12]的方法。由10名来自北京农学院食品科学与工程学院具有干酪品尝经验的品鉴员(5男5女,年龄20~35岁)对成熟1和90 d的干酪样品进行感官评价,从外观(25分)、口感(25分)、气味(25分)、滋味(25分)4个方面进行打分,总分100分,以10人平均分作为干酪感官得分的最终值。
1.4 数据分析
所有样品均重复测定3次。方差分析借助SPSS 23.0完成;图表借助Origin 2018完成;热图借助Heml完成。
2 结果与分析
2.1 挥发性风味化合物
表1~表3分别是KY、KH、KC三组干酪成熟1、30、60、90 d挥发性风味化合物的变化。3组干酪成熟过程中挥发性风味化合物的种类和含量发生显著性变化(P<0.05)。随着干酪成熟时间的延长,3组干酪的挥发性风味化合物的种类都呈现增加趋势:KY、KH、KC三组干酪在成熟1 d分别检测到挥发性风味化合物13、13、14种,在成熟90 d分别检测到挥发性风味化合物19、21、23种。3组干酪成熟过程中,KY、KH两组挥发性风味化合物的含量基本呈现增加趋势(P<0.05),而KC组则基本呈现降低趋势(P<0.05)。在同一成熟时间,3组干酪中挥发性风味化合物的种类和含量存在显著性差异(P<0.05)。在3组干酪中都含有且含量较高的挥发性风味化合物包括乙醇、异戊醇、苯乙醇、己酸乙酯、辛酸乙酯、癸酸乙酯、乙基9-癸烯酸酯、苯乙烯等。3组干酪中不同种类风味物质的分布有一定的相似性,含量最高的是醇类和酯类。KY、KH两组挥发性风味化合物的种类和含量与KC组差异显著(P<0.05),挥发性风味化合物的含量显著高于KC组(P<0.05)。
醇类化合物主要通过乳糖代谢、氨基酸代谢等生化反应生成[13]。与传统工艺制作的干酪不同,3组干酪的加工过程中添加了酿酒酵母,因此酿酒酵母的无氧代谢也是醇类化合物的重要生成途径。3组干酪在所有成熟期内均检测到乙醇、异戊醇和苯乙醇,其中乙醇与酒的气味有关;异戊醇被认为是干酪的主要香气之一,提供了一种甜味,与水果味和果渣味有关[14];苯乙醇是苯丙氨酸在酵母菌的代谢作用下形成的,与玫瑰香气有关[15]。随着干酪成熟时间的延长,KY、KH两组中乙醇、异戊醇和苯乙醇含量显著增加(P<0.05);KC组中乙醇和苯乙醇含量显著降低(P<0.05),异戊醇则呈现先增加后降低的趋势。3组干酪的加工工艺显示KY、KH两组中蔗糖添加量高于KC组,导致前两者中酿酒酵母的数量高于KC组(结果未显示),可能是成熟90 d时KY、KH两组中醇类化合物含量显著高于KC组的主要原因。
表1 KY组干酪成熟过程中挥发性风味化合物的变化(峰面积×106)
Table 1 Changes in volatile flavor substances of KY during ripening (peak area×106)

风味成分CAS成熟时间/d1306090醇类乙醇64-17-55.84±1.02a10.45±1.48a58.48±4.61b203.34±12.62c异戊醇123-51-35.27±0.40a8.01±0.70b12.10±0.97c29.64±2.55d正辛醇111-87-5--0.25±0.01苯乙醇60-12-86.69±0.61a7.25±0.42a7.80±0.74a11.83±1.24b酸类己酸142-62-1--1.05±0.05-辛酸124-07-2--0.77±0.07a1.16±0.10b正壬酸112-05-0--0.22±0.03-正癸酸334-48-5--0.20±0.04-棕榈酸57-10-3---1.66±0.06酮类2-壬酮821-55-60.66±0.06a0.99±0.09b0.78±0.05a1.22±0.09c2-十一烷酮112-12-9--0.44±0.06-2-十三烷酮593-08-8--0.17±0.01-酯类乙酸异戊酯123-92-21.03±0.09a1.19±0.10ab1.41±0.13b3.87±0.19c丁酸乙酯105-54-4---3.47±0.21己酸乙酯123-66-03.37±0.34a5.18±0.42b5.33±0.62b10.63±1.03c庚酸乙酯106-30-90.26±0.01a0.50±0.02c0.39±0.04b0.75±0.06d辛酸甲酯111-11-5--0.20±0.03a0.51±0.02b辛酸乙酯106-32-137.77±2.01a43.31±1.86ab46.57±3.71b61.07±4.54c壬酸乙酯123-29-50.25±0.01a0.25±0.01a0.35±0.03b-癸酸乙酯110-38-38.48±0.59a10.27±1.27ab12.97±2.24bc15.20±2.11c乙基9-癸烯酸酯67 233-91-41.25±0.11a1.59±0.11a2.05±0.26b2.58±0.32c月桂酸乙酯106-33-20.58±0.05a0.74±0.06a1.05±0.01b1.39±0.24c月桂酸异戊酯6 309-51-9--0.18±0.01-辛酸异丁酯5 461-06-3--0.16±0.02-辛酸异戊酯2 035-99-6---0.28±0.01癸酸异戊酯2 306-91-4--0.03±0.01-十四酸乙酯124-06-1--0.08±0.01a0.12±0.01b其他苯乙烯100-42-53.32±0.28ab4.15±0.42c3.09±0.41a3.88±0.44bc苯乙醛122-78-1--0.17±0.01a0.32±0.02b
注:同一行内不同字母(a~d)表示差异显著(P<0.05)(下同)
表2 KH组干酪成熟过程中挥发性风味化合物的变化(峰面积×106)
Table 2 Changes in volatile flavor substances of KH during ripening (peak area×106)

风味成分CAS成熟时间/d1306090醇类乙醇64-17-535.76±1.25a72.37±2.82b130.72±4.29c133.69±3.33c异戊醇123-51-31.25±0.08a17.67±1.18b17.72±1.29b17.64±1.33b正辛醇111-87-5---0.43±0.02苯乙醇60-12-88.33±0.70a9.03±0.75ab9.18±0.81ab10.01±0.34b酸类辛酸124-07-2--0.64±0.05a0.95±0.05b正癸酸334-48-5--0.12±0.01a0.25±0.03b棕榈酸57-10-3--0.37±0.02-硬脂酸57-11-4--0.10±0.01-酮类2-壬酮 821-55-60.69±0.04a1.09±0.15b1.46±0.08c2.02±0.08d2-十一烷酮 112-12-9--0.34±0.01-2-十三烷酮 593-08-8--0.15±0.01b0.07±0.04a酯类
续表2

风味成分CAS成熟时间/d1306090乙酸异戊酯123-92-21.36±0.09a3.82±0.50b3.61±0.33b3.55±0.48b乙酸乙酯141-78-6--0.93±0.14-丁酸乙酯105-54-4--2.07±0.25a2.39±0.28a己酸乙酯 123-66-03.52±0.36a8.62±0.51b9.39±0.74b11.71±1.34c庚酸乙酯106-30-90.24±0.01a0.56±0.02b0.66±0.03c0.82±0.06d辛酸甲酯111-11-5---0.51±0.01辛酸乙酯 106-32-136.93±2.35a49.18±1.83b55.05±1.78c72.57±2.71d壬酸乙酯123-29-5-0.32±0.03a0.33±0.03a0.50±0.02b癸酸乙酯110-38-37.74±1.08a10.57±1.32b11.27±0.85b17.99±1.93c乙基9-癸烯酸酯67 233-91-41.49±0.17a1.82±0.10b1.93±0.07b3.04±0.22c月桂酸乙酯106-33-20.47±0.03a0.73±0.04b1.03±0.08c1.46±0.06d辛酸异丁酯5 461-06-3-0.11±0.01a0.14±0.01a6.25±0.65b辛酸异戊酯2 035-99-6--0.10±0.01a0.10±0.01a癸酸异戊酯2 306-91-4--0.04±0.01-十三酸乙酯28 267-29-00.37±0.03---十四酸乙酯124-06-1--0.11±0.01-十六酸乙酯628-97-7--0.10±0.01-其他苯乙烯100-42-53.04±0.14a3.46±0.38a3.71±0.28a4.43±0.50b
表3 KC组干酪成熟过程中挥发性风味化合物的变化(峰面积×106)
Table 3 Changes in volatile flavor substances of KC during ripening (peak area×106)

风味成分CAS成熟时间/d1306090 醇类乙醇64-17-537.18±1.27b36.26±1.39b34.69±2.03b12.66±1.81a异戊醇 123-51-32.80±0.21a5.79±0.28c4.53±0.13b2.65±0.31a苯乙醇60-12-86.40±0.48b5.44±0.42ab5.58±0.36ab4.73±0.65a酸类庚酸111-14-8---0.78±0.04辛酸124-07-2--0.74±0.04b0.43±0.04a正癸酸334-48-5--0.22±0.01-棕榈酸57-10-3---0.34±0.02硬脂酸57-11-4---0.17±0.02酮类2-壬酮 821-55-60.92±0.05c0.89±0.07c0.68±0.03b0.47±0.04a2-十一烷酮 112-12-9--0.49±0.02b0.32±0.03a2-十三烷酮 593-08-8---0.14±0.01酯类甲酸异戊酯110-45-23.14±0.25---乙酸乙酯 141-78-6---1.22±0.11乙酸异戊酯123-92-21.21±0.09b1.07±0.10b0.23±0.01a0.22±0.02a丁酸乙酯105-54-4--0.36±0.05b0.22±0.02a己酸乙酯 123-66-04.19±0.34bc4.55±0.17c3.83±0.13b2.73±0.21a庚酸乙酯106-30-90.39±0.03b0.36±0.04b0.39±0.01b0.24±0.02a辛酸乙酯 106-32-136.17±1.07c35.70±1.28c32.49±1.10b27.53±1.71a壬酸乙酯123-29-50.33±0.04a-0.58±0.04b0.35±0.02a癸酸乙酯110-38-38.18±0.24a10.47±0.61b9.67±0.54b9.97±0.25b乙基9-癸烯酸酯67 233-91-41.34±0.08a1.27±0.12a1.71±0.13b1.33±0.12a月桂酸乙酯106-33-20.78±0.13a-0.84±0.07a0.95±0.15a辛酸异丁酯5 461-06-3--0.13±0.01-辛酸异戊酯2 035-99-6--0.19±0.02-十三酸乙酯28 267-29-0-0.85±0.05--十四酸乙酯124-06-1---0.08±0.01十六酸乙酯 628-97-7---0.06±0.01其他苯乙烯100-42-54.15±0.24c3.88±0.15bc3.45±0.12b2.30±0.37a苯乙醛122-78-1--0.22±0.02-
酸类化合物主要来源于干酪成熟过程中的脂肪降解、蛋白质水解和乳糖发酵。3组干酪中都存在的酸类化合物包括辛酸、正癸酸和棕榈酸,且都存在于成熟后期。辛酸与微弱的水果酸、油脂酸败的气味有关,仅存在于KH组中的己酸与羊乳气息、腐臭味、汗气和油脂味有关[16],对干酪的风味有不利影响。
酮类化合物多由不饱和脂肪酸氧化、热降解、氨基酸降解和微生物代谢产生。干酪中酮类化合物的含量较低,但是它们具有较低的感知阈值和典型的气味,是干酪挥发性风味化合物的来源之一。在3组干酪的不同成熟期均能检测到2-壬酮,2-壬酮是3种干酪中含量最高的酮类化合物,与干酪的花香味、水果味、桃子味有关。在成熟过程中,KY、KH两组中2-壬酮含量显著增加(P<0.05),KC组中2-壬酮含量显著降低(P<0.05)。除此之外,在3组干酪成熟后期还检测到少量的2-十一烷酮和2-十三烷酮,其中2-十一烷酮与脂肪和黄油的香味有关,2-十三烷酮与蜡香、脂香、乳品和椰子香气有关,3种酮类物质均赋予干酪积极的风味。
酯类化合物主要由酸和醇的酯化反应及氨基酸代谢产生。酯类化合物与干酪的花香味、水果味和甜味有关,还可以削弱脂肪酸产生的刺激味和苦味[17],对干酪风味具有重要作用。在3组干酪不同成熟期均检测到的酯类化合物有乙酸异戊酯、己酸乙酯、庚酸乙酯、辛酸乙酯、癸酸乙酯、月桂酸乙酯和乙基9-癸烯酸酯,主要以乙酯类为主,乙酯类对干酪香气影响最大。已有研究报道切达干酪中关键的酯包括己酸乙酯和辛酸乙酯[18]。己酸乙酯与橘子风味有关[19],对干酪的风味有积极影响。辛酸乙酯可以使干酪散发出一种令人愉快的、新鲜的、类似丁香的甜味。在成熟过程中,KY、KH两组中己酸乙酯和辛酸乙酯的含量均显著增加(P<0.05),而KC组中这两种物质的含量则显著降低(P<0.05)。在KY、KH两组中,随着成熟时间的增加,酯类化合物的含量也显著增加(P<0.05)。研究表明乙醇可能是一些干酪中酯合成的限制因素[20-21],因此高浓度的乙醇会增加干酪中酯类化合物的含量。这与本研究中具有高浓度乙醇的KY、KH两组中酯类化合物含量高的结果是一致的。相似的现象在其他研究中也有报道[10]。
除了种类和含量较多的醇类、酸类、酮类和酯类以外,干酪中还检测出苯乙烯和苯乙醛。在3组干酪中均检测出的苯乙烯具有橡胶味,对干酪的风味有消极影响。醛是干酪中不稳定的中间化合物,性质较为活泼,很容易进一步转化为醇或酯[22],在KC、KY两组检测到少量苯乙醛的存在,苯乙醛呈强烈的风信子香气,在低浓度时与杏仁味、樱桃味有关,对切达干酪的风味具有很好的修饰作用。
2.2 挥发性风味化合物聚类分析
图1为3组干酪成熟过程中挥发性风味化合物聚类分析热图。3组干酪中挥发性风味化合物的聚类情况在成熟前期和后期具有显著差异。
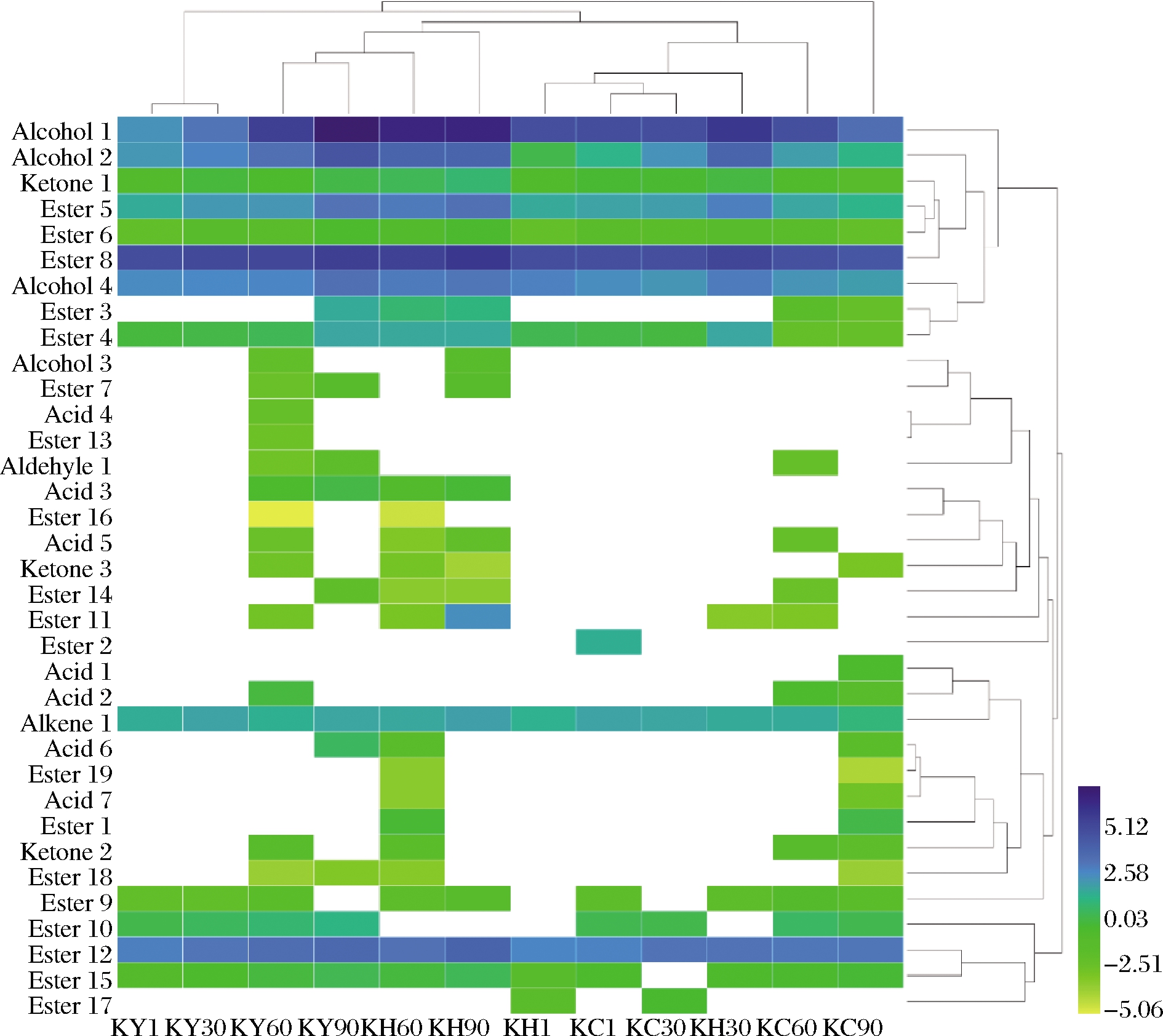
Alcohol 1-乙醇;Alcohol 2-异戊醇;Alcohol 3-正辛醇;Alcohol 4-苯乙醇;Acid 1-庚酸;Acid 2-己酸;Acid 3-辛酸;Acid 4-正壬酸;Acid 5-正癸酸;Acid 6-棕榈酸;Acid 7-硬脂酸;Ketone 1-2-壬酮;Ketone 2-2-十一烷酮;Ketone 3- 2-十三烷酮;Ester 1-乙酸乙酯;Ester 2-甲酸异戊酯;Ester 3-丁酸乙酯;Ester 4-乙酸异戊酯;Ester 5-己酸乙酯;Ester 6-庚酸乙酯;Ester 7-辛酸甲酯;Ester 8-辛酸乙酯;Ester 9-壬酸乙酯;Ester 10-乙基9-癸烯酸酯;Ester 11-辛酸异丁酯;Ester 12-癸酸乙酯;Ester 13-月桂酸异戊酯;Ester 14-辛酸异戊酯;Ester 15-月桂酸乙酯;Ester 16-癸酸异戊酯;Ester 17-十三酸乙酯;Ester 18-十四酸乙酯;Ester 19-十六酸乙酯;Alkene 1-苯乙烯;Aldehyde 1-苯乙醛;KY1、KY30、KY60、KY90:KY组成熟1、30、60、90 d样品;KH1、KH30、KH60、KH90:KH组成熟1、30、60、90 d样品;KC1、KC30、KC60、KC90:KC组成熟1、30、60、90 d样品
图1 干酪成熟过程中挥发性风味化合物聚类分析热图
Fig.1 Heat map of cluster analysis of volatile flavor compounds in cheeses during ripening
在成熟前期,KY1(KY组成熟1 d)和KY30可归为一类;KC1和KC30可归为一类,二者又可与KH1归为一类,并进一步与KH30归为一类,表明成熟前期KY组与KH、KC两组的挥发性风味化合物存在显著差异。在成熟后期,KY60和KY90可归为一类,二者又可与KH60归为一类,并进一步与KH90归为一类;KC60与成熟前期的KC组的挥发性风味化合物较为相似,而KC90与其他各组差异较大,表明随着成熟过程的进行,KY组与KH组中挥发性风味化合物更为接近,KC组与其他两组差异显著。对3组干酪成熟过程中挥发性风味化合物进行聚类分析可知,己酸乙酯、庚酸乙酯、辛酸乙酯和乙酸异戊酯这些含量较高的酯类化合物可与乙醇归为一类,这与先前的结果一致,表明乙醇可能是一些干酪中酯合成的限制因素[20-21]。
2.3 感官评价
图2为3组干酪在成熟1 d和90 d的感官评价雷达图。成熟1 d时,KY组感官评价总分为82.76,KH组感官评价总分为75.55,KC组感官评价总分为75.64。随着成熟时间的延长,3组干酪的感官评价总分和各感官指标得分均呈现出下降的趋势,其中口感评分下降最显著(P<0.05)。成熟90 d时,KY组感官评价总分为73.51,KH组感官评价总分为67.10,KC组感官评价总分为66.24。
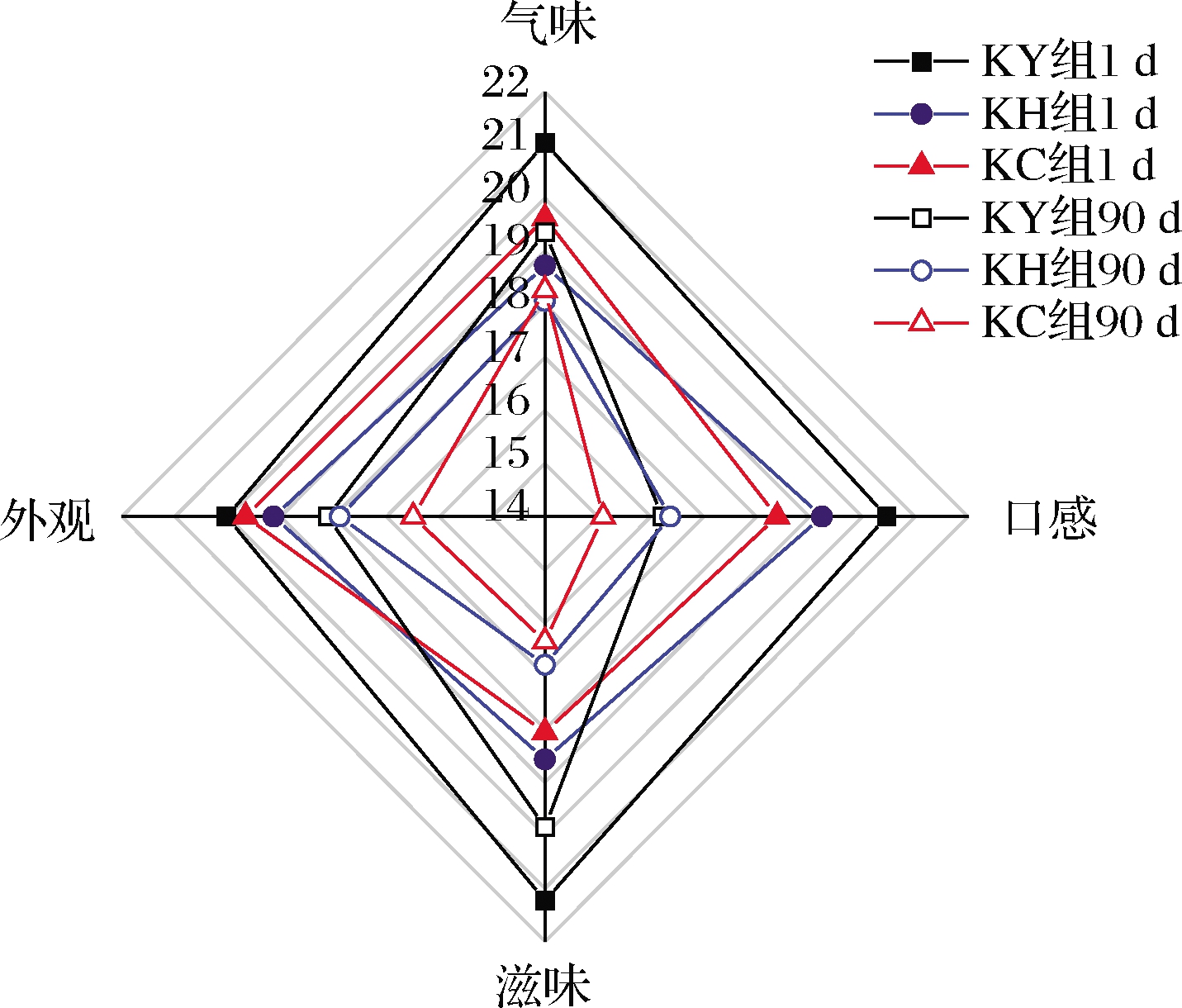
图2 干酪成熟1 d和90 d的感官评价雷达图
Fig.2 Radar charts of sensory evaluation at day 1 and day 90 of cheeses ripening
干酪的风味形成是一个较为漫长的过程。成熟1 d时,3组干酪滋气味浓郁,尤其是KC组中酒香味十分突出,这与本研究中KC组具有最高的乙醇含量的结果是一致的。但KC组由于乙醇含量较高导致酒香味过重,以至掩盖了干酪特有的乳脂味,因此KC组感官评分低于其他两组。而KY组由于酒香味与乳脂味较为均衡,因此感官评分最高,与KH组相比差异显著(P<0.05)。成熟90 d时,3组干酪酒香味均有所下降,而水果味显著增加。有研究表明,乙醇可以通过酯化反应转化为酯,而过量的酯类物质会导致干酪的果味缺陷[20],3组干酪的气味和滋味评分较成熟1 d时均有所降低。除此之外,随着干酪成熟时间的增加,蛋白质结构变得脆弱,导致3组干酪的口感评分显著降低。
3 结论
3组干酪在成熟过程中挥发性风味化合物的种类均有所增加,KY、KH两组干酪挥发性风味化合物的含量显著增加,尤其是乙醇、己酸乙酯、辛酸乙酯和癸酸乙酯。3组干酪挥发性风味化合物在成熟前期和后期差异显著,其中KY组干酪在成熟前期感官评分较高,酒香味与乳脂味较为均衡,成熟后期由于酯类化合物过量累积及蛋白质结构变得脆弱导致感官评分较低。综上所述,酿酒酵母能够促进KY组切达干酪风味的形成,短成熟期内具有最佳食用品质。
[1] 王磊,莫蓓红,刘振民,等.干酪风味分析研究进展[J].食品与发酵工业,2016,42(6):230-235.
WANG L,MO B H,LIU Z M,et al.Research progress on cheese flavour[J].Food and Fermentation Industries,2016,42(6):230-235.
[2] 宋云花,刘美玉,罗洁,等.利用辅助发酵剂生产水果风味Cheddar干酪[J].中国奶牛,2017(1):47-51.
SONG Y H,LIU M Y,LUO J,et al.Production of fruit-flavored Cheddar cheese using a supplementary starter[J].China Dairy Cattle,2017,(1):47-51.
[3] 宋君红,张晓莹,郭慧媛,等.辅助发酵剂对切达(Cheddar)干酪坚果风味的影响[J].中国奶牛,2015(2):29-32.
SONG J H,ZHANG X Y,GUO H Y,et al.Effects of adjunct cultures on the nutty flavor of cheddar cheese[J].China Dairy Cattle,2015(2):29-32.
[4] 萨如拉,闫清泉,朱莹丹,等.瑞士乳杆菌对Gouda干酪品质的影响[J].中国食品学报,2016,16(2):145-150.
SARULA,YAN Q Q,ZHU Y D,et al.Effect of Lactobacillus helveticus on quality of Gouda cheese[J].Journal of Chinese Institute of Food Science and Technology,2016,16(2):145-150.
[5] DE WIT M,OSTHOFF G,VILJOEN B C,et al.A comparative study of lipolysis and proteolysis in Cheddar cheese and yeast-inoculated Cheddar cheeses during ripening[J].Enzyme and Microbial Technology,2005,37(6):606-616.
[6] PRICE E J,LINFORTH R S T,DODD C E R,et al.Study of the influence of yeast inoculum concentration (Yarrowia lipolytica and Kluyveromyces lactis) on blue cheese aroma development using microbiological models[J].Food Chemistry,2014,145:464-472.
[7] BERTUZZI A S,KILCAWLEY K N,SHEEHAN J J,et al.Use of smear bacteria and yeasts to modify flavour and appearance of Cheddar cheese[J].International Dairy Journal,2017,72:44-54.
[8] KAGKLI D M,T CHE R,COGAN T M,et al.Kluyveromyces lactis and Saccharomyces cerevisiae,two potent deacidifying and volatile-sulphur-aroma-producing microorganisms of the cheese ecosystem[J].Applied Microbiology and Biotechnology,2006,73(2):434-442.
CHE R,COGAN T M,et al.Kluyveromyces lactis and Saccharomyces cerevisiae,two potent deacidifying and volatile-sulphur-aroma-producing microorganisms of the cheese ecosystem[J].Applied Microbiology and Biotechnology,2006,73(2):434-442.
[9] HANSEN T K,TEMPEL T V D,CANTOR M D,et al.Saccharomyces cerevisiae as a starter culture in Mycella[J].International Journal of Food Microbiology,2001,69(1-2):101-111.
[10] SØRENSEN L M,GORI K,PETERSEN M A,et al.Flavour compound production by Yarrowia lipolytica,Saccharomyces cerevisiae and Debaryomyces hansenii in a cheese-surface model[J].International Dairy Journal,2011,21(12):970-978.
[11] 程晶晶,陈会民,罗洁,等.不同成熟期切达干酪的组分及特征风味物质的解析[J].食品与发酵工业,2020,46(15):231-237.
CHENG J J,CHEN H M,LUO J,et al.Analysis of components and characteristic flavor substances of Cheddar cheese at different maturation stages[J].Food and Fermentation Industries,2020,46(15):231-237.
[12] BIAGIOTTI C,CIANI M,CANONICO L,et al.Occurrence and involvement of yeast biota in ripening of Italian Fossa cheese[J].European Food Research and Technology,2018,244(11):1 921-1 931.
[13] 郝晓娜,张健,杨亚威,等.益生性植物乳杆菌对切达干酪挥发性风味形成的影响[J].食品科学,2018,39(4):49-58.
HAO X N,ZHANG J,YANG Y W,et al.Effect of probiotic Lactobacillus plantarum on volatile flavor formation in Cheddar cheese[J].Food Science,2018,39(4):49-58.
[14] ANDRADE R P,DE OLIVEIRA D R,LOPES A C A,et al.Survival of Kluyveromyces lactis and Torulaspora delbrueckii to simulated gastrointestinal conditions and their use as single and mixed inoculum for cheese production[J].Food Research International,2019,125:108620.
[15] XU Z L,CHEN J L,SHI X W,et al.Characteristic physicochemical indexes and flavor compounds in Xinjiang Kazak cheese during ripening[J].Food Bioscience,2020,35:100586.
[16] 王磊,莫蓓红,刘振民,等.8种典型成熟干酪挥发性风味差异性研究[J].食品与机械,2017,33(4):33-38.
WANG L,MO B H,LIU Z M,et al.Study on the differences of volatile flavor of eight typical mature cheeses[J].Food & Machinery,2017,33(4):33-38.
[17] PINHO O,PÉRÉS C,FERREIRA I M P L V O.Solid-phase microextraction of volatile compounds in “Terrincho” ewe cheese:Comparison of different fibers[J].Journal of Chromatography A,2003,1011(1-2):1-9.
[18] WANG J,YANG Z J,XU L Y,et al.Key aroma compounds identified in Cheddar cheese with different ripening times by aroma extract dilution analysis,odor activity value,aroma recombination,and omission[J].Journal of Dairy Science,2021,104(2):1 576-1 590.
[19] CURIONI P M G,BOSSET J O.Key odorants in various cheese types as determined by gas chromatography-olfactometry[J].International Dairy Journal,2002,12(12):959-984.
[20] RICHOUX R,MAILLARD M B,KERJEAN J R,et al.Enhancement of ethyl ester and flavour formation in Swiss cheese by ethanol addition[J].International Dairy Journal,2008,18(12):1 140-1 145.
[21] HONG Q,WANG G,ZHANG Q,et al.Enhancement of ester formation in Camembert cheese by addition of ethanol[J].International Journal of Dairy Technology,2017,70(2):220-227.
[22] WANG J,FANG X B,WU T,et al.Exopolysaccharide producing Lactobacillus plantarum SKT109 as adjunct culture in Cheddar cheese production[J].LWT,2018,97:419-426.