植物乳杆菌(Lactobacillus plantarum)是一种可以生产多种有益物质的功能性乳酸菌,其自身可用做食品发酵剂。植物乳杆菌在生长代谢过程中为适应环境会形成乳酸菌胞外多糖(exopolysaccharides,EPS),它们有的分泌到培养基,形成黏液多糖;有的依附于细胞壁上,称为荚膜多糖[1]。乳酸菌胞外多糖按照单糖组成,可以分为同型多糖(homopolysaccharide,HoPS)和异型多糖(heteropolysaccharide,HePS)。HoPS只包含一种单糖(葡萄糖或果糖),他们在糖苷键、分支、链长、相对分子质量和聚合物结构方面有所不同。与HoPS相比,HePS的生物合成及其结构更为复杂。HePS由不同单糖的重复单元组成,包括葡萄糖、半乳糖和鼠李糖,偶尔含有N-乙酰-D-葡萄糖胺、N-乙酰-D-半乳糖胺、糖醛酸和一些非碳水化合物取代物如丙酮酸、乙酸、磷酸盐和琥珀酸,这些物质在生理和工艺中发挥关键作用[2]。研究表明,植物乳杆菌EPS可以改善奶酪和酸奶等发酵乳制品的质构和流变性,作为增黏剂、乳化剂、胶凝剂或稳定剂广泛应用于乳制品行业[3-4]。除了能改善发酵食品特性,植物乳杆菌EPS还能够增强人体免疫力,促进人体健康,具有降血压、降胆固醇和抗溃荡等功能,同时可以改善肠道微生态环境等[5-9]。另外,植物乳杆菌EPS还可以用作纳米材料的稳定剂。例如,用植物乳杆菌EPS制备得到的多糖/硒纳米颗粒(exopolysaccharides selenium nanoparticles,E-SeNPs)在水中的稳定性和分散性高,具有良好的抗氧化活性[10],可以作为安全和高效的药物使用。同时,胞外多糖还可以作为高效的染料废水色素吸附剂使用,提高环境效益。与此同时,植物乳杆菌在发酵过程中还可以生产副产物DL-乳酸,可以用做酸味剂、强化剂、防腐剂等,广泛地应用于食品、医药、化工等行业。在国内,目前DL-乳酸市场价格约15 000元/t,市场前景十分可观。
目前,植物乳杆菌多糖主要通过真菌发酵或从植物中提取得到。但是,利用细菌进行EPS工业化生产的相关报道较少,主要包括:来自肠膜明串珠菌的右旋糖酐,用野油菜黄单胞菌发酵得到的黄原胶[11],来源于伊乐假单胞杆菌发酵的结冷胶[12],以及通过谷氨酸棒杆菌发酵得到的透明质酸[13]等。限制EPS工业发酵生产的因素主要是发酵原料(昂贵的培养基)和操作成本(好氧发酵体系黏度高、搅拌耗电量大)高;多糖精制提取难度大、成本高;某些生产菌种是非食品级细菌,不能用于食用、药物和人类健康等领域。相比于上述微生物多糖,植物乳杆菌多糖在食用安全和厌氧发酵及不需大量耗电等方面更具优势。植物乳杆菌发酵体系的黏度相对较低,EPS提取工艺较简单、精制成本较低。但是,目前产植物乳杆菌多糖的菌株依旧存在着多糖产量低和原料成本高等问题,制约了植物乳杆菌多糖的实际应用。据报道,在对培养基成分进行优化以后,EPS产量也只能达到50~600 mg/L的水平[4,14]。MACEDO等[15]通过优化培养基成分使EPS产量达到2.78 g/L,是现有报告中乳杆菌EPS的最高产量。用Lactobacillus kefranofaciens WT-2B生产乳酸菌EPS,产量也可以达到2.50 g/L的水平[16]。还有研究者使用廉价的RH培养基(含大米淀粉和蛋白、可用做发酵的碳氮源)进行多糖发酵,节约了原料成本[17]。
本研究室前期研究中,从富源泡菜中分离出1株高产EPS的菌株Lactobacillus plantarum R040。摇瓶实验发现,使用MRS培养基、Lactobacillus plantarum R040在31 ℃、pH 6、接种量3%(体积分数)条件下发酵18 h,EPS-R040产量最大,达到1.80 g/L。EPS溶解在水中并与功能性硒纳米颗粒混合后可以得到稳定性和均一性较好的硒纳米产品,EPS还具有良好的吸附染印废水色素的能力[18]。理论上、L.plantarum 可以在控制pH的条件下,量产EPS-R040,但也可能造成副产物乳酸的大量积累,而乳酸又可能会对植物乳杆菌细胞的生长产生抑制,进而影响主产物植物乳杆菌EPS的合成。本论文以L.plantarum R040为模式菌株,在5 L搅拌发酵罐中进行扩大培养,利用不同的发酵工艺,包括常规发酵、生物催化、生物催化/液液萃取复合策略缓解乳酸对主产物——植物乳杆菌EPS合成的抑制,以及基于pH-Stat法自动流加葡萄糖的反复生物催化等策略进行EPS发酵,为高效经济发酵生产植物乳杆菌EPS提供新的途径和重要参考,并对规模发酵得到的植物乳杆菌EPS与摇瓶发酵得到多糖的特性进行分析比对。研究内容具有一定的理论意义和潜在的应用价值。与此同时,通过自由选择发酵操作工艺,在提高植物乳杆菌EPS产量的同时,联产副产物乳酸,有望降低生产成本和实现发酵产品多样性。
1 材料与方法
1.1 实验菌株
本实验采用的L.plantarum R040分离于中国云南的富源泡菜,保藏于本实验室,菌株保藏于甘油管中(-20 ℃)。
1.2 主要仪器与设备
Bailun-Bio 5 L发酵罐,上海百仑生物设备工程有限公司(配有pH/DO电极和控制柜);SBA-40C生物传感分析仪,山东省科学院生物研究所;1100高效液相色谱仪,美国Agilent公司;510工业控制计算机,台湾研华科技有限公司;VORTEX 21K和H1850R离心机,湖南湘仪设备有限公司。
1.3 传统发酵培养基
MRS培养基(g/L):蛋白胨10.0,牛肉浸粉8.0,酵母浸粉4.0,葡萄糖20.0,K2HPO4 2.0,柠檬酸氢二铵2.0,乙酸钠5.0,MgSO4 0.2,MnSO4 0.04,吐温80 1.0。pH 5.7,以水溶解,121 ℃灭菌15 min。
1.4 磷酸缓冲液
pH 6的磷酸缓冲液:预先配制1 mol/L的NaH2PO4和Na2HPO4溶液,然后将877 mL 1 mol/L的NaH2PO4溶液和123 mL 1 mol/L的Na2HPO4溶液混合,121 ℃灭菌 15 min。
1.5 培养/发酵方法
L.plantarum R040活化培养:取100 μL甘油管保藏的菌种接种到10 mL MRS培养基中,在31 ℃静置培养18 h后,得到种子液。
250 mL摇瓶下的细胞培养:按照5%的接种量将L.plantarum R040种子液接种到MRS肉汤培养基中,装液量为100 mL,在31 ℃培养箱中静置培养18 h。
5 L发酵罐下的常规发酵:在多个上述摇瓶中进行细胞培养,按需要接种,经离心(8 000 r/min,30 min,4 ℃)分离得到半固态菌体,然后用少量新鲜培养基将细胞溶解。“浓缩”细胞液作为种子液接种至5 L发酵罐(MRS培养基装液量2 L)中,接种量为5%。发酵温度控制在31 ℃。用50%的氨水将pH控制在5.9。根据不同需求,使用通气或不通气发酵。控制搅拌转速在20~100 r/min。葡萄糖耗尽,pH突然上升后流加500 g/L的葡萄糖浓缩液。当乳酸浓度不再增加时,终止发酵。
生物催化法发酵:将5 L发酵罐的常规发酵结束时的发酵液进行离心(8 000 r/min,30 min,4 ℃),得到的细胞保存于磷酸缓冲液中,置4 ℃冰箱中待用。使用时直接将含细胞的缓冲液与适当浓度的葡萄糖溶液直接混合,在5 L发酵罐内发酵,实际装液量1 L。
1.6 分析方法
葡萄糖、L-乳酸:用生物传感分析仪测定。
总乳酸(DL-乳酸):采用Agilent公司的HPLC进行测量。色谱条件:反相柱C18柱,温度30 ℃,洗脱液流速0.8 mL/min,洗脱液:5%甲醇+0.05%磷酸+94.95%水。
EPS:将发酵液离心(9 500 r/min、4 ℃、20 min)取上清液,在发酵上清液中加入800 g/L的三氯乙酸,最终三氯乙酸质量浓度为40 g/L,置4 ℃冰箱过夜,去除蛋白质后离心(6 080 r/min、4 ℃、15 min) 取上清液,加入3倍体积的无水乙醇置于4 ℃冰箱过夜,沉淀多糖;相同条件下再次离心,去除上清液,得到多糖沉淀物,用少量蒸馏水充分溶解多糖沉淀物。最后,将溶解后的多糖放入透析袋,置于装有2 L蒸馏水的3 L烧杯中,在4 ℃下透析2 d,换水6次,取出透析袋中的多糖溶液冻干称重,测量EPS产量。
细胞测量:在600 nm下测量光学密度OD600 nm值,将发酵结束后离心得到的湿菌体置于烘箱内烘干至恒重,得到单位体积细胞干重ρ=0.21OD600 nm。
1.7 EPS的应用
1.7.1 EPS制备硒纳米材料的方法
将2.98 mL的Na2SeO3溶液(4 mg/mL)加入到1 mg/mL的EPS-R040 多糖溶液中,使Se与EPS的质量比为4∶3,剧烈搅拌过夜,然后将与Na2SeO3等体积的抗坏血酸(18 mg/mL)缓慢加入到上述混合液中,室温下搅拌6 h,将所得溶液于4 ℃透析2 d,将其冻干,室温储存在装有硅胶的干燥器中备用。
1.7.2 EPS吸附印染废水中亚甲基蓝(methylene blue,MB)的方法
配制0.8 g/L多糖水溶液,置于80 ℃恒温水浴锅中,待多糖全部溶解,室温冷却。剪取8 cm的透析袋(市售,截留相对分子质量10 kDa),装入5 mL多糖溶液于透析袋中,用塑料绳结扎两端,将其置于MB质量浓度为500 mg/L的烧杯(装液量50 mL)中。将透析袋在烧杯中浸泡24 h,确保最终的吸附平衡,每2 h取样1次。温度控制在25 ℃,重复3次。
2 结果与讨论
2.1 250 mL摇瓶中的多糖发酵
前期研究中,在250 mL摇瓶规模下,对利用L.plantarum的EPS发酵条件进行了优化。结果发现,在31 ℃、pH 6、接种量3%的条件下发酵18 h,EPS产量最高可达到1.80 g/L[18]。重复实验显示,最高EPS质量浓度为1.58 g/L,较前期发酵水平略低。为此,在5 L发酵罐中进行利用L.plantarum生产EPS的发酵,控制pH,提高EPS产量和乳酸浓度,量产EPS。
2.2 5 L发酵罐上的多糖发酵
首先,在5 L发酵罐中进行常规发酵,即分批补料发酵。结果如图1、图2和表1所示。使用研究室自行开发的BioJN控制系统,在工业控制计算机上显示发酵数据曲线图,并据此手动添加葡萄糖浓缩液。如图1-a所示,当葡萄糖耗尽时,乳酸合成停止,pH维持在高位(6.0)不变,此时按需要流加不同量的葡萄糖浓缩液。加入葡萄糖后,乳酸合成重新开始、pH迅速下降、降至低位(5.9)时,重新自动流加氨水调节pH。乳酸发酵属于兼性厌氧发酵,在通气情况下,发酵初期(2 h)溶氧浓度就开始不断上升、说明通气发酵并不能改善L.plantarum发酵生产EPS的性能,因此在后续实验中均使用不通气策略进行发酵,以降低操作成本。
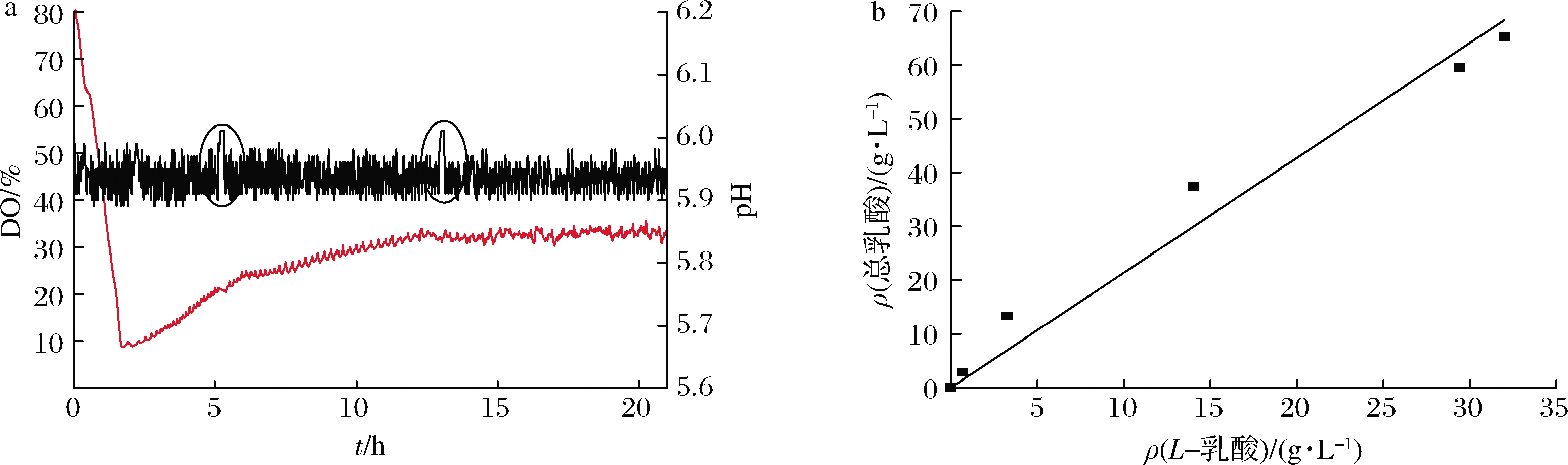
a-常规流加发酵、通空气发酵中的pH和DO变化;b-L.plantarum发酵所产L-乳酸和总乳酸浓度之间的定量关系
图1 5 L发酵罐中生产EPS时的pH/DO变化情况以及L-乳酸和总乳酸浓度之间的关系
Fig.1 pH/DO variations in exopolysaccharides production and the relationship of L-lactate/total lactate concentrations in 5 L fermentor
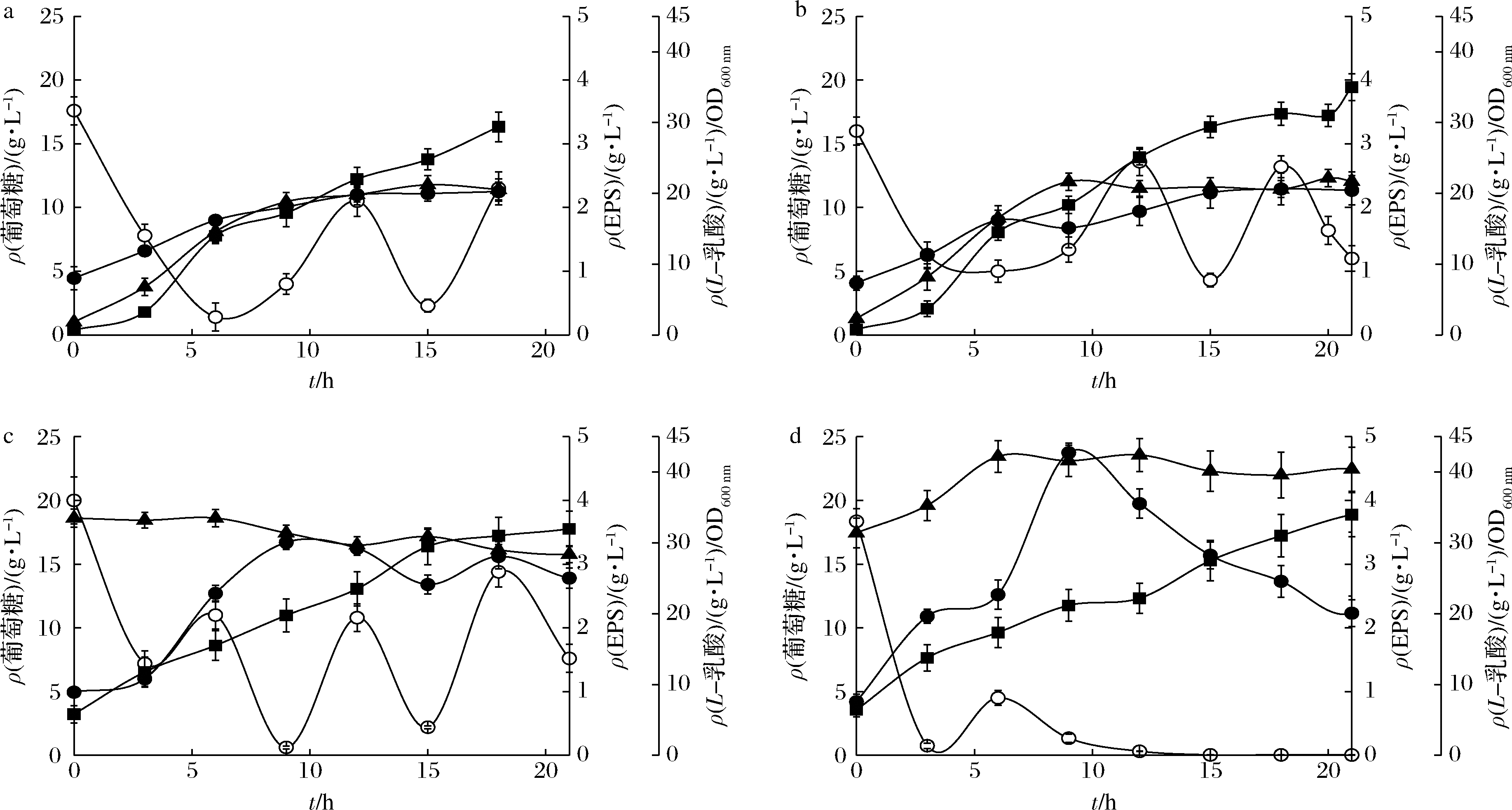
■-L-乳酸;●-EPS;○-葡萄糖;▲-OD600 nm a-常规发酵,搅拌速度50 r/min,通气量0.1 vvm;b-常规发酵,搅拌速度50 r/min,不通气; c-生物催化,搅拌速度20 r/min,不通气;d-生物催化+液液萃取复合操作策略,搅拌速度100 r/min,不通气
图2 不同发酵策略下的EPS发酵性能
Fig.2 Exopolysaccharides fermentation performance with different operating strategies
经测定,L.plantarum生产的乳酸为DL-乳酸。将批次#4的样品(表1)分别用生物传感仪和HPLC进行乳酸浓度测定,得到图1-b所示的L-乳酸和总乳酸浓度的校正曲线。L-乳酸和总乳酸浓度呈线性关系,拟合公式为y=2.103x(y,总乳酸含量;x,L-乳酸含量),说明L-乳酸和D-乳酸产量基本相等。
表1 不同操作条件下EPS发酵生产的性能比较
Table 1 The exopolysaccharides fermentation performance with different strategies

发酵策略 批次L-乳酸/(g·L-1)总乳酸/(g·L-1)OD600 nmEPS/(g·L-1)EPS/X/(g·g-1)时间/h多糖/葡萄糖转化率/(g·g-1)总乳酸得率/(mol·mol-1)常规发酵20 r/min 通气0.1 vvm#123.5049.4319.401.720.407180.031.4720 r/min 不通气#227.5057.8417.951.930.659180.041.5350 r/min 通气0.1 vvm#329.4061.8420.562.250.521180.021.2750 r/min 不通气#435.0073.6221.702.290.529180.021.34生物催化20 r/min 不通气#532.0067.3128.403.340.50790.081.63催化+萃取100 r/min 不通气#634.0071.5140.404.750.54490.091.98pH-Stat常规发酵(回用1)#77.3015.3511.401.540.96090.121.89催化(回用2)#823.5049.4341.503.330.370120.071.62催化(回用3)#917.2536.2823.502.620.540120.061.38催化(回用4)#1015.0031.5522.702.330.489120.051.27催化(回用5)#1113.7528.9217.001.880.506120.041.12
注:EPS为其最大浓度;EPS/X、时间和多糖/葡萄糖转化率分别为EPS最大浓度下的数据;其余是发酵结束时的数据,X为细胞干重
2.2.1 常规发酵生产EPS
在5 L罐下进行常规发酵实验,发酵批次#1(通气)和批次#2(不通气)的搅拌转速均为20 r/min,最高EPS质量浓度分别为1.72 g/L和1.93 g/L(表1),略高于摇瓶发酵的水平(1.58 g/L)。在发酵批次#3(表1,图2-a,通气)和#4(表1,图2-b,不通气)中、将搅拌转速提升到50 r/min。上述2个批次中,当葡萄糖耗尽,pH停留在高位水平不再变化时,手动流加葡萄糖浓缩液提升葡萄糖浓度。2个批次中,细胞均在10 h左右停止生长;L-乳酸持续积累增加直至发酵结束,最终质量浓度达到29~35 g/L的水平;EPS质量浓度在12~14 h后也不再增加,其中,批次#3和批次#4的最大EPS质量浓度分别为2.25 g/L和2.29 g/L,相比摇瓶发酵的水平(1.58 g/L)分别提高了42.4%和44.9%。图2-a和图2-b的结果显示,多糖和乳酸合成均属于典型的生长半耦联型过程。由于初始细胞浓度(OD600 nm)较低,且细胞生长在12~14 h后基本停止,导致EPS浓度偏低。为了解决上述问题,考虑使用生物催化法提高初始细胞浓度,来提升EPS浓度。
2.2.2 生物催化法生产EPS
将常规发酵批次#3结束时的发酵液进行离心分离,所得湿细胞直接投入到磷酸缓冲液中,置4 ℃冰箱保存(保存期不超过1个月)。再将含休眠细胞的磷酸缓冲液与适当浓度的葡萄糖溶液直接复配启动多糖发酵,装液量为1 L,搅拌转速为20 r/min(发酵批次#5,表1)。此时,初始细胞浓度(OD600 mm)高达33.50 g/L,此后略有下降,促进了多糖合成。EPS浓度在9 h左右就达到3.34 g/L的最高水平,比摇瓶发酵的最高水平(1.58 g/L)提高了110%,0~9 h多糖得率和生产效率分别达到0.08 g/g和0.37 g/(L·h)。与常规发酵类似,当葡萄糖耗尽时,手动流加葡萄糖浓缩液、将葡萄糖浓度提升到10 g/L的水平。使用生物催化法生产多糖,虽然细胞不再生长,但由于初始细胞浓度高,发酵9 h时、L-乳酸产量就达到22 g/L的水平(总乳酸46.20 g/L),以后继续上升直至发酵结束(L-乳酸~32 g/L,总乳酸67.20 g/L)。由于乳酸浓度高会对细胞合成EPS产生抑制,发酵9 h后多糖浓度不再继续上升。因此,有必要限制乳酸的快速积累,进一步提升EPS浓度。总体上,与常规发酵相比,使用生物催化发酵工艺提高了EPS浓度,缩短了发酵时间,简化了配料过程,降低了原料成本(只使用葡萄糖),发酵总体性能得到改善。
2.2.3 生物催化+液液萃取复合工艺生产EPS
乳酸对乳酸菌生长有抑制作用[19]。为此,在250 mL摇瓶中添加不同浓度的L-乳酸,控制葡萄糖初质量浓度在20 g/L、装液量100 mL。启动植物乳杆菌合成EPS的发酵。发酵18 h结束,结果如表2所示。随着初始乳酸浓度的增加,L.plantarum菌体生长受到抑制,EPS产量也不断降低。当初始乳酸质量浓度达到10 g/L时,细胞基本不生长,EPS浓度很低,说明乳酸确实对细胞生长和EPS合成具有抑制作用。
表2 乳酸浓度对发酵性能的影响
Table 2 Effects of lactic acid concentrations on fermentation performance
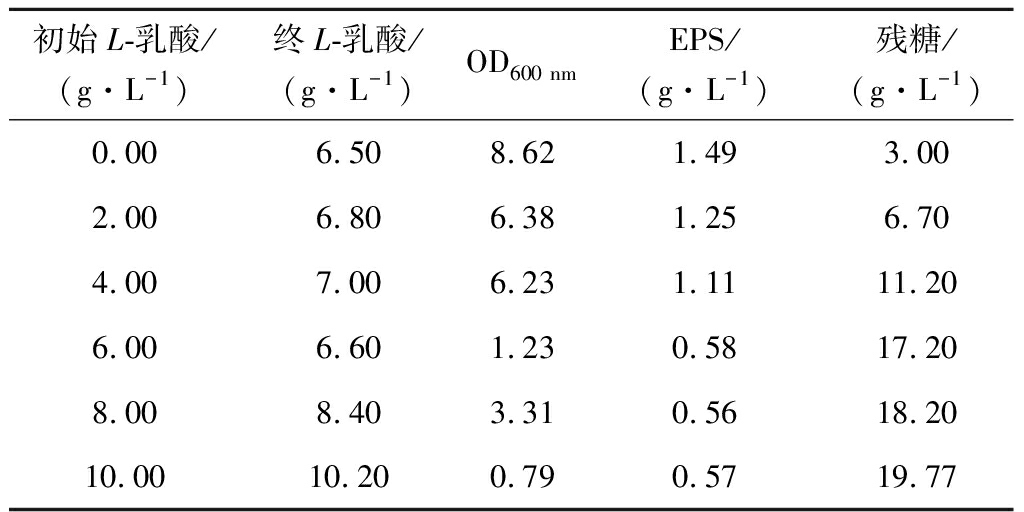
初始L-乳酸/(g·L-1)终L-乳酸/(g·L-1)OD600 nmEPS/(g·L-1)残糖/(g·L-1)0.006.508.621.493.002.006.806.381.256.704.007.006.231.1111.206.006.601.230.5817.208.008.403.310.5618.2010.0010.200.790.5719.77
还有文献指出,使用油醇为萃取剂(含体积分数15%的 Alamine 336)形成油水两相的液液萃取发酵体系,可以将发酵液中的乳酸原位移除到油相中,降低发酵液相中的乳酸浓度,促进乳酸菌生长、提高菌体浓度[20]。但是,Alamine 336对乳酸菌细胞具有一定毒性[21]。使用与生物催化同样的方法配制细胞悬浊液。首先利用生物催化法启动发酵,搅拌速率20 r/min,装液量1 L。发酵3 h、按体积比1∶3添入含15%(体积分数) Alamine 336的油醇(油水两相总体积1.33 L),开始进行生物催化+液液萃取复合工艺的EPS发酵。增加搅拌速度至100 r/min,使萃取剂与发酵液充分混合,整个发酵体系呈乳化状态,有效原位移除发酵液中的乳酸。如图2-d所示,细胞浓度稳定在40(OD600 nm)的高水平,EPS质量浓度在9 h迅速升高到4.75 g/L,比摇瓶发酵水平(1.58 g/L)提高了200%,0~9 h,多糖得率和生产效率分别达到0.09 g/g和0.53 g/(L·h)。发酵性能有了进一步提高。但是,9 h后乳酸仍在积累,为此在发酵后期,当pH停留在高位的现象出现时,每次只添加2 g/L-broth的葡萄糖。其目的在于,利用葡萄糖受限的条件进一步抑制乳酸积累,但是9 h、EPS浓度达到最高值后迅速下降,结果不尽人意。
萃取剂油醇价格高,必须要对其进行回用,上述工艺才具有实际意义。为此,用水对发酵结束时油醇中的乳酸进行反向萃取,降低油醇中的乳酸浓度、实现油醇回用。在烧杯中,将油水体积比分别控制在1∶3、1∶5、1∶8、1∶10、1∶20和1∶50进行反萃,用磁力搅拌器搅拌6 h,尽可能将乳酸提取到水相中。然后对水相中的L-乳酸和EPS浓度进行测定,当水相中L-乳酸浓度恒定后停止反萃。用公式(1)物料平衡方程对油醇的乳酸萃取系数进行计算:
A=CWVW+COVO
(1)
式中:A,乳酸总量;CW,水相中的乳酸浓度;CO,油相中的乳酸浓度;VW和VO分别代表水相和油相的体积。将公式(1)变形得到公式(2):
(2)
式中:W,A/VW。以VO/VW为横坐标,W为纵坐标,截距为![]() 时,CW=0.1 g/L)作图(图3-a)。用试行错误法计算萃取系数m,选取拟合系数最高时的m值作为萃取系数的最佳推定值(m=0.95,m=CO/CW)。推定结果表明,油醇对乳酸的萃取系数并不高,与文献报道(德氏乳杆菌培养)的数值有较大差异[21],乳酸原位移除率不高、最大乳酸移除率只能达到17 g/L(≈60×0.95×0.3)的水平。乳酸反萃时的耗水量大、反萃操作成本高,难以实现油醇的回用。
时,CW=0.1 g/L)作图(图3-a)。用试行错误法计算萃取系数m,选取拟合系数最高时的m值作为萃取系数的最佳推定值(m=0.95,m=CO/CW)。推定结果表明,油醇对乳酸的萃取系数并不高,与文献报道(德氏乳杆菌培养)的数值有较大差异[21],乳酸原位移除率不高、最大乳酸移除率只能达到17 g/L(≈60×0.95×0.3)的水平。乳酸反萃时的耗水量大、反萃操作成本高,难以实现油醇的回用。
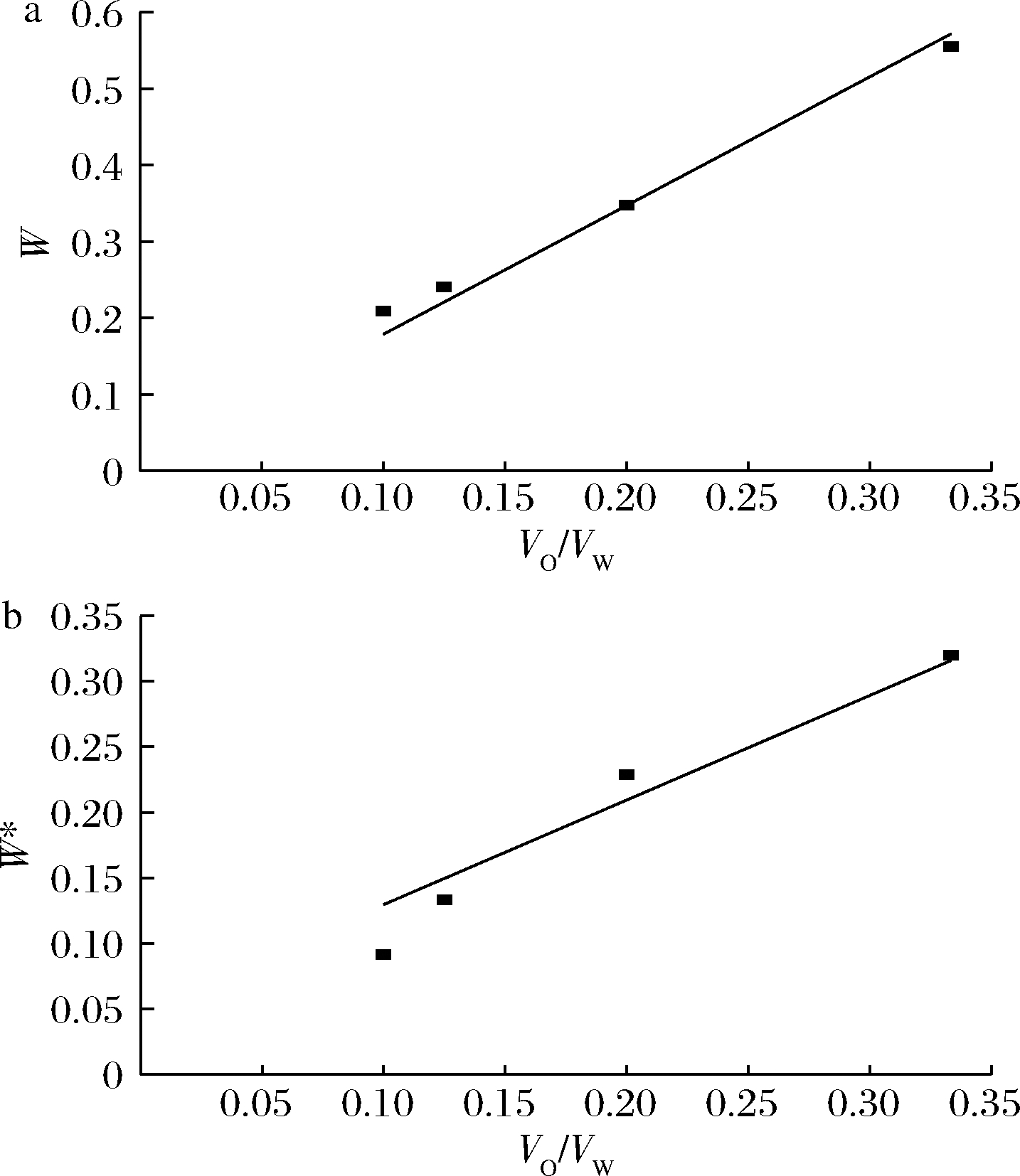
a-反向萃取;b-EPS推定
图3 反向萃取油醇中的乳酸和EPS推定油醇 与它们的萃取系数关系
Fig.3 Counter extracting lactic acid and EPS in oleyl alcohol to estimate their extraction coefficients
用同样方法计算油醇对EPS的萃取系数m*(m*=0.2)。结果发现,油醇对EPS的萃取系数很低(图3-b,W*为多糖的水相浓度),EPS几乎全部存在于发酵液相。总体上,使用生物催化+液液萃取复合工艺可以进一步提高EPS浓度。但是,由于油醇对乳酸的萃取系数不高、油醇回用困难,如果每批次发酵都用新鲜油醇,则操作成本太高,限制了该工艺的实用性。
2.2.4 使用基于pH-Stat葡萄糖流加法的反复生物催化工艺生产EPS
使用生物催化和生物催化+液液萃取复合工艺生产EPS的发酵体系,发酵液相中的乳酸积累依旧无法控制。因此,考虑使用pH-Stat葡萄糖流加工艺来生产EPS。pH-Stat法根据pH的变化,可将发酵液中的葡萄糖浓度自动控制在低水平,限制乳酸积累。另外,单纯的生物催化和生物催化+液液萃取复合工艺每次都需要利用常规发酵(使用MRS培养基)工艺来获取休眠细胞,原料成本高、操作复杂,经济性能较差。因此,提出了使用基于pH-Stat葡萄糖流加法的反复生物催化策略强化EPS生产的发酵工艺。
先使用常规发酵法收集反复生物催化所需的菌体(反复生物催化批次#1,总发酵批次#7,表1),初始葡萄糖质量浓度为6 g/L,葡萄糖耗尽后,pH-Stat流加葡萄糖自动启动。结果如图4-a所示。此时,乳酸浓度在发酵18 h时仍处在10 g/L以下,乳酸积累确实得到了抑制。但是,细胞生长也受到抑制,18 h时OD600 nm只能达到11.4的低水平,无法满足收集足够菌体为次轮发酵服务的目标。故在18 h后,当出现葡萄糖匮乏的现象时,手动流加葡萄糖浓缩液,将葡萄糖质量浓度一次性提升至20 g/L的水平(18 h后的数据未在图4-a中显示)。发酵27 h,OD600 nm达到了26.2的较高水平,离心分离收集菌体,为次级反复生物催化生产EPS所用。第2次反复生物催化发酵生产EPS,OD600 nm稳定在40的水平不变,EPS质量浓度在9 h达到最大值3.33 g/L,与发酵批次#5的水平相等(表1,图4-b,发酵批次#8),多糖得率也大幅提高,达到0.16 g/g。L-乳酸质量浓度最大为23 g/L。发酵结束后,再次收集菌体为第3次反复生物催化发酵生产EPS所用,依此类推。但是,在细胞收集和磷酸缓冲液处理休眠细胞的过程中,细胞总量有所损失,第3次反复生物催化时的初始细胞浓度OD600 nm下降到25,EPS质量浓度在12 h达到最大值2.62 g/L。然而,EPS/X(EPS与细胞量之比)却从0.370 g/g增加到0.540 g/g(表1),说明细胞活性并没有下降,绝对EPS浓度下降的原因是因为初始细胞总量减少了。15 h发酵结束时乳酸质量浓度为17.25 g/L,乳酸积累基本得到控制。第5次反复生物催化生产EPS时,初始细胞量和EPS最大浓度(OD600 nm=17.0,EPS质量浓度在12 h时为1.88 g/L,表1和图4-e)继续下降。但EPS/X仍可维持在0.506 g/g的水平(表1),最终L-乳酸质量浓度仅有13.75 g/L。
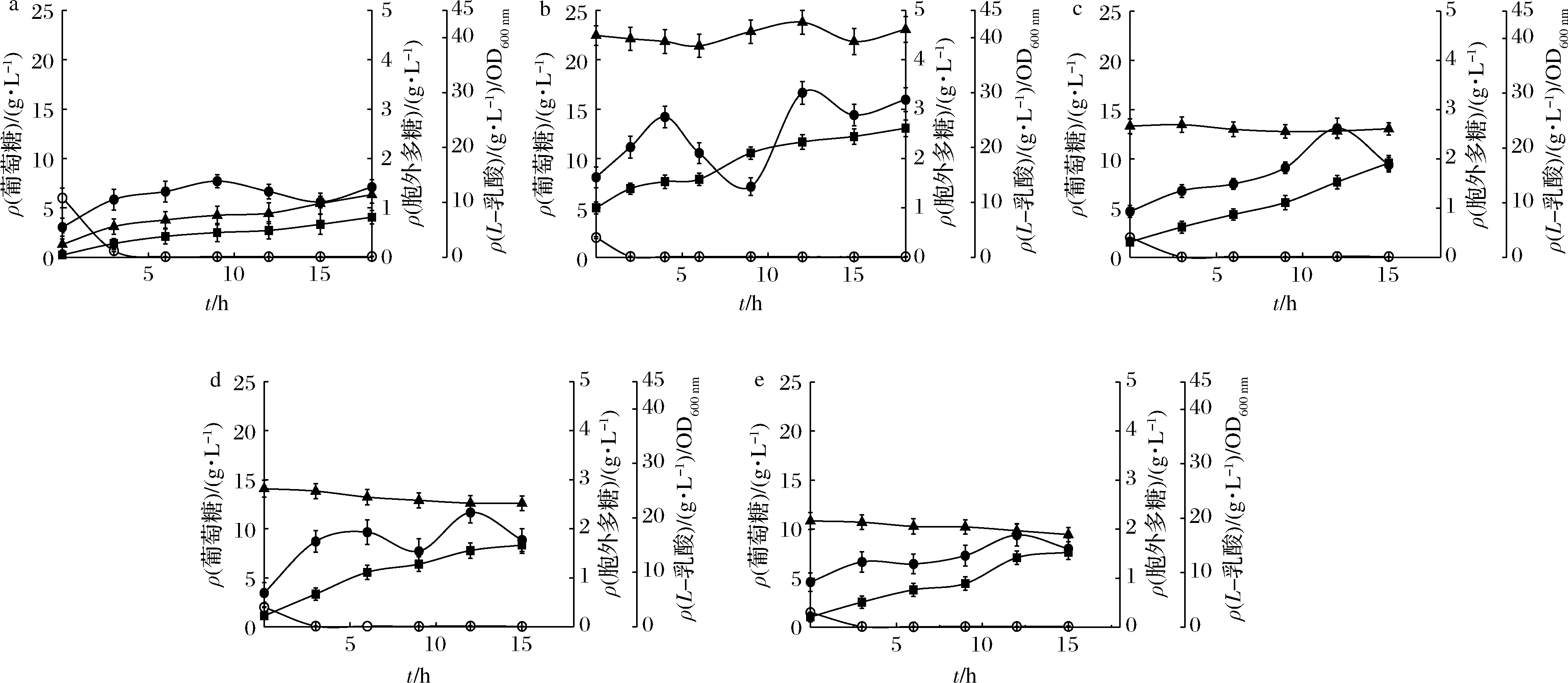
■-L-乳酸;●-EPS;○-葡萄糖;▲-OD600 nm a-常规发酵(回用批次#1);b~e -多次反复生物催化(#2~#5)
图4 使用基于pH-Stat葡萄糖流加法的反复生物催化时的发酵性能
Fig.4 EPS fermentation performance with pH-Stat strategy based repeated bio-catalysis
生物催化法发酵生产EPS需要较高浓度的初始细胞,每次都通过常规发酵获取所需细胞,增加了原料成本(使用昂贵的MRS培养基)。使用基于pH-Stat葡萄糖流加法的反复生物催化工艺生产EPS,提高了发酵自动化程度,5次连续回用EPS/X基本不变,细胞活性没有下降。如果将第一次常规发酵的装液量增大(反复回用批次#1,常规发酵),可提高细胞总量,则各反复生物催化批次的绝对EPS浓度仍可以保持在较高水平。但是由于本论文将常规发酵的装液量统一在2.2 L的水平上,故没有在更高初始装液量的条件下进行常规发酵操作。总之,使用基于pH-Stat葡萄糖流加法的反复生物催化工艺生产EPS,可以缩短发酵时间、缓解乳酸积累、简化配料和发酵操作过程,具有一定的实用性。
2.2.5 植物乳杆菌生产EPS的同时联产副产物DL-乳酸
利用L.plantarum发酵生产EPS的同时,还可联产副产物DL-乳酸。使用基于pH-Stat法流加葡萄糖浓缩液的发酵批次中,DL-乳酸积累虽然得到了一定程度的控制,DL-乳酸浓度(总乳酸浓度,表1)仍可维持在28~50 g/L的水平,但是,基于pH-Stat流加葡萄糖法的反复生物催化工艺得到的EPS性能指标较高,整体发酵性能的评价最终还取决于多糖浓度、多糖得率、乳酸浓度和发酵原料/操作成本之间的综合权衡(Trade-off)。
2.3 碳源控制和菌体累积提高EPS产率
EPS的合成是一个耗能的过程,合成前体糖核苷酸、磷酸化脂载体、聚合重复单元及转移输出集合体都需要能量,这些能量由糖酵解产生的ATP提供[22]。提高葡萄糖消耗,过量生产ATP可以有效地提高多糖的产量。菌体生长也需要耗费大量ATP,而使用生物催化法进行发酵时,初始菌体浓度高,虽然发酵过程细胞生长基本停止,但这可以节约大量的ATP,将其有效地利用于EPS合成途径。由图5可知,乳酸和EPS合成也在互相争夺和竞争葡萄糖的利用。使用基于pH-Stat葡萄糖流加法的反复生物催化策略进行EPS发酵,可以抑制乳酸积累,进而改善L.plantarum发酵生产的EPS产量和EPS对葡萄糖的得率。
2.4 规模发酵(罐发酵)所获EPS的结构、特性及其应用情况
本研究室前期的实验结果表明,EPS-R040是由半乳糖、葡萄糖、甘露糖和葡萄糖醛酸组成,其摩尔比为1.4∶9.4∶3.4∶1.0,包含68.9%的C、28.5%的O、2.3%的N、0.1%的S和0.3%的P。EPS表面上还带有孔(0.38 μm)或洞穴,表现出粗糙的多孔网络状结构,可极大增加与染料的接触面积,对印染废水中的主要色素物质MB有良好的吸附能力,最大吸附容

图5 L.plantarum发酵生产EPS时的乳酸/EPS代谢途径
Fig.5 Metabolic pathway of EPS and lactic acid in EPS fermentation by L.plantarum
量为163.1 mg/g。它还具有出色的脱附能力,循环使用3次并不会明显丧失吸附能力。在相同条件下(相同用量、相同温度、相同时间),EPS对MB的吸附能力分别是葡聚糖、黄原胶和结冷胶的12.5、2.2、3.2倍[23]。EPS还可以合成具有良好分散性和稳定性的E-SeNPs,其平均粒径为(45.17±11.9)nm、带负电荷(-31.3 mV)。同时,由于包覆作用,该E-SeNPs在水溶液中可稳定存在20 d。相同浓度下,E-SeNPs的还原力、ABTS阳离子自由基清除率都明显高于EPS和硒纳米颗粒(selenium nanoparticles,SeNPs),表现出良好的抗氧化活性[10]。
在相同用量条件下,本研究对使用基于pH-Stat葡萄糖流加法的反复生物催化策略进行EPS发酵时,所产EPS对MB的吸附能力与其他市售多糖(葡聚糖、黄原胶和结冷胶)的吸附能力进行了比较。使用不同多糖复配溶液吸附MB 24 h后,透析袋中的MB积聚图像如图6-a所示。植物乳杆菌L.plantarum所产EPS对MB的吸附量为135.1 mg/g,分别是葡聚糖、黄原胶和结冷胶吸附能力的6.9、1.6和2.0倍(图6-b)。与摇瓶条件下所产EPS对MB的吸附能力基本相同。用L.plantarum反复生物催化法所得EPS与SeNPs复配得到E-SeNPs,用透射电镜对其形态结构进行了观察分析。当不添加EPS时,形成的SeNPs(图6-c)不能分散成团簇。而用EPS复配得到的E-SeNPs具有均匀分散的球形结构(图6-d),平均粒径分布频率为(46.6±11.5)nm,表明EPS对SeNPs具有良好的分散和稳定作用,与摇瓶发酵所得EPS的结果基本一致。
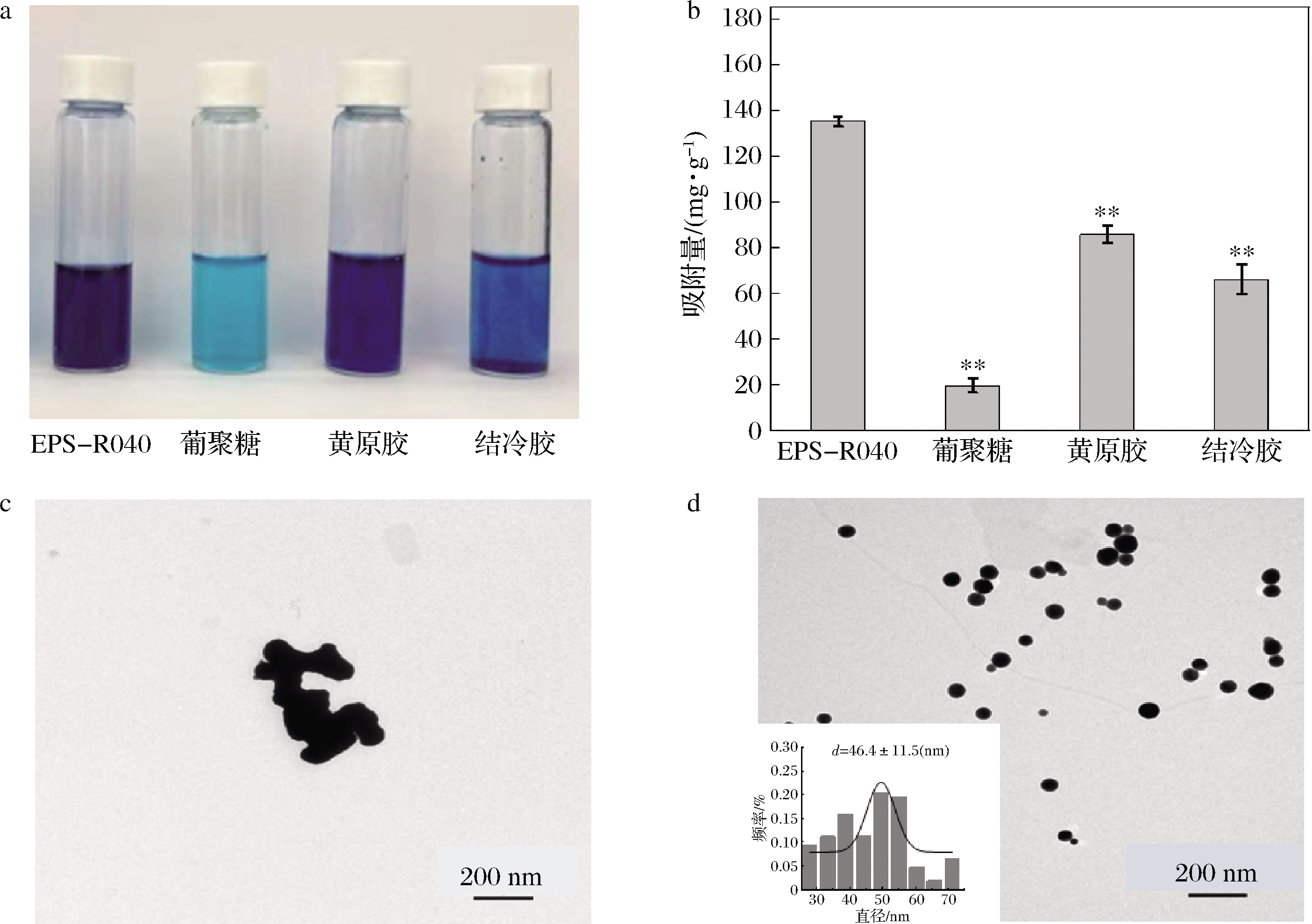
a-吸附24 h后,透析袋中MB的吸附图像;b-EPS-R040、葡聚糖、黄原胶、结冷胶对MB吸附量; c-SeNPs的透射电镜图;d-E-SeNPs的透射电镜图及粒径统计
图6 L.plantarum所产EPS对MB吸附能力及其复配硒纳米材料E-SeNPs的透射电镜结果
Fig.6 Adsorption of MB by EPS and TEM results of E-SeNPs
注:采用SPSS软件进行单因素方差分析,对葡聚糖、黄原胶、结冷胶的MB吸附量和EPS-R040的MB吸附量进行比较,P值分别为6.46×10-7, 4.64×10-5,5.75×10-5;*:P<0.01,代表葡聚糖、黄原胶、结冷胶对MB的吸附量和EPS-R040对MB的吸附量均存在极显著性差异
3 结论
对在5 L发酵罐条件下,利用植物乳杆菌L.plantarum高效生产功能性EPS,并对其应用进行了研究。使用基于pH-Stat自动流加葡萄糖法的反复生物催化策略进行EPS发酵的整体性能最佳。该策略可以提升EPS产量,省去昂贵的MRS培养基的使用,降低发酵的原料和操作成本,实现EPS的量产和发酵过程的自动化控制,改善了发酵过程的经济性。与摇瓶相比,发酵罐上量产所得EPS复配处理硒纳米材料、所得EPS-硒纳米溶液的均一性/稳定性、EPS对印染废水中有害物质色素的吸附能力基本不变。该策略还可联产40 g/L的DL-乳酸,从而实现发酵产品的多样性。
[1] 钟颜麟,彭志英,赵谋明.乳酸菌胞外多糖的研究[J].中国乳品工业,1999,27(4):7-10.
ZHONG Y L,PENG Z Y,ZHAO M M.The studies on exopolysaccharides produced by lactic acid bacteria[J].China Dairy Industry,1999,27(4):7-10.
[2] HUSSAIN A,ZIA K M,TABASUM S,et al.Blends and composites of exopolysaccharides;properties and applications:A review[J].International Journal of Biological Macromolecules,2017,94:10-27.
[3] BENGOA A A,LLAMAS M G,IRAPORDA C,et al.Impact of growth temperature on exopolysaccharide production and probiotic properties of Lactobacillus paracasei strains isolated from kefir grains[J].Food Microbiology,2018,69:212-218.
[4] DEGEEST B,VANINGELGEM F,DE VUYST L.Microbial physiology,fermentation kinetics,and process engineering of heteropolysaccharide production by lactic acid bacteria[J].International Dairy Journal,2001,11(9):747-757.
[5] 胡东良.乳酸菌的抗肿瘤、抗变异原及免疫增强作用[J].中国乳品工业,1997,25(6):9-12.
HU D L.The report on antitumour,antigenic variation and immunological enhancement of lactic acid bacteria[J].China Dairy Industry,1997,25(6):9-12
[6] YASUI H,KAN S D,MATSUZAKI T,et al.Immunomodulatory function of lactic acid bacteria[J].Antonie Van Leeuwenhoek,1999,76(1-4):383-389.
[7] DE VUYST L,DEGEEST B.Heteropolysaccharides from lactic acid bacteria[J].FEMS Microbiology Reviews,1999,23(2):153-177.
[8] 李全阳,夏文水.酸乳中乳酸菌所产胞外多糖特性的初步研究[J].食品科学,2004,25(2):80-84.
LI Q Y,XIA W S.Study on characteristics of exopolysaccharides produced by yoghurt lactic acid bacteria[J].Food Science,2004,25(2):80-84.
[9] 顾笑梅.乳酸菌产胞外多糖的研究[D].济南:山东大学,2003.
GU X M.Studies on excellular polysaccharide produced by lactic acid bacterium[D].Jinan:Shandong University,2003.
[10] 陈东,李程程,史仲平.植物乳杆菌胞外多糖包覆的高稳定性硒纳米颗粒的制备及其抗氧化活性的研究[J].中国生物工程杂志,2020,40(9):18-27.
CHEN D,LI C C,SHI Z P.Lactobacillus plantarum exopolysaccharide coated high-stable selenium nanoparticles and its antioxidant activity[J].China Biotechnology,2020,40(9):18-27.
[11] 王子朝,朱莉,吴剑荣,等.以甘油为底物发酵生产新型黄原胶[J].食品与生物技术学报,2018,37(10):1 028-1 034.
WANG Z C,ZHU L,WU J R,et al.Production of a new xanthan gum with glycerol as substrate[J].Journal of Food Science and Biotechnology,2018,37(10):1 028-1 034.
[12] 王姗杰,詹晓北,吴剑荣,等.低能氮离子注入诱变选育高产结冷胶菌株的研究[J].工业微生物,2010,40(2):20-24.
WANG S J,ZHAN X B,WU J R,et al.Breeding of gellan gum-producing bacteria by low energy N+ ion implantation[J].Industrial Microbiology,2010,40(2):20-24.
[13] 胡立涛,王阳,李佳莲,等.代谢工程改造谷氨酸棒杆菌合成透明质酸[J].食品与发酵工业,2020,46(18):1-7.
HU L T,WANG Y,LI J L,et al.Metabolic engineering of Corynebacterium glutamicum for hyaluronic acid production[J].Food and Fermentation Industries,2020,46(18):1-7.
[14] DE VUYST L,DE VIN F,VANINGELGEM F,et al.Recent developments in the biosynthesis and applications of heteropolysaccharides from lactic acid bacteria[J].International Dairy Journal,2001,11(9):687-707.
[15] MACEDO M G,LACROIX C,GARDNER N J,et al.Effect of medium supplementation on exopolysaccharide production by Lactobacillus rhamnosus RW-9595M in whey permeate[J].International Dairy Journal,2002,12(5):419-426.
[16] MAEDA H,ZHU X,SUZUKI S,et al.Structural characterization and biological activities of an exopolysaccharide kefiran produced by Lactobacillus kefiranofaciens WT-2B(T)[J].Journal of Agricultural and Food Chemistry,2004,52(17):5 533-5 538.
[17] MAEDA H,ZHU X,MITSUOKA T.New medium for the production of exopolysaccharide (OSKC) by Lactobacillus kefiranofaciens[J].Bioscience and Microflora,2003,22(2):45-50.
[18] 陈东.产胞外多糖乳杆菌筛选/鉴定、多糖应用和发酵工艺初步研究[D].无锡:江南大学,2021.
CHEN D.Preliminary study on screening/identification,applications of expolysaccharide and fermentation technology of expolysaccharide-producing Lactobacillus[D].Wuxi:Jiangnan University,2021.
[19] 朱化雷,高大成,孙启梅,等.原位分离技术应用于乳酸发酵的研究进展[J].当代化工,2020,49(9):1 969-1 972;2 032.
ZHU H L,GAO D C,SUN Q M,et al.Research progress in application of in situ separation technology in lactic acid fermentation[J].Contemporary Chemical Industry,2020,49(9):1 969-1972;2 032.
[20] YABANNAVAR V M,WANG D I C.Extractive fermentation for lactic acid production[J].Biotechnology and Bioengineering,1991,37(11):1 095-1 100.
[21] YABANNAVAR V M,WANG D I C.Bioreactor system with solvent extraction for organic acid productiona[J].Annals of the New York Academy of Sciences,1987,506(1):523-535.
[22] BADEL S,BERNARDI T,MICHAUD P.New perspectives for Lactobacilli exopolysaccharides[J].Biotechnology Advances,2011,29(1):54-66.
[23] LI C C,CHEN D,DING J,et al.A novel hetero-exopolysaccharide for the adsorption of methylene blue from aqueous solutions:Isotherm,kinetic,and mechanism studies[J].Journal of Cleaner Production,2020,265:121800.