食品包装是防止外界污染,减少食品不良反应的外部保护,相对于传统食品包装而言,活性包装是一种全新意义上的包装,是通过提高食品包装的功能以延长食品货架期或改善食品质量的包装技术[1-3]。向包装基质中添加天然的抗氧化活性物质,而不是直接添加到食品本身,可以减少活性物质的损失、增强使用效果[4]。
在食品包装领域,可降解类的生物基食品包装材料天然、安全、不造成环境污染,一直都是研究的热点。聚乳酸(polylactic acid,PLA)是一种应用较为广泛的生物基食品包装材料,可完全由玉米淀粉、土豆等可再生资源加工制成,在微生物的作用下被完全分解为水和CO2,具有良好的安全性、机械性能、生物相容性和较高的透明度[5-6]。以PLA为基质生产的食品包装具有出色的阻隔性,通常用于贮藏食物[7]。向基质中加入抗氧化物质[8]、抑菌物质[9],通过活性成分的释放控制食品中有害物质的生长,可以达到延长食品保质期的目的。
曲酸是由曲霉菌、醋酸杆菌等多种微生物经好氧发酵产生的一种弱酸性代谢物,它能通过螯合酶活性部位的Cu2+使酪氨酸酶失活从而抑制黑色素的形成[10]。曲酸安全无毒,对人体无刺激[11],作为一种抗生素,曲酸对大肠杆菌及金黄色葡萄球菌的生长具有一定的抑制作用[12]。刘波[13]通过研究发现曲酸对苹果汁的抗褐变效果优于抗坏血酸和柠檬酸,在较低的浓度下就能达到抑制苹果多酚氧化酶(polyphenol oxidase,PPO)活性的目的。LIU等[14]研究壳聚糖-曲酸复合膜发现,壳聚糖中加入曲酸后,薄膜的力学性能明显提高且具有显著的抗菌效果。吕艳芳等[15]研究不同浓度曲酸对蘑菇PPO的抑制作用,发现0.3 mmol/L的曲酸可以使蘑菇PPO活性降至原酶活性的7.12%。近年来,曲酸及其衍生物在化妆品和医药行业的研究与应用较为广泛,然而,将曲酸用于聚乳酸食品包装的研究却鲜有报道。
本文以曲酸为天然抗氧化剂添加到聚乳酸基材中,制备抗氧化的食品活性包装膜,探索曲酸对活性包装膜的物理性能、抗氧化性能、化学结构等的影响,以期为基于聚乳酸的新型食品活性包装膜的研发提供理论依据。
聚乳酸,宁波志展新材料有限公司;曲酸,济南允诚生物科技有限公司;三氯甲烷、无水乙醇、甲醇、无水氯化钙、氯化钠(均为分析纯),天津市凯通化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)(分析纯),华蓝化工科技有限公司;苹果,泰安市泰山区大润发超市。
AL204型电子天平,梅特勒-托利多仪器有限公司;0~25 mm螺旋测微器,南京苏测计量仪器有限公司;WSC-S色差仪,上海精密科学仪器有限公司;UV-5100B紫外分光光度计,上海元析仪器有限公司;SHB-Ⅲ型循环水式真空泵,郑州长城科技工贸有限公司;78-1磁力加热搅拌器,常州国华电器有限公司;IX73倒置荧光显微镜,日本奥林巴斯有限公司;Nicolet iS5型FTIR傅里叶红外光谱仪,赛默飞世尔科技有限公司;XLW拉伸试验机,济南兰光机电技术有限公司;JSM-6610扫描电子显微镜,日本电子株式会社。
1.3.1 曲酸抑制苹果汁褐变的实验设计
取新鲜苹果,洗净去皮后快速切分,液氮冷冻粉碎、装袋,置于冰箱中备用。取4支离心管,依次加入0.5 g苹果冻粉,再分别加入0、0.01、0.1和1 mg/mL曲酸,静置观察其颜色变化。
1.3.2 聚乳酸/曲酸膜的制备
参照ROY等[16]的方法并作适当修改,称取一定量的曲酸粉末,用无水乙醇溶解后得到曲酸溶液,将4 g聚乳酸颗粒溶于100 mL的三氯甲烷溶液中,并与曲酸溶液混合,室温下磁力搅拌1 h后得到适宜质量分数的聚乳酸/曲酸膜溶液。搅拌结束后将膜溶液转移至真空抽滤瓶中,借助真空泵将气泡除去后倒在提前调平的水平玻璃板上,于通风橱中室温干燥5~6 h后成膜,揭膜后放在干燥器中备用。成膜组分的配比设计如表1所示。
表1 聚乳酸/曲酸成膜组分配比
Table 1 Polylactic acid/kojic acid film forming component ratio

编号聚乳酸/%曲酸/%乙醇/mLCK400PK24210PK44420PK64630
注:将聚乳酸/曲酸复合膜命名为PK2,PK4,PK6(分别代表添加2%、4%、6%曲酸的复合膜),CK为对照(下同)
1.3.3 膜的厚度、颜色及不透明度测定
膜厚度的测定采用精度为0.001 mm的螺旋测微器,在膜上随机选取6个点测定,取平均值。
用WSC-S色差仪测定膜的颜色,白板作色差测定参比,每个处理重复测定6次,取其平均值,得到膜的L*、a*、b*。
不透明度的测定参照HU等[17]的方法,将薄膜切成矩形,置于比色皿内一侧,以空白比色皿为对照,使用紫外分光光度计测定其在600 nm处的吸光度值,按公式(1)计算不透明度:
O=A600/L
(1)
式中:O,不透明度;A600,薄膜在600 nm下的吸光度值;L,膜的厚度,mm。
1.3.4 膜的含水量、膨胀程度、水溶性、水蒸气透过率(water vapor permeability,WVP)的测定
参照孟文博等[18]的方法,将膜切成20 mm×20 mm的方形,记录膜的初始质量为m0。将切好的薄膜放入105 ℃的烘箱中干燥24 h后取出,冷却后称量,记录质量为m1,以[(m0-m1)/m0]×100表示膜的含水量。之后将薄膜分别放入30 mL的蒸馏水中,浸泡24 h后取出称重,记录为m2,以[(m2-m1)/m1]×100表示膜的膨胀度。最后再放入70 ℃的烘箱中干燥24 h,得到膜的最终质量,记为m3,膜的水溶性用[(m1-m3)/m1]×100表示,每个处理重复3次。
水蒸气透过率的测定参照LIAN等[19]的方法,将薄膜(60 mm×60 mm)固定在装有无水氯化钙的称量皿上,氯化钙与称量皿口的间隙小于6 mm,记录此时称量皿的质量m1。之后将称量皿放入装有饱和NaCl溶液的干燥器中,每隔24 h记录称量皿质量,直至前后2次之差<0.001 g,得到称量皿质量m2,每个处理重复3次。按公式(2)计算水蒸气透过率:
(2)
式中:m2-m1,通过膜的水的质量,g;L,膜的厚度,m;A,薄膜的有效面积,m2;t,时间,s;ΔP,薄膜两侧的水蒸气压差,Pa。
1.3.5 膜的力学性能测定
力学性能的测定参照GB/T 1040.3—2006《塑料 拉伸性能的测定 第3部分:薄膜和薄片的试验条件》的方法并适当调整。将样品切成15 mm×150 mm的矩形,在23 ℃、相对湿度为53%的条件下放置2 d,用XLW拉伸试验机测定膜的抗拉强度、断裂伸长率和弹性膜量,以10 mm/min的恒定速度进行拉伸直到膜断裂。
1.3.6 膜的抗氧化性能测试
参照彭勇等[20]的方法,将膜样品切成20 mm×20 mm的方形,在100 mL蒸馏水中放置1 h,取膜溶液1 mL与3 mL的DPPH甲醇溶液(150 μmol/L)混合,摇匀,以1 mL蒸馏水作为对照组,在25 ℃下的黑暗中反应30 min,用紫外分光光度计测定其在516 nm下的吸光度,按公式(3)计算DPPH自由基清除率:
DPPH自由基清除率![]()
(3)
式中:AS,样品的吸光值;AC,对照组的吸光值。
1.3.7 膜中曲酸的释放测定
参照LIAN等[19]的方法并适当调整,室温下将膜样品(20 mm×20 mm)浸泡在含有30 mL的蒸馏水中,每隔一段时间用移液枪吸取1 mL溶液和4 mL蒸馏水混合后放入离心管中,用紫外分光光度计测定其在269 nm处的吸光度,每个处理重复3次测定。实验前采用全波段扫描确定曲酸的最大吸收峰,并在此波长下测定溶液的吸光度,以某时间点曲酸的释放量占总释放量的百分比计算该时间点曲酸的释放率,并制作释放曲线。
1.3.8 膜的傅里叶红外光谱
参照YE等[21]的方法,并作适当调整。将膜切成20 mm×20 mm的方形,置于干燥器中干燥2周后取出,采用傅里叶变换红外光谱仪的全反射模式进行红外扫描。光谱分辨率为4 cm-1,在4 000~650 cm-1扫描32次。
1.3.9 膜的表面形态与截面结构
将薄膜用双面胶固定于载玻片上,使用IX73倒置荧光显微镜观察膜的表面形态,调整适当的焦距和光源强度观察并拍照记录。
将薄膜样品干燥后在液氮中淬裂,适宜大小的膜粘贴在金属板上,将淬裂的截面进行喷金处理,使用扫描电镜在15 kV的电压下放大1 000倍进行观察。
结果以平均值±标准差表示,所有数据采用SPSS 22.0软件中ANOVA程序的Duncan法进行分析,P<0.05为差异显著。
不同浓度的曲酸对苹果汁褐变的影响见图1,可以看出,不添加曲酸的对照组褐变现象最为严重,加入曲酸的苹果汁液颜色明显变淡,曲酸浓度越高抑制效果越好,当曲酸含量达到1 mg/mL时,能明显抑制苹果汁的褐变。苹果汁发生褐变的主要因素是多酚氧化酶,而曲酸可以竞争性抑制PPO活性,螯合Cu2+以及还原形成黑色素的底物醌类化合物[22],此外,曲酸还可以清除一定量的氧自由基来阻止酶促反应中对氧的吸收从而抑制褐变的发生[13]。

图1 曲酸浓度对苹果冻粉褐变的影响
Fig.1 Effect of kojic acid concentration on browning of apple frozen powder
膜的厚度与构成薄膜的组成成分和物质含量有关[17],如表2所示,未添加曲酸的纯PLA膜厚度最小,加入2%的曲酸后,膜的厚度略有增加,但无显著差异。添加4%和6%曲酸的薄膜厚度显著增加,PK4膜的厚度比纯PLA膜增加了9.11%,PK6膜比纯PLA膜增加了18.24%,膜厚度的增加可能是聚乳酸与曲酸相互作用的结果[14]。
薄膜的颜色可以影响消费者对产品的选择和认可,对照组纯聚乳酸膜的L*、a*、b*值分别为92.93、0.04、3.29。加入曲酸后,复合膜与纯聚乳酸膜相比都表现为L*、a*值降低,b*值显著增加,即亮度下降、黄色增加,这与LIU等[14]将曲酸添加到壳聚糖膜的结果相似。但PK6薄膜的b*值更大,达到31.23,表明高浓度的曲酸会造成聚乳酸膜颜色的明显变化。
薄膜具有一定的遮光性能可以减轻外界光照及辐射对食品产生不良影响,所以不透明度是决定食品质量的一个重要指标[17]。由表2可以看出,加入曲酸后,薄膜的不透明度降低,其中PK4和PK6处理组分别比对照组下降了5.40%和9.61%,不透明度的差异主要与膜的内部结构有关[23]。
表2 曲酸浓度对聚乳酸膜厚度、颜色及不透明度的影响
Table 2 Effect of kojic acid concentration on thickness, color and opacity of polylactide film
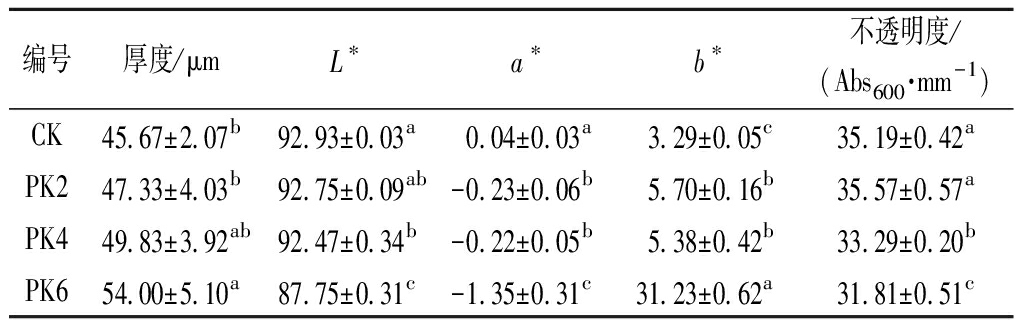
编号厚度/μmL∗a∗b∗不透明度/(Abs600·mm-1)CK45.67±2.07b92.93±0.03a0.04±0.03a3.29±0.05c35.19±0.42aPK247.33±4.03b92.75±0.09ab-0.23±0.06b5.70±0.16b35.57±0.57aPK449.83±3.92ab92.47±0.34b-0.22±0.05b5.38±0.42b33.29±0.20bPK654.00±5.10a87.75±0.31c-1.35±0.31c31.23±0.62a31.81±0.51c
如表3所示,纯PLA膜的含水量最低,为9.51%,随着曲酸浓度的增加,含水量逐渐上升,各处理间差异显著,复合膜含水量增加的原因可能与曲酸的加入使复合膜形成了更多的氢键有关[7]。膨胀度和水溶性取决于膜中氢键的增减、氨基或羧基的离子化及膜结构的再松弛,反映了薄膜对外界水分的抵制能力[19,23],表3中PK2膜的膨胀度最大,为10.38%,而PK6膜的膨胀度最小,两者差异显著,这可能由于少量的曲酸干扰了聚乳酸膜的氢键作用,但过量的曲酸重排了复合膜的氢键,使得复合膜抵制水分的能力增强。
食品包装膜能有效地避免食品与周围环境的水分转移,防止食品中水分的流失,从而保持较长的货架期,这要求薄膜的WVP应尽可能低[17]。由表3可知,对照组纯PLA膜的WVP最高,加入曲酸后,薄膜的WVP显著下降,WVP的下降可能是PLA与曲酸结合后导致亲水基团减少,从而限制了水分子的移动所致。
表3 膜的含水量、膨胀度、水溶性和水蒸气透过率
Table 3 Water content,swelling degree,water solubility and water vapor permeability of films
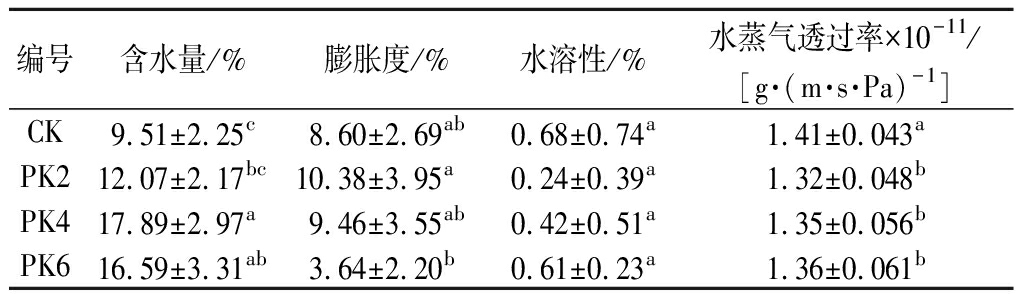
编号含水量/%膨胀度/%水溶性/%水蒸气透过率×10-11/[g·(m·s·Pa)-1]CK9.51±2.25c8.60±2.69ab0.68±0.74a1.41±0.043aPK212.07±2.17bc10.38±3.95a0.24±0.39a1.32±0.048bPK417.89±2.97a9.46±3.55ab0.42±0.51a1.35±0.056bPK616.59±3.31ab3.64±2.20b0.61±0.23a1.36±0.061b
一定的延展性和适当的机械强度是生物基可降解薄膜在运输过程中保持完整性和阻隔性的关键[14]。图2和图3显示了薄膜的抗拉强度、断裂伸长率及弹性模量。
由图2、3所示,对照膜的拉伸强度为18.99 MPa,断裂伸长率为16.97%,弹性膜量为1 468.29 MPa,具有一定的脆性。PK2膜的抗拉强度与弹性膜量较对照膜差异不大,这可能取决于曲酸在PLA基质中良好的分散性。而PK4膜和PK6膜的抗拉强度较对照膜显著增加,这可能是因为PLA基质与曲酸发生了分子间的强相互作用。与对照膜相比,PK4膜和PK6膜的弹性膜量也显著增加。薄膜的断裂伸长率随着曲酸浓度的增加而逐渐增加,这与在壳聚糖膜中添加曲酸[14]和在聚乳酸膜中添加木质素[6]的效果类似,表明曲酸增加了分子链的移动性。
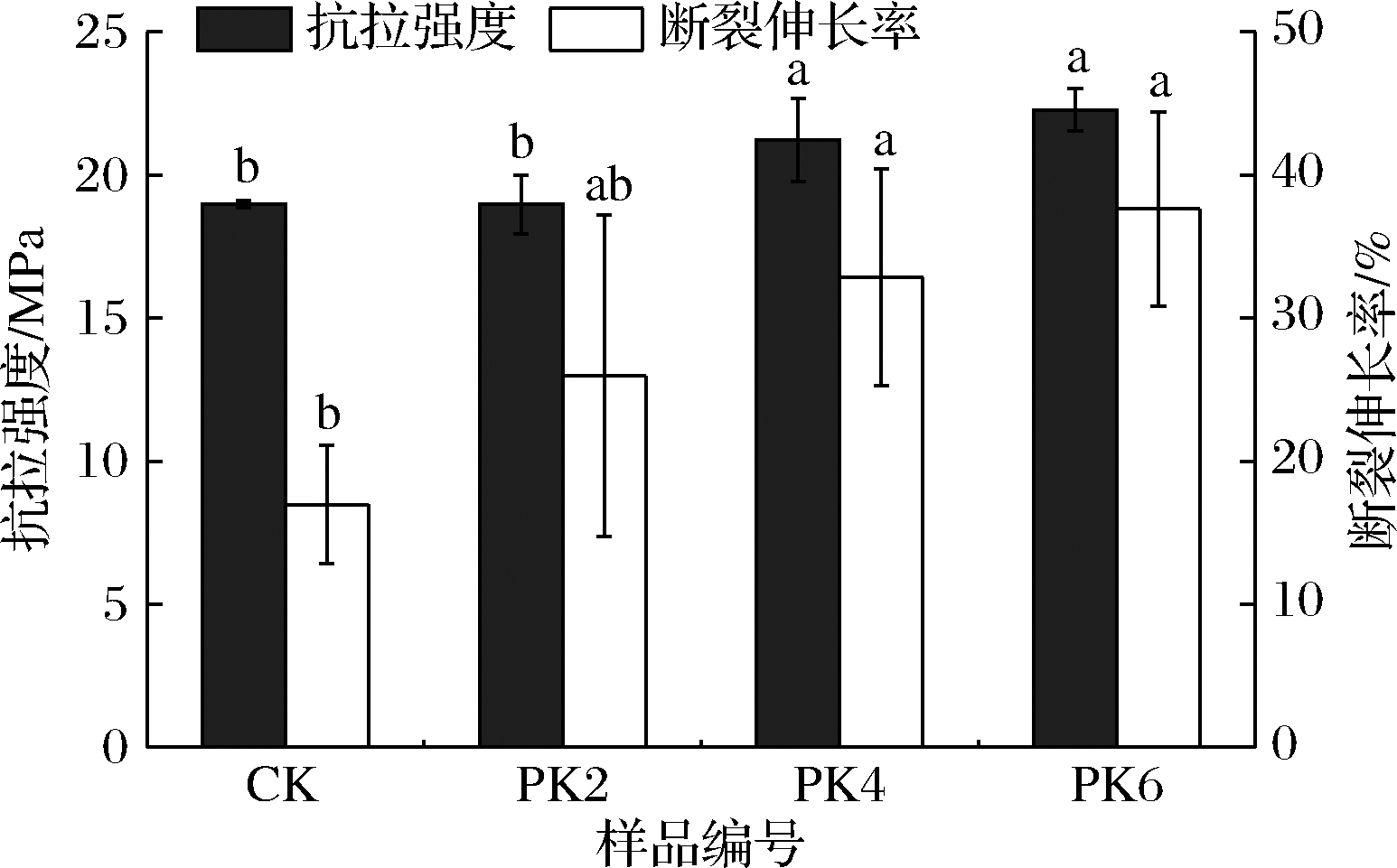
图2 曲酸浓度对薄膜抗拉强度和断裂伸长率的影响
Fig.2 Effect of kojic acid concentration on tensile strength and elongation at break of films
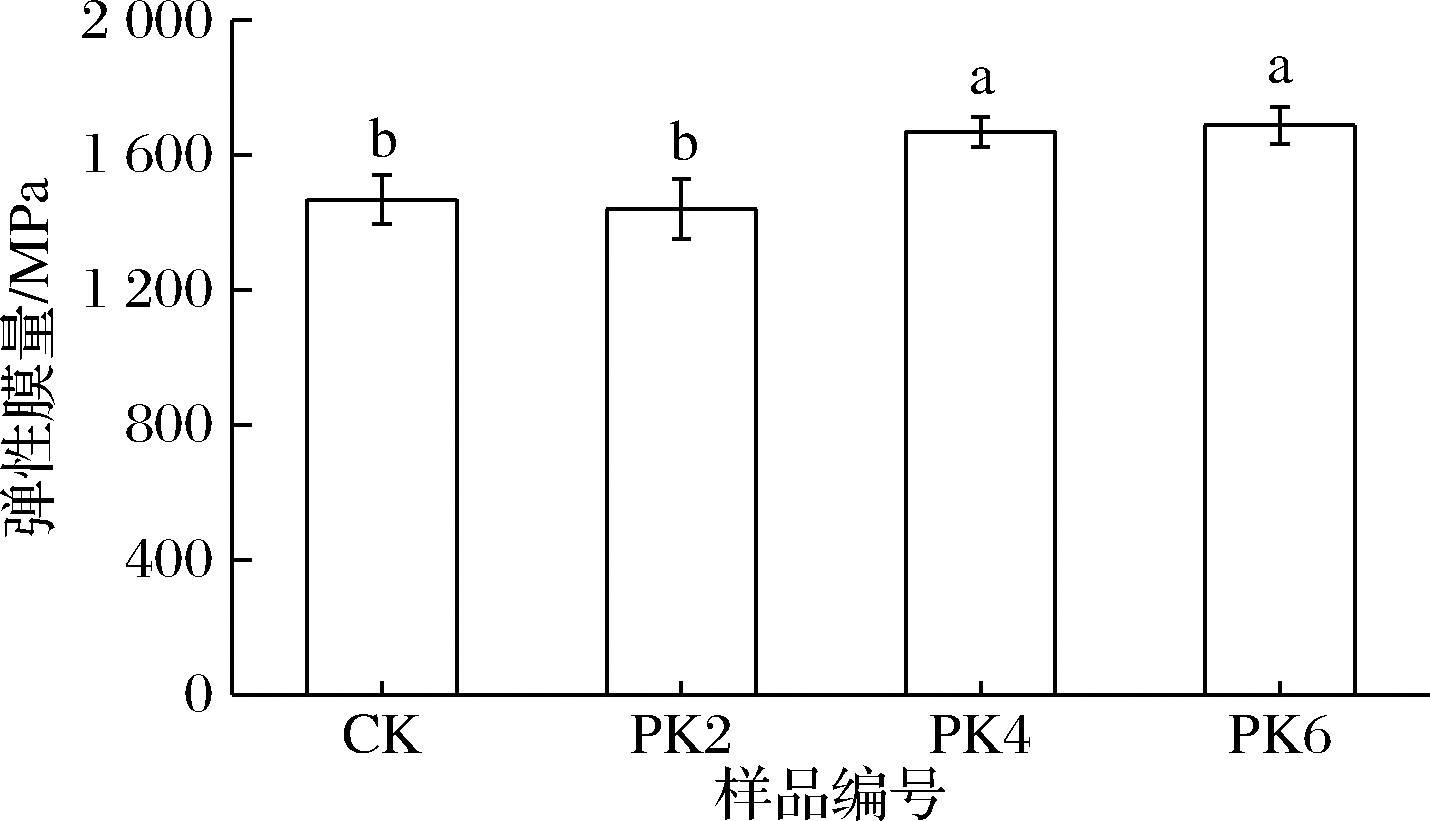
图3 膜的弹性膜量
Fig.3 Elasticity of films
由图4可以看出,样品的DPPH自由基清除率与薄膜中曲酸的浓度呈正比关系,纯PLA膜抗氧化能力极低,几乎检测不到,随着曲酸浓度的增加,薄膜的DPPH自由基清除率显著上升,曲酸浓度为4%和6%时分别达到51.75%和64.21%,抗氧化性的提高与薄膜中曲酸的释放有关。
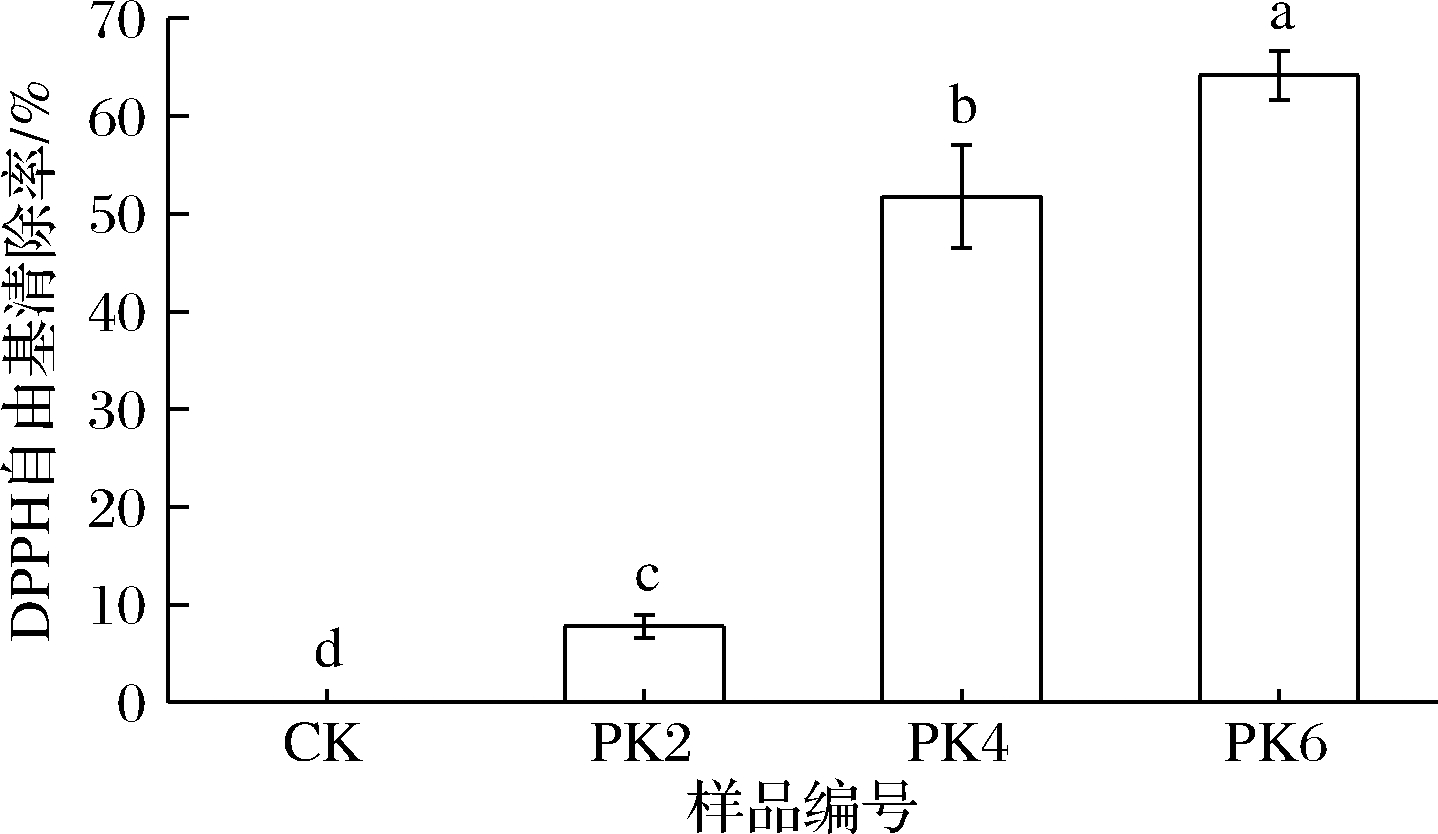
图4 曲酸浓度不同的薄膜的自由基清除率
Fig.4 Free radical scavenging rate of kojic acid films with different concentrations
如图5所示,所有处理组中曲酸的释放呈现先快后慢的趋势,在0.5 h内释放较快,而后释放变慢(由于对照膜中没有检测到曲酸,作图时未列出),这与百里香、姜黄素及其他抗氧化成分在聚乳酸膜中的释放规律是相似的[4,16]。从3个浓度的曲酸处理比较来看,PK2膜中曲酸的释放速率最慢,在0.5 h时PK2处理组释放率达到57.13%,随着膜中曲酸浓度的增加,其释放速率逐渐增加,但PK4和PK6膜的释放率差异并不明显。复合膜中活性物质的释放可能与膜在蒸馏水中的溶解、膨胀以及膜的成分组成、氢键数量、功能基团相互作用有关[19]。所有处理的释放速率均呈现先快后慢的趋势,这可能是因为膜刚浸入蒸馏水时,膜表面的曲酸直接溶解在蒸馏水中,导致前期检测到的曲酸释放速率快;中后期曲酸的释放速率逐渐变慢,可能是由于复合膜的溶胀,内部的曲酸逐步迁移造成的,姜黄素构建的聚乳酸复合膜在蒸馏水中也表现出类似的释放规律[16]。
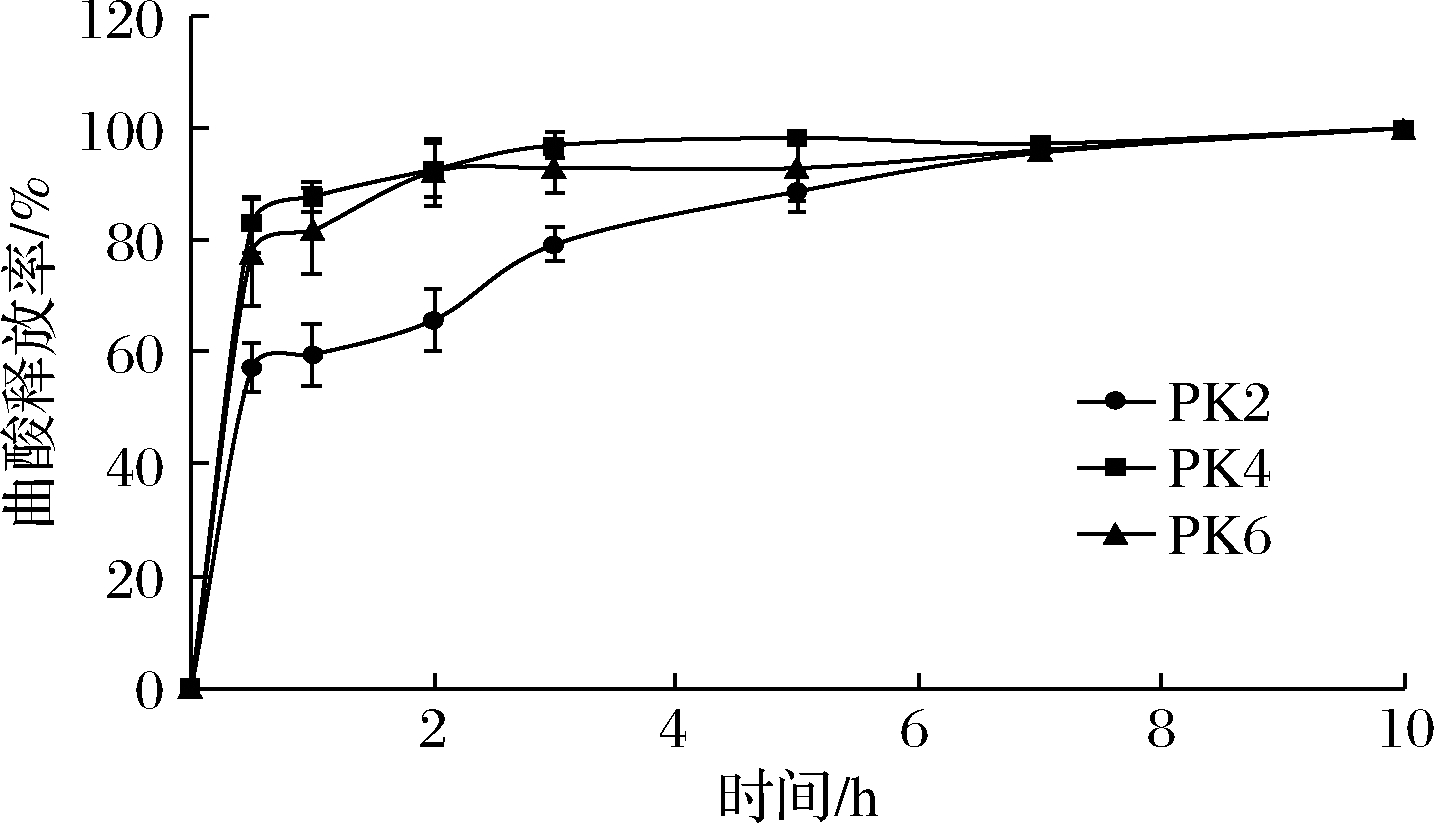
图5 不同复合膜中曲酸在蒸馏水中的释放结果
Fig.5 Release rate of kojic acid from different composite membranes in distilled water
由图6可以看出,纯PLA膜在794、871 cm-1处的峰是由C—C伸缩振动所致[21],在1 030 cm-1处的峰是由于C—O—C醚键的反对称伸缩振动,1 180和1 260 cm-1处的峰归因于酯基的C—O—C伸缩振动[24],在1 390、1 450 cm-1处的峰代表着—CH3的对称和不对称变形振动[16],在1 750 cm-1处出现的PLA膜的特征峰与C![]() O的伸缩振动有关[9],在2 990和2 920 cm-1处的峰分别对应着饱和碳氢化合物—CH3基团的反对称和对称伸缩振动区域[24]。
O的伸缩振动有关[9],在2 990和2 920 cm-1处的峰分别对应着饱和碳氢化合物—CH3基团的反对称和对称伸缩振动区域[24]。
加入曲酸后,分子间的相互作用改变,曲酸被结合到PLA基质中,特征峰发生变化,薄膜在1 180、1 260 cm-1处的峰值逐渐变弱。此外,PK2和PK4膜在794、871 cm-1处的峰值增强,这是PLA基质中分子重排造成的[7]。复合膜在1 750 cm-1处的峰值减弱,PK4和PK6薄膜的峰值显著降低,这表明C![]() O的伸缩振动受到显著抑制,分子间的相互作用增强[7]。除了峰强度的变化,因曲酸和PLA基质结合产生了新的化学键,也导致了新峰的出现。与其他薄膜相比,PK4膜在1 650 cm-1处出现新的C
O的伸缩振动受到显著抑制,分子间的相互作用增强[7]。除了峰强度的变化,因曲酸和PLA基质结合产生了新的化学键,也导致了新峰的出现。与其他薄膜相比,PK4膜在1 650 cm-1处出现新的C![]() C双键的特征峰,在942 cm-1处出现的峰值代表—OH的面外摇摆振动,在3 140 cm-1处附近出现的宽峰代表—OH基团的伸缩振动,1 580 cm-1代表—NH2的剪式振动,在1 600 cm-1处还能观察到苯环骨架伸缩振动。当曲酸浓度继续增大到6%时,薄膜的峰数量减少,但在1 030、1 750 cm-1等多处的峰值略有增强,表明高浓度的曲酸重排了膜的结构。整体来看,4%曲酸与PLA基质形成的C
C双键的特征峰,在942 cm-1处出现的峰值代表—OH的面外摇摆振动,在3 140 cm-1处附近出现的宽峰代表—OH基团的伸缩振动,1 580 cm-1代表—NH2的剪式振动,在1 600 cm-1处还能观察到苯环骨架伸缩振动。当曲酸浓度继续增大到6%时,薄膜的峰数量减少,但在1 030、1 750 cm-1等多处的峰值略有增强,表明高浓度的曲酸重排了膜的结构。整体来看,4%曲酸与PLA基质形成的C![]() C双键等新的化学键使PK4薄膜形成了独特的内部结构与表面形态。
C双键等新的化学键使PK4薄膜形成了独特的内部结构与表面形态。

图6 曲酸浓度不同的薄膜的傅里叶红外光谱图
Fig.6 FTIR spectra of kojic acid films with different concentrations
图7显示了含不同浓度曲酸的聚乳酸薄膜的表面和截面形态,通过IX73倒置荧光显微镜可以观察到,纯PLA膜的表面光滑、平整,而加入2%的曲酸后,薄膜表面变得粗糙,有明显的颗粒状结构,曲酸均匀地分布在PLA基质中;当曲酸浓度为4%和6%时,薄膜的表面外观发生显著变化,PK4膜表面可以观察到明显的波纹,PK6膜的表面纹理减少,这可能与曲酸和PLA基质的相互作用有关。
从截面图中也可以看出,对照的聚乳酸膜截面结构致密均匀、无裂纹,有蜂窝状孔隙,这与PHAECHAMUD等[25]对聚乳酸结构的研究结果是相似的,聚乳酸做成的薄膜会通过分子链交联形成网络结构。当加入曲酸时,膜的结构不再均匀一致,随着曲酸浓度的增加,膜的孔隙减少,膜更致密紧凑,颗粒状明显。ROY等[16]研究表明曲酸的官能团可与壳聚糖的羟基和氨基相互作用,从而影响膜的结构,本实验也表明曲酸可以通过分子间相互作用影响聚乳酸膜的微观结构。
曲酸对苹果汁液的褐变具有一定的抑制作用,1 mg/mL的曲酸就可以观察出明显的效果。膜溶液中加入曲酸后显著提高了复合膜的DPPH自由基清除率,抗氧化能力显著提高。由于曲酸本身颜色及复合膜内部结构的影响,膜的不透明度、亮度下降,黄色显著增加。4%和6%曲酸可以使复合膜的膨胀度及WVP同时降低。与纯PLA膜和加入2%曲酸的复合膜相比,4%和6%曲酸使膜的抗拉强度、断裂伸长率及弹性膜量同时增加,提高了膜的力学性能。此外,加入曲酸后薄膜在1 750 cm-1处的峰值减弱,表明分子间的相互作用增强,4%曲酸使薄膜产生了新的化学键,增强了复合膜组分分子链之间的相互作用,导致复合膜表面出现明显的波纹,表现出明显的曲酸浓度响应,但曲酸和PLA基质的作用机理还有待进一步研究。
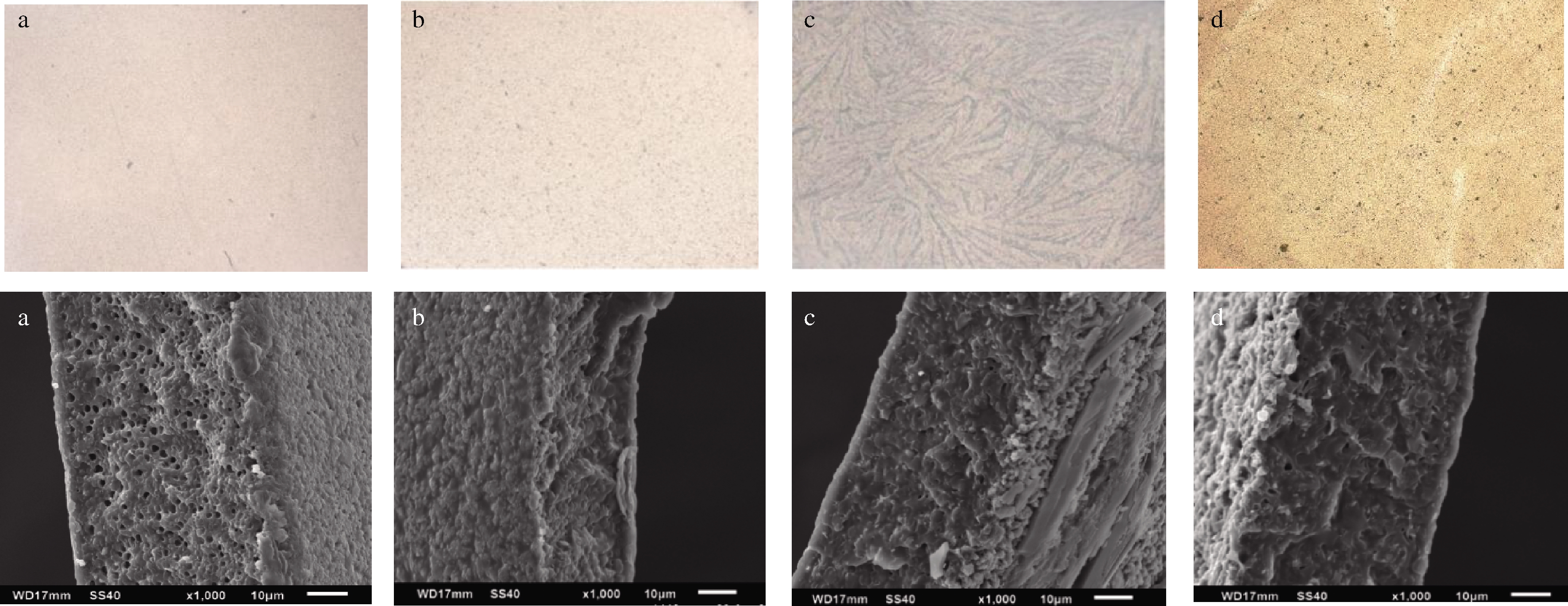
a-CK;b-PK2;c-PK4;d-PK6
注:上图,薄膜的表面形态;下图,截面结构
图7 曲酸浓度不同的薄膜的表面形态和截面结构
Fig.7 Surface morphology and cross section structure of films with different kojic acid concentration
[1] 贺琛,王臻,梅婷,等.食品活性包装研究的进展与趋势[J].包装与食品机械,2011,29(3):40-44.
HE C,WANG Z,MEI T,et al.The recent research and trend of food active package[J].Packaging and Food Machinery,2011,29 (3):40-44.
[2] 侯晓阳.新型食品包装材料的发展概况及趋势[J].食品安全质量检测学报,2018,9(24):6 400-6 405.
HOU X Y.Development and tendency of novel food packaging materials[J].Journal of Food Safety & Quality,2018,9(24):6 400-6 405.
[3] G MEZ-ESTACA J,L
MEZ-ESTACA J,L PEZ-DE-DICASTILLO C,HERN
PEZ-DE-DICASTILLO C,HERN NDEZ-MU
NDEZ-MU OZ P,et al.Advances in antioxidant active food packaging[J].Trends in Food Science & Technology,2014,35(1):42-51.
OZ P,et al.Advances in antioxidant active food packaging[J].Trends in Food Science & Technology,2014,35(1):42-51.
[4] LUKIC I,VULIC J,IVANOVIC J.Antioxidant activity of PLA/PCL films loaded with thymol and/or carvacrol using scCO2 for active food packaging[J].Food Packaging and Shelf Life,2020,26:100 578.
[5] ZHOU H J,KAWAMURA S,KOSEKI S,et al.Comparative quality changes of fresh-cut melon in bio-based and petroleum-based plastic containers during storage[J].Environment Control in Biology,2016,54(2):93-99.
[6] YANG W J,WENG Y X,PUGLIA D B,et al.Poly(lactic acid)/lignin films with enhanced toughness and anti-oxidation performance for active food packaging[J].International Journal of Biological Macromolecules,2020,144:102-110.
[7] MOHAMAD N,MAZLAN M M,TAWAKKAL I S M A,et al.Development of active agents filled polylactic acid films for food packaging application[J].International Journal of Biological Macromolecules,2020,163:1 451-1 457.
[8] MELO P E F,SILVA A P M,MARQUES F P,et al.Antioxidant films from mango kernel components[J].Food Hydrocolloids,2019,95:487-495.
[9] ZHANG L Y,HUANG C X,XU Y F,et al.Synthesis and characterization of antibacterial polylactic acid film incorporated with cinnamaldehyde inclusions for fruit packaging[J].International Journal of Biological Macromolecules,2020,164:4 547-4 555.
[10] 张婷婷,蒲云峰,王雷,等.曲酸、抗坏血酸及柠檬酸对鲜切苹果褐变的影响[J].中国食品学报,2020,20(3):188-194.
ZHANG T T,PU Y F,WANG L,et al.Effect of kojic acid,ascorbic acid and citric acid on the browning of fresh cut apple[J].Journal of Chinese Institute of Food Science and Technology,2020,20 (3):188-194.
[11] 刘晓丽,夏文水.壳寡糖-O-曲酸聚合物的理化性质及抗氧化活性研究[J].食品科学技术学报,2020,38(5):31-40.
LIU X L,XIA W S.Studies on physico-chemical properties and antioxidant activities of chitosan oligosaccharide-O-kojic acid polymers[J].Journal of Food Science and Technology,2020,38 (5):31-40.
[12] EMAMI S,GHAFOURI E,FARAMARZI M A,et al.Mannich bases of 7-piperazinylquinolones and kojic acid derivatives:Synthesis,in vitro antibacterial activity and in silico study[J].European Journal of Medicinal Chemistry,2013,68(12):185-191.
[13] 刘波.曲酸对苹果汁酶促褐变抑制作用的研究[J].四川食品与发酵,2007,43(5):39-41.
LIU B.Study on the kojic acid’s inhibition to the enzymatic browning in apple juice[J].Sichuan Food and Fermentation,2007,43(5):39-41.
[14] LIU X L,XU Y X,ZHAN X B,et al.Development and properties of new kojic acid and chitosan composite biodegradable films for active packaging materials[J].International Journal of Biological Macromolecules,2020,144:483-490.
[15] 吕艳芳,陈培丽,李颖畅,等.曲酸对蘑菇多酚氧化酶的抑制作用[J].中国食品学报,2017,17(4):30-36.
LYU Y F,CHEN P L,LI Y C,et al.Inhibitory effect of kojic acid on mushroom polyphenol oxidases[J].Journal of Chinese Institute of Food Science and Technology,2017,17 (4):30-36.
[16] ROY S,RHIM J W.Preparation of bioactive functional poly(lactic acid)/curcumin composite film for food packaging application[J].International Journal of Biological Macromolecules,2020,162:1 780-1 789.
[17] HU F,SUN T,XIE J,et al.Functional properties of chitosan films with conjugated or incorporated salicylic acid[J].Journal of Molecular Structure,2021,1223:129237.
[18] 孟文博,连欢,赵翰卿,等.复配乳化剂HLB值对壳聚糖精油复合膜物理和结构性能的影响[J].食品研究与开发,2021,42(1):42-47.
MENG W B,LIAN H,ZHAO H Q,et al.Effect of compound emulsifier HLB value on physical and structural properties of chitosan-essential oil composite films[J].Food Research and Development,2021,42(1):42-47.
[19] LIAN H,SHI J Y,ZHANG X Y,et al.Effect of the added polysaccharide on the release of thyme essential oil and structure properties of chitosan based film[J].Food Packaging and Shelf Life,2020,23:100467.
[20] 彭勇,李云飞,项凯翔.绿茶多酚提高壳聚糖包装膜的抗氧化性能[J].农业工程学报,2013,29(14):269-276.
PENG Y,LI Y F,XIANG K X.Adding green tea polyphenols enhances antioxidant of chitosan film[J].Transactions of the Chinese Society of Agricultural Engineering,2013,29 (14):269-276.
[21] YE J S,WANG S Y,LAN W J,et al.Preparation and properties of polylactic acid-tea polyphenol-chitosan composite membranes[J].International Journal of Biological Macromolecules,2018,117:632-639.
[22] 孙蕊,郭蓓,李慧,等.曲酸对鲜切山药色泽及相关生理变化的影响[J].中国食品学报,2014,14(1):184-191.
SUN R,GUO B,LI H,et al.Role of kojic acid in color related physiological parameters in fresh-cut Chinese yam[J].Journal of Chinese Institute of Food Science and Technology,2014,14 (1):184-191.
[23] 彭勇. 可食性壳聚糖活性包装膜成膜组分研究[D].上海:上海交通大学,2014.
PENG Y.Study on the critical components of active chitosan-based edible packaging films[D].Shanghai:Shanghai Jiao Tong University,2014.
[24] MORACZEWSKI K,PAW OWSKA
OWSKA ![]() M,et al.Plant extracts as natural additives for environmentally friendly polylactide films[J].Food Packaging and Shelf Life,2020,26:100 593.
M,et al.Plant extracts as natural additives for environmentally friendly polylactide films[J].Food Packaging and Shelf Life,2020,26:100 593.
[25] PHAECHAMUD T,CHITRATTHA S.Pore formation mechanism of porous poly(DL-lactic acid) matrix membrane[J].Materials Science and Engineering C,2016,61:744-752.