黄瓜(Cucumis sativus L.)属于葫芦科,是一年生的藤本植物或攀缘植物。黄瓜富含蛋白质、糖、维生素、矿物质和其他营养素,水分含量高达98%,是一种非常有价值的果蔬。研究发现低温贮藏结合贮前热处理技术可以延长黄瓜果实货架期[1-2],但黄瓜属于典型的冷敏性果蔬,临界贮藏温度约为10 ℃[3],极易受到低温胁迫。当其受到低温胁迫时,只有转移到室温下放置一段时间才会出现可见性冷害[4],多表现为表面点蚀,出现水斑或鳞状凹陷,进而出现组织塌陷、腐烂等[5-6]。另外,很多研究表明,低温逆境下果蔬发生冷害现象以及果体软化等与细胞壁代谢相关[7-8]。
热处理因无毒无害,成本低,能够有效减轻采后果蔬冷害、病害等问题,已经得到许多研究学者的认可。研究表明冷害的减轻与细胞壁组分及其水解酶活性变化有关[9]。赵云峰等[10]将“福眼”龙眼果实浸入50 ℃热水处理10 min,结果发现与未经热水处理的对照果实相比,热处理显著抑制了龙眼果实果肉自溶现象,降低了果胶甲酯酶(pectin methylesterase,PME)、多聚半乳糖醛酸酶(poly-galacturonase,PG)、纤维素酶(cellulase,Cx)、β-半乳糖苷酶(β-galactosidase,β-Gal)的活性,延缓了水溶性果胶含量的上升和离子结合型、共价结合型果胶以及纤维素、半纤维素含量的下降。邓佳等[11]发现50 ℃热水浸泡“里约红”葡萄柚5 min可以抑制细胞壁水解酶活性和水溶性果胶的上升,从而减轻果实冷害,维持果实更高的硬度。沈丽雯等[12]用42 ℃热水处理“金田208” 黄瓜10 min,于(2±1)℃下贮藏。结果发现,与对照组相比,热处理可以显著降低黄瓜果实冷害指数,抑制PME、PG、Cx和β-葡萄糖苷酶活性的上升,延缓果胶和纤维素含量的下降。
现阶段,热处理作为贮前预处理技术应用于采后果蔬来减轻低温贮藏冷害已有较多研究[1-2,13],但是针对不同低温贮藏时间采取统一的热处理手段,不仅会造成人力物力浪费而且可能难以达到最好的热处理效果,为此,若能根据实际货架期的长短来选择适宜的贮后热处理技术来减轻低温胁迫对果蔬的伤害,将会为果蔬种植户以及商超带来较大的经济效益。基于此,本实验以典型冷敏果蔬“申青”黄瓜为试材,在前期研究基础上,探究梯度热水处理对不同低温贮后时间的黄瓜细胞壁代谢的影响,旨在从细胞壁代谢角度探索梯度热水处理减轻贮后黄瓜冷害的机理,同时为梯度热水处理在果蔬保鲜方面的应用提供参考。
1 材料与方法
1.1 材料
“申青”黄瓜于2020年9月采购自上海市南汇新城镇果蔬种植园,当天送到实验室。实验用的黄瓜均达到商业成熟阶段,平均长度为(27±1) cm,直径为(3.5±0.5) cm,单根果实的质量为(180±20)g,无明显机械损伤。
A140-1-1果胶酶试剂盒、A138-1-1纤维素酶试剂盒,中国南京建成生物工程研究所;BC2560 β-葡萄糖苷酶试剂盒,北京索莱宝科技有限公司。
1.2 仪器与设备
BJ2100D数字孔式电子天平,台湾精达电子仪器有限公司;HSWX-600BS电热恒温水温箱,上海圣科仪器设备有限公司;GY4-1数显式水果硬度测试仪,浙江托普仪器有限公司;H1850R台式高速冷冻离心机,湖南湘仪离心机仪器有限公司;UV-7504紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.3 实验方法
1.3.1 样品处理
180根新鲜黄瓜随机分为3组,每组又分为4个亚组。标记后,将所有黄瓜放入厚度为0.02 mm,有6个平均分布小孔(直径10 mm)的聚乙烯薄膜袋中,每袋放入3根黄瓜。在温度(4±0.5)℃,湿度(80±5)%的冷藏条件下贮藏2、4、6 d,随后进行不同梯度热水处理(依次进行TG10:14 ℃,4 min;24 ℃,4 min;34 ℃,4 min;44 ℃,4 min浸泡处理;TG20:24 ℃,8 min;44 ℃,8 min浸泡处理;TG40:黄瓜在44 ℃下浸泡16 min),对照组不做热水处理。将黄瓜放在干净的工作台上,风干2 h,直到表面干燥后转移到观察架上储存。模拟货架期[(20±1) ℃,湿度为(50±5%)] 3 d后进行指标测定,每次测定从每个处理组随机取12根黄瓜计算冷害指数,3根黄瓜果实用来测定其他指标,每个指标重复3次。
1.3.2 冷害指数的测定
冷害指数的测定参考王静等[14]的评价方法。冷害指数分为5个等级:0,无冷害;1,冷害面积0%~20 %;2,冷害面积为20%~40 %;3,冷害面积为40%~60 %;4,冷害面积为60%~100 %。最后,根据公式(1)计算冷害指数。
冷害指数![]()
(1)
1.3.3 硬度的测定
硬度参考ZHANG等[13]的方法使用数显式水果硬度测试仪测量水果的硬度。探针(SMSP/6)的直径为10 mm,下压距离为10 mm,速度为1 mm/s,重复3次,果实硬度表示为N。
1.3.4 细胞壁组分的测定
纤维素含量参考王晶英等[15]蒽酮比色法方法测定。称取5 g样品于烧杯中,冰浴研磨,加入冷的60%(体积分数)H2S04溶液60 mL消化1 h,将溶液转入100 mL容量瓶中,用60%H2SO4溶液定容,摇匀后用布氏漏斗过滤于另一烧杯中。取滤液5 mL置于100 mL容量瓶中,在冷水浴中加蒸馏水定容,取2 mL样液加0.5 mL 2%(质量分数)葱酮,沿管壁加入5 mL浓H2SO4,沸水浴10 min,于620 nm下比色。
果胶提取及含量测定参考曹建康等[16]方法。称取2 g样品,加少量95%(体积分数)乙醇,冰浴研磨,转入到50 mL离心管中,加入25 mL 95%乙醇,沸水浴30 min,取出冷却至室温后,8 000 r/min离心15 min,弃去上清液。如此重复3~5次。然后将沉淀放入原离心管中,加入20 mL蒸馏水,在50 ℃水浴中保温30 min。取出冷却至室温后,8 000 r/min离心15 min,将上清液移入100 mL容量瓶中,加蒸馏水定容至刻度,此溶液即为可溶性果胶。然后原离心管中加入25 mL 0.5 mol/L H2SO4溶液,沸水浴1 h。取出冷却至室温后,8 000 r/min离心15 min,将上清液移入100 mL容量瓶中,加蒸馏水定容至刻度,此为原果胶。测定采用咔唑比色法,吸取1 mL果胶提取液于25 mL试管中,小心地沿管壁加入6.0 mL浓H2SO4,沸水浴加热20 min,冷却至室温后各加入0.2 mL 0.15%(质量分数)咔唑-乙醇溶液,摇匀。在暗处放置30 min后,测定反应液在波长530 nm处的吸光度值。
1.3.5 细胞壁水解酶活性的测定
果胶酶活性使用果胶酶试剂盒测定,按照试剂盒规定进行操作,以每克样本每小时分解果胶产生1 mg半乳糖醛酸为1个酶活力单位(U);纤维素酶活性使用纤维素酶试剂盒测定,按照试剂盒规定进行操作,以每克组织中纤维素酶每分钟催化纤维素水解产生1 μg还原糖为1个酶活力单位(U);β-葡萄糖苷酶活性使用β-葡萄糖苷酶试剂盒测定(北京索莱宝科技有限公司),按照试剂盒规定进行操作,以每克组织每小时产生1 nmol对硝基苯酚定义为1个酶活力单位(U)。
1.4 数据分析
采用 Excel 2010 软件进行数据处理并制图,结果以平均值±标准偏差表示。用SPSS 21.0软件对实验结果进行单因素方差分析及Duncan多重比较,显著性水平设为0.05。
2 结果与分析
2.1 热水处理对减轻黄瓜冷害的影响
热水处理对低温贮藏黄瓜冷害指数的影响如表1所示。结果表明,TG10和TG20黄瓜明显降低了冷害发生率。冷藏2 d时,黄瓜可见冷害现象并不明显,在贮藏(20 ℃)3 d时,各处理组冷害指数没有显著性差异。但TG10和TG20冷害指数仅为0.06,相比于CK降低了45.45%,相比于TG40降低了57.14%。冷藏4 d,贮藏(20 ℃)3 d时,TG20黄瓜冷害指数显著低于CK和TG40(P<0.05),但是与TG10黄瓜无显著差异(P>0.05)。冷藏6 d,贮藏(20 ℃)3 d后,黄瓜可见冷害现象较为明显。TG10和TG20黄瓜冷害指数低于CK和TG40。TG20冷害指数最小为0.36,相比于CK降低了23.40%,相比于TG40降低了32.08%。说明TG10和TG20能够有效缓解黄瓜果实的冷害现象,但是TG40却会对黄瓜造成伤害。另外,热处理的效果与冷藏时间有着很大关系,冷藏时间越长,效果越不明显。
表1 热水处理对贮后(4 ℃)黄瓜模拟货架期时 (20±1 ℃)冷害指数的影响
Table 1 Effect of hot water treatments on chilling injury index of cucumber (20±1 ℃)
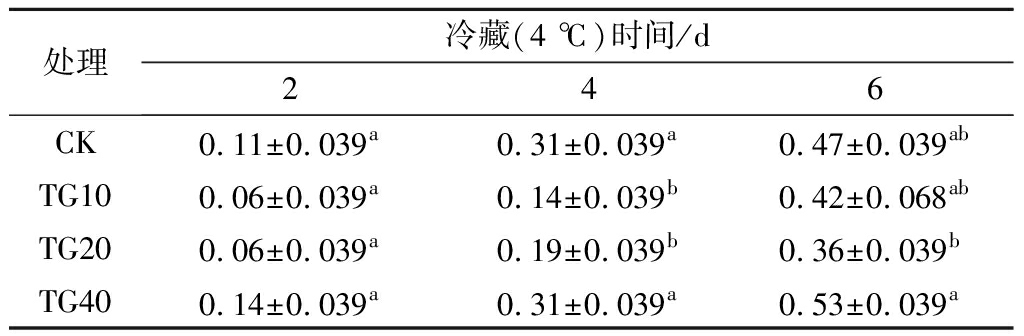
处理冷藏(4 ℃)时间/d246CK0.11±0.039a0.31±0.039a0.47±0.039abTG100.06±0.039a0.14±0.039b0.42±0.068abTG200.06±0.039a0.19±0.039b0.36±0.039bTG400.14±0.039a0.31±0.039a0.53±0.039a
注:同列标注不同字母表示差异显著(P<0.05)
2.2 热水处理对黄瓜硬度的影响
果实硬度是衡量果实贮藏品质的重要指标之一。在果实衰老、变质的过程中,果实硬度逐渐降低。通过测定果实硬度,可以了解果实的软化程度,从而确定果实的品质变化特点,以正确指导果蔬的贮藏。如图1所示,随着冷藏(4 ℃)时间的增加,各处理组黄瓜果实的硬度均逐渐降低。在4 ℃下冷藏2、4、6 d,20 ℃下放置3 d后,TG10和TG20处理组的黄瓜果实硬度均显著高于CK(P<0.05),而TG40黄瓜果实硬度一直处于最低水平。其中,冷藏(4 ℃)4 d,贮藏(20 ℃)3 d时,热处理效果最为明显,相比于CK,TG20黄瓜硬度提高了14.17%。而冷藏(4 ℃)2 d,贮藏(20 ℃)3 d时,相比于CK,TG20黄瓜硬度提高了9.29%,可能是因为冷藏2 d时黄瓜果实硬度都保持在较高水平,热处理效果不显著。冷藏(4 ℃)6 d,贮藏(20 ℃)3 d时,相比于CK,TG20黄瓜硬度提高了12.22%,这可能是因为随着冷藏时间的增加,梯度热水处理的效果会逐渐减弱。
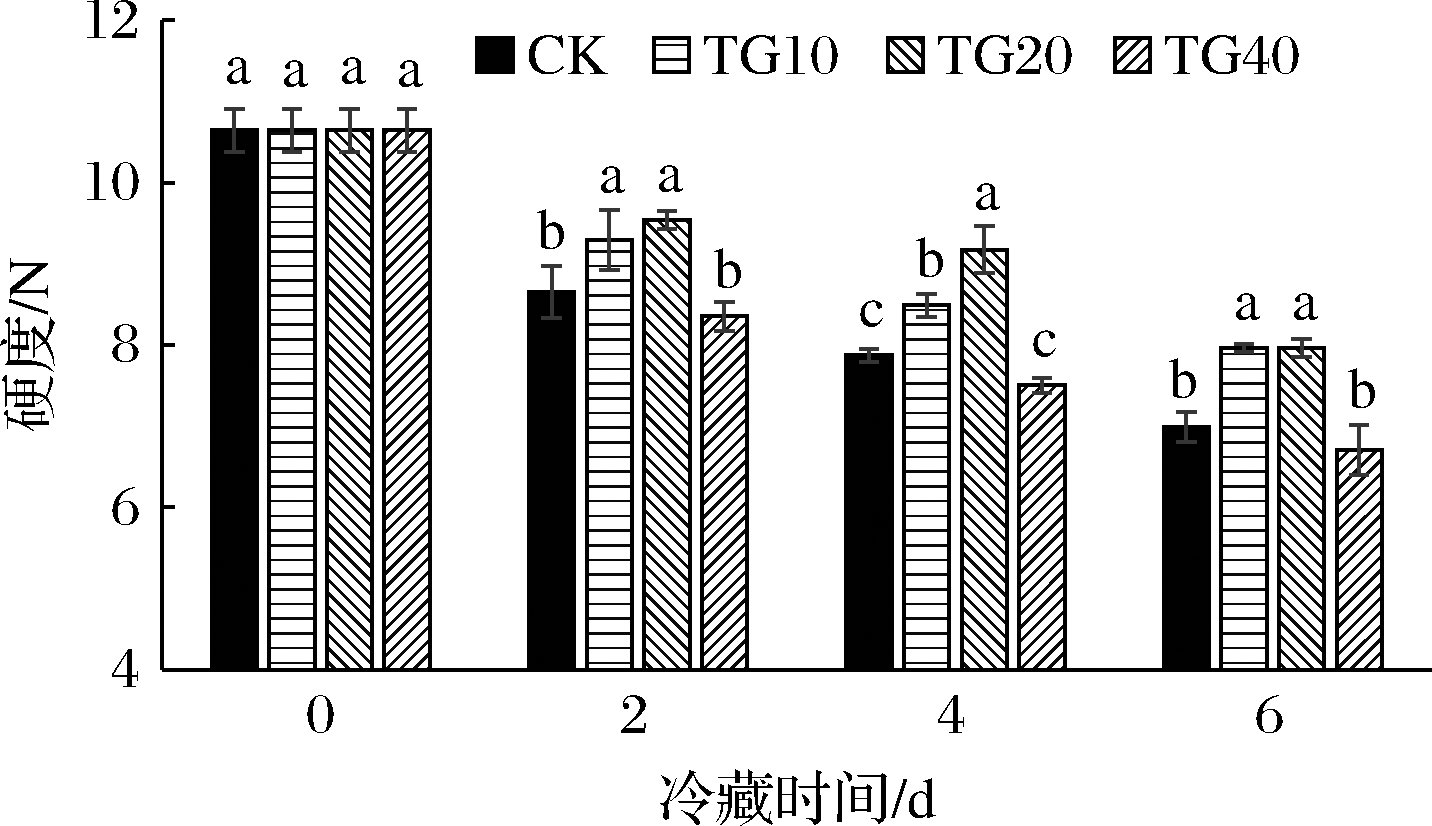
图1 热水处理对4 ℃冷藏(2、4、6 d)黄瓜模拟 货架期20 ℃(3 d)果实硬度的影响
Fig.1 Effects of hot water treatment on the firmness of cucumbers after storage at 4 ℃ (2,4,6 d) and shelf life at 20 ℃ (3 d)
注:标注不同字母表示差异显著(P<0.05)(下同)
2.3 热水处理对黄瓜纤维素含量的影响
热水处理对果实纤维素含量的影响如图2所示,相比于CK,TG10和TG20更好地维持了果实纤维素含量,TG40不能阻止果实纤维素含量的下降。冷藏2 d,贮藏(20 ℃)3 d后,TG10和TG20黄瓜纤维素含量显著高于CK组(P<0.05)。冷藏4 d时,TG10和TG20黄瓜纤维素含量显著高于CK,纤维素含量分别提高了41.22%,30.57%,TG40黄瓜纤维素含量与CK差异不显著。冷藏6 d,贮藏(20 ℃)3 d后,TG20黄瓜纤维素含量显著高于CK,提高了15.94%,而TG10和TG40黄瓜纤维素含量与CK差异不显著。因此,可以看出冷藏4 d时,热处理可有效抑制了纤维素的分解,同时诱导了纤维素合成基因的表达。

图2 热水处理对4 ℃冷藏(2、4、6 d)黄瓜模拟货架 期20 ℃(3 d)果实纤维素含量影响
Fig.2 Effects of hot water treatment on the cellulose content of cucumbers after storage at 4 ℃ (2,4,6 d) and shelf life at 20 ℃ (3 d)
2.4 热水处理对黄瓜果胶含量的影响
热水处理对黄瓜果实原果胶含量的影响如图3所示,随着冷藏时间的增加,黄瓜果实原果胶含量不断下降。冷藏2 d,贮藏(20 ℃)3 d后,TG10和TG20黄瓜原果胶含量与CK组无显著差异(P>0.05),TG40黄瓜原果胶含量处于最低水平。冷藏4 d,贮藏(20 ℃)3 d后,相比于CK,TG20黄瓜原果胶含量提高了21.00%,TG10黄瓜原果胶含量与CK差异不显著,然而TG40黄瓜原果胶含量下降了13.78%。冷藏6 d时,贮藏(20 ℃)3 d后,TG20处于最高水平1.11 mg/g。相比于CK,TG20黄瓜原果胶含量提高了21.42%,TG10提高了8.70%,TG40与CK差异不显著。热水处理对果实可溶性果胶含量的影响如图4所示,可以看出冷藏2 d,贮藏(20 ℃)3 d后,各处理组黄瓜果实可溶性果胶含量没有显著差异,并且与新鲜黄瓜果实可溶性果胶含量基本处于同一水平。冷藏4、6 d,贮藏(20 ℃)3 d后,各处理组黄瓜果实可溶性果胶含量急剧增加,TG20黄瓜果实可溶性含量显著低于CK(P<0.05)。
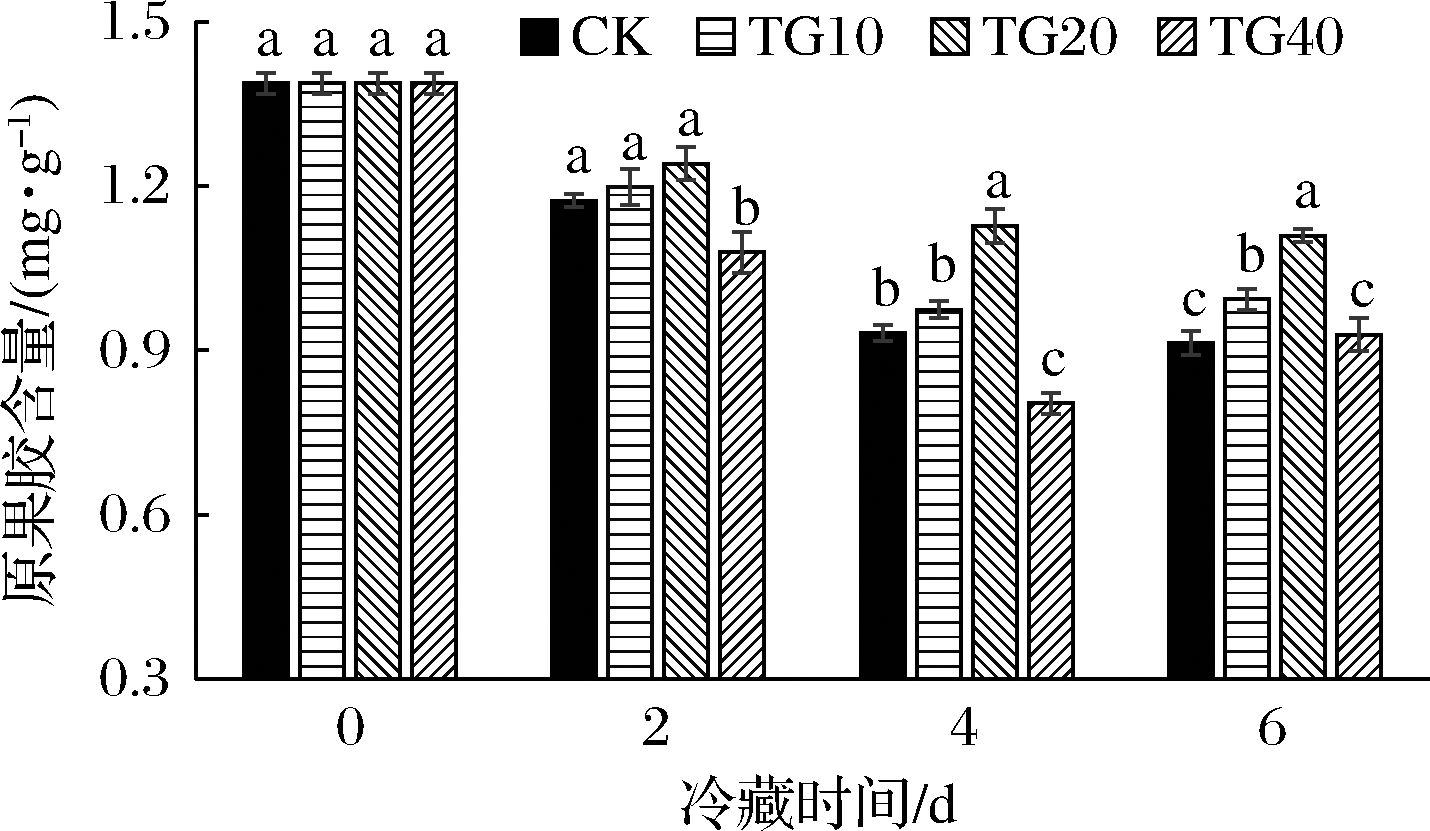
图3 热水处理对4 ℃冷藏(2、4、6 d)黄瓜模拟货架期 20 ℃(3 d)果实原果胶含量影响
Fig.3 Effects of hot water treatment on the protopectin content of cucumbers after storage at 4 ℃ (2,4,6 d) and shelf life at 20 ℃ (3 d)
冷藏6 d,贮藏(20 ℃)3 d时,CK组(0.60 mg/g)和TG40组(0.65 mg/g)黄瓜果实可溶性果胶含量分别是TG20(0.44 mg/g)的1.36、1.47倍。

图4 热水处理对4 ℃冷藏(2、4、6 d)黄瓜模拟货架期 20 ℃(3 d)果实可溶性果胶的影响
Fig.4 Effects of hot water treatment on the soluble pectin content of cucumbers after storage at 4 ℃ (2,4,6 d) and shelf life at 20 ℃ (3 d)
2.5 热水处理对黄瓜果胶酶活性的影响
热水处理对黄瓜果实果胶酶活性影响如图5所示,经过冷藏后黄瓜果实果胶酶活性迅速下降。冷藏2 d,贮藏(20 ℃)3 d时,TG10黄瓜果胶酶活性显著低于CK(P<0.05),其他处理组与CK组无明显差异(P>0.05)。冷藏4 d,贮藏(20 ℃)3 d时,梯度热水处理组黄瓜果胶酶活性均显著低于CK。相比于CK,TG20黄瓜果胶酶活性降低了28.37%,TG10和 TG40黄瓜果胶酶活性分别降低了27.44%、20.93%。冷藏6 d,贮藏(20 ℃)3 d后,TG20果胶酶活性处于最低水平为0.70 U/g。相比于CK(1.29 U/g),TG10、TG20和TG40分别降低了43.59%、45.51%、3.21%。
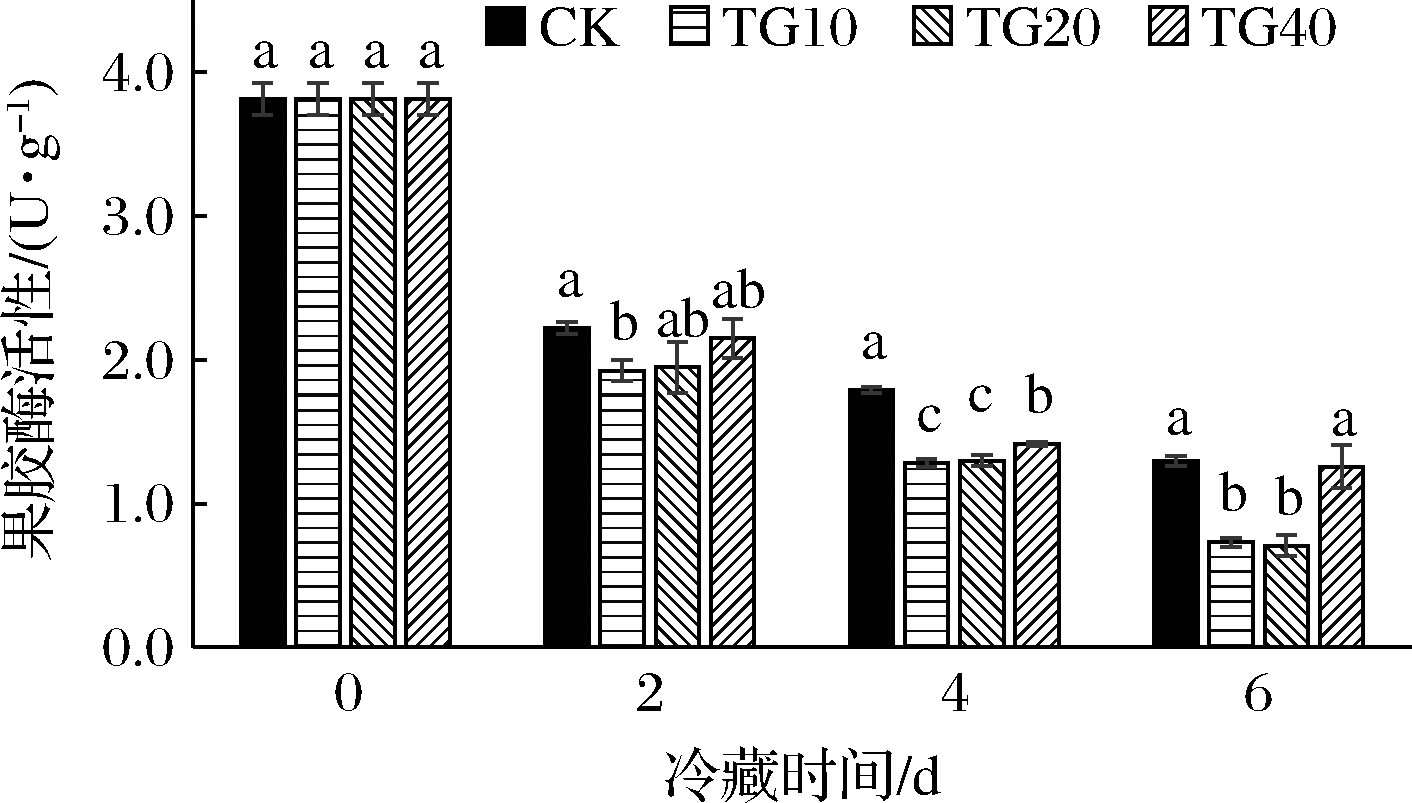
图5 热水处理对4 ℃冷藏(2、4、6 d)黄瓜模拟货架期 20 ℃(3 d)果实果胶酶活性影响
Fig.5 Effects of hot water treatment on the pectinase of cucumbers after storage at 4 ℃ (2,4,6 d) and shelf life at 20 ℃ (3 d)
2.6 热水处理对黄瓜纤维素酶活性的影响
热水处理对黄瓜果实纤维素酶活性影响如图6所示,冷藏2 d,贮藏(20 ℃)3 d时,黄瓜纤维素酶活性变化不大,处于443.42(TG10)~533.09 U/g,TG10和TG20黄瓜纤维素酶活性显著低于CK(P<0.05)。冷藏4 d,贮藏(20 ℃)3 d后,梯度热水处理组黄瓜纤维素酶活性均显著低于CK(P<0.05)。相比于CK,TG20黄瓜纤维素酶活性降低了48.90%,TG10和 TG40黄瓜纤维素酶活性分别降低了25.27%、6.59%。冷藏6 d,贮藏(20 ℃)3 d后,TG20纤维素酶活性处于最低水平为827.04 U/g,相比于CK(1 046.26 U/g)降低了20.95%。TG10和TG40黄瓜果实纤维素酶活性与CK无显著差异。
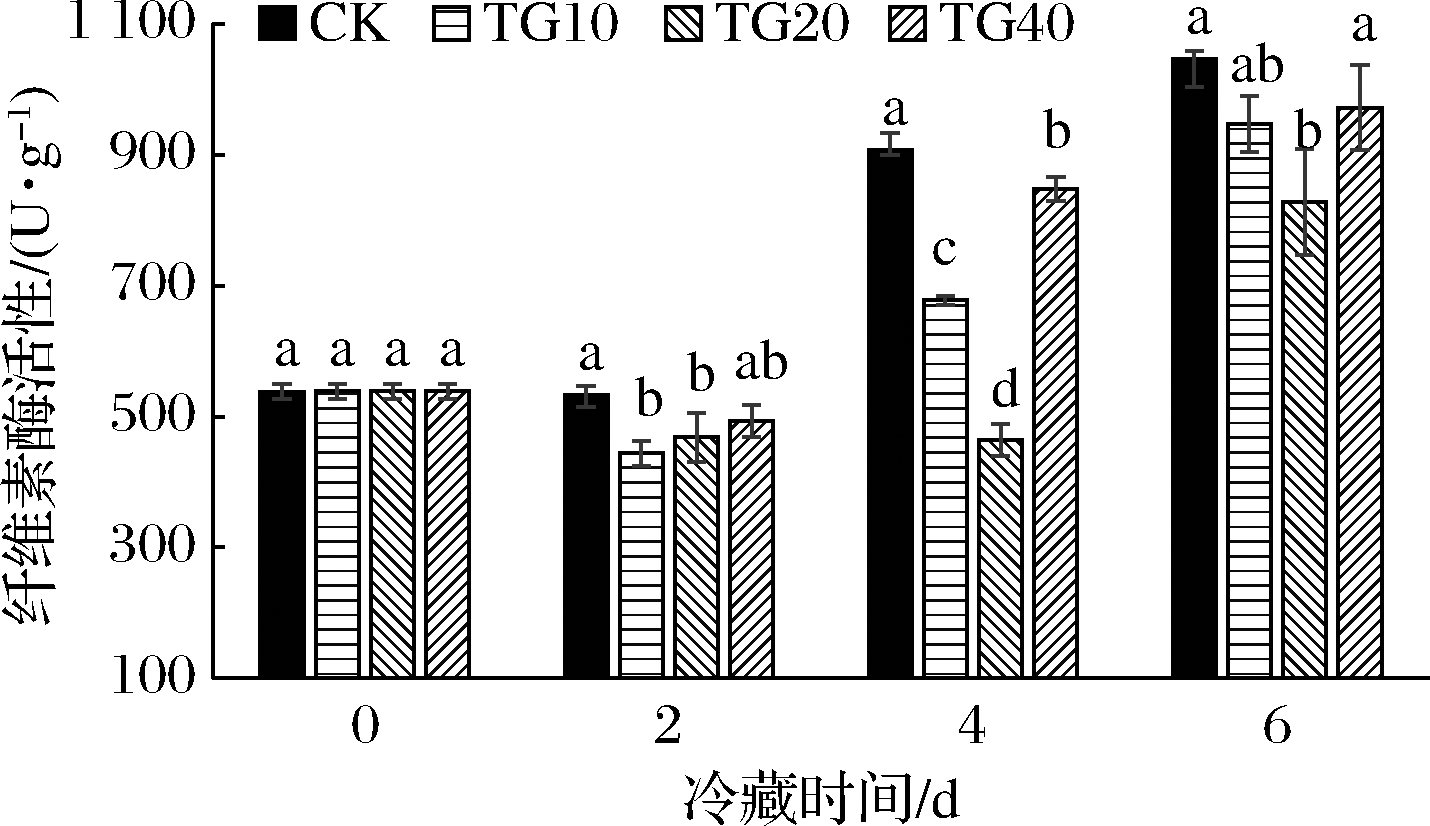
图6 热水处理对4 ℃冷藏(2、4、6 d)黄瓜模拟货架期 20 ℃(3 d)果实纤维素酶活性的影响
Fig.6 Effects of hot water treatment on the cellulase of cucumbers after storage at 4 ℃ (2,4,6 d) and shelf life at 20 ℃ (3 d)
2.7 热水处理对黄瓜β-葡萄糖苷酶活性的影响
梯度热水处理对黄瓜β-葡萄糖苷酶活性的影响如图7所示,CK组黄瓜β-葡萄糖苷酶活性一直处于最高水平。冷藏2 d,贮藏(20 ℃)3 d时,梯度热水处理组黄瓜β-葡萄糖苷酶活性均显著低于CK。相比于CK,TG20黄瓜β-葡萄糖苷酶活性降低了58.43%,TG10和 TG40黄瓜β-葡萄糖苷酶活性分别降低了53.48%、50.79%。冷藏4 d,贮藏(20 ℃)3 d后,梯度热水处理组黄瓜β-葡萄糖苷酶活性均显著低于CK。相比于CK,TG20黄瓜β-葡萄糖苷酶活性降低了70.89%,TG10和 TG40黄瓜β-葡萄糖苷酶活性分别降低了70.10%、26.93%。冷藏6 d,贮藏(20 ℃)3 d后,黄瓜β-葡萄糖苷酶活性变化不大,处于3 272.09(TG20)~3 844.18 U/g。相比于CK,TG10和TG20黄瓜β-葡萄糖苷酶活性分别降低了9.80%、14.88%。
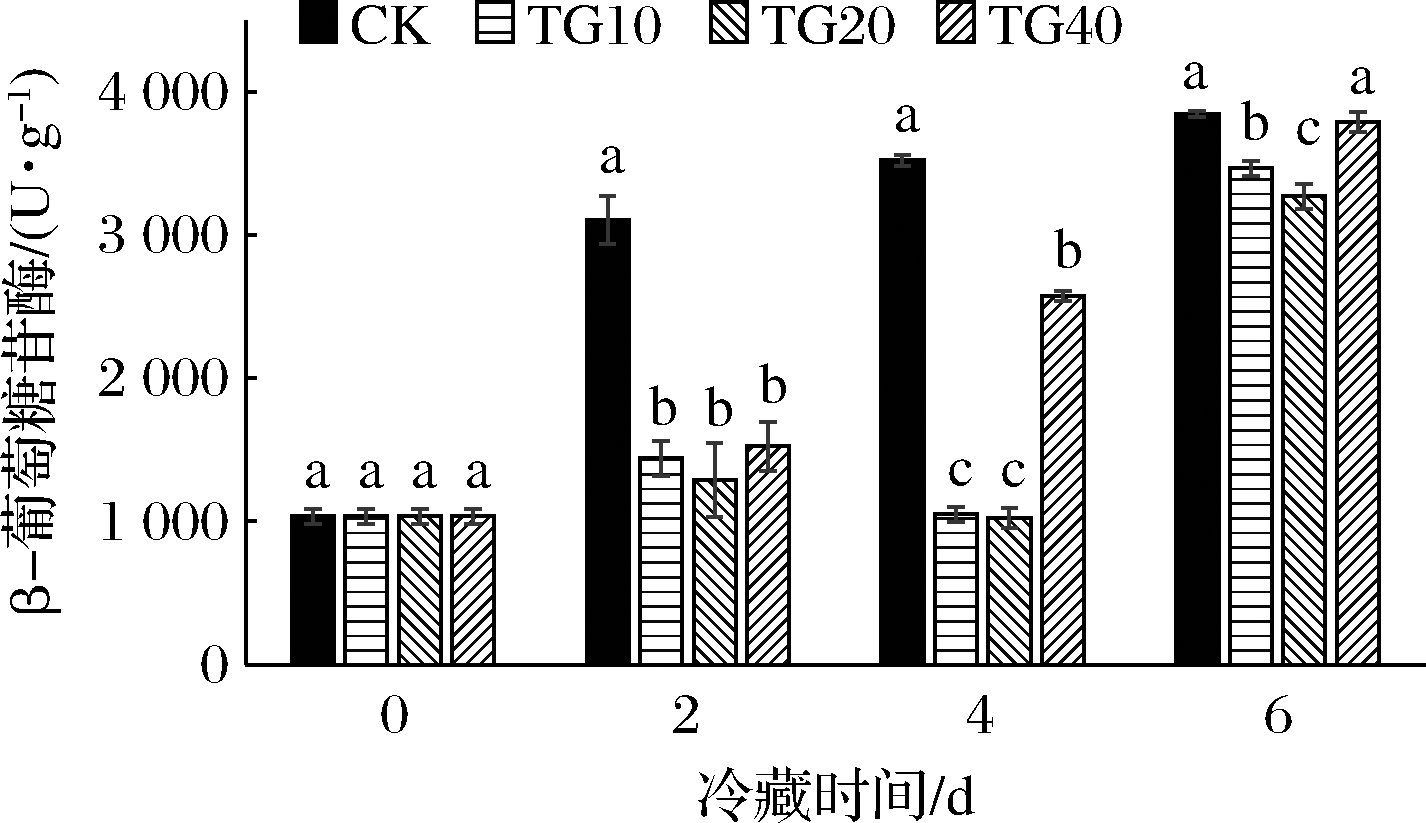
图7 热水处理对4 ℃冷藏(2、4、6 d)黄瓜模拟货架期 20 ℃(3 d)果实β-葡萄糖苷酶活性影响
Fig.7 Effects of hot water tr eatment on the β-glucosidase of cucumbers after storage at 4 ℃ (2,4,6 d) and shelf life at 20 ℃ (3 d)
3 讨论
细胞壁位于细胞膜外,是一层较厚、较坚韧并略具弹性的结构[17]。细胞壁分为3层,即胞间层、初生壁和次生壁。胞间层由果胶多聚物组成,起到黏连细胞和缓冲挤压的作用;初生壁紧挨胞间层,主要由纤维素、半纤维素和少量果胶组成,起到保持形状和伸缩的作用。次生壁在初生壁内侧,由原生质分泌的纤维素及少量半纤维素和木质素组成,起到增加细胞壁厚度的作用[18]。果实在贮藏过程中,β-半乳糖苷酶作用于水果软化早期,水解β-1,4-半乳糖键,去除果胶侧链上的半乳糖残基,使中性糖与果胶、纤维素和半纤维素分离[8]。随后,果胶甲酯酶与半乳糖醛酸残基的C-6位甲酯化羧基反应,生成多聚半乳糖醛酸和甲醇。多聚半乳糖醛酸酶则水解多聚半乳糖醛酸中α-1,4-2-D-半乳糖苷键,导致果胶降解[19-20]。同时纤维素酶是由内葡聚糖酶、外葡聚糖酶和葡萄糖苷酶组成的多酶系统,可以使含β-1,4糖苷键的半纤维素分解[21-22]。
细胞壁组分中果胶物质、纤维素、半纤维素含量是影响果实质地的重要因素[23]。纤维素是植物细胞壁的主要组成部分,对细胞起着骨架支持和保护作用。黄瓜果实中纤维素的含量对果蔬品质和贮藏性质变化有重要影响,在其抗逆性方面有重要意义。在本实验中,相比于CK,TG10和TG20更好地维持了果实纤维素含量,而TG40不能阻止果实纤维素含量的下降。尤其是冷藏4 d,贮藏(20 ℃)3 d时,TG10和TG20黄瓜纤维素含量显著高于CK,相比于CK,TG10和TG20黄瓜纤维素含量分别提高了41.22%,30.57%。沈丽雯等[12]用42 ℃热水处理“金田208” 黄瓜10 min后,于(2±1)℃下贮藏,发现热激处理会导致纤维素含量出现升高的现象。陈亚敏等[24]认为纤维素含量的增加一方面可能是原本以微纤丝的结构形式存在于细胞壁内的纤维素分子发生解离,导致纤维素含量增加;另一方面可能是热水处理诱导了纤维素合成基因表达的同时有效抑制了纤维素酶活性。果胶物质即多聚半乳糖醛酸,是一种植物胶,主要存在于果实细胞初生壁和中胶层中,起着黏结细胞个体的作用。最初,果胶物质和纤维素结合以原果胶的形式存在,使果实显得坚实、脆硬。随着果实的成熟衰老,果胶物质逐渐与纤维素分离形成易溶于水的果胶,使果实组织变得松弛,软化,硬度下降[7]。在本实验中,随着冷藏时间的增加,黄瓜果实原果胶含量不断下降,可溶性果胶呈不断上升的趋势。冷藏4 d,贮藏(20 ℃)3 d后,相比于CK,TG20黄瓜原果胶含量增加了21.00%,可溶性果胶含量下降了17.96%。TG40黄瓜原果胶含量下降了13.78%。冷藏6 d,贮藏(20 ℃)3 d后,相比于CK,TG20黄瓜原果胶含量提高了21.42%,可溶性果胶含量下降了26.42%。TG10黄瓜原果胶提高了8.70%,可溶性果胶含量下降了15.24%。果胶含量和结构的改变会直接影响果蔬的质构特征[25]。VICENTE 等[26]将草莓在45 ℃的热空气下处理3 h,之后在 20 ℃下保存2 d,发现与未热处理的草莓果实相比有更高的原果胶,更低水平的可溶性果胶。LUO 等[27]分别用40、45、50 ℃热空气处理杨梅果实3 h,发现与20 ℃处理3 h的果实相比,热处理减缓了螯合性和碱溶性果胶物质的解聚,并且抑制了水溶性果胶物质的增加。
低温会增强果实中果胶甲基酯酶、多聚半乳糖醛酸酶和纤维素酶的酶活性,从而加速果胶的溶解,也增加了半纤维素和纤维素的流失[28-29]。因此果实细胞壁物质的降解与细胞壁降解酶活性以及细胞壁降解酶相关基因的表达和调控密切相关[30]。果胶酶是一种分解果胶物质的复合酶,主要包括多聚半乳糖醛酸酶、果胶甲酯酶和果胶裂解酶(pectinlyase,PL)等。纤维素酶是一种复合酶,可以将纤维素逐步水解并最终生成β-葡萄糖。β-葡萄糖苷酶是纤维素酶的一个主要组分,它主要作用于纤维素水解的最后一步,将纤维寡糖水解为葡萄糖。β-葡萄糖苷酶的活性能够更加直观反映纤维素水解的程度。本实验中,冷藏2 d,贮藏(20 ℃)3 d时,TG10黄瓜果胶酶活性显著低于CK(P<0.05),其他处理组与CK组无明显差异;TG10和TG20黄瓜纤维素酶和β-葡萄糖苷酶活性显著低于CK(P<0.05)。冷藏4 d,贮藏(20 ℃)3 d时,梯度热水处理组黄瓜果胶酶、β-葡萄糖苷酶活性均显著低于CK;相比于CK,TG20黄瓜纤维素酶活性降低了48.90%,TG10和 TG40黄瓜纤维素酶活性分别降低了25.27%、6.59%;冷藏6 d,贮藏(20 ℃)3 d后,TG20果胶酶活性处于最低水平为0.70 U/g;TG 20纤维素酶活性处于最低水平为827.04 U/g,相比于CK(1 046.26 U/g)降低了20.95%;β-葡萄糖苷酶活性变化不大,处于3 272.09(TG20)~3 844.18 U/g。赵云峰等[19]用45 ℃热空气处理茄子24 h,发现与对照果实相比,热处理可有效延缓PME、PG、Cx和β-Gal活性的上升,抑制离子结合型果胶、共价结合型果胶、半纤维素和纤维素含量的下降。沈丽雯等[12]、VICENTE等[26]分别对黄瓜、草莓果实进行热处理,也发现了同样的结论。但是,也有与此结论相反的报道,ZHANG等[31]用55 ℃热水处理杧果果实10 min后置于5 ℃贮存3周,发现相较于未用热水处理果实,热水处理的果实细胞壁组分中含更多的水溶性果胶,使聚半乳糖醛酸酶和β-半乳糖苷酶维持更高的酶活性,并降低果胶甲酯酶的活性。罗自生等[32]、茅林春等[33]发现热处理对竹笋、桃果实的影响与此一致。由此可见,热处理对果蔬细胞壁代谢的影响与果实类型有十分紧密的关系。
综上,TG10和TG20梯度热水处理应该是通过降低细胞壁水解酶活性,从而抑制原果胶的水解以及纤维素的分解,以达到减轻贮后黄瓜冷害,保持较高硬度的效果。相反TG40对黄瓜果实表现出较大的伤害,这可能是温度在短时间内迅速变化而严重损害黄瓜果实的内部调节系统导致的。
4 结论
本研究结果表明TG10和TG20梯度热水处理能够显著减轻贮后黄瓜冷害,使黄瓜果实保持较高硬度。与对照组相比,TG10和TG20有效抑制了细胞壁水解酶活性的上升,从而延缓了原果胶的水解以及纤维素的分解,以达到减轻贮后黄瓜冷害,保持较高硬度的效果。不过TG20黄瓜果实硬度、原果胶含量显著高于TG10,可溶性果胶含量、纤维素酶活性显著低于TG10,关于果胶酶和β-葡萄糖苷酶活性两者无显著性差异。因此,从处理效果和经济成本两方面来说,TG20要优于TG10。相反TG40黄瓜果实表现出较差的状态。另外,梯度热水处理对冷藏(4 ℃)2 d的黄瓜处理效果不太明显,对冷藏(4 ℃)4 d的黄瓜处理效果最好,对冷藏(4 ℃)6 d的黄瓜处理效果比较微弱。因此,梯度热水处理减轻贮后黄瓜冷害的机理研究是十分必要的,并且梯度升温的范围以及果蔬冷藏的时长等都是影响贮后热处理效果的关键因素。
[1] AMER B M A,AZAM MM.Using hot water as a pretreatment to extend the shelf life of cucumbers (Cucumis sativus L.) under cold storage conditions[J].Journal of Food Process Engineering,2019,42(2):e12958.
[2] NASEF I N.Short hot water as safe treatment induces chilling tolerance and antioxidant enzymes,preventsdecay and maintains quality of cold-stored cucumbers[J].Postharvest Biology and Technology,2018,138:1-10.
[3] 张敏,解越.采后果蔬低温贮藏冷害研究进展[J].食品与生物技术学报,2016,35(1):1-11.
ZHANG M,XIE Y.Research progress of chilling injury on post-harvest fruits and vegetables stored at low temperature[J].Journal of Food Science and Biotechnology,2016,35(1):1-11.
[4] 艾文婷,张敏,李春晖,等.电导法结合二次回归正交旋转组合设计确定黄瓜果实低温冷害临界值[J].食品科学,2017,38(19):218-222.
AI W T,ZHANG M,LI C H,et al.Using quadratic regression orthogonal rotation combination design to determine the critical value of chilling injury in cucumber fruits based on conductivity[J].Food Science,2017,38(19):218-222.
[5] 钟志友,张敏,杨乐,等.果蔬冰点与其生理生化指标关系的研究[J].食品工业科技,2011,32(2):76-78.
ZHONG Z Y,ZHANG M,YANG L,et al.Study on relation between freezing and physiological and biochemical indexes of fruits and vegetables[J].Science and Technology of Food Industry,2011,32(2):76-78.
[6] GWANPUA S G,JABBAR A,ZHAO M,et al.Investigating the potential of dual temperature storage as a postharvest management practice to mitigate chilling injury in kiwifruit[J].International Journal of Refrigeration,2018,86:62-72.
[7] PANIAGUA C,SANTIAGO-DOMÉNECH N,KIRBY A R,et al.Structural changes in cell wallpectins during strawberry fruit development[J].Plant Physiology and Biochemistry,2017,118:55-63.
[8] CHEN Y H,HUNG Y C,CHEN M Y,et al.Effects of acidic electrolyzed oxidizing water on retarding cell wall degradation and delaying softening of blueberries during postharvest storage[J].LWT,2017,84:650-657.
[9] 张子沛,宋会歌,顾楠,等.采后处理对果蔬细胞壁组成的影响[J].食品工业科技,2011,32(10):458-461.
ZHANG Z P,SONG H G,GU N,et al.Effect of different postharvest treatment on cell wall components of fruits and vegetables[J].Science and Technology of Food Industry,2011,32(10):458-461.
[10] 赵云峰,林河通,王静,等.热处理抑制采后龙眼果肉自溶及细胞壁物质降解[J].农业工程学报,2014,30(11):268-275.
ZHAO Y F,LIN H T,WANG J,et al.Inhibiting aril breakdown and degradation of cell wall material in pulp of harvested longan fruits by heat treatment[J].Transactions of the ChineseSociety of Agricultural Engineering,2014,30(11):268-275.
[11] 邓佳,刘惠民,张南新,等.采后钙及热处理对葡萄柚果实贮藏期细胞壁物质代谢的影响[J].北方园艺,2013(2):123-129.
DENG J,LIU H M,ZHANG N X,et al.Effect of calcium and hot treatments on cell wall metabolism during grapefruit (Citrus paradise Macf.) postharvest storage[J].Northern Horticulture,2013(2):123-129.
[12] 沈丽雯,刘娟,董红敏,等.热激处理减轻黄瓜冷害与细胞壁代谢的关系[J].食品工业科技,2015,36(23):329-332;338.
SHEN L W,LIU J,DONG H M,et al.Impact of heat shock treatment on cucumber cell wall composition and cell wall hydrolase activity[J].Science and Technology of Food Industry,2015,36(23):329-332;338.
[13] ZHANG M,LIU W,LI C H,et al.Postharvest hot water dipping and hot water forced convection treatments alleviate chilling injury for zucchini fruit during cold storage[J].Scientia Horticulturae,2019,249:219-227.
[14] 王静,茅林春,李学文,等.热处理降低哈密瓜果实活性氧代谢减轻冷害[J].农业工程学报,2016,32(2):280-286.
WANG J,MAO L C,LI X W,et al.Reduction of active oxygen metabolism and mitigation of chilling injury in Hami melon fruit as influenced by postharvest hot water treatment[J].Transactions of the Chinese Society of Agricultural Engineering,2016,32(2):280-286.
[15] 王晶英.植物生理生化实验技术与原理[M].哈尔滨:东北林业大学出版社,2003.
WANG J Y.Experiment techniques and principles of physiology and biochemistry of plant[M].Harbin:Northeast Forestry University Press,2003.
[16] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007.
CAO J K,JIANG W B,ZHAO Y M.Experiment guidance of postharvest physiology and biochemistry of fruits and vegetables[M].Beijing:China Light Industry Press,2007.
[17] 夏斐,范佩,张明菊,等.次生细胞壁在植物抗病中的作用研究进展[J].湖北农业科学,2015,54(23):5 797-5 803.
XIA F,FAN P,ZHANG M J,et al.Advances in roles of the secondary cell wall in plant resistance to pathogens[J].Hubei Agricultural Sciences,2015,54(23):5 797-5 803.
[18] KRATSCH H A,WISE R R.The ultrastructure of chilling stress[J].Plant,Cell & Environment,2000,23(4):337-350.
[19] 赵云峰,林瑜,林河通,等.热处理对冷藏茄子果实细胞壁代谢的影响[J].扬州大学学报(农业与生命科学版),2012,33(4):97-102.
ZHAO Y F,LIN Y,LIN H T,et al.Effects of heat treatment on cell wall metabolism in cold-stored eggplant fruits[J].Journal of Yangzhou University (Agricultural and Life Science Edition),2012,33(4):97-102.
[20] 郑秋萍,林育钊,李美玲,等.果实采后软化的影响因素及抑制技术研究进展[J].亚热带农业研究,2019,15(4):262-270.
ZHENG Q P,LIN Y Z,LI M L,et al.Research progress on the influencing factors and inhibiting technologies of postharvest fruit softening[J].Subtropical Agriculture Research,2019,15(4):262-270.
[21] 袁德保,刘兴华,马艳萍,等.鲜食核桃贮藏中脂肪酶活性及油脂酸价变化[J].食品研究与开发,2006,27(11):79-81.
YUAN D B,LIU X H,MA Y P,et al.Changes of lipase activity and the acid value of oil in walnut during storage[J].Food Research and Development,2006,27(11):79-81.
[22] WEI YY,ZHOU D D,WANG Z J,et al.Hot air treatment reduces postharvest decay and delays softening of cherry tomato by regulating gene expression and activities of cell wall-degrading enzymes[J].Journal of the Science of Food and Agriculture,2018,98(6):2 105-2 112.
[23] 林河通,赵云峰,席芳.龙眼果实采后果肉自溶过程中细胞壁组分及其降解酶活性的变化[J].植物生理与分子生物学学报,2007.33(2):137-145.
LIN H T,ZHAO Y F,XI F.Changes in cell wall components and cell wall-degrading enzyme activities of postharvest longan fruit during aril breakdown[J].Journal of Plant Physiology and Molecular Biology,2007,33(2):137-145.
[24] 陈亚敏.核果类果实采后细胞壁多糖微观结构及降解模式的研究[D].郑州:河南工业大学,2013.
CHEN Y M.Study on cell wall polysaccharide microstructure and degradation mode of postharvest drupe fruits[D].Zhengzhou:Henan University of Technology,2013.
[25] 易建勇,吕健,毕金峰,等.果胶分子结构与功能关系的研究进展[J].中国食品学报,2017,17(9):175-181.
YI J Y,LÜ J,BI J F,et al.Research process of structure and function relationship of pectin in processed fruits and vegetables[J].Journal of Chinese Institute of Food Science and Technology,2017,17(9):175-181.
[26] VICENTE A R,COSTA M L,MART NEZ G A,et al.Effect of heat treatments on cell wall degradation and softening in strawberry fruit[J].Postharvest Biology and Technology,2005,38(3):213-222.
NEZ G A,et al.Effect of heat treatments on cell wall degradation and softening in strawberry fruit[J].Postharvest Biology and Technology,2005,38(3):213-222.
[27] LUO Z S,XU T Q,XIE J,et al.Effect of hot air treatment on quality and ripening of Chinese bayberry fruit[J].Journal of the Science of Food and Agriculture,2009,89(3):443-448.
[28] CARVAJAL F,PALMA F,JAMILENA M,et al.Cell wall metabolism and chilling injury during postharvest cold storage in zucchini fruit[J].Postharvest Biology and Technology,2015,108:68-77.
[29] ZHAO YY,CHEN J X,TAO X Y,et al.The possible role of BAX and BI-1 genes in chilling-induced cell death in cucumber fruit[J].Acta Physiologiae Plantarum,2014,36(6):1 345-1 351.
[30] PAYASI A,MISHRA N N,CHAVES A L S,et al.Biochemistry of fruit softening:An overview[J].Physiology and Molecular Biology of Plants,2009,15(2):103-113.
[31] ZHANG Z K,GAO Z Y,LI M,et al.Hot water treatment maintains normal ripening and cell wall metabolism in mango (Mangifera indica L.) fruit[J].HortScience,2012,47(10):1 466-1 471.
[32] 罗自生,席玙芳,傅国柱,等.竹笋采后热处理对细胞壁组分和水解酶活性的影响[J].园艺学报,2002,29(1):43-46.
LUO Z S,XI Y F,FU G Z,et al.Effect of heat treatment on cell wall components in relation to cell wall hydrolase of excised bamboo shoots[J].ActaHorticulturae Sinica,2002,29(1):43-46.
[33] 茅林春,张上隆.间歇低温胁迫对桃果实细胞壁代谢的影响[J].植物生理学报,2001,27(2):151-155.
MAO L C,ZHANG S L.Influence of intermittent low temperature stress on cell wall metabolism in PeachesMAO Lin-Chun[J].Acta Photophysiologica Sinica,2001,27(2):151-155.