黄瓜(Cucumis sativus L.)是典型的亚热带冷敏果实,是我国主要的夏季蔬菜之一,因其采后仍在进行新陈代谢等生命活动,且含水量高,容易受机械损伤,在常温下贮藏容易失水皱缩、营养流失[1]。低温贮藏是广泛使用的黄瓜果实采后贮藏技术,其在维持黄瓜果实正常生命活动的前提下,最大限度地抑制新陈代谢,从而减少果实的物质消耗、延长采后贮藏期[2]。然而,国内外学者研究发现低温虽能显著延长果蔬的贮藏期,但冷敏果蔬在低温下贮藏和运输时会产生低温胁迫,造成细胞生理功能紊乱从而导致冷害等现象发生[3],症状包括严重的点蚀、局部凹陷、花萼变黑、果体浸水和腐烂等[4],冷害现象通常在果蔬从低温环境转移到室温环境一定时间后才会表现出来,这会影响到黄瓜的品质和货架期等[5]。
热处理作为操作便捷、安全有效地保持果蔬低温贮藏品质的贮前预处理手段,被认为是降低采后果蔬冷藏期间冷害发生的有效技术[6-10],还能有效延长果蔬贮藏期与货架期,降低生理病害[1]。SHADMANI等[11]发现 42 ℃、30 min 和 49 ℃、20 min 的热水处理可以诱导番木瓜在 6 ℃贮藏条件下的抗冷性;WANG等[12]用 52 ℃热水处理香蕉果实3 min,有效地提高了其贮藏期间过氧化氢酶(catalase,CAT)活性并降低了其在 7 ℃贮藏下的冷害发生。赵昱瑄等[1]对黄瓜进行 39.4 ℃、24.4 min的热水处理,能有效抑制贮藏期间黄瓜果实超氧化物歧化酶(superoxide dismutase,SOD)活性的下降与![]() 的生成速率;同样地,热处理也提高了西葫芦[13]、青椒[7]、鲜枣[14]等果蔬的抗冷性。
的生成速率;同样地,热处理也提高了西葫芦[13]、青椒[7]、鲜枣[14]等果蔬的抗冷性。
近年来关于果蔬热处理技术的研究大都着重于热处理的参数,如处理温度和持续时间,很少考虑到热水处理后在室温下放置时间这一重要因素。在实际操作中,热水处理后在非低温贮藏环境中的停留时间对果实机体抗氧化系统有着不可忽略的影响,是重要的商业考虑因素,热水处理后的果实应在处理后立即转移到低温贮藏环境中,还是在低温贮藏之前于室温下放置一段时间以使其适应环境,这取决于果实机体的生理状态,而关于热水处理后环境放置期间果实温度及抗氧化系统变化的研究鲜有报道。因此,本研究以申青黄瓜为实验材料,根据前期试验筛选出的最佳热水处理条件(40 ℃热水处理20 min),测定了热水处理后环境放置期间(0、1、2、4、8 h)黄瓜果实果体温度、活性氧水平及抗氧化酶活性;研究了热水处理后在非低温贮藏环境放置期间黄瓜果实果体温度及抗氧化系统变化,旨在为采后黄瓜果实贮前热水处理技术的实践与进一步研究提供参考。
申青黄瓜,中国上海南汇新城种植园,采摘当天装于泡沫箱运回实验室。黄瓜的长度约为(30±2) cm,平均直径约为(4±0.5) cm,单个果实的平均质量为(250±20) g。在恒温恒湿箱中将黄瓜复温至(20±1) ℃,选择成熟度相同、无病虫害、无机械损伤的果实进行实验处理。将黄瓜果实表面尘土拭净后随机分2组,分别为热水处理(hot water treat,HWT)组和CK(未处理),每组450根。每个组再分为5个亚组(每个亚组3个平行,每个平行3根):HWT0(热处理后0 h)、HWT1(热处理后1 h)、HWT2(热处理后放置2 h)、HWT4(热处理后放置4 h)、HWT8(热处理后放置8 h);CK0(放置0 h)、CK1(放置1 h)、CK2(放置2 h)、CK4(放置4 h)、CK8(放置8 h)。根据前期预实验结果,将黄瓜果实置于40 ℃热水浴中20 min,热水处理完毕后立即轻拭水分并转移至实验室干净的工作台上[(20±1) ℃],立即开始测定果体温度,此外分别在0、1、2、4、8 h对HWT和CK组的果实进行取样(用洁净的小刀快速除去果皮和果瓤,取赤道部位中果肉),测定其活性氧水平及抗氧化酶活性变化。并在每个时间点,将黄瓜果实装于带有小孔的聚乙烯保鲜袋(厚度0.02 mm)中,放于冷库[(4±0.5) ℃,相对湿度(relative humidity,RH)(80±5)%]贮藏,于贮藏6 d后取出黄瓜果实观察冷害指数。
丙二醛测试盒,上海兰拓生物科技有限公司;抗坏血酸检测试剂盒,上海源叶生物科技有限公司;超氧阴离子自由基测试盒、过氧化氢测试盒、谷胱甘肽测定试剂盒、超氧化物歧化酶测试盒、过氧化氢酶测定试剂盒、过氧化物酶测试盒、抗坏血酸过氧化物酶活性测试盒,南京建成生物工程研究所。
BPS-100CA型恒温恒湿箱,上海一恒科学仪器有限公司;HSWX-600BS型电热恒温水温箱,上海圣科仪器设备有限公司;H-2050R-1型高速冷冻离心机,长沙湘仪离心机有限公司;BJ2100D型数字孔式电子天平、福禄克F2640多点温度采集仪、紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.3.1 黄瓜果实果体温度测定
采用福禄克F2640多点温度采集仪,将测温探针(直径0.2 mm)从完整的黄瓜果实赤道部位垂直刺入果肉(1/2黄瓜果体直径处),每隔3 s采集黄瓜果实中心温度,测量精度为±0.1 ℃。
1.3.2 MDA 含量测定
丙二醛(malondialdehyde,MDA)含量的测定参照MDA 测试盒说明书,结果以 nmol/g 表示。
![]() 和H2O2含量测定
和H2O2含量测定
![]() 活力的测定参照测试盒说明书,结果以U/g表示。H2O2含量的测定参照H2O2含量测试盒说明书,结果以mmol/g表示。
活力的测定参照测试盒说明书,结果以U/g表示。H2O2含量的测定参照H2O2含量测试盒说明书,结果以mmol/g表示。
1.3.4 AsA、GSH含量测定
抗坏血酸(ascorbic acid,AsA)含量的测定参照AsA测定试剂盒说明书,结果以mg/100 g表示。还原型谷胱甘肽(reduced glutathione,GSH)含量的测定参照GSH测定试剂盒说明书,结果以mgGSH/g表示。
1.3.5 SOD、CAT、POD、APX活性测定
SOD活性的测定参照 SOD 测试盒说明书,以每克组织在1 mL反应液中SOD抑制率达50%时所对应的 SOD 量为1个SOD活力单位(U),结果以U/g表示。CAT活性的测定参考CAT测定试剂盒说明书,以每克样品每分钟吸光度变化值减少0.01为1个CAT活性单位(U),结果以 U/g 表示。过氧化物酶(peroxidase,POD)活性的测定参考测试盒说明书,以每克样品每分钟吸光度变化值增加1时为1个POD活力单位(U),结果以U/g 表示。抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性的测定参考APX测定试剂盒说明书,以每克样品每分钟吸光度变化值降低0.01为1个酶活力单位(U),结果以 U/g 表示。
1.3.6 冷害指数测定
冷害指数的测定参考ZHANG等[8]的方法,在低温贮藏6 d后每组随机选取12根黄瓜,对黄瓜果实外表面点蚀和凹陷区域进行视觉评级(0~4级)后计算冷害指数,见公式 (1)。0级=无伤害;1级=轻度,损伤面积25%;2级=中度,损伤面积26%~50%;3级=中度严重,损伤面积51%~75%;4级=严重,损伤面积76%~100%。
冷害指数![]()
(1)
采用 SPSS21.0软件对数据进行单因素方差分析及 Duncan 多重比较,显著性水平设为 0.05。
如图1所示,热水处理后黄瓜果体即刻温度(热水处理后0 h)为36.5 ℃,热水处理后0~10 min黄瓜果体温度由36.5下降到32.79 ℃,平均下降速率高达0.37 ℃/min;10~30 min黄瓜果体温度由32.79下降到28.70 ℃,平均下降速率为0.20 ℃/min,与0~10 min相比减少了45.9%;在随后的30~60 min、1~1.5 h黄瓜果体温度下降速度逐渐放缓,平均下降速率分别为0.11、0.06 ℃/min,与0~10 min相比分别减少了70.3%和83.8%;热水处理1.5~2 h,黄瓜果体温度由23.74 ℃下降到22.39 ℃,平均下降速率为0.04 ℃/min,与0~10 min相比减少了89.2%。此外,热水处理2~4 h内黄瓜果体温度下降到20.37 ℃,与CK组黄瓜果体温度逐渐接近,且与环境温度相一致(20±1) ℃,而在随后的4~8 h,热水处理黄瓜果体温度与CK组保持相接近的状态且稳定在环境温度范围。由此可见,热水处理后将黄瓜果实置于环境中一定时间使其适应环境是有必要的,且在热水处理后2~4 h黄瓜果体温度变化逐渐稳定,说明在此时间段内黄瓜果实机体自我调节可能达到了平衡状态。

图1 热水处理后环境放置期间黄瓜果实果体温度变化
Fig.1 Change of temperature in cucumber fruit during environmental storage after HWT
2.2.1 热水处理后环境放置期间黄瓜果实![]() 和H2O2含量变化
和H2O2含量变化
如图2所示,热水处理0~8 h黄瓜果实中![]() 随放置时间呈先上升后下降再上升的趋势,其中热水处理后0 h的黄瓜果实中
随放置时间呈先上升后下降再上升的趋势,其中热水处理后0 h的黄瓜果实中![]() 的活力相较热水处理前显著升高(P<0.05),增加了19.55 U/g;在随后的1~4 h黄瓜果实
的活力相较热水处理前显著升高(P<0.05),增加了19.55 U/g;在随后的1~4 h黄瓜果实![]() 含量不断下降,到放置2 h时已显著低于0 h(P<0.05),相较于0 h减少了25.71 U/g;至放置4 h 时黄瓜果实
含量不断下降,到放置2 h时已显著低于0 h(P<0.05),相较于0 h减少了25.71 U/g;至放置4 h 时黄瓜果实![]() 达到最低水平且2、4 h时均显著低于CK(P<0.05);然而在放置8 h时
达到最低水平且2、4 h时均显著低于CK(P<0.05);然而在放置8 h时![]() 急剧升高,较0 h增加了22.63 U/g,显著高于0 h水平(P<0.05)。热水处理后放置2、4 h的黄瓜果实
急剧升高,较0 h增加了22.63 U/g,显著高于0 h水平(P<0.05)。热水处理后放置2、4 h的黄瓜果实![]() 浓度得到显著抑制,而在4~8 h升高,这可能是由于热水处理导致的黄瓜果体温度适当升高与热胁迫造成的黄瓜果实
浓度得到显著抑制,而在4~8 h升高,这可能是由于热水处理导致的黄瓜果体温度适当升高与热胁迫造成的黄瓜果实![]() 瞬时低浓度积累,协同诱导了热水处理后0~4 h抗氧化酶的活性升高从而抑制了2~4 h黄瓜果实
瞬时低浓度积累,协同诱导了热水处理后0~4 h抗氧化酶的活性升高从而抑制了2~4 h黄瓜果实![]() 浓度;而随后的4~8 h随着果体温度稳定在环境温度水平,
浓度;而随后的4~8 h随着果体温度稳定在环境温度水平,![]() 浓度持续高浓度积累,抗氧化酶活性不再增强,导致了
浓度持续高浓度积累,抗氧化酶活性不再增强,导致了![]() 水平的急剧升高。这表明了热水处理后在环境中适当的放置,有助于黄瓜果实机体自我调节,以适应环境。
水平的急剧升高。这表明了热水处理后在环境中适当的放置,有助于黄瓜果实机体自我调节,以适应环境。
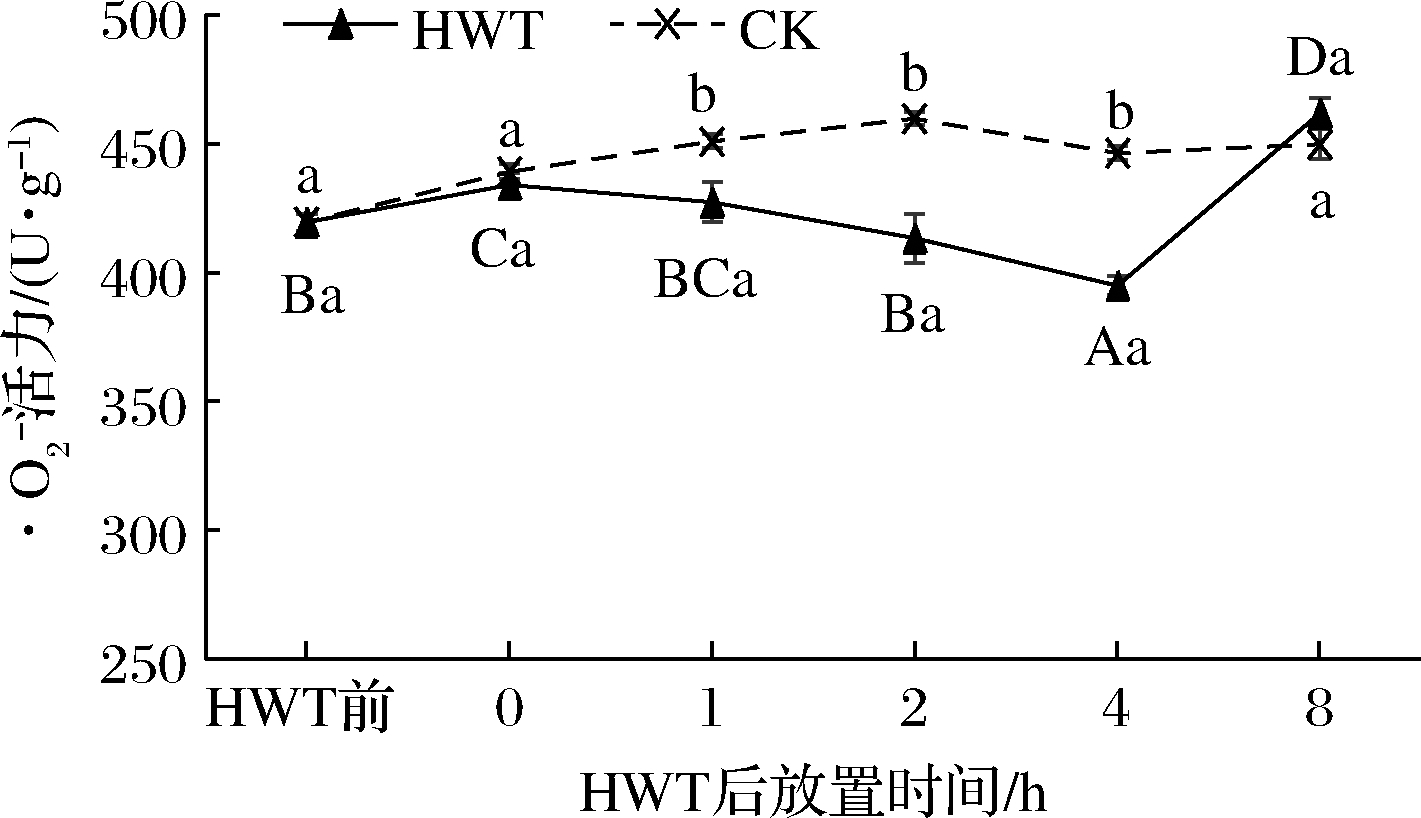
图2 热水处理后环境放置期间黄瓜果实中![]() 变化
变化
Fig.2 Change of ![]() in cucumber fruit during environmental storage after HWT
in cucumber fruit during environmental storage after HWT
注:各阶段HWT组中不含相同大写字母表示差异显著(P<0.05); 同一阶段HWT和CK组中不含相同小写字母表示差异显著 (P<0.05)(下同)
如图3所示,热水处理后0~8 h黄瓜果实中H2O2含量随放置时间呈先上升后下降再上升的趋势,而CK组H2O2含量随着时间持续升高。热水处理后0 h黄瓜果实H2O2含量相较热水处理前增加了20.72%,差异具有显著性(P<0.05);热水处理后1~2 h黄瓜果实H2O2含量逐渐降低,到2 h时H2O2含量达到最低水平且显著低于CK组(P<0.05),仅为CK的57.1%;而随后的2~8 h H2O2含量逐渐升高,但CK 组与热水处理后1~8 h黄瓜果实H2O2含量之间始终存在显著性差异(P<0.05)。这表明,热水处理能显著降低黄瓜 H2O2含量的积累,抑制果实膜脂过氧化进程,且在热水处理后2 h左右对H2O2含量的抑制作用最显著。
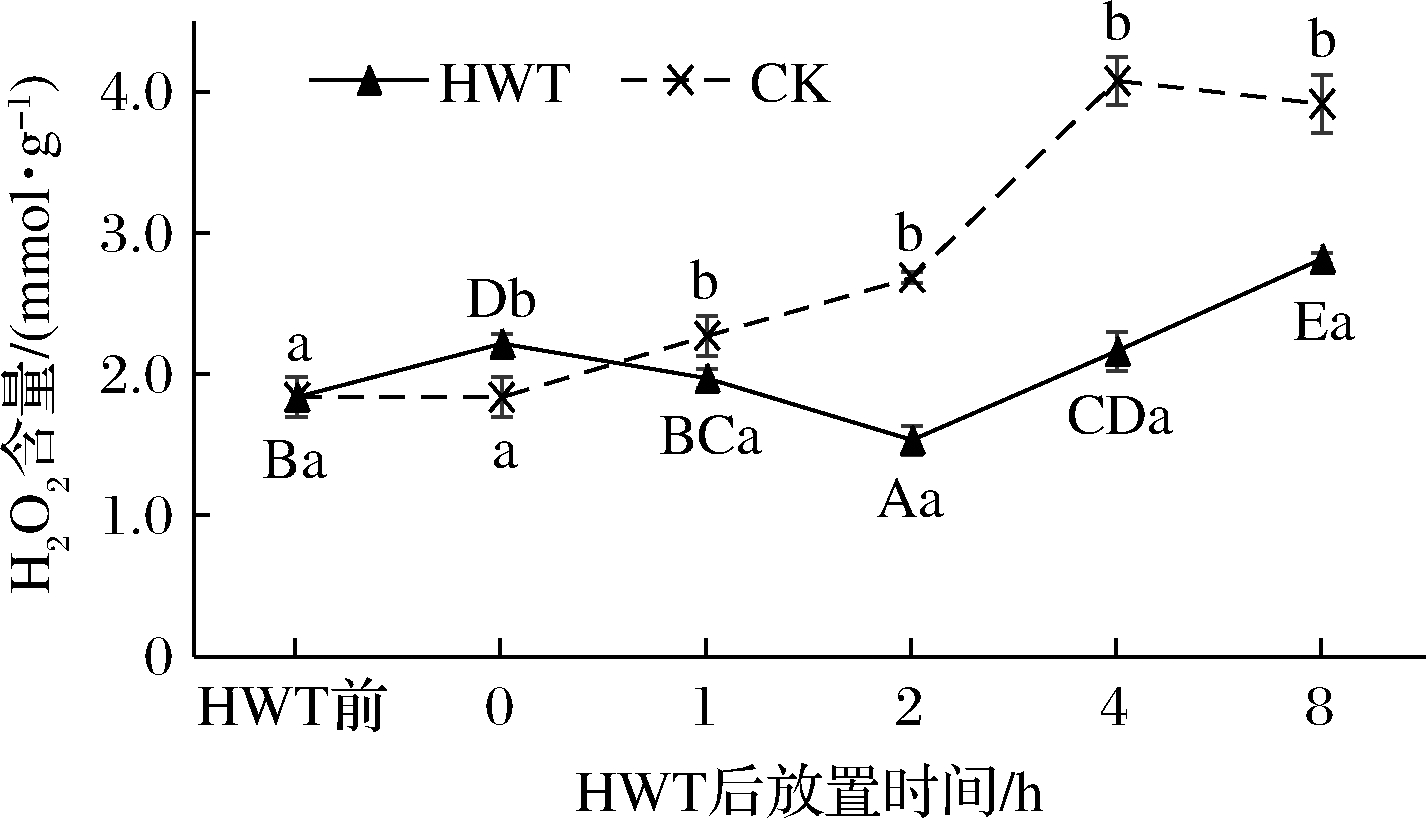
图3 热水处理后环境放置期间黄瓜果实中H2O2含量变化
Fig.3 Change of H2O2 content in cucumber fruit during environmental storage after HWT
2.2.2 热水处理后环境放置期间黄瓜果实MDA含量变化
MDA被广泛用作指示果蔬机体氧化损伤程度的指标,因此,可以通过测量MDA的含量来表征植物细胞脂质过氧化的程度[8]。如图4所示,热水处理后0~8 h黄瓜果实中MDA含量随放置时间呈先上升后下降再上升的趋势,而CK组MDA含量随着时间缓慢升高。热水处理后0 h黄瓜果实MDA含量相较热水处理前显著升高(P<0.05),这可能是由于热处理后黄瓜果体温度接近植物组织中酶的最适温度[15],激发了脂氧合酶的活性,促进了组织中多不饱和脂肪酸的氧化反应,导致了作为次级终产物的MDA的瞬时积累。在热水处理后1~4 h MDA含量降低,2和4 h时MDA含量均显著低于0 h时,也显著低于CK(P<0.05),相较于CK分别降低了0.41和1.11 μmol/g;而随后的4~8 h MDA含量逐渐升高,但低于CK组,且 CK 组与热水处理后2~8 h黄瓜果实MDA含量之间存在显著性差异(P<0.05)。这表明热水处理能抑制果实膜脂过氧化进程,且在热水处理后2~4 h热激抑制作用最显著。
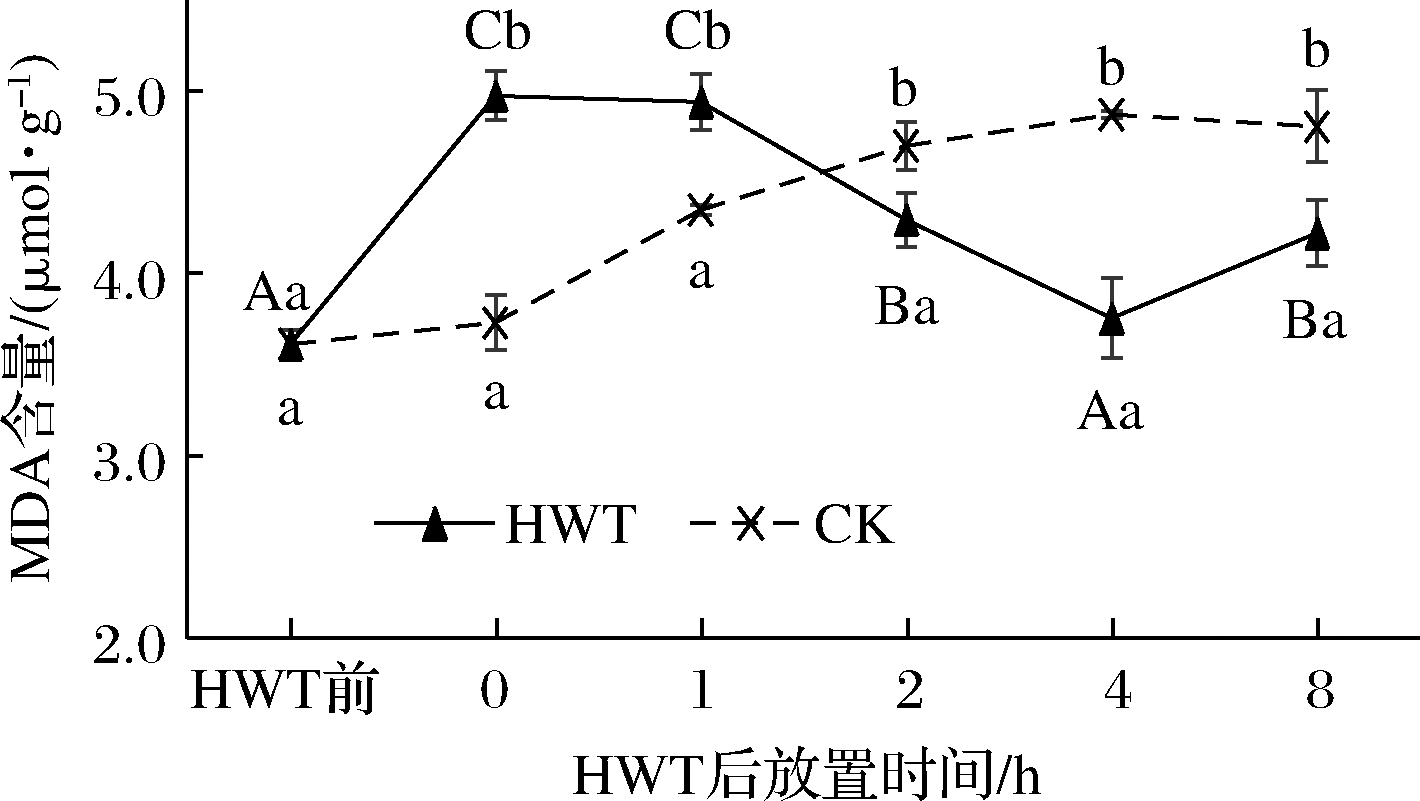
图4 热水处理后环境放置期间黄瓜果实中MDA含量变化
Fig.4 Change of MDA content in cucumber fruit during environmental storage after HWT
2.2.3 热水处理后环境放置期间黄瓜果实AsA、GSH含量变化
如图5所示,热水处理后0~8 h黄瓜果实中AsA含量随放置时间呈先上升后下降的趋势,且1~4 h均显著高于CK组(P<0.05)。热水处理后0~4 h黄瓜果实AsA含量相较热水处理前持续升高,放置2、4 h时黄瓜果实AsA含量显著高于热水处理前(P<0.05),分别增加了0.39和0.56 mg/100 g;而4~8 h黄瓜果实AsA含量逐渐降低,8 h时处于最低水平,略低于CK,但差异不具有显著性(P>0.05)。这表明适度的热胁迫有助于果蔬体内AsA的生物合成,且在热水处理后0~4 h均能有效维持AsA含量的升高,而热水处理后8 h的AsA含量降低可能是由于放置时间过长导致热激效应的消失。
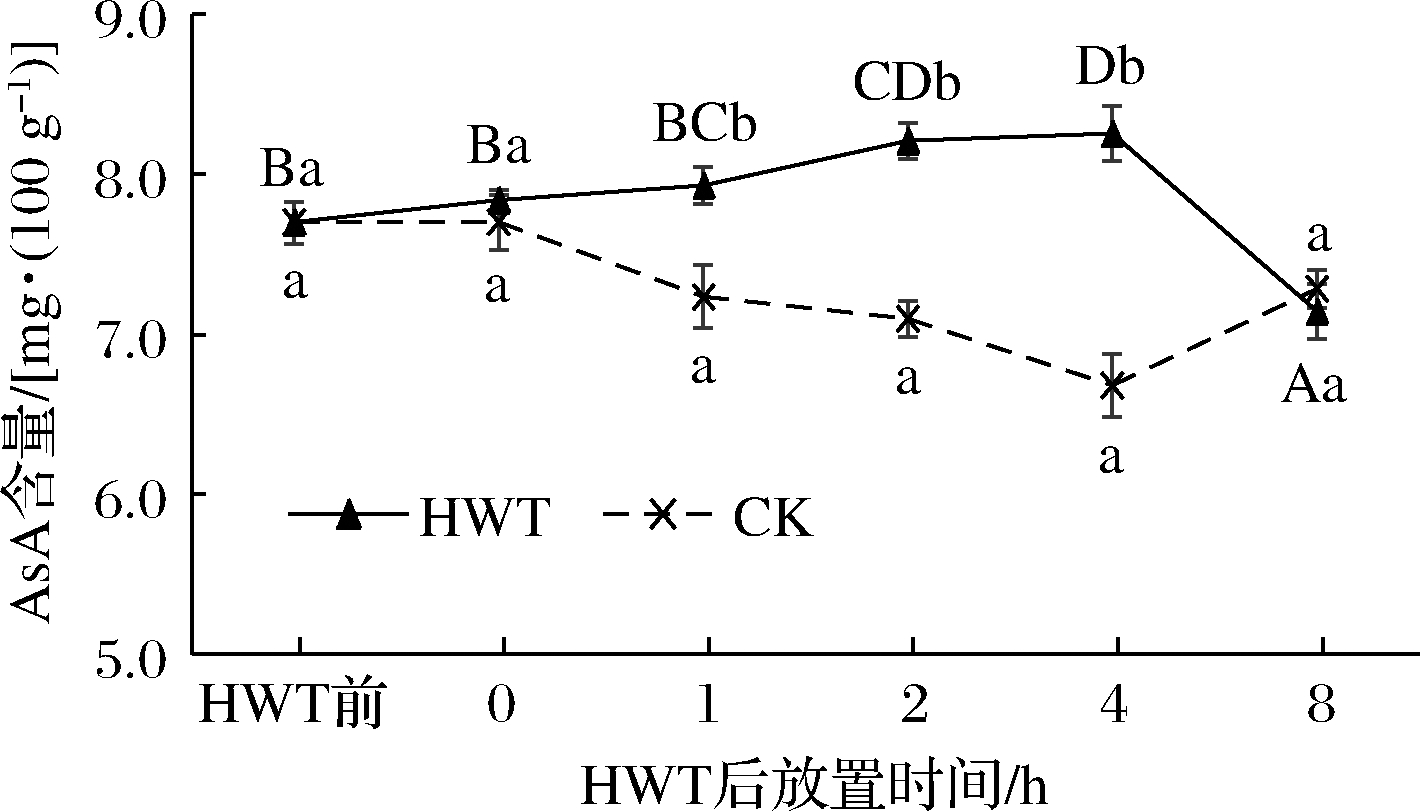
图5 热水处理后环境放置期间黄瓜果实中AsA含量变化
Fig.5 Change of AsA content in cucumber fruit during environmental storage after HWT
如图6所示,热水处理后0~8 h黄瓜果实中GSH含量随放置时间呈先上升后下降再上升的趋势。热水处理后0 h黄瓜果实GSH含量相较热水处理前显著降低(P<0.05),为热水处理前的80.5%;但在热水处理1 h后GSH逐渐升高,到放置2 h时黄瓜果实GSH含量达到热水处理后的最高水平,相较于CK及热水处理前分别增长了26.8%和24%,且差异具有显著性(P<0.05),这与放置2 h时最低的H2O2含量相呼应。
而4~8 h黄瓜果实GSH含量又恢复到与0~1 h相当的水平;相对应的,0~8 h CK的GSH含量也呈波动变化。这可能由于GSH是果蔬机体内GSH-AsA循环的主要成分,受GSH-AsA循环和其他抗氧化酶物质的多级调控[4],使其含量在热水处理后0~8 h呈波动变化。但热水处理后2 h黄瓜果实仍有显著最高的GSH含量,这表明热水处理后放置2 h对于正向热激作用的发挥是有益的。
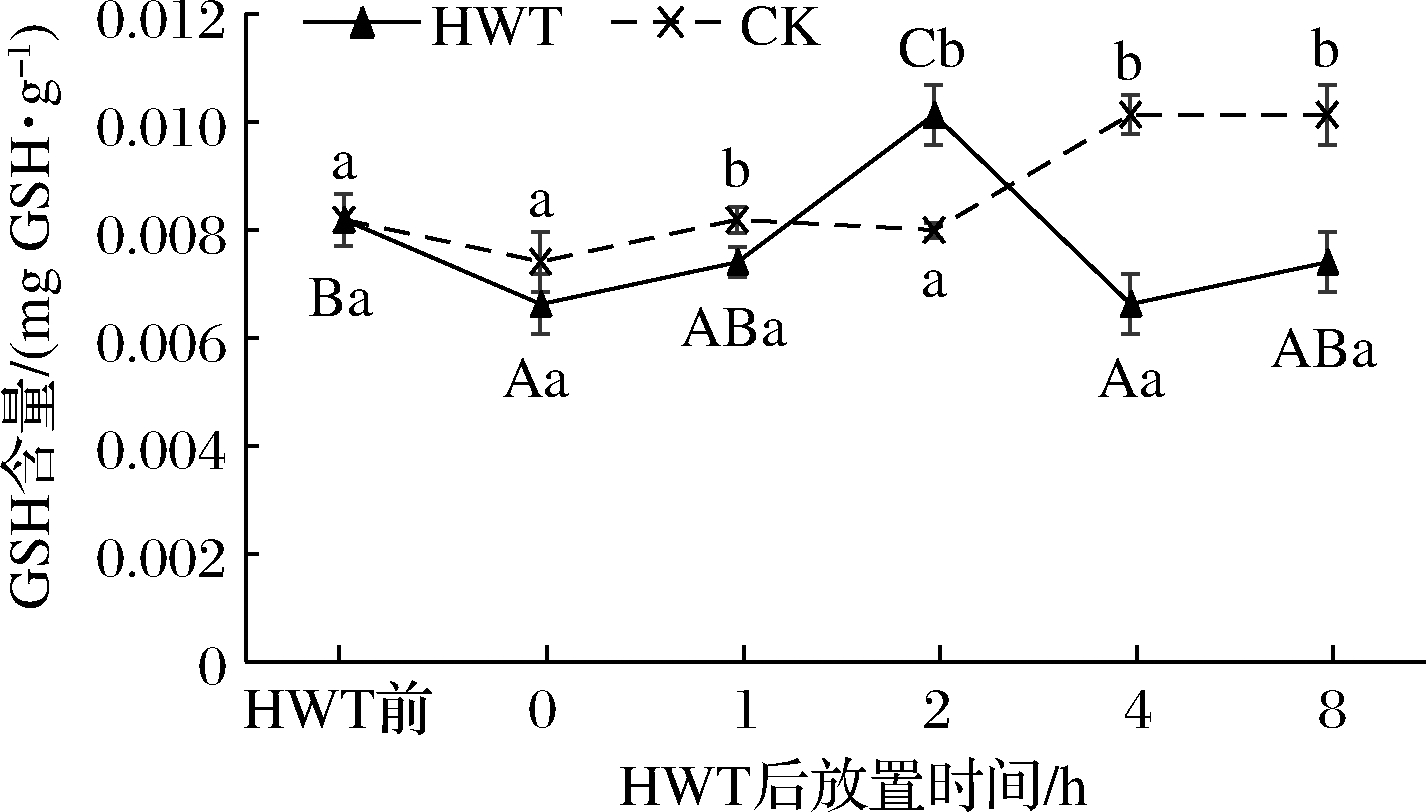
图6 热水处理后环境放置期间黄瓜果实中GSH含量变化
Fig.6 Change of GSH content in cucumber fruit during environmental storage after HWT
2.2.4 热水处理后环境放置期间黄瓜果实 SOD、CAT、APX和POD活性的变化
如图7所示,热水处理后0~8 h黄瓜果实SOD含量呈先上升后下降再上升的趋势,且在热水处理后2~8 h热水处理组黄瓜SOD活力均显著高于CK。热水处理后0 h黄瓜果实SOD活性较热水处理前显著下降,降低了20.6 U/g,这可能是由于黄瓜果实刚离开热水环境,湿度温度差导致调控SOD酶生成的途径受到影响[16-17];而在随后的1~2 h 黄瓜果实SOD活性升高,并在2 h达到最高水平,相较于CK和热水处理前分别增加了17.01和32.2 U/g,差异具有显著性(P<0.05);且在随后的4~8 h热水处理黄瓜果实SOD活性也处于高于CK和热水处理前的状态。这说明适宜的热水处理能显著提高SOD的活性,但此热激效果的发挥需要给黄瓜果实适应环境的时间,在放置2 h左右热激效果得到发挥。
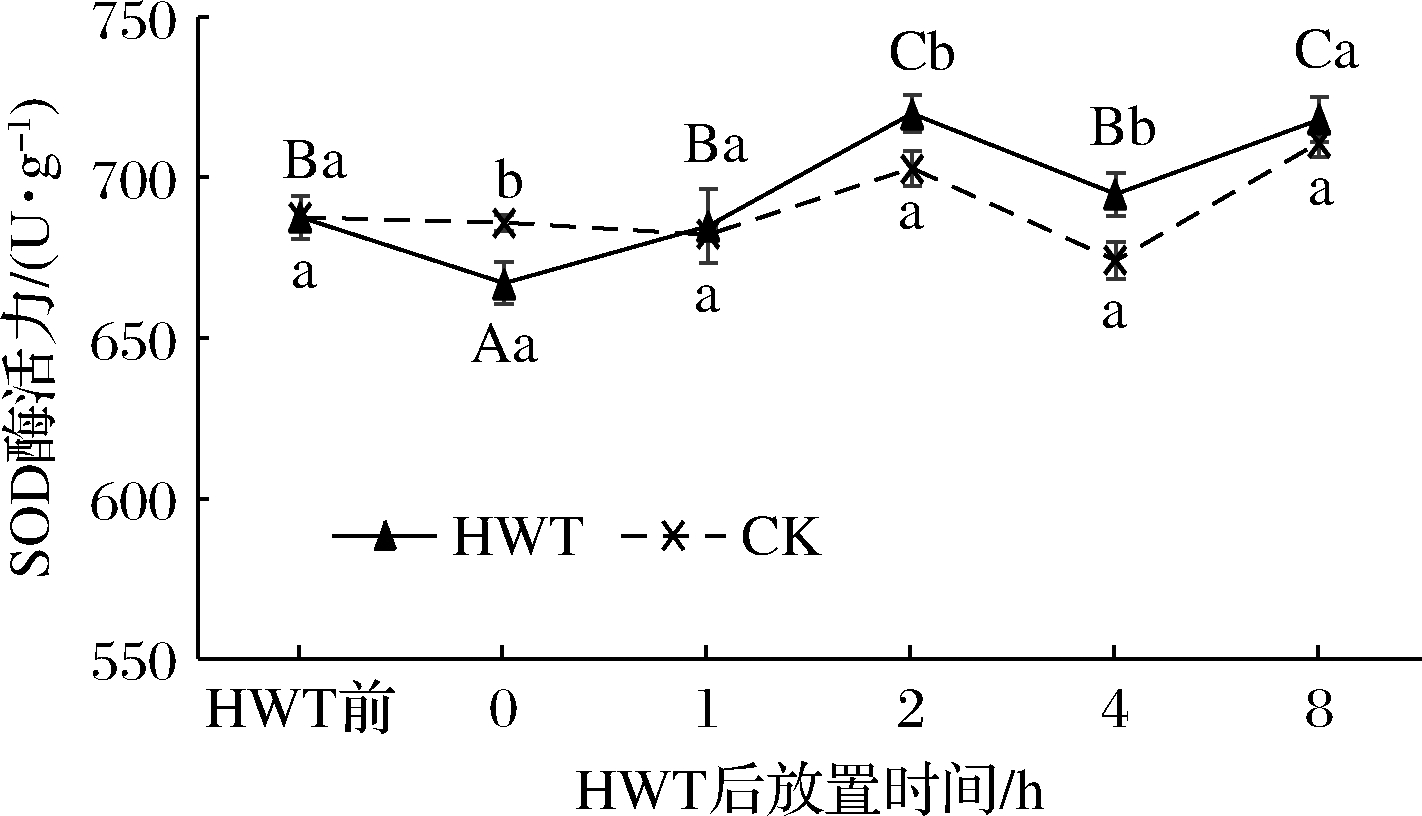
图7 热水处理后环境放置期间黄瓜果实中SOD活性变化
Fig.7 Change of SOD activity in cucumber fruit during environmental storage after HWT
如图8所示,热水处理后和CK组黄瓜果实0~8 h CAT含量随时间呈波动式缓慢下降的趋势,且在热水处理后0~8 h热水处理组黄瓜CAT活力均显著高于CK(P<0.05)。但在热水处理后0 h,黄瓜果实CAT活性较热水处理前下降了0.36 U/g,这可能是由于瞬时温度差造成了黄瓜果实机体调节失衡;热水处理后1 h黄瓜果实CAT活力缓慢回升到与热处理前相当,且达到显著高于CK的水平,在之后的1~8 h热水处理黄瓜果实CAT活性始终显著高于CK(P<0.05)。这表明,相较于CK,热水处理能延缓CAT活性的下降,并可在果体温度接近最适酶活温度时促进CAT的活力。
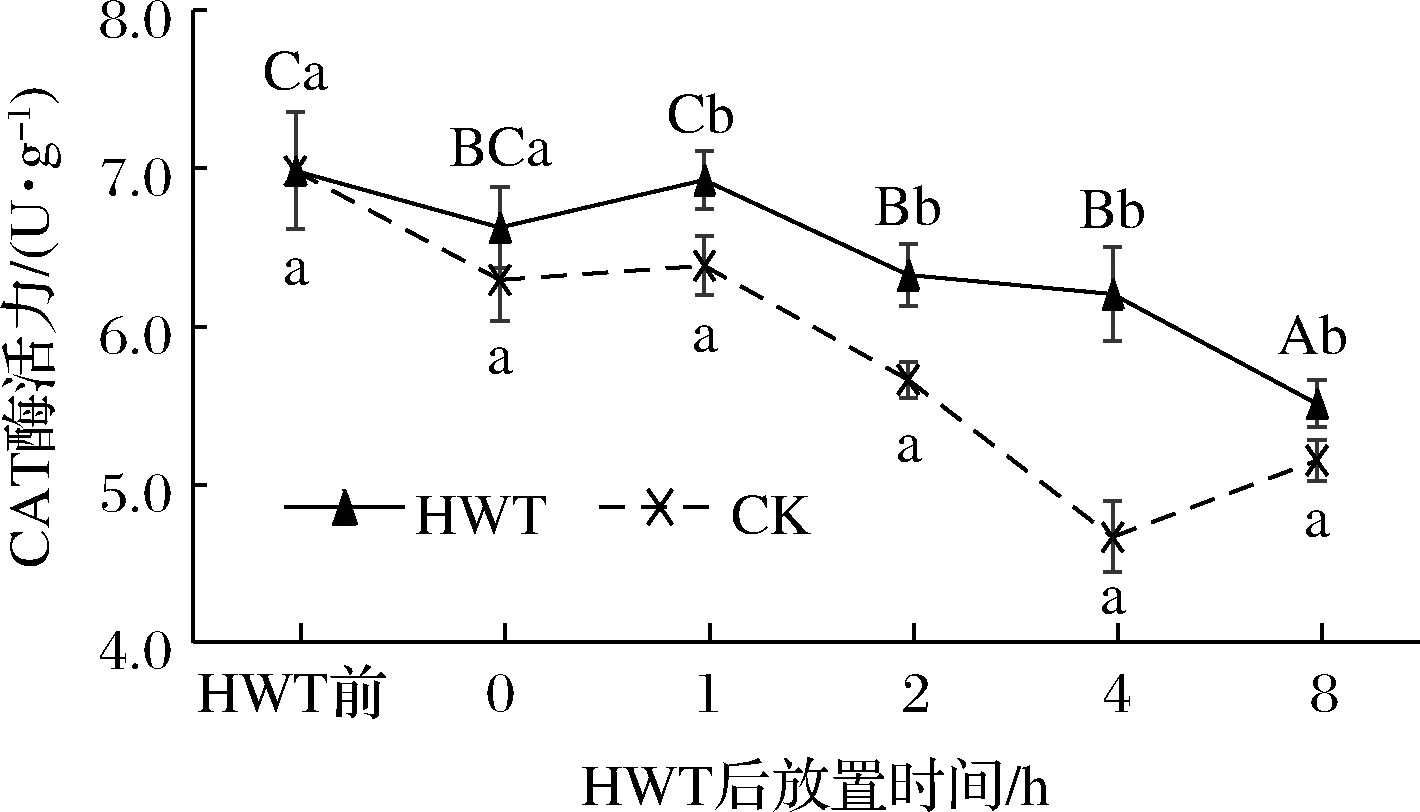
图8 热水处理后环境放置期间黄瓜果实中CAT活性变化
Fig.8 Change of CAT activity in cucumber fruit during environmental storage after HWT
如图9所示,热水处理后0~8 h黄瓜果实POD活性呈先下降后上升的趋势且均显著高于CK(P<0.05)。热水处理后0 h黄瓜果实POD活性较热水处理前显著升高,而在0~2 h逐步下降,这可能是由于0 h为热水处理环境与放置环境的临界点,温度湿度差使黄瓜机体POD活性瞬时升高。热水处理后2 h黄瓜果实POD活性为最低水平但仍然显著高于CK(P<0.05)。这表明热水处理能够提高POD的活性,且热水处理后2 h的放置使热胁迫的损伤效果降低。

图9 热水处理后环境放置期间黄瓜果实中POD活性变化
Fig.9 Change of POD activity in cucumber fruit during environmental storage after HWT
如图10所示,热水处理后0~8 h黄瓜果实APX活性呈先上升后下降的趋势,且显著高于CK和热水处理前(P<0.05)。热水处理后0 h黄瓜果实APX 含量相较于热水处理前显著升高(P<0.05),并在随后的0~2 h持续升高,在2 h 时达到最高水平(P<0.05);而在随后的2~8 h APX活性缓慢下降。这表明热水处理上调黄瓜果实中APX活性效果显著,且在热水处理后2 h达到最高活性。
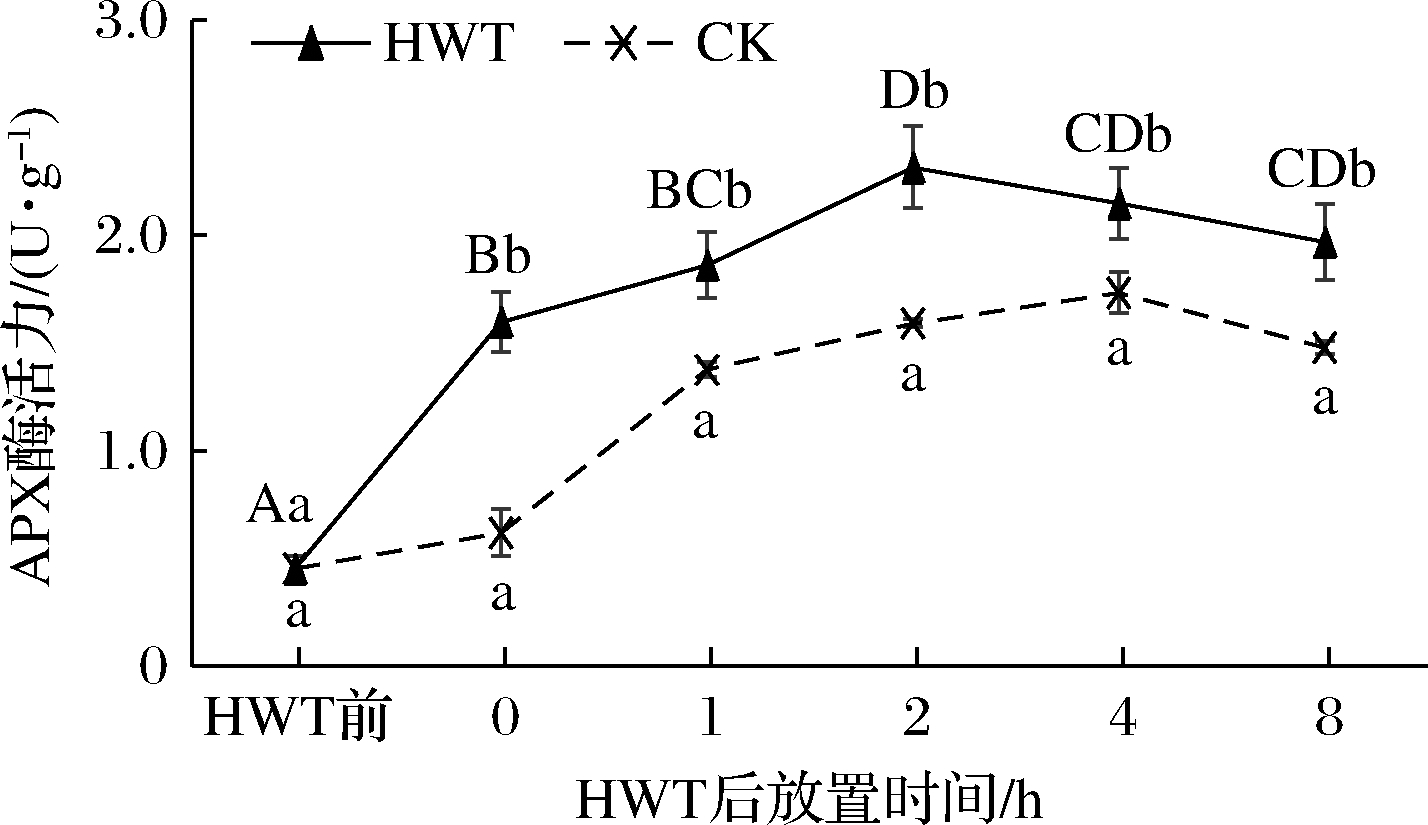
图10 热水处理后环境放置期间黄瓜果实中APX活性变化
Fig.10 Change of APX activity in cucumber fruit during environmental storage after HWT
低温贮藏可能会造成冷敏果实的冷害现象,从而降低水果和蔬菜的感官品质、营养品质和商业价值,而冷害指数是反映冷敏果蔬低温贮藏期间冷害发生情况的指标。如表1所示,低温贮藏黄瓜果实的冷害程度受热水处理后放置时间影响显著,在整个贮藏期间,所有热水处理组黄瓜果实的冷害指数均显著低于CK(P<0.05);而在所有热水处理组之间,热水处理后放置2 h组的冷害指数始终保持最低水平(0.28)且其差异具有显著性(P<0.05),而对照组则高达0.58。在本研究中,即使热水处理后的不同放置时间对低温贮藏过程中黄瓜果实的冷害指数有影响,但热水处理后所有不同放置时间组的冷害指数仍显著低于对照组,尤其是放置2 h组始终表现出最低的冷害指数。这可能表明热水处理后放置2 h是诱导黄瓜抗冷性并减轻黄瓜在贮藏期间冷害症状的有效方法。
表1 热水处理后不同环境放置时间对黄瓜果实冷藏6 d冷害指数的影响
Table 1 Effect of after HWT storage time on chilling injury index of cucumber cold storage for 6 d
放置时间CK0 h1 h2 h4 h8 h冷害指数0.58±0.02e0.52±0.01d0.39±0.03bc0.28±0.02a0.36±0.02b0.42±0.02c
注:同一行中不含相同小写字母表示差异显著(P<0.05)
果蔬机体在逆境胁迫下会造成![]() 和H2O2的积累。
和H2O2的积累。![]() 是果蔬机体通过呼吸作用生成的首要副产物,是一种氧化还原活性都很强的活性氧[18]。活性氧化学性质非常活泼,被众多国内外学者认为是一类损伤植物机体的毒性物质。因此,果蔬中
是果蔬机体通过呼吸作用生成的首要副产物,是一种氧化还原活性都很强的活性氧[18]。活性氧化学性质非常活泼,被众多国内外学者认为是一类损伤植物机体的毒性物质。因此,果蔬中![]() 等活性氧自由基的水平可作为衡量果蔬机体氧化损伤程度的指标[4,7]。当
等活性氧自由基的水平可作为衡量果蔬机体氧化损伤程度的指标[4,7]。当![]() 低浓度积累时可诱导以其为底物的抗氧化酶的活性如SOD [19],SOD被激活时可清除果蔬体内积累的低浓度
低浓度积累时可诱导以其为底物的抗氧化酶的活性如SOD [19],SOD被激活时可清除果蔬体内积累的低浓度![]() 使机体内活性氧的产生与清除处于平衡;而当
使机体内活性氧的产生与清除处于平衡;而当![]() 持续向高浓度积累时,因酶与底物结合生成中间产物后,即使在增加底物浓度,中间产物浓度也不会增加,酶促反应速度也不增加[15,17],机体内活性氧产生与清除的平衡被打破,造成植物机体损伤。在本研究中热水处理后放置2、4 h的黄瓜果实
持续向高浓度积累时,因酶与底物结合生成中间产物后,即使在增加底物浓度,中间产物浓度也不会增加,酶促反应速度也不增加[15,17],机体内活性氧产生与清除的平衡被打破,造成植物机体损伤。在本研究中热水处理后放置2、4 h的黄瓜果实![]() 浓度得到显著抑制。SOD活性的高低在一定程度上能反映果实抵御氧化损伤的能力[20-21]。H2O2作为果蔬组织氧化代谢的组成部分,是一种强氧化剂,H2O2的积累会引发局部氧化损伤,从而导致代谢功能受到破坏并在其积累的部位失去细胞完整性[8]。本研究结果表明热水处理能显著降低黄瓜 H2O2含量的积累,抑制果实膜脂过氧化进程,且在热水处理后2 h左右对H2O2含量的抑制作用最显著。此外,在本研究中,热水处理后0 h黄瓜果实SOD活性较热水处理前显著下降,这可能是因为黄瓜果实刚离开热水环境,湿度温度差导致调控SOD酶生成的途径受到影响[16-17]。适宜的热水处理能显著提高SOD的活性,但此热激效果的发挥需要给黄瓜果实适应环境的时间,在放置2 h左右热激效果得到发挥。这与邵婷婷等[7]发现采后热水处理显著抑制青椒果实
浓度得到显著抑制。SOD活性的高低在一定程度上能反映果实抵御氧化损伤的能力[20-21]。H2O2作为果蔬组织氧化代谢的组成部分,是一种强氧化剂,H2O2的积累会引发局部氧化损伤,从而导致代谢功能受到破坏并在其积累的部位失去细胞完整性[8]。本研究结果表明热水处理能显著降低黄瓜 H2O2含量的积累,抑制果实膜脂过氧化进程,且在热水处理后2 h左右对H2O2含量的抑制作用最显著。此外,在本研究中,热水处理后0 h黄瓜果实SOD活性较热水处理前显著下降,这可能是因为黄瓜果实刚离开热水环境,湿度温度差导致调控SOD酶生成的途径受到影响[16-17]。适宜的热水处理能显著提高SOD的活性,但此热激效果的发挥需要给黄瓜果实适应环境的时间,在放置2 h左右热激效果得到发挥。这与邵婷婷等[7]发现采后热水处理显著抑制青椒果实![]() 及H2O2浓度、提升其SOD活性的结果相一致;同样地,在西葫芦果实[13]中也有类似的结果。
及H2O2浓度、提升其SOD活性的结果相一致;同样地,在西葫芦果实[13]中也有类似的结果。
GSH-AsA循环是果蔬机体中抗氧化系统重要的一环[22],因此,维持AsA和GSH水平对果蔬机体尤为重要。AsA不仅是评估果蔬品质的重要指标,还是清除果蔬中活性氧的重要抗氧化剂[7]。环境胁迫中低温或高温胁迫都可能会激活AsA的生物合成基因以及维持AsA合成前体物质的含量,这表明人为施加适当的温度胁迫时可能有助于植物体内AsA的生物合成[23-24]。在本研究中,适度的热胁迫有助于果蔬体内AsA的生物合成,且在热水处理后0~4 h内均能有效维持AsA含量的升高。GSH是一种重要的生物功能因子,广泛分布于植物机体内,具有抗氧化、清除自由基的作用,在维持细胞生理功能方面起着重要的作用[22]。GSH作为植物体活性氧清除系统中十分重要的非酶类抗氧化剂,是组成GSH-AsA循环的非常关键的部分,该循环在清除H2O2的过程中起着重要作用。其含量能直接指示果蔬抵抗活性氧有害影响的能力[25]。在本研究中,热水处理后2 h黄瓜果实仍有最高的GSH含量,这表明热水处理后放置2 h对于正向热激作用的发挥是有益的。
果蔬机体中主要的酶促抗氧化系统由SOD、CAT、APX和POD等构成[22]。SOD是果蔬机体抵抗氧化胁迫的第一道防线,能将![]() 歧化为O2和 H2O2,以消除超氧自由基对细胞的损伤,可能在细胞的活性氧清除机制中起主要作用[19]。SOD 是一种被诱导酶,其水平会随着活性氧含量升高而上升[22]。SOD活性的高低在一定程度上能反映果实抵御氧化损伤的能力[20-21]。在本研究中,适宜的热水处理能显著提高SOD的活性,但此热激效果的发挥需要给黄瓜果实适应环境的时间,在放置2 h左右热激效果得到发挥。CAT是果蔬中活性氧清除系统的主要酶之一,当果蔬机体受到氧化胁迫产生氧化应激反应时被激活,可以催化 H2O2 分解,减少对组织造成的氧化伤害[26]。在本研究中,热水处理能延缓CAT活性的下降,并可在果体温度接近最适酶活温度时促进CAT的活力。POD广泛分布于动植物界,是以H2O2为电子受体催化酚类和胺类等底物氧化的酶[27],具有消除H2O2、酚类和胺类等植物细胞中毒性物质的作用[28];此外,POD除参与植物机体中H2O2的清除过程外还会参与组织伤口愈合和木质化等过程,而 WANG等[29]研究发现 ,POD在分解H2O2的同时会产生新的自由基,因此,植物机体中较高的POD活性除表征植物组织清除活性氧的能力外,可能还指示了植物组织较高的损伤程度,而较低的POD活性表明损伤程度较小[22]。在本研究中,热水处理能够提高POD的活性,且热水处理后2 h的放置使热胁迫的损伤效果降低。APX是分布于叶绿体、线粒体、微体和胞浆的植物细胞中分解H2O2的关键酶,APX利用2个抗坏血酸分子将H2O2还原成水,与SOD 和 CAT 协同清除机体内的活性氧,延缓和抑止植物细胞过氧化作用[22]。在本研究中,黄瓜果实中APX活性受热水处理温度调控显著,热水处理使黄瓜果实中APX活性显著升高,且在热水处理后2 h达到最高活性。
歧化为O2和 H2O2,以消除超氧自由基对细胞的损伤,可能在细胞的活性氧清除机制中起主要作用[19]。SOD 是一种被诱导酶,其水平会随着活性氧含量升高而上升[22]。SOD活性的高低在一定程度上能反映果实抵御氧化损伤的能力[20-21]。在本研究中,适宜的热水处理能显著提高SOD的活性,但此热激效果的发挥需要给黄瓜果实适应环境的时间,在放置2 h左右热激效果得到发挥。CAT是果蔬中活性氧清除系统的主要酶之一,当果蔬机体受到氧化胁迫产生氧化应激反应时被激活,可以催化 H2O2 分解,减少对组织造成的氧化伤害[26]。在本研究中,热水处理能延缓CAT活性的下降,并可在果体温度接近最适酶活温度时促进CAT的活力。POD广泛分布于动植物界,是以H2O2为电子受体催化酚类和胺类等底物氧化的酶[27],具有消除H2O2、酚类和胺类等植物细胞中毒性物质的作用[28];此外,POD除参与植物机体中H2O2的清除过程外还会参与组织伤口愈合和木质化等过程,而 WANG等[29]研究发现 ,POD在分解H2O2的同时会产生新的自由基,因此,植物机体中较高的POD活性除表征植物组织清除活性氧的能力外,可能还指示了植物组织较高的损伤程度,而较低的POD活性表明损伤程度较小[22]。在本研究中,热水处理能够提高POD的活性,且热水处理后2 h的放置使热胁迫的损伤效果降低。APX是分布于叶绿体、线粒体、微体和胞浆的植物细胞中分解H2O2的关键酶,APX利用2个抗坏血酸分子将H2O2还原成水,与SOD 和 CAT 协同清除机体内的活性氧,延缓和抑止植物细胞过氧化作用[22]。在本研究中,黄瓜果实中APX活性受热水处理温度调控显著,热水处理使黄瓜果实中APX活性显著升高,且在热水处理后2 h达到最高活性。
本研究以“申青”黄瓜为材料,研究了热水处理后0~8 h放置期间黄瓜果实果体温度变化、活性氧水平及与其代谢相关酶的变化。研究结果表明,热水处理后0 h黄瓜果体温度高达36.5 ℃,随后的0~1 h黄瓜果体温度急剧下降,1~2 h果体温度缓慢下降,2~8 h黄瓜果体温度下降并持续稳定在环境温度;热水处理后放置2、4 h的黄瓜果实中抗氧化酶(SOD、APX、CAT)及抗氧化物质(AsA、GSH)的活性显著提高,而具有细胞毒性的H2O2和![]() 的含量则被显著抑制;此外,热水处理后放置2 h再进入低温贮藏环境的黄瓜果实在贮藏期间显示出较低的冷害指数。因此,热水处理后应将黄瓜果实于室温下放置2 h左右,以使黄瓜果实机体得以自我调节、抗氧化酶系统活性得以提高。
的含量则被显著抑制;此外,热水处理后放置2 h再进入低温贮藏环境的黄瓜果实在贮藏期间显示出较低的冷害指数。因此,热水处理后应将黄瓜果实于室温下放置2 h左右,以使黄瓜果实机体得以自我调节、抗氧化酶系统活性得以提高。
[1] 赵昱瑄,张敏,姜雪,等.短时热处理对低温逆境下黄瓜不同部位的冷害及活性氧代谢影响[J].食品与发酵工业,2020,46(7):180-187.
ZHAO Y X,ZHANG M,JIANG X,et al.Effects of short time heat treatment on chilling injury and reactive oxygen metabolism in different parts of cucumber under low temperature[J].Food and Fermentation Industries,2020,46(7):180-187.
[2] 杨杰,王灵玲,鲁雨轩.我国果蔬产业冷链物流运输研究[J].粮食科技与经济,2020,45(4):75-76.
YANG J,WANG L L,LU Y X,et al.Research on cold chain logistics transportation of fruit and vegetable industry in my country[J].Grain Science and Technology and Economy,2020,45(4):75-76.
[3] 张敏,解越.采后果蔬低温贮藏冷害研究进展[J].食品与生物技术学报,2016,35(1):1-11.
ZHANG M,XIE Y.Research progress of chilling injury on post-harvest fruits and vegetables stored at low temperature[J].Journal of Food Science and Biotechnology,2016,35(1):1-11.
[4] ENDO H,MIYAZAKI K,OSE K,et al.Hot water treatment to alleviate chilling injury and enhance ascorbate-glutathione cycle in sweet pepper fruit during postharvest cold storage[J].Scientia Horticulturae,2019,257:108715.
[5] 郝佳诗,王愈,尹建云,等.短波紫外线结合热处理对黄瓜冷害及抗氧化代谢的影响[J].浙江农林大学学报,2018,35(3):476-482.
HAO J S,WANG Y,YIN J Y,et al.Chilling injury and antioxidative metabolism in cucumber with combined UV-C and heat treatment[J].Journal of Zhejiang A&F University,2018,35(3):476-482.
[6] LURIE S.Postharvest heat treatments[J].Postharvest Biology and Technology,1998,14(3):257-269.
[7] 邵婷婷,张敏,刘威,等.采后热水处理对青椒果实低温贮藏期间活性氧代谢及抗氧化物质的影响[J].食品与发酵工业,2019,45(12):133-139.
SHAO T T,ZHANG M,LIU W,et al.Effects of postharvest hot water treatment on active oxygen metabolism and antioxidative substances in green peppers during low temperature storage[J].Food and Fermentation Industries,2019,45(12):133-139.
[8] ZHANG M,LIU W,LI C H,et al.Postharvest hot water dipping and hot water forced convection treatments alleviate chilling injury for zucchini fruit during cold storage[J].Scientia Horticulturae,2019,249:219-227.
[9] ENDO H,OSE K,BAI J H,et al.Effect of hot water treatment on chilling injury incidence and antioxidative responses of mature green mume (Prunus mume) fruit during low temperature storage[J].Scientia Horticulturae,2019,246:550-556.
[10] AGHDAM M S,SEVILLANO L,FLORES F B,et al.Heat shock proteins as biochemical markers for postharvest chilling stress in fruits and vegetables[J].Scientia Horticulturae,2013,160:54-64.
[11] SHADMANI N,AHMAD S H,SAARI N,et al.Chilling injury incidence and antioxidant enzyme activities of Carica papaya L.‘Frangi’as influenced by postharvest hot water treatment and storage temperature[J].Postharvest Biology and Technology,2015,99:114-119.
[12] WANG H B,ZHANG Z Q,XU L Y,et al.The effect of delay between heat treatment and cold storage on alleviation of chilling injury in banana fruit[J].Journal of the Science of Food and Agriculture,2012,92(13):2 624-2 629.
[13] 姜雪,张敏,赵昱瑄.不同初始机体温度对热水处理西葫芦果实低温贮藏品质和活性氧代谢的影响[J].食品与发酵工业,2020,46(5):231-239.
JIANG X,ZHANG M,ZHAO Y,et al.Effects of different initial body temperatures on low-temperature storage quality and active oxygen metabolism of hot water treated zucchini fruit[J].Food and Fermentation Industries,2020,46(5):231-239.
[14] 李君兰,马勇,康慧仁,等.热空气处理对冷藏鲜枣衰老软化及相关酶活性的影响[J].现代食品科技,2017,33(3):237-243;236.
LI J L,MA Y,KANG H R,et al.Effects of hot-air treatment on the senescence and softening of fresh jujube fruits during cold storage[J].Modern Food Science and Technology,2017,33(3):237-243;236.
[15] 郭勇.酶的生产与应用[M].北京:化学工业出版社,2003.
GUO Y.Enzyme Production and Application[M].Beijing:Chemical Industry Press,2003.
[16] 高惠滢,胡薇.生物体的抗氧化酶系统概述[J].生物学教学,2018,43(10):3-5.
GAO H Y,HU W.An overview of the antioxidant enzyme system in organisms[J].Biology Teaching,2018,43(10):3-5.
[17] 冯作化,药立波.生物化学与分子生物学[M].第3版.北京:人民卫生出版社,2015.
FENG Z H,YAO L B.Biochemistry and Molecular Biology[M].3rd ed.Beijing:People's Medical Publishing House,2015.
[18] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2011.
CAO J K,JIANG W B,ZHAO Y M.Experiment Guidance of Postharvest Physiology and Biochemistry of Fruits and Vegetables[M].Beijing:China Light Industry Press,2011.
[19] 白英俊,李国瑞,黄凤兰,等.活性氧与植物抗氧化系统研究进展[J].安徽农业科学,2017,45(36):1-3.
BAI Y J,LI G R,HUANG F L,et al.Research progress of reactive oxygen species and plant antioxidant system[J].Journal of Anhui Agricultural Sciences,2017,45(36):1-3.
[20] 陈楚英,周梦娇,韩舒睿,等.热空气处理对冷藏新余蜜橘活性氧代谢的影响[J].江西农业大学学报,2014,36(3):507-513.
CHEN C Y,ZHOU M J,HAN S R,et al.Effect of hot air flowing on reactive oxygen metabolism of Xinyu tangerine during cold storage[J].Acta Agriculturae Universitatis Jiangxiensis,2014,36(3):507-513.
[21] WANG C Y.Effect of temperature preconditioning on catalase,peroxidase,and superoxide dismutase in chilled zucchini squash[J].Postharvest Biology and Technology,1995,5(1-2):67-76.
[22] 胡均如,张敏.热处理提高采后果蔬低温贮藏期间活性氧清除能力的机制[J].食品与发酵工业,2021,47(12):269-276.
HU J R,ZHANG M.Mechanism of heat treatment to improve the active oxygen scavenging ability of postharvest vegetables during low temperature storage[J].Food and Fermentation Industries,2021,47(12):269-276.
[23] MASSOT C,BANCEL D,LOPEZ LAURI F L,et al.High temperature inhibits ascorbate recycling and light stimulation of the ascorbate pool in tomato despite increased expression of biosynthesis genes[J].PLoS One,2013,8(12):e84474.
[24] 赵云峰,林河通,王静,等.热处理对龙眼果实采后生理和贮藏品质的影响[J].中国食品学报,2014,14(5):124-133.
ZHAO Y F,LIN H T,WANG J,et al.Effects of heat treatment on postharvest physiology and storage quality of longan fruits[J].Journal of Chinese Institute of Food Science and Technology,2014,14(5):124-133.
[25] 邵婷婷,姜雪,张敏,等.贮前强制对流热空气处理对低温胁迫下青椒果实AsA-GSH 循环代谢的影响[J].食品与发酵工业,2019,45(18):65-72.
SHAO T T,JIANG X,ZHANG M,et al.Effects of pre-storage forced convective hot air treatment on AsA-GSH cycle of green pepper in low temperature stress[J].Food and Fermentation Industries,2019,45(18):65-72.
[26] IMAHORI Y,BAI J H,BALDWIN E.Antioxidative responses of ripe tomato fruit to postharvest chilling and heating treatments[J].Scientia Horticulturae,2016,198:398-406.
[27] NASEF I N.Short hot water as safe treatment induces chilling tolerance and antioxidant enzymes,prevents decay and maintains quality of cold-stored cucumbers[J].Postharvest Biology and Technology,2018,138:1-10.
[28] 詹秀飞,慕明涛,杨飞.医学细胞生物学[M].北京:中国协和医科大学出版社,2019.
ZHAN X F,MU M T,YANG F.Medical Cell Biology[M].Beijing:Peking Union Medical College Press,2019.
[29] WANG C Y.Effect of temperature preconditioning on catalase,peroxidase,and superoxide dismutase in chilled zucchini squash[J].Postharvest Biology and Technology,1995,5(1-2):67-76.