GB/T 17204—2021《饮料酒术语和分类》中将乙醇体积分数在0.5%以上的酒精饮料定义为饮料酒,包括发酵酒、蒸馏酒以及配制酒。挥发性酚类化合物是饮料酒的重要香味组分,对饮料酒的香气、口味以及稳定性等方面均具有重要的作用[1]。此外研究表明,酚类物质还具有一定的生理活性[2]。它们主要来源于酿酒原料中的阿魏酸、木质素、单宁等,经过细菌和酵母的发酵形成,或是由微生物转化制曲过程的中间产物形成[3]。
挥发性酚类物质对饮料酒的产品品质有较大影响[4],准确定量分析饮料酒中挥发性酚类化合物对研究产品风味质量、调控优化生产工艺具有重要意义。目前,已报道的酒样中微量成分的前处理方法主要有直接进样、固相微萃取(solid phase microextraction,SPME)、液液萃取(liquid-liquid extraction,LLE)、固相萃取(solid phase extraction,SPE)、搅拌棒吸附萃取(stir bar sorptive extraction,SBSE)等方法[5];挥发性酚类化合物的检测方法主要是上述前处理方法与GC、GC-MS、HPLC等方法联合使用[6-8]。2010年朱燕等[9]应用SPME和GC-MS分析白酒中游离挥发性酚类化合物,发现不同香型成品白酒中这些挥发性酚类化合物的种类、质量浓度差异较大,其中浓香型成品白酒中酚类物质总质量浓度较高。2017年孙啸涛等[10]采用涡旋辅助LLE结合GC-MS法建立了白酒中4-甲基愈创木酚、4-乙基愈创木酚的检测方法,不同添加水平的平均回收率为80.1%~88.0%。2018年赵雅敏等[11]采用液液微萃取(liquid-liquid microextraction,LLME)结合GC-MS联用技术建立了1种检测饮料酒中9种挥发性酚类化合物的方法。饮料酒中挥发性酚类化合物性质差异较大、质量浓度低,选择适合的提取方法至关重要。SPME方法具有操作简便、绿色环保的优点[5],但是萃取效果会受到较多因素的影响且基质影响严重[12];SBSE方法具有萃取容量高等优点[5],但该方法耗时长、操作步骤多[12]。与传统LLE相比,LLME 具有加快萃取平衡速率、提高萃取效率的优点,同时减少低沸点化合物的损失[13]。HPLC常用于难挥发性物质分析,不适于挥发性酚类化合物的定量分析;相较于GC-MS,气相色谱-串联质谱(GC-MS/MS)具有选择性高、定量更准确的优点[14],目前LLME结合GC-MS/MS在挥发性酚类化合物分析方面的应用还少有报道。
本研究采用LLME结合GC-MS/MS,通过对萃取溶剂、酒样酒精度、酒样加入NaCl质量浓度、静置时间4个影响因素进行单因素考察,建立了1种定量饮料酒中挥发性酚类化合物的方法,相较于SPME-GC-MS方法,本方法萃取效率和准确度更高。进一步,使用该方法定量分析了5种不同香型白酒、威士忌及保健酒共35个样品中的挥发性酚类化合物,结果发现10种挥发性酚类化合物在不同类型饮料酒中的质量浓度具有较大差异。
1 材料与方法
1.1 材料与试剂
共35个实验酒样,样品信息见表1。
表1 样品信息列表
Table 1 Information of test samples

样品信息数量样品编号生产厂家备注小曲清香型白酒5XQJ-1~5湖北劲牌有限公司原酒大曲清香型白酒5DQQXJ-1~5湖北绣林玉液酒业原酒浓香型白酒5NXJ-1~5四川宜宾六尺巷酒业原酒酱香型白酒5JXJ-1~5贵州茅台镇酒业原酒米香型白酒5MXJ-1~5广西天龙泉酒业原酒中国劲酒5ZGJJ-1~5湖北劲牌有限公司成品酒威士忌酒5WSK-1~5苏格兰威士忌成品酒
标准品与试剂:苯酚、4-甲基苯酚、愈创木酚、4-乙基苯酚、4-甲基愈创木酚、4-乙基愈创木酚、2,6-二甲氧基苯酚、丁子香酚、4-乙烯基愈创木酚、2,6-二甲氧基-4-甲基苯酚、4-甲基苯酚-d7、2-甲氧基-d3-苯酚、4-乙基苯酚-d10、丁子香酚-d3,均为色谱纯,上海安谱实验科技股份有限公司;无水乙醇、无水乙醚、乙酸乙酯、正己烷、二氯甲烷,均为色谱纯,德国CNW公司;NaCl、Na2SO4,均为分析纯,国药集团化学试剂有限公司;所用水为本实验室自制超纯水。
1.2 仪器与设备
AB135-S十万分之一电子分析天平,瑞士Mettler-Toledo公司;FA2004万分之一天平,上海精密科学仪器有限公司;Multi Reax涡旋振荡仪,德国海道夫仪器公司;3K15高速离心机,美国SIGMA公司;SK8200HP超声波清洗器,上海科导超声仪器有限公司;8890B—7000D气相色谱三重四极杆串联质谱仪(GC-MS/MS)、7890B-5977C气相色谱质谱联用仪、DB-FFAP毛细管色谱柱(60 m×0.25 mm,0.25 μm),美国Agilent科技有限公司;MPS 2多功能样品前处理平台,德国Gerstel公司;50/30 μm二乙基苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/polydimethylsiloxane,DVB/CAR/PDMS)萃取头,美国Supelco公司。
1.3 实验方法
1.3.1 目标化合物混合溶液的配制
以无水乙醇为溶剂配制苯酚、4-甲基苯酚、愈创木酚、4-乙基苯酚、4-甲基愈创木酚、4-乙基愈创木酚、2,6-二甲氧基苯酚、丁子香酚、4-乙烯基愈创木酚、2,6-二甲氧基-4-甲基苯酚共10种目标化合物混合标准溶液,质量浓度均为10.0 mg/L。以体积分数为60%的乙醇溶液为溶剂将上述标准溶液稀释20倍,标识为Model样品。
1.3.2 标准溶液与标准系列工作液的配制
以乙酸乙酯为溶剂配制苯酚、4-甲基苯酚、愈创木酚、4-乙基苯酚、4-甲基愈创木酚、4-乙基愈创木酚、2,6-二甲氧基苯酚、丁子香酚、4-乙烯基愈创木酚、2,6-二甲氧基-4-甲基苯酚共10种目标化合物混合标准溶液,质量浓度均为5.0 mg/L。用乙酸乙酯将上述混合标准溶液逐级稀释成标准系列工作液,质量浓度依次为2.0、1.0、0.5、0.2、0.1、0.05、0.02、0.01 mg/L。
1.3.3 内标溶液的配制
以乙酸乙酯为溶剂配制2-甲氧基-d3-苯酚(IS1)、4-甲基苯酚-d7(IS2)、4-乙基苯酚-d10(IS3)、丁子香酚-d3(IS4)共4种化合物混合溶液作为内标溶液,质量浓度均为5.0 mg/L。
1.3.4 样品前处理
1.3.4.1 LLME法的优化
采用单因素法依次优化萃取溶剂(乙酸乙酯、乙醚、二氯甲烷、正已烷)、酒样酒精度(体积分数依次为10%、20%、30%、40%、50%、60%)、酒样中加入NaCl质量浓度(0、0.12、0.24、0.36 g/mL)、静置时间(2、4、8、12、24 h)4个影响因素。萃取溶剂的选择:准确吸取4 mL 1.3.1中所述Model样品于50 mL离心管中,稀释至体积分数为10%,加入20 μL内标溶液,混合均匀,加入NaCl饱和,振摇5 min,再分别加入2 mL不同萃取溶剂,振摇5 min,超声10 min,以8 000 r/min离心10 min,静置12 h,收集上层萃取液,加入无水Na2SO4置于冰箱冷冻室(-18 ℃)内干燥过夜,过滤后所得样液用于GC-MS/MS分析。其他3个因素依次进行优化。上述实验条件的优化均进行3次平行实验。
1.3.4.2 酒样前处理
准确吸取1.1中所述酒样4 mL于50 mL离心管中,采用上述优化后的方法进行前处理,所得样液,用于GC-MS/MS分析。
1.3.5 分析条件
气相色谱条件:载气为高纯He(纯度≥99.999%),恒流模式,流速为1.0 mL/min;升温程序为初温60 ℃,保持1 min,以20 ℃/min升至180 ℃,再以3.5 ℃/min升至240 ℃;进样口温度为250 ℃,进样量为1 μL,不分流进样。
质谱条件:电子轰击源(EI Xtr350)能量为70 eV;离子源温度230 ℃;四级杆温度150 ℃;辅助通道加热温度280 ℃;动态多反应监测模式(dMRM)。10种酚类物质和4种同位素内标物经GC-MS/MS进行SCAN模式的全扫描(m/z 30~550),得到全扫描质谱图。选择丰度较高,质荷比合适的碎片离子作为母离子,进行二级质谱扫描,从二级质谱图中选择响应较高的碎片离子作为子离子。通过改变碰撞电压来优化能量,最终选取表2中的保留时间和质谱特征离子对。
表2 十种挥发性酚类化合物保留时间、监测离子对 和碰撞电压表
Table 2 The retention time,monitoring ion pair,and collision voltage for 10 phenols

编号化合物内标保留时间/min定量离子对(m/z)碰撞电压/V定性离子对(m/z)碰撞电压/V12-甲氧基-d3-苯酚IS1∗12.102127/8125127/109102愈创木酚IS112.125124/8115124/812034-甲基愈创木酚IS113.231138/12310138/95204苯酚IS213.72994/66.11594/65.12054-乙基愈创木酚IS114.155137/12210137/911064-甲基苯酚-d7IS2∗14.699115/8520115/1141074-甲基苯酚IS214.770107/77.115108/107.11584-乙基苯酚-d10IS3∗16.027131/11315113/112109丁子香酚-d3IS4∗16.117167/14910167/1311010丁子香酚IS416.152164.1/149.110164.1/104.115114-乙基苯酚IS316.143107/7715107/10710124-乙烯基愈创木酚IS116.653150/7730150/13510132,6-二甲氧基苯酚IS417.771154/13910154/11115142,6-二甲氧基-4-甲基苯酚IS419.229168/15310168/12515
注:*指该化合物为内标物
2 结果与分析
2.1 LLME方法中4个优化因素对挥发性酚类物质回收率的影响
实验考察了4个因素(萃取溶剂、酒样酒精度、酒样加入NaCl质量浓度、静置时间)对LLME萃取10种目标挥发性酚类化合物的结果影响,取1 mL 1.3.2中与Model样品相同质量浓度的标准系列工作液于样品瓶中,加入10 μL内标溶液,混合均匀后直接进样,以内标峰面积法计算Model样品中10种挥发性酚类化合物的质量浓度和回收率,分析结果如图1所示。
由于待测酚类化合物种类较多,理化性质存在差异,选择的萃取溶剂需考虑多种酚类的萃取效果,实验比较了乙醚、乙酸乙酯、正己烷、二氯甲烷分别为萃取溶剂时挥发性酚类化合物的萃取效果(图1-a)。4种有机溶剂的萃取效果从优到差依次为乙酸乙酯、乙醚、二氯甲烷、正已烷,其中以乙酸乙酯萃取溶剂时,酚类化合物的萃取效果最佳,10种目标化合物的加标回收率为95.81%~102.49%,相对标准偏差(relative standard deviation,RSD)<5%,这一实验结果与酚类化合物的化学性质较为吻合,因此选择乙酸乙酯作为酚类化合物的萃取溶剂。
由于样品中酒精体积分数对萃取效果存在影响,实验通过调整酒精度的方法,考察了60%、50%、40%、30%、20%、10%酒精体积分数水平下挥发性酚类化合物的实验结果(图1-b)。部分酚类化合物的回收率实验结果随着酒精度的增加出现下降趋势,酒精度为10%时,酚类化合物的萃取效果最佳,10种目标化合物的加标回收率为99.67%~102.49%,且RSD<5%,因此实验确定样品萃取酒精度为10%;对于酒精度低于10%的样品,可以直接萃取,无需稀释步骤。
Na+可以改变样品溶液中水相的极性,影响萃取效果,实验通过加入质量浓度0、0.12、0.24、0.36 g/mL 的NaCl溶液测定了挥发性酚类化合物的萃取效果(图1-c),加入NaCl质量浓度为0.36 g/mL,即饱和状态时,酚类化合物的萃取效果最佳,10种挥发性酚类化合物的加标回收率为99.67%~102.49%,且RSD<5%,因此实验选择加入质量浓度为0.36 g/mL的NaCl为后续样品前处理实验条件。
为了水相和有机相达到最佳的分离状态,样品萃取过程需进行静置。实验考察了2、4、8、12、24 h共5个静置时间下酚类化合物的实验结果(图1-d),酚类化合物的萃取效果随静置时间的延长呈上升趋势,当静置时间达到12 h后,回收率趋于稳定,10种挥发性酚类化合物的加标回收率为98.81%~102.13%,且RSD<5%,综合考虑工作效率,选择12 h作为最佳静置时间。
2.2 LLME方法参数的确认
综上所述,LLME最优萃取条件为:以乙酸乙酯为萃取溶剂,酒样酒精度稀释至体积分数为10%,加入0.36 g/mL NaCl溶液,静置时间为12 h;在该优化条件下,Model样品中10种挥发性酚类化合物均具有良好的峰形,GC-MS/MS色谱图如图2所示。

a-萃取溶剂;b-酒样酒精度;c-NaCl质量浓度;d-静置时间
图1 萃取溶剂、酒样酒精度、酒样加入NaCl质量浓度、静置时间对LLME结果的影响
Fig.1 Effect of LLME parameters:extraction solvent,alcoholic content of liquor,NaCl concentration, resting time on the extraction efficiency of volatile compounds
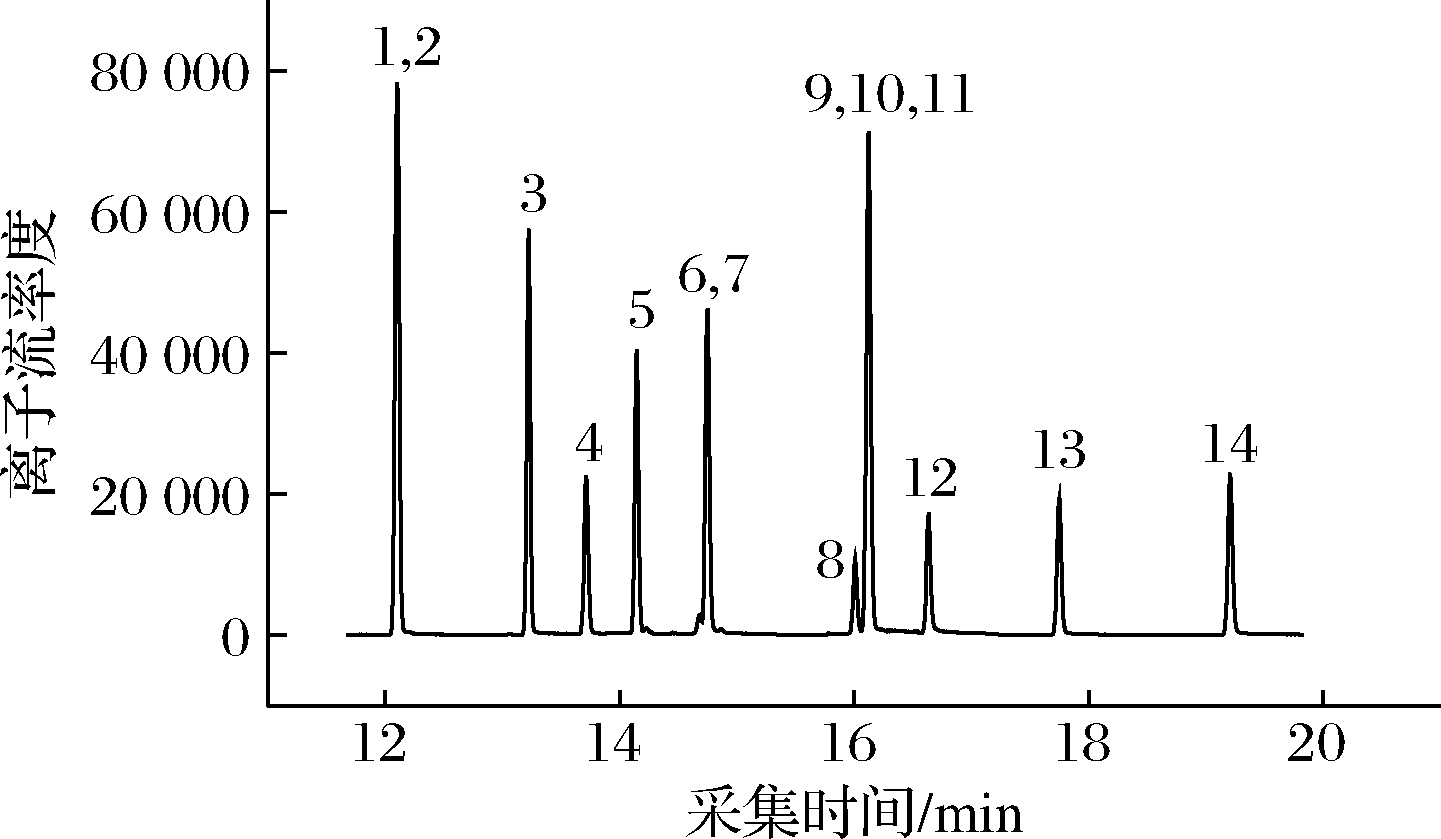
1-2-甲氧基-d3-苯酚;2-愈创木酚;3-4-甲基愈创木酚;4-苯酚;5-4-乙基愈创木酚;6-4-甲基苯酚-d7;7-4-甲基苯酚;8-4-乙基苯酚-d10;9-丁子香酚-d3;10-丁子香酚;11-4-乙基苯酚;12-4-乙烯基愈创木酚;13-2,6-二甲 氧基苯酚;14-2,6-二甲氧基-4-甲基苯酚
图2 十种酚类化合物的总离子流色谱图
Fig.2 TIC chromatogram of 10 phenol compounds
2.3 方法评价
2.3.1 线性范围、检出限与定量限
将1.3.2中8个不同浓度梯度的标准系列工作液进入GC-MS/MS分析,获得10种目标酚类化合物与4种内标物的峰面积,以各化合物与对应内标的峰面积比为纵坐标(y),以相应质量浓度比为横坐标(x)绘制标准曲线,得到各待测化合物的线性方程。以3倍信噪比(S/N=3)计算检出限(limit of detection,LOD),以10倍信噪比(S/N=10)计算定量限(limit of quantitation,LOQ),实验结果如表3所示。10种挥发性酚类化合物在相应的浓度范围内线性关系良好,r2均大于0.998,10种挥发性酚类化合物的LOD为1.0~10.0 μg/L,LOQ为3.5~35.0 μg/L,表明该方法具有良好的线性和灵敏度。
表3 10种酚类化合物的线性范围、线性关系、检出限及定量限
Table 3 Linear range,linear equations,LODs,and LOQs of 10 phenols
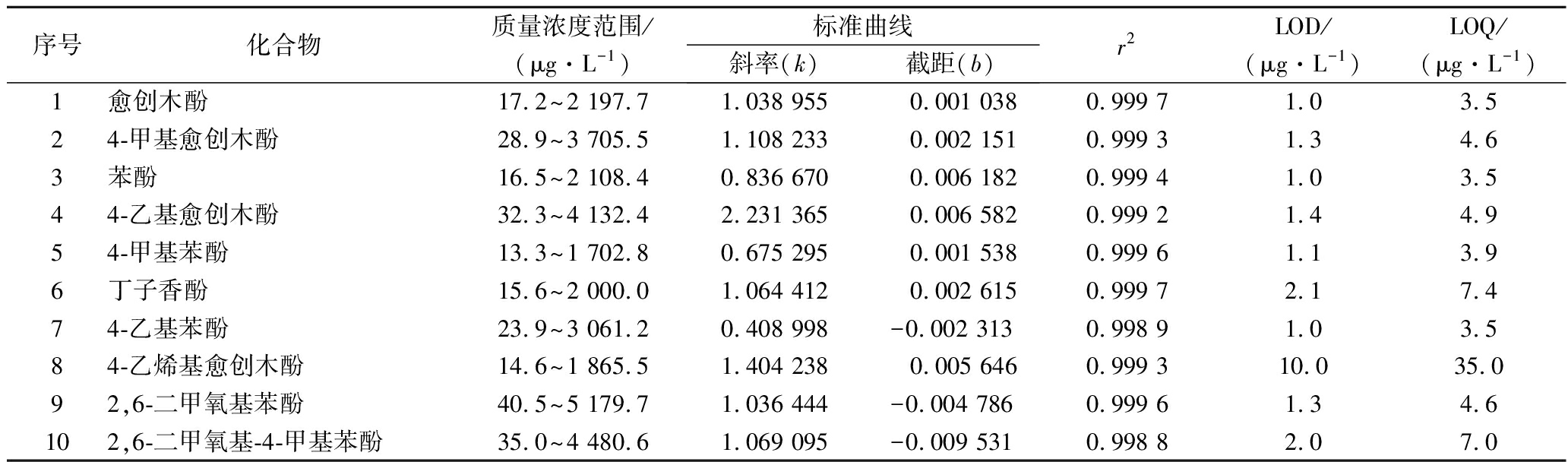
序号化合物质量浓度范围/(μg·L-1)标准曲线斜率(k)截距(b)r2LOD/(μg·L-1)LOQ/(μg·L-1)1愈创木酚17.2~2 197.71.038 955 0.001 0380.999 71.03.524-甲基愈创木酚28.9~3 705.51.108 233 0.002 1510.999 31.34.63苯酚16.5~2 108.40.836 670 0.006 1820.999 41.03.544-乙基愈创木酚32.3~4 132.42.231 365 0.006 5820.999 21.44.954-甲基苯酚13.3~1 702.80.675 295 0.001 5380.999 61.13.96丁子香酚15.6~2 000.01.064 412 0.002 6150.999 72.17.474-乙基苯酚23.9~3 061.20.408 998-0.002 3130.998 91.03.584-乙烯基愈创木酚14.6~1 865.51.404 238 0.005 6460.999 310.035.092,6-二甲氧基苯酚40.5~5 179.71.036 444-0.004 7860.999 61.34.6102,6-二甲氧基-4-甲基苯酚35.0~4 480.61.069 095-0.009 5310.998 82.07.0
2.3.2 回收率与精密度
以酚类化合物质量浓度较低的酒样XQJ-3为基质,分别按照高、中、低3个浓度水平进行加标回收率测定,每个浓度水平共6个平行样,目标化合物的回收率和精密度见表4。10种酚类化合物在不同浓度下的添加回收率为92.3%~100.7%,RSD为0.3%~3.7%。本方法的准确度与精密度均符合有关标准和法规的要求。
表4 十种酚类化合物的加标回收率与相对标准偏差(n=6)
Table 4 Recoveries and RSDs of 10 phenols in liquor samples (n=6)

序号化合物空白质量浓度/(μg·L-1)加标质量浓度/(μg·L-1)测定值/(μg·L-1)回收率/%RSD/%1愈创木酚2.19109.88,219.77,329.65108.01,212.73,319.3196.3,95.8,96.20.324-甲基愈创木酚2.07177.16,359.06,543.04169.48,350.00,532.6294.5,96.9,97.71.73苯酚30.05132.62,204.94,309.62159.09,229.25,333.1797.3,97.2,97.90.444-乙基愈创木酚N.D206.62,413.24,619.86199.18,409.52,618.6296.4,99.1,99.81.954-甲基苯酚19.6085.14,170.28,255.4198.35,180.17,261.9992.5,94.3,94.91.36丁子香酚N.D100.00,200.00,299.9994.40,190.60,287.6994.4,95.3,95.90.874-乙基苯酚51.2093.28,186.55,279.83138.79,239.06,329.3593.9,100.7,99.43.784-乙烯基愈创木酚N.D153.10,306.12,459.18144.07,288.37,428.8794.1,94.2,93.40.592,6-二甲氧基苯酚7.59258.98,517.97,776.95250.26,504.84,751.9193.7,96,95.81.3102,6-二甲氧基-4-甲基苯酚2.30224.03,448.06,672.09184.22,417.21,628.0291.2,92.6,93.11.1
注:N.D表示低于检出限(下同)
2.3.3 方法的对比分析
将本实验建立的LLME-GC-MS/MS与HS-SPME-GC-MS方法进行对比。根据2.3.2的方法,以酒样XQJ-3为基质,分别按照高、中、低3个浓度水平进行加标回收率测定,每个浓度水平共6个平行样,分别采用LLME-GC-MS/MS与HS-SPME-GC-MS方法进行分析。HS-SPME-GC-MS参照文献[15]的方法稍做改进,将上述待测样品用超纯水稀释至体积分数10%,取8 mL稀释液于20 mL顶空瓶中并加NaCl至饱和,加入20.0 μL内标溶液充分混合并在50 ℃下孵育5 min以达到平衡,将固相微萃取纤维头(先行在250 ℃下老化30 min)插入顶空瓶中并萃取45 min,定期振动(每振动10 s后停止2 s),萃取结束后将纤维头插入GC-MS进样口,在250 ℃下解吸5 min,进行GC-MS分析,计算10种目标化合物的回收率和精密度,2种方法的结果如图3所示。采用HS-SPME-GC-MS方法测定时,10种挥发性酚类化合物的回收率为88.4%~95.2%,RSD为3.6%~11.3%。回收率略低于本实验建立的LLME-GC-MS/MS方法,而方法的重复性则明显不及LLME-GC-MS/MS。表明该实验建立的方法在测定饮料酒中10种挥发性酚类化合物时,具有更为准确而稳定重复的优点。

1-愈创木酚;2-4-甲基愈创木酚;3-苯酚;4-4-乙基愈创木酚; 5-4-甲基苯酚;6-丁子香酚;7-4-乙基苯酚; 8-4-乙烯基愈创木酚;9-2,6-二甲氧基苯酚; 10-2,6-二甲氧基-4-甲基苯酚
图3 采用LLME-GC-MS/MS与HS-SPME-GC-MS分析10种 挥发性酚类化合物回收率对比图
Fig.3 Comparison of recoveries of 10 phenols in liquor samples by LLME-GC-MS/MS and HS-SPME-GC-MS
2.4 实际样品的测定
应用本实验优化后的GC-MS/MS方法定量分析不同香型白酒、威士忌、保健酒样品中的挥发性酚类物质,其中小曲清香型白酒、大曲清香型白酒、浓香型白酒、酱香型白酒、米香型白酒、威士忌及中国劲酒各5个,共计35个样品,结果见表5。
表5 不同饮料酒中挥发性酚类化合物含量 单位:μg/L
Table 5 Content of 10 volatile phenolic compounds in different beverage alcohol

样品愈创木酚4-甲基愈创木酚苯酚4-乙基愈创木酚4-甲基苯酚丁子香酚4-乙基苯酚4-乙烯基愈创木酚2,6-二甲氧基苯酚2,6-二甲氧基-4-甲基苯酚XQJ-154.2272.2746.4025.8056.35N.D166.7334.9441.2644.58XQJ-220.413.7035.40N.D67.85N.D122.95N.D3.77N.DXQJ-32.192.0730.05N.D19.60N.D51.20N.D7.592.30XQJ-440.40N.D93.25N.D20.55N.D111.40N.DN.D2.21XQJ-51.291.6230.85N.D10.95N.D217.30N.DN.D2.69DQQXJ-11.75N.D189.53N.D475.35N.D10.38N.DN.DN.DDQQXJ-235.29169.55179.00208.0930.40N.D84.65N.DN.DN.DDQQXJ-327.85111.8548.25272.7934.00N.D670.0528.52N.DN.DDQQXJ-4N.D2.25406.052.557.85N.D205.80N.DN.D2.45DQQXJ-57.602.6218.3012.052.30N.D13.85N.DN.DN.DNXJ-11.57N.D57.23N.D157.55N.D15.98N.DN.DN.DNXJ-28.056.47235.6511.43855.70N.D74.45N.DN.DN.DNXJ-38.5410.19243.7011.77866.30N.D49.45N.DN.DN.DNXJ-47.189.29148.156.14608.75N.D5.05N.DN.DN.DNXJ-513.5020.12338.6513.721 840.70N.D5.26N.DN.DN.DJXJ-151.33270.6259.93204.218.68N.D53.1012.20N.DN.DJXJ-229.985.3957.707.007.60N.D27.35N.DN.DN.DJXJ-334.6330.6564.2025.538.05N.D22.00N.DN.DN.DJXJ-426.21N.D62.80N.D7.35N.D18.65N.DN.DN.DJXJ-5N.DN.D57.65N.D11.20N.D23.55N.DN.DN.DMXJ-1N.DN.D5.85N.DN.DN.DN.DN.DN.DN.DMXJ-2N.D12.677.7048.551.55N.D223.05N.DN.DN.DMXJ-32.55N.D15.3015.75N.DN.D13.80N.DN.DN.DMXJ-41.39N.D37.75N.D14.00N.DN.DN.DN.DN.DMXJ-52.51N.D40.853.6416.70N.DN.DN.DN.DN.DZGJJ-151.98110.2555.0830.1629.104 935.22145.43440.1354.166.14ZGJJ-250.86100.0565.3527.8126.706 611.65174.85528.2933.018.95ZGJJ-361.10174.1569.6544.3836.556 297.95211.75634.5040.8625.27ZGJJ-447.4181.7069.1520.8429.155 792.65167.95547.1460.3118.36ZGJJ-554.8958.2060.7516.2827.005 885.00179.40627.3447.1120.07WSK-1106.1714.3051.306.722.8590.40N.D114.71495.0612.94WSK-232.797.9336.257.9711.40N.D10.5039.48106.217.13WSK-346.4010.759.9014.714.15178.20238.30135.38228.1621.89WSK-438.735.366.6010.343.10N.D9.2598.66105.4610.71WSK-535.815.579.4514.101.60N.D15.0579.4684.169.05
有研究表明,4-乙基苯酚、4-乙基愈创木酚、4-乙烯基苯酚和4-乙烯基愈创木酚等挥发性酚在酒中的总质量浓度<400 μg/L,为酒的风味贡献辛香、烟气和革香韵,当其总质量浓度>620 μg/L时,会使酒的“酚样特征”过于明显;酒会产生腥异味,掩盖酒的香味[16]。表5结果表明,7种不同饮料酒中酚类化合物种类和质量浓度间存在显著差异。10种酚类化合物在中国劲酒中均有检出,而且质量浓度都比较高,中国劲酒中质量浓度最高的酚类化合物为丁子香酚,质量浓度范围为4 935.22~6 611.65 μg/L,其他饮料酒中均未检出丁子香酚。丁子香酚天然存在于丁香油、丁香罗勒油等中,具有辛香、烟熏香、甜香香味,可以抗菌、抗氧化,同时还具有解热镇痛、麻醉等药效[17];此外,在中国劲酒中质量浓度较高的挥发性酚类化合物还包括4-甲基苯酚、4-甲基愈创木酚、4-乙基愈创木酚、愈创木酚等,这些化合物多具有独特的辛香、烟熏香、草药香,天然主要存在于合金欢、茴香、肉桂和芹菜籽中[18];其中4-甲基愈创木酚、4-乙基愈创木酚能够通过抑制自由基的生成来维持细胞稳态,是优良的自由基清除剂,4-乙基愈创木酚还可以通过抑制炎症因子和炎性体的表达,从而起到细胞内抗炎的作用[19];愈创木酚可用于慢性支气管炎多痰咳嗽的治疗[20]。中国劲酒属于配制酒,使用了大量的中药材,这是中国劲酒中酚类化合物的主要来源;酚类化合物是中国劲酒烟熏香的主要来源,对中国劲酒药香、辛香和甜香等特征香气的形成也具有重要作用;高浓度的酚类化合物对中国劲酒的保健功能同样具有重要影响。
酚类物质为白酒提供独特的烟熏风味、焦酱味、奶香味和窖泥味等,是白酒主要风味的组成[16,21]。在5种不同类型白酒中,米香型白酒中酚类化合物种类最少、质量浓度最低,这与米香型白酒的生产工艺有关,米香型白酒采用液态或者半固态发酵工艺,用曲量少,发酵期短,且酿造米香型白酒所使用的糖化发酵剂的主要微生物是糖化力很强的根霉和发酵力旺盛的酵母,酶系较为简单[22]。有些酚类化合物带给饮料酒异嗅味,如苯酚具有药气味、烟臭味,4-甲基苯酚具有窖泥臭、皮革臭、焦皮臭、动物臭,4-乙基苯酚呈动物臭、马厩臭[23]。从表5可知,这3种化合物在各香型白酒中均有检出,其中浓香型白酒中4-甲基苯酚质量浓度最高,可达1 840 μg/L,明显高于其他饮料酒。江南大学徐岩团队通过检测窖泥中的可挥发性组分后,确认浓香型白酒产生窖泥臭的化合物是4-甲基苯酚[24]。此外,通过数据对比发现,小曲清香型白酒中酚类化合物的质量浓度和种类与其生产工艺具有重要关系,如样品XQJ-1为传统工艺酿造,相较于自动化生产工艺酿造的小曲清香型白酒样品,酚类化合物的种类更多、质量浓度更高,这与传统工艺为开放式生产,酿造过程中微生物酶系更为复杂具有关系。在5种不同类型白酒中,酱香型白酒中愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚质量浓度最高;4-乙基愈创木酚在高浓度时闻香呈臭豆酱气味,低浓度时似酱香空杯留香气味,曾被认为酱香型白酒的主体香气化合物[25];愈创木酚具有水果香、焦酱香,茅台酒中的愈创木酚质量浓度与“粮香”强度具有相关性,其对“粮香”有着十分重要的作用[26]。本实验同时发现在一轮次酱香型白酒中愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚质量浓度高于其他轮次酒,而三、四轮次质量浓度则较为接近,这个结果后续还需要通过增加样品量进行深入验证。
相较于白酒,威士忌酒中酚类化合物的种类和质量浓度都较高,尤其是愈创木酚、4-乙基愈创木酚、4-乙烯基愈创木酚、2,6-二甲氧基苯酚、2,6-二甲氧基-4-甲基苯酚等化合物的质量浓度相对较高,这些化合物的来源与威士忌酒采用橡木桶作为储存容器具有重要关系,它们为威士忌酒提供橡木香和烟熏气味,是形成威士忌酒独特风味的重要化合物。
3 结论
本实验采用液液微萃取结合气相色谱-串联质谱联用技术,通过对比考察前处理实验参数,优选了1种饮料酒中挥发性酚类化合物的实验方法。采用该方法对5种不同香型的白酒、威士忌及中国劲酒样品中挥发性酚类化合物进行了分析。结果表明,该方法在白酒、威士忌、保健酒样品中均适用,所测10种酚类化合物在不同类型饮料酒中质量浓度分布差异较大。米香型白酒中酚类化合物种类最少、质量浓度最低;苯酚、4-甲基苯酚、4-乙基苯酚在所有香型白酒中均存在,其中浓香型白酒中4-甲基苯酚质量浓度最高;酱香型白酒中愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚质量浓度最高;10种酚类化合物在中国劲酒中均有检出,而且质量浓度都比较高,中国劲酒中质量浓度最高的酚类化合物为丁子香酚,其他饮料酒中均未检出丁子香酚。本方法可为饮料酒中酚类化合物的研究提供方法参考。
[1] VAN BEEK S,PRIEST F G.Decarboxylation of substituted cinnamic acids by lactic acid bacteria isolated during malt whisky fermentation[J].Applied and Environmental Microbiology,2000,66(12):5 322-5 328.
[2] 徐岩,范文来,葛向阳,等.科学认识中国白酒中的生物活性成分[J].酿酒科技,2013(9):1-6.
XU Y,FAN W L,GE X Y,et al.Scientific recognition of biofunctional components in Chinese liquors[J].Liquor-Making Science & Technology,2013(9):1-6.
[3] 庄名扬.中国白酒香味物质形成机理及酿酒工艺的调控[J].四川食品与发酵,2007,43(2):1-6.
ZHUANG M Y.The production mechanism of the fragrance in the Chinese spirit & the operation of the spirit brewing[J].Sichuan Food and Fermentation,2007,43(2):1-6.
[4] 董睿,杨敏,彭黔荣,等.饮料酒中挥发性酚类物质分析方法研究进展[J].中国酿造,2011,30(3):9-13.
DONG R,YANG M,PENG Q R,et al.Progress in determination of volatile phenols in alcoholic beverages[J].China Brewing,2011,30(3):9-13.
[5] 孙宝国,吴继红,黄明泉,等.白酒风味化学研究进展[J].中国食品学报,2015,15(9):1-8.
SUN B G,WU J H,HUANG M Q,et al.Recent advances of flavor chemistry in Chinese liquor spirits(Baijiu)[J].Journal of Chinese Institute of Food Science and Technology,2015,15(9):1-8.
[6] 丁云连,范文来,徐岩,等.老白干香型白酒香气成分分析[J].酿酒,2008,35(4):109-113.
DING Y L,FAN W L,XU Y,et al.Analysis of aroma components in laobaigan-flavor liquor[J].Liquor Making,2008,35(4):109-113.
[7] 李俊,杜楠,袁旭,等.气相色谱质谱法测定酱香型白酒中挥发性酚类物质[J].酿酒科技,2017(1):98-101.
LI J,DU N,YUAN X,et al.Determination of volatile phenols in Jiangxiang Baijiu by GC-MS[J].Liquor-Making Science & Technology,2017(1):98-101.
[8] 冒德寿,牛云蔚,姚征民,等.顶空固相微萃取-气相色谱质谱联用和气相色谱嗅闻技术鉴定清香型白酒特征香气物质[J].中国食品学报,2019,19(7):251-261.
MAO D S,NIU Y W,YAO Z M,et al.Characterization of the key aroma compounds in Chinese light aroma-type liquors by headspace solid-phase microextraction-gas chromatography-mass spectrometry,gas chromatography-olfactometry[J].Journal of Chinese Institute of Food Science and Technology,2019,19(7):251-261.
[9] 朱燕,范文来,徐岩.应用DI-SPME和GC-MS分析白酒中游离挥发性酚类化合物[J].食品与发酵工业,2010,36(10):138-143.
ZHU Y,FAN W L,XU Y.Determination of free volatile phenolic compounds in Chinese liquors(Baijiu) using direct immersion-solid phase microextraction coupled with gas chromatography-mass spectrometry[J].Food and Fermentation Industries,2010,36(10):138-143.
[10] 孙啸涛,王宗元,刘淼,等.涡旋辅助液液微萃取结合GC-MS法检测67种白酒中四甲基吡嗪、4-甲基愈创木酚和4-乙基愈创木酚[J].食品科学,2017,38(18):73-79.
SUN X T,WANG Z Y,LIU M,et al.Determination of tetramethylpyrazine-4-methyl guaiacol and 4-ethyl guaiacol in 67 Chinese Baijiu samples by vortex assisted liquid-liquid microextration combined with gas chromatography-mass spectrometry[J].Food Science,2017,38(18):73-79.
[11] 赵雅敏,林琳,王和玉,等.液-液微萃取结合气相色谱-质谱联用技术快速测定饮料酒中挥发性酚类化合物[J].分析科学学报,2018,34(6):789-794.
ZHAO Y M,LIN L,WANG H Y,et al.Quantitative analysis of volatile phenols in alcoholic beverages by liquid-liquid microextration coupled with gas chromatography-mass spectrometry[J].Journal of Analytical Science,2018,34(6):789-794.
[12] 唐平,山其木格,王丽,等.白酒风味化学研究方法及酱香型白酒风味化学研究进展[J].食品科学,2020,41(17):315-324.
TANG P,SHAN Q M G,WANG L,et al.A review of research methods in baijiu flavor chemistry and recent progress in the flavor chemistry of Maotai-flavored Baijiu[J].Food Science,2020,41(17):315-324.
[13] 林文轩,敖灵,董蔚,等.白酒风味物质前处理方法的研究进展[J].食品与发酵工业,2021,47(15):307-314.
LIN W X,AO L,DONG W,et al.Research progress of the pretreatment methods on flavoring substances in Baijiu[J].Food and Fermentation Industries,2021,47(15):307-314.
[14] 乔海霞,曹宁,蔡可文,等.QuEChERS-三重四极杆气质联用法测定大米中12种农药残留量[J].食品安全质量检测学报,2019,10(10):3 150-3 154.
QIAO H X,CAO N,CAI K W,et al.Determination of 12 kinds of pesticide residues in rice by QuEChERS-gas chromatography-triple quadrupole mass spectrometry[J].Journal of Food Safety & Quality,2019,10(10):3 150-3 154.
[15] 孙细珍,左可成,唐娟,等.基于气相色谱-嗅闻-质谱技术结合化学计量法分析小曲清香型白酒醛异味成分[J].食品与发酵工业,2021,47(16):263-270.
SUN X Z,ZUO K C,TANG J,et al.Analysis of aldehyde off-flavor compounds of Xiaoqu light flavor Baijiu based on GC-O-MS combined with chemometric method[J].Food and Fermentation Industries,2021,47(16):263-270.
[16] CABONI P,SARAIS G,CABRAS M,et al.Determination of 4-ethylphenol and 4-ethylguaiacol in wines by LC-MS-MS and HPLC-DAD-fluorescence[J].Journal of Agricultural and Food Chemistry,2007,55(18):7 288-7 293.
[17] 彭宅彪,张琼光,代虹健,等.丁香酚的药理学研究进展[J].时珍国医国药,2006,17(10):2 079-2 081.
PENG Z B,ZHANG Q G,DAI H J,et al.Advances in pharmacological studies of eugenol[J].Lishizhen Medicine and Materia Medica Research,2006,17(10):2 079-2 081.
[18] 孙宝国.食用香料手册[M].北京:中国石化出版社,2004:75-82.
SUN B G.Handbook of Edible Spices[M].Beijing:China Petrochemical Press,2004:75-82.
[19] 赵东瑞.古井贡酒风味物质及酚类风味物质的抗氧化性和抗炎性的研究[D].广州:华南理工大学,2019.
ZHAO D R.Research on the aroma compounds of Gujinggong Chinese Baijiu and evaluation of the antioxidant and anti-inflammatory effects of phenolic aroma compounds[D].Guangzhou:South China University of Technology,2019.
[20] 黄蕴利,黄永光,郭旭.白酒中的主要生物活性功能成分研究进展[J].食品工业科技,2016,37(15):375-379.
HUANG Y L,HUANG Y G,GUO X.Bioactive functional components in Chinese liquor[J].Science and Technology of Food Industry,2016,37(15):375-379.
[21] MCMURROUGH I,MADIGAN D,DONNELLY D,et al.Control of ferulic acid and 4-vinyl guaiacol in brewing[J].Journal of the Institute of Brewing,1996,102(5):327-332.
[22] GOU M,WANG H Z,YUAN H W,et al.Characterization of the microbial community in three types of fermentation starters used for Chinese liquor production[J].Journal of the Institute of Brewing,2015,121(4):620-627.
[23] 范文来,徐岩.白酒79个风味化合物嗅觉阈值测定[J].酿酒,2011,38(4):80-84.
FAN W L,XU Y.Determination of odor thresholds of volatile aroma compounds in baijiu by a forced-choice ascending concentration series method of limits[J].Liquor Making,2011,38(4):80-84.
[24] 刘博,杜海,王雪山,等.基于高通量测序技术解析浓香型白酒中窖泥臭味物质4-甲基苯酚的来源[J].微生物学通报,2017,44(1):108-117.
LIU B,DU H,WANG X S,et al.Detecting source of p-cresol in strong flavor Chinese liquor by high throughput sequencing[J].Microbiology China,2017,44(1):108-117.
[25] 周恒刚.4-乙基愈创木酚[J].酿酒,1989(6):17-19.
ZHOU H G.4-Ethyl guaiacol[J].Liquor Making,1989(6):17-19.
[26] 杨玉波,倪德让,林琳,等.高粱蒸煮风味物质香气活力研究[J].食品与发酵工业,2018,44(5):222-226.
YANG Y B,NI D R,LIN L,et al.Odor activity study on the aroma compounds of steamed sorghum[J].Food and Fermentation Industries,2018,44(5):222-226.