铁蛋白(ferritin)是一个古老而庞大的蛋白家族,普遍存在于各种动物、植物以及微生物体内。它是一种分子质量为450 kDa左右的大分子蛋白,由24个亚基自组装形成中空笼形结构[1]。铁蛋白在生物体内主要是参与机体铁元素的代谢平衡以及保护细胞免受因各种环境胁迫而导致的细胞氧化损伤[2]。20世纪80年代以来,随着纳米技术的飞速发展和铁蛋白结构特性认识的加深,铁蛋白作为一种新型的蛋白质纳米材料已经被广泛用于无机纳米颗粒合成[3]、生物传感器[4]、生物成像[5]、药物递送[6]等领域。基于铁蛋白独特的纳米笼形结构,其内部的纳米空间结构可装载各种食品功能活性物质。由于铁蛋白外壳的稳定性良好,一旦外源性分子被装载到铁蛋白空腔内部,笼形结构外壳可将其与复杂的外界环境隔绝开来,避免与外界的大分子物质、氧化剂、酸碱物质等接触,以适应各种复杂的加工条件,有助于保护包埋物的生物活性;蛋白质外壳结构还可以有效降低环境中的光照和热量等因素的不良影响,稳定包埋物的理化特性[7]。因此,铁蛋白纳米笼在生物活性物质递送的研究中已经展现出良好的应用效果和发展前景。本文将对铁蛋白的分布、结构及其制备方法进行介绍,总结铁蛋白纳米颗粒装载外源性小分子的途径,即基于可逆组装特性的分子装载途径和基于环境响应的通道“门控”特性的分子装载途径,并综述了铁蛋白纳米颗粒在食品功能活性物质包埋中的应用。
1 铁蛋白纳米笼的分子结构
铁蛋白是生物体内一种十分重要的富含铁元素的铁贮存及去毒蛋白质,在生物体内具有调节铁代谢平衡的功能;还可以清除铁介导的自由基反应,保护机体免受环境胁迫而导致的细胞氧化性损伤[8]。铁蛋白广泛存在于各种动物、植物以及微生物中[9-11]。生物体内的铁蛋白主要由蛋白质外壳和铁核2部分构成。铁核是由磷酸盐和氢氧化铁组成的非均匀无机纳米颗粒[10];蛋白质外壳是由24个亚基组装而成的高度对称的中空笼形结构(图1)。该结构的内径约为7~8 nm,外径约为12~13 nm,厚度约为2~2.5 nm。一般情况下,铁蛋白的笼形结构是按照F432对称方式组装形成的近似正八面体结构[1]。高度对称的组装方式使得铁蛋白纳米笼具有8个相同的三重轴通道和6个相同的四重轴通道,这些通道的直径大小约为0.3~0.5 nm,是离子或者分子等物质进出铁蛋白的主要路径,在铁蛋白内部空腔与外界环境的物质和能量交换中扮演着十分重要的角色[11]。铁蛋白的每个亚基呈近似圆柱状,长约5 nm,直径约为2.5 nm,主要由4个长α-螺旋(A,B,C,D)和C端第5个较短α-螺旋结构组成。与动物铁蛋白相比,植物铁蛋白除了具有保守的螺旋结构之外,其亚基结构还包含一个N端的EP(extension peptide)结构,延伸于铁蛋白的外壳表面,参与铁蛋白的氧化沉淀[12]。
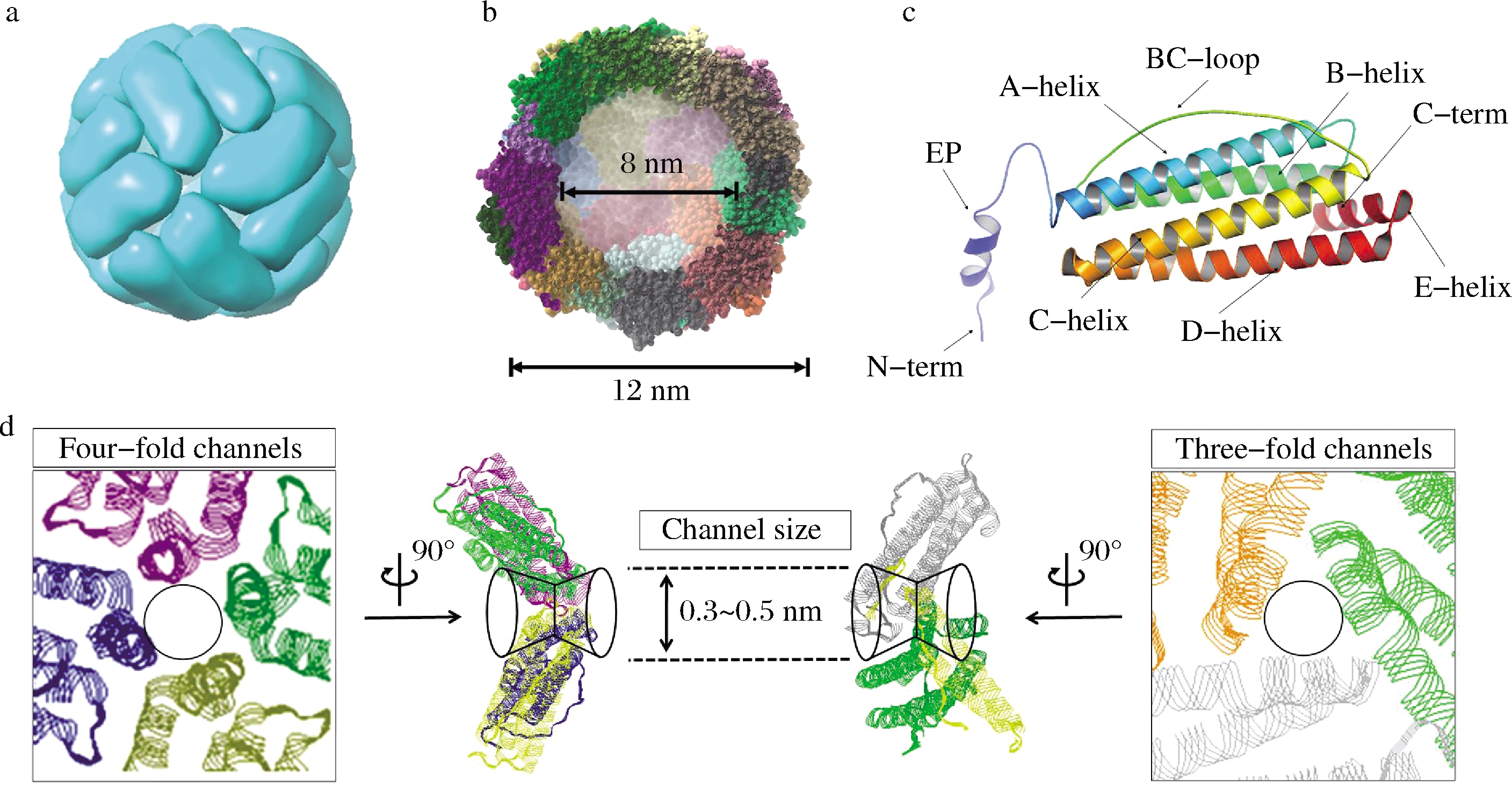
a-铁蛋白的笼形结构;b-铁蛋白的内外直径;c-植物铁蛋白的亚基结构;d-铁蛋白的三重轴和四重轴通道
图1 铁蛋白结构及其离子通道
Fig.1 The structure of ferritin protein and its ions channels
2 铁蛋白纳米笼的制备及表征方法
2.1 生物材料提取天然铁蛋白
铁蛋白的来源非常广泛,几乎在所有的生物体内都有发现。目前,科研工作者相继从各种动植物组织中如猪脾、鲟鱼肝脏、大豆、红小豆、鹰嘴豆、花芸豆等分离出铁蛋白,并建立了动植物铁蛋白的分离纯化方法[2,7,13-14]。从动植物组织中提取铁蛋白的基本流程主要包括:组织细胞破碎、粗料液热处理、中性盐沉淀以及色谱分离。其中,提取温度、缓冲液pH值、料液比、中性盐的种类、盐浓度等是提取铁蛋白的主要影响因素,对铁蛋白产率的影响较大。例如,辛敏等[13]在单因素试验的基础上,采用L9(34)正交试验方法优化了鹰嘴豆铁蛋白的提取工艺。各种实验因素对鹰嘴豆铁蛋白提取率的影响顺序依次为:料液比>盐浓度>温度>pH。在天然铁蛋白的提取工艺过程中,料液的加热处理可以有效地去除热敏感杂蛋白,提高铁蛋白的提取率。基于铁蛋白较高的热稳定性,粗料液热处理一般于60~75 ℃水浴加热20 min。
2.2 基因工程制备
利用基因工程的方法,使铁蛋白基因在宿主细胞中高效表达,可以为铁蛋白工业化生产奠定基础。大肠杆菌表达系统遗传背景清楚,培养周期短并且表达水平高,是目前基因工程制备铁蛋白的主要表达系统。研究发现多种来源的铁蛋白基因可以在大肠杆菌表达系统中高效地表达并折叠形成正确的蛋白质三维构象[15-19],如缢蛏蛋白[16]、牡蛎铁蛋白[17]、大豆铁蛋白[18]等。相比于生物组织的提取方法,利用DNA重组技术制备铁蛋白具有产量高、周期短、利于分离纯化等特点。基因工程技术制备铁蛋白的产量会受到外源铁蛋白基因本身的特性、表达系统、培养条件如温度、诱导剂以及诱导时间等因素的影响。通过控制宿主细胞的培养温度、诱导剂浓度及诱导时间可以提升铁蛋白的产率。夏小雨等[19]探究了中式发酵罐制备人源重链铁蛋白的生产工艺,对搅拌转速、空气量以及诱导时间3个关键的工艺参数进行了优化,实验结果表明在中式发酵罐中表达铁蛋白的最佳搅拌转速为200 r/min,空气通量1.6 L/min,表达时间9 h。该研究的开展为工业化制备铁蛋白纳米递送系统奠定了研究基础。
2.3 铁蛋白的鉴定及表征
目前,基于对不同来源铁蛋白的广泛研究,系统的鉴定和表征方法得以建立,电泳技术、电镜技术等是鉴定和表征铁蛋白最常用的方法。由于铁蛋白是24个蛋白亚基组成的中空笼形结构蛋白,因此,采用变性电泳、非变性电泳及透射电子显微镜技术可以有效地对铁蛋白的结构进行鉴定和表征。另外,随着科学技术的快速发展,肽指纹图谱和X射线晶体衍射技术也逐步被用于铁蛋白的结构表征。
3 铁蛋白纳米笼包埋外源性小分子的途径
铁蛋白具有特殊的笼状结构,其天然的内部空腔为外源性营养素、药物等小分子的装载提供了良好的空间基础。目前,将食品生物活性物质装载至铁蛋白内部空腔的途径主要依赖于可逆组装特性的调控和环境响应通道门控特性的调控。
3.1 基于可逆组装特性的分子装载途径
铁蛋白的亚基以自组装的方式形成中空的笼形24聚体,维系亚基与亚基之间的相互作用力主要是氢键、盐桥、疏水作用力等弱相互作用力。在一定的物理和化学条件下,铁蛋白笼形结构可以发生解聚并重新组装。多数铁蛋白具有独特的pH值响应的可逆组装特性(图2),即在pH≤2.0或pH≥11.0的条件下,铁蛋白能够解离成单亚基状态,当环境恢复至中性条件时,铁蛋白亚基又自发的重新组装,形成中空球状结构[20]。因此,在铁蛋白复性的过程中,外源性小分子物质可以通过物理截留以及化学结合的方式有效地包埋于铁蛋白的内部空腔[21-22]。利用这一可逆组装特性,已经成功地实现了姜黄素[22]、花青素[23]、胡萝卜素[24]等多种生物活性物质的装载。

图2 铁蛋白的可逆组装特性示意图
Fig.2 Schematic diagram of the reversible assembly and disassembly characteristics of ferritin nanocage
铁蛋白亚基与亚基之间的界面相互作用直接影响着铁蛋白结构的稳定性。合理修饰或改造界面间的相互作用可以有效地调控铁蛋白对pH值的敏感程度,进而改善铁蛋白可逆组装的条件。CHEN等[25]采用分子裁剪的方法减弱C4界面亚基与亚基之间的相互作用力。研究结果表明该新型蛋白纳米笼在pH 4.0条件下解离成亚基,当环境恢复至中性时,解离的亚基可以自发组装形成笼形结构。同时,复性的过程可以实现姜黄素小分子的装载。WANG等[26]报道了基于AB loop结构修饰的制备策略,修饰后的铁蛋白能够在pH 4.0的条件下自发解离成蛋白亚基,为小分子包埋物的进入提供了结构基础。相比于动物铁蛋白,植物铁蛋白的N端包含EP肽段结构,以交互的方式结合在相邻亚基的表面[27]。研究发现碱性蛋白酶可以水解红小豆铁蛋白的EP肽段结构,进而降低铁蛋白的稳定性,促使铁蛋白在pH 4.0的条件下发生解离[28]。相对温和的可逆组装特性不仅降低了极端pH环境对包埋物生物活性的影响,同时还可以极大地拓展铁蛋白纳米载体的应用范围。
脉冲电场、超高压、辐照、超声处理等新型物理加工方式能够影响蛋白质结构内的疏水相互作用、盐桥、氢键以及二硫键等分子内相互作用,从而实现蛋白质的物理改性[29]。YANG等[30]采用大气压冷等离子体(atmospheric cold plasma,ACP)技术预处理红小豆铁蛋白(ted bean seed ferritin,RBF)。研究发现ACP处理RBF之后,RBF结构中的部分α-螺旋结构转变为无规则卷曲结构,蛋白质结构的稳定性明显降低。但是铁蛋白局部结构的转变并未对RBF四级结构产生较大的破坏。更值得关注的是,稳定性的降低使得RBF可以在pH 4.0的条件下解离成单亚基,当溶液pH值恢复至中性时,解离的亚基又可以重组装成中空球状结构。基于这一特性,ACP处理后的RBF能够在温和条件下装载姜黄素小分子。MENG等[31]研究了脉冲电场(pulsed electric fields,PEF)对RBF结构的影响,PEF预处理BRF使得部分α-螺旋结构被破坏,RBF稳定性降低。进一步研究发现,PEF处理后的RBF具有温和的可逆组装特性(pH 3.6)。而且,在该实验条件下,芦丁的包埋率可以达到13.7 %。最近,MENG等[32]报道了一种基于压热声处理(manothermosonication,MTS)技术改善RBF可逆组装特性的研究,实验结果表明,MTS技术将RBF解离成亚基所需要的临界pH值提升至3.6,并且在该条件下实现了表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)的高效装载。因此,采用物理加工方式对铁蛋白进行改性,可以改善铁蛋白的可逆组装条件,进而实现铁蛋白在温和的条件下装载小分子。
3.2 基于环境响应的通道“门控”特性的分子装载途径
铁蛋白封闭的壳状结构表面分布着8个三重轴通道和6个四重轴通道,这些通道的尺寸大小为0.3~0.5 nm,是连接内部空腔与外环境的主要桥梁。金属离子、水分子等尺寸较小的离子或者分子可以自由扩散进出铁蛋白。相反,分子质量较大的生物活性物质由于通道尺寸的限制并不能自由地进出铁蛋白[1]。植物源铁蛋白的这些通道在特殊环境下并不是完全的刚性结构,而是表现出一定的柔性特质,即环境响应的通道“门控”特性(图3)。这一发现为生物活性小分子进入铁蛋白内部空腔提供了新的装载途径[33-36]。低浓度尿素、盐酸胍、热处理等均可诱发铁蛋白的通道尺寸(Dchannel)发生变化,进而为小分子进入铁蛋白内部空腔敞开“大门”;当改变诱发条件时,变大的通道可逆性的恢复至原始的刚性结构,进而完成“大门”关闭及小分子的封装。
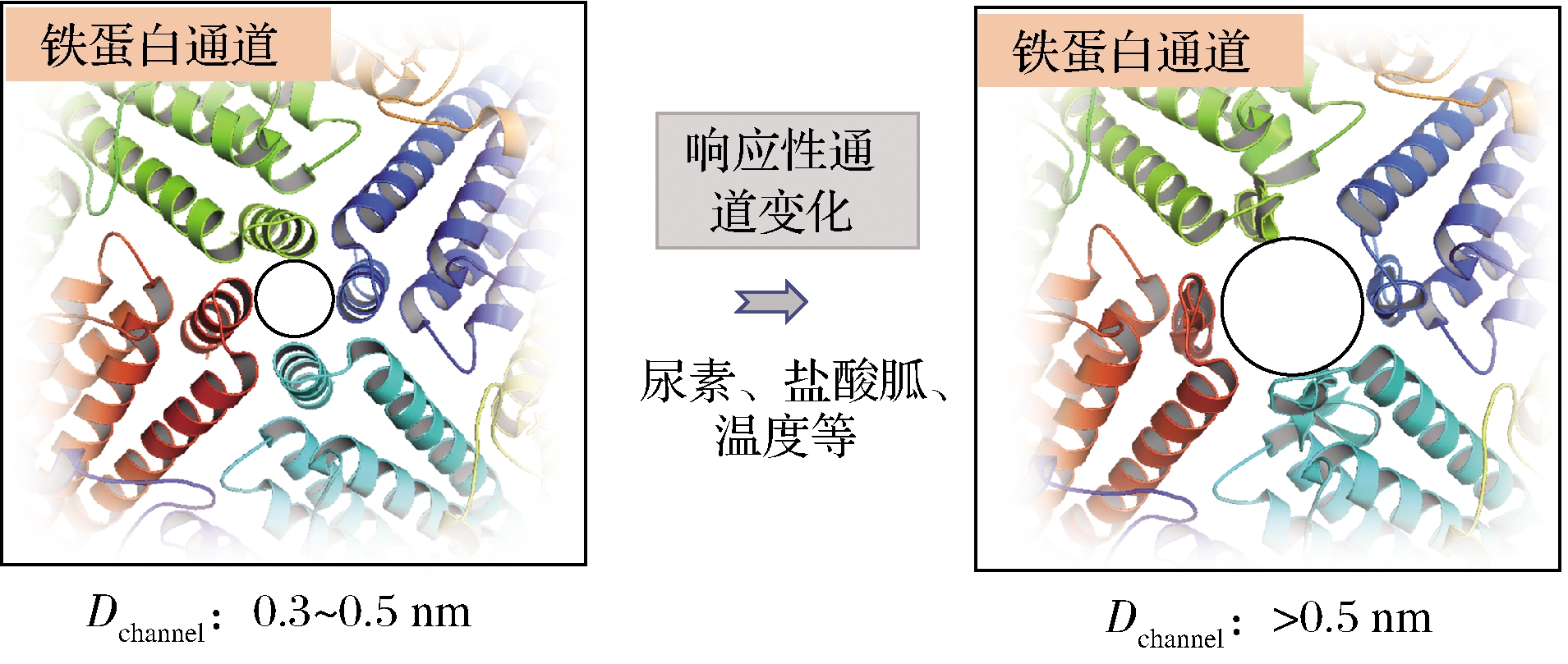
图3 响应性的铁蛋白通道变化
Fig.3 Stimulus-responsive channel of ferritin
尿素分子会破坏蛋白质内部的弱相互作用力,进而导致蛋白质发生不同程度的变性,并且蛋白质的变性程度依赖于尿素的工作浓度。YANG等[33]研究发现,低浓度的尿素(20 mmol/L)处理红小豆铁蛋白不会破坏铁蛋白的球状结构,但会诱导铁蛋白四重轴通道尺寸变大;圆二色谱结果显示,这种响应性的通道尺寸变化可能与铁蛋白亚基C端的E螺旋结构的变性密切相关。低浓度诱发的E螺旋结构变性是可逆的,透析去除尿素之后,变大的通道恢复至变性前的刚性结构。基于尿素响应性的通道“门控”特性,红小豆铁蛋白可以成功封装EGCG、绿原酸和花青素等小分子物质;相比于pH诱导铁蛋白可逆组装的装载途径,铁蛋白装载小分子的包埋率相差无几。盐酸胍(GuHCl)与尿素分子具有类似的功能,均能够影响蛋白质结构;研究表明2 mmol/L盐酸胍处理大豆铁蛋白(soybean seed ferritin,SSF)也可达到类似的“门控”特性[34]。蛋白质受到加热处理时,结构内部的次级键发生不同程度的破坏,导致局部构象变化甚至不可逆的彻底变性。YANG等[35]评估了不同温度对铁蛋白整体结构以及局部构象的影响,发现大豆铁蛋白在60 ℃加热30 min后,铁蛋白局部构象发生变化,通道尺寸变大;当温度降低至20 ℃时,局部构象的变化得以恢复。基于温度响应的通道“门控”特性,铁蛋白装载芦丁的包埋率为8.08 %。最近,张晨曦等[36]采用超声辅助加热的方法制备铁蛋白-虾青素包埋物,研究发现超声(100 W)处理人H型铁蛋白(HuHF)30 min,诱发铁蛋白的通道发生变化的温度降低至40 ℃。综上所述,环境响应的通道“门控”特性为铁蛋白装载食品功能性活性分子提供了新途径,并且可有效地避免因极端酸性或者碱性环境对包埋物造成的结构破坏和活性损失。值得注意的是,基于通道“门控”特性装载活性物质的途径极大地受限于被包埋物的分子大小,因为过度的通道尺寸变化会导致铁蛋白整体结构的破坏。
4 铁蛋白纳米笼在食品生物活性物质装载方 面的应用
4.1 改善脂溶性活性物质的水溶性
食品中含有许多对人体有益的脂溶性活性物质,如胡萝卜素类、黄酮类化合物等,通常具有抗氧化、抗炎和抗癌等功能[37-38]。然而,这些活性成分具有较差的水溶性,极大地限制了其在食品工业中的应用。不同来源的铁蛋白的外表面分布着较多的亲水性氨基酸及负电荷氨基酸,因此,具有很好的水溶性和单分散性;另外,相比于植物来源的铁蛋白,动物铁蛋白通常表现出更高的水溶性,因此,被广泛用于改善脂溶性活性成分的水溶性。CHEN等[24]利用pH诱导的可逆组装特性将脂溶性的β-胡萝卜素包埋于HuHF的内部空腔,使β-胡萝卜素在水溶液中的溶解性发生了显著的改变。而且,铁蛋白-β-胡萝卜素复合物的制备过程不会对铁蛋白本身的溶解性产生负面影响。除此之外,多种植物铁蛋白如大豆铁蛋白、红小豆铁蛋白等也被用作载体材料负载脂溶性活性物质。目前,脂溶性生物活性物质如姜黄素[22]、虾青素[36]、芦丁[39]、叶黄素[40]等均可以借助于铁蛋白纳米颗粒改善其在水溶液中的溶解性。
4.2 增强活性物质的稳定性
生物活性物质结构中通常含有—OH、C![]() O、C
O、C![]() C等官能团结构,易受到环境因素如光、热等的作用发生降解、氧化、聚合和异构化,导致功能活性的降低和损失[41]。铁蛋白封闭的笼形结构外壳提供了天然的物理屏障,使得内部空腔与复杂的外界环境隔绝,在保护包埋物方面具有独特的优势。铁蛋白本身具有较好的稳定性,多种来源的铁蛋白结构能够耐受80 ℃加热30 min而不发生结构的破坏[42]。最近的研究报道,大豆铁蛋白(soybean seed H-2 ferritin,SSFH-2)具有极高的热稳定性,其Tm值高达106 ℃,比HuHF的Tm高24 ℃左右[43]。相比于动物铁蛋白,这种特殊的物理性质在保护活性成分方面具有重要意义。YANG等[44]从大豆种子中提取了天然SSF蛋白,采用可逆组装特性负载芦丁分子,制备了分散性良好的芦丁-铁蛋白复合物纳米颗粒(SSF stabilized rutin nanodispersions,FRNs);相比于游离的芦丁分子,FRNs的热稳定性提升了2倍左右,紫外光稳定性提升了4倍左右。
C等官能团结构,易受到环境因素如光、热等的作用发生降解、氧化、聚合和异构化,导致功能活性的降低和损失[41]。铁蛋白封闭的笼形结构外壳提供了天然的物理屏障,使得内部空腔与复杂的外界环境隔绝,在保护包埋物方面具有独特的优势。铁蛋白本身具有较好的稳定性,多种来源的铁蛋白结构能够耐受80 ℃加热30 min而不发生结构的破坏[42]。最近的研究报道,大豆铁蛋白(soybean seed H-2 ferritin,SSFH-2)具有极高的热稳定性,其Tm值高达106 ℃,比HuHF的Tm高24 ℃左右[43]。相比于动物铁蛋白,这种特殊的物理性质在保护活性成分方面具有重要意义。YANG等[44]从大豆种子中提取了天然SSF蛋白,采用可逆组装特性负载芦丁分子,制备了分散性良好的芦丁-铁蛋白复合物纳米颗粒(SSF stabilized rutin nanodispersions,FRNs);相比于游离的芦丁分子,FRNs的热稳定性提升了2倍左右,紫外光稳定性提升了4倍左右。
4.3 提高活性物质的生物利用度
LV等[45]探究了植物铁蛋白和动物铁蛋白在人体肠胃中的稳定性及其细胞吸收机制,体外模拟消化实验和小鼠体内消化实验结果证实动物和植物铁蛋白可以通过肠胃屏障抵达小肠;Caco-2细胞模型显示动植物铁蛋白以受体介导的内吞作用吸收进入细胞,并且吸收效率与铁蛋白种类及亚基组成密切相关。因此,利用铁蛋白纳米颗粒负载生物活性物质可以有效地克服其生物利用度低的缺点。ZHANG等[23]利用SSFH-2包埋花色苷cyanidin-3-O-glucoside (C3G),经测定平均每个SSFH-2内部空腔装载了37.5个C3G分子。通过分析游离C3G和SSFH-2-C3G复合物的单细胞吸收和粘附效果,结果表明SSFH-2-C3G复合物能够以内吞的方式吸收进入细胞,相比于游离的C3G分子,包埋复合物具有较高的吸收效率,而且粘附并截留在Caco-2细胞表面的含量更低,更加有利于C3G分子的肠道吸收。而且,较高的细胞吸收效率可显著提高生物活性物质在体内的功能特性[46]。
4.4 靶向运输活性物质
研究发现转铁蛋白受体1(transferrin receptor 1,TfR1)是HuHF进入细胞的重要受体分子之一,它们之间较高亲和力的结构基础主要源于HuHF的AB loop及其周围结构[47]。由于大多数癌细胞在生长增殖的过程中会过度地表达TfR1。因此,HuHF对多种癌细胞都表现出特异性的识别和靶向性[48]。生物活性物质具有抗炎、抗氧化、抗癌等功能,在癌症治疗方面发挥着积极的作用。PANDOLFI等[49]采用碱性条件解离HuHF的策略成功装载姜黄素小分子,制备出了水溶性良好的铁蛋白-姜黄素(Curcumin-HuHF,CFn)纳米复合物;通过TfR1介导的内吞作用,CFn纳米颗粒能够有效地将姜黄素小分子靶向递送到乳腺癌细胞,并通过抑制Akt 的磷酸化活性杀伤癌细胞。相比于游离的姜黄素分子,CFn纳米复合物表现出更好的治疗效果。
4.5 发挥生物活性物质的协同效应
2种或多种生物活性物质混合后,在抗炎、抗氧化、抗癌等方面往往能表现出生物协同效应。然而,由于不同生物活性物质在溶解度、细胞吸收途径、细胞吸收效率等方面存在差异,使得它们在生物体内协同效应的发挥受到极大的影响。MANSOURIZADEH等[22]利用马脾铁蛋白(equine spleen apoferritin,HoS-Apo)的可逆组装特性,将槲皮素和姜黄素装载于其内部空腔,获得了槲皮素-姜黄素-铁蛋白三元纳米复合物;相比于二者的简单混合,三元复合物同时提高了槲皮素和姜黄素的生物利用度和癌细胞靶向性,对人乳腺癌细胞(human breast cancer cell,MCF7)表现出更高的协同杀伤效果,抑制和杀伤MCF7细胞所需的剂量显著降低。封装于铁蛋白内部空腔后可显著降低其对MCF10A细胞的毒副作用。另外,在不影响铁蛋白内部空腔装载能力的前提下,其外表面也可以用于负载某些特殊的生物活性小分子。MENG等[50]利用碱性条件诱发橙皮素共价结合于铁蛋白外表面,制备了橙皮素-铁蛋白纳米复合物。研究发现橙皮素的共价结合对铁蛋白的可逆组装特性并未产生显著影响,橙皮素-铁蛋白二元纳米复合物的内部空腔可进一步装载多种生物活性物质,如槲皮素[50]。因此,该研究为充分发挥橙皮素和其他生物活性物质的协同作用提供了研究基础。
5 结束语
食品中的许多生物活性物质容易受到光、热、金属离子等环境因素的作用而发生结构破坏和生物活性的降低,而且多数生物活性物质具有较差的水溶性,这些因素限制了其在功能食品开发以及临床辅助治疗上的应用。铁蛋白是广泛存在于生物体内的铁贮藏蛋白,其独特的纳米笼形结构和装载特性可以将外源性小分子包埋于内部空腔,以此隔绝外部环境的干扰。铁蛋白具有良好的水溶性、单分散性、稳定性、细胞吸收效率以及细胞靶向性。因此,铁蛋白作为一种新型的蛋白质纳米载体,在稳定生物活性物质的结构、保护生物活性以及提升生物利用率等方面展现出巨大的应用前景。目前,铁蛋白包埋生物活性物质的研究主要聚焦于铁蛋白装载率的提升、装载途径的工艺优化、以及生物活性成分的保护,而对于生物活性分子-铁蛋白复合物在肠胃中的稳定研究以及体内缓释研究相对较少[40]。由于受到肠胃酸性环境影响以及各种酶的作用,铁蛋白载体在抵达小肠之前,部分铁蛋白遭受结构性破坏,内容物易发生泄漏。因此,如何减少或者防止铁蛋白纳米载体在肠胃中的损失仍需要进一步的研究。另外,基于铁蛋白纳米复合物的可控释放相关的研究仍然处于起步阶段,铁蛋白纳米复合物对外界环境响应性的释放内容物对生物活性分子功能的发挥具有重要意义,如何实现铁蛋白纳米复合物的可控释放将是铁蛋白纳米载体在食品生物活性物质递送以及医药领域的重要研究方向。
[1] MING T H,HUAN H S,SU C,et al.Structural comparison of two ferritins from the marine invertebrate Phascolosoma esculenta[J].FEBS Open Bio,2021,11(3):793-803.
[2] MELMAN A,BOU-ABDALLAH F.Iron mineralization and core dissociation in mammalian homopolymeric H-ferritin:Current understanding and future perspectives[J].Biochimica et Biophysica Acta General Subjects,2020,1864(11):129700.
[3] LV C,YIN S H,ZHANG X Q,et al.16-mer ferritin-like protein templated gold nanoclusters for bioimaging detection of methylmercury in the brain of living mice[J].Analytica Chimica Acta,2020,1127:149-155.
[4] YANG L,FAN D W,ZHANG Y,et al.Ferritin-based electrochemiluminescence nanosurface energy transfer system for procalcitonin detection using HWRGWVC heptapeptide for site-oriented antibody immobilization[J].Analytical Chemistry,2019,91(11):7 145-7 152.
[5] YAO H C,ZHAO W W,ZHANG S G,et al.Dual-functional carbon dot-labeled heavy-chain ferritin for self-targeting bio-imaging and chemo-photodynamic therapy[J].Journal of Materials Chemistry B,2018,6(19):3 107-3 115.
[6] SITIA L,BONIZZI A,MAZZUCCHELLI S,et al.Selective targeting of cancer-associated fibroblasts by engineered H-ferritin nanocages loaded with navitoclax[J].Cells,2021,10(2):328.
[7] LIU Y Q,YANG R,LIU J G,et al.Fabrication,structure,and function evaluation of the ferritin based nano-carrier for food bioactive compounds[J].Food Chemistry,2019,299:125097.
[8] ZHANG N,YU X Q,XIE J X,et al.New insights into the role of ferritin in iron homeostasis and neurodegenerative diseases[J].Molecular Neurobiology,2021,58(6):2 812-2 823.
[9] PULLIN J,BRADLEY J M,MOORE G R,et al.Electron transfer from haem to the di-iron ferroxidase centre in bacterioferritin[J].Angewandte Chemie International Edition,2021,60(15):8 376-8 379.
[10] CHASTEEN N D,HARRISON P M.Mineralization in ferritin:An efficient means of iron storage.[J].Journal of Structural Biology,1999,126(3):182-194.
[11] YANG R,TIAN J,LIU Y Q,et al.Interaction mechanism of ferritin protein with chlorogenic acid and iron ion:The structure,iron redox,and polymerization evaluation[J].Food Chemistry,2021,349:129144.
[12] 付晓苹,云少君,赵广华.植物铁蛋白的铁氧化沉淀与还原释放机理[J].农业生物技术学报,2014,22(2):239-248.
FU X P,YUN S J,ZHAO G H.Mechanisms of iron oxidative deposition and iron reductive release in phytoferritin[J].Journal of Agricultural Biotechnology,2014,22(2):239-248.
[13] 辛敏,黄昀,郝鹏飞,等.鹰嘴豆铁蛋白提取工艺优化研究[J].天然产物研究与开发,2014,26(2):283-288.
XIN M,HUANG Y,HAO P F,et al.Optimization of extraction conditions of ferritin from chickpea seed[J].Natural Product Research and Development,2014,26(2):283-288.
[14] 饶承冬,叶浪,邓静,等.响应面法优化鲟鱼肝脏铁蛋白提取工艺[J].四川农业大学学报,2018,36(6):851-856.
RAO C D,YE L,DENG J,et al.Optimization of extraction process of ferritin from sturgeon liver by response surface methodology[J].Journal of Sichuan Agricultural University,2018,36(6):851-856.
[15] SONG X T,ZHENG Y X,ZHU L,et al.Development of robust and facile purification process for production of recombinant human ferritin heavy chain nanoparticle from Escherichia coli[J].Process Biochemistry,2021,104(5):1-9.
[16] SU C,MING T H,WU Y,et al.Crystallographic characterization of ferritin from Sinonovacula constricta[J].Biochemical and Biophysical Research Communications,2020,524(1):217-223.
[17] LI H,ZANG J C,TAN X Y,et al.Purification and characterizations of a nanocage ferritin GF1 from oyster (Crassostrea gigas)[J].LWT,2020,127:109416.
[18] DONG X B,TANG B,LI J,et al.Expression and purification of intact and functional soybean (Glycine max) seed ferritin complex in Escherichia coli[J].Journal of Microbiology and Biotechnology,2008,18(2):299-307.
[19] 夏小雨,李晗,王震宇,等.人源重链铁蛋白纯化及其纳米粒制备[J].食品科学,2020,41(12):91-98.
XIA X Y,LI H,WANG Z Y,et al.Purification and preparation of nanoparticles of human H-chain ferritin[J].Food Science,2020,41(12):91-98.
[20] MAITY B,LI Z P,NIWASE K,et al.Single-molecule level dynamic observation of disassembly of the apo-ferritin cage in solution[J].Physical Chemistry Chemical Physics,2020,22(33):18 562-18 572.
[21] SHAMSI A,SHAHWAN M,KHAN M S,et al.Elucidating the interaction of human ferritin with quercetin and naringenin:Implication of natural products in neurodegenerative diseases:Molecular docking and dynamics simulation insight[J].ACS Omega,2021,6(11):7 922-7 930.
[22] MANSOURIZADEH F,ALBERTI D,BITONTO V,et al.Efficient synergistic combination effect of Quercetin with Curcumin on breast cancer cell apoptosis through their loading into Apo ferritin cavity[J].Colloids and Surfaces.B,Biointerfaces,2020,191:110982.
[23] ZHANG T,LV C,CHEN L L,et al.Encapsulation of anthocyanin molecules within a ferritin nanocage increases their stability and cell uptake efficiency[J].Food Research International,2014,62:183-192.
[24] CHEN L L,BAI G L,YANG R,et al.Encapsulation of β-carotene within ferritin nanocages greatly increases its water-solubility and thermal stability[J].Food Chemistry,2014,149:307-312.
[25] CHEN H,ZHANG S,XU C,et al.Engineering protein interfaces yields ferritin disassembly and reassembly under benign experimental conditions[J].Chemical Communications(Cambridge England),2016,52(46):7 402-7 405.
[26] WANG W M,WANG L L,LI G B,et al.AB loop engineered ferritin nanocages for drug loading under benign experimental conditions[J].Chemical Communications (Cambridge,England),2019,55(82):12 344-12 347.
[27] LIAO X Y,YUN S J,ZHAO G H.Structure,function,and nutrition of phytoferritin:A newly functional factor for iron supplement[J].Critical Reviews in Food Science and Nutrition,2014,54(10):1 342-1 352.
[28] YANG R,LIU Y Q,MENG D M,et al.Alcalase enzymolysis of red bean (adzuki) ferritin achieves nanoencapsulation of food nutrients in a mild condition[J].Journal of Agricultural and Food Chemistry,2018,66(8):1 999-2 007.
[29] MIRMOGHTADAIE L,SHOJAEE ALIABADI S,HOSSEINI S M.Recent approaches in physical modification of protein functionality[J].Food Chemistry,2016,199:619-627.
[30] YANG R,LIU Y Q,MENG D M,et al.Effect of atmospheric cold plasma on structure,activity,and reversible assembly of the phytoferritin[J].Food Chemistry,2018,264:41-48.
[31] MENG D M,WANG B W,ZHEN T Y,et al.Pulsed electric fields-modified ferritin realizes loading of rutin by a moderate pH transition[J].Journal of Agricultural and Food Chemistry,2018,66(46):12 404-12 411.
[32] MENG D M,ZUO P,SONG H L,et al.Influence of manothermosonication on the physicochemical and functional properties of ferritin as a nanocarrier of iron or bioactive compounds[J].Journal of Agricultural and Food Chemistry,2019,67(23):6 633-6 641.
[33] YANG R,LIU Y Q,MENG D M,et al.Urea-driven epigallocatechin gallate (EGCG) permeation into the ferritin cage,an innovative method for fabrication of protein-polyphenol Co-assemblies[J].Journal of Agricultural and Food Chemistry,2017,65(7):1 410-1 419.
[34] YANG R,LIU Y Q,BLANCHARD C,et al.Channel directed rutin nano-encapsulation in phytoferritin induced by guanidine hydrochloride[J].Food Chemistry,2018,240:935-939.
[35] YANG R,TIAN J,LIU Y Q,et al.Thermally induced encapsulation of food nutrients into phytoferritin through the flexible channels without additives[J].Journal of Agricultural and Food Chemistry,2017,65(46):9 950-9 955.
[36] 张晨曦,张晓荣,吕晨艳,等.超声辅助法制备铁蛋白-虾青素包埋物[J].食品科学,2020,42(11):94-101.
ZHANG C X,ZHANG X R,LYU C Y.et al.Ultrasound-assisted encapsulation of astaxanthin within ferritin nanocages with enhanced efficiency[J].Food Science,2020,42(11):94-101.
[37] BAYAT P,FARSHCHI M,YOUSEFIAN M,et al.Flavonoids,the compounds with anti-inflammatory and immunomodulatory properties,as promising tools in multiple sclerosis (MS) therapy:A systematic review of preclinical evidence[J].International Immunopharmacology,2021,95:107562.
[38] DE CARVALHO A P A,CONTE C A Jr.Health benefits of phytochemicals from Brazilian native foods and plants:Antioxidant,antimicrobial,anti-cancer,and risk factors of metabolic/endocrine disorders control[J].Trends in Food Science & Technology,2021,111:534-548.
[39] YANG R,SUN G Y,ZHANG M,et al.Epigallocatechin gallate (EGCG) decorating soybean seed ferritin as a rutin nanocarrier with prolonged release property in the gastrointestinal tract[J].Plant Foods for Human Nutrition,2016,71(3):277-285.
[40] YANG R,GAO Y,ZHOU Z,et al.Fabrication and characterization of ferritin-chitosan-lutein shell-core nanocomposites and lutein stability and release evaluation in vitro[J].RSC Advances,2016,6(42):35 267-35 279.
[41] DREWNOWSKI A,GOMEZ-CARNEROS C.Bitter taste,phytonutrients,and the consumer:A review[J].The American Journal of Clinical Nutrition,2000,72(6):1 424-1 435.
[42] LI H,TAN X Y,XIA X Y,et al.Improvement of thermal stability of oyster (Crassostrea gigas) ferritin by point mutation[J].Food Chemistry,2021,346:128879.
[43] ZHANG X R,ZANG J C,CHEN H,et al.Thermostability of protein nanocages:the effect of natural extra peptide on the exterior surface[J].RSC Advances,2019,9(43):24 777-24 782.
[44] YANG R,ZHOU Z K,SUN G Y,et al.Synthesis of homogeneous protein-stabilized rutin nanodispersions by reversible assembly of soybean (Glycine max) seed ferritin[J].RSC Advances,2015,5(40):31 533-31 540.
[45] LV C,ZHAO G H,LÖNNERDAL B.Bioavailability of iron from plant and animal ferritins[J].The Journal of Nutritional Biochemistry,2015,26(5):532-540.
[46] ZHANG Y,DONG Y X,LI X,et al.Proanthocyanidin encapsulated in ferritin enhances its cellular absorption and antioxidant activity[J].Journal of Agricultural and Food Chemistry,2019,67(41):11 498-11 507.
[47] MONTEMIGLIO L C,TESTI C,CECI P,et al.Cryo-EM structure of the human ferritin-transferrin receptor 1 complex[J].Nature Communications,2019,10(1):1121.
[48] RENSI N,SAMMARCO A,MOCCIA V,et al.Evaluation of TFR-1 expression in feline mammary cancer and in vitro antitumor efficacy study of doxorubicin-loaded H-ferritin nanocages[J].Cancers,2021,13(6):1 248.
[49] PANDOLFI L,BELLINI M,VANNA R,et al.H-ferritin enriches the curcumin uptake and improves the therapeutic efficacy in triple negative breast cancer cells[J].Biomacromolecules,2017,18(10):3 318-3 330.
[50] MENG D M,CHEN S N,LIU J,et al.Double-interface binding of two bioactive compounds with cage-like ferritin[J].Journal of Agricultural and Food Chemistry,2020,68(29):7 779-7 788.