海洋一直是地球上重要的食物来源地,海洋生物更是天然物质的重要来源,这些天然产物具有潜在的有助于人类健康的各种生理活性[1]。大量研究从海洋生物如鱼、虾、贝、藻等获得许多具有增强机体免疫、缓解疲劳、降血脂、降血糖、抗氧化、改善生长发育等多种生理活性的化合物[2]。近年来研究发现,海洋源虾青素、二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳六烯酸(docosahexaenoic acid,DHA)、岩藻黄质等脂溶性活性物质在预防人体疾病中起到积极的促进作用(表1)。
尽管海洋源脂溶性活性物质在功能食品、药品、保健品领域具有广泛的应用前景,但是其水溶性差,易降解,感官特性差,对环境中的光、氧、热敏感,难以应用到上述的领域中[3]。并且通过口服摄入的脂溶性活性物质很难被小肠的上皮细胞吸收消化,生物利用度低,不能有效发挥其生理活性,这些缺陷使其在食品、药品领域中的应用受到了限制[4]。为了解决这些活性物质的理化稳定性差、生物利用度低等缺点,研究人员在食品、药品领域进行了使用乳液输送体系包埋虾青素、EPA、DHA、岩藻黄质等海洋源脂溶性活性物质的研究,如传统乳液、纳米乳液、多层乳液、Pickering乳液等。通过开发有效的乳液输送体系来递送这些活性物质[5],在增强功能性食品营养价值的同时,又不会对食品的感官特性产生不利影响。
脂溶性活性物质可以通过专门设计的乳液输送体系加入到食品中,以达到一定程度的保护并到达特定的靶点,即控制它们在胃肠道内的特定位置进行释放。输送体系应能够保护这些化合物在加工、处理和储存过程中免受物理、化学降解,并将它们输送到胃肠道中所需的位置,而不会对食品的外观、稳定性、质地或风味产生不良影响。本文介绍了常见的乳液输送体系及其制备方法,重点介绍了几种海洋源脂溶性活性物质乳液输送体系的优势及局限性,同时针对这些乳液输送体系提高其溶解度和生物利用度的研究现状进行综述,并对海洋源脂溶性活性物质乳液输送体系的未来发展进行展望,以期为海洋源脂溶性活性成分在功能食品中的广泛应用提供参考。
表1 常见海洋源脂溶性活性物质的预防疾病及其作用机理
Table 1 Prevention of diseases and its mechanism of lipophilic marine bioactive substances
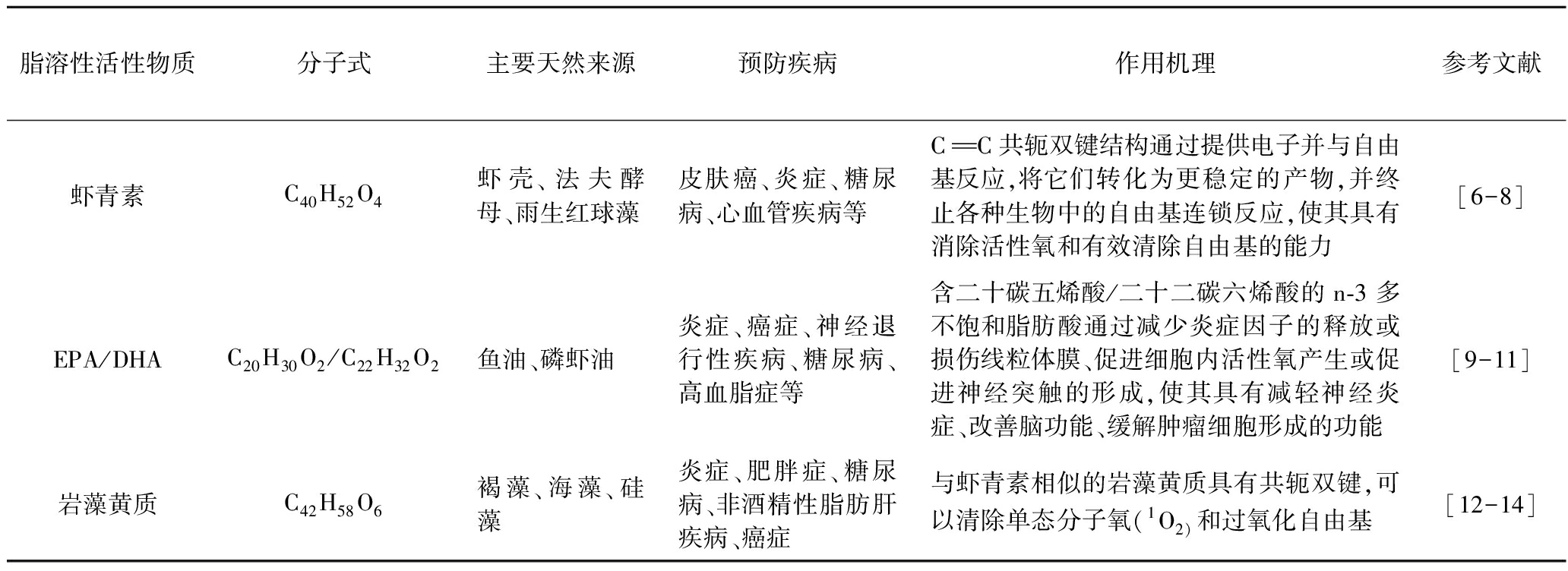
脂溶性活性物质分子式主要天然来源预防疾病作用机理参考文献虾青素C40H52O4虾壳、法夫酵母、雨生红球藻皮肤癌、炎症、糖尿病、心血管疾病等CC共轭双键结构通过提供电子并与自由基反应,将它们转化为更稳定的产物,并终止各种生物中的自由基连锁反应,使其具有消除活性氧和有效清除自由基的能力[6-8]EPA/DHAC20H30O2/C22H32O2鱼油、磷虾油炎症、癌症、神经退行性疾病、糖尿病、高血脂症等含二十碳五烯酸/二十二碳六烯酸的n-3 多不饱和脂肪酸通过减少炎症因子的释放或损伤线粒体膜、促进细胞内活性氧产生或促进神经突触的形成,使其具有减轻神经炎症、改善脑功能、缓解肿瘤细胞形成的功能[9-11]岩藻黄质C42H58O6褐藻、海藻、硅藻炎症、肥胖症、糖尿病、非酒精性脂肪肝疾病、癌症与虾青素相似的岩藻黄质具有共轭双键,可以清除单态分子氧(1O2)和过氧化自由基[12-14]
1 乳液输送体系类型及其制备方法
近10年来,有关“乳液”、“包埋”、“活性物质”为共同关键词检索的论文发表数量呈现增长趋势,同时被引用量增长数量惊人,这说明乳液输送体系在包埋活性物质研究越来越被重视(Web of Science数据库)。乳液输送体系可用于包埋、递送、保护和控制疏水性活性成分的释放、消化和吸收[15]。在功能性食品研究领域,包埋技术常用于将对外界环境敏感的活性物质加入食品运载体系中,设计合理的运载体系可以改善活性物质的水溶性,提高其对光和热的稳定性,改善食品感官和品质,防止聚集、沉淀的产生及提高缓释功效及靶向输送。它们的功能可以通过控制其化学成分和物理性质来设计,常见类型有传统乳液、纳米乳液、多层乳液、Pickering乳液等(图1),不同类型的乳液输送体系的主要特性也不一样(表2)。
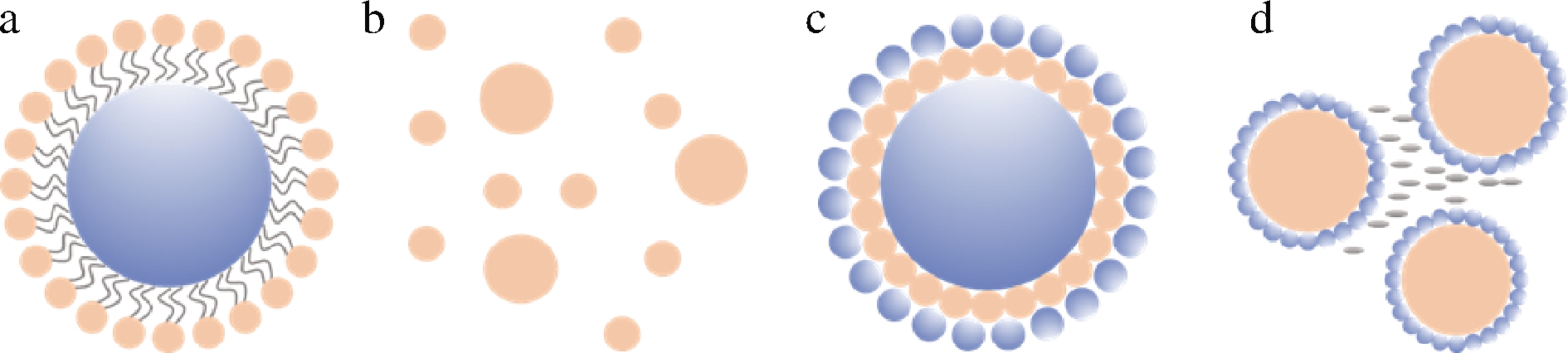
a-传统乳液;b-纳米乳液;c-多层乳液;d-Pickering乳液
图1 常见的海洋源脂溶性活性物质乳液输送体系
Fig.1 Common emulsion delivery system of lipophilic marine bioactive substances
表2 不同类型的乳液输送体系的特性
Table 2 Characteristics of different types of emulsion delivery systems

乳液输送体系特性参考文献传统乳液相对容易制备,生产成本低,但是在加热、极端pH、低温和高离子强度下较为敏感,易导致氧化、水解、絮凝等物理化学不稳定[16]纳米乳液较厚的界面层防止了相分离,具有良好的贮藏稳定性。整体透明清晰,不会改变活性物质的外观。能很好地掩盖活性物质的不良感官气味[17]多层乳液高抗氧化性,更好地防止物理化学不稳定性,可控制定点释放包埋的活性物质。但是制备成本高,制备过程稍有差错就会絮凝[18]Pickering乳液抗聚结性高,没有表面活性剂,有效解决传统乳液稳定性差,安全性低,难降解等问题。但是缺乏关于Picker-ing乳液商业化或工业化的研究[19]
1.1 传统乳液
传统乳液作为食品工业中最重要的输送体系,被广泛应用于亲脂性活性物质和其他食品活性成分的包埋[20]。传统乳液的制备是将亲脂性化合物混合在油相,亲水性化合物混合在水相,再通过高能均质或者低能均质技术将两相混合形成粒径大于100 nm的乳液[18]。在乳化剂存在的情况下,根据水相和油相的初始浓度,可得到2种不同类型的乳液;在高油浓度时可形成油包水(W/O)型乳液,在低油浓度时可形成水包油(O/W)型乳液。目前,大多数的传统乳液是使用高能均质技术生产的,一般采用超声均质机、高压混合器、微通道和高压阀均质器等高压均质系统,如研究人员利用6种不同的乳化剂通过超声波均质制备虾青素O/W型乳液,发现由乳清蛋白(whey protein isolate,WPI)稳定的乳液能够显著增加细胞对虾青素的摄取[21]。而为了更好地改善传统乳液的热力学不稳定性,可以通过添加乳化剂、改变乳液两相的组成成分、优化制备工艺等方法解决其性质的问题,并将脂溶性活性物质分散在油相中,形成稳定的乳液输送体系,从而提高活性物质的生物利用度和消化吸收。
1.2 纳米乳液
与传统乳液相比,纳米乳液作为疏水性活性成分的输送体系被广泛使用[22],因为其液滴更小,粒径一般在10~100 nm,乳液整体清澈,液滴的布朗运动能够抵抗重力作用引起的沉淀从而不易发生相分离[23],具有较好的贮藏稳定性和更高的生物利用度。纳米乳液的制备是在搅拌作用下,将油相和乳化剂加入水相中形成粗乳液,再经过均质处理制备成纳米乳液,还可以通过超声仪、剪切机和高压均质机等辅助手段制备小而均匀的纳米乳液[24]。纳米乳液作为功能性食品的输送体系,可用于改善多种疏水性活性物质的稳定性和生物利用度[25],在食品领域具有一定的潜力。
1.3 多层乳液
多层乳液是一种通过静电相互作用,具有相反电荷的乳化剂稳定的乳液体系。近年来,利用逐层静电沉积制备多层乳液的研究日益受到重视[26]。该方法首先用乳化剂制备表面带电荷的初级乳液,然后通过静电相互作用逐步沉积带相反电荷的物质,如图1-c所示,最终在界面上形成多层结构[27]。
传统乳液中的液滴通常是由单层乳化剂包裹,一旦遇到高温、光照、盐浓度增加等因素时其容易发生相分离,从而导致活性物质泄露,降低包埋率[28]。与传统乳液相比,多层乳液可以包埋脂溶性或水溶性活性物质,且包埋率高,有效改善乳液对物理化学因素引起的不稳定性[29],被广泛应用于食品、药品和化妆品等领域[30]。目前使用逐层静电沉积法制备的多层乳液已被应用于食品中,且具有控制释放包埋活性成分、提高乳液在加工过程中的稳定性以及调节胃肠道内脂质消化的能力[31]。
1.4 Pickering乳液
Pickering乳液一般是指具有稳定乳液能力的胶体颗粒或固体颗粒充当乳化剂稳定的乳液[32],其固体颗粒可以在油水界面形成致密的薄膜而防止液滴聚集,且该过程是不可逆的[33]。与传统乳液相比,Pickering乳液具有低毒性、高抗聚集性等优势,不仅能够有效包埋活性物质,还进一步对其成分起到保护、输送、定向释放等作用[34]。Pickering乳液研究的首要目的是提高乳液的稳定性,进而研究其在胃肠道的靶向递送相关的功能性质,最后寻求天然的、绿色的Pickering颗粒,如蛋白质等固体颗粒[35]制备食品级Pickering乳液。
Pickering乳液中存在油水界面颗粒层,可更加稳定包埋活性物质及提高其生物可及性[36]。此外,Pickering乳液可有效改善传统乳液的稳定性差、安全性低、生物不相容与难降解等缺点,且Pickering乳液由于不含表面活性剂,可以改善表面活性剂的刺激性和溶血性等不良影响,在化妆品和制药领域应用方面有良好的发展前景。
2 海洋源脂溶性活性物质的乳液输送体系
2.1 虾青素
虾青素是一种亲脂性的类胡萝卜素,广泛存在于藻类、虾类、鲑鱼和虹鳟鱼等多种生物中,其中雨生红球藻是天然虾青素含量最高的生物来源。如图2所示,虾青素的分子结构中含有2个β-紫罗兰酮环和羟基,11个共轭双键,其分子中13个不饱和键组成了共轭大Π键,是目前已知共轭双键最多的化合物[37]。由于虾青素比其他类胡萝卜素具有更强的生物活性[38],包括但不限于抗氧化、增强机体免疫、抗肿瘤、抗癌症、预防心血管疾病、治疗糖尿病肾病等活性功能[39-40],因此其被广泛用作食品、化妆品和医药产品的色素和保健成分的来源。然而,目前虾青素由于化学不稳定性、生物利用度低,在食品加工后无法保证其原有的活性[41]。乳液输送体系被认为是提高虾青素稳定性和生物利用度的有效方法[42]。
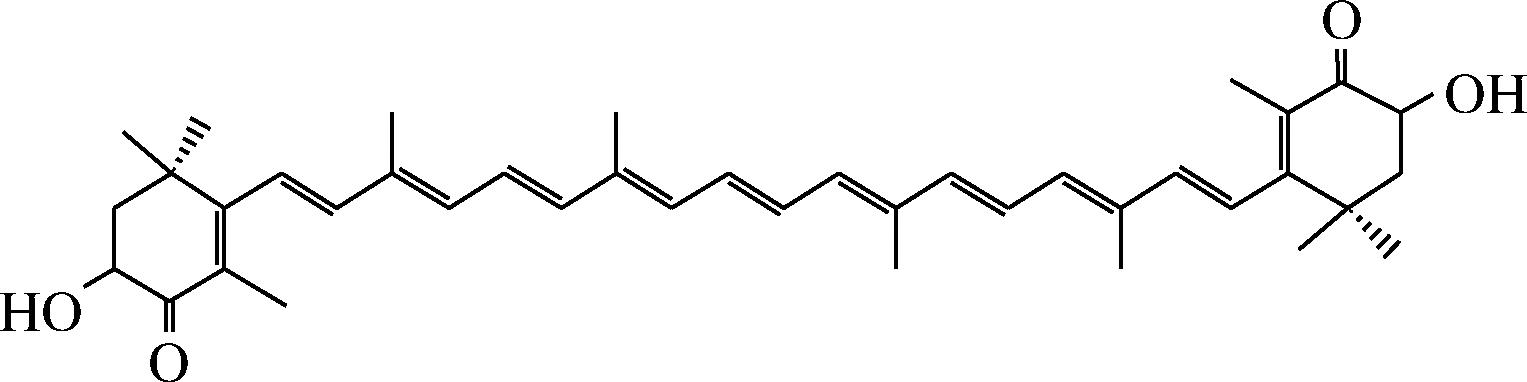
图2 虾青素的结构示意图
Fig.2 Schematic diagram of the structure of astaxanthin
以WPI作为乳化剂和0.5%黄原胶(xanthan gum,XG)的O/W型乳液包埋虾青素,与单独使用WPI稳定的O/W型乳液相比,WPI-XG联合使用降低了虾青素的消化和释放,可获得更好的控制释放输送能力[43]。传统乳液有效提高了虾青素的体内释放、消化及生物利用度,但是在改善虾青素易氧化降解方面仍有欠缺。基于α-生育酚可以有效缓解类胡萝卜素乳液体系的氧化,SHANMUGAPRIYA等[44]通过自乳化法和超声乳化法制备了虾青素-α生育酚纳米乳液,细胞毒性试验发现纳米乳液在作用24~48 h后,癌细胞存活率显著下降3%~6%,表明虾青素在48 h内不易被降解。纳米乳液的出现可以提高虾青素的稳定性及降低降解速度,但是在功能食品或营养补充剂中提高虾青素生物利用度的潜力,或制备更为安全可靠、天然绿色的乳液输送体系仍然存在不足。LIU等[28]创建了虾青素的全天然乳液输送体系,将阴离子(果胶)和阳离子(壳聚糖)生物聚合物依次静电沉积到阴离子皂素包埋的脂滴上形成多层乳液,并测试乳液包埋和保护虾青素的能力,结果表明,虾青素多层乳液在15 d的储存过程中没有表现出任何明显的相分离,缓解虾青素降解能力是传统乳液的3~4倍。BURGOS-DíAZ等[45]采用食品级Pickering乳液对虾青素进行包埋,经喷雾干燥后的虾青素乳液粉末包埋率在90%以上、生物利用度在80%左右。以羽扇豆蛋白质形成的蛋白质颗粒聚集体作为乳化剂稳定食品级Pickering乳液,使虾青素在贮藏过程中表现出良好的抗氧化性和稳定性。多层乳液为虾青素在功能食品的应用提供了可能,也为天然安全的虾青素乳液输送体系创造了条件,而食品级Pickering乳液能更好地包埋虾青素以及提高其生物利用度,Pickering乳液输送体系的发展使得天然虾青素的高效利用成为了可能。
2.2 n-3多不饱和脂肪酸
海洋性鱼类含有高比例的n-3多不饱和脂肪酸(polyunsaturated fatty acid,PUFAs),特别是EPA和DHA,具有防治心血管疾病、改善脂质代谢、预防糖尿病、抗炎症、抗癌症等生理活性功能[46-48],而膳食中n-3 PUFAs摄入量较低会导致自闭症、注意力缺陷或多动症等神经发育障碍[49],所以联合国粮食及农业组织建议成年人每天摄入0.25~2 g EPA和DHA [50]。EPA、DHA的结构如图3所示,其分子结构含有许多不饱和的双键导致其不稳定,而难溶于水和腥味重的缺点使得鱼油的感官风味差、生物利用度低[51]。
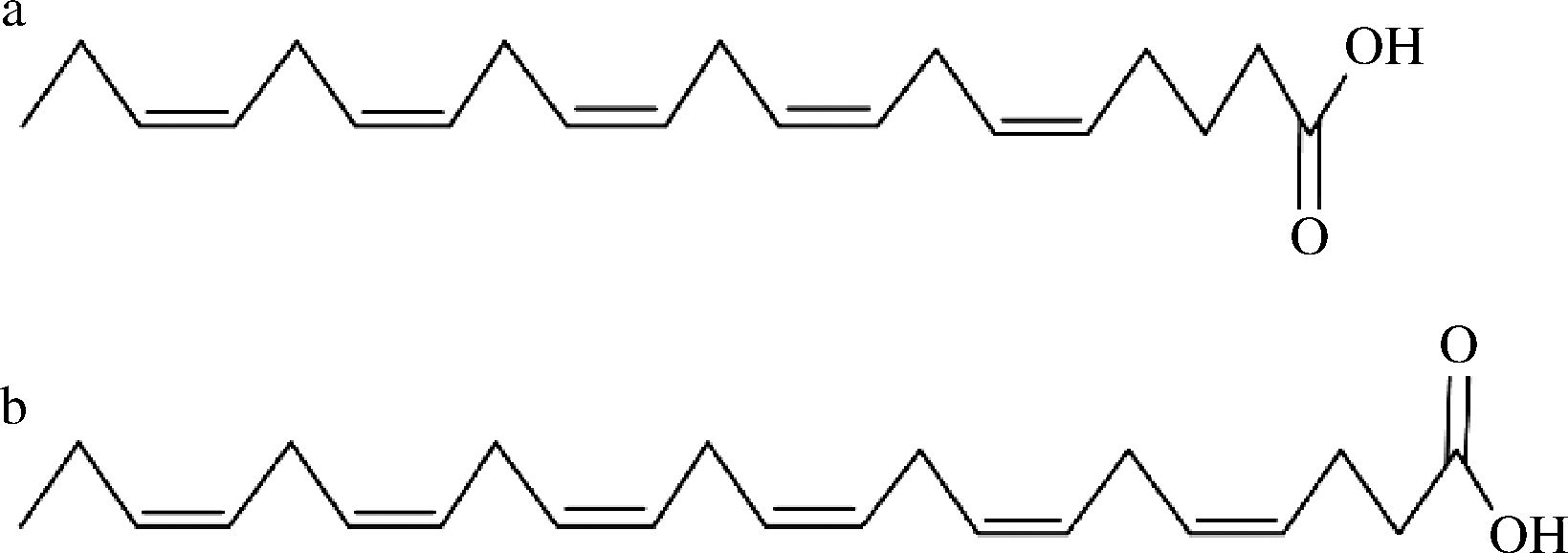
图3 二十碳五烯酸(a)和二十二碳六烯酸(b)的结构示意图
Fig.3 Schematic diagram of the structure of EPA (a) and DHA(b)
因此,可将鱼油封装在乳液输送体系中或将其作为乳液的油相,制备含有鱼油的乳液,以改善其稳定性、增溶性和感官风味,同时提高EPA和DHA的生物利用度。
研究人员将不同类型的蛋白质及其组合作为表面活性剂制备鱼油乳液[52],结果表明,添加0.5%(质量分数)酪蛋白和0.5%(质量分数)明胶的组合对鱼油的氧化保护效果优于所有其他蛋白质组合及未包埋的鱼油。而酪蛋白-糖结合物具有高表面活性和表面疏水性,可稳定鱼油乳液和降低其脂肪降解速率,从而进一步缓解鱼油的脂肪氧化[53]。蛋白质作为乳化剂能够改善传统乳液的稳定性、乳化性,从而保护了鱼油免受氧化的影响,但是传统乳液在缓解鱼油的降解、减少鱼油的腥味方面不能体现优势。SALVIA-TRUJILLO等[54]研究多糖的添加对n-3 PUFAs纳米乳液的流变性、物理稳定性和氧化稳定性的影响,结果表明海藻酸钠既促进n-3 PUFAs纳米乳液的乳化,又抑制n-3 PUFAs的脂质氧化,且比甲基纤维素和壳聚糖具有更强的抗氧化性。此外,同时将棕榈酸、槲皮素、WPI添加到鱼油固体脂质纳米乳液中,槲皮素提高鱼油的氧化稳定性,棕榈酸可以减小乳液的液滴大小及起到抗氧化作用[55]。纳米乳液输送体系相比传统乳液输送体系,在乳液乳化和抑制n-3 PUFAs的脂质氧化方面便突出了更为优越的性能。
2.3 岩藻黄质
岩藻黄质是仅存在于藻类中而不存在陆地植物中的一种特殊的类胡萝卜素,其主要存在于褐藻和硅藻中[56]。岩藻黄质具有抗氧化、抗糖尿病、抗肥胖、抗癌症、抗炎症等生物活性[57-59],在食品、医药领域的潜力巨大。岩藻黄质具有丙烯键、5,6-单环氧化物和9个共轭双键(图4),这些分子结构特点使其具有易氧化降解、易溶于有机溶剂等活泼的化学性质[60]。与虾青素等类胡萝卜素一样具有化学不稳定、水溶性差、熔点高等特点,从而限制了其在食品工业中的应用。类胡萝卜素的乳液输送体系可以提高其稳定性和抗氧化活性,可靠的包埋体系可以让岩藻黄质在递送、控制释放、代谢和生化过程中保持活性,提高生物利用度[61]。
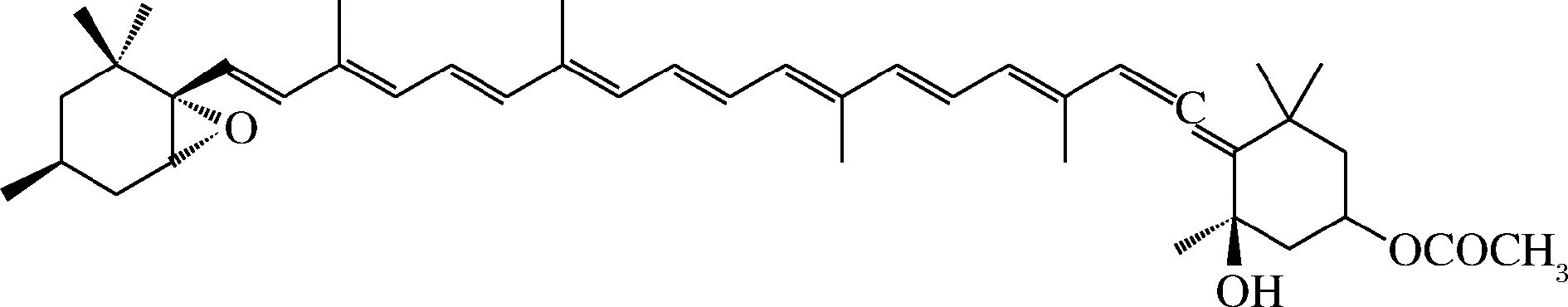
图4 岩藻黄质的结构示意图
Fig.4 Schematic diagram of the structure of fucoxanthin
O/W型乳液能够作为一种方便、有效的系统将岩藻黄质输送到食品中,从而提高其稳定性和生物利用度。物理化学因素在一定程度上对传统乳液的性质有影响,特别是pH、光照、温度等。有研究人员发现岩藻黄质在乳液中对pH具有一定的依赖稳定性,即在偏酸性的环境下,传统乳液中的岩藻黄质含量下降幅度较大,而在pH 7.4的偏中性环境中,岩藻黄质稳定性较高[62],其原因可能是 pH能够有效改变决定降解程度的质子化和氧化还原电位的大小,中性条件下质子化程度降低,还原电位增加,缓解了乳液中岩藻黄质的降解速度。为了验证岩藻黄质乳液能有效应用到食品领域中,MOK等[63]将岩藻黄质添加到牛奶(O/W型乳液)中并储存1个月,结果发现其具有良好的稳定性,经3次巴氏杀菌后的岩藻黄质仍有91%的保留率。O/W型传统乳液不仅证明岩藻黄质在食品中应用的可行性,也间接说明岩藻黄质在乳液中能够耐受巴氏杀菌的温度,还能进一步提高岩藻黄质的生物可及性,但是在岩藻黄质传统乳液的活性能力和胃肠道消化能力方面未得到测定和验证。纳米乳液不仅可以提高岩藻黄质的体外消化能力、生物可及性,还表现出较为明显的生物活性。SARAVANA等[64]利用超声辅助乳化技术制备κ-卡拉胶纳米乳液,用其包埋富含岩藻黄质的海藻油,在控制较小液滴体积的基础上可以有效提高岩藻黄质的氧化稳定性、体外消化能力和生物可及性,还能对少数癌细胞产生良好的抑制作用。
3 展望
综上所述,从海洋生物中提取分离的脂溶性活性物质具有降血脂、抗氧化、抗癌症、缓解或预防人类慢性疾病等多种生理活性功能,但是其溶解度差、易降解,生物利用度低,使得这些活性物质的生物可及性受到限制。近年来,科研人员设计不同类型的乳液输送体系对海洋源脂溶性活性脂质进行包埋,发现该技术可有效保护活性物质免受物理化学因素的影响,提高溶解度,在体外消化模拟中可显著提高活性物质的生物利用度、实现缓释和靶部位释放,是一种安全、简便的技术手段。然而,目前相关研究仍存在一些问题:(1)目前乳液输送体系包埋海洋源脂溶性活性物质的研究集中在理化稳定上,对于有效输送至靶组织或靶器官的生物利用度方面相关研究甚少,忽略对整个体系有效性评价;(2)海洋源脂溶性活性物质固有的生理活性,在经过乳液输送体系包埋后,缺乏活性验证实验,无法证实在形成稳定的乳液体系后,被包埋物质的生理活性是否还存在;(3)关于脂溶性活性物质-乳液体系的优化、不同因素的影响研究较多,而关于其在食品领域、工业化生产的实际应用研究甚少,能否根据工业生产需求设计出一个具有较强应用价值的产品还有待深入研究。
因此,今后在设计海洋源脂溶性活性物质的乳液输送体系时,有几个方面需要关注:(1)为了保证海洋源脂溶性活性物质对人体产生的积极影响,在进行乳液包埋和输送环节,应当着重考虑活性物质的包埋量和可控的靶向输送,从而保证设计的乳液输送体系生物利用度;(2)对于包埋后的海洋源脂溶性活性物质,当前是从胃肠道消化角度进行研究,为了确保输送到靶组织或靶器官后的活性物质依旧具有生物活性,应当进一步进行活性验证实验,包括体外细胞实验和体内小鼠活体实验,从而验证乳液输送体系是有效可行的;(3)设计符合实际要求的产品,探究多种海洋源脂溶性活性脂质和制备方法对输送体系的影响,在对所包埋的物质不产生负面影响的基础上,更好地提升体系的输送能力,以实现海洋源活性物质的高效利用。此外,由于海洋源特有的风味,特别是腥味特征降低了消费者的可接受程度,乳液体系对海洋源脂溶性活性物质风味特征的影响有待进一步深入研究。
[1]  IMAT V,ELABED N,KULAWIK P,et al.Recent advances in marine-based nutraceuticals and their health benefits[J].Marine Drugs,2020,18(12):627.
IMAT V,ELABED N,KULAWIK P,et al.Recent advances in marine-based nutraceuticals and their health benefits[J].Marine Drugs,2020,18(12):627.
[2] HOSSEINI S F,REZAEI M,MCCLEMENTS D J.Bioactive functional ingredients from aquatic origin:A review of recent progress in marine-derived nutraceuticals[J].Critical Reviews in Food Science and Nutrition,2020(11):1-28.
[3] ZHAO D,KIM S M,PAN C H,et al.Effects of heating,aerial exposure and illumination on stability of fucoxanthin in canola oil[J].Food Chemistry,2014,145:505-513.
[4] MCCLEMENTS D J,LI Y.Structured emulsion-based delivery systems:Controlling the digestion and release of lipophilic food components[J].Advances in Colloid and Interface Science,2010,159(2):213-228.
[5] YAO M F,LI Z Z,JULIAN MCCLEMENTS D,et al.Design of nanoemulsion-based delivery systems to enhance intestinal lymphatic transport of lipophilic food bioactives:Influence of oil type[J].Food Chemistry,2020,317:126229.
[6] ZHAO T,YAN X J,SUN L J,et al.Research progress on extraction,biological activities and delivery systems of natural astaxanthin[J].Trends in Food Science & Technology,2019,91:354-361.
[7] GALASSO C,OREFICE I,PELLONE P,et al.On the neuroprotective role of astaxanthin:new perspectives?[J].Marine Drugs,2018,16(8):247.
[8] DAVINELLI S,NIELSEN M E,SCAPAGNINI G.Astaxanthin in skin health,repair,and disease:A comprehensive review[J].Nutrients,2018,10(4):E522.
[9] ZHANG T T,XU J,WANG Y M,et al.Health benefits of dietary marine DHA/EPA-enriched glycerophospholipids[J].Progress in Lipid Research,2019,75:100997.
[10] NEWELL M,MAZURAK V,POSTOVIT L M,et al.N-3 long-chain polyunsaturated fatty acids,eicosapentaenoic and docosahexaenoic acid,and the role of supplementation during cancer treatment:a scoping review of current clinical evidence[J].Cancers,2021,13(6):1206.
[11] GHASEMI FARD S,WANG F L,SINCLAIR A J,et al.How does high DHA fish oil affect health? A systematic review of evidence[J].Critical Reviews in Food Science and Nutrition,2019,59(11):1 684-1 727.
[12] ZHAO C,YANG C F,LIU B,et al.Bioactive compounds from marine macroalgae and their hypoglycemic benefits[J].Trends in Food Science & Technology,2018,72:1-12.
[13] LIU M J,LI W W,CHEN Y,et al.Fucoxanthin:A promising compound for human inflammation-related diseases[J].Life Sciences,2020,255:117850.
[14] MARIA A G,GRAZIANO R,NICOLANTONIO D.Carotenoids:potential allies of cardiovascular health?[J].Food & Nutrition Research,2015,59(1):26762.
[15] SARKAR A,MACKIE A R.Engineering oral delivery of hydrophobic bioactives in real-world scenarios[J].Current Opinion in Colloid & Interface Science,2020,48:40-52.
[16] DICKINSON E.Food emulsions and foams:Stabilization by particles[J].Current Opinion in Colloid & Interface Science,2010,15(1-2):40-49.
[17] GUPTA A,ERAL H B,HATTON T A,et al.Nanoemulsions:Formation,properties and applications[J].Soft Matter,2016,12(11):2 826-2 841.
[18] MCCLEMENTS D J.Food Emulsions:Principles,Practices,and Techniques,Third Edition[M].CRC Press,2015.
[19] XIAO J,LI Y Q,HUANG Q R.Recent advances on food-grade particles stabilized Pickering emulsions:Fabrication,characterization and research trends[J].Trends in Food Science & Technology,2016,55:48-60.
[20] ROOS Y H,LIVNEY Y D.Engineering Foods for Bioactives Stability and Delivery[M].New York,NY:Springer,2017.
[21] SHEN X,FANG T Q,ZHENG J,et al.Physicochemical properties and cellular uptake of astaxanthin-loaded emulsions[J].Molecules,2019,24(4):727.
[22] CHOI S J,MCCLEMENTS D J.Nanoemulsions as delivery systems for lipophilic nutraceuticals:Strategies for improving their formulation,stability,functionality and bioavailability[J].Food Science and Biotechnology,2020,29(2):149-168.
[23] BUSH L,STEVENSON L,LANE K E.The oxidative stability of Omega-3 oil-in-water nanoemulsion systems suitable for functional food enrichment:A systematic review of the literature[J].Critical Reviews in Food Science and Nutrition,2019,59(7):1 154-1 168.
[24] 陈帅,高彦祥.天然防腐剂肉桂醛传递载体的构建与应用研究进展[J].中国食品添加剂,2018,19(10):189-195.
CHEN S,GAO Y X.Advances on natural preservative cinnamaldehyde delivery system[J].China Food Additives,2018,19(10):189-195.
[25] 夏天航,魏子淏,马磊,等.负载虾青素的油凝胶纳米乳液的构建及体外消化研究[J].食品与发酵工业,2021,47(9):1-7.
XIA T H,WEI Z H,MA L,et al.The development and its digestion study of astaxanthin-loaded oleogel-based nanoemulsions in vitro[J].Food and Fermentation Industries,2021,47(9):1-7.
[26] 陈雨露,孙婉秋,高彦祥,等.食品运载体系提高酚类物质生物利用度的研究进展[J].食品科学,2020,41(5):323-330.
CHEN Y L,SUN W Q,GAO Y X,et al.Recent progress in food delivery systems for improving bioavailability of phenolic compounds[J].Food Science,2020,41(5):323-330.
[27] ACEVEDO-FANI A,SILVA H D,SOLIVA-FORTUNY R,et al.Formation,stability and antioxidant activity of food-grade multilayer emulsions containing resveratrol[J].Food Hydrocolloids,2017,71:207-215.
[28] LIU C Z,TAN Y B,XU Y,et al.Formation,characterization,and application of chitosan/pectin-stabilized multilayer emulsions as astaxanthin delivery systems[J].International Journal of Biological Macromolecules,2019,140:985-997.
[29] FIORAMONTI S A,MARTINEZ M J,PILOSOF A M R,et al.Multilayer emulsions as a strategy for linseed oil microencapsulation:effect of ph and alginate concentration[J].Food Hydrocolloids,2015,43:8-17.
[30] 徐文华,张佳,王梓涵,等.双重乳液的制备及应用研究进展[J].食品与机械,2020,36(9):1-11.
XU W H,ZHANG J,WANG Z H,et al.Progress in preparation and application of double emulsion[J].Food & Machinery,2020,36(9):1-11.
[31] EVANS M,RATCLIFFE I,WILLIAMS P A.Emulsion stabilisation using polysaccharide-protein complexes[J].Current Opinion in Colloid & Interface Science,2013,18(4):272-282.
[32] TAVERNIER I,WIJAYA W,VAN DER MEEREN P,et al.Food-grade particles for emulsion stabilization[J].Trends in Food Science & Technology,2016,50:159-174.
[33] CHEN L J,AO F,GE X M,et al.Food-grade pickering emulsions:preparation,stabilization and applications[J].Molecules,2020,25(14):3202.
[34] NIROULA A,GAMOT T D,OOI C W,et al.Biomolecule-based pickering food emulsions:Intrinsic components of food matrix,recent trends and prospects[J].Food Hydrocolloids,2021,112:106303.
[35] 王文莉,柴向华,范宇婷,等.基于玉米醇溶蛋白纳米颗粒稳定的Pickering乳液研究进展[J].食品与发酵工业,2021,47(18):301-307.
WANG W L,CHAI X H,FAN Y T,et al.Advances of Pickering emulsion stabilized by zein-based complex nanoparticles[J].Food and Fermentation Industries,2021,47(18):301-307.
[36] WEI Z H,CHENG Y J,ZHU J Y,et al.Genipin-crosslinked ovotransferrin particle-stabilized Pickering emulsions as delivery vehicles for hesperidin[J].Food Hydrocolloids,2019,94:561-573.
[37] 刘建国,李虎,张孟洁,等.红球藻虾青素与炎症反应和肺部疾病的研究进展[J].生物学杂志,2021,38(2):8-12.
LIU J G,LI H,ZHANG M J,et al.Research progress of the astaxanthin from Haematococcus pluvialis in inflammation and lung diseases[J].Journal of Biology,2021,38(2):8-12.
[38] AMBATI R R,PHANG S M,RAVI S,et al.Astaxanthin:Sources,extraction,stability,biological activities and its commercial applications:A review[J].Marine Drugs,2014,12(1):128-152.
[39] FARAONE I,SINISGALLI C,OSTUNI A,et al.Astaxanthin anticancer effects are mediated through multiple molecular mechanisms:A systematic review[J].Pharmacological Research,2020,155:104689.
[40] CHEN Z,LI W H,SHI L W,et al.Kidney-targeted astaxanthin natural antioxidant nanosystem for diabetic nephropathy therapy[J].European Journal of Pharmaceutics and Biopharmaceutics,2020,156:143-154.
[41] MART NEZ-DELGADO A A,KHANDUAL S,VILLANUEVA-RODR
NEZ-DELGADO A A,KHANDUAL S,VILLANUEVA-RODR GUEZ S J.Chemical stability of astaxanthin integrated into a food matrix:Effects of food processing and methods for preservation[J].Food Chemistry,2017,225:23-30.
GUEZ S J.Chemical stability of astaxanthin integrated into a food matrix:Effects of food processing and methods for preservation[J].Food Chemistry,2017,225:23-30.
[42] KOTAKE-NARA E,NAGAO A.Absorption and metabolism of xanthophylls[J].Marine Drugs,2011,9(6):1 024-1 037.
[43] BOONLAO N,SHRESTHA S,SADIQ M B,et al.Influence of whey protein-xanthan gum stabilized emulsion on stability and in vitro digestibility of encapsulated astaxanthin[J].Journal of Food Engineering,2020,272:109859.
[44] SHANMUGAPRIYA K,KIM H,SARAVANA P S,et al.Astaxanthin-alpha tocopherol nanoemulsion formulation by emulsification methods:Investigation on anticancer,wound healing,and antibacterial effects[J].Colloids and Surfaces B:Biointerfaces,2018,172:170-179.
[45] BURGOS-D AZ C,OPAZO-NAVARRETE M,SOTO-A
AZ C,OPAZO-NAVARRETE M,SOTO-A UAL M,et al.Food-grade Pickering emulsion as a novel astaxanthin encapsulation system for making powder-based products:Evaluation of astaxanthin stability during processing,storage,and its bioaccessibility[J].Food Research International (Ottawa,Ont.),2020,134:109244.
UAL M,et al.Food-grade Pickering emulsion as a novel astaxanthin encapsulation system for making powder-based products:Evaluation of astaxanthin stability during processing,storage,and its bioaccessibility[J].Food Research International (Ottawa,Ont.),2020,134:109244.
[46] MOZAFFARI H,DANESHZAD E,LARIJANI B,et al.Dietary intake of fish,n-3 polyunsaturated fatty acids,and risk of inflammatory bowel disease:A systematic review and meta-analysis of observational studies[J].European Journal of Nutrition,2020,59(1):1-17.
[47] MANSON J E,COOK N R,LEE I M,et al.Marine n-3 fatty acids and prevention of cardiovascular disease and cancer[J].The New England Journal of Medicine,2019,380(1):23-32.
[48] INNES J K,CALDER P C.Marine omega-3(n-3) fatty acids for cardiovascular health:An update for 2020[J].International Journal of Molecular Sciences,2020,21(4):1362.
[49] MARTINS B P,BANDARRA N M,FIGUEIREDO-BRAGA M.The role of marine omega-3 in human neurodevelopment,including Autism Spectrum Disorders and Attention-Deficit/Hyperactivity Disorder-a review[J].Critical Reviews in Food Science and Nutrition,2020,60(9):1 431-1 446.
[50] PADIAL-DOM NGUEZ M,ESPEJO-CARPIO F J,GARC
NGUEZ M,ESPEJO-CARPIO F J,GARC A-MORENO P J,et al.Protein derived emulsifiers with antioxidant activity for stabilization of omega-3 emulsions[J].Food Chemistry,2020,329:127148.
A-MORENO P J,et al.Protein derived emulsifiers with antioxidant activity for stabilization of omega-3 emulsions[J].Food Chemistry,2020,329:127148.
[51] LEE M C,TAN C,ABBASPOURRAD A.Combination of internal structuring and external coating in an oleogel-based delivery system for fish oil stabilization[J].Food Chemistry,2019,277:213-221.
[52] COMUNIAN T A,RAVANFAR R,SELIG M J,et al.Influence of the protein type on the stability of fish oil in water emulsion obtained by glass microfluidic device[J].Food Hydrocolloids,2018,77(1):96-106.
[53] LIU J H,LIU W L,SALT L J,et al.Fish oil emulsions stabilized with caseinate glycated by dextran:Physicochemical stability and gastrointestinal fate[J].Journal of Agricultural and Food Chemistry,2019,67(1):452-462.
[54] SALVIA-TRUJILLO L,DECKER E A,MCCLEMENTS D J.Influence of an anionic polysacchide on the physical and oxidative stability of omega-3 nanoemulsions:Antioxidant effects of alginate[J].Food Hydrocolloids,2016,52:690-698.
[55] AZIZI M,LI Y T,KAUL N,et al.Study of the physicochemical properties of fish oil solid lipid nanoparticle in the presence of palmitic acid and quercetin[J].Journal of Agricultural and Food Chemistry,2019,67(2):671-679.
[56] MIYASHITA K,BEPPU F,HOSOKAWA M,et al.Nutraceutical characteristics of the brown seaweed carotenoid fucoxanthin[J].Archives of Biochemistry and Biophysics,2020,686:108364.
[57] ZHANG Y P,XU W,HUANG X Q,et al.Fucoxanthin ameliorates hyperglycemia,hyperlipidemia and insulin resistance in diabetic mice partially through IRS-1/PI3K/Akt and AMPK pathways[J].Journal of Functional Foods,2018,48:515-524.
[58] MIYASHITA K,HOSOKAWA M.Fucoxanthin in the management of obesity and its related disorders[J].Journal of Functional Foods,2017,36:195-202.
[59] EID S Y,ALTHUBITI M A,ABDALLAH M E,et al.The carotenoid fucoxanthin can sensitize multidrug resistant cancer cells to doxorubicin via induction of apoptosis,inhibition of multidrug resistance proteins and metabolic enzymes[J].Phytomedicine,2020,77:153280.
[60] 李敏兰,弓泽华,盛滟,等.岩藻黄素提取与分析方法研究进展[J].食品研究与开发,2021,42(3):202-206.
LI M L,GONG Z H,SHENG Y,et al.Advances in extraction and analysis methods of fucoxanthin[J].Food Research and Development,2021,42(3):202-206.
[61] WANG C Y,CHEN X,NAKAMURA Y,et al.Fucoxanthin activities motivate its nano/micro-encapsulation for food or nutraceutical application:A review[J].Food & Function,2020,11(11):9 338-9 358.
[62] ZHAO D,YU D,KIM M,et al.Effects of temperature,light,and pH on the stability of fucoxanthin in an oil-in-water emulsion[J].Food Chemistry,2019,291:87-93.
[63] MOK I K,YOON J R,PAN C H,et al.Development,quantification,method validation,and stability study of a novel fucoxanthin-fortified milk[J].Journal of Agricultural and Food Chemistry,2016,64(31):6 196-6 202.
[64] SARAVANA P S,SHANMUGAPRIYA K,GERENIU C R N,et al.Ultrasound-mediated fucoxanthin rich oil nanoemulsions stabilized by κ-carrageenan:Process optimization,bio-accessibility and cytotoxicity[J].Ultrasonics Sonochemistry,2019,55:105-116.