柑橘种植面积及产量巨大,但柑橘皮渣的综合利用是一大问题。柑橘作为食品原料直接食用或加工时会产生近半数未利用的废物,目前柑橘皮再利用的一大方向是副产物提取,包括香橙素、柚皮素及其糖苷、橙皮素等。其中柚皮素及其苷类物质含量较香橙素高,如何绿色高效的获得香橙素已成为柑橘加工业亟待解决的一大难题。
香橙素,又名二氢山奈酚,是一种重要的二氢黄酮醇化合物。香橙素具有强抗氧化性,可以高效清除自由基,它还具有改善重症急性胰腺炎[1]、抗关节炎[2]、抗肝损伤[3]的作用。此外,香橙素也是多种具有重要价值的类黄酮化合物的前体物质,如二氢槲皮素、花青素和山奈酚等。
目前二氢黄酮醇的生产主要通过从植物中直接提取[4]来完成,少部分也可通过化学方法进行合成[5]。其中直接提取法存在一定的局限性[6],包括受季节和产地影响较大,提取效率较低、耗时长、各异构体的分离难等问题;而化学合成法又因环境污染严重且毒性较大的问题[7]无法广泛应用。与其他方法相比,生物转化法具有较高的特异性和环境相容性,具有更大的发展潜能。采用微生物法生产香橙素等二氢黄酮醇类化合物,不受季节影响,反应温和,选择性强并且微生物还具有生长迅速和对环境污染小等优势[8-9]。
黄烷酮-3-羟化酶(flavanone-3-hydroxylase,F3H)在类黄酮化合物的生物代谢途径中十分必要,它能引导碳流流向碳3号位羟基黄酮类化合物的生产,是下游黄酮醇和花青素合成过程中的关键步骤[10]。F3H是一种双加氧酶,它依赖于Fe2+和α-酮戊二酸[11],具有十分保守的同源性和遗传稳定性。它催化黄烷酮如柚皮素和圣草酚等形成包括香橙素在内的二氢黄酮醇。F3H第一次从矮牵牛[12]中成功分离后,陆续也从许多其他物种中克隆出来,如龙眼[13]、醋栗[14]等。其中一些基因在酵母、大肠杆菌或植物中已有功能性表达[15-19]。大肠杆菌是一种遗传背景清晰的微生物,已被用作多种蛋白质表达和小分子异源生物合成的重组宿主[20],成为重要的工业模式菌株。目前香橙素在国内外多作为中间产物来连接上下游黄酮化合物,对其表达含量的研究较少。
本研究在前期构建原核表达载体pET32a-ZmF3H的基础上,对重组蛋白诱导表达,催化以柚皮素为底物生成香橙素的反应,并对蛋白表达条件进行单因素试验优化,从而初步提高香橙素产量,为今后合成香橙素反应条件优化及研究F3H蛋白纯化条件提供一定的基础。
1 材料与方法
1.1 实验材料
1.1.1 材料与试剂
从GenBank数据库中获取来自玉米的Zmf3h(U04434.1)核酸序列并由上海生工公司合成,pET32a购自上海生工公司,大肠杆菌BL21(DE3)、JM109均为本实验室保存。
液体Luria-Bertani(LB)培养基、固体LB培养基、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶制备试剂盒,北京索莱宝科技有限公司;质粒小量抽提试剂盒,生工生物工程(上海)股份有限公司;异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG),上海瑞永生物科技公司;蛋白marker(10~170 kDa),美国Thermo公司;柚皮素标准品、香橙素标准品,质量分数≥98%,上海源叶生物科技有限公司。其余试剂均为国产分析纯。
1.1.2 仪器与设备
ZQPZ-115型组合式振荡培养箱,天津市莱玻特瑞仪器设备有限公司;MDF-86V408型医用低温保存箱,安徽中科都菱商用电器股份有限公司;SYNERGY H1型酶标仪,美国Bio Tek公司;H-class超高效液相色谱仪,美国沃特世公司;qtof6550型质谱仪,美国安捷伦公司;Mini-PROTEAN Tetra Cell1658004型蛋白电泳仪,美国Bio-Rad公司;5424R小型台式高速离心机,德国艾本德股份公司。
1.2 实验方法
1.2.1 目的菌株的构建与培养
在Bam HI和Hind III位点进行酶切将Zmf3h与pET32a相连,转入JM109感受态细胞,挑选阳性克隆送至生工公司(上海)进行测序,提取其质粒转入制备好的感受态大肠杆菌BL21(DE3)。加入100 μL 液体LB培养基,在37 ℃、200 r/min摇床中培养30 min。取70 μL已活化的菌液,将已加入氨苄青霉素的LB固体培养基预热,用无菌涂布棒将菌液涂布均匀。待平板吸收菌液倒置于37 ℃培养箱过夜培养。
取单菌落在加入抗性的液体LB培养基中培养,在37 ℃,220 r/min摇床中培养至OD600=0.7时加入IPTG使其终浓度为0.2 mmol/L,进行诱导表达。24 h后在诱导后的菌液中添加终浓度为0.1 mmol/L的FeSO4、100 mg/L的柚皮素以及终浓度为8.2 mmol/L的α-酮戊二酸,继续在摇床中培养24 h。
1.2.2 重组表达载体产物鉴定
取5 mL发酵液转移至离心管中,用超声将发酵液破碎后加入同体积乙酸乙酯进行萃取,静置30 min后在3 700 r/min、4 ℃、条件下离心(10 min),取上层乙酸乙酯进行氮吹,待其完全挥发后加入1 mL甲醇复溶,将得到的溶解液经0.22 μm滤膜过滤后转移至液相瓶,用HPLC进行分析并在电喷雾离子源(electron spray ionization,ESI)负离子模式(U=175 V)下进行质谱分析。
1.2.3 ZmF3H蛋白位置的确定
为确定ZmF3H在大肠杆菌中表达的位置,将目的菌株加入IPTG后诱导表达4 h,取适量全细胞发酵液和离心后的发酵上清液,将剩余发酵液经400 W、7 min超声破碎后重悬,取匀浆液、离心后的上清液以及沉淀,将各组按照4∶1(体积比)加入5×蛋白上样缓冲剂,混匀后在100 ℃的沸水水浴加热5 min后马上放入冰中预冷。制备电泳胶后用SDS-PAGE检测。
1.2.4 ZmF3H蛋白表达条件的优化
为进一步提高香橙素产量,设计单因素试验来探讨ZmF3H蛋白表达过程中的最佳反应条件,并采取高效液相对产物进行定量分析。
1.2.4.1 菌体密度对香橙素生成量的影响
取30 μL菌液到3 mL液体LB培养基(含有100 mg/L的氨苄青霉素)中,在37 ℃、220 r/min条件下过夜活化。按照1%接种量接种到30 mL液体LB培养基中扩大培养,当OD600分别为0.4、0.6、0.8、1和1.2时,添加IPTG使其终浓度为0.2 mmol/L进行诱导表达。在23 ℃、220 r/min的摇床中培养24 h。加入底物柚皮素及辅因子后继续发酵24 h,取发酵菌体经超声破碎、萃取、离心,收集上清液后用HPLC检测香橙素的含量。
1.2.4.2 IPTG终浓度对香橙素生成量的影响
培养条件同1.2.4.1。培养至OD600=0.6时,添加终浓度分别为0、0.2、0.4、0.6、0.8和1 mmol/L的IPTG,在23 ℃、220 r/min的摇床中继续培养24 h,取样破碎离心后取上清液进行SDS-PAGE检测。加入底物及辅因子后用HPLC检测香橙素含量。
在96孔板中加入200 μL的菌液,以OD600=0.2为起点添加不同终浓度的诱导剂IPTG,在37 ℃条件下振板培养,每0.5 h用酶标仪测定OD600。
1.2.4.3 诱导时间对香橙素生成量的影响
培养条件同1.2.4.1。培养至OD600=0.6时,添加终浓度为0.2 mmol/L IPTG,在23 ℃、220 r/min的摇床中分别培养4、8、12、20和24 h,加入底物及辅因子后用HPLC检测香橙素含量。
1.2.4.4 诱导温度对香橙素生成量的影响
培养条件同1.2.4.1。培养至OD600=0.6时,添加终浓度为0.2 mmol/L IPTG,分别在温度为13、18、23、28、33和38 ℃,220 r/min的摇床中培养24 h,取样破碎离心后取上清液进行SDS-PAGE检测。加入底物及辅因子后用HPLC检测香橙素含量。
2 结果与分析
2.1 ZmF3H蛋白位置的确定及重组表达载体产物鉴定
目的蛋白分子质量约为41 kDa,重组载体中融合的硫氧还蛋白等标签分子质量大约22 kDa,因此外源蛋白在大肠杆菌中总蛋白的分子质量约为63 kDa,由图1可知,与空载相比,有新的蛋白条带出现,且新条带与预测的目标蛋白在大肠杆菌体内总蛋白的分子质量基本一致,说明ZmF3H在大肠杆菌中已经成功表达。发现在3、5和6泳道有明显的亮带,4和7泳道无明显条带,说明ZmF3H在大肠杆菌中已经成功表达且判断ZmF3H蛋白存在于细胞内,属于胞内蛋白;ZmF3H主要存在于破胞上清液中也说明ZmF3H属于可溶蛋白。在7泳道有极轻微细条带出现,可能是由于离心后有微量上清液残留在下层沉淀中无法彻底分开,但可认为对此结果无影响。

M-蛋白分子质量标准;1-空载体pET32a发酵液;2-全细胞发酵液; 3-发酵液上清液;4-破碎重悬的匀浆液;5-破胞液上清液;6-破胞液沉淀
图1 SDS-PAGE分析pET32a-ZmF3H重组菌的蛋白表达
Fig.1 SDS-PAGE analysis of pET32a-ZmF3H recombinant protein expression
将重组菌株诱导后进行发酵培养,图2是重组菌株产酶催化生成香橙素的HPLC,样品在图谱中出现了与柚皮素、香橙素标准品出峰位置一致的峰且分离效果较好。MS结果显示在负离子模式下样品化合物与香橙素标准品中离子峰位置一致,证明大肠杆菌能够成功将柚皮素转化为香橙素。先前研究中已经成功测得经ZmF3H催化后的产物香橙素约为20.12 mg/L[21]。
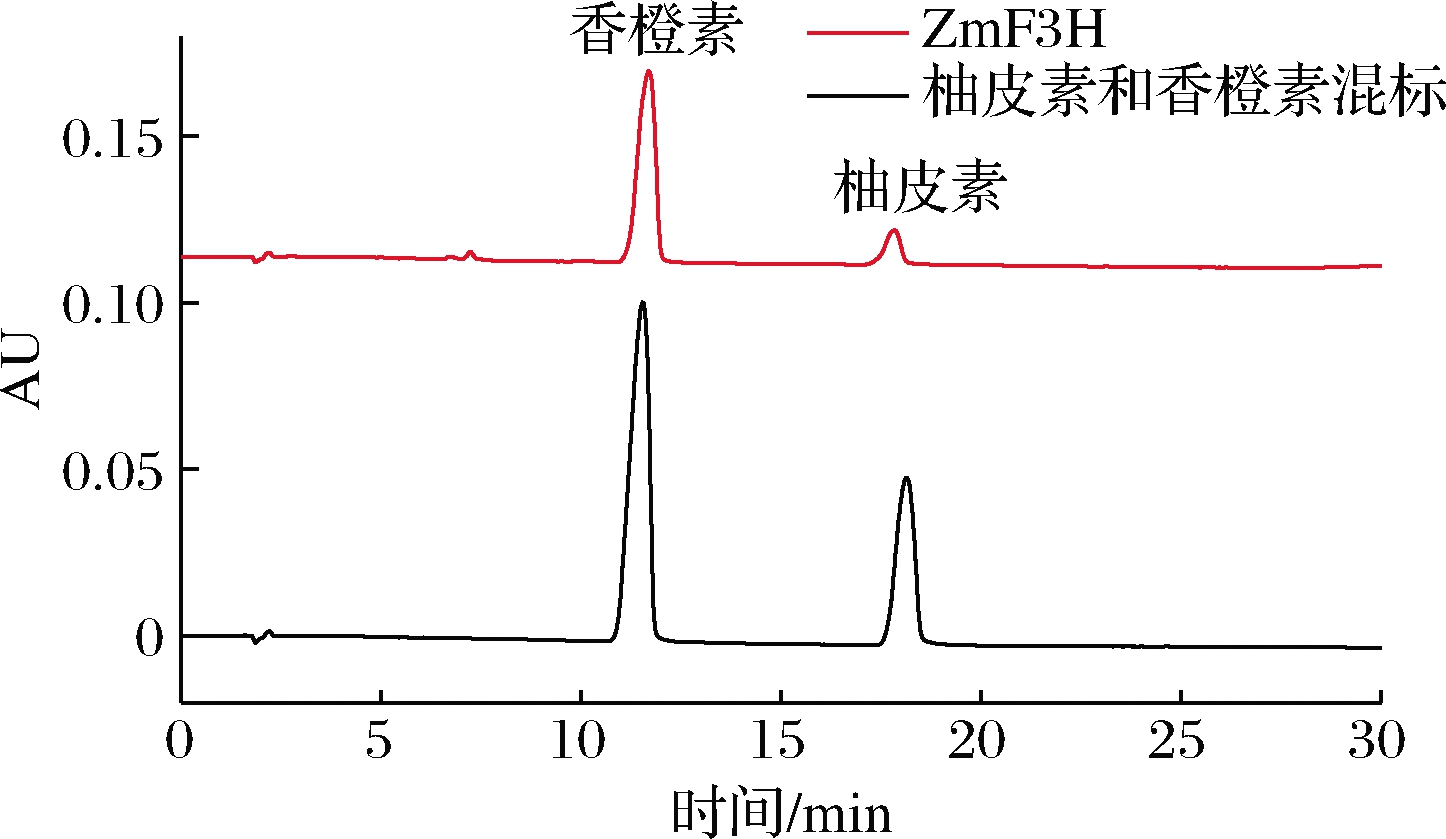
图2 表达ZmF3H重组菌株催化生成香橙素的HPLC
Fig.2 HPLC of aromadendrin catalyzed by recombinant strain expressing ZmF3H
2.2 单因素分析诱导表达条件
2.2.1 初始菌体密度(OD600)对香橙素生成量的影响
在不同菌体密度下添加诱导剂后生成的香橙素产量变化如图3,随着诱导前菌体密度的增加,香橙素产量呈现先增加后降低的趋势。在OD600=0.8和1.0时,香橙素产量达到(20.33±0.51)和(20.23±0.42)mg/L,无显著差异,因此判断当OD600在0.8~1.0时产量达到最大值。诱导的时机对于香橙素产量有重要作用,推测当OD600<0.8时,细菌浓度过低造成目的蛋白ZmF3H产量也过低且容易感染杂菌,在此时加入诱导剂后影响后续催化反应的进行;菌群继续生长到OD600>1.0时,细菌浓度过高,大肠杆菌表达外源蛋白ZmF3H的时间减少,影响工程菌的稳定性和活性,进而影响目的产物的产量。
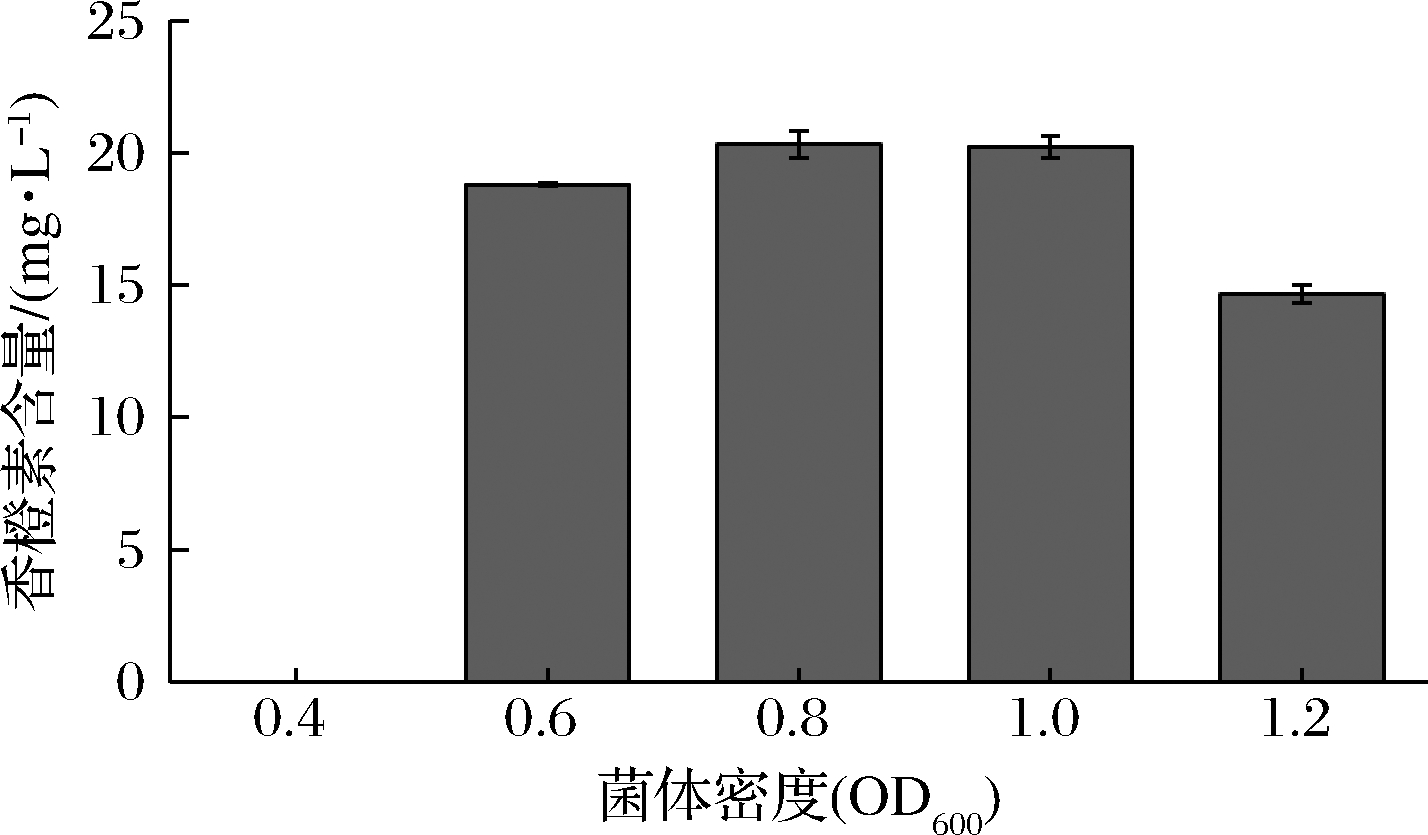
图3 初始OD600对香橙素生成量的影响
Fig.3 Effects of induction OD600 on the production of aromadendrin
2.2.2 IPTG终浓度对香橙素生成量的影响
IPTG是常见的乳糖操纵子的诱导剂,使T7启动子与T7 RNA聚合酶特异性结合,大量表达下游的目的基因。IPTG在合理的浓度范围内可有效地提高表达量。在IPTG诱导体系中,诱导剂浓度会影响蛋白的表达,因此需要选择合适的浓度。在菌种密度OD600为0.6左右,诱导温度为23 ℃,加入不同终浓度的IPTG诱导24 h后加入底物反应测定的香橙素产量见图4-a。随诱导剂终浓度的增加,香橙素生成量整体呈现先增加后下降的趋势。加入诱导剂浓度为0.6 mmol/L时,香橙素的产量最高为(26.59±1.37)mg/L。之后随诱导剂浓度增加产量下降但仍比少量添加诱导剂时的产量高。图4-b是不同IPTG终浓度对ZmF3H表达量的影响,当添加IPTG终浓度为0.6 mmol/L时ZmF3H表达量最高。

a-不同IPTG浓度对香橙素生成量的影响; b-pET32a-ZmF3H的蛋白电泳图 M-蛋白Marker;1-IPTG浓度为0.2 mmol/L;2-IPTG浓度为 0.4 mmol/L;3-IPTG浓度为0.6 mmol/L;4-IPTG浓度为0.8 mmol/L; 5-IPTG浓度为1 mmol/L
图4 不同IPTG浓度对香橙素生成量的影响和 蛋白表达量的影响
Fig.4 Effect of different IPTG concentrations on the production of aromadendrin and protein expression
图5是加入不同终浓度的IPTG后大肠杆菌生长曲线图。加入的IPTG浓度较低时对大肠杆菌的生长没有显著抑制作用,随着加入的诱导剂终浓度增大菌群生长速度减缓,且无法到达大肠杆菌正常生长密度最大值。推测大肠杆菌生长减缓是由于部分物质与能量用于蛋白合成,影响了生长速度;而当IPTG浓度过高,大肠杆菌生长受到抑制可能是过高的蛋白合成速率对菌造成了负面影响。因此,当IPTG终浓度较低时,目的蛋白ZmF3H表达较少,后续与底物结合有限因此转化量较少;当IPTG终浓度较高时,由于IPTG对细菌具有一定毒性作用,可能会抑制大肠杆菌的生长,增加原核表达系统的负载,甚至对细胞具有一定的抑制作用,从而使香橙素产量下降。

图5 不同IPTG浓度对大肠杆菌生长的影响
Fig.5 Effect of different IPTG concentrations on the growth of E.coli
2.2.3 诱导时间对香橙素生成量的影响
不同蛋白对应的最适诱导时间不同,因此诱导时间的选择也是进行优化的重要条件。在OD600为0.6,添加终浓度为0.2 mmol/L IPTG及诱导温度为23 ℃的条件下,香橙素在不同诱导时间下的生成量变化如图6所示,随着诱导时间的增加,香橙素的产量上升,在诱导时间为8 h达到最高值为(24.45±1.91)mg/L;在8 h后香橙素产量已无明显增加并在20 h后逐步下降,推测在0~8 h目的蛋白ZmF3H开始逐步积累,之后继续增大诱导时间未见产量增加;当持续诱导时间过长时香橙素含量下降,可能是因为菌体老化且诱导形成的蛋白有降解的可能性,蛋白的分泌程度已经小于降解程度,从而不利于柚皮素转化为香橙素。

图6 不同诱导时间对香橙素生成量的影响
Fig.6 Effect of different induction time on the production of aromadendrin
2.2.4 诱导温度对香橙素生成量的影响
在OD600为0.6,IPTG终浓度为0.2 mmol/L,诱导温度分别为13、18、23、28、33 ℃的条件下,诱导24 h离心菌体进行收集并超声破碎,发酵液用液相检测。随着诱导温度的升高,产物生成量先增加后减小(图7-a);在诱导温度为23 ℃,产物生成量最高为(20.50±1.51)mg/L;图7-b是不同诱导温度的蛋白电泳图,在23 ℃时目的蛋白ZmF3H的可溶性表达最高。随着温度继续升高,产量急速下降,可能是因为在高温环境下进行诱导时,大肠杆菌的生长速度加快从而蛋白表达的速度也加快,就使得表达的目的蛋白无法进行正确的折叠,可溶性蛋白减少,从而减少与底物柚皮素的结合效率,影响香橙素的形成。

a-不同诱导温度对香橙素生成量的影响;b-pET32a-ZmF3H 的蛋白电泳图 M-蛋白Marker;1-诱导温度为13 ℃;2-诱导温度为18 ℃; 3-诱导温度为23 ℃;4-诱导温度为28 ℃;5-诱导温度为33 ℃
图7 不同诱导温度对香橙素生成量和蛋白表达量的影响
Fig.7 Effect of different induction temperatures on the production of aromadendrin and protein expression
综合以上单因素试验可知,当菌体密度OD600=0.8~1时,在诱导温度为23 ℃条件下加入终浓度0.6 mmol/L的IPTG诱导8 h,此时香橙素产量最高。经试验验证后发现,在此条件下香橙素产量为(32.27±1.98)mg/L,与未优化前相比增加了60.39%,香橙素生成量有显著提高。
3 结论
以高效绿色的方式获得柑橘中的类黄酮物质已经成为一大热点。随着生物合成手段的发展,引入外源代谢途径或创造全新代谢途径来实现和提高类黄酮物质的产量已经引起普遍关注。香橙素是联结类黄酮各生物代谢通路的重要的代谢中间物。微生物法合成黄酮类物质本质是酶催化反应,但在表达外源蛋白阶段时,常由于蛋白合成速度较快,导致无法形成正确的目的蛋白进而影响后续的酶催化反应。因此对于ZmF3H诱导阶段的条件优化具有重要意义。原核表达产物的生成量与多种因素有关,其中蛋白表达阶段的菌种密度、诱导剂终浓度等对于产物的生成量有影响作用。本研究选取来自玉米的ZmF3H,将其在大肠杆菌原核系统中进行表达,以柚皮素为底物成功催化得到产物香橙素,确定了外源表达ZmF3H的可行性并对菌液处理后进行蛋白电泳验证其属于胞内可溶性蛋白。经HPLC检测在未经优化时原始生成量约为20.12 mg/L。在研究中探索了ZmF3H蛋白表达时期不同条件对香橙素生成情况的影响因素,结果发现,菌种密度、诱导温度、诱导剂浓度和诱导时间均是ZmF3H蛋白表达阶段提高香橙素生成量的重要影响因素。单因素试验分析结果表明在ZmF3H蛋白表达阶段当菌种密度在OD600=0.8~1.0,诱导温度为23 ℃,诱导剂IPTG终浓度为0.6 mmol/L,诱导时间为8 h时分别能取得处理组内最佳产物生成量。综合各单因素最优条件进行实验验证后发现,在最优单因素条件下其产量为(32.27±1.98)mg/L,相较于原始条件下增加了60.39%。
[1] LIANG X Q,HU C,LIU C Y,et al.Dihydrokaempferol (DHK) ameliorates severe acute pancreatitis (SAP) via Keap1/Nrf2 pathway[J].Life Sciences,2020,261:118340.
[2] ZHANG Y Q,YAN G H,SUN C T,et al.Apoptosis effects of dihydrokaempferol isolated from Bauhinia championii on synoviocytes[J].Evidence-Based Complementary and Alternative Medicine,2018,2 018:9806160.
[3] ZHANG J Q,HU C,LI X L,et al.Protective effect of dihydrokaempferol on acetaminophen-induced liver injury by activating the SIRT1 pathway[J].The American Journal of Chinese Medicine,2021,49(3):705-718.
[4] MA C H,YANG L,WANG W J,et al.Extraction of dihydroquercetin from Larix gmelinii with ultrasound-assisted and microwave-assisted alternant digestion[J].International Journal of Molecular Sciences,2012,13(7):8 789-8 804.
[5] 吴峥.生物活性黄酮醇和香豆素及其新型糖缀合物的合成及性能研究[D].长沙:湖南大学,2012.
WU Z.Synthesis and properties of bioactive flavonols and coumarins and their novel glycoconjugates[D].Changsha:Hunan University,2012.
[6] 方芳,王凤忠.植物黄酮醇提取方法研究进展[J].食品工业科技,2018,39(7):323-328;334.
FANG F,WANG F Z.Research progress on the extraction methods of flavonols in plants[J].Science and Technology of Food Industry,2018,39(7):323-328;334.
[7] DE RIJKE E,OUT P,NIESSEN W M A,et al.Analytical separation and detection methods for flavonoids[J].Journal of Chromatography A,2006,1 112(1-2):31-63.
[8] WU J J,LIU P R,FAN Y M,et al.Multivariate modular metabolic engineering of Escherichia coli to produce resveratrol from L-tyrosine[J].Journal of Biotechnology,2013,167(4):404-411.
[9] 望潇文,向腊,徐婷,等.碱性果胶酶高产菌株的构建和高密度发酵[J].生物工程学报,2017,33(12):2 017-2 027.
WANG X W,XIANG L,XU T,et al.Construction and high-density fermentation of alkaline pectate lyase high-yield yeast[J].Chinese Journal of Biotechnology,2017,33(12):2 017-2 027.
[10] WANG L X,LUI A C W,LAM P Y,et al.Transgenic expression of flavanone 3-hydroxylase redirects flavonoid biosynthesis and alleviates anthracnose susceptibility in sorghum[J].Plant Biotechnology Journal,2020,18(11):2 170-2 172.
[11] CHENG S Y,SONG Q L,YU T,et al.Characterization and expression analysis of four members genes of flavanone 3-hydroxylase families from Chamaemelum nobile[J].Notulae Botanicae Horti Agrobotanici Cluj-Napoca,2020,48(1):102-115.
[12] BRITSCH L,RUHNAU-BRICH B,FORKMAN G.Molecular cloning,sequence analysis,and in vitro expression of flavanone 3 β-hydroxylase from Petunia hybrida[J].Journal of Biological Chemistry,1992,267(8):5 380-5 387.
[13] 郑威,董学明,张秋颖,等.龙眼Dlf3 h基因的克隆、表达及其生物信息学分析[J].分子植物育种,2019,17(15):4 944-4 953.
ZHENG W,DONG X M,ZHANG Q Y,et al.Cloning,expression and bioinformatics analysis of Dlf3 h gene in Dimocarpus longan[J].Molecular Plant Breeding,2019,17(15):4 944-4 953.
[14] 王海竹,闫海芳,徐启江.红穗和白穗醋栗F3H的克隆及其在果实成熟过程中的表达分析[J].园艺学报,2016,43(10):2 003-2 011.
WANG H Z,YAN H F,XU Q J.Molecular cloning and expression analysis of F3H gene in Ribes rubrum and R.albrum during fruit mature[J].Acta Horticulturae Sinica,2016,43(10):2 003-2 011.
[15] MARTENS S,FORKMANN G,BRITSCH L,et al.Divergent evolution of flavonoid 2-oxoglutarate-dependent dioxygenases in parsley[J].FEBS Letters,2003,544(1-3):93-98.
[16] HALBWIRTH H,FISCHER T C,SCHLANGEN K,et al.Screening for inhibitors of 2-oxoglutarate-dependent dioxygenases:Flavanone 3β-hydroxylase and flavonol synthase[J].Plant Science,2006,171(2):194-205.
[17] SONG X Y,DIAO J J,JI J,et al.Molecular cloning and identification of a flavanone 3-hydroxylase gene from Lycium chinense,and its overexpression enhances drought stress in tobacco[J].Plant Physiology and Biochemistry,2016,98:89-100.
[18] MAHAJAN M,YADAV S K.Overexpression of a tea flavanone 3-hydroxylase gene confers tolerance to salt stress and Alternaria solani in transgenic tobacco[J].Plant Molecular Biology,2014,85(6):551-573.
[19] STAHLHUT S G,SIEDLER S,MALLA S,et al.Assembly of a novel biosynthetic pathway for production of the plant flavonoid fisetin in Escherichia coli[J].Metabolic Engineering,2015,31:84-93.
[20] LEONARD E,YAN Y J,FOWLER Z L,et al.Strain improvement of recombinant Escherichia coli for efficient production of plant flavonoids[J].Molecular Pharmaceutics,2008,5(2):257-265.
[21] 黄旭,田苗苗,肖妃垚,等.柑橘香橙素生成途径关键酶黄烷酮-3-羟化酶特性分析及原核表达[J].食品科学技术学报,2021,39(2):65-72.
HUANG X,TIAN M M,XIAO F Y,et al.Characteristic analysis and prokaryotic expression of key enzyme flavanone-3-hydroxylase in formation pathway of citrus aromadendrin[J].Journal of Food Science and Technology,2021,39(2):65-72.