益生菌是一种无侵袭性、无致病性的革兰氏阳性细菌,与病原体和毒素竞争,黏附于肠上皮细胞,促进肠上皮细胞存活,增强屏障功能,并与免疫系统细胞(如树突状细胞)直接相互作用,从而调节机体免疫功能[1]。研究发现,植物乳杆菌(Lactobacillus plantarum 299v)能增加黏蛋白Muc2 的表达量,并抑制致病菌黏附[2]。益生型大肠杆菌 Nissle 1917(Escherichia coli Nissle 1917)在治疗溃疡性结肠炎方面效果显著,可通过Toll样受体(Toll like receptor,TLR) TLR-2识别系统减少促炎细胞因子IL-2、IFN-γ 和 TNF-α的表达,及提高IL-10、IL-8和IL-1β的分泌量[3]。
然而,林显华等[4]研究枯草芽胞杆菌B7对肉鸡生长性能及免疫性能的影响,发现随着枯草芽胞杆菌B7添加量的增加,肉鸡的生长性能有所增加,但差异不明显,且高剂量组并未起到促进作用。WEI等[5]研究益生菌LFB112对肉鸡生长性能的影响时发现,随着益生菌剂量的提高,肉鸡日增重提高,但高剂量组肉鸡日增重减少。WANG等[6]将乳酸菌按照高低剂量饲喂被产气荚膜梭菌感染肉鸡时,观察到低剂量更能改善肉鸡的脂肪代谢、肉品质和肠道渗透性。上述报道显示高剂量益生菌喂养组未展现出更好的养殖促进效果。RAO等[7]发现脑模糊患者(长期使用益生菌)的小肠内有大量细菌繁殖,以及细菌发酵碳水化合物产生的D-乳酸,其对脑细胞具有暂时毒性,干扰认知、思维和时间感。当患者停止服用益生菌一段时间后,症状得以改善。2018年,ZMORA等发表在Cell杂志的研究显示,益生菌在某些情况下对人体的益处很大,例如:患有肠胃炎或胃病的人以及当患者服用抗生素后,可食用益生菌来恢复肠道菌群[8]。但益生菌不可能对每个人产生相同效果,一刀切必需补充益生菌的观念值得探讨。
肠道菌群失调会影响机体健康,甚至导致多种疾病的发生,肠道菌群平衡状态对维持机体健康十分关键,但益生菌的使用需根据个体特点及特殊需求选择和确定使用剂量。目前,对单一菌株或简单复合菌株的肠道调节作用研究报道较多,但很少关注益生菌使用剂量方面的研究。本研究考察了不同剂量复合益生菌对小鼠生理生长特性、血清生化指标、肝肾结构以及肠道菌群结构的影响。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
假链状双歧杆菌(Bifidobacterium pseudocatenulatum)、植物乳杆菌(Laobacillus plantarum) HZLp-005、干酪乳杆菌(Lactobacillus casei) HZLc-017、凝结芽胞杆菌(Bacillus coagulans) CGMCC 9951,实验室保藏。
1.1.2 实验动物
40只6周龄SPF级BALB/C小鼠(雌雄各半、清洁级),郑州伊美诺生物技术有限公司,SYXK(豫)2017—0005。普通饲料由郑州伊美诺生物技术有限公司提供。
1.1.3 主要试剂
无水乙醇、甲醛、二甲苯等,天津科密欧化学试剂有限公司。
1.2 仪器与设备
H1850R台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;奥林巴斯BX50显微镜,瑞戈(上海)实业有限公司;其他为实验室常用仪器和设备。
1.3 试验方法
1.3.1 菌种培养和富集
双歧杆菌在液体MRS培养基中37 ℃ 培养24 h,植物乳杆菌HZLp-005、干酪乳杆菌HZLc-017在液体MRS培养基中37 ℃培养18 h,凝结芽胞杆菌CGMCC 9951在液体LB培养基中37 ℃培养16 h,以 3% 接种量连续活化传代2~3次。将活化好的种子液4 000 r/min离心10 min,用生理盐水洗涤2次,并重悬于生理盐水中。将获得的双歧杆菌、植物乳杆菌HZLp-005、干酪乳杆菌HZLc-017和凝结芽胞杆菌CGMCC 9951按1∶1∶1∶1比例混合配置成浓度为108、109、1010 CFU/mL的菌液。
1.3.2 动物实验
将小鼠随机分为4组,每组10只,分别为对照组(灌胃生理盐水)、试验组(灌胃高、中、低剂量复合益生菌),每只小鼠下午4点经口灌胃0.2 mL复合菌悬液,对照组小鼠每天灌胃等量生理盐水,试验期间各组小鼠均饲喂普通饲料,自由进食和饮水。小鼠喂养6周后,禁食12 h,处死前称重。动物实验所有操作符合实验动物管理各项规定,许可证号:SYXK(豫)2017—0005。动物实验方案经河南科技大学实验动物福利与伦理审查批准。
1.3.3 血清生化指标分析
颈椎脱臼法致死小鼠后,主动脉取血,3 000 r/min离心6 min,分离得到小鼠血清并用全自动生化分析仪分析血清生化指标,其原理及实验步骤根据试剂盒所附说明书进行。
1.3.4 小肠、肝脏、肾脏组织切片染色
小鼠处死后,立即将小肠上端肠段2~3 cm、肝脏、肾脏组织用10%甲醛溶液固定。将组织切成小块放入包埋笼中冲洗,按照乙醇体积分数为70%、80%、95%(1)、95%(2)以及无水酒精进行梯度脱水。然后用二甲苯处理2次,进行包埋、切片、烤片,苏木精染色10 min,蒸馏水返蓝5~15 min,伊红染液细胞质染色,中性树胶封片,晾干镜检。
1.3.5 肠道微生物多样性测定
小鼠肠道微生物多样性测定样品送至美吉生物科技有限公司进行测序分析。采用Illumina MiSeq高通量测序平台测序。根据OTU分析结果,使用在线平台软件,对样本进行物种注释和多样性分析。
1.4 数据统计分析
利用Origin统计分析软件进行数据处理,每个实验重复3次,最后用3个独立实验以平均值±标准差表示,各组数据间的差异用SPSS 19.0 软件进行Duncan’s 多重比较分析,当P<0.05时视为差异显著。
2 结果与分析
2.1 复合益生菌剂量对小鼠体重和饲料利用率的影响
由图1-a所示,低剂量和中剂量组小鼠体重显著高于对照组,而高剂量组小鼠体重增加不显著。与WEI等[5]研究结果一致,过量添加益生菌并未能达到较好的效果。

C-对照组;L-低剂量组;M-中剂量组;H-高剂量组(下同) a-体重增加量;b-饲料利用效率
图1 复合益生菌剂量对小鼠体重增加量和饲料 利用率的影响
Fig.1 Effects of compound probiotics on weight gain and feed efficiency in mice
图1-b显示,低剂量和中剂量组小鼠对饲料利用率显著高于对照组,WANG等[9]研究也证实高剂量组的小鼠饲料利用率增加但不显著,与本实验结果一致。
2.2 血清生化指标检测
血清生化指标是机体营养代谢、应激和健康状态的综合表征,血清中蛋白质含量可以反应机体内蛋白质的代谢水平[10],由表1可知,血清总蛋白、白蛋白与对照组差异不显著,但都高于对照组,表明益生菌能够增强蛋白质的代谢水平。丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)是肝细胞损害和坏死程度的敏感指标,测定脏器酶活性变化可分析益生菌干预剂量对脏器的损害程度。与对照组相比,高、中、低剂量组小鼠的总蛋白(total protein,TP)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein,HDL-C)含量均未出现明显变化,各处理组间不存在显著或极显著差异,说明益生菌干预剂量未导致小鼠血液脂代谢的异常。益生菌添加组总胆固醇(total cholesterol,TC)较未添加组均呈降低趋势,中剂量益生菌可有效降低小鼠血清中AST和ALT,而高剂量干预组则相反,血清中ALT和AST呈现显著上升的现象。血清ALT、AST转氨酶活性升高在一定程度上反映了肝细胞的损害和坏死程度,表明益生菌干预剂量过高可能会对肝脏有损伤。
表1 复合益生菌剂量对小鼠血清生化指标的影响
Table 1 Effect of compound probiotics dosage on serum biochemical parameter in mice

组别ALT/(U·L-1)HDL-C/(mmol·L-1)AST/(U·L-1)TG/(mmol·L-1)TC/(mmol·L-1)TP/(g·L-1)白蛋白/(g·L-1)C45.3±6.4ab2.1±0.4a63.5±6.2a1.5±0.3a3.5±0.4b52.0±3.0a25.0±2.0aL44.0±6.1ab2.3±0.3a62.4±4.5a1.1±0.8a3.2±0.8ab55.0±1.0a27.0±1.0aM40.0±5.3b2.3±0.2a47.0±2.3b1.0±0.9a2.8±0.5ab54.0±2.0a26.0±1.0aH52.7±3.1a2.5±0.3a69.8±5.2a1.1±0.4a2.7±0.5ab52.0±2.0a26.0±1.0a
2.3 复合益生菌剂量对小肠组织结构的影响
肠黏膜屏障是宿主对入侵的共生细菌和肠道病原体的第一道防线。由图2可知,低剂量和中剂量组小鼠的小肠绒毛长度有显著增加,说明益生菌能够黏附于肠道上皮细胞,保护胃肠道黏膜。郭元晟等[11]发现发酵乳酸菌能够显著增加肉鸡小肠绒毛的长度及隐窝的深度,但高剂量组肉鸡的小肠绒毛较短,可能是由于肠道病原体增加,肠上皮细胞损坏导致的。

a-对照组;b-低剂量组;c-中剂量组;d-高剂量组
图2 复合益生菌剂量对小鼠小肠绒毛结构的影响
Fig.2 Effect of compound probiotics dosage on villus structure of small intestine in mice
2.4 复合益生菌剂量对肝脏结构的影响
肠道屏障损伤会增加肠道通透性,导致细菌易位和脂多糖的积累,从而引起肝脏发病[12]。图3小鼠肝损伤情况表明,对照组、低剂量组和中剂量组的小鼠肝小叶结构清晰,但高剂量组小鼠的肝脏周围有轻微的纤维化,这可能是有害菌增多,使肠道通透性增加,细菌易位,最终导致肝纤维化。
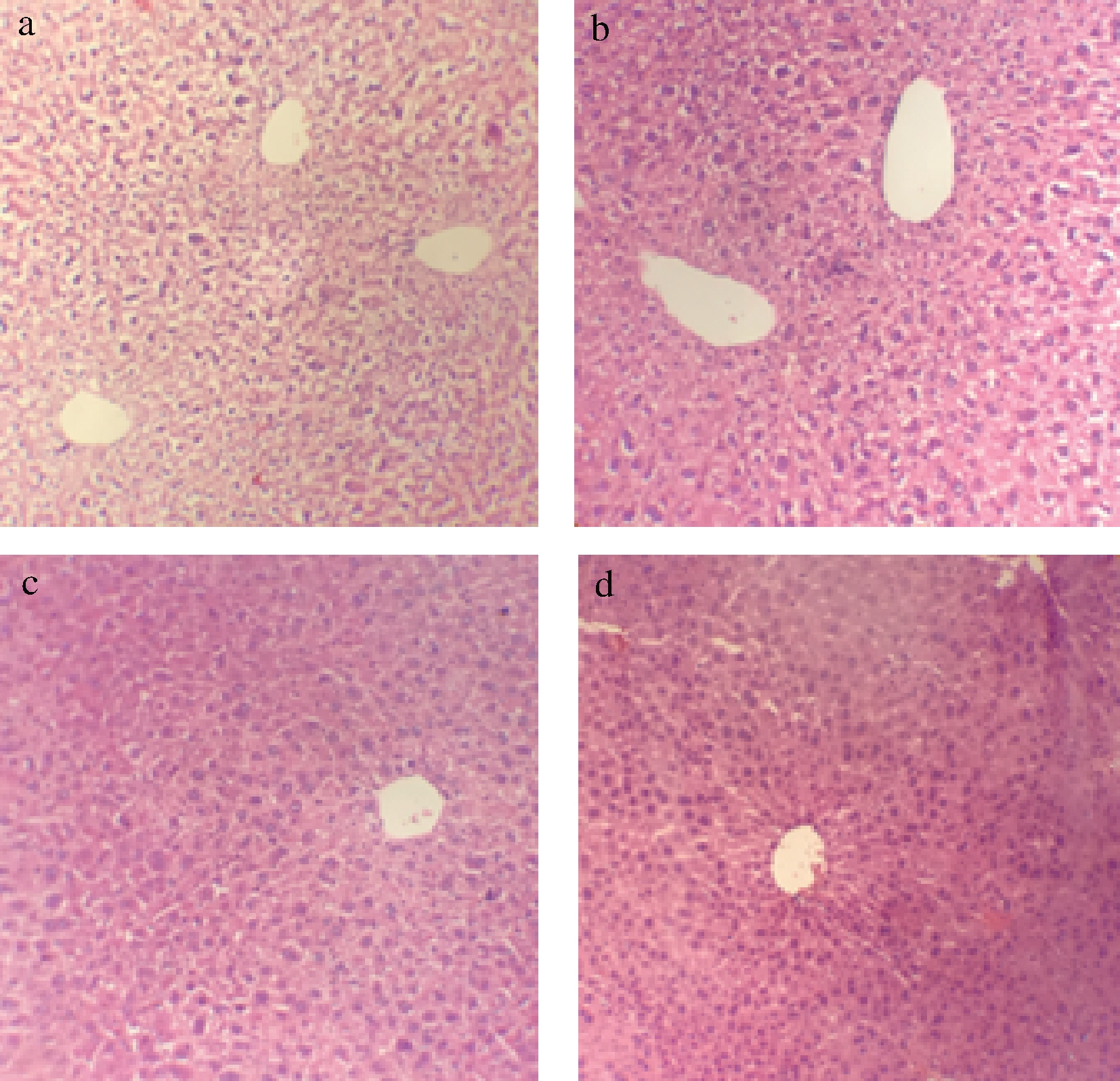
a-对照组;b-低剂量组;c-中剂量组;d-高剂量组
图3 复合益生菌剂量对小鼠肝脏结构的影响
Fig.3 Effects of compound probiotics on liver structure of mice
在生理条件下,营养物质和细菌化合物通过门静脉循环输送到肝脏,有助于宿主的体内平衡。因此,肠腔(即微生物、消化食物、异种生物)、门静脉血和肝脏之间的主要边界是肠屏障。肠道细菌能够通过模式识别受体的特殊分子与宿主细胞相互作用。CANI等[13]发现血浆脂多糖水平与小肠细菌过度生长、肠道菌群组成变化和肠道通透性增加有关,代谢性内毒素血症也会引起肝脏脂肪堆积,但缺乏脂多糖受体复合物CD14/TLR4的小鼠中却未出现。表明肠道微生物代谢产生的化合物与肝脂肪变性的发生有直接联系。肝硬化患者的肠道细菌易位增加,血液循环系统中细菌DNA浓度也会相应增加,说明肠道通透性增加反映了机体病原体的感染情况。
2.5 复合益生菌剂量对肾脏组织的影响
由图4可知,对照组、低剂量组和中剂量组小鼠的肾组织形态正常,而高剂量组小鼠的肾小球有轻微萎缩,可能是源于肠道微生物群的改变,增加了炎症、尿毒症和血压水平[14]。由于哺乳动物不能分解尿素,是利用肠道细菌通过尿素酶将尿素转化为NH3和CO2,经过肝脏中的尿素循环,一些氨被转化成尿素,其他则转化为NH4OH并在粪便中排泄[15]。生活方式、饮食模式改变和纤维摄入减少会导致肠道发育不良,产生过量毒素(如NH3、胺、硫醇、酚类和吲哚)。NH3/NH4OH的形成和肠腔pH值的增加会影响共生菌和病原菌之间的平衡,并导致有害菌增殖[16]。
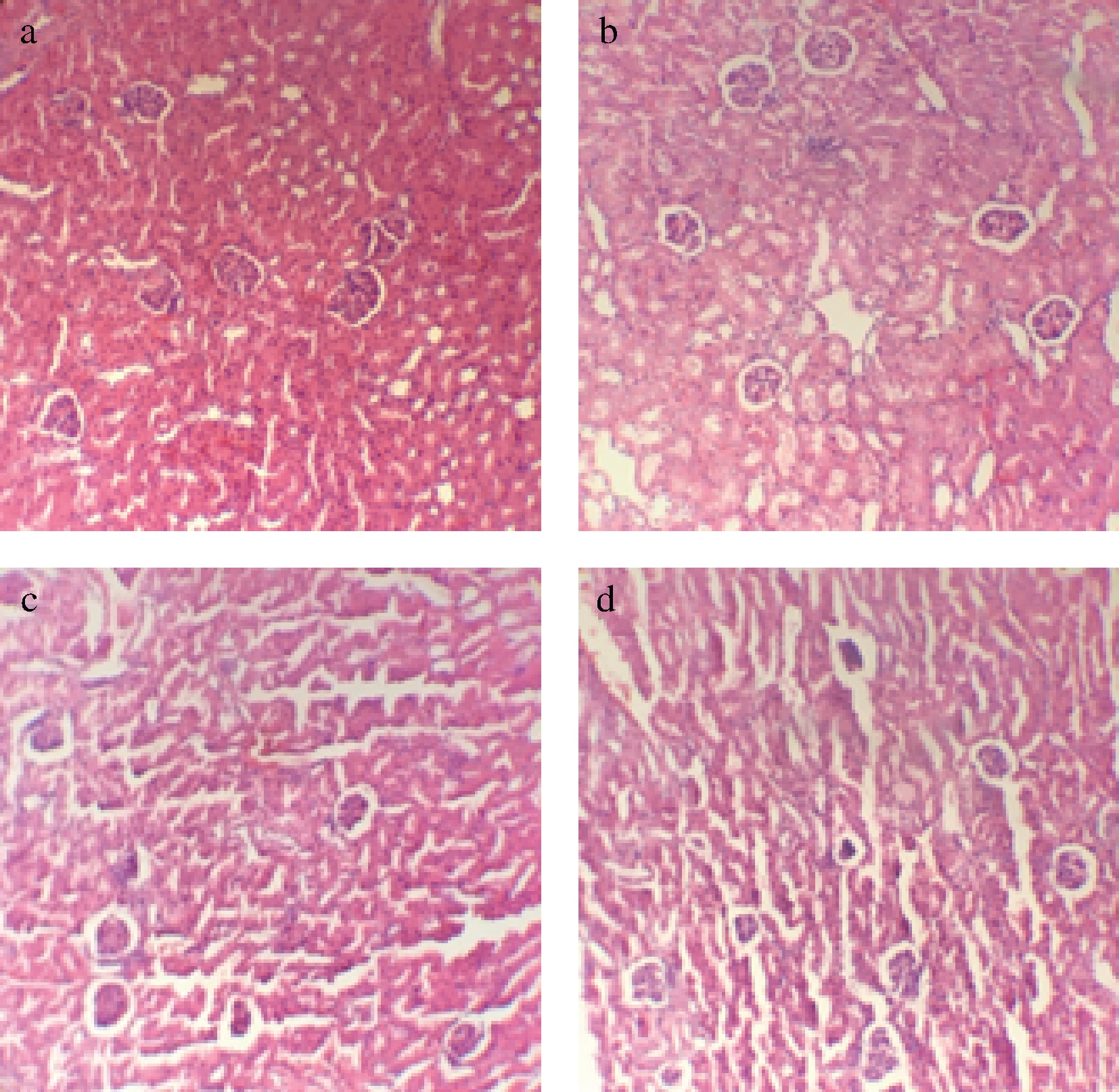
a-对照组;b-低剂量组;c-中剂量组;d-高剂量组
图4 复合益生菌剂量对小鼠肾脏结构的影响
Fig.4 Effects of compound probiotics on kidney structure of mice
肠道中病原菌的过度生长会破坏肠道屏障的完整性,进而增加细菌及其代谢产物向系统循环的易位,导致慢性肾脏病的进展。
2.6 复合益生菌剂量对小鼠肠道菌群结构的影响
图5结果表明,各组小鼠肠道菌群中的拟杆菌门和厚壁菌门为优势菌门,但中、低剂量组的乳杆菌科和毛螺菌科均高于对照组,而高剂量组小鼠肠道菌群中的厚壁菌门减少,拟杆菌门和变形菌门增加。BAJAJ等[17]发现肝硬化患者的肠道菌群中变形菌门在肝硬化患者中较高,如大肠杆菌、肺炎克雷伯菌和假单胞菌造成肝硬化的感染,导致死亡[18];另外,变形菌门中的肠杆菌科、弯曲杆菌科和巴斯德菌科,厚壁菌门中的肠球菌科和链球菌科与不良后果有关,而厚壁菌门中法人毛螺菌科可降低不良后果。此外,肝硬化患者肠道也有潜在致病性类群,如最终导致死亡的肠球菌科和链球菌科,且肠道的梭状芽胞杆菌和毛螺菌科也会随之减少[19]。研究人员发现瘤胃菌科与肾功能负相关,与硫酸吲哚酚代谢物呈正相关,毛螺菌科与肾功能正相关。VAZIRI等[16]发现在肾脏疾病中的放线菌、厚壁菌门中的亚门梭状芽胞杆菌和变形菌门大量增加。BAJAJ等[17]发现肠道失调与慢性肝病的关系,毛螺菌科与肝病呈负相关,葡萄球菌科、肠球菌科、肠杆菌科与肝病呈正相关。我们的研究结果与其报道相一致,即高剂量组小鼠的肾脏结构出现问题,从科水平上看,高剂量组的毛螺菌科、乳杆菌科较少,幽门螺杆菌、脱硫弧菌科和脱铁杆菌门增多,可能
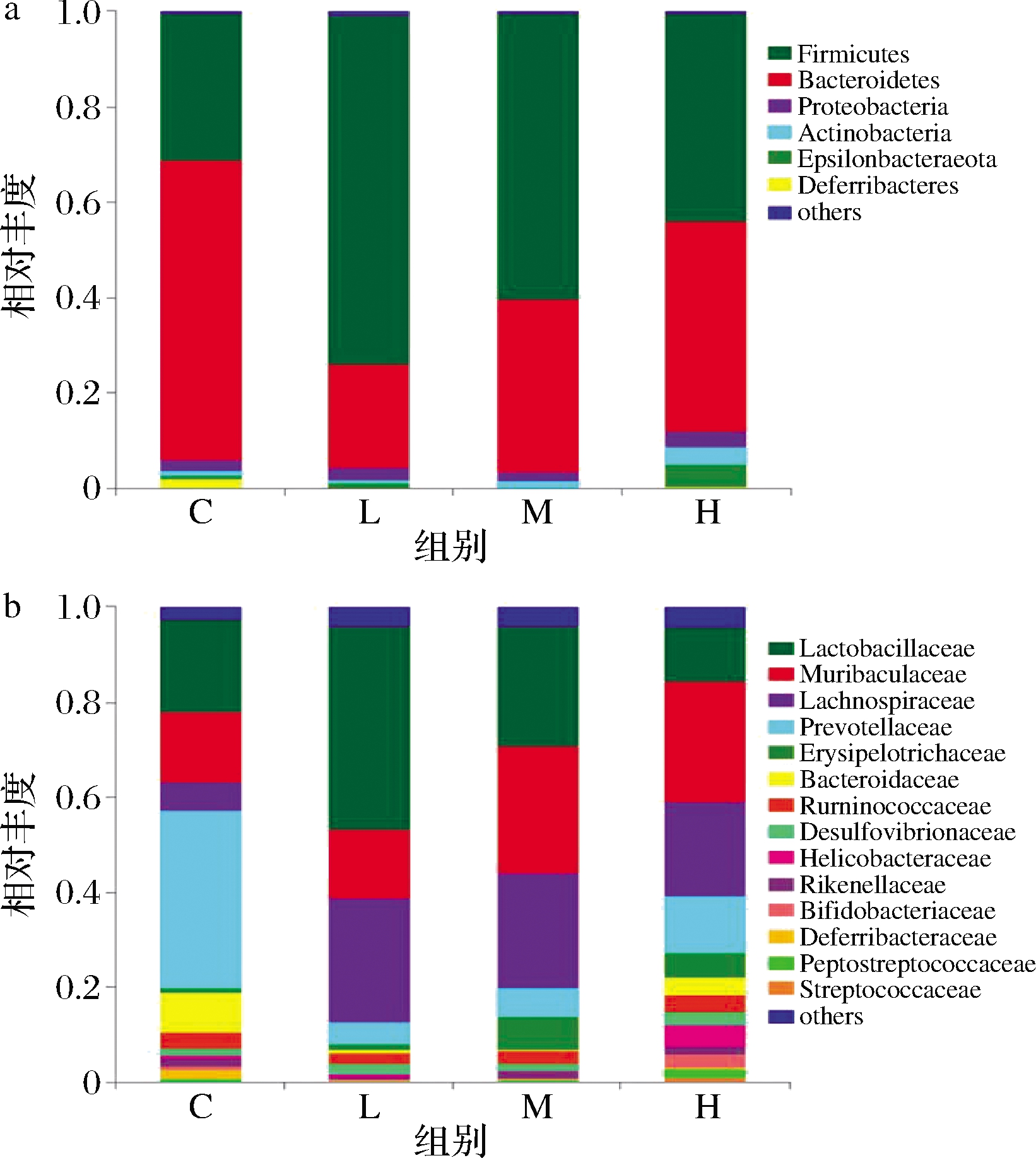
a-门水平;b-科水平
图5 复合益生菌剂量对小鼠肠道菌群相对丰度
Fig.5 Effect of compound probiotics dosage on relative abundance of intestinal flora in mice
是这些有害菌产生的毒素导致了肾脏组织结构变化。WONG等[20]在肾脏疾病患者肠道菌群中发现了12个科产脲酶,5个科产尿酸酶,4个科产吲哚酶和对甲酚生成酶,都与尿毒症有关。两个具有产丁酸酯酶的微生物被削弱,这表明合成短链脂肪酸能力下降,患者的炎症反应可能受损。
2.7 复合益生菌剂量对小鼠肠道菌群功能特征的影响
为更好理解样本,我们基于16S rRNA的高通量测序数据和同源群数据库(COG),利用PICRUSt 软件进一步对小鼠肠道微生物群的功能特征进行了分析。由图6可见,小鼠肠道微生物主要的COG功能包括:能量生产与转换、氨基酸转运与代谢、碳水化合物转运与代谢、无机离子转运与代谢、翻译,核糖体结构和生物起源、转录、复制,重组和修复。与对照组相比,复合益生菌添加组的肠道微生物代谢功能更旺盛,但高剂量组的代谢功能丰度呈现降低的趋势。

图6 复合益生菌剂量对小鼠微生物功能特征的影响
Fig.6 Effect of compound probiotics dosage on microbial function features in mice
由表2可知,添加复合益生菌增强了肠道微生物的代谢功能,如抗坏血酸和醛酸代谢、次生胆汁酸生物合成、甘油酯新陈代谢、碳水化合物代谢、丙酮酸代谢、磷酸戊糖途径、糖酵解和糖质新生、淀粉和蔗糖的代谢、戊糖和葡萄糖醛酸盐的相互转化、组氨酸代谢、色氨酸代谢等。其中,组氨酸分解代谢可以产生组胺,组胺能够抑制抗炎细胞因子TNF-α、IL-1和IL-12的产生,同时防止肠道细菌易位[21]。色氨酸分解代谢产生色胺和吲哚类物质,色胺是一种神经递质,在调节肠道运动和免疫功能方面发挥作用;另一方面,吲哚是色氨酸的一种主要代谢产物,由拟杆菌和肠杆菌科产生[22],在宿主防御中发挥重要作用。然而,吲哚过量时,在肝脏中,被硫酸化为吲哚酰基硫酸盐,这是一种与慢性肾病相关的尿毒症毒素[23]。随着益生菌剂量的增加,代谢功能降低,且与炎症相关的脂多糖生物合成、甾类激素生物合成、花生四烯酸代谢代谢通路丰度增加。GILL等[24]也研究发现炎症相关通路,如脂多糖合成、类固醇合成、生物素代谢等与肠道菌群显著相关,表2中高剂量组中氮代谢要高于其他组,与肾脏病理学检查结果一致。高剂量组的维生素B6的新陈代谢、甜菜碱生物合成和N-聚糖生物合成代谢功能增强,表明益生菌含量过高,并没有完全破坏其他的微生物代谢功能。RAO等[7]认为益生菌不应该被当作营养食品补充剂,饮食正常、身体健康的人群不需要额外补充益生菌;如果饮食不规律,且经常吃不健康的食物,适时适量补充益生菌确实可改善肠道菌群。
表2 微生物功能特征的丰度值
Table 2 Abundance value of microbial functional features
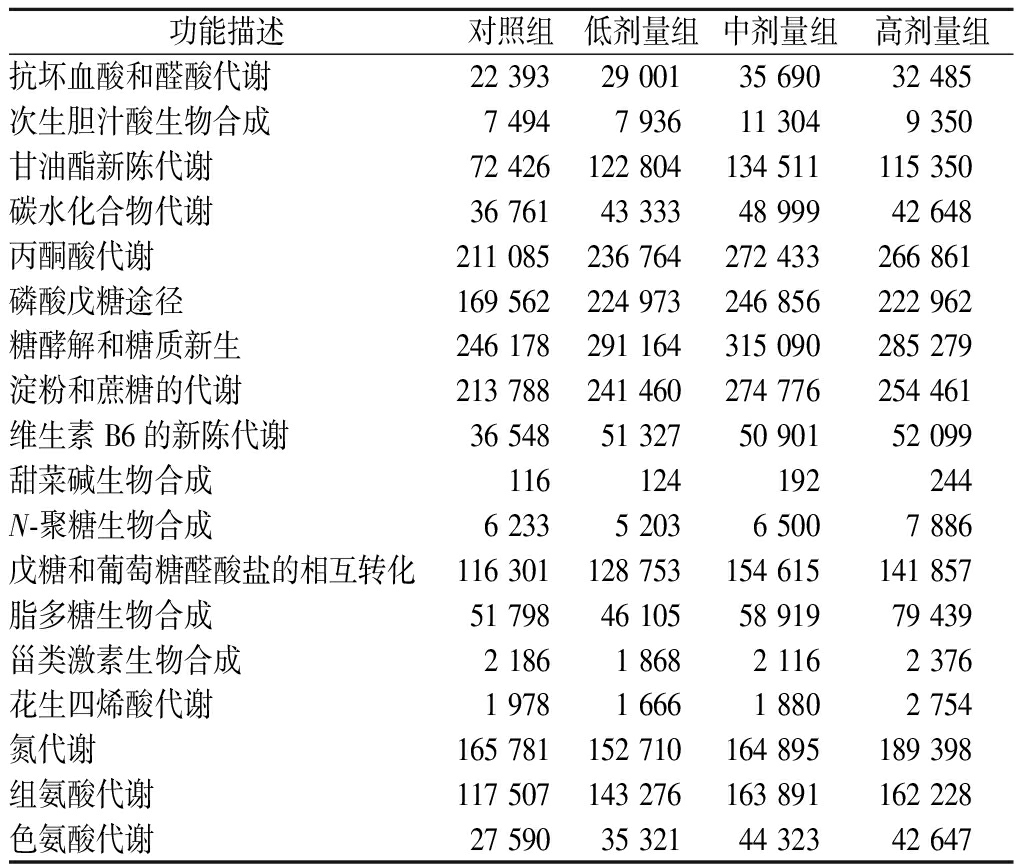
功能描述对照组低剂量组中剂量组高剂量组抗坏血酸和醛酸代谢22 39329 00135 69032 485次生胆汁酸生物合成7 4947 93611 3049 350甘油酯新陈代谢72 426122 804134 511115 350碳水化合物代谢36 76143 33348 99942 648丙酮酸代谢211 085236 764272 433266 861磷酸戊糖途径169 562224 973246 856222 962糖酵解和糖质新生246 178291 164315 090285 279淀粉和蔗糖的代谢213 788241 460274 776254 461维生素B6的新陈代谢36 54851 32750 90152 099甜菜碱生物合成116124192244N-聚糖生物合成6 2335 2036 5007 886戊糖和葡萄糖醛酸盐的相互转化116 301128 753154 615141 857脂多糖生物合成51 79846 10558 91979 439甾类激素生物合成2 1861 8682 1162 376花生四烯酸代谢1 9781 6661 8802 754氮代谢165 781152 710164 895189 398组氨酸代谢117 507143 276163 891162 228色氨酸代谢27 59035 32144 32342 647
3 讨论
肠道微生态在维持宿主健康和体内平衡的调节中起着重要作用,越来越多证据表明,微生物群组成和结构的变化可影响人类健康和疾病。肠道菌群影响多种病理生理过程,在正常生理和疾病方面,肝脏和肠道之间存在紧密的相互作用,肠肝轴参与了各种肝脏疾病,从非酒精性脂肪肝疾病,酒精性脂肪性肝炎到肝纤维化以及肝细胞癌。肠肝轴已经成为该领域的研究热点。SCHNEIDER等[25]探讨了肠道菌群失调在急性肝损伤中的作用,Nlrp6小鼠的共生菌群诱导肝脏单核细胞来源的巨噬细胞出现Ly6Chi表型,并加剧急性肝损伤,且该表型可通过粪便菌群转移至WT小鼠。此外,Nature Medicine期刊发表的一项研究显示,通过对肝衰竭小鼠模型单细胞转录组学进行分析,全方位揭示了肠道菌群在急性肝衰竭中的作用,发现肠道菌群介导了星状细胞、内皮细胞、Kupffer细胞的myc-依赖性激活过程[26]。TRANAH等[27]指出,患者的肠道菌群失调(多样性降低、定殖抗性丢失、致病菌扩增)、肠道屏障被破坏,促进致病菌及PAMP(病原相关分子模式)的易位,从而恶化肝脏炎症。这些研究证实,肠道菌群结构的改变在肝脏损伤和疾病发生发展中起着关键作用。本研究通过对组织病理学的观察、肠道菌群丰度以及微生物群的功能特征的研究,发现导致肠道和脏器不同程度损伤的原因可能是微生物有害代谢产物造成的。
4 结论
本文研究了不同剂量复合益生菌对小鼠生理、生长代谢特性和肠道菌群结构的影响。结果表明,适量的益生菌能够显著提高小鼠的体重及饲料利用率,增加肠道有益菌,增强肠道微生物的代谢功能(抗坏血酸和醛酸代谢、次生胆汁酸生物合成、甘油酯新陈代谢、碳水化合物代谢、丙酮酸代谢、磷酸戊糖途径、糖酵解和糖质新生、淀粉和蔗糖的代谢、戊糖和葡萄糖醛酸盐的相互转化、组氨酸代谢、色氨酸代谢)。通过组织病理学发现,益生菌使用过量可能会对小鼠的脏器产生负面影响;肠道菌群结构和代谢功能分析表明,过量使用益生菌可能会使小鼠肠道有害菌增加,维生素B6的新陈代谢、甜菜碱生物合成和N-聚糖生物合成的代谢功能增强,且与炎症相关的脂多糖生物合成、甾类激素生物合成、花生四烯酸代谢代谢通路丰度增加。
综上所述,益生菌过量使用可能会给健康带来一定的风险。补充益生菌应根据个体特性及特殊需求量身定制,不要过量补充,并应根据机体状况选择适宜种类的益生菌。
[1] LI J H,JIA H J,CAI X H,et al.An integrated catalog of reference genes in the human gut microbiome[J].Nature Biotechnology,2014,32(8):834-841.
[2] WLODARSKA M,FINLAY B B.Host immune response to antibiotic perturbation of the microbiota[J].Mucosal Immunology,2010,3(2):100-103.
[3] RAO S,HU S,MCHUGH L,et al.Toward a live microbial microbicide for HIV:Commensal bacteria secreting an HIV fusion inhibitor peptide[J].PNAS,2005,102(34):11 993-11 998.
[4] 林显华, 孙合美,谷巍.枯草芽胞杆菌B7对肉鸡生长性能及免疫性能的影响[J].中国畜牧兽医,2013,40(2):91-95.
LIN X H,SUN H M,GU W.Effects of Bacillus subtilis on growth performance and immune function of broilers[J].China Animal Husbandry & Veterinary Medicine,2013,40(2):91-95.
[5] WEI X B,LIAO X D,CAI J,et al.Effects of Bacillus amyloliquefaciens LFB112 in the diet on growth of broilers and on the quality and fatty acid composition of broiler meat[J].Animal Production Science,2017,57(9):1 899-1 905.
[6] WANG H S,NI X Q,QING X D,et al.Live probiotic Lactobacillus johnsonii BS15 promotes growth performance and lowers fat deposition by improving lipid metabolism,intestinal development,and gut microflora in broilers[J].Frontiers in Microbiology,2017,8:1073.
[7] RAO S S C,REHMAN A,YU S,et al.Brain fogginess,gas and bloating:A link between SIBO,probiotics and metabolic acidosis[J].Clinical and Translational Gastroenterology,2018,9(6):162.
[8] ZMORA N,ZILBERMAN-SCHAPIRA G,SUEZ J,et al.Personalized gut mucosal colonization resistance to empiric probiotics is associated with unique host and microbiome features[J].Cell,2018,174(6):1 388-1 405.
[9] WANG J,ZHANG H,CHEN X,et al.Selection of potential probiotic Lactobacilli for cholesterol-lowering properties and their effect on cholesterol metabolism in rats fed a high-lipid diet[J].Journal of Dairy Science,2012,95(4):1 645-1 654.
[10] 曾东,李涛,倪学勤,等.乳酸杆菌和囊素三肽对肉鸡生长性能、屠宰性能、肉质和血清生化指标的影响[J].动物营养学报,2014,26(5):1 320-1 326.
ZENG D,LI T,NI X Q,et al.Effects of Lactobacilli and bursin on growth performance,slaughter performance,meat quality and serum biochemical parameters of broiler[J].Chinese Journal of Animal Nutrition,2014,26(5):1 320-1 326.
[11] 郭元晟,闫素梅,史彬林,等.发酵乳酸杆菌对肉鸡小肠绒毛形态的影响[J].动物营养学报,2011,23(7):1 194-1 200.
GUO Y S,YAN S M,SHI B L,et al.Effects of Lactobacillus fermentum supplementation on the small intestinal villus structure of broilers[J].Chinese Journal of Animal Nutrition,2011,23(7):1 194-1 200.
[12] WIEST R,LAWSON M,GEUKING M.Pathological bacterial translocation in liver cirrhosis[J].Journal of Hepatology,2014,60(1):197-209.
[13] CANI P D,AMAR J,IGLESIAS M A,et al.Metabolic endotoxemia initiates obesity and insulin resistance[J].Diabetes,2007,56(7):1 761-1 772.
[14] FELIZARDO R J F,CASTOLDI A,ANDRADE-OLIVEIRA V,et al.The microbiota and chronic kidney diseases:A double-edged sword[J].Clinical & Translational Immunology,2016,5(6):e86.
[15] RAMEZANI A,MASSY Z A,MEIJERS B,et al.Role of the gut microbiome in uremia:A potential therapeutic target[J].American Journal of Kidney Diseases,2016,67(3):483-498.
[16] VAZIRI N D.Effect of synbiotic therapy on gut-derived uremic toxins and the intestinal microbiome in patients with CKD[J].Clinical Journal of the American Society of Nephrology,2016,11(2):199-201.
[17] BAJAJ J S,BETRAPALLY N S,HYLEMON P B,et al.Salivary microbiota reflects changes in gut microbiota in cirrhosis with hepatic encephalopathy[J].Hepatology,2015,62(4):1 260-1 271.
[18] FERN NDEZ J,ACEVEDO J,WIEST R,et al.Bacterial and fungal infections in acute-on-chronic liver failure:Prevalence,characteristics and impact on prognosis[J].Gut,2018,67(10):1 870-1 880.
NDEZ J,ACEVEDO J,WIEST R,et al.Bacterial and fungal infections in acute-on-chronic liver failure:Prevalence,characteristics and impact on prognosis[J].Gut,2018,67(10):1 870-1 880.
[19] LLORENTE C,JEPSEN P,INAMINE T,et al.Gastric acid suppression promotes alcoholic liver disease by inducing overgrowth of intestinal Enterococcus[J].Nature Communications,2017,8(1):837.
[20] WONG J,PICENO Y M,DESANTIS T Z,et al.Expansion of urease-and uricase-containing,indole-and p-cresol-forming and contraction of short-chain fatty acid-producing intestinal microbiota in ESRD[J].American Journal of Nephrology,2014,39(3):230-237.
[21] THOMAS C M,HONG T,VAN PIJKEREN J P,et al.Histamine derived from probiotic Lactobacillus reuteri suppresses TNF via modulation of PKA and ERK signaling[J].PLoS One,2012,7(2):e31951.
[22] GAO J,XU K,LIU H N,et al.Impact of the gut microbiota on intestinal immunity mediated by tryptophan metabolism[J].Frontiers in Cellular and Infection Microbiology,2018,8:13.
[23] EVENEPOEL P,POESEN R,MEIJERS B.The gut-kidney axis[J].Pediatric Nephrology,2017,32(11):2 005-2 014.
[24] GILL T,BROOKS S R,ROSENBAUM J T,et al.Novel inter-omic analysis reveals relationships between diverse gut microbiota and host immune dysregulation in HLA-B27-induced experimental spondyloarthritis[J].Arthritis & Rheumatology,2019,71(11):1 849-1 857.
[25] SCHNEIDER K M,ELFERS C,GHALLAB A,et al.Intestinal dysbiosis amplifies acetaminophen-Induced acute liver injury[J].Cellular and Molecular Gastroenterology and Hepatology,2021,11(4):909-933.
[26] KOLODZIEJCZYK A A,FEDERICI S,ZMORA N,et al.Acute liver failure is regulated by MYC-and microbiome-dependent programs[J].Nature Medicine,2020,26(12):1 899-1911
[27] TRANAH T H,EDWARDS L A,SCHNABL B,et al.Targeting the gut-liver-immune axis to treat cirrhosis[J].Gut,2021,70(5):982-994.