幽门螺杆菌(Helicobacter pylori)是弯曲菌科螺杆菌属的一种微需氧革兰氏阴性菌,可定植于人体胃部。H.pylori感染在世界范围内极为常见,世界人口感染率高达50%[1]。H.pylori与胃炎、消化溃疡以及胃癌的发生密切相关,已被世界卫生组织列为生物致癌因子[2-3]。临床上幽门螺杆菌感染最主要采用的治疗方案是三联疗法,即质子泵抑制剂配合2种抗生素,常用抗生素为阿莫西林和克拉霉素[4]。由于抗生素的长时间滥用,H.pylori的耐药性逐年升高,三联疗法疗效受到严重影响,因此,四联疗法应运而生,即在三联疗法基础上加入铋剂辅助治疗,但疗效并未显著提高,反而出现了多重耐药的现象[5]。因此,寻找潜在有效治疗H.pylori的替代药物迫在眉睫。
脲酶(urease,EC3.5.1.5)是H.pylori重要的定殖因子与毒力因子[6],可分解尿素产生氨以中和胃酸,在其周围形成一片“氨云”,使得H.pylori可以在胃部生长繁殖。研究表明,剔除脲酶突变基因,H.pylori不能在无菌猪仔胃部定殖[7]。脲酶能分解尿素产生过量氨,并进一步形成硝酸盐和亚硝酸盐损害组织甚至致癌[8];尿素的水解产物还能激活单核细胞,促使免疫炎症递质和超氧自由基的分泌,促使空泡的形成[6,9]。在脲酶的结构单元中,其活性位点的Ni2+和活性位点附近的必需基团巯基对脲酶的催化作用是必需的,而脲酶的活性又与H.pylori能否成功定殖胃部,影响生物体氮利用有关系[4],因此,抑制脲酶活性被视作抗菌物质研究的关键[10-11]。
沙棘(Hippophae rhamnoides Linn.)为青藏高原的特色浆果资源,属药食同源植物,目前已从沙棘根、茎、叶、果实中分离了多种生物活性物质,如甾醇类化合物、多酚类化合物、多糖、不饱和脂肪酸等。沙棘鲜果可直接食用,但因其酸度较大,故主要用于加工,当前市场上的沙棘产品主要包括食品、药品、化妆品、保健品等8大类,沙棘食品主要为沙棘饮料、沙棘茶、沙棘果醋、沙棘酒和沙棘果粉等。在饲用价值方面,以沙棘叶和沙棘残渣为饲料或补充饲料可有效提高乳肉产品的质量、数量,增加了优质饲料的种类[12]。在药用价值方面,沙棘为藏、蒙传统药物用于治疗烧伤、冻伤、心脑血管疾病等,早期研究表明,沙棘提取物对多种肠道致病菌有抑制作用,沙棘中的抑菌成分多样,包括沙棘甾醇、沙棘多糖及沙棘黄酮等,且沙棘在调节肠道微生物系统方面也有一定功效[13]。研究发现沙棘籽、叶提取物对白色念珠菌、大肠杆菌、枯草芽胞杆菌等均有很强的抑菌效果[14-17]。黄国栋等[18]用沙棘原花青素治疗H.pylori相关性胃炎,治疗组的有效率高达88%。目前,沙棘资源虽得到一定程度的开发,但是关于沙棘抗H.pylori感染的潜在机制鲜有报道,考虑到幽门螺旋杆菌脲酶(Helicobacter pylori urease,HPU)作为H.pylori定殖于胃部的重要因子,本试验将研究沙棘提取物对HPU的抑制作用机制,为探明沙棘提取物抑制H.pylori感染机制提供基础数据,进一步开发沙棘资源。
1 材料与方法
1.1 试验材料
野生沙棘鲜果,青海省西宁市城北区;幽门螺杆菌ATCC 43504标准株,美国菌种保藏中心。
1.2 试验仪器与试剂
1.2.1 试验试剂
LA3540哥伦比亚琼脂基础、LA3550布氏肉汤、R0010高效RIPA裂解液(组织/细胞)、BC4110脲酶活性检测试剂盒,北京索莱宝科技有限公司;A045-2蛋白定量测试盒,南京建成生物工程研究所;RN08-EASYspin细菌总RNA提取试剂盒,北京艾德莱生物科技有限公司;RR820A荧光定量PCR试剂盒,宝生物工程(大连)有限公司。
1.2.2 试验仪器
SW-CJ-ID单人净化工作台,苏州净化设备有限公司;YM50FNG高压蒸汽灭菌锅,上海三申医疗器械;SPX-450FT恒温生化培养箱,宁波普朗特仪器有限公司;Multiskan Sky微量核酸蛋白测定仪,美国Thermo Fisher公司;Centrifuge 5430R低温高速离心机,德国Eppendorf有限公司;CFX-96 Touch荧光定量PCR仪,美国Bio-Rad公司。
1.3 样品制备及主要指标测定
1.3.1 沙棘水及乙醇提取物的制备
新鲜沙棘果烘干打粉,果粉分别与水、体积分数80%的乙醇以料液比1∶20(g∶mL)混合,超声辅助提取2次(40 ℃,30 min),提取液经过滤后浓缩至一定体积,将浓缩的提取液进行真空冷冻干燥,所得冻干物按浓度需求以原溶剂进行复溶,并以0.22 μm滤膜过滤除菌。
1.3.2 H.pylori的培养
H.pylori接种于布氏肉汤培养基,添加体积分数5%胎牛血清和混合抗生素(万古霉素0.01 mg/mL,两性霉素B 0.01 mg/mL,多粘菌素0.000 2 mg/mL,甲氧苄氨0.005 mg/mL),于微需氧条件下(5% O2,10% CO2和85% N2),37 ℃恒温振荡培养24 h,得菌液备用。
1.3.3 脲酶的制备
脲酶提取参照XIAO等[19]的方法并进行改进。肉汤培养物离心(6 000×g,10 min,4 ℃)以收集菌体,以pH 7.4的PBS缓冲液清洗两遍,加入适量的细胞裂解液、蛋白酶抑制剂,混匀,冰浴20~30 min。再次离心(15 000×g,5 min,4 ℃)收集脲酶,检测其活性,并置于-80 ℃冰箱保存。
1.3.4 HPU酶活性测定方法
采用Berthelot法(靛酚蓝显色法)对HPU的酶活性进行测定。按脲酶活性测定试剂盒将尿素溶于蒸馏水,加入脲酶溶液,充分混匀后于37 ℃反应1 h,再加入显色液进行显色,于630 nm处检测吸光值,测得脲酶活性为1.22 U/mg prot,一个脲酶活性单位定义为1 mg蛋白1 min产生1 μg NH3-N(氨氮),计算如公式(1)所示:
(1)
式中:UE,酶活力,U/mg prot;ΔA(测定)=A(测定管)-A(对照管),吸光值之差;ΔA(标准)=A(标准管)-A(空白管),吸光值之差;ρ(标准品),氮标液的质量浓度,μg/mL;V(酶促),酶促反应体系总体积,mL;V(样本),加入反应体系中样本体积,mL;ρ(pr),样本蛋白质质量浓度,mg/mL;t,反应时间,min。蛋白质浓度由考马斯亮蓝法测定。
1.4 主要研究内容及试验设计
1.4.1 沙棘水提物对菌液脲酶活性的影响
将沙棘水提物同H.pylori菌液混合,设置组间浓度梯度,各组沙棘水提物体系质量浓度分别为0、0.5、1、2.5、5 mg/mL,于37 ℃振荡培养6 h,评价其HPU活性差异。
1.4.2 脲酶活性抑制试验
将沙棘果粉水提物、80%乙醇提取物与HPU于37 ℃孵育20 min后测定其酶活性,设置沙棘水提物的体系质量浓度为5 mg/mL,设置pH 3、4的柠檬酸溶液,80%乙醇作为空白对照。试验重复3次。
参照WU等[20]设置孵育时间梯度、抑制剂浓度梯度试验探究沙棘提取物对脲酶活性的抑制作用效力。
将沙棘水提物与HPU混合,设置沙棘水提物的体系质量浓度为5 mg/mL,组间孵育时间分别为5、10、20、40 min,测定各组HPU活性。试验重复3次。
将沙棘水提物与HPU混合,设置各组间沙棘水提物体系质量浓度分别为0、2.5、5、7.5、10 mg/mL,孵育20 min后测定各组HPU活性。试验重复3次。
1.4.3 HPU脲酶动力学研究试验
沙棘水提物的系列质量浓度梯度为0、1、2、3 mg/mL,共4个组。每个浓度组8个试管,每组的8个试管中含不同浓度的尿素溶液(0.5、1、2、4、6、10、16、20 mmol/L)。根据分组,分别加入不同浓度的抑制剂和尿素溶液,再加入HPU溶液,混匀,置于37 ℃水浴20 min后分别测定其脲酶活性,试验重复3次。
根据Lineweaver-Burk plot双倒数法作图求得动力学参数Vmax及米氏常数Km,确定沙棘水提物对HPU的抑制作用类型。
1.4.4 沙棘水提物对HPU脲酶抑制位点影响研究
利用两类保护剂,一类为含巯基化合物二硫苏糖醇(dithiothreitol,DTT);第二类为脲酶无机保护剂硼酸(boric acid,BA)。两类保护剂分别针对HPU活性位点附近的巯基和活性中心的Ni2+。
采用硫醇化合物进行保护,将HPU分别与10 mmol/L DTT于37 ℃预反应20 min,然后将被保护的每个脲酶样品与4 mg/mL沙棘水提物反应20 min,测定脲酶活性。试验重复3次。
采用无机化合物(BA)进行保护,将HPU与5 mmol/L BA于37 ℃预反应20 min,再向反应体系加入4 mg/mL沙棘水提物反应20 min,测定脲酶活性。试验重复3次。
1.4.5 沙棘水提物对HPU毒力基因的影响
设置沙棘水提物高剂量组(5 mg/mL)、中剂量组(1 mg/mL)、低剂量组(0.2 mg/mL)和空白对照组。
细菌总RNA的提取与检测:将沙棘水提物与H.pylori菌液共同孵育12 h,离心收集菌体(4 000 r/min,10 min),参照Aidlab细菌总RNA提取试剂盒说明书提取细菌RNA,检测其纯度及浓度,再通过琼脂糖凝胶电泳检测提取RNA的完整性,电泳条件:电压150 V,时间15 min。凝胶成像仪检测电泳结果。
反转录反应:所提取RNA的A260/A280达到纯度要求1.8~2.0后,按TAKARA反转录试剂盒说明进行反转录实验。
引物设计:依据H.pylori 26695标准株脲酶蛋白α亚基(urease subunit α,Ure-α),脲酶蛋白β亚基(urease subunit β,Ure-β),脲酶辅助蛋白E(urease accessory protein E,Ure-E),脲酶辅助蛋白H(urease accessory protein H,Ure-H)相应基因的CDS区序列,所得序列见表1,委托生工生物工程股份有限公司设计合成引物。
表1 HPU毒力基因引物序列
Table 1 Primer sequence of virulence gene of urease of Helicobacter pylori

基因名称引物序列(5′-3′)产物大小/bp16S-FCGATGGATGCTAGTTGTTGGAG11616S-RGTCCCCGTCTATTCCTTTGAGTTUre α-FGCGGGACAGCGGTAAGGTTTG114Ure α-RTGTCTGCTTGCCTATCAACCAACGUre β-FCGGTTGCGTGGAAGACACTATGG136Ure β-RAGTGGAAGCGGGAAGAATGTTGTGUre E-FTCAGCGTGGATCATGTGGATTTGG107Ure E-RGGGAGCGTCTTTAAGGCGTATGGUre H-FCGCACACGGCTATTAGAGAAGACG133Ure H-RTCTGGGTTGAATGTCGCTGAAAGG
实时荧光定量PCR:实时荧光定量PCR扩增程序按试剂盒说明进行操作,于Bio-Rad Real-Time PCR仪上扩增。扩增条件:94 ℃预变性30 s,94 ℃变性5 s,72 ℃延伸30 s,40个循环。
以16S为内参,以空白组表达量为参照,计算各组目的基因的相对表达量,用2-ΔΔCt表示,ΔCtxx组=Ctxx组目的基因-Ctxx组内参基因,ΔΔCtxx组=ΔCtxx组-ΔCt空白组,所得值即为各组目的基因mRNA水平的相对表达量。
1.5 数据处理
采用Excel 2016和SPSS 20软件进行数据处理,统计结果用“平均值±标准差![]() 表示。
表示。
2 结果与分析
2.1 不同浓度沙棘水提物对菌液脲酶活性影响
不同浓度沙棘水提物对菌液脲酶活性影响试验结果如图1所示。随着沙棘水提物浓度的增加,反应体系中的脲酶残留活性减小,当沙棘水提物的体系质量浓度为5 mg/mL时,菌液的脲酶残留活性为7.5%,表明沙棘水提物对H.pylori菌液脲酶活性的抑制作用与提取物浓度呈相关性。
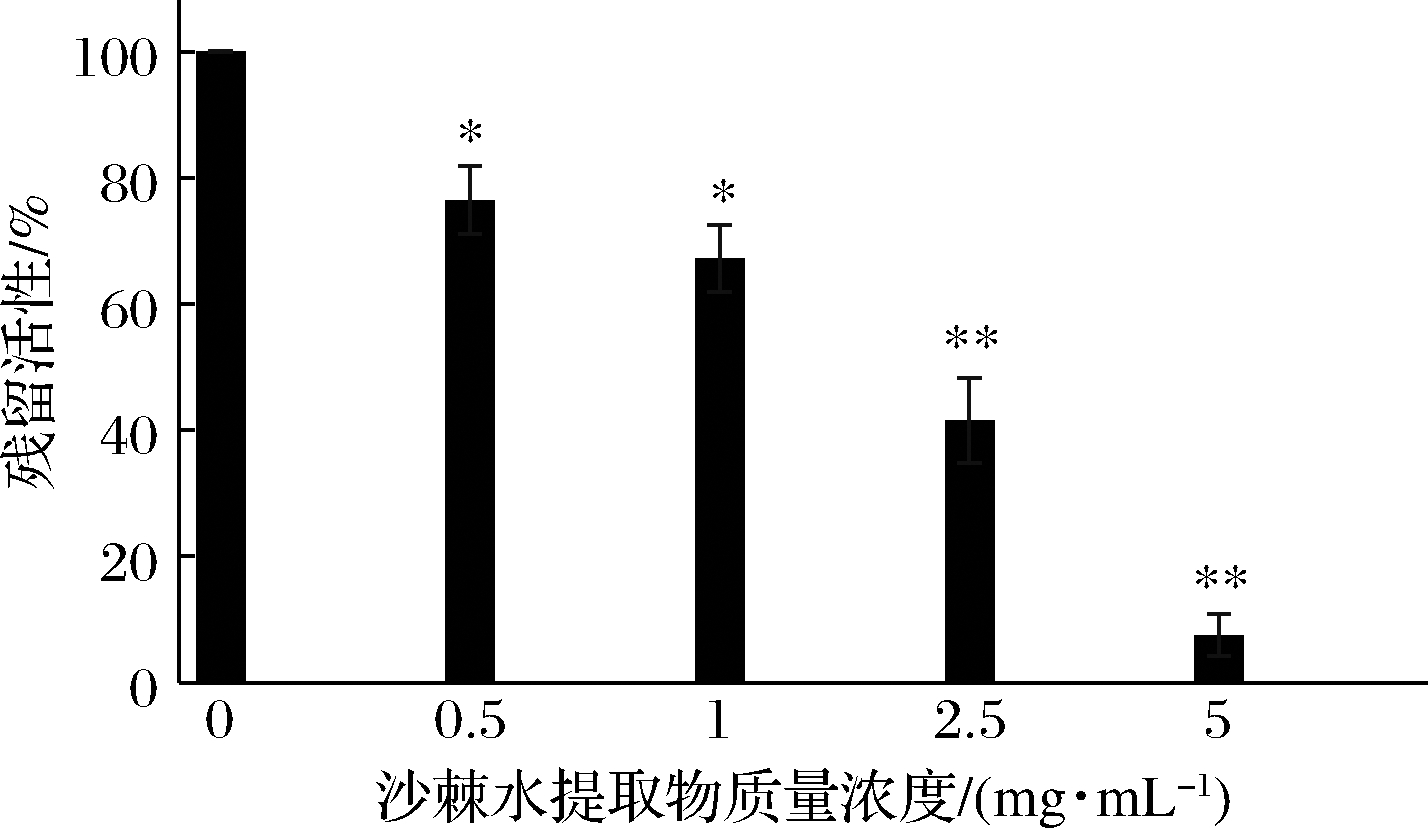
图1 不同浓度沙棘水提物对菌液HPU活性的影响
Fig.1 Effect of concentration of H.rhamnoides water extracts on HPU activities in bacterial solution
注:与未加入沙棘水提物的空白组比较,*表示P<0.05,差异显著; **表示P<0.01,差异极显著(下同)
2.2 沙棘提取物对HPU的抑制作用
沙棘提取物及其他处理对HPU的抑制作用如图2所示。在排除溶剂、反应体系酸碱度对酶活性的影响后,结果表明沙棘水提物及乙醇提取物对HPU活性具有明显抑制作用(P<0.01)。5 mg/mL的沙棘水提物和体积分数80%乙醇提取物作用20 min后,HPU活性分别降至9.6%、6.7%。
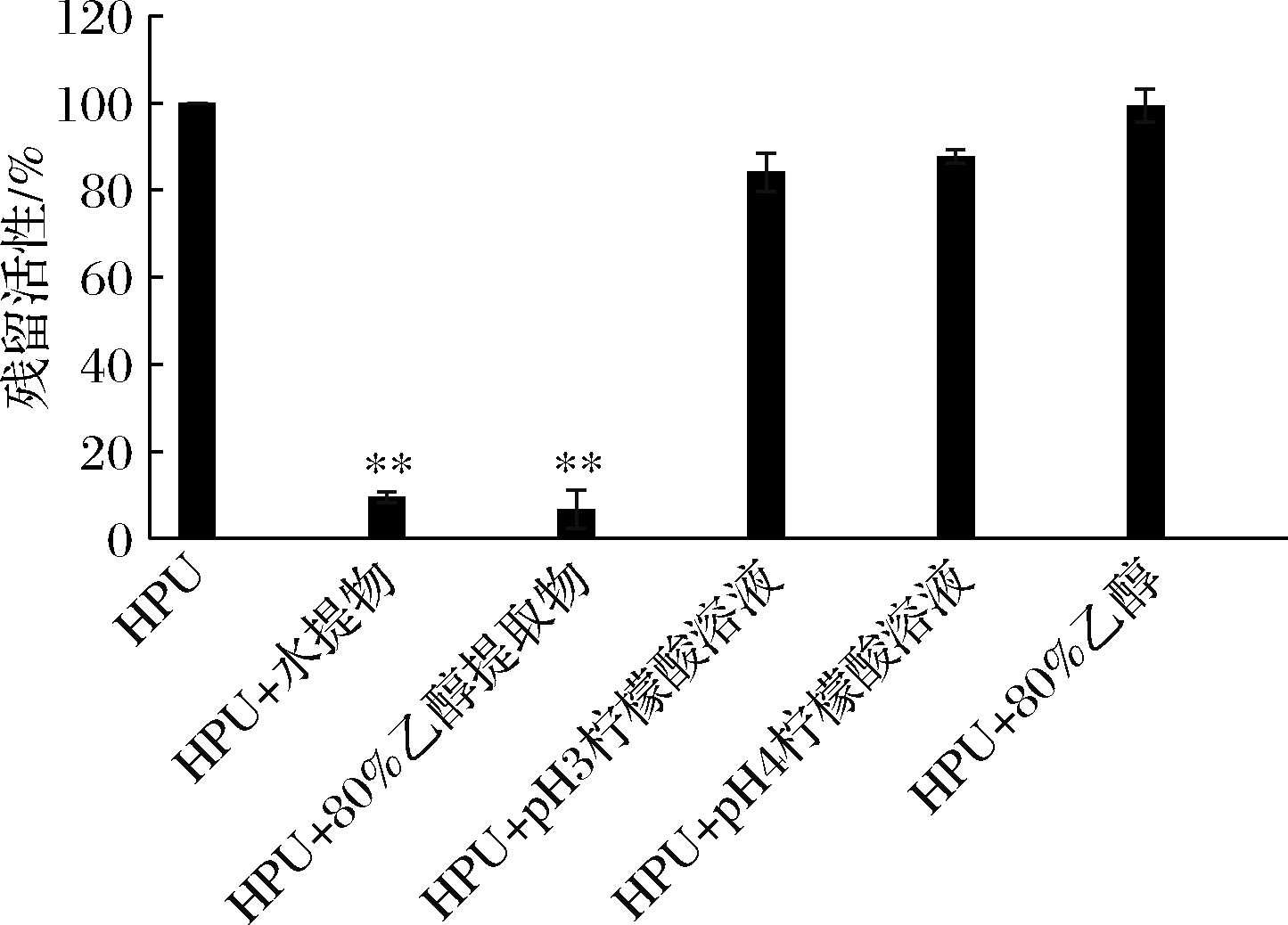
图2 沙棘提取物以及溶剂、体系环境对HPU活性影响
Fig.2 Effect of H.rhamnoides extracts,solvent and system environment on the activities of HPU
2.3 沙棘水提物的IC50值测定结果
沙棘水提物抑制H.pylori的IC50值测定结果见图3。
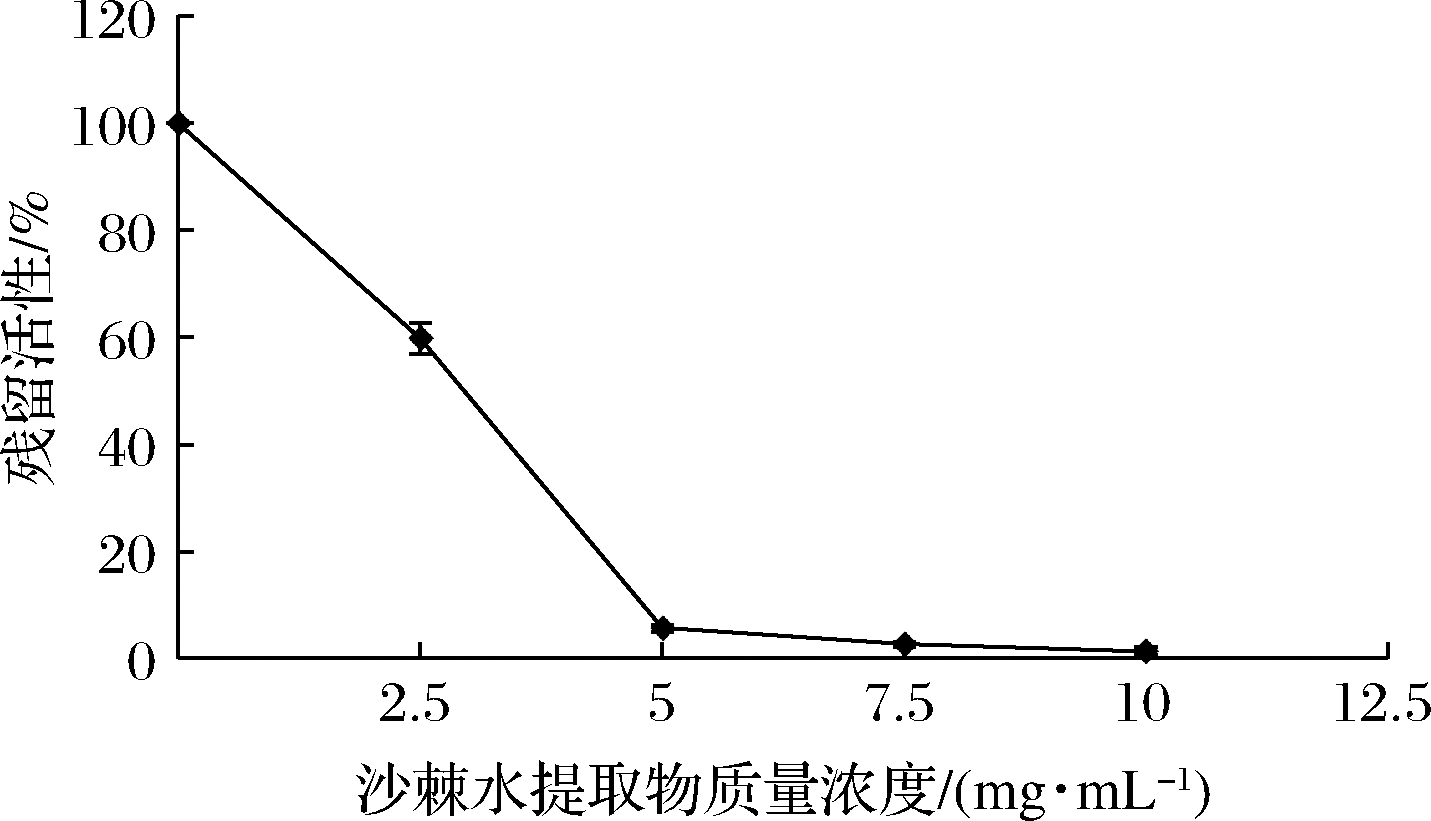
图3 不同浓度沙棘水提物对HPU活性影响
Fig.3 Effect of concentration of H.rhamnoides water extracts on HPU activities
沙棘水提物对HPU的抑制作用与提取物浓度正相关,当提取物质量浓度>5 mg/mL时,HPU残留活性<5%,抑制效果明显,其IC50值为(2.73±0.10)mg/mL。
2.4 孵育时间对HPU活性的影响
沙棘水提物与HPU共同孵育时间对HPU活性的影响试验结果见图4。随着孵育时间的延长,HPU活性逐渐减小,5 mg/mL沙棘水提物与HPU溶液孵育5、10、20、40 min后,HPU活性分别降至9.3%、6.3%、5.7%、3.8%,表明沙棘水提物对HPU的抑制效果呈时间依赖性。
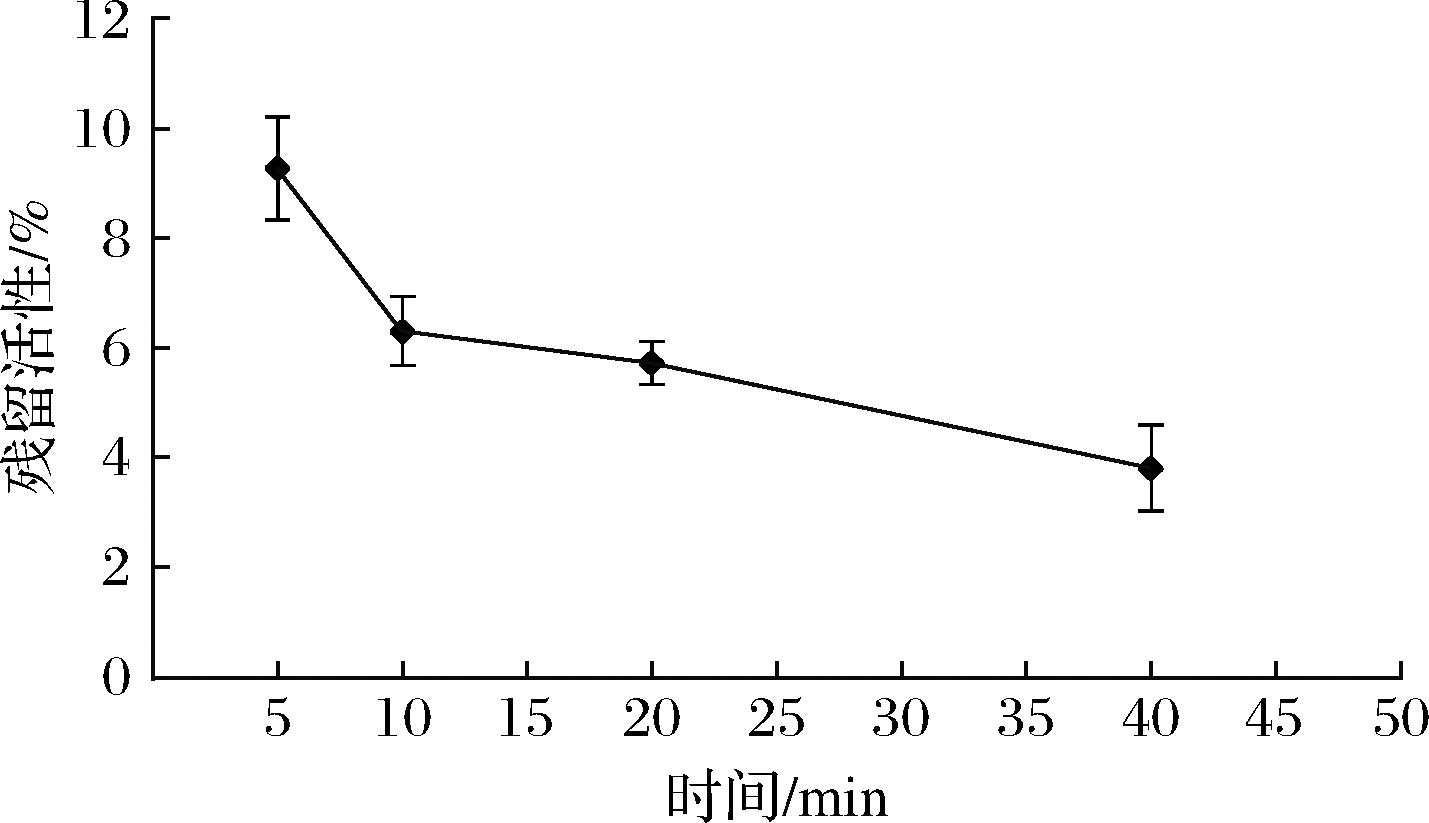
图4 孵育时间对HPU活性影响
Fig.4 Effect of incubation time on HPU activities
2.5 HPU活性动力学方程
HPU的Km和Vmax的测定及Lineweaver-Burk曲线如图5所示。在Lineweaver-Burk图中,在沙棘水提物存在下,随着沙棘水提物浓度的升高,Vmax降低,而Km值并无明显变化。由Lineweaver-Burk图分析可知,沙棘水提物对HPU的抑制类型为可逆抑制中的非竞争性抑制,Vmax值为(0.42±0.02)mmol/(L·min),Km值为(1.26±0.10)mmol·L-1,试验结果表明抑制位点位于HPU活性中心以外的其他位点。

图5 沙棘水提物抑制HPU的L-B双倒数作图法
Fig.5 Double-reciprocal Lineweaver-Burk plot of HPU inhibition by H.rhamnoides water extract
有研究表明多酚类物质为非底物类似物的脲酶抑制剂,可通过与HPU活性中心外的必需基团相结合最终形成三元复合物,因不能生成产物以使HPU活性受到抑制。沙棘中富含多酚类物质,因此本试验结果表明沙棘水提物中的抑菌成分之一可能是多酚类物质。此外,余晓丹[6]发现黄芩苷与野黄芩苷对HPU的抑制类型也为非竞争性抑制;PAULO等[21]研究了白藜芦醇对HPU的抑制作用,酶动力学结果同为非竞争性抑制。
2.6 HPU活性保护剂试验结果
不同位点保护剂对HPU活性的保护结果,以及保护剂本身对脲酶活性的影响试验结果见图6。DTT对HPU活性无明显影响,BA对脲酶活性有明显抑制作用(P<0.05)。巯基保护剂DTT并未降低沙棘水提物对HPU活性的抑制作用,而与沙棘水提物有明显的协同抑制作用(P<0.05);在金属离子保护剂BA与沙棘水提物共存时对HPU活性有明显的抑制作用(P<0.01)。在抑制位点的试验中,本试验选择了针对活性位点的Ni2+以及活性位点附近必需基团巯基的相应保护剂,巯基试剂的作用机理是巯基试剂与脲酶活性位点附近的巯基相互作用,而无机保护剂BA则通过与Ni2+配位作用阻止抑制剂与HPU的活性位点结合。
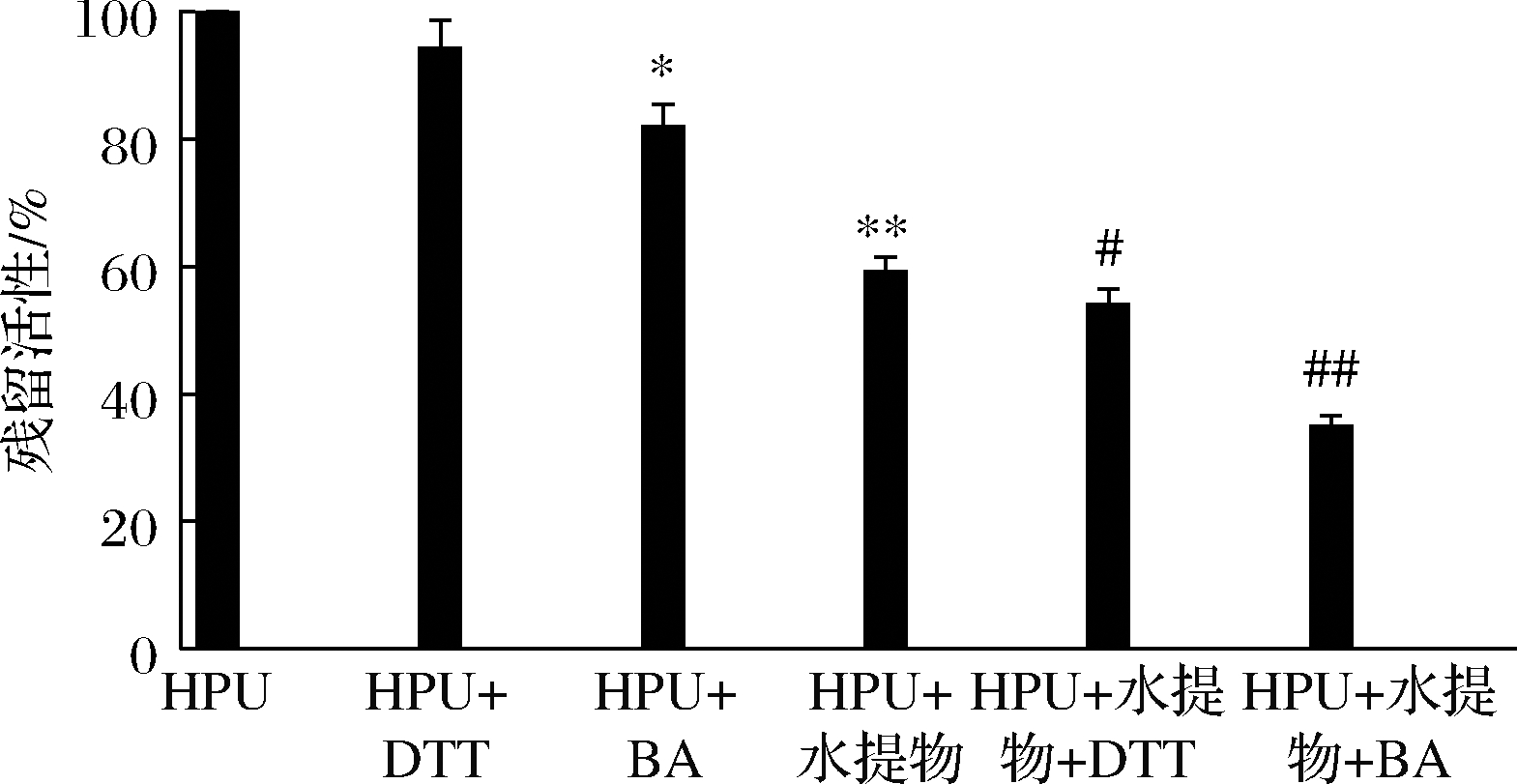
图6 硫醇化合物与无机化合物对于被沙棘水提物 抑制HPU活性的影响
Fig.6 Effect of thiol-containing compounds and inorganic compounds on the inhibition of HPU activity by H.rhamnoides water extract
注:与未加入保护剂和沙棘提取物的空白组HPU活性比较,*表示P<0.05,差异显著;**表示P<0.01,差异极显著;与加入沙棘提取物的试验组比较,#表示P<0.05,差异显著;##表示P<0.01,差异极显著
针对巯基所选用的保护剂DTT并未有任何保护HPU活性的作用,这点同以往其他研究不同,余晓丹[6]研究表明DTT可激活被黄芩苷与野黄芩苷灭活的HPU;LU等[22]试验结果表明两面针可以较好地抑制HPU,且DTT也能有效缓解其抑制作用;谈丽华[23]发现DTT对于被黄连碱灭活的HPU有较好的激活作用,这种作用与黄连碱、HPU和DTT的孵育顺序有关。试验过程中,考虑到沙棘提取物可能使反应体系的pH不利于DTT发挥其作用,故反应于pH 7.5的羟乙基哌嗪乙硫磺酸(2-[4-(2-hydroxyethyl)-1-piperazinyl]ethanesulfonic acid,HEPES)缓冲液中进行。DTT未起到保护作用表明沙棘水提物抑制HPU的位点可能不是巯基基团,这一结果也可能与HPU是粗提液有关。对于活性中心的Ni2+保护剂BA的试验结果显示,BA可与沙棘提取物协同抑制HPU的活性,与近些年来同类型研究结果一致。
2.7 沙棘水提物对HPU毒力基因表达的影响
各组HPU毒力基因mRNA的相对表达量见表2。与对照组相比,5 mg/mL沙棘水提物可使ure-α、ure-β、ure-E和ure-H基因表达出现明显下降(P<0.05)。结果表明,质量浓度为5 mg/mL的沙棘水提物可抑制HPU活性,可能是通过降低脲酶结构基因ure-α和ure-β的表达,抑制脲酶辅酶基因ure-E和ure-H。该结果与连大卫等[9]研究广藿香醇抑制HPU相关基因表达结果一致。
表2 沙棘水提物对HPU毒力基因mRNA相对表达量的影响
Table 2 Effect of H.rhamnoides water extracts on mRNA relative expression level of HPU virulence gene
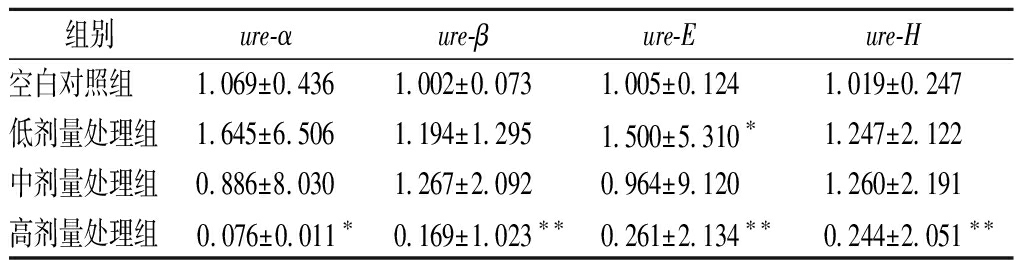
组别ure-αure-βure-Eure-H空白对照组1.069±0.4361.002±0.0731.005±0.1241.019±0.247低剂量处理组1.645±6.5061.194±1.2951.500±5.310∗1.247±2.122中剂量处理组0.886±8.0301.267±2.0920.964±9.1201.260±2.191高剂量处理组0.076±0.011∗0.169±1.023∗∗0.261±2.134∗∗0.244±2.051∗∗
注:与空白对照组目的基因相对表达量比较,*表示P<0.05,差异显著;**表示P<0.01,差异极显著
3 结论
沙棘提取物可明显抑制HPU活性,是良好的脲酶抑制剂,其抑制类型为非竞争性抑制;抑制位点并非HPU活性中心的Ni2+或活性中心附近的巯基。沙棘提取物抑制脲酶活性可降低脲酶相关基因ure-α、ure-β、ure-E和ure-H的表达。沙棘提取物对H.pylori在胃内感染定植的影响可能与其抑制脲酶活性有一定的关系,其抑菌功效可能是多酚及多糖等物质共同作用的结果,需要进一步研究。
[1] ZAMANI M,EBRAHIMTABAR F,ZAMANI V,et al.Systematic review with meta-analysis:The worldwide prevalence of Helicobacter pylori infection[J].Alimentary Pharmacology Therapeutics,2018,47(7):868-876.
[2] 王佳静,邵洲杰,叶鸿雁.幽门螺杆菌传播和定植机制研究进展[J].检验医学,2020,35(3):282-286.
WANG J J,SHAO Z J,YE H Y.Research progress of the mechanism of Helicobacter pylori transmission and colonization[J].Laboratory Medicine,2020,35(3):282-286.
[3] 周汀,刘斌,李善高.幽门螺杆菌感染治疗的研究进展[J].国际消化病杂志,2021,41(2):96-99.
ZHOU T,LIU B,LI S G.Research progress in treatment of Helicobacter pylori infection[J].International Journal of Digestive Diseases,2021,41(2):96-99.
[4] ZHOU J T,LI C L,TAN L H,et al.Inhibition of Helicobacter pylori and its associated urease by palmatine:Investigation on the potential mechanism[J].PLoS One,2017,12(1):e0168944.
[5] 许艺飞.广藿香醇抗幽门螺杆菌作用及其机制研究[D].广州:广州中医药大学,2016.
XU Y F.Anti-Helicobacter pylori effect and mechanism of patchouli alcohol[D].Guangzhou:Guangzhou University of Chinese Medicine,2016.
[6] 余晓丹.黄芩苷与野黄芩苷抑制幽门螺杆菌脲酶作用及其机理研究[D].广州:广州中医药大学,2015.
YU X D.Biological evaluation and molecular docking of baicalin and scutellarin as Helicobacter pylori urease inhibitors[D].Guangzhou:Guangzhou University of Chinese Medicine,2015.
[7] COVACCI A,TELFORD J L,GIUDICE G D,et al.Helicobacter pylori virulence and genetic geography[J].Science,1999,284(5418):1 328-1 333.
[8] CARLINI C R,POLACCO J C.Toxic properties of urease[J].Crop Science,2008,48(5):1 665-1 672.
[9] 连大卫,许艺飞,任文康,等.广藿香醇抑制幽门螺杆菌脲酶活性及其机制[J].中国中药杂志,2017,42(3):562-566.
LIAN D W,XU Y F,REN W K,et al.Mechanism of anti-Helicobacter pylori urease activity of patchouli alcohol[J].China Journal of Chinese Materia Medica,2017,42(3):562-566.
[10] FOLLMER C.Ureases as a target for the treatment of gastric and urinary infections[J].Journal of Clinical Pathology,2010,63(5):424-430.
[11] FIORI-DUARTE A T,RODRIGUES R P,KITAGAWA R R,et al.Insights into the design of inhibitors of the urease enzyme-A major target for the treatment of Helicobacter pylori infections[J].Current Medicinal Chemistry,2020,27(23):3 967-3 982.
[12] 姚娜娜,车凤斌,李永海,等.沙棘的营养价值及综合开发利用概述[J].保鲜与加工,2020,20(2):226-232.
YAO N N,CHE F B,LI Y H,et al.Nutritional value and comprehensive development and utilization of Hipopophae rhamnoides[J].Storage and Process,2020,20(2):226-232.
[13] 常应九,高庆超,曹效海,等.沙棘活性成分及其对胃肠微生物影响的研究进展[J].包装工程,2019,40(21):15-22.
CHANG Y J,GAO Q C,CAO X H,et al.Advances in research on active ingredients of Hippophae rhamnoides Linn.and their effects on gastrointestinal microorganisms[J].Packaging Engineering,2019,40(21):15-22.
[14] 焦岩,常影,余世锋,等.大果沙棘总黄酮体外抗氧化和抑菌作用研究[J].食品研究与开发,2015,36(19):12-15.
JIAO Y,CHANG Y,YU S F,et al.Study on the antioxidant and antibacterial activities in vitro of seabuckthorn flavonoids[J].Food Research and Development,2015,36(19):12-15.
[15] CRISTE A,URCAN A C,BUNEA A,et al.Phytochemical composition and biological activity of berries and leaves from four Romanian sea buckthorn (Hippophae rhamnoides L.) varieties[J].Molecules,2020,25(5):1170.
[16] 扎格乐,边鑫,赵莉,等.沙棘籽提取物抑菌能力的研究及其生物活性成分分析[J].中国酿造,2016,35(8):110-114.
BAYARAA Z,BIAN X,ZHAO L,et al.Research on the antimicrobial activity of the sea-buckthorn seed extract and analysis of its bioactive components[J].China Brewing,2016,35(8):110-114.
[17] 陈彤,王常青,连伟帅,等.沙棘籽渣酶解产物的体内外抑菌作用[J].食品科学,2015,36(11):91-94.
CHEN T,WANG C Q,LIAN W S,et al.Antibacterial activity in vivo and in vitro of enzymatic hydrolysates of sea buckthorn seed residue[J].Food Science,2015,36(11):91-94.
[18] 黄国栋,杨治芳,游宇,等.沙棘原花青素治疗慢性胃炎的机理及与细胞凋亡的相关性研究[J].重庆医科大学学报,2008(8):970-972;1 002.
HUANG G D,YANG Z F,YOU Y,et al.Observe the possible mechanisms of sea buckthorn procyanidins (SBPC) treat gastritis and study the relationship with apoptosis[J].Journal of Chongqing Medical University,2008(8):970-972;1 002.
[19] XIAO Z P,PENG Z Y,DONG J J,et al.Synthesis,structure-activity relationship analysis and kinetics study of reductive derivatives of flavonoids as Helicobacter pylori urease inhibitors[J].European Journal of Medicinal Chemistry,2013,63:685-695.
[20] WU D W,YU X D,XIE J H,et al.Inactivation of jack bean urease by scutellarin:Elucidation of inhibitory efficacy,kinetics and mechanism[J].Fitoterapia,2013,91:60-67.
[21] PAULO L,OLEASTRO M,GALLARDO E,et al.Anti-Helicobacter pylori and urease inhibitory activities of resveratrol and red wine[J].Food Research International,2011,44(4):964-969.
[22] LU Q,LI C L,WU G S.Insight into the inhibitory effects of Zanthoxylum nitidum against Helicobacter pylori urease and jack bean urease:Kinetics and mechanism[J].Journal of Ethnopharmacology,2020,249:112419.
[23] 谈丽华.黄连中黄连碱及表小檗碱抗幽门螺杆菌作用机制研究[D].广州:广州中医药大学,2019.
TAN L H.Coptisine and epiberberine,the characteristic constituents of Rhizoma coptidis,inhibit Helicobacter pylori:Susceptibility and mechanism[D].Guangzhou:Guangzhou University of Chinese Medicine,2019.