胶原蛋白是动物结缔组织中的重要成分,也是哺乳动物体内含量最高的蛋白质,约占动物体蛋白质总量的25%~30%[1-3]。因为胶原蛋白分子表面具有大量极性侧链基,所以胶原蛋白具有较强的吸水性,可结合10倍于自身质量的水,且不溶于水[4]。胶原蛋白可以降低甘油三酯和胆固醇,对自发性高血压有一定的缓解作用[5],同时增加脂肪的分解并延长其过程,具有减肥、降血压和降血脂的作用[6]。此外,胶原蛋白还可以作为乳化剂、稳定剂、发泡剂等改良肉类及其制品、乳制品、饮料的口感[7]。总之,胶原蛋白作为良好的生物资源广泛应用于食品工业中。
天然胶原蛋白来自畜禽源动物组织,具有一定的病毒隐患[8]。此外,天然胶原蛋白提取的方法还存在产量低等不足。利用基因工程可以获得安全、优质的重组蛋白,因此研究人员开始以基因工程技术,利用不同宿主细胞生产胶原蛋白,如转基因动物[9-10]、转基因烟草[11]、大肠杆菌[12]、酵母[13]等。20世纪90年代,日本广岛大学的吉里胜利教授将人胶原蛋白的基因植入蚕细胞,获得人胶原蛋白[10]。培养动、植物细胞的难度大、成本高,而利用重组微生物发酵生产胶原蛋白的技术相对简单,成为热门研究。范代娣等[14]将人胶原蛋白基因片段转化至大肠杆菌,并通过高密度发酵培养生产人胶原蛋白。大肠杆菌表达系统以包涵体形式表达外源蛋白,致使产物纯化困难;同时大肠杆菌表达系统的蛋白质翻译后加工修饰体系不完善,重组胶原蛋白的生物活性较低。因此酵母等真核微生物表达胶原蛋白就更加受重视。
毕赤酵母是一种著名的甲基营养型蛋白质表达系统。它具有基因操作成熟,高密度发酵,可以对目的蛋白进行类人的糖基化、二硫键形成等后修饰[15]。毕赤酵母的分泌表达模式也有利于重组蛋白的纯化[16-17]。本研究利用已构建的表达类人胶原蛋白的重组毕赤酵母菌株,进行发酵优化以显著提高类人胶原蛋白的表达量,为重组胶原蛋白在食品工业中的应用奠定基础。
1 材料与方法
1.1 菌株和试剂
重组毕赤酵母GS115-Collagen由本实验室构建并保藏;酵母粉、蛋白胨、葡萄糖、蛋白marker等试剂,生工生物工程(上海)股份有限公司;YNB,上海源叶生物科技有限公司;其余试剂购自国药集团化学试剂有限公司。
YPD培养基:1 g酵母粉、2 g蛋白胨、2 g葡萄糖,定容至100 mL,115 ℃灭菌20 min。
BSM培养基:10 mL 100 mmol/L磷酸盐缓冲液、1.26 g甘油、1.63 g(NH4)2SO4、1.49 g MgSO4·7H2O、0.093 g CaSO4·2H2O,定容至100 mL,121 ℃灭菌15 min,加入0.44 mL PTM1。
PTM1:6 g CuSO4·5H2O、0.088 g KI、3 g MnSO4·H2O、0.2 g Na2MoO4·2H2O、0.02 g H3BO3、0.5 g CoCl2·6H2O、20 g ZnCl2、65 g FeSO4·7H2O、0.2 g 生物素、浓H2SO4 5 mL,定容至1 L,过滤除菌。
1.2 重组酵母的培养方法
1.2.1 重组毕赤酵母培养方法
取适量甘油保菌管的菌液于YPD培养基中30 ℃培养24 h,再划线到YPD平板培养基(含有20 g/L琼脂)30 ℃培养48 h。挑取单菌落至100 mL YPD液体培养基至OD600为2~8,然后,接种到BSM培养基中进行发酵。具体培养过程:以4%接种量到BSM培养基在30 ℃条件下培养48 h后,每24 h补加体积分数为1.5%的甲醇。培养基优化的条件采用BSM+10 g/L酵母粉、BSM+20 g/L蛋白胨、BSM+13.4 g/L YNB、BSM+0.02%生物素(体积分数)4种培养基进行培养。
1.2.2 甲醇添加量的优化
在30 ℃,pH为6.0的条件下,每24 h补加体积分数为1%、1.5%、2%、2.5%、3%甲醇。
1.2.3 抑制胶原蛋白水解
为了避免胶原蛋白的水解,分别将BSM培养基(除甘油外)中无机盐浓度减少至原来的1/4、1/3、1/2、3/4,再加20 g/L的蛋白胨进行培养,每24 h补加体积分数为1.5%的甲醇。
1.2.4 添加酪蛋白水解物
分别添加5、10、15、20 g/L酪蛋白水解物到培养基中培养重组毕赤酵母,每24 h补加体积分数为1.5%的甲醇。
1.2.5 添加辅助氮源
添加1 g/L尿素、甘氨酸、酪氨酸、L-脯氨酸、谷氨酸、L-羟脯氨酸到培养基中培养重组毕赤酵母,每24 h补加体积分数为1.5%的甲醇。
1.3 分析方法
细胞浓度采用在600 nm波长条件下测定吸光度值的方法。蛋白总量的测定采用Bradford法[18]。胶原蛋白含量的测定采用离心发酵液后取上清,进行三氯乙酸浓缩处理[19](浓缩25倍),对浓缩的胶原蛋白进行SDS-PAGE定性检测[20],分析胶原蛋白条带灰度后得出胶原蛋白分泌量。本研究所有实验均进行3次平行实验。
2 结果与分析
2.1 添加复合成分对重组毕赤酵母生长及分泌类人胶原蛋白的影响
前期研究表明,本重组毕赤酵母在BMGY培养基中可以分泌表达类人胶原蛋白,不能在BSM培养基中分泌表达类人胶原蛋白。向BSM中添加复合成分使重组毕赤酵母表达类人胶原蛋白的结果见图1。向BSM培养基中分别添加蛋白胨、酵母粉、YNB等复合成分后重组毕赤酵母的细胞浓度明显高于添加生物素的细胞浓度,但是分别添加蛋白胨、酵母粉、YNB条件下的毕赤酵母细胞浓度之间差别不显著(图1-a)。对重组毕赤酵母发酵上清液进行十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)可知,添加20 g/L蛋白胨使重组毕赤酵母明显表达类人胶原蛋白(图1-b)。所以下述实验的重组毕赤酵母培养实验基于BSM+20 g/L蛋白胨展开。

M-标准蛋白质分子质量;1~3:BSM+10 g/L酵母粉; 4~6:BSM+20 g/L蛋白胨;7~8:BSM+YNB;9~10:BSM+生物素 a-细胞浓度;b-诱导120 h时发酵上清液的SDS-PAGE电泳图
图1 添加复合成分对重组毕赤酵母生长和类人 胶原蛋白表达的影响
Fig.1 Effects of complex constituents addition on recombinant K.phaffii growth and collagen expression
2.2 甲醇添加量对重组毕赤酵母生长及表达类人胶原蛋白的影响
每24 h补加体积分数为1%、1.5%、2%、2.5%、3%的甲醇诱导胶原蛋白表达。当补加体积分数为1.5%甲醇时,重组毕赤酵母的细胞浓度最佳(图2-a),类人胶原蛋白的分泌量也有最佳值,为18.87 mg/L(图2-b)。SDS-PAGE表明,每24 h补加体积分数为2%甲醇时,类人胶原蛋白出现明显降解。每24 h添加体积分数为3%甲醇时,电泳图中类人胶原蛋白的条带不明显(图2-c)。因此,高浓度的甲醇添加量不利于重组毕赤酵母分泌表达类人胶原蛋白。
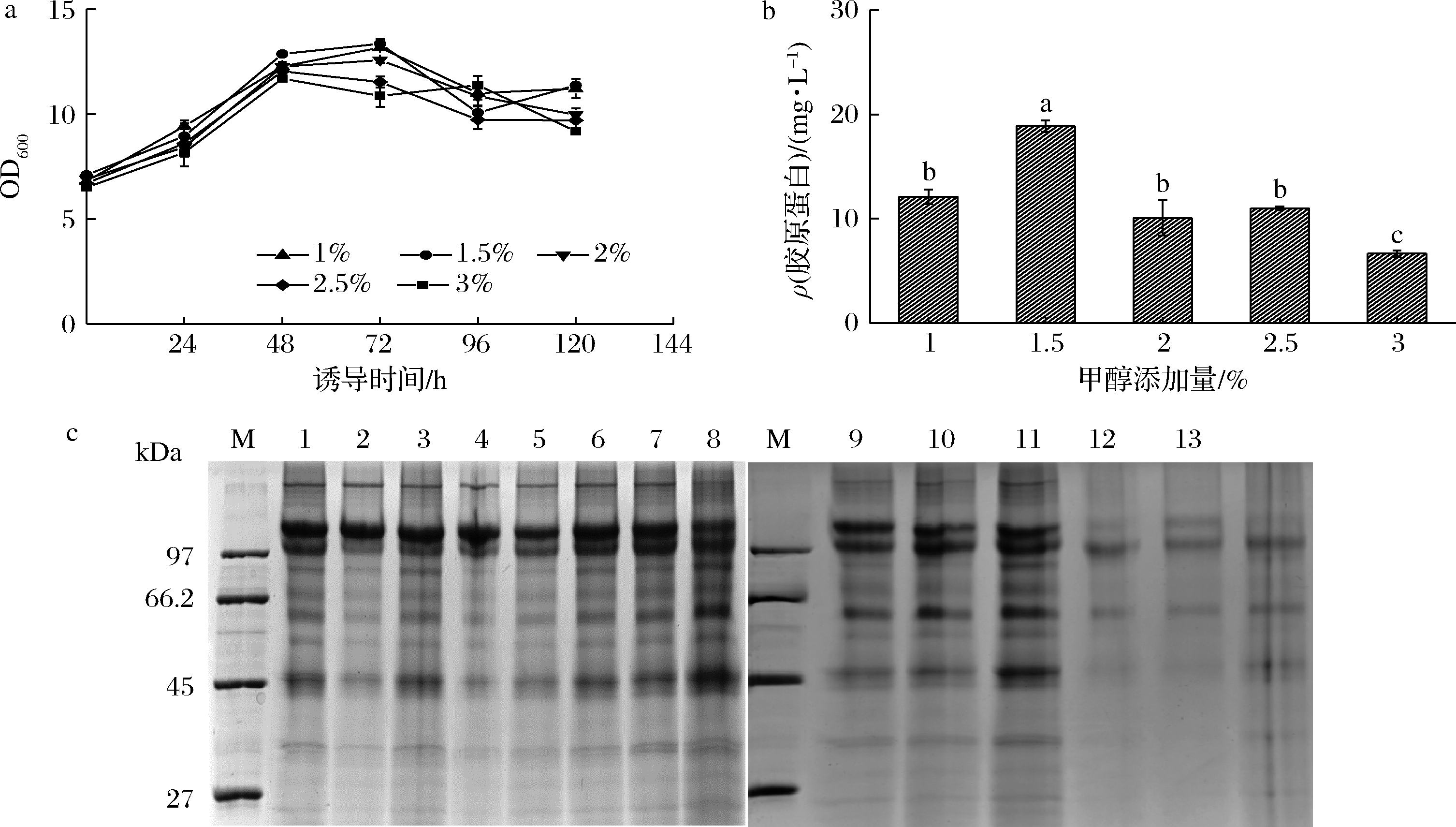
M-标准蛋白质分子量;1~3-1%甲醇诱导;4~6-1.5%甲醇诱导;7~8-2%甲醇诱导;9~11-2.5%甲醇诱导;12~14-3%甲醇诱导。 a-细胞浓度;b-诱导120 h的类人胶原蛋白分泌量;c-诱导120 h时发酵上清液的SDS-PAGE电泳图
图2 甲醇添加量对重组毕赤酵母生长和类人胶原蛋白表达的影响
Fig.2 Effects of methanol addition on recombinant K.phaffii growth and collagen expression
2.3 避免类人胶原蛋白的降解
为避免分泌后的类人胶原蛋白在发酵液中被水解,本研究通过减少BSM培养基中无机盐含量,研究其对重组毕赤酵母生长和分泌类人胶原蛋白的影响。图3-a表明重组毕赤酵母的细胞浓度随着无机盐浓度的减少而降低。但是诱导120 h,重组毕赤酵母在不同稀释程度的BSM(终浓度20 g/L蛋白胨)的细胞浓度差别不显著(图3-a)。诱导96 h后,类人胶原蛋白的分泌量在1/4 BSM培养基中最高。诱导120 h时,类人胶原蛋白在1/4 BSM培养基出现显著降解,在1/3 BSM发酵液中类人胶原蛋白量为18.49 mg/L,降解不显著(图3-b,3-c)。

M-标准蛋白质分子量;1~3-1/4BSM;4~6-1/3BSM;7~8-1/2BSM;9~10-3/4BSM a-细胞浓度;b-诱导96 h的类人胶原蛋白分泌量;c-诱导120 h的类人胶原蛋白分泌量;d-诱导96 h时发酵上清液的 SDS-PAGE电泳图;e-诱导120 h时发酵上清液的SDS-PAGE电泳图
图3 稀释BSM培养基对重组酵母生长和类人胶原蛋白表达的影响
Fig.3 Effects of BSM dilution on recombinant K.phaffii growth and collagen expression
图3-d、3-e为诱导96、120 h时发酵液上清液的SDS-PAGE图。类人胶原蛋白表达量在稀释BSM后杂蛋白显著减少。这说明稀释BSM培养基有利于类人胶原蛋白的表达及其纯化。综合以上考虑,后续研究以1/3 BSM+20 g/L蛋白胨为培养基继续研究。
2.4 添加酪蛋白水解物对重组毕赤酵母生长及表达类人胶原蛋白的影响
添加酪蛋白水解物促进重组毕赤酵母生长,诱导120 h后细胞浓度达到15.22(OD600),比基础培养基增加了约19.70%(图4-a)。诱导96 h时,添加质量浓度为20 g/L酪蛋白水解物时类人胶原蛋白的分泌量达35.85 mg/L,增加了约90%(图4-b)。诱导120 h时类人胶原蛋白的量仍出现下降(图4-c,4-d),说明仍有类人胶原蛋白降解的现象。这可能由于高浓度酪蛋白水解物不利于类人胶原蛋白在细胞器(例如高尔基体)中正确折叠。

M-标准蛋白分子量;1~2-5 g/L酪蛋白;3~4-10 g/L酪蛋白;5~6-15 g/L酪蛋白;7~8-2 g/L酪蛋白;9-5 g/L酪蛋白; 10-10 g/L酪蛋白;11-15 g/L酪蛋白;12-20 g/L酪蛋白 a-酪蛋白对重组毕赤酵母生长的影响;b-诱导96 h的类人胶原蛋白;c-诱导120 h的类人胶原蛋白; d-诱导120 h时发酵上清液的SDS-PAGE电泳图
图4 添加酪蛋白对重组毕赤酵母生长和类人胶原蛋白表达的影响
Fig.4 Effects of casein addition on recombinant K.phaffii growth and collagen expression
2.5 添加氮源对重组毕赤酵母生长及表达类人胶原蛋白的影响
氮源是生物体合成蛋白质的重要原料。在1/3 BSM+20 g/L蛋白胨培养基中添加6种氮源后的结果见图5。分别添加甘氨酸、L-脯氨酸和谷氨酸将细胞浓度提高了10%~15%(图5-a)。氮源的添加也可以提高重组毕赤酵母分泌蛋白总量。其中甘氨酸、尿素、L-脯氨酸的添加将蛋白总量提高了52.8%(部分数据列于表1)。
表1 不同氮源种类对蛋白总量和类人胶原蛋白表达量的影响
Table 1 Effects of nitrogen sources on protein and collagen expression
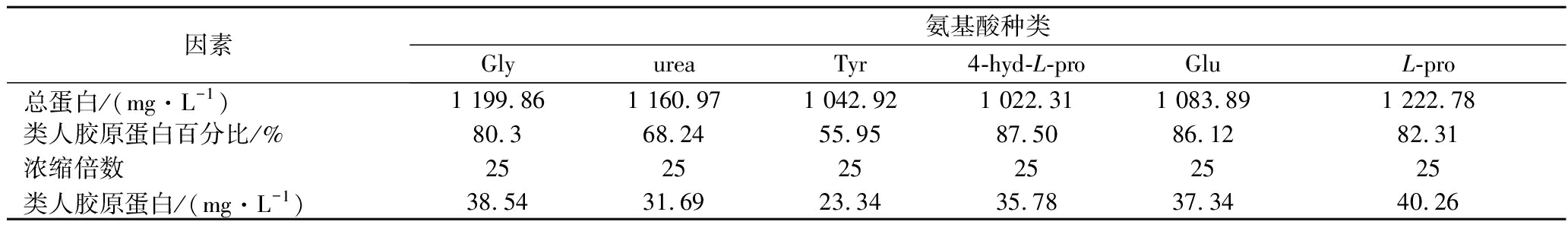
因素氨基酸种类GlyureaTyr4-hyd-L-proGluL-pro总蛋白/(mg·L-1)1 199.861 160.971 042.921 022.311 083.891 222.78类人胶原蛋白百分比/%80.368.2455.9587.5086.1282.31浓缩倍数252525252525类人胶原蛋白/(mg·L-1)38.5431.6923.3435.7837.3440.26
氮源的添加显著提高类人胶原蛋白的表达量,同时显著地减少了杂蛋白的分泌量(图5-b、5-c)。其中L-脯氨酸使类人胶原蛋白的分泌量增加到40.26 mg/L(图5-b)。经诱导120 h后,添加L-脯氨酸的培养基中重组毕赤酵母分泌的类人胶原蛋白量最高,且无明显降解现象(图5-c)。

M-标准蛋白质分子质量;1~2-甘氨酸;3~5-尿素;6~8-酪氨酸;9~10-4-羟基-L脯氨酸;11~13-谷氨酸;14~16-L-脯氨酸 a-细胞浓度;b-诱导120 h的类人胶原蛋白;c-诱导120 h时发酵上清液的SDS-PAGE电泳图
图5 不同氮源对重组毕赤酵母生长和类人胶原蛋白表达的影响
Fig.5 Effects of nitrogen sources on recombinant K.phaffii growth and collagen expression
3 结论
本文从培养基成分、甲醇添加剂量及最佳营养物的添加量等方面优化了重组毕赤酵母分泌表达类人胶原蛋白表达条件。通过稀释BSM至1/3,添加20 g/L蛋白胨,添加1 g/L的L-脯氨酸为辅助氮源,以1.5%的甲醇作为诱导剂诱导,可将类人胶原蛋白的分泌量提高到40.26 mg/L,比优化前的分泌量提高2.13倍。本研究通过减少培养基中无机盐的含量抑制了类人胶原蛋白的水解,降低了生产成本。通过添加氮源等营养物质,提高类人胶原蛋白的表达量,其中L-脯氨酸的添加,显著提高了类人胶原蛋白的分泌量。综上所述,添加合适的氮源更有利于重组毕赤酵母菌株分泌类人胶原蛋白,同时还能减少杂蛋白的生成。本研究结果为胶原蛋白的应用提供了基础。
[1] CHEN D N,SMITH L R,KHANDEKAR G,et al.Distinct effects of different matrix proteoglycans on collagen fibrillogenesis and cell-mediated collagen reorganization[J].Scientific Reports,2020,10(1):1 906-1 911.
[2] 兰文婷,金若芸,刘耀文,等.草鱼鳞和草鱼皮胶原蛋白性质及自聚集行为对比研究[J].食品与发酵工业,2018,44(2):92-97.
LAN W T,JUN R Y,LIU Y W,et al.Comparative study on characteristicss and self-assembly behavior of collagen extracted from skins and scales of grass carp[J]. Food and Fermentation Industries,2018,44(2):92-97.
[3] 张强,黄鑫,符安卫,等.中华鳖裙边胶原蛋白的提取、鉴定及其理化性质[J].食品与发酵工业,2019,45(12):176-182.
ZHANG Q,HUANG X,FU A W,et al.Extraction and characterization of collagens in Chinesesturgeon calipash[J]. Food and Fermentation Industries,2019,45(12):176-182.
[4] 梁飞,左红梅.胶原蛋白肽的性质、应用及发展前景的研究[J].明胶科学与技术,2014,34(3):109-115.
LIANG F,ZUO H M.A review on the properties,applications and prospect of collagen peptide[J].The Science and Technology of Gelatin,2014,34(3):109-115.
[5] KANG C,YU X W,XU Y.A codon-optimized endoprotease Endo-Pro-Aspergillus niger:Over expression and high-density fermentation in Pichia pastoris[J].Journal of Molecular Catalysis.B:Enzymatic,2014,104:64-69.
[6] XI C X,LIU N,LIANG F,et al.Molecular assembly of recombinant chicken type II collagen in the yeast Pichia pastoris[J].Science China Life Sciences,2018,61(7):815-825.
[7] SILVA C I F,TELES H,MOERS A P H,et al.Secreted production of collagen-inspired gel-forming polymers with high thermal stability in Pichia pastoris[J].Biotechnology and Bioengineering,2011,108(11):2 517-2 525.
[8] KARAMI A,TEBYANIAN H,SOUFDOOST R S,et al.Extraction and characterization of collagen with cost-effective method from human placenta for biomedical applications[J].World Journal of Plastic Surgery,2019,8(3):352-358.
[9] STEIN H,WILENSKY M,TSAFRIR Y,et al.Production of bioactive,post-translationally modified,heterotrimeric,human recombinant type-I collagen in transgenic tobacco[J].Biomacromolecules,2009,10(9):2 640-2 645.
[10] TOMAN P D,PIEPER F,SAKAI N M,et al.Production of recombinant human type I procollagen homotrimer in the mammary gland of transgenic mice[J].Transgenic Research,1999,8(6):415-427.
[11] MERLE C,PERRET S,LACOUR T,et al.Hydroxylated human homotrimeric collagen I in Agrobacterium tumefaciens-mediated transient expression and in transgenic tobacco plant[J].FEBS Letters,2002,515(1-3):114-118.
[12] RUTSCHMANN C,BAUMANN S,CABALZAR J,et al.Recombinant expression of hydroxylated human collagen in Escherichia coli[J].Applied Microbiology and Biotechnology,2014,98(10):4 445-4 455.
[13] PAKKANEN O,PIRSKANEN A,MYLLYHARJU J.Selective expression of nonsecreted triple-helical and secreted single-chain recombinant collagen fragments in the yeast Pichia pastoris[J].Journal of Biotechnology,2006,123(2):248-256.
[14] 范代娣,段明瑞,米钰,等.重组E.coli工程菌高密度培养生产人源型胶原蛋白[J].化工学报,2002,53(7):752-754.
FAN D D,DUAN M R,MI Y,et al.High density fermentation of recombinant E.coli for production of human-like collagen[J].Journal of Chemical Industry and Engineering (China),2002,53(7):752-754.
[15] 刘晓宇,李晋,温赛.游离型质粒在毕赤酵母中表达人溶菌酶的研究[J].食品与发酵工业,2021,47(22):70-75.
LIU XY,LI J,WEN S.Study on the expression of human lysozyme by episomal plasmid in Pichia pastoris[J].Food and Fermentation Industries,47(22):70-75.
[16] DURANTI C,LASTRAIOLI E,IORIO J,et al.Expression and purification of a novel single-chain diabody (scDb-hERG1/β1) from Pichia pastoris transformants[J].Protein Expression and Purification,2021,184:105879.
[17] TOMAN P D,CHISHOLM G,MCMULLIN H,et al.Production of recombinant human type I procollagen trimers using a four-gene expression system in the yeast Saccharomyces cerevisiae[J].The Journal of Biological Chemistry,2000,275(30):23 303-23 309.
[18] 李梦腊.重组环糊精糖基转移酶的发酵条件优化及其固定化研究[D].上海:上海理工大学,2019.
LI M L.Optimization of conditions of recombinant cyclodextrin glycosyltransferase and its immobilization[D].Shanghai:University of Shanghai for Science and Technology,2019.
[19] 高力虎.重复序列类人胶原蛋白表达载体的构建及在毕赤酵母中的分泌表达[D].南京:南京理工大学,2007.
GAO L H.Construction of repetitive sequence human-like collagen expression vector and secretion expression in Pichia pastoris[D].Nanjing:Nanjing University of Technology,2007.
[20] NURFAIDAH,METUSALACH,MAHENDRADATTA M,et al.Analysis of molecular weight albumin concentrate on various types of freshwater fish using SDS-page electrophoresis method[J].IOP Conference Series:Earth and Environmental Science,2020,564(1):2 057-2 064.