乳铁蛋白(lactoferrin,Lf)早在1939年就被分离得到,分子质量大约为80 kDa,属于转铁蛋白家族的一种非血红素转铁蛋白[1]。Lf存在于人体的各种分泌液中,在母乳中含量最高[2],它的生物学功能尤其是对婴幼儿的健康和肠道菌群的影响已经被广泛报道,包括Lf降低婴儿和儿童腹泻发病率[3-4]、降低婴儿和儿童呼吸道疾病发病率[5]、降低新生儿败血症发生率[6-7]、对多种致病菌呈现抑菌活性[8-9]、具有促进肠道发育的功能[10]等,因此Lf被广泛应用于婴幼儿配方奶粉领域中,GB 1903.17—2016 《食品安全国家标准 食品营养强化剂 乳铁蛋白》对Lf的理化指标进行明确规定,其中Lf纯度为95%。但Lf价格昂贵和制造技术被国外垄断这些严重制约着我国婴幼儿配方奶粉产业的发展。目前,Lf提取的方法包括凝胶过滤色谱法、亲和色谱法、膜过滤法、磁分离法、离子交换色谱法。其中,离子交换色谱法是根据组分电荷的不同实现从多组分体系中分离出单一组分常用的方法,LU等[11]采用超滤和强阳离子交换层析相结合的方法从牛初乳中分离Lf,使用膜进行超滤后,再用阳离子交换层析进行纯化,Lf的纯度达到94.2%;WU等[12]用连续阳离子-阴离子交换层析从牛初乳中分离到纯度为95%的Lf。与其他方法相比,离子交换色谱法分离Lf具有可大规模实施、特异性强、分离成本相对较低、效率较高的优点,但是上述分离Lf方法的缺点是吸附剂价格昂贵、分离步骤繁杂、分离循环时间长、Lf纯度较低等,制约着其工业化的实现。
针对离子交换色谱法分离Lf存在的上述问题,本文以乳品加工副产物乳清为原料,通过筛选低成本、高效特异性的Lf吸附剂,研究从乳清中高效分离Lf的关键技术条件,研究可工业化高效分离Lf的关键技术,降低吸附成本,提高Lf的纯度,为推动我国Lf的工业化生产提供技术支持。
1 材料和方法
1.1 实验材料
新鲜牛乳样品,奥特奶牛良种牧场(中国青岛);Lf样品,Edifice International Trading Pte;SDS-PAGE凝胶制备试剂盒、彩虹180广谱marker(PR1910),北京索莱宝科技有限公司;阳离子交换树脂X,利穗科技(苏州)有限公司;732型阳离子交换树脂,天津市广成化学试剂有限公司;D152大孔阳离子交换树脂、壳聚糖,上海源叶生物有限公司;C-115E阳离子交换树脂,上海恩临环保科技有限公司;SDS-PAGE蛋白上样缓冲液(SDS-PAGE sample loading buffer,2X)、BCA蛋白浓度测定试剂盒(BCA protein assay kit),碧云天生物科技公司;牛乳铁蛋白ELISA检测试剂盒,上海羽朵生物科技有限公司;盐酸、氢氧化钠、冰醋酸,均为分析纯,国药集团化学试剂有限公司;实验室用水为蒸馏水。
1.2 实验方法
1.2.1 阳离子交换树脂及壳聚糖水凝胶处理及吸附Lf能力的研究
(1)阳离子交换树脂预处理方法。将C-115E阳离子交换树脂、D152大孔弱酸性丙乙酸系阳离子交换树脂、阳离子交换树脂X、732型阳离子交换树脂浸泡于饱和食盐水中18 h后,用蒸馏水洗净,使水不带黄色,然后用质量分数4%~5%的NaOH溶液和体积分数4%~5%的HCl溶液依次交替浸泡2 h,在碱酸之间用大量清水淋洗至出水接近中性,重复3次,备用。
(2)壳聚糖水凝胶制备方法。以质量浓度为0.04 g/mL壳聚糖水溶液,滴于体积分数为2%的醋酸溶液中,制备壳聚糖水凝胶微球备用。
(3)阳离子交换树脂及壳聚糖水凝胶吸附Lf能力的研究。用0.02 mol/L磷酸盐缓冲液(phosphate buffer saline,PBS)(pH 7.2)配制质量浓度为1 mg/mL的Lf样品溶液,分别取2 g已处理好的各种吸附剂于40 mL Lf样品溶液中静态吸附处理12 h后,静置沉降,取吸附残液上清液与上样缓冲液按体积比1∶1混匀,加热煮沸3 min后通过SDS-PAGE电泳,同时以未处理Lf样品为对照,采用ImagJ软件对图像进行蛋白质相对定量检测(灰度值)。各种吸附剂对Lf的吸附率计算如公式(1)所示:
吸附率![]()
(1)
1.2.2 阳离子交换树脂X对Lf最大吸附量检测
配制质量浓度为1 mg/mL的Lf样品溶液,取1 g处理好的阳离子交换树脂X于50 mL Lf样品溶液中静态吸附处理。分别在不同时间取样,经SDS-PAGE电泳,处理过程同1.2.1,通过最大吸附率计算阳离子交换树脂X对Lf样品的最大吸附量。
1.2.3 阳离子交换树脂X吸附乳清的时间曲线
首先取3 g处理好的阳离子交换树脂X于40 mL乳清中静态吸附处理。20 ℃水浴摇床(75 r/min),分别在不同时间取样,经SDS-PAGE电泳,处理过程同1.2.1,分析树脂对乳蛋白吸附能力及其对Lf吸附的特异性。
1.2.4 阳离子交换树脂X吸附不同pH值乳清蛋白特异性检测
取3 g已处理好的阳离子交换树脂X分别在pH为4.07、5.17、5.87条件下静态吸附乳清3 h,取吸附残液上清液。将树脂与乳清分离,采用NaCl+0.02 mol/L PBS缓冲液连续洗脱3次,分别取上清液经SDS-PAGE电泳,处理过程同1.2.1,分析pH值对树脂吸附Lf特异性影响。
1.2.5 阳离子交换树脂X与乳清的体积比对吸附Lf效果的影响
取1 mL已处理好的阳离子交换树脂X分别静态吸附10、15、20、25、30、35 mL乳清3 h,取吸附残液上清液进行SDS-PAGE电泳,处理过程同1.2.1,分析树脂静态吸附乳清的最佳体积比。
1.2.6 阳离子交换树脂X吸附Lf过程搅拌处理
取1.5 mL已处理好的阳离子交换树脂X静态吸附30 mL乳清,磁力搅拌速度分别为100、200、300 r/min,吸附3 h,取吸附残液上清液,经SDS-PAGE电泳,处理过程同1.2.1,分析阳离子交换树脂X静态吸附乳清的最佳搅拌转速。
1.2.7 洗脱液离子浓度对于阳离子交换树脂X吸附Lf后的洗脱
首先取2 mL处理好的阳离子交换树脂X在pH 5.20条件下静态吸附乳清3 h,将乳清与树脂分离,得到吸附乳清后的树脂进行洗脱,根据洗脱液的离子浓度不同分为3种洗脱方法。(1)首先用蒸馏水冲洗,再用0.3 mol/L NaCl+0.02 mol/L PBS洗脱10 min,再用蒸馏水冲洗10 min,最后用0.9 mol/L NaCl+0.02 mol/L PBS洗脱30 min;(2)首先用蒸馏水冲洗,再用0.6 mol/L NaCl+0.02 mol/L PBS洗脱10 min、再用蒸馏水冲洗10 min,最后用0.9 mol/L NaCl+0.02 mol/L PBS洗脱30 min;(3)首先用蒸馏水冲洗,再用0.9 mol/L NaCl+0.02 mol/L PBS洗脱10 min、再用蒸馏水冲洗10 min,最后用0.9 mol/L NaCl+0.02 mol/L PBS洗脱30 min。取洗脱液做SDS-PAGE电泳,处理过程同1.2.1,确定最佳的洗脱工艺。
1.2.8 最佳工艺条件下Lf高效特异性分离效果评价
取2 mL处理好的阳离子交换树脂X在pH 5.17静态吸附30 mL乳清3 h,使乳清与树脂分离,树脂经蒸馏水冲洗后通过以下工艺洗脱,首先用10 mL 0.3 mol/L NaCl+0.02 mol/L PBS洗脱10 min,再用30 mL蒸馏水冲洗10 min,最后用10 mL 0.9 mol/L NaCl+0.02 mol/L PBS洗脱30 min,取洗脱液和未处理组乳清留样检测。
采用ELISA法测定乳清与洗脱液中Lf的浓度,并根据乳清与洗脱液的体积计算Lf的回收率。采用BCA测总蛋白浓度法测定洗脱液中总蛋白浓度,并根据洗脱液中Lf浓度,计算出Lf的蛋白质纯度。采用SDS-PAGE电泳法,辅助检测洗脱液中各蛋白的相对含量。
2 结果与分析
2.1 不同阳离子交换树脂及壳聚糖水凝胶吸附Lf能力
将Lf样品经过不同阳离子交换树脂及壳聚糖水凝胶吸附后,取各吸附剂吸附后Lf样品残液进行SDS-PAGE凝胶电泳,结果见图1。通过公式(1)计算各吸附剂对Lf样品的吸附率,结果见图2。

1-蛋白marker;2-未处理组Lf样品;3-Lf经过壳聚糖水凝胶吸附后残余液;4-Lf经过C-115E阳离子交换树脂吸附后残余液;5-Lf经过D152阳离子交换树脂吸附后残余液;6-Lf经过阳离子交换树脂X吸附 后残余液;7-Lf经过732阳离子交换树脂吸附后残余液
图1 Lf样品经壳聚糖水凝胶或不同阳离子交换树脂 处理后SDS-PAGE凝胶电泳图
Fig.1 SDS-PAGE gel electrophoresis of Lf samples after treatment with chitosan hydrogel or different cation exchange resins

1-壳聚糖水凝胶;2-C-115E阳离子交换树脂;3-D152阳离子 交换树脂;4-阳离子交换树脂X;5-732阳离子交换树脂
图2 壳聚糖水凝胶和不同阳离子交换树脂对 Lf样品吸附效果
Fig.2 Adsorption effect of chitosan hydrogel and different cation exchange resins on Lf samples
由图2可知,阳离子交换树脂X对Lf样品具有较强的吸附能力,732阳离子交换树脂对Lf样品具有一定的吸附能力,壳聚糖水凝胶、C115E阳离子交换树脂、D152阳离子交换树脂对Lf样品几乎没有吸附能力。因此阳离子交换树脂X可作为进一步研究Lf分离的吸附剂。
2.2 阳离子交换树脂X吸附Lf的最大吸附量
将Lf样品经阳离子交换树脂X静态吸附不同时间后,取吸附残液进行SDS-PAGE凝胶电泳,结果见图3,采用ImagJ软件对图像进行蛋白质相对定量检测,分析吸附残余液中Lf的相对含量,计算吸附量,结果见图4。1 g阳离子交换树脂X可吸附大约70 mg的Lf,其对Lf样品的吸附容量较高,较高吸附容量意味着可以通过相对较少的吸附剂处理等量的原料,有利于低成本高效工业化生产。

M-蛋白marker;泳道1、2、3、4、5、6、7、8、9分别为Lf样品 经过阳离子交换树脂X静态吸附0、0.25、0.5、1、 1.5、2、3、4、5 h后吸附残液
图3 Lf样品经阳离子交换树脂X静态吸附不同时间 后残液的SDS-PAGE凝胶电泳图
Fig.3 SDS-PAGE gel electrophoresis of Lf samples after static adsorption of cation exchange resin X for different time
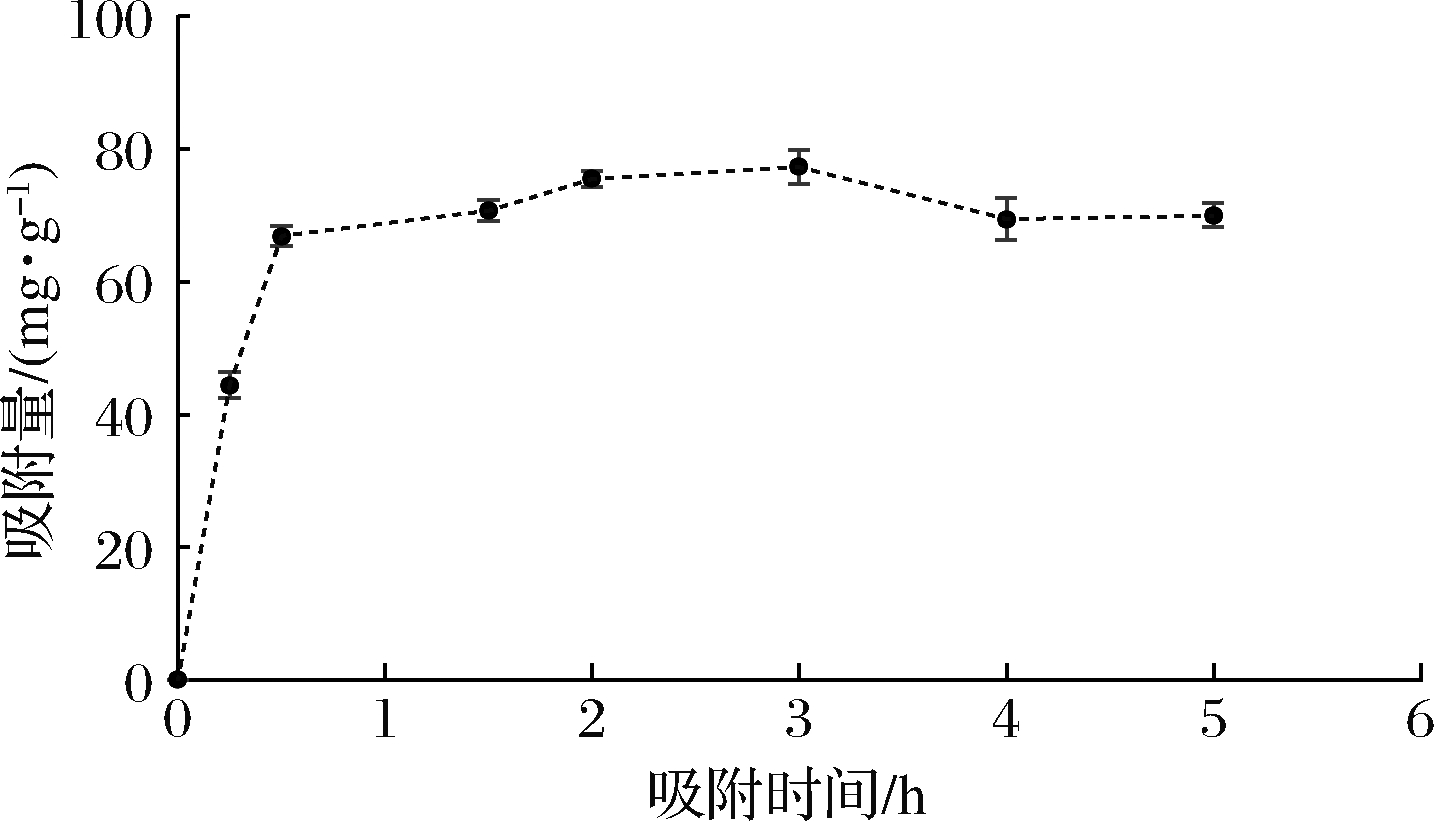
图4 阳离子交换树脂X对Lf样品的吸附量与静态吸附 时间的关系分析
Fig.4 Relationship between static adsorption time and adsorption capacity of cation exchange resin x for Lf samples
2.3 不同时间阳离子交换树脂X静态吸附乳蛋白的效果
将乳清经阳离子交换树脂X静态吸附不同时间后,取吸附残液进行SDS-PAGE凝胶电泳,结果见图5。通过公式(1)计算各乳清蛋白的吸附率,结果见图6。阳离子交换树脂X在pH 4.2条件下对乳清中的Lf的吸附具有一定的特异性,对其他乳蛋白吸附能力比Lf低,因此该树脂具备从乳清中直接分离Lf的潜力。但是由于其对乳清中其他乳蛋白也具有一定的吸附能力,因此需要优化吸附条件,进一步提高其对Lf分离的特异性。
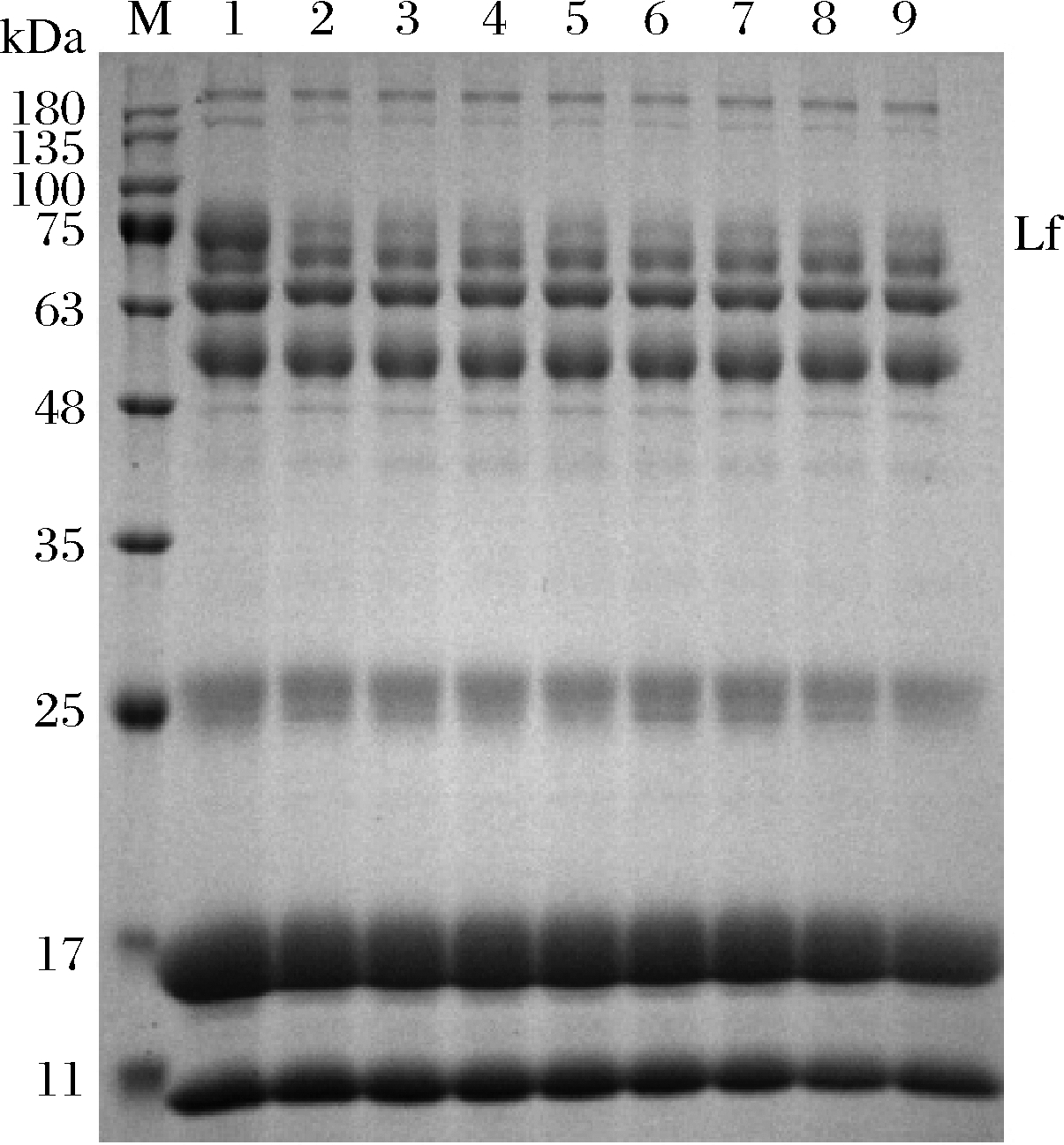
M-蛋白marker;泳道1、2、3、4、5、6、7、8、9分别为乳清 经阳离子交换树脂X吸附0、2、3、4、5、6、7、8、20 h残液
图5 乳清经阳离子交换树脂X静态吸附不同时间后残液 蛋白质的SDS-PAGE凝胶电泳图
Fig.5 SDS-PAGE gel electrophoresis of protein residue in whey after cation exchange resin X static adsorption at different time
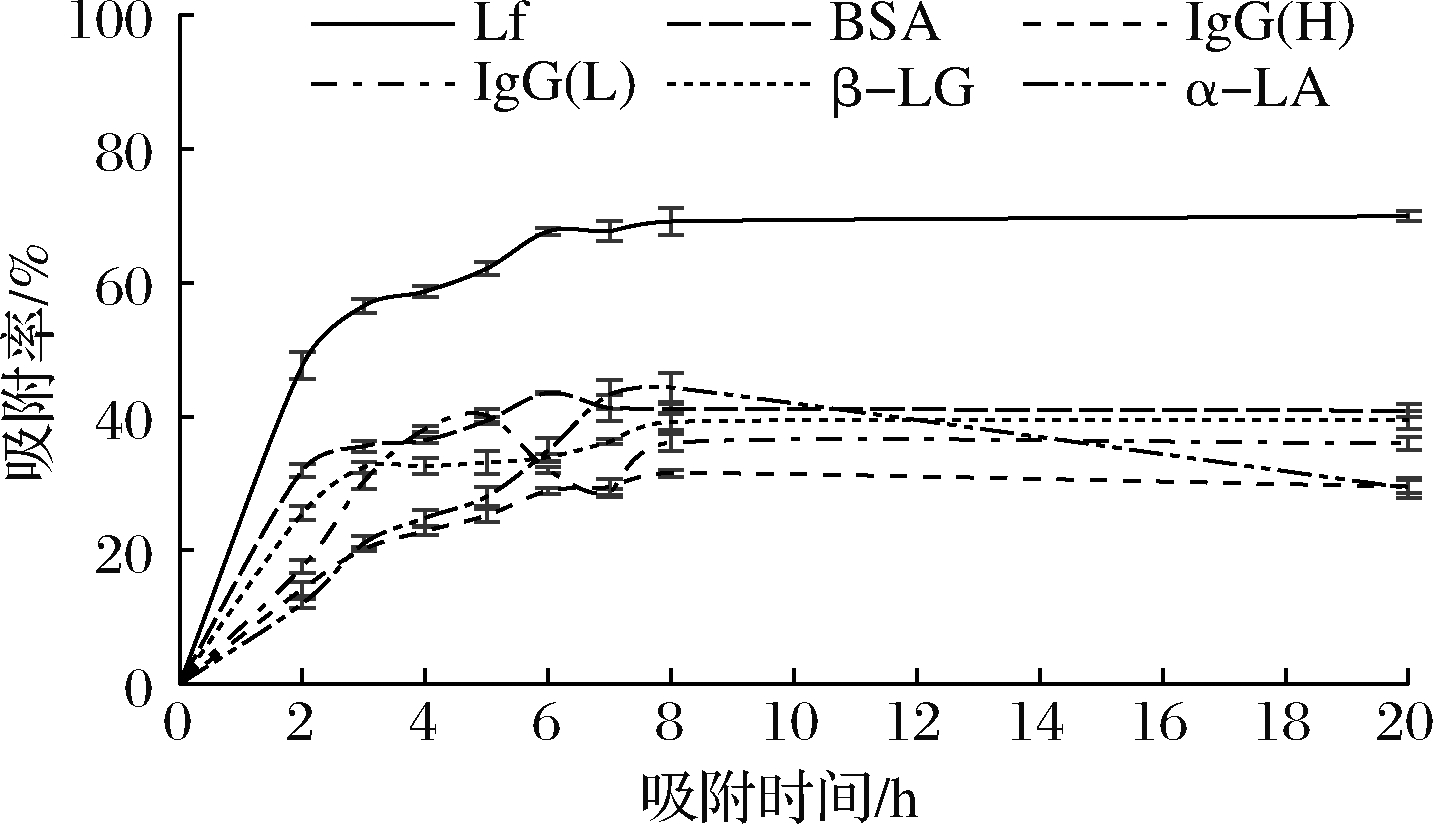
图6 阳离子交换树脂X静态吸附乳清不同时间 后各乳蛋白的吸附效果
Fig.6 The adsorption effect of each milk protein after cation exchange resin X static adsorption whey different times
2.4 pH值对阳离子交换树脂X吸附乳清蛋白特异性的影响
将乳清经阳离子交换树脂X分别在pH 4.02、5.17、5.86下静态吸附3 h,取上清液进行电泳,结果见图7。
采用ImagJ软件对图像进行蛋白质相对定量检测,并将吸附残余液中各蛋白的相对含量与未处理组乳清中各蛋白的相对含量进行比较,通过公式(1)计算各乳清蛋白的吸附率,结果见图8。阳离子交换树脂X对于乳清中各蛋白质的吸附率受pH影响很大。在pH 4.02时,该树脂对乳清中Lf的吸附率较高,但是由于其对乳清中其他蛋白吸附率也很高,导致其对Lf吸附的特异性并不高。在pH 5.86时,该树脂对Lf吸附的特异性最高,但其对Lf吸附率有所降低。因此,随着pH增加,该树脂对乳清的吸附特异性增加,但是吸附速率降低。综合看,在pH 5.17时树脂对Lf的吸附特异性相对较高,对Lf的吸附率也相对较高。

M-蛋白marker;泳道1、2:pH 4.02时未处理组乳清、吸附残余液乳清;泳道3、4、5:吸附pH 4.02时,树脂经0.6 mol/L NaCl PBS溶液连续洗脱3次洗脱液;泳道6、7:pH 5.17时未处理组乳清、吸附残余液乳清;泳道8、9、10:吸附pH 5.17时,树脂经0.6 mol/L NaCl PBS溶液连续洗脱3次洗脱液;泳道11、12:pH 5.86时未处理组乳清、吸附残余液乳清;泳道13、14、15:吸附pH 5.86时,树脂经0.6 mol/L NaCl PBS溶液 连续洗脱3次洗脱液
图7 不同pH下阳离子交换树脂X吸附乳清残余液和 洗脱液的SDS-PAGE凝胶电泳图
Fig.7 SDS-PAGE gel electrophoresis of whey residues and eluent adsorbed by cation exchange resin X at different pH levels

图8 pH对阳离子交换树脂X吸附乳清蛋白 特异性的影响分析结果
Fig.8 Effect of pH on the specificity of whey protein adsorbed by cation exchange resin X
2.5 阳离子交换树脂X与乳清的体积比对Lf吸附率的影响
取1 mL已处理好的阳离子交换树脂X分别静态吸附10、15、20、25、30、35 mL乳清3 h,取吸附残液上清液留样,经SDS-PAGE凝胶电泳,结果见图9。
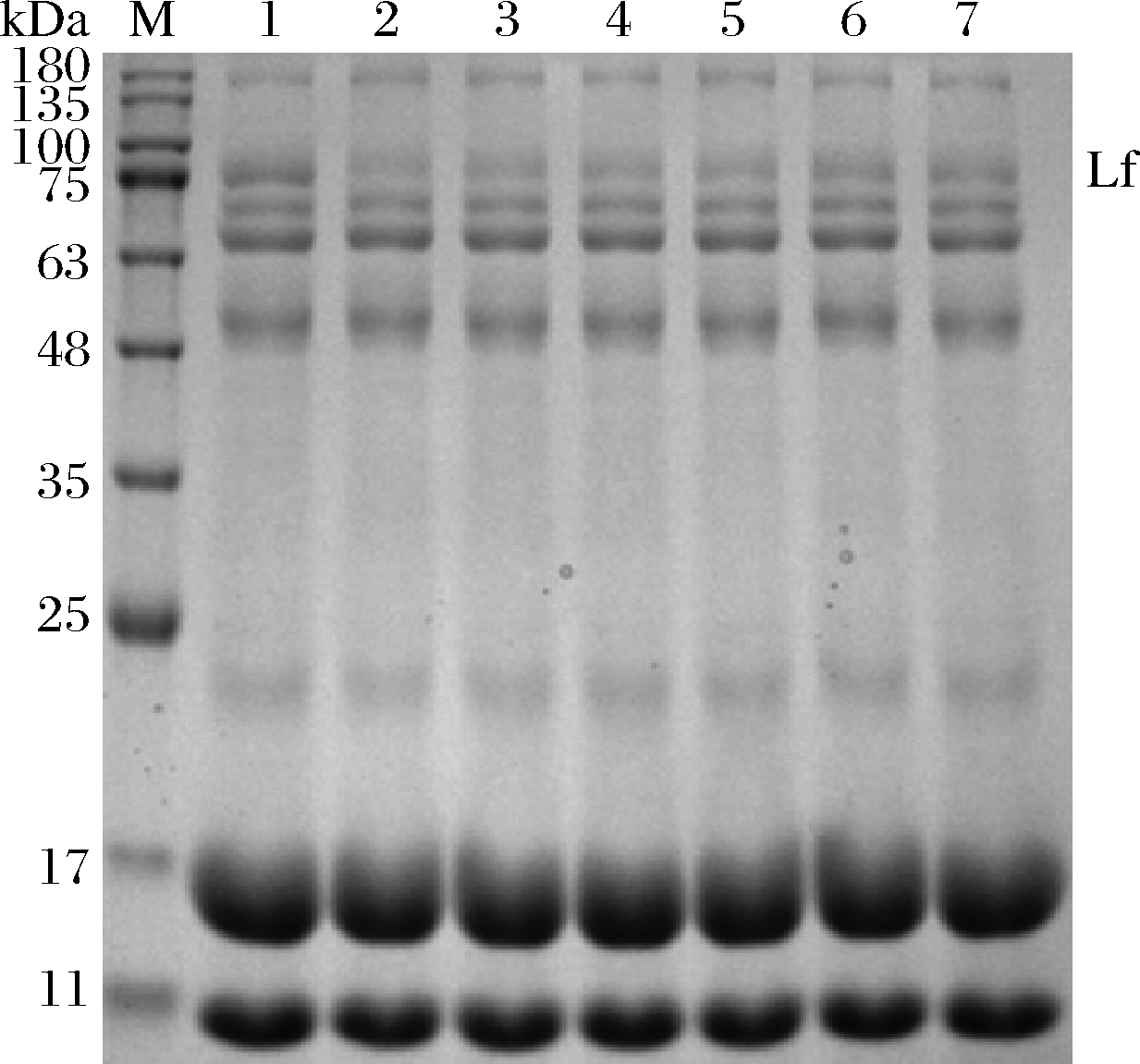
M-蛋白marker;1-未处理组乳清;2、3、4、5、6、7: 树脂与乳清的体积比分别为1∶10、1∶15、1∶20、 1∶25、1∶30、1∶35的吸附后残余液
图9 单位体积阳离子交换树脂X吸附不同体积乳清 残余液SDS-PAGE凝胶电泳图
Fig.9 SDS-PAGE gel electrophoresis of different volume of whey residual liquid adsorbed by unit volume resin
采用ImagJ软件对图像进行蛋白质相对定量检测,得到1 mL树脂静态吸附不同体积乳清时,吸附残余液中Lf的剩余情况,通过公式(1)计算各乳清蛋白的吸附率,得到不同体积比下的Lf的吸附率。由图10 可知,静态吸附时间为3 h时,阳离子交换树脂X对乳清中Lf的吸附率受到树脂与乳清体积比的影响,1 mL树脂吸附10~20 mL乳清时,Lf的吸附率保持在60%上下,当1 mL树脂吸附乳清体积大于25 mL时,吸附率开始持续降低。结合经济性考虑,可将1 mL该树脂吸附乳清体积设定为15~20 mL,可保持较高的吸附率,更高效地从乳清中吸附Lf。
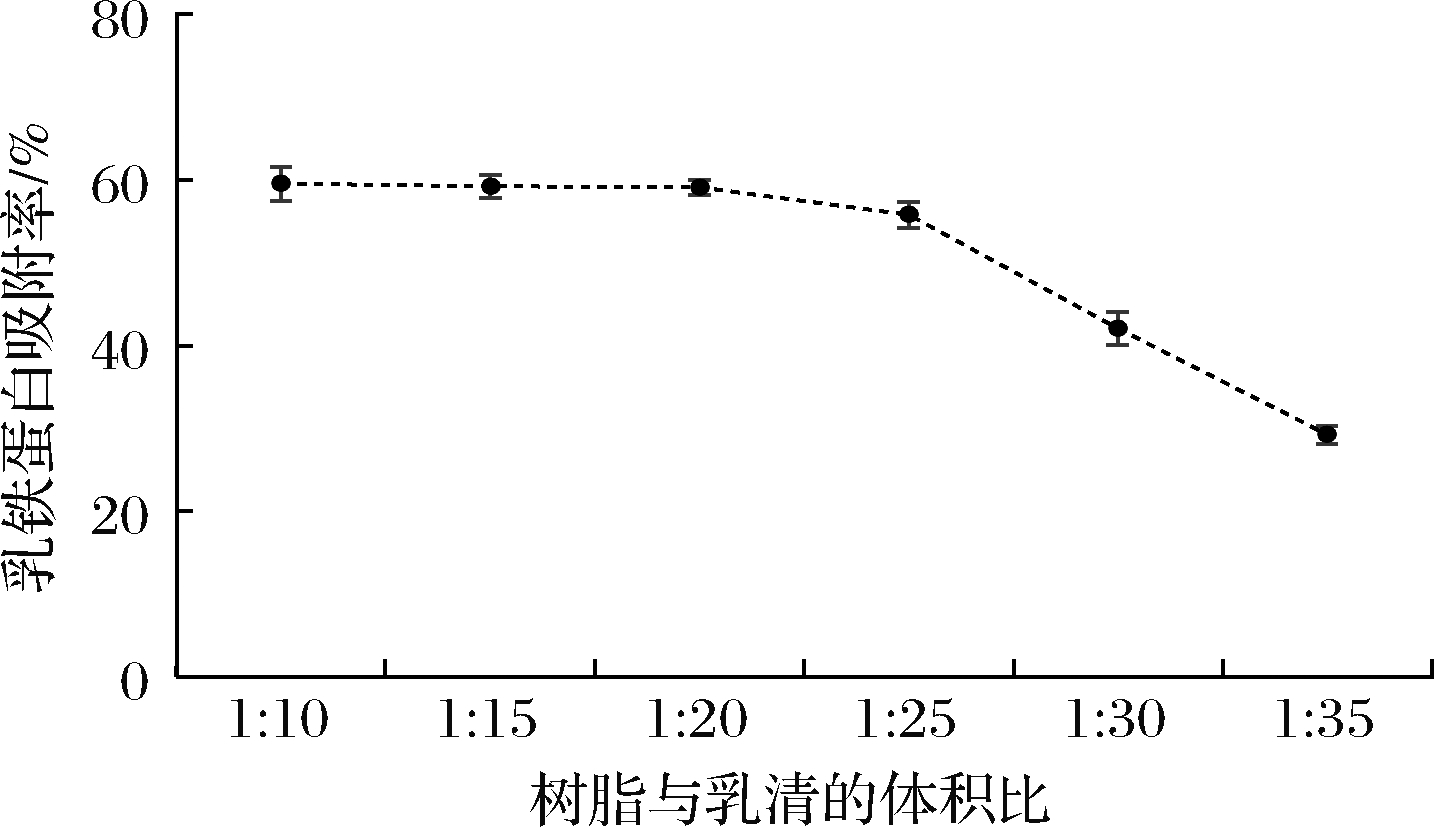
图10 阳离子交换树脂X与乳清不同体积比下Lf的吸附率
Fig.10 The adsorption rate of Lf on different volume ratio of cation exchange resin X to whey
2.6 搅拌转速对阳离子交换树脂X吸附Lf吸附率的影响
将阳离子交换树脂X在100、200、300 r/min下,静态吸附乳清3 h取吸附残液,经SDS-PAGE电泳,结果见图11。

M-蛋白marker;1-未处理中组乳清;2-搅拌转速为 100 r/min;3-搅拌转速为200 r/min;4-搅拌转速为300 r/min
图11 不同搅拌转速下阳离子交换树脂X吸附乳清 残余液SDS-PAGE凝胶电泳图
Fig.11 SDS-PAGE gel electrophoresis of whey residues adsorbed by cation exchange resin X at different stirring speeds
采用ImagJ软件对图像进行蛋白质相对定量检测,分析吸附残余液中Lf的剩余情况,通过公式(1)计算不同吸附转速下,该树脂对Lf的吸附率,结果见图12。该树脂对于乳清中Lf的吸附率受到吸附转速的影响,随着吸附转速的增加,Lf的吸附率呈上升趋势。
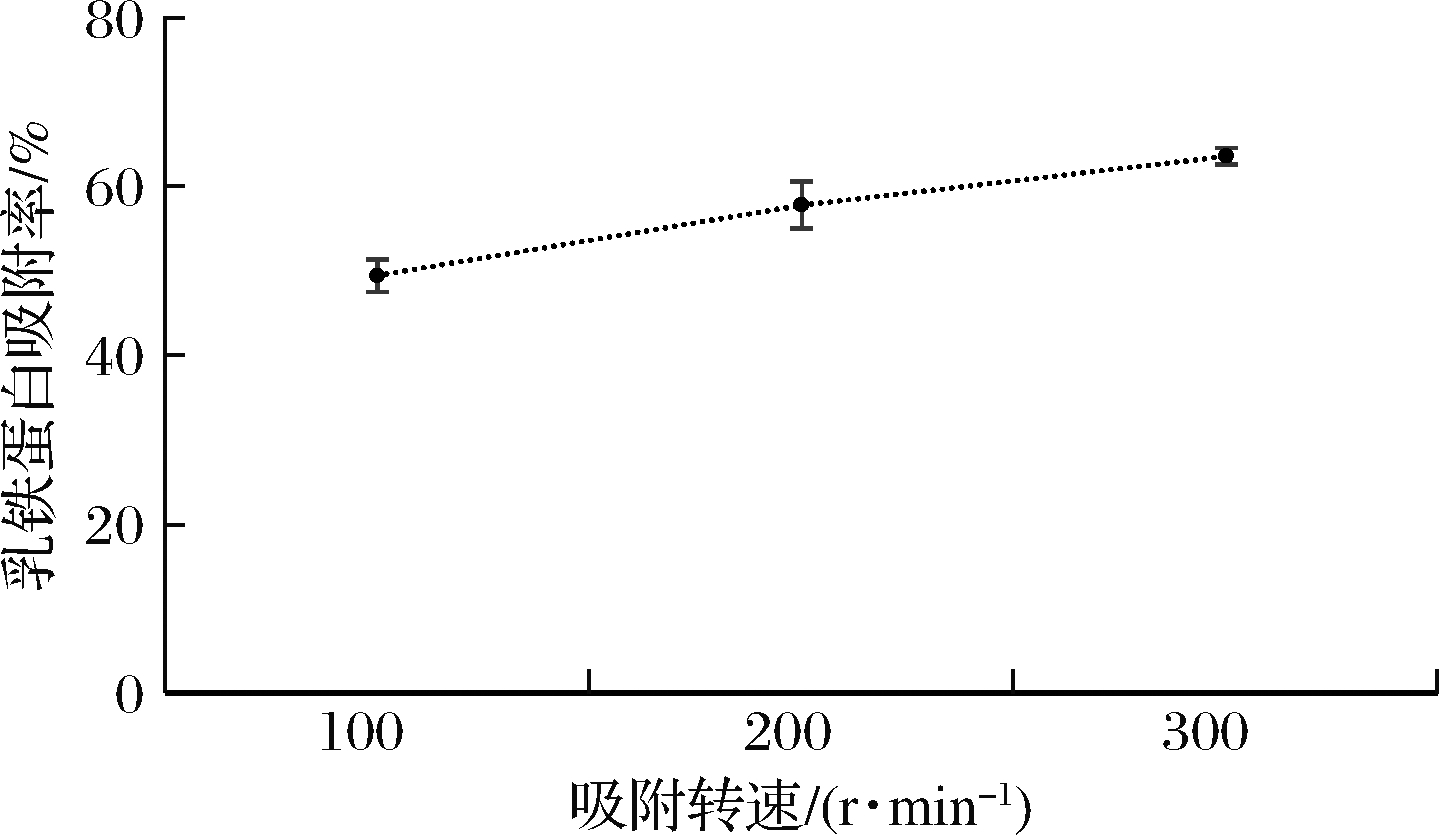
图12 不同搅拌转速下阳离子交换树脂X对乳清中 Lf的吸附率分析结果
Fig.12 Analysis of adsorption rate of Lf in whey by ion exchange resin X at different stirring speeds
2.7 洗脱液的离子浓度对于洗脱效果的影响
乳清经阳离子交换树脂X静态吸附3 h后,将吸附后的树脂与乳清分离,用蒸馏水冲洗后,分别用3种洗脱方法进行洗脱,取上清液电泳,结果见图13。离子交换树脂X吸附的乳清蛋白的洗脱程度受洗脱液离子浓度的影响,0.3 mol/L NaCl+0.02 mol/L PBS洗脱液可以将阳离子交换树脂X吸附的大部分除Lf之外的乳蛋白洗脱下来,而保留大部分的Lf,再用0.9 mol/L NaCl+0.02 mol/L PBS进行洗脱时,可将Lf高纯度的洗脱下来。而如果只单独用0.6或0.9 mol/L NaCl+0.02 mol/L PBS洗脱阳离子交换树脂X,Lf与其他的乳蛋白被一同洗脱下来,Lf纯度降低。因此,采用分步洗脱的方法洗脱阳离子交换树脂X,首先用0.3 mol/L NaCl+0.02 mol/L PBS洗脱液洗脱除Lf之外的其他乳蛋白,再用0.9 mol/L NaCl+0.02 mol/L PBS洗脱液将Lf洗脱下来。
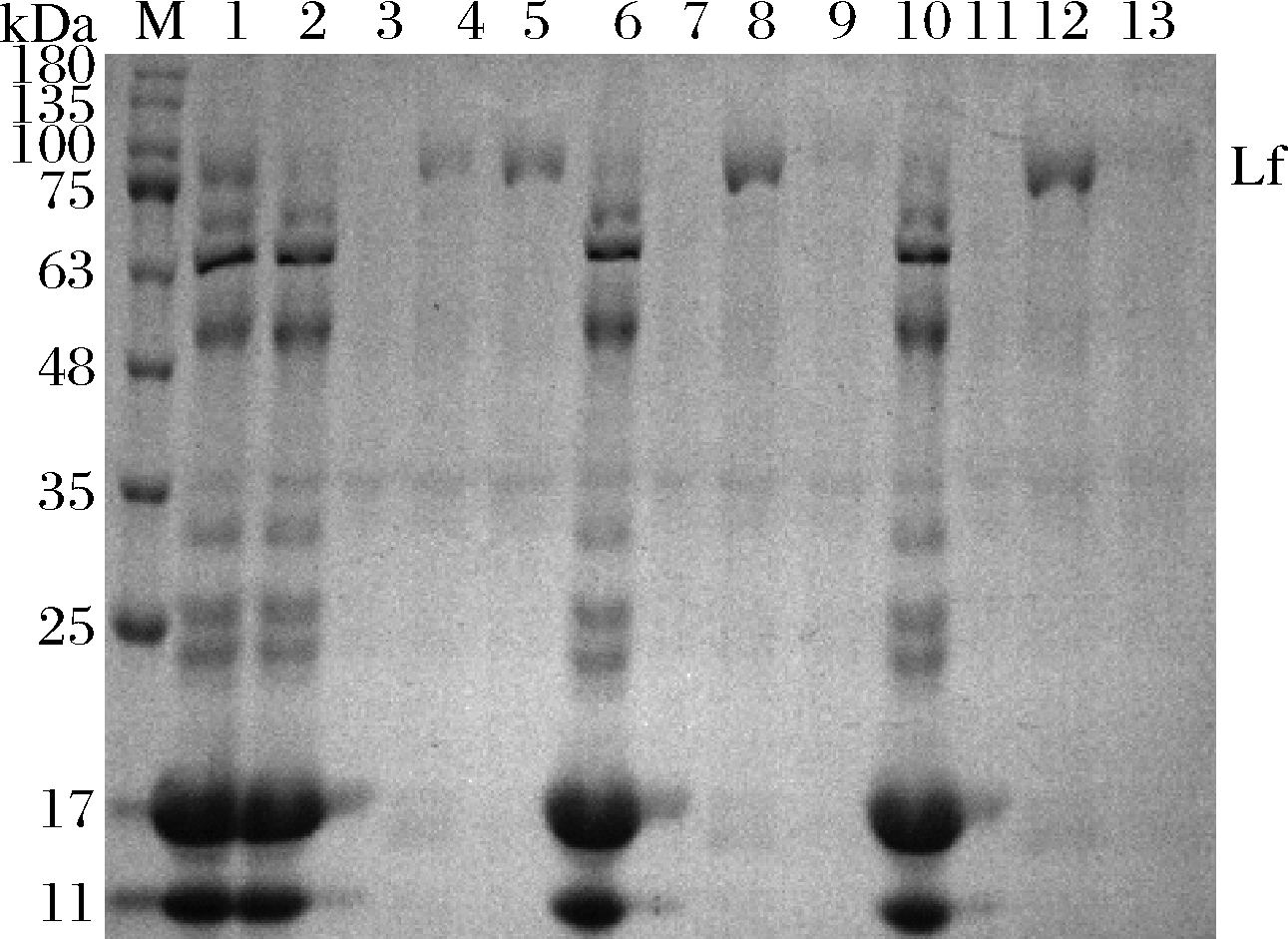
M-蛋白marker;1-未处理中组乳清;2、3、4、5分别为方法1经树脂吸附后的乳清残液、1次水洗洗脱液、0.3 mol/L NaCl+0.02 mol/L PBS、0.9 mol/L NaCl+0.02 mol/L PBS洗脱液;6、7、8、9分别为方法2经树脂吸附后的乳清残液、1次水洗洗脱液、0.6 mol/L NaCl+0.02 mol/L PBS、0.9 mol/L NaCl+0.02 mol/L PBS洗脱液;10、11、12、13分别为方法3经树脂吸附后的乳清残液、1次水洗洗脱液、0.9 mol/L NaCl+0.02 mol/L PBS、0.9 mol/L NaCl+0.02 mol/L PBS洗脱液
图13 不同浓度洗脱液对离子交换树脂X吸附Lf洗脱 效果的SDS-PAGE凝胶电泳图
Fig.13 SDS-PAGE gel electrophoresis of elution effect of different concentrations of eluent to ion exchange resin X
2.8 最佳吸附洗脱条件下Lf特异性分离效果
将未处理组乳清、经树脂吸附后乳清残液、Lf洗脱液通过SDS-PAGE凝胶电泳,结果见图14,由电泳图可知,Lf单一条带较为明显。

M-蛋白marker;1-未处理组乳清;2-经树脂 吸附后的乳清残液;3-Lf洗脱液
图14 乳清、吸附残液、洗脱液SDS-PAGE凝胶电泳图
Fig.14 SDS-PAGE gel electrophoresis of whey,adsorption residue and eluent
通过BCA法检测洗脱液的总蛋白浓度,BCA标准曲线见图15,经过计算,洗脱液的总蛋白质量浓度为(0.461 8±0.001 8)g/L。
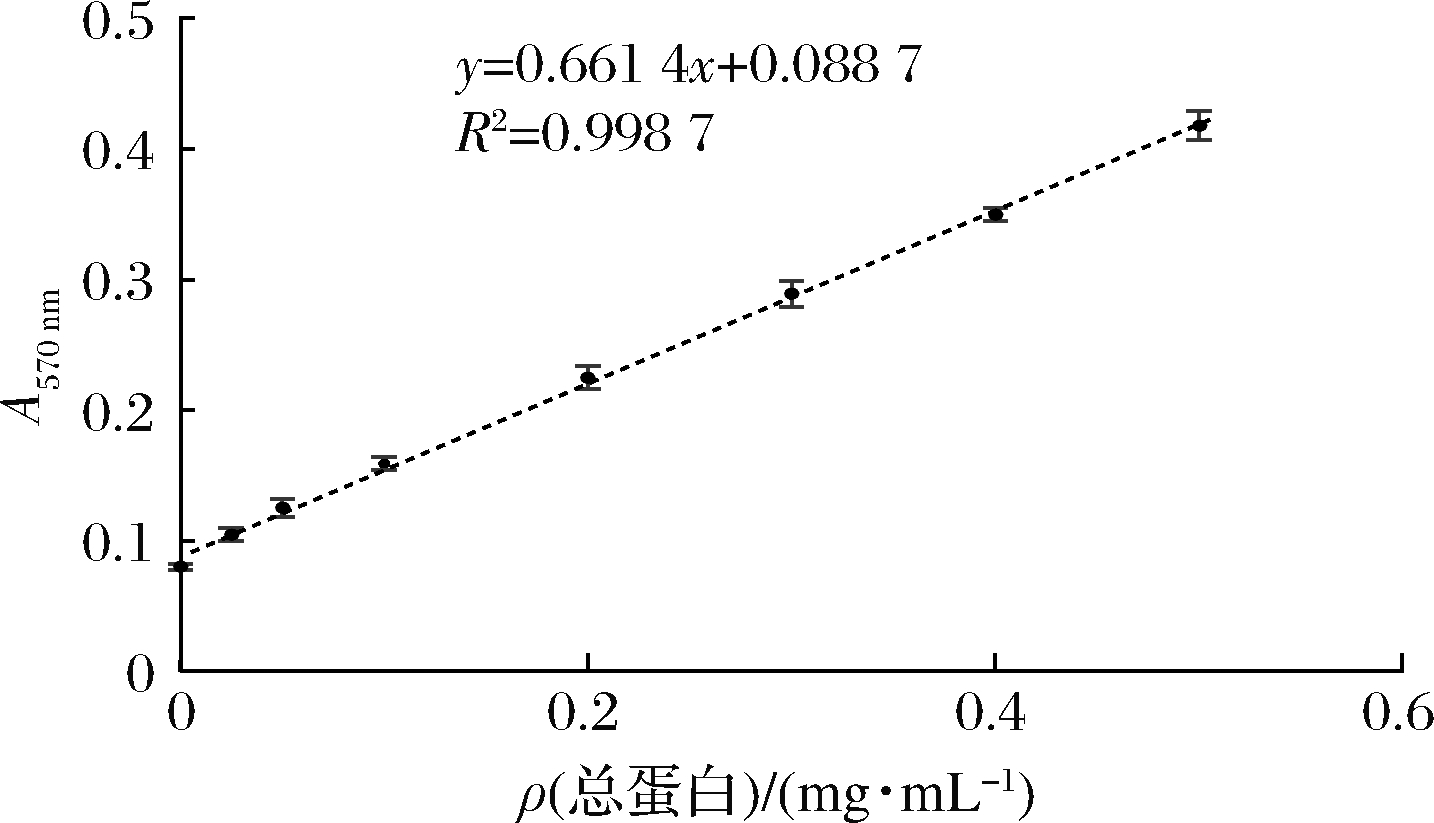
图15 BCA法测总蛋白浓度的标准曲线图
Fig.15 Standard graph for BCA method to determine total protein concentration
通过ELISA法测乳清与洗脱液的Lf浓度,ELISA标准曲线见图16,经过分析计算,乳清中Lf质量浓度为(0.266±0.001)g/L,洗脱液中Lf质量浓度为(0.441±0.002)g/L。通过计算,洗脱液中Lf的纯度为95.5%,回收率为55.3%。
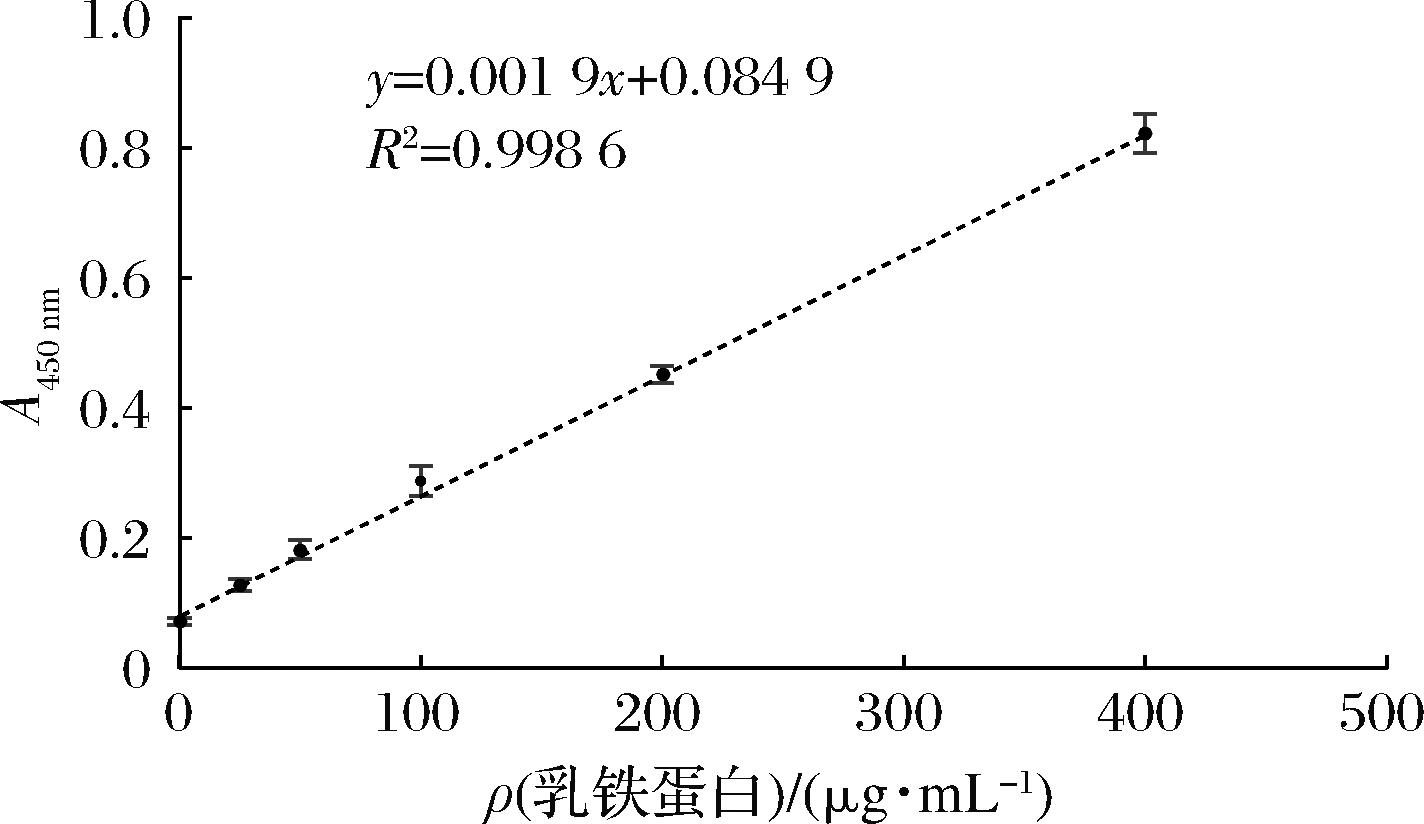
图16 ELISA法测Lf浓度的标准曲线图
Fig.16 Standard graph for ELISA method to determine Lf concentration
3 结论
离子交换色谱法在蛋白质纯化方面表现出很大的潜力,多种阳离子交换树脂被证明可以实现Lf的分离纯化[11-12],本研究发现不同吸附剂在Lf吸附率和吸附特异性方面存在很大差异,与其他吸附剂相比,阳离子交换树脂X对Lf的吸附率更高、吸附特异性更强,这可能是阳离子交换树脂X网络骨架的亲水性比其他吸附剂强,亲水性会提高树脂与水溶性蛋白的结合力[13],同时该树脂较低的价格也有利于其工业化应用。
有研究表明[11],在动态吸附中,流速、树脂与乳清的体积比会对吸附率产生影响,由于Lf等电点为8.5,显著高于乳清中其他乳蛋白[14],因此可通过调节pH值控制Lf与其他乳蛋白的带电性,进而影响阳离子交换树脂吸附Lf的特异性。本研究发现,随着pH的升高,阳离子交换树脂X对Lf的吸附率降低,但是对Lf的吸附特异性升高,这可能是随着pH的升高,Lf所带的正电荷总量降低,树脂与Lf之间的结合力减弱,导致Lf吸附率降低,与此同时,由于升高pH值后,pH高于大部分乳蛋白等电点,使得其他乳蛋白携带负电荷,表现为阴离子状态,进而失去与阳离子交换树脂的结合能力[15],而由于Lf表现为阳离子状态,使得阳离子交换树脂X对Lf具有吸附作用,使得该树脂对Lf的吸附特异性增强。进一步研究了吸附转速、树脂与乳清的体积比对阳离子交换树脂X吸附乳清中Lf吸附率的影响,发现随着吸附转速的增加,Lf的吸附率呈上升的趋势,搅拌转速的升高会对树脂吸附Lf产生2方面的影响,第一方面是提高树脂与Lf的碰撞几率,导致Lf与树脂结合的概率增加,进而提高Lf吸附率,第二方面是会降低树脂与Lf结合的牢固性,进而降低Lf吸附率,因此在转速为100~300 r/min时,随着转速的升高,第一方面的影响大于第二方面,从而表现为Lf的吸附率上升;1 mL树脂吸附10~20 mL乳清时,Lf的吸附率保持在60%上下,当1 mL树脂吸附乳清体积大于25 mL时,吸附率开始持续降低,这可能是由于树脂与乳清的体积比在1∶25时,阳离子交换树脂X吸附Lf的量已经达到饱和状态[16],随着乳清体积的进一步增加,该树脂无法吸附更多的Lf,从而表现为对Lf的吸附率降低。
前人的研究结果表明,不同浓度的盐溶液可以将乳清蛋白从树脂上洗脱下来,并且随着盐浓度的提高,可将更多的蛋白洗脱下来[17]。本文分别以含0.3、0.6、0.9 mol/L NaCl的PBS缓冲液为洗脱液,研究发现,含0.3 mol/L NaCl的PBS可以将阳离子交换树脂X吸附的大部分除Lf之外的乳蛋白洗脱下来,而保留大部分的Lf,再用含0.9 mol/L NaCl的PBS进行洗脱时,可将Lf高纯度的洗脱下来,这是由于带正电荷的Lf与阳离子交换树脂X之间的结合力大于其他乳蛋白与该树脂的结合力,Lf与阳离子交换树脂X结合地更牢固,因此可先用含0.3 mol/L NaCl的PBS将大部分的乳蛋白洗脱下来,再用0.9 mol/L NaCl的PBS将Lf洗脱下来,实现Lf的高纯度洗脱。通过ELISA法检测Lf的浓度、BCA法检测总蛋白浓度,计算洗脱液中Lf的蛋白纯度和回收率。本文研究的Lf的蛋白纯度为95.5%,达到GB 1903.17—2016 《食品安全国家标准 食品营养强化剂 乳铁蛋白》中规定的95%的要求,并且本工艺的成本较低,符合大规模实施的条件,具备工业化分离Lf的潜力。
总之,本研究结果表明,阳离子交换树脂X可以最大量地从乳清中分离Lf,最佳技术条件为:吸附条件为pH 5.17、搅拌转速为300 r/min、树脂与乳清的体积比为1∶15、作用时间3 h;洗脱条件为:0.3 mol/L NaCl+0.02 mol/L PBS、蒸馏水、0.9 mol/L NaCl +0.02 mol/L PBS顺次洗脱,获得Lf的蛋白纯度为95.5%,Lf的回收率为55.3%。
[1] 陈柔含,古淑青,赵超敏,等.超高效液相色谱-串联质谱法测定乳与乳制品中牛乳铁蛋白[J].色谱,2020,38(6):663-671.
CHEN R H,GU S Q,ZHAO C M,et al.Determination of bovine lactoferrin in milk and dairy products by ultra performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography,2020,38(6):663-671.
[2] PIERCE A,COLAVIZZA D,BENAISSA M,et al.Molecular cloning and sequence analysis of bovine lactotransferrin[J].European Journal of Biochemistry,1991,196(1):177-184.
[3] OCHOA T J,CHEA-WOO E,BAIOCCHI N,et al.Randomized double-blind controlled trial of bovine lactoferrin for prevention of diarrhea in children[J].The Journal of Pediatrics,2013,162(2):349-356.
[4] CHEN K,CHAI L Y,LI H,et al.Effect of bovine lactoferrin from iron-fortified formulas on diarrhea and respiratory tract infections of weaned infants in a randomized controlled trial[J].Nutrition,2016,32(2):222-227.
[5] KING J C,CUMMINGS G E,GUO N,et al.A double-blind,placebo-controlled,pilot study of bovine lactoferrin supplementation in bottle-fed infants[J].Journal of Pediatric Gastroenterology and Nutrition,2007,44(2):245-251.
[6] KAUR G,GATHWALA G.Efficacy of bovine lactoferrin supplementation in preventing late-onset Sepsis in low birth weight neonates:A randomized placebo-controlled clinical trial[J].Journal of Tropical Pediatrics,2015,61(5):370-376.
[7] OCHOA T J,ZEGARRA J,CAM L,et al.Randomized controlled trial of lactoferrin for prevention of Sepsis in Peruvian neonates less than 2 500 G[J].The Pediatric Infectious Disease Journal,2015,34(6):571-576.
[8] ISHIKAWA H,AWANO N,FUKUI T,et al.The protective effects of lactoferrin against murine Norovirus infection through inhibition of both viral attachment and replication[J].Biochemical and Biophysical Research Communications,2013,434(4):791-796.
[9] VELLIYAGOUNDER K,ALSAEDI W,ALABDULMOHSEN W,et al.Oral lactoferrin protects against experimental candidiasis in mice[J].Journal of Applied Microbiology,2015,118(1):212-221.
[10] YANG C W,ZHU X,LIU N,et al.Lactoferrin up-regulates intestinal gene expression of brain-derived neurotrophic factors BDNF,UCHL1 and alkaline phosphatase activity to alleviate early weaning diarrhea in postnatal piglets[J].The Journal of Nutritional Biochemistry,2014,25(8):834-842.
[11] LU R R,XU S Y,WANG Z,et al.Isolation of lactoferrin from bovine colostrum by ultrafiltration coupled with strong cation exchange chromatography on a production scale[J].Journal of Membrane Science,2007,297(1-2):152-161.
[12] WU M B,XU Y J.Isolation and purification of lactoferrin and immunoglobulin G from bovine colostrum with serial cation-anion exchange chromatography[J].Biotechnology and Bioprocess Engineering,2009,14(2):155-160.
[13] NOH H,VOGLER E A.Volumetric interpretation of protein adsorption:Mass and energy balance for albumin adsorption to particulate adsorbents with incrementally increasing hydrophilicity[J].Biomaterials,2006,27(34):5 801-5 812.
[14] GONZ LEZ-CH
LEZ-CH VEZ S A,ARÉVALO-GALLEGOS S,RASC
VEZ S A,ARÉVALO-GALLEGOS S,RASC N-CRUZ Q.Lactoferrin:structure,function and applications[J].International Journal of Antimicrobial Agents,2009,33(4):301.e1-301.e8.
N-CRUZ Q.Lactoferrin:structure,function and applications[J].International Journal of Antimicrobial Agents,2009,33(4):301.e1-301.e8.
[15] LAMPREAVE F,PI EIRO A,BROCK J H,et al.Interaction of bovine lactoferrin with other proteins of milk whey[J].International Journal of Biological Macromolecules,1990,12(1):2-5.
EIRO A,BROCK J H,et al.Interaction of bovine lactoferrin with other proteins of milk whey[J].International Journal of Biological Macromolecules,1990,12(1):2-5.
[16] LIANG Y F,WANG X W,WU M B,et al.Simultaneous isolation of lactoferrin and lactoperoxidase from bovine colostrum by SPEC 70 SLS cation exchange resin[J].International Journal of Environmental Research and Public Health,2011,8(9):3 764-3 776.
[17] HEIDEBRECHT H J,KAINZ B,SCHOPF R,et al.Data concerning the chromatographic isolation of bovine IgG from milk-and colostral whey[J].Data in Brief,2018,21:527-539.