非酿酒酵母广泛存在于葡萄的种植环境和发酵环境中[1],相关研究表明,采用控制接种酿酒酵母和非酿酒酵母混合发酵是提高葡萄酒复杂度和增强葡萄酒独特性的有效方法[2-3],非酿酒酵母中的某些代谢产物对葡萄酒的香气具有重要贡献[4]。由非酿酒酵母菌产生的天然抗菌剂可以有效抑制腐败微生物,确保葡萄酒发酵进程平稳进行,对于提升葡萄酒品质具有重要贡献[5-7]。但在葡萄酒酿造过程中由于非酿酒酵母发酵能力弱[8]、耐受性差[9],导致其参与发酵周期短,对葡萄酒品质影响较小,且商业酵母种类单一[10],制约了葡萄酒风味的多样性。
常压室温等离子体(atmospheric room temperature plasma,ARTP)原理是ARTP产生的高浓度活性粒子能够使DNA单链或双链发生断裂,造成DNA损伤,进而诱发细胞启动应急修复机制,引起微生物突变[11]。该项技术具有突变效率高、安全性高等特点[12],目前ARTP诱变育种研究已日趋成熟,在食品、药品、饲料等产业均有应用[13-14]。
从葡萄酒风味多样性角度出发,结合非酿酒酵母耐受性方面存在的问题,本研究以从葡萄皮表面筛选的马克斯克鲁维酵母(Kluyveromyces marxianus)YK为研究对象,采用ARTP诱变育种技术对出发菌株进行改良,以高耐受性为初筛标准对诱变菌株进行初筛,以高产酸、产酯为复筛标准对诱变菌株进行产香复筛,最终获得高耐受性产香非酿酒酵母,并对遗传稳定性,发酵能力,产香能力进行验证。后期将用筛选获得的非酿酒酵母与酿酒酵母混合发酵,以期打破葡萄酒品质单一性这一局面,为非酿酒酵母在葡萄酒发酵过程中的应用提供理论技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
马克斯克鲁维酵母(Kluyveromyces marxianus)YK,新疆农业大学食品科学与药学学院食品生物发酵与质量安全研究室。
1.1.2 化学试剂
无水乙醇、葡萄糖、氢氧化钠、盐酸,天津市致远化学试剂有限公司;偏重亚硫酸钾,名人生物科技有限公司;L(+)酒石酸,宁波金展生物科技有限公司;2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TTC),上海蓝季生物科技发展有限公司;酚酞,天津市化学试剂三厂,以上实际均为分析纯。
1.1.3 培养基
TTC上层培养基、TTC下层培养基配制方法见参考文献[15]。
YPD培养基,青岛高科技工业园海博生物技术有限公司。
1.2 仪器与设备
ⅡS型ARTP诱变仪,无锡源清天木生物科技有限公司;PTX-FA210型分析天平,福州华志科学仪器有限公司;LDZX-50KBS型立式高压灭菌器,上海申安医疗器械厂;HR40-A2型生物安全柜,青岛海尔特种电器有限公司;MJX-100B-Z型生化培养箱,上海博讯实业有限公司医疗设备厂;TU-1810型紫外可见光光度计,北京普析通用仪器有限责任公司;LE2002E电子天平,梅特勒-托利多仪器(上海)有限公司。
1.3 实验方法
1.3.1 ARTP诱变试验
试验参数:参照文献[16]中方法进行设置。
1.3.2 致死率计算
致死率计算如公式(1)所示:
致死率![]()
(1)
1.3.3 高耐受性非酿酒酵母初筛
1.3.3.1 TTC培养基筛选
选取YPD固体培养基上生长的单菌落诱变菌株并重新接种到新的YPD固体培养基上,培养温度为28 ℃,培养时间为48 h,48 h后将TTC上层培养基倾覆在TTC下层培养基上,28 ℃培养3 h后观察显色情况,筛选出产酒精能力强的诱变菌株。
1.3.3.2 菌株发酵能力测试
采用杜氏小管发酵法, 将上步筛选的突变菌株, 以4%的接种量分别接种装有杜氏小管和10 mL YPD液体培养基试管中,28 ℃条件下培养, 测定菌株产气能力,筛选发酵性能优良的菌株。
1.3.3.3 菌株耐受性筛选
将上步筛选得到的突变菌株分别接种于不同葡萄糖质量浓度(220、240、260、280 g/L)、SO2质量浓度(40、50、60、70 mg/L)、乙醇体积分数(2%、4%、6%、8%)、pH值(2.5、3.0、3.5、4.0)的YPD液体培养基,接种量1×107 CFU/mL,28 ℃培养24 h后在600 nm下测量吸光度,以不接种菌株的YPD液体培养基为空白对照。
1.3.4 产香非酿酒酵母复筛
总酯、总酸测定参考文献[17]进行。
1.3.5 遗传稳定性试验
将最终筛选得到的诱变菌株连续传代培养5次,每一代菌株以4%的接种量接种于糖度为22.5 °Bx葡萄汁中28 ℃培养8 d,测诱变菌株产酒精能力和产酯产酸能力,验证诱变菌株遗传稳定性。
1.3.6 发酵能力验证
葡萄酒酒精度的测定参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定。
1.3.7 产香能力验证
感官分析方法具体参照文献[18]进行。品评小组由11名专业人员组成。在分析过程中,将酒样随机编号,每一个酒样重复2次品评,对香气特征进行标准描述,并进行量化。使用5分制对香气强度进行打分,强度越高分值越高。
2 结果与分析
2.1 ARTP诱变时间的确定
原始菌株YK经ARTP诱变后致死率曲线如图1所示。随着时间的增长,致死率也在随之增大。当诱变时间为100 s时,致死率达到93.25%,诱变时间为120 s时,致死率达到100%,未发现有活菌存在。当致死率>90%时,菌株突变概率较高,突变幅度较大[19]。因此,选择ARTP诱变时间100 s为本试验的最佳诱变时间。
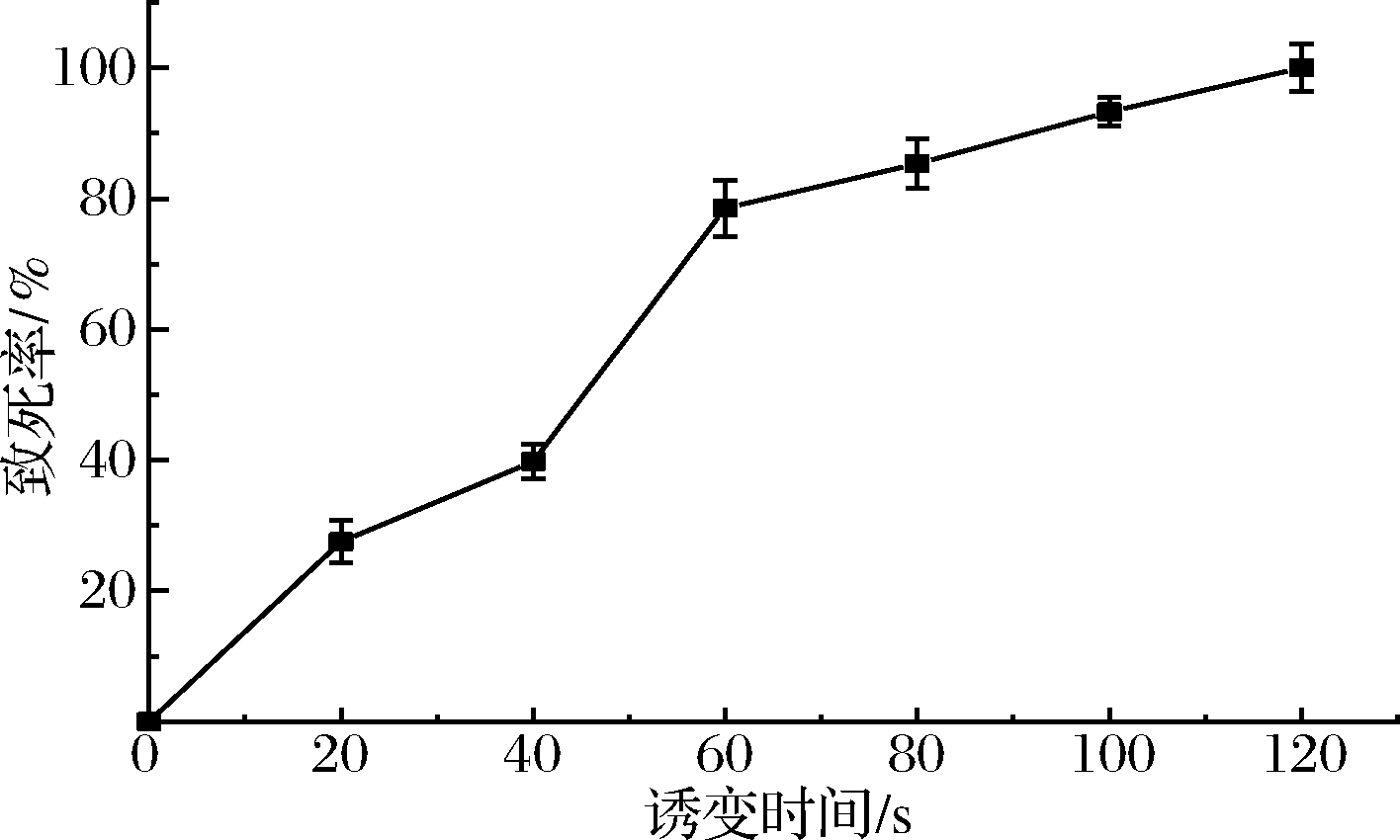
图1 不同辐照下菌株YK致死率
Fig.1 Lethality of YK strains after ARTP
2.2 高耐受性非酿酒酵母初筛
2.2.1 TTC培养基筛选
TTC作为一种显色剂,在培养基上颜色的深浅反应菌株产酒精能力的强弱。产酒精能力越强的菌株,其呼吸酶的活力越旺盛,在显色培养基上的颜色就越深。将通过ARTP诱变获得的35株诱变菌株分别接种到YPD固体培养基上,以原始菌株YK作为对照,显色情况如表1所示。原始菌株YK呈粉色,说明显色为红色的菌株YK-1,YK-8,YK-17,YK-24,YK-27,YK-28,以及深红色的菌株YK-7,YK-12,YK-13,YK-14,YK-20,YK-21,YK-29产酒精能力较原始菌株均有所增强,将筛选得到的13株诱变菌株进行发酵能力筛选试验。
表1 ARTP诱变菌株显色结果
Table 1 Colour result of ARTP mutagenesis strain

菌株编号显色情况菌株编号显色情况YK++YK-18-YK-1+++YK-19++YK-2-YK-20++++YK-3-YK-21++++YK-4+YK-22-YK-5-YK-23-YK-6-YK-24+++YK-7++++YK-25+YK-8+++YK-26-YK-9+YK-27+++YK-10++YK-28+++YK-11-YK-29++++YK-12++++YK-30-YK-13++++YK-31++YK-14++++YK-32+YK-15+YK-33-YK-16+YK-34++YK-17+++YK-35-
注:“++++”表示显深红色;“+++”表示显红色;“++”表示显粉色;“+”表示显淡粉色;“-”表示不显色
2.2.2 杜氏小管发酵能力筛选
将上步筛选得到的13株诱变菌株接种在装有杜氏小管的试管中,产气情况如表2所示。诱变菌株YK-1,YK-8,YK-12,YK-13,YK-24培养8 h就观察到有气体产生,说明诱变菌株起酵能力迅速,且YK-1,YK-8,YK-12起酵能力要优于另外2株;培养12 h后诱变菌株YK-7,YK-21,YK-27未起酵,其余菌株均有气体产生且YK-1,YK-29发酵能力强,已在杜氏小管中产生4/5气体;培养24 h后诱变菌株YK-1,YK-29杜氏小管充满气体已完全浮在液面上;培养36 h原始菌株YK,诱变菌株YK-28杜氏小管充满气体,YK-8,YK-12,YK-13,YK-27发酵能力相同,已产生4/5气体;48 h后除诱变菌株YK-7,YK-20,YK-24未能将杜氏小管中充满气体其余菌株均充满气体。综合考虑诱变菌株YK-14,YK-17,YK-21,YK-27前期起酵速率慢发酵能力弱,因此选择YK-1,YK-8,YK-12,YK-13,YK-28,YK-29起酵能力快,发酵能力强的菌株作为耐受性筛选出发菌株。
2.2.3 乙醇耐受性筛选
非酿酒酵母对乙醇具有较低的耐受性,参与葡萄酒发酵周期较短[20]。因此,筛选高酒精耐受性非酿酒酵母,提高非酿酒酵母存活时间,可以为葡萄酒贡献更多的风味物质。不同乙醇体积分数对菌株活性影响如图2所示。乙醇体积分数在4%以内,原始菌株YK表现出较高的乙醇耐受性,但当乙醇体积分数高于4%时,耐受性均低于其他诱变菌株;诱变菌株YK-1,YK-28,YK-29对乙醇的耐受性整体优于诱变菌株YK-8,YK-12,YK-13;乙醇体积分数在6%以内,诱变菌株均能正常代谢生长;当乙醇体积分数到8%时,6株诱变菌株生长代谢均受到了不同程度的抑制,其中菌株YK-8,YK-12,YK-13代谢缓慢,YPD液体培养基菌液轻微浑浊。
表2 杜氏小管产气结果
Table 2 Du′s tubule gas production result
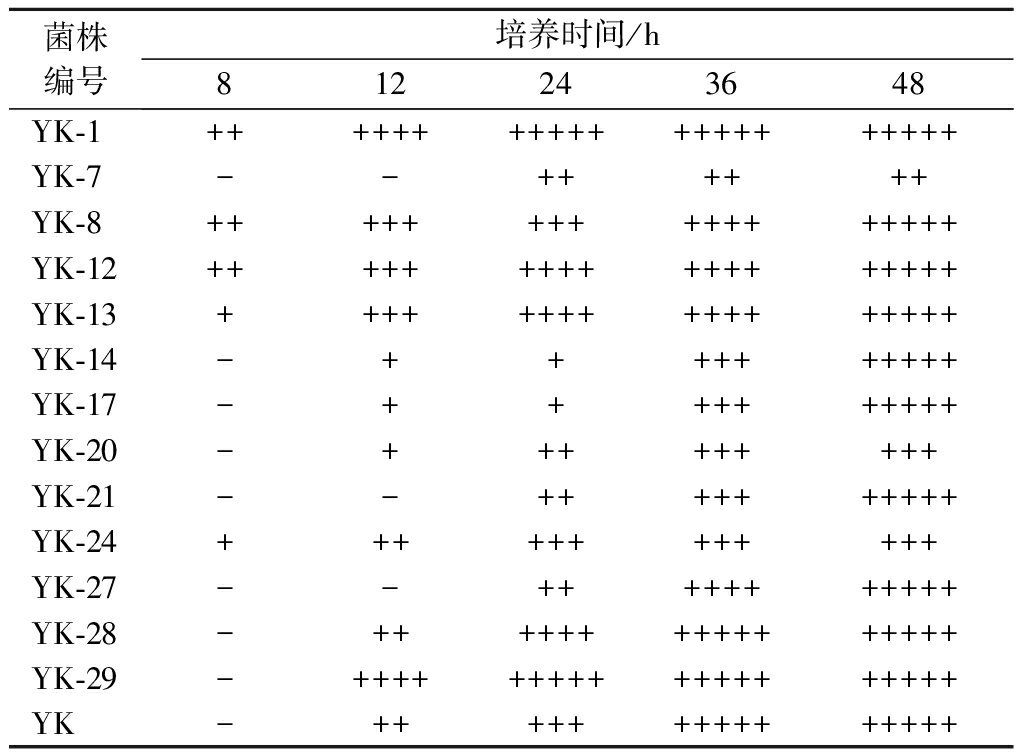
菌株编号培养时间/h812243648YK-1+++++++++++++++++++++YK-7--++++++YK-8+++++++++++++++++YK-12++++++++++++++++++YK-13+++++++++++++++++YK-14-++++++++++YK-17-++++++++++YK-20-+++++++++YK-21--++++++++++YK-24++++++++++++YK-27--+++++++++++YK-28-++++++++++++++++YK-29-+++++++++++++++++++YK-+++++++++++++++
注:“+++++”表示杜氏小管中充满气体;“++++”表示杜氏小管中充满4/5的气体;“+++”表示杜氏小管中充满3/5的气体;“++”表示杜氏小管中充满2/5的气体;“+”表示杜氏小管中充满1/5的气体;“-”表示杜氏小管中没有产生气体

图2 不同乙醇体积分数对菌株代谢的影响
Fig.2 Effect of different ethanol volume fraction on metabolism of strain
2.2.4 二氧化硫耐受性筛选
二氧化硫作为一种在葡萄酒中重要的食品添加剂被广泛使用,在葡萄酒中具有杀菌增酸等多种作用[21]。将原始菌株及诱变菌株接种于YPD液体培养基中,生长情况如图3所示。原始菌株YK及诱变菌株均表现较高的耐受性,代谢生长旺盛,菌液浑浊。二氧化硫质量浓度在60 mg/L以内时,菌株耐受性YK-28>YK-29>YK>YK-8>YK-12>YK-1>YK-13。

图3 不同二氧化碳质量浓度对菌株代谢的影响
Fig.3 Effects of different SO2 mass concentration on metabolism of strains
2.2.5 糖度耐受性筛选
菌株对葡萄糖的耐受性如图4所示。在葡萄糖质量浓度<240 g/L时,原始菌株YK表现出高耐受性,当葡萄糖质量浓度>240 g/L时,原始菌株YK生长代谢受到明显抑制,发酵活力降低;诱变菌株YK-12表现出对葡萄糖的不耐受,在不同葡萄糖质量浓度下,该菌株生长代谢缓慢,无法满足葡萄酒的发酵条件;在葡萄糖质量浓度达到280 g/L时,所有菌株均表现出不耐受。果酒酒精发酵时初始糖度一般<250 g/L[22],所以在葡萄糖质量浓度<250 g/L时除诱变菌株YK-12表现出不耐受,其余6株菌株均表现出一定的耐受性。
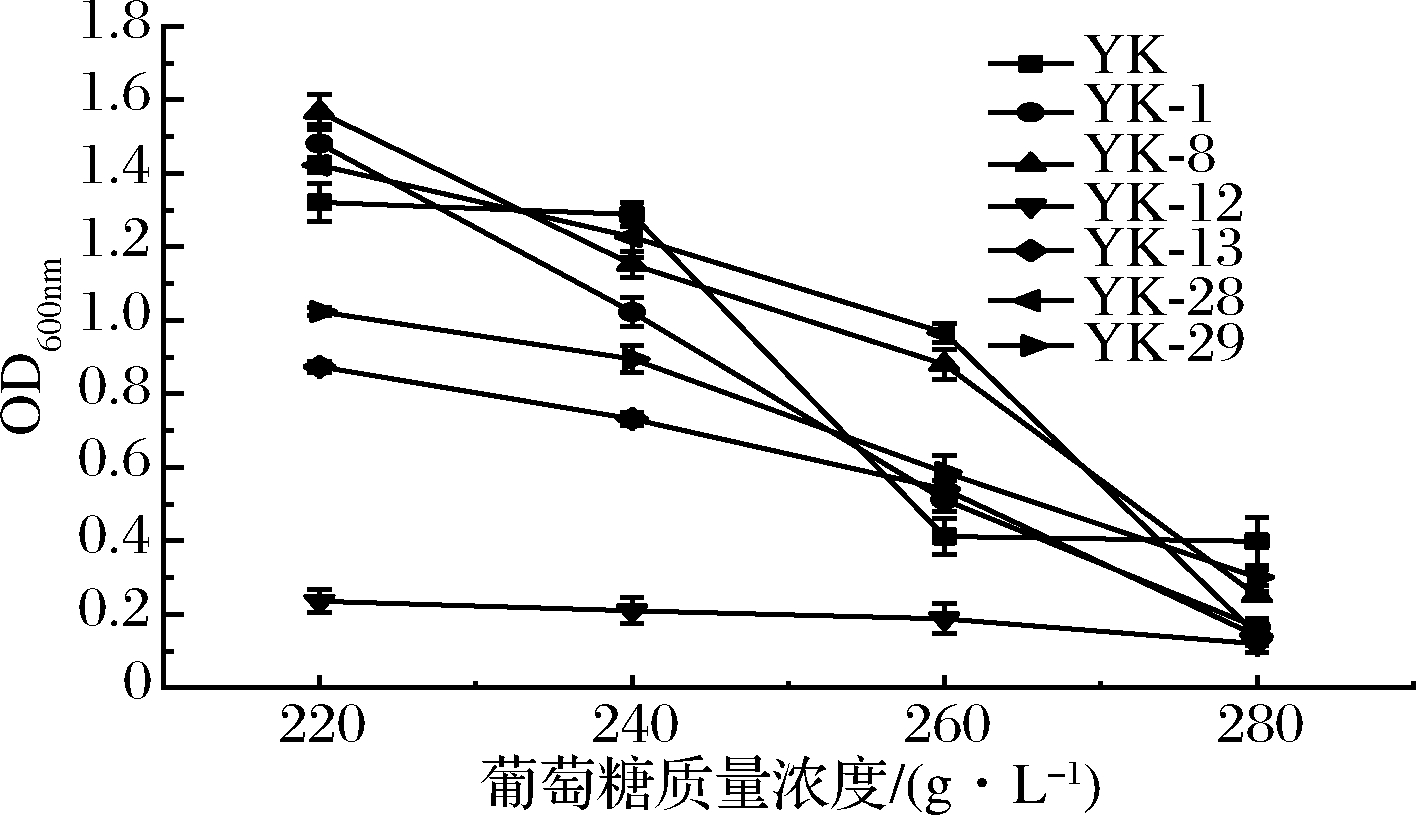
图4 不同葡萄糖质量浓度对菌株代谢的影响
Fig.4 Effect of different glucose mass concentration on metabolism of strain
2.2.6 酸耐受性筛选
发酵过程中,葡萄汁酸度过高会直接影响酵母菌的活性,抑制其代谢生长甚至杀死酵母菌。因此,酵母要有一定的耐酸能力适应复杂的酿酒环境。不同酸度环境对菌株代谢影响如图5所示。诱变菌株YK-12,YK-28在不同pH环境下具有较强的耐受性;诱变菌株YK-8对酸性环境敏感,在酸性环境下生长代谢缓慢;原始菌株YK,诱变菌株YK-1,YK-8,YK-13,YK-29在pH为2.5的高酸性环境中受到了严重抑制,随着pH值的增高菌株生长代谢速率逐渐增强。葡萄酒在发酵过程中pH一般在3.3~3.5,此范围内杂菌会受到抑制,保证葡萄酒品质。因此,原始菌株YK,诱变菌株YK-1,YK-12,YK-13,YK-28,YK-29在此酸度范围内能较好生长。

图5 不同pH值对菌株代谢的影响
Fig.5 Effect of different pH on metabolism of strain
综上所述,结合菌株耐受性分析,选取诱变菌株YK-1,YK-12,YK-28,YK-29进行下一步产香复筛。
2.3 产香非酿酒酵母复筛
发酵衍生的酯类在很大程度上决定了葡萄酒的果味;有机酸影响发酵产品的风味与滋味,也是构成酵母挥发性风味的重要前体物质[23]。采用皂化回流法对耐受性强的4株诱变菌株进行总酯、总酸含量测定,以原始菌株为对照,结果如表3所示。代谢生长72 h后,诱变菌株YK-29发酵液中总酯、总酸含量显著高于其他各组菌株,分别为2.15 g/100mL、0.135%;诱变菌株YK-28产酯能力显著低于对照组;诱变菌株YK-12与对照组产酯能力差异不显著,分别为0.53、0.44 g/100mL。4株诱变菌株的产酸能力均高于对照组,产酸能力由高到低依次为YK-29>YK-12>YK-28>YK-1。
表3 菌株总酯、总酸含量
Table 3 Total ester and total acid content of the strain

菌株总酯含量/[g·(100mL)-1]总酸含量/%YK0.44±0.06c0.032±0.004cYK-11.68±0.11b0.053±0.013bcYK-120.53±0.08c0.062±0.016bYK-280.10±0.03d0.059±0.012bcYK-292.15±0.14a0.135±0.021a
注:同列不同小写字母表示差异显著(P<0.05)(下同)
根据产酯、产酸能力测试,综合分析筛选出产香能力最优的诱变菌株YK-1、YK-29。
2.4 遗传稳定性测试
通过ARTP诱变选育的菌株仍然具有不稳定性,会有回复性突变和隐性突变的可能,因此对诱变菌株进行传代试验是验证菌株传代稳定性的有效方法[24]。将诱变菌株YK-1,YK-29连续传代5次,测定产酸产酯能力,结果如表4所示。诱变菌株YK-1,YK-29产酯能力分别稳定在1.55~1.7、2.02~2.21 g/100mL;产酸能力稳定在0.051%~0.060%、0.131%~0.141%,各代菌株总酯、总酸含量差异不显著,变化幅度小。因此,可以证明诱变菌株YK-1,YK-29产酯、产酸能力可以稳定遗传,发生回复性突变概率较小,可以应用到葡萄酒发酵中。
表4 菌株遗传稳定性测试结果
Table 4 Genetic stability test results of the strain
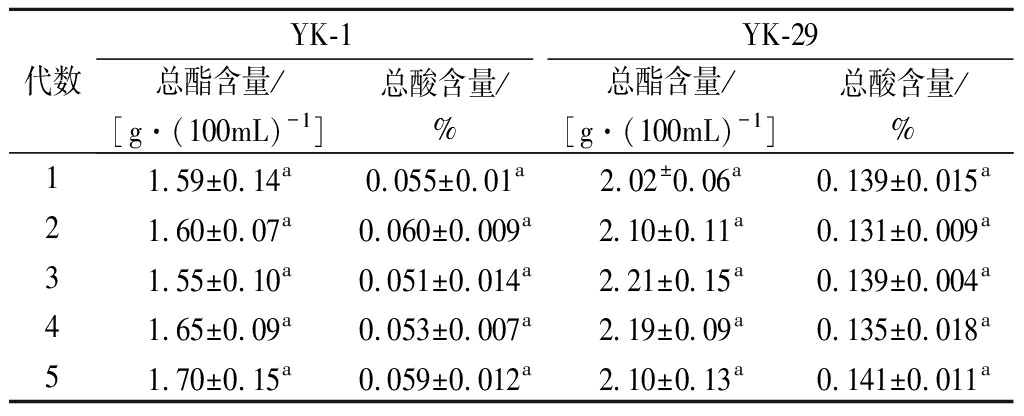
代数YK-1YK-29总酯含量/[g·(100mL)-1]总酸含量/%总酯含量/[g·(100mL)-1]总酸含量/%11.59±0.14a0.055±0.01a2.02±0.06a0.139±0.015a21.60±0.07a0.060±0.009a2.10±0.11a0.131±0.009a31.55±0.10a0.051±0.014a2.21±0.15a0.139±0.004a41.65±0.09a0.053±0.007a2.19±0.09a0.135±0.018a51.70±0.15a0.059±0.012a2.10±0.13a0.141±0.011a
2.5 发酵能力验证
为验证诱变菌株是否有良好的发酵性能,把诱变菌株接种到总糖含量为225 g/L的葡萄汁中进行发酵试验,发酵温度28 ℃,发酵周期为8 d,同时设原始菌株YK为对照组。发酵8 d后菌株产酒精能力如表5所示。诱变菌株YK-1,YK-29产酒精能力显著高于对照组,分别为6.45%、7.31%,产酒精能力分别提高149%和169%,可以更长时间的参与葡萄酒的前期发酵,通过菌株的代谢为葡萄酒提供更多的风味物质。因此,2株诱变菌株均有良好的发酵性能。
表5 菌株发酵能力验证
Table 5 Verification of fermentation ability of strain
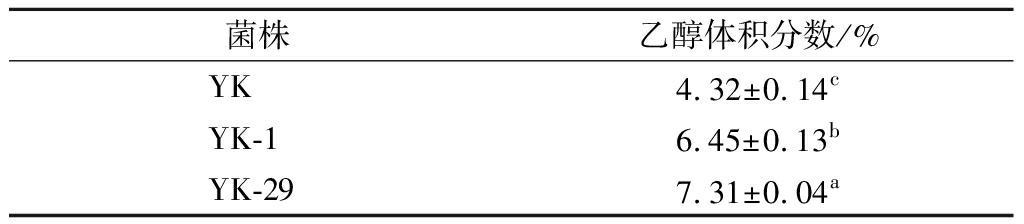
菌株乙醇体积分数/%YK4.32±0.14cYK-16.45±0.13bYK-297.31±0.04a
2.6 产香能力验证
由于非酿酒酵母发酵能力弱,无法独自完成葡萄酒整个发酵过程,一般多采用与商业酿酒酵母混合发酵方式进行葡萄酒发酵[9]。因此,选择将原始菌株YK,诱变菌株YK-1,YK-29与商业酵母以1∶1接种比例接种到葡萄汁进行发酵试验。对3款葡萄酒进行定量描述分析,雷达图如图6所示。3款葡萄酒中主要的香气是花香、水果味、生青味、浆果味、烟熏味、香料味。3款葡萄酒中浆果味、水果味香气突出,2个特征香气强度均高于对照组;花香强度3款酒基本一致;由于酒龄较轻的缘故,3款葡萄酒均带有轻微生轻味,随着酒龄的增长生青味会慢慢消失。整体来看,诱变菌株YK-1,YK-29接种增强了葡萄酒浆果味和水果味,与菌株产酯产酸能力相吻合。
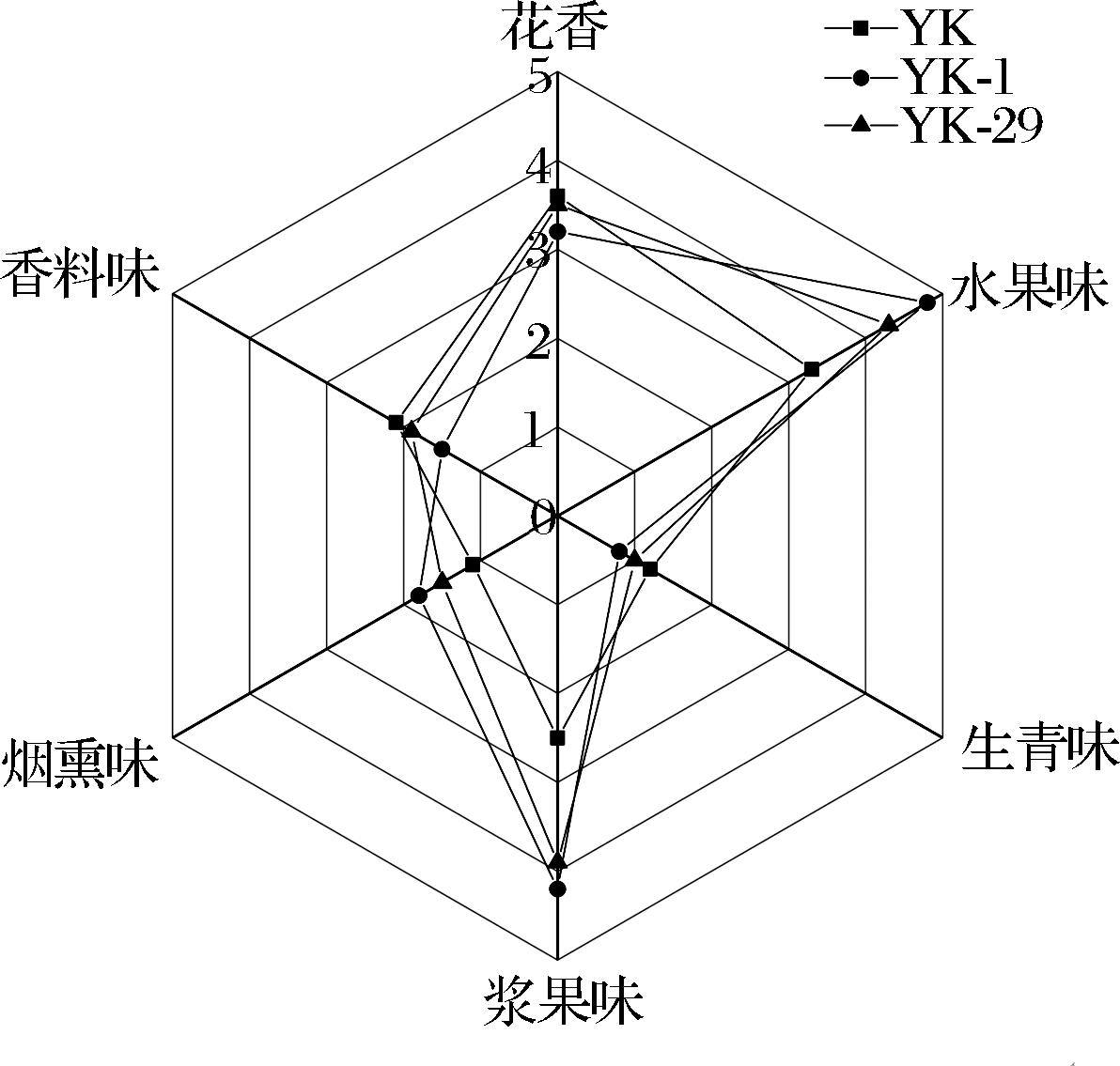
图6 香气特征雷达图
Fig.6 Aroma characteristic radar map
3 结论
本研究通过从葡萄皮表面筛选分离的马克斯克鲁维酵母(Kluyveromyces marxianus)YK经过ARTP诱变后,利用TTC产酒精能力试验,杜氏小管产气试验,耐受性试验和产香试验筛选获得了2株耐受性高,产香能力强的诱变菌株YK-1和YK-29。将诱变菌株连续培养5代,分别接种于葡萄汁中,诱变菌株产酯产酸能力稳定,具有良好的遗传稳定性。与出发菌株YK相比,诱变菌株YK-1,YK-29酿造的葡萄酒产酒精能力分别提高了149%和169%。通过定量描述分析,诱变菌株参与发酵的葡萄酒具有花香、水果味、生青味、浆果味、烟熏味、香料味,其中水果味和浆果香味强度均高于对照组。在葡萄酒发酵过程中诱变菌株的参与可以提高葡萄酒的香气质量,与本次试验目的相符。
目前,对于非酿酒酵母的研究多数集中在其与酿酒酵母共发酵体系中菌种之间的相互作用,以及通过改变2种酵母菌的接种方式,接种比例探究混合发酵体系最佳发酵工艺条件来提高葡萄酒品质等方面,对于非酿酒酵母本身研究较少。本研究以非酿酒酵母本身存在的问题为切入点,对新疆本土非酿酒酵母进行ARTP诱变,经过多轮筛选最终得到能稳定遗传的目标菌株。诱变菌株YK-1,YK-29在葡萄酒中的应用有望改变葡萄酒品质单一化的局面,在葡萄酒酿造生产方面具有更广阔的应用前景。
[1] 王伟雄, 古丽米热·祖努纳, 杜展成, 等.新视角探析微生物对葡萄酒品质的影响[J].中外葡萄与葡萄酒, 2020, 6(14):78-83.
WANG W X, GULIMIRE Z, DU Z C, et al.A new perspective on the influence of microorganisms on wine quality[J].Sino-Overseas Grapevine & Wine, 2020, 6(14):78-83.
[2] LEMA C, GARCIA-JARES C, ORRIOLS I, et al.Contribution of Saccharomyces cerevisiae and non-Saccharomyces cerevisiae populations to the production of some components of albarino wine aroma[J].American Journal of Enology & Viticulture, 1996, 47(2):206-216.
[3] SU Y, SEGUINOT P, BLOEM A, et al.Isotopic tracers unveil distinct fates for nitrogen sources during wine fermentation with two non-Saccharomyces cerevisiae strains[J].Microorganisms, 2020, 8(6):904.
[4] SWANGKEAW J, VICHITPHAN S, BUTZKE C E, et al.Characterization of β-glucosidases from Hanseniaspora sp.and Pichia anomala with potentially aroma-enhancing capabilities in juice and wine[J].World Journal of Microbiology & Biotechnology, 2011, 27(2):423-430.
[5] HEARD G M.Novel yeasts in winemaking-looking to the future[J].Food Australia, 1999, 51(8):347-352.
[6] JOLLY N P, AUGUSTYN O P H, PRETORIUS I S.The use of Candida pulcherrima in combination with Saccharomyces cerevisiae for the production of Chenin Blanc wine[J].South African Journal of Enology & Viticulture, 2003, 24(2):63-69.
[7] CIANI M, COMITINI F, MANNAZZU I, et al.Controlled mixed culture fermentation:A new perspective on the use of non-Saccharomyces cerevisiae yeasts in winemaking[J].FEMS Yeast Research, 2010, 10(2):123-133.
[8] 谭凤玲, 王宝石, 胡培霞, 等.非酿酒酵母在葡萄酒混菌发酵中的应用及其挑战[J].食品与发酵工业, 2020, 46(22):282-286.
TAN F L, WANG B S, HU P X, et al.Application and challenge of non-Saccharomyces cerevisiae yeast in the mixed fermentation of fruit wine[J].Food and Fermentation Industries, 2020, 46(22):282-286.
[9] MINNAAR P P, DU PLESSIS H W, JOLLY N P, et al.Non-Saccharomyces cerevisiae and lactic acid bacteria in co-inoculated fermentations with two Saccharomyces cerevisiae yeast strains:A strategy to improve the phenolic content of syrah wine[J].Food Chemistry, 2019, 10(4): 1-29.
[10] 于洋, 粟春燕, 陈晶瑜.3株葡萄酒非酿酒酵母的生长与发酵特性[J].食品科学, 2015, 36(19):106-111.
YU Y, SU C Y, CHEN J Y.Growth and fermentation characteristics of three non-Saccharomyces cerevisiae wine yeasts [J].Food Science, 2015, 36(19):106-111.
[11] 徐欢欢, 张红兵, 李会宣, 等.常压室温等离子体技术在微生物诱变中的应用进展[J].生物技术进展, 2020, 10(4):358-362.
XU H H, ZHANG H B, LI H X, et al.Application progress of atmospheric and room temperature plasma technology in microbial mutagenesis[J].Current Biotechnology, 2020, 10(4):358-362.
[12] 李小坤. 基于常压室温等离子体诱变技术选育的高核酸酿酒酵母及其特性分析[D].广州:华南理工大学, 2018.
LI X K.Breeding high-yield nucleic acid Saccharomyces cerevisiae with atmospheric and room temperature plasma mutation technology and its characteristic analysis[D].Guangzhou:South China University of Technology, 2018.
[13] 李慧芝, 康振, 李江华, 等.常压室温等离子体诱变扭脱甲基杆菌AM1高产吡咯喹啉醌[J].生物工程学报, 2016, 32(8):1 145-1 149.
LI H Z, KANG Z, LI J H, et al.Mutagenesis of Methylobacterium extorquens AM1 for increasing pyrroloquinoline quinone production by atmospheric and room temperature plasma[J].Chinese Journal of Biotechnology, 2016, 32(8):1 145- 1 149.
[14] 张雪, 张晓菲, 王立言, 等.常压室温等离子体生物诱变育种及其应用研究进展[J].化工学报, 2014, 65(7):2 676- 2 684.
ZHANG X, ZHANG X F, WANG L Y, et al.Recent progress on atmospheric and room temperature plasma mutation breeding technology and its applications [J].CIESC Journal, 2014, 65(7):2 676-2 684.
[15] 杨小冲. 酿酒酵母酒精耐受机理的研究及其在果酒生产中的应用[D].呼和浩特:内蒙古农业大学, 2018.
YANG X C.Alcohol tolerance mechanism of Saccharomyces cerevisiae and its application in wine production[D].Hohhot:Inner MongoliaAgricultural University, 2018.
[16] 王犁烨, 王浩臣, 马珊, 等.常压室温等离子体选育高产酒精及酸的酿酒酵母[J].食品与机械, 2019, 35(5):26-31.
WANG L Y, WANG H C, MA S, et al.Breeding of Saccharomyces cerevisiae high-yield of alcohol and acid by atmospheric room temperature plasma[J].Food & Machinery, 2019, 35(5):26-31.
[17] 廖永红, 沈晗, 石文娟, 等.产香酵母碳源利用及发酵产香特性初步研究[J].食品与发酵工业, 2010, 36(2):1-7.
LIAO Y H, SHEN H, SHI W J, et al.Study on carbon sources utilization and fermentation features of ester-producing yeasts[J].Food and Fermentation Industries, 2010, 36(2):1-7.
[18] 赵鹏涛. 西拉葡萄酒的香气活性物质以及影响瓶装葡萄酒香气因素的研究[D].杨凌:西北农林科技大学, 2017.
ZHAO P T.Characterization of syrah wine aroma and study of the influence factors of the bottle wine flavor[D].Yangling:Northwest A&F University, 2017.
[19] PÉREZ-SANTAESCOL STICA C, CARBALLO J, FULLADOSA E, et al.Effect of proteolysis index level on instrumental adhesiveness,free amino acids content and volatile compounds profile of dry-cured ham[J].Food Research International, 2018, 3(18):559-566.
STICA C, CARBALLO J, FULLADOSA E, et al.Effect of proteolysis index level on instrumental adhesiveness,free amino acids content and volatile compounds profile of dry-cured ham[J].Food Research International, 2018, 3(18):559-566.
[20] 李旋, 亓桂梅, 王超萍.非酿酒酵母在葡萄酒生产中的作用及研究进展[J].中外葡萄与葡萄酒, 2019, 223(1):57-61.
LI X, QI G M, WANG C P.Research progresses and function of non-Saccharomyces cerevisiae in wine production[J].Sino-Overseas Grapevine & Wine, 2019, 223(1):57-61.
[21] 刘静芳, 张博钦, 朱本忠, 等.二氧化硫保鲜剂预处理对葡萄酒香气和生物胺含量的影响[J].中国酿造, 2020, 39(4):32-39.
LIU J F, ZHANG B Q, ZHU B Z, et al.Effect of pretreatment of sulfur dioxide preservative on aroma and biogenic amines contents in wines[J].China Brewing, 2020, 39(4):32-39.
[22] 邢晓莹, 刘毅, 霍乃蕊, 等.山西老陈醋中优良酵母菌株筛选及其在木枣果酒发酵中的应用[J].中国酿造, 2021, 40(3):64-72.
XING X Y, LIU Y, HUO N R, et al.Screening of excellent yeast strains in Shanxi-aged vinegar and their application in jujube wine fermentation[J].China Brewing, 2021, 40(3):64-72.
[23] UGLIANO M, HENSCHKE P A.Yeasts and Wine Flavour[M].New York:Springer,2009.
[24] 邹宗胜, 王婧雅, 赵运英, 等.高产纤维素酶突变株的筛选及其产酶条件优化[J].食品科学, 2019, 40(6):48-54.
ZOU Z S, WANG J Y, ZHAO Y Y, et al.Screening of Trichoderma reesei mutants and optimization of fermentation conditions for higher cellulase production[J].Food Science, 2019, 40(6):48-54.