近年来,随着消费观念的改变和保健品行业的飞速发展,青稞作为具有营养和保健功能的天然绿色谷物广泛受到大众青睐[1]。黑青稞更是一种珍贵的青稞种质资源,相比于白青稞,黑青稞含有更高的营养成分(如粗纤维、脂肪和氨基酸等)和矿物质元素(如钙、磷、铁和锌等)[2]。黑青稞富含的花青素类物质具有清除自由基和抗氧化作用[3],且黑青稞制品对治疗Ⅱ型糖尿病和肥胖症等有明显疗效[4]。基于这些结果,黑青稞具有潜在的应用开发价值。
在食品加工领域中,萌发处理是用来改善种子品质的一种加工方式。据已有报道,谷类作物在经过浸泡处理萌发时,谷物中的酶活性、种类和数量都会显著增加,这使种子的生理代谢过程处在较高的水平,同时加快了谷物中的化学物质及其含量的变化,对人体而言,这些变化大部分是有益的[5]。萌发不仅能有效提高蛋白质和淀粉的消化率和生物利用率,减少抗营养成分[6],还能改变一些活性物质的含量,如具有提高免疫力和调节血脂等功效的β-葡聚糖[7]和具有促进睡眠、抗衰老、抗肿瘤和抗炎作用等多种功效的褪黑素[8]等。CHO等[9]经过萌发处理检测到葵花芽中褪黑素含量为1.53 ng/g,而在种子中未检测到褪黑素;SALEH等[10]发现随着萌发天数的增加,不同品种豆类子叶、胚根和种皮中褪黑素含量(melation content,MC)均显著增加,菜豆褪黑素平均含量在萌发的第6天达到217.78 ng/g,是萌发前的37.23倍;KIM[11]在研究萌发对油菜籽品质的影响时发现,MC在2~6 d显著增加,第6天MC达到14.93 ng/g;总酚含量(total phenolic content,TPC)在第8天达到最大为19.2 mg/g;此外,苟美玲等[12]研究发现萌发显著增加了青稞的TPC和总黄酮含量(total flavonoid content,TFC),分别达到2.96和2.34 mg/g;TANG等[13]也发现萌发增加了不同粒色青稞TPC和TFC;张伊迪等[14]发现在22 ℃下培养9~21 h的青稞中β-葡聚糖含量(β-glucan content,GC)最高为10.01%,是未处理前的1.27倍,但大部分报道都是萌发会降低GC[15]。也有研究报道,鹰嘴豆种皮中酚类化合物的种类和含量显著高于子叶部分,显现出更强的抗氧化能力[16]。综上,萌发可以增加谷物的活性成分且存在组织间差异。
目前关于黑青稞的研究主要集中在营养成分的测定及活性成分的提取等方面,萌发处理对黑青稞影响的研究鲜有报道。因此本实验重点研究了萌发对黑青稞子叶、种皮和胚根中GC、MC、TPC、TFC及其抗氧化能力的影响。此外,还对青稞不同组织间活性成分和抗氧化能力进行了相关性分析,这些研究有助于了解黑青稞主要功能活性成分与抗氧化能力之间的关系,并为萌发黑青稞功能性食品的开发提供有用信息。
1 材料与方法
1.1 试剂与仪器
黑青稞由西藏自治区农牧科学院提供;ABTS、甲醇、过硫酸钾、Folin-酚试剂、没食子酸标准品(纯度≥98%)、芦丁标准品(纯度≥98%),国药集团化学试剂有限公司;DPPH、水杨酸、刚果红、三水醋酸钠、FeCl3·6H2O、冰乙酸、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox)、2,4,6-三嘧啶基三嗪[2,4,6-Tris(2-pyridyl)-s-triazine,TPTZ],上海阿拉丁生化科技有限公司;β-葡聚糖标准品(纯度≥99%),美国Sigma公司。其余试剂均为分析纯。Plant MT ELISA kit,上海桥杜生物科技有限公司。
030S超声波清洗仪,深圳市超洁科技实业有限公司;D3024R台式高速冷冻型微量离心机,北京大龙兴创实验仪器有限公司;SPECTRAMAX M5酶标仪,上海赛默飞世尔仪器有限公司;UV-5200紫外可见分光光度计,上海元析仪器有限公司;LGJ-12真空冷冻干燥机,北京松源华兴科技有限公司;YRG-150光照种子发芽箱,上海合恒仪器设备有限公司。
1.2 实验方法
1.2.1 种子萌发
称取100 g黑青稞,用1 g/L的高锰酸钾溶液消毒5 min。用纯水润洗后浸泡10 h,以使种子水合(种子与水料液比为1∶20,g∶mL),然后置于光照种子发芽箱中(相对湿度为80%,光周期为12 h光照/12 h黑暗),萌发7 d,同时每天换水。选取长势均匀的萌发3~7 d的黑青稞幼苗,分别将其子叶、种皮和胚根分离,经真空冷冻干燥,粉碎后过80目筛,装在棕色塑料器皿中,置于4 ℃冰箱保存,备用。
1.2.2 样品提取液的制备
根据SALEH等[10]的提取方法略作修改。称取0.1 g样品加入2 mL 50%甲醇溶液振荡混匀。在黑暗、4 ℃条件下过夜处理,之后将样品水浴超声30 min,离心(10 000×g,15 min,4 ℃),收集上清液,重复上述操作,合并上清液用棕色样品管贮存,并调整最终体积为2 mL,所得提取物用于褪黑素、β-葡聚糖、总酚和总黄酮含量及抗氧化能力的测定。
1.2.3 活性成分的测定
1.2.3.1 MC的测定
MC采用双抗体一步夹心法酶联免疫吸附试验(enzyme linked immuno sorbent assay,ELISA)测定,操作步骤按照Plant MT ELISA Kit试剂盒说明书进行。
1.2.3.2 GC的测定
GC使用刚果红法测定,取1 mL样品提取液于试管中,用纯水补至2 mL,再加入4 mL刚果红溶液(取0.01 g刚果红溶于100 mL浓度为0.1 mol/L pH 8.0的磷酸盐缓冲液),摇匀放置30 min,于523 nm处测定吸光值。β-葡聚糖标准曲线:y=0.353 3x-0.012 9(0~1.2 mg/mL,R2=0.994 6)。
1.2.3.3 TPC的测定
TPC的测定根据SHEN等[17]的方法略作修改,取0.1 mL样品提取液于试管中,加入0.1 mL Folin-酚试剂混匀,静止反应6 min。然后再加入1 mL的70 g/L碳酸钠溶液,最后加入纯水调整最终体积为3.6 mL。室温下避光反应90 min,在760 nm处测定吸光度。没食子酸标准曲线:y=2.549x+0.057(0~0.5 mg/mL,R2=0.994 5)。
1.2.3.4 TFC的测定
TFC的测定根据WANG等[18]的方法略作修改。取0.2 mL样品提取液于试管中,添加0.2 mL 50 g/L的碳酸钠溶液静止反应6 min,再添加0.2 mL 100 g/L的硝酸铝溶液静止反应6 min,最终加入2 mL 40 g/L的氢氧化钠溶液,并用纯水调整体积为3.8 mL。室温下避光反应15 min,并在510 nm处测定吸光值。芦丁标准曲线为:y=11.895x+0.015 7(0~0.1 mg/mL,R2=0.999 9)。
1.2.4 抗氧化能力测定
1.2.4.1 DPPH自由基清除能力测定
根据KIM[11]的方法分析了样品的DPPH自由基清除能力。首先制备100 mmol/L的 DPPH甲醇溶液,然后用80%(体积分数)甲醇溶液稀释为0.1 mmol/L的工作液。将0.1 mL样品提取液于试管中,加入2 mL稀释后的DPPH工作液,用80%甲醇补足体积为4 mL混匀,于黑暗条件下反应30 min,并在517 nm处测量吸光度。以Trolox浓度为横坐标,吸光度为纵坐标绘制标准曲线:y=-2.175 6x+0.532 3(0~0.2 mg/mL,R2=0.996 6),结果以Trolox当量计(mg Trolox equivalent/g)。
1.2.4.2 ABTS阳离子自由基清除能力测定
取0.031 g过硫酸钾溶解后,转入50 mL容量瓶中,再加入0.192 g ABTS试剂,摇匀后室温下放置12~16 h(产生ABTS阳离子自由基),然后用80%甲醇稀释使其在734 nm处吸光度为0.7±0.02(现配现用)。取0.2 mL样品提取液于试管中加入4 mL ABTS工作液,用80%甲醇溶液补足体积为5 mL,避光反应30 min,并在734 nm处测定吸光值。以Trolox浓度为横坐标,吸光度为纵坐标绘制标准曲线:y=-4.353 1x+0.504 4(0~0.08 mg/mL,R2=0.995 8),结果以Trolox当量计(mg Trolox equivalent/g)。
1.2.4.3 Fe3+还原能力(ferric reducing antioxidant power,FRAP)测定
根据KIM[11]的方法测定样品的FRAP。以体积比10∶1∶1 混合0.3 mmol/L的醋酸钠缓冲液(pH 3.6),0.01 mmol/L的TPTZ溶液(溶于40 mmol/L盐酸溶液)和0.02 mmol/L的三氯化铁来制备FRAP溶液,使用前37 ℃下预热。取0.2 mL样品提取液与4 mL FRAP工作液混合,避光反应30 min,在593 nm处测定吸光值。以Trolox浓度为横坐标,吸光度为纵坐标绘制标准曲线:y=6.397 4x+0.130 5(0~0.3 mg/mL,R2=0.998 9),结果以Trolox当量计(mg Trolox equivalent/g)。
1.2.5 统计分析
实验所有对象均设置3组重复,以平均值±标准差表示,使用Duncan′s多重比较进行显著性分析,显著性检验水平P<0.05表示差异显著,P<0.01表示差异极显著。使用Origin 2019软件进行绘图;使用SPSS 22.0软件对黑青稞不同组织中活性成分含量与抗氧化能力进行相关性分析。
2 结果与分析
2.1 黑青稞种子中活性成分及抗氧化能力
如表1所示,黑青稞中GC为(62.82±0.07) mg/g,远高于小麦和燕麦等,约为小麦平均含量的50倍[19]。黑青稞中MC为(5.88±0.05) ng/g,高于其他植食性植物种子的报道,如水稻(1.50 ng/g)、玉米(1.88 ng/g)和燕麦(2.00 ng/g)[20],是一种良好的膳食褪黑素来源。黑青稞中TPC和TFC分别为(3.05±0.03) mg/g和(0.40±0.01) mg/g,与邢玉晓[21]报道的云南迪庆长黑青稞TPC为2.84 mg/g,TFC为0.58 mg/g数据相似。青稞中含有多种酚类化合物,如阿魏酸、异阿魏酸、儿茶酸和类黄酮等,而且青稞中的黄酮类化合物还具有抗菌、抗氧化和降血糖等功效[7]。青稞中富含多种功能活性物质,具有很好的抗氧化能力,是一种天然的抗氧化活性食品。
表1 黑青稞种子的β-葡聚糖、褪黑素、总酚和总黄酮含量和抗氧化能力
Table 1 β-glucan, melatonin, total phenol and total flavonoid contents and antioxidant capacity of raw black barley

名称GC/(mg·g-1)MC/(ng·g-1)TPC/(mg·g-1)TFC/(mg·g-1)抗氧化能力/(mg Trolox equivalent·g-1)FRAPDPPHABTS黑青稞62.82±0.075.88±0.053.05±0.030.40±0.013.42±0.011.79±0.020.51±0.07
2.2 黑青稞萌发过程中不同组织GC的变化
如图1所示,黑青稞子叶中GC随萌发时间的增加,显著减少。种皮和胚根中GC出现相似的变化趋势,随萌发时间的延长,先增加后下降。子叶、种皮和胚根中GC最低均在萌发的第7天,与第3天相比,平均降解了34.26%。王波等[22]也发现隆子黑青稞在萌发期间GC显著降低,前3 d下降最快,降低了43.75%。在本实验中,黑青稞不同组织GC变化趋势不完全相同,就整体而言,萌发降低了GC。这可能是因为黑青稞在浸泡萌发时,激活胚上皮细胞分泌大量赤霉酸,刺激胚乳糊粉层合成葡聚糖酶,水解黑青稞细胞间的β-葡聚糖[23]。黑青稞萌发过程中葡聚糖和葡聚糖酶共同作用,在萌发初期葡聚糖合成酶强于葡聚糖酶[24],所以种皮和胚根中GC增加,但后期葡聚糖酶活力增强,GC随萌发时间延长而减少;在子叶中可能葡聚糖合成酶一直低于葡聚糖酶,导致GC持续降低。

图1 萌发对黑青稞不同组织GC的影响
Fig.1 Effect of germination on the GC content in different tissues of black barley 注:图中不同小写字母表示差异显著(P<0.05)(下同)
2.3 黑青稞萌发过程中不同组织MC的变化
如图2可知,黑青稞子叶、种皮和胚根的MC随萌发时间的延长呈现不同的变化规律。在萌发的1~7 d内,子叶和胚根中MC均在发芽第5天达到最大值,分别为(6.56±0.19) ng/g和(6.87±0.05) ng/g。种皮中MC呈下降趋势,萌发第7天MC相对于第3天下降了11.68%。子叶和胚根MC的增加可能是随着种子的萌发形成大量的叶绿体和线粒体,导致褪黑素合成加快,因为正常情况下叶绿体和线粒体是植物产生褪黑素的主要场所[25]。研究表明,褪黑素在植物发育过程中起着生长调节剂的作用,在种子萌发时,褪黑素会参与胚芽鞘和根系的生长[26],因此种皮中MC呈下降趋势,可能是种子中原有的褪黑素被运输到根和芽中参与植物的生长。

图2 萌发对黑青稞不同组织MC的影响
Fig.2 Effect of germination on MC in different tissues of black barley
2.4 黑青稞萌发过程中不同组织TPC的变化
如图3所示,黑青稞TPC受萌发时间和组织部位的影响,子叶和胚根中总酚含量没有固定的变化趋势,种皮中TPC整体呈上升趋势,在萌发的第7天达到最大为(7.1±0.20) mg/g,是萌发前的1.93倍。这种增加可能归因于发芽期间,胚乳中大量营养成分溶解用于新的酚类化合物的合成以及种胚乳中存在的酯或糖苷形式的酚类化合物的水解所致[27];TANG等[13]也报道了不同粒色青稞萌发期TPC的类似增加。以上表明黑青稞萌发过程中TPC因组织不同存在差异,种皮中总酚含量最高。

图3 萌发对黑青稞不同组织TPC的影响
Fig.3 Effect of germination on TPC in different tissues of black barley
2.5 黑青稞萌发过程中不同组织TFC的变化
如图4所示,随着萌发时间的延长,子叶和胚根中TFC几乎没有变化,种皮中TFC先下降后增加,在萌发的第7天达到(0.50±0.003) mg/g,相比于第3天增加了51.52%,TFC的变化规律与TPC类似。胚乳中TFC的增加可能是萌发激活了葡萄糖苷酶催化糖苷的分解,从而使黑青稞中黄酮得到生物合成,如苟美玲等[12]研究发现,发芽后青稞的TFC提高了101.7%;张桂芳等[28]研究黑豆芽不同组织中TFC变化规律发现胚芽中TFC最高为3.95 g/100g,胚轴和胚根次之,与本实验结果有一定差异,原因可能是由于品种间差异,但都说明了TFC因芽苗组织部位不同存在差异。以上表明黑青稞萌发过程中TFC因组织不同存在差异,种皮中TFC最高。

图4 萌发对黑青稞不同组织TFC的影响
Fig.4 Effect of germination on TFC in different tissues of black barley
2.6 黑青稞萌发过程中不同组织抗氧化能力的变化
本文采用了FRAP法、DPPH法和ABTS法分析了萌发对黑青稞不同组织抗氧化能力的影响,结果以生育酚的水溶性衍生物Trolox当量表示,其结果如图5所示。
黑青稞子叶、种皮和胚根的抗氧化能力随萌发时间的延长出现不同的变化规律。如图5-a所示,子叶中FRAP还原能力在萌发第4天达到最大(0.50±0.008) mg Trolox equivalent/g,种皮和胚根中FRAP还原能力均在萌发的第7天达到最大,分别为(6.24±0.004)、(0.88±0.005) mg Trolox equivalent/g。其中种皮的平均FRAP还原能力最大,子叶最小。这可能是萌发过程中不同组织酚类化合物含量变化引起的,据研究资料显示,FRAP还原能力与TPC密切相关[12]。而且在整个发芽期间种皮和胚根的FRAP还原能力与TFC和TPC的变化规律一致。如图5-b所示,子叶中DPPH自由基清除能力在萌发第4天达到最大为(0.47±0.008) mg Trolox equivalent/g,种皮和胚根中DPPH自由基清除能力均在萌发的第7天达到最大,分别为(4.47±0.010)、(1.60±0.630) mg Trolox equivalent/g。其中种皮的平均DPPH自由基清除能力最大,胚根次之。在整个发芽期间子叶、种皮和胚根的DPPH自由基清除能力与TFC的变化规律一致。如图5-c所示,子叶中ABTS阳离子自由基清除能力随萌发时间的延长呈下降趋势,在萌发第3天最大为(1.48±0.005) mg Trolox equivalent/g,萌发的第7天相对于第3天下降了40.20%,种皮和胚根中ABTS阳离子自由基清除能力均在萌发的第7天达到最大,分别为(2.05±0.007)、(1.08±0.010) mg Trolox equivalent/g。其中种皮的平均ABTS阳离子自由基清除能力最大,胚根最小。在萌发的3~4 d内,子叶的ABTS阳离子自由基清除能力显著大于种皮和胚根,宋妍等[29]研究发现由于实验组有较高的GC,导致实验组与对照组的ABTS阳离子自由基清除能力无显著差异,因此子叶具有强ABTS阳离子自由基清除能力的原因可能是子叶具有较高的GC。
尽管这3种分析方法测定抗氧化能力的机理并不完全相同, 但上述实验结果一致表明黑青稞在萌发过程中种皮具有更高的抗氧化能力。在已有的报道中也发现了类似的结果,如AGUILERA等[30]发现扁豆在萌发期间种皮是抗氧化能力最高的组织,比胚乳高6.24倍,比胚根高2.06倍。

a-FRAP还原能力;b-DPPH自由基清除能力;c-ABTS阳离子自由基清除能力
图5 萌发对黑青稞不同组织抗氧化能力的影响
Fig.5 Effect of germination on the antioxidant capacity of different tissues of black barley
2.7 黑青稞不同组织活性成分与抗氧化能力的相关性分析
黑青稞子叶中活性成分与抗氧化能力的相关性分析结果如表2所示。子叶中GC与ABTS阳离子自由基清除能力呈极显著的正相关(P<0.01);TPC与FRAP还原能力、DPPH自由基清除能力和ABTS阳离子自由基清除能力呈极显著的正相关(P<0.01);TFC与FRAP还原能力和DPPH自由基清除能力呈极显著的正相关(P<0.01)。这说明子叶中TPC和TFC是FRAP还原能力和DPPH自由基清除能力的主要贡献者;GC和TPC是ABTS阳离子自由基清除能力的主要贡献者。
表2 黑青稞子叶中活性成分与抗氧化能力的相关性分析
Table 2 Correlation analysis of cotyledons active components and antioxidant capacity of black barley
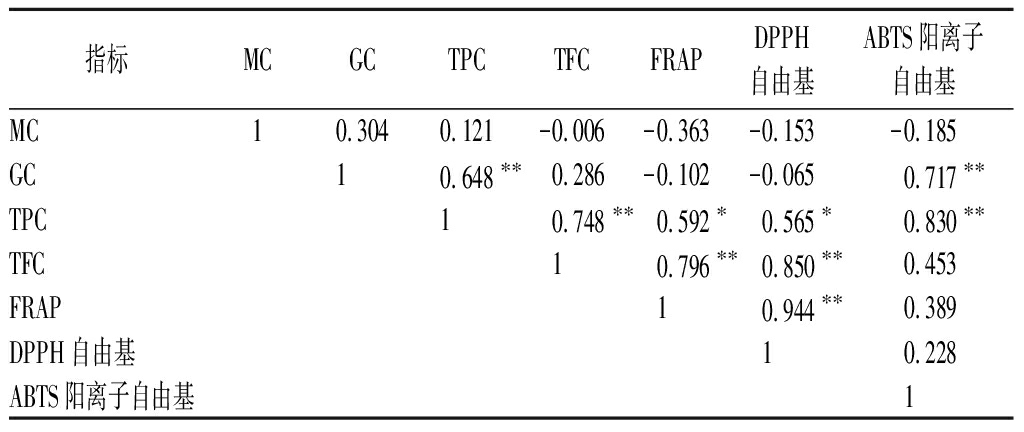
指标MCGCTPCTFCFRAPDPPH自由基ABTS阳离子自由基MC10.3040.121-0.006-0.363-0.153-0.185GC10.648∗∗0.286-0.102-0.0650.717∗∗TPC10.748∗∗0.592∗0.565∗0.830∗∗TFC10.796∗∗0.850∗∗0.453FRAP10.944∗∗0.389DPPH自由基10.228ABTS阳离子自由基1
注:**表示在0.01水平(双侧)上显著极相关;*表示在0.05水平(双侧)上显著相关(下同)
黑青稞种皮中活性成分与抗氧化能力的相关性分析结果如表3所示。种皮中MC和GC均与FRAP还原能力、DPPH自由基清除能力和ABTS阳离子自由基清除能力呈极显著的负相关(P<0.01);TPC和TFC与之相反,分别呈极显著的正相关(P<0.01)。这说明在黑青稞种皮中TPC和TFC才是主要的抗氧化活性物质。
表3 黑青稞种皮中活性成分与抗氧化能力的相关性分析
Table 3 Correlation analysis of seed coat active components and antioxidant capacity of black barley

指标MCGCTPCTFCFRAPDPPH自由基ABTS阳离子自由基MC10.781∗∗-0.864∗∗-0.958∗∗-0.860∗∗-0.827∗∗-0.900∗∗GC1-0.928∗∗-0.876∗∗-0.893∗∗-0.927∗∗-0.898∗∗TPC10.957∗∗0.946∗∗0.940∗∗0.970∗∗TFC10.962∗∗0.940∗∗0.984∗∗FRAP10.993∗∗0.991∗∗DPPH自由基10.976∗∗ABTS阳离子自由基1
黑青稞胚根中活性成分与抗氧化能力的相关性分析结果如表4所示。胚根中MC与FRAP还原能力和DPPH自由基清除能力呈极显著的负相关(P<0.01);GC与FRAP还原能力和ABTS阳离子自由基清除能力呈极显著的负相关(P<0.01);TPC与FRAP还原能力、DPPH自由基清除能力和ABTS阳离子自由基清除能力均呈极显著的正相关(P<0.01);TFC与FRAP还原能力和DPPH自由基清除能力呈极显著的正相关(P<0.01)。这说明胚根中TPC和TFC是FRAP还原能力和DPPH自由基清除能力的主要贡献者;TPC是ABTS阳离子自由基清除能力的主要贡献者。
表4 黑青稞胚根中活性成分与抗氧化能力的相关性分析
Table 4 Correlation analysis of radicle active components and antioxidant capacity of black barley
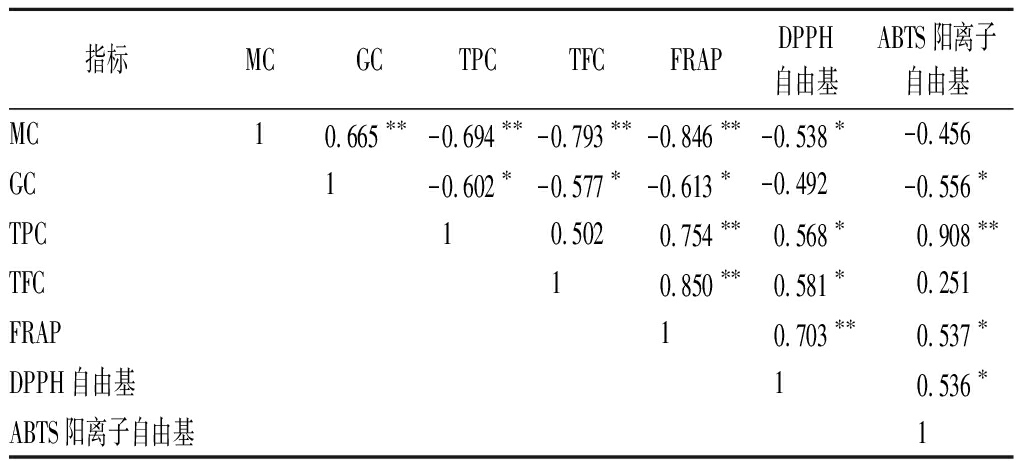
指标MCGCTPCTFCFRAPDPPH自由基ABTS阳离子自由基MC10.665∗∗-0.694∗∗-0.793∗∗-0.846∗∗-0.538∗-0.456GC1-0.602∗-0.577∗-0.613∗-0.492-0.556∗TPC10.5020.754∗∗0.568∗0.908∗∗TFC10.850∗∗0.581∗0.251FRAP10.703∗∗0.537∗DPPH自由基10.536∗ABTS阳离子自由基1
3 结论
在黑青稞萌发过程中,随萌发时间的延长,子叶、胚根中GC减少,TPC和TFC波动;种皮中GC减少,TPC和TFC增加。在萌发的第7天与第3天相比,子叶、胚根和种皮中GC分别降低了24.86%、44.90%和33.03%;种皮中TPC和TFC分别增加了26.35%和48.67%。子叶和胚根中MC均在萌发第5天达到最大值,相比于第3天分别增加了8.42%和10.60%,种皮中MC呈下降趋势,萌发第7天比第3天减少了11.68%。不同组织平均MC为:胚根>子叶>种皮。抗氧化能力结果显示,子叶、种皮和胚根的抗氧化能力呈现不同的变化规律,其中种皮具有更高的抗氧化能力。相关分析结果表明,除子叶中β-葡聚糖是清除ABTS阳离子自由基的主要贡献者外,黑青稞不同组织具有较强的抗氧化能力与TPC和TFC显著相关(R2=0.565~0.984)。这些结果揭示了黑青稞可以作为天然抗氧化食品的来源,也为对黑青稞相关食品的开发奠定理论基础。而且在已有的报道中还未有人涉及青稞不同组织活性成分组成的研究,而对于青稞不同组织酚类化合物的具体成分的探究,也是今后研究的方向。
[1] 谭大明, 谭海运, 刘国一, 等.西藏不同黑青稞品种的农艺性状和营养品质分析[J].麦类作物学报, 2018, 38(2):142-147.
TAN D M, TAN H Y, LIU G Y, et al.Analysis of agronomic characters and nutritional quality of different black highland barley varieties in Tibet[J].Journal of Triticeae Crops, 2018, 38(2):142-147.
[2] 林津, 洛桑仁青, 周陶鸿, 等.西藏山南隆子县黑青稞与白青稞的营养成分及生理活性物质的比较分析[J].食品科技, 2016, 41(10):88-92.
LIN J, LUOSANG R Q, ZHOU T H, et al.Analysis of nutrient ingredients and physiological active substances in black and white hullessbarley from Shannan Longzi in Tibet[J].Food Science and Technology, 2016, 41(10):88-92.
[3] 杜道坤, 贺娟, 孟利东, 等.黑青稞花色苷提取及抗氧化活性的分析[J].江苏农业科学, 2017, 45(18):173-179.
DU D K, HE J, MENG L D, et al.Extraction of anthocyanin and analysis of antioxidant activity of black barley [J].Jiangsu Agricultural Sciences, 2017, 45(18):173-179.
[4] GUO T L, HORVATH C, CHEN L, et al.Understanding the nutrient composition and nutritional functions of highland barley (Qingke):A review[J].Trends in Food Science & Technology, 2020, 103:109-117.
[5] CHO D H, LIM S T.Germinated brown rice and its bio-functional compounds[J].Food Chemistry, 2016, 196:259-271.
[6] ZHANG G, XU Z C, GAO Y Y, et al.Effects of germination on the nutritional properties, phenolic profiles, and antioxidant activities of buckwheat[J].Journal of Food Science, 2015, 80(5):1 111-1 119.
[7] 罗静, 李玉锋, 胥霞.青稞中的活性物质及功能研究进展[J].食品与发酵工业, 2018, 44(9):300-304.
LUO J, LI Y F, XU X.Research progress of bioactive components in hulless barley [J].Food and Fermentation Industries, 2018,44(9):300-304.
[8] NABAVI S M, NABAVI S F, SUREDA A, et al.Anti-inflammatory effects of melatonin:A mechanistic review[J].Critical Reviews in Food Science and Nutrition, 2019,59(sup1):S4-S16.
[9] CHO M H, NO H K, PRINYAWIWATKUL W.Chitosan treatments affect growth and selected quality of sunflower sprouts[J].Journal of Food Science, 2008, 73(1):70-77.
[10] SALEH H M, HASSAN A A, MANSOUR E H, et al.Melatonin, phenolics content and antioxidant activity of germinated selected legumes and their fractions[J].Journal of the Saudi Society of Agricultural Sciences, 2019, 18(3):294-301.
[11] KIM S J.Changes in approximate composition, antioxidant activity and melatonin content of rapeseed during germination[J].Korean Journal of Food Preservation, 2016, 23(6):839-847.
[12] 苟美玲, 张静.发芽对青稞的营养成分和抗氧化活性的影响[J].食品工业科技, 2020, 41(3):86-89;97.
GOU M L, ZHANG J.Effects of germination on the nutrient and antioxidant activity of barley[J].Science and Technology of Food Industry, 2020, 41(3):86-89;97.
[13] TANG Y, XIAO L, WU X Y, et al.Impact of germination pretreatment on the polyphenol profile, antioxidant activities, and physicochemical properties of three color cultivars of highland barley[J].Journal of Cereal Science, 2021, 97:103152.
[14] 张伊迪, 周选围.青稞籽粒中β-葡聚糖在发芽过程中的变化[J].中国农学通报, 2014, 30(24):294-298.
ZHANG Y D, ZHOU X W.Analysis of the β-glucan content changesin germination process of highland barley kernels[J].Chinese Agricultural Science Bulletin, 2014, 30(24):294-298.
[15] MARCONI O, TOMASI I, DIONISIO L, et al.Effects of malting on molecular weight distribution and content of water-extractable β-glucans in barley[J].Food Research International, 2014, 64:677-682.
[16] SREERAMA Y N, SASHIKALA V B, PRATAPE V M.Variability in the distribution of phenolic compounds in milled fractions of chickpea and horse gram:Evaluation of their antioxidant properties[J].Journal of Agricultural & Food Chemistry, 2010, 58(14):8 322-8 330.
[17] SHEN Y B, HU C R, ZHANG H, et al.Characteristics of three typical Chinese highland barley varieties:Phenolic compounds and antioxidant activities[J].Journal of Food Biochemistry, 2017,42(2):e12488.
[18] WANG J F, BIAN Z X, WANG S M, et al.Effects of ultrasonic waves, microwaves, and thermal stress treatment on the germination of Tartary buckwheat seeds[J].Journal of Food Process Engineering, 2020, 43(10):e13494.
[19] 游茂兰, 覃小丽, 段娇娇, 等.超声-微波协同提取青稞β-葡聚糖[J].食品与发酵工业, 2019, 45(8):178-183.
YOU M L, QIN X L, DUAN J J, et al.Ultrasonic-microwave synergistic extraction of β-glucan from hull-less barley[J].Food and Fermentation Industries, 2019, 45(8):178-183.
[20] NAWAZ M A, HUANG Y, BIE Z L et al.Melatonin:Current status and future perspectives in plant science[J].Frontiers in Plant Science, 2015, 6:1 230.
[21] 邢玉晓. 不同品种青稞的抗氧化活性及抗氧化作用的研究[D].重庆:西南大学, 2017.
XING Y X.Study on the antioxidant activities and antioxidant effects in different varrrieties of hull-less barley [D].Chongqing:Southwest University, 2017.
[22] 王波, 张文会.3种青稞发芽过程中营养物质的变化[J].食品研究与开发, 2019, 40(6):26-30;35.
WANG B, ZHANG W H.Nutrient changes of three species of highland barley during germination[J].Food Research and Development,2019, 40(6):26-30;35.
[23] 李婷玉, 杜艳, 陈正行, 等.胁迫萌发对青稞籽粒中β-葡聚糖和γ-氨基丁酸含量的影响[J].中国粮油学报, 2021,36(6):30-35.
LI T Y, DU Y, CHEN Z X, et al.Effects of highland barley seed germination under stress on contents of β-glucan and γ-aminobutyric acid[J].Journal of the Chinese Cereals and Oils Association, 2021,36(6):30-35.
[24] 邓俊琳, 朱永清, 陈建, 等.青稞萌动过程中β-葡聚糖、γ-氨基丁酸和多酚的含量研究[J].中国粮油学报, 2018, 33(7):19-25.
DENG J L, ZHU Y Q, CHEN J, et al.Contents of β-glucan, γ-aminobutyric acid and polyphenol in highland barley during germination [J].Journal of the Chinese Cereals and Oils Association, 2018, 33(7):19-25.
[25] 王蕊, 杨小龙, 须晖, 等.高等植物褪黑素的合成和代谢研究进展[J].植物生理学报, 2016, 52(5):615-627.
WANG R, YANG X L, XU H, et al.Research progress of melatonin biosynthesis and metabolism in higher plants [J].Plant Physiology Journal, 2016, 52(5):615-627.
[26] 吕严. 褪黑素影响种子萌发的机制研究[D].昆明:云南大学, 2019.
LYU Y.Research on the mechanism of melatonin affecting seed germination[D].Kunming:Yunnan University, 2019.
[27] SIGER A, CZUBINSKI J, DWIECKI K, et al.Identification and antioxidant activity of sinapic acid derivatives in Brassica napus L.seed meal extracts[J].European Journal of Lipid Science and Technology, 2013, 115:1 130-1 138.
[28] 张桂芳, 张东杰, 鹿保鑫, 等.不同萌发时间黑豆芽总黄酮含量及DPPH自由基清除能力的测定[J].食品科技, 2020, 45(12):39-45.
ZHANG G F, ZHANG D J, LU B X, et al.Determination of total flavonoid content and DPPH free radical scavenging ability of black bean sprouts at different germination times[J].Food Science and Technology, 2020, 45(12):39-45.
[29] 宋妍, 李粟晋, 陶阳, 等.青稞籽粒富硒萌发条件优化及其抗氧化物质和能力分析[J].食品工业科技, 2019, 40(14):188-195;202.
SONG Y, LI S J, TAO Y, et al.Optimization of selenium enriched germination conditions and its antioxidant abilities in highland barley seeds[J].Science and Technology of Food Industry, 2019, 40(14):188-195;202.
[30] AGUILERA Y, HERRERA T, LIÉBANA R, et al.Impact of melatonin enrichment during germination of legumes on bioactive compounds and antioxidant activity[J].Journal of Agricultural and Food Chemistry, 2015, 63(36):7 967-7 974.