块菌,又称松露,隶属Tuber属块菌科Tuberaceae,是一类著名的菌根型野生食药用菌,研究表明块菌含有丰富的营养物质及生物活性物质,主要含有17种氨基酸、8种维生素、以及多糖、蛋白质、雄性酮、甾醇、多酚、鞘脂、脂肪酸、微量元素等。具有增强免疫力、抗氧化、抗肿瘤、益胃、清神、止血、疗痔等多种生物活性,是药物的潜在替代品[1]。研究发现块菌中具有活性的多糖和次生代谢产物(多酚、甾醇及黄酮类成分),能抑制或减缓其他分子氧化,能够有效清除DPPH自由基、ABTS阳离子自由基、羟自由基等自由基,具有较好的抗氧化能力。人体进行代谢时,自由基在线粒体内产生,多余的自由基可以被抗氧化剂清除进而维持其在体内的代谢平衡。但是,一些外部因素,如吸烟、环境污染、工业溶剂、臭氧、一些药品和农药等,可促进自由基的产生,打破体内平衡,进而引发机体衰老以及癌症、动脉粥样硬化、肺气肿等疾病[2-3]。因此,天然氧化剂的发现,有助于延缓人的衰老,降低这些疾病出现的概率。
据估计,块菌属在全球有180种之多,我国目前已报道有60余种。目前关于块菌研究,多集中于物种多样性、生态学、遗传学、人工栽培等方面,化学成分方面多聚焦于多糖及其挥发性成分,至今尚无其系统化学成分分析的研究,且多集中于印度块菌,会东块菌等[1]。基于此,本实验采用超高效液相色谱-四极杆-静电场轨道阱高分辨质谱法(ultra-performance liquid chromatography- tandem q-exactive quadrupole-electrostatic field track trap high resolution mass spectrometry,UPLC-Q-Orbitrap HRMS)借助Compound Discoverer 3.0软件,根据化合物的精确相对分子质量、色谱保留时间、特征离子碎片信息,并结合数据库和相关文献比对,对假喜马拉雅块菌的营养成分进行鉴定,根据化合物的质谱信息,结合对照品、数据库及文献信息对假喜马拉雅块菌中的化学成分进行鉴定,以期为其药效物质基础、质量评价及物种鉴定方面提供参考,通过对其抗氧化能力进行研究,为资源的有效利用提供帮助。充分挖掘块菌的食药用价值,把块菌中的有效成分应用于食品、药品、保健品及化妆品中,进一步推进块菌产业发展。
1 材料与方法
1.1 材料与试剂
1.1.1 药材
假喜马拉雅块菌于2020年12月采集于四川省攀之花市会东县(20200806),将其进行测序,根据形态特征和18S rRNA基因序列比对,鉴定为T.pesudohimalayense。该菌种现保存于成都中医药大学药学院生化制药实验室。
1.1.2 试剂
苯丙氨酸、亮氨酸、L-酪氨酸对照品,中国食品药品检定研究院;L-谷氨酸对照品,成都市科隆化学品有限公司;腺苷,英国PureChemLand公司;苯甲酸、油酰胺、没食子酸对照品(对照品纯度均>98%),成都克洛玛生物科技有限公司;碳酸钠、水杨酸钠、硫酸亚铁、过氧化氢、铁氰化钾、三氯乙酸、磷酸氢二钠、磷酸二氢钠、氯化铁、碳酸钠,北京化工厂;福林酚试剂,北京索莱宝试剂公司;水为娃哈哈纯净水;乙腈、甲醇(色谱纯),成都科隆化学品有限公司。
1.2 仪器与设备
Vanquish型超高效液相色谱联用Q-Exactive型四极杆-静电场轨道阱高分辨质谱仪、Varioskan LUX多功能酶标仪,美国Thermo Fisher Scientific公司;SL302 N万分之一电子天平,上海民侨精密科学仪器有限公司;QE-50型高速粉碎机,浙江屹立工贸有限公司;SCIENTZ-10 N冷冻干燥机,宁波新芝生物科技股份有限公司;超声波清洗机,成都雅源科技有限公司。
1.3 实验方法
1.3.1 UPLC-Q-Orbitrap HRMS分析
1.3.1.1 供试品溶液
将新鲜假喜马拉雅块菌,冷冻干燥,将冻干的假喜马拉雅块菌粉碎,称取适量本品粉末(过二号筛)约1 g,精密称定,置50 mL锥形瓶中,精密加入80%甲醇25 mL,密塞,称定质量,浸泡1 h,超声处理(150 W,40 kHz)30 min,放冷,称定质量,用80%甲醇补足减失的质量,摇匀,过0.22 μm微孔滤膜,取续滤液[4-6],备用。
1.3.1.2 对照品溶液
取苯丙氨酸、亮氨酸、L-谷氨酸、L-酪氨酸、腺苷、苯甲酸、油酰胺、吡嗪对照品适量,加甲醇超声使溶解并定容至25 mL,配制成质量浓度约0.05 g/L的混合对照品,溶液置于4 ℃冰箱中保存,使用时过0.22 μm 微孔滤膜。
1.3.1.3 检测条件
(1)色谱条件
Waters ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm),流动相0.1%乙酸水溶液(A相)-乙腈(B相)梯度洗脱:(0~4 min,5% B;4~7 min,5%~10% B;7~10 min,10%~16% B;10~20 min,16~32% B;20~24 min,32%~60% B;24~30 min,60% B;30~36 min,60%~70% B;36~43 min,70%~95% B;43~46 min, 95% B,流速0.3 mL/min,进样量3 μL,柱温30 ℃。
(2)质谱条件
离子源:采用电喷雾离子源(ESI),扫描方式:正、负离子监测模式,正负离子源电压:3 500~3 000 V,质量扫描范围:m/z 100~1 500;裂解电压:(ESI+)3.5 kV和(ESI-)3.0 kV,鞘气流速:35 L/min,辅助气流量:10 L/min,离子传输管温度:300 ℃,辅助气温度:350 ℃。扫描模式为全扫描/数据依赖二级扫描(Full MS/dd-MS 2),一级分辨率70 000,二级分辨率17 500。MS/MS模式时,正、负离子模式下的碰撞能量梯度为20、40、60 eV。
1.3.1.4 数据处理
将UPLC-Q-Orbitrap HRMS所采集的原始数据导入到Compound Discoverer 3.0软件进行计算,对原始数据进行峰对齐和峰提取,利用Compound Discoverer 3.0将提取得到的分子离子色谱峰、同位素峰拟合出分子式,将所得结果与数据库mzCloud,mzVault及本地中药成分高分辨质谱数据库OTCML进行匹配,对匹配结果设置过滤参数为峰面积阈值8万,一级准分子离子及二级碎片离子质量偏差5 ppm(1 ppm=1×106),匹配度分值>80。对过滤后的目标化合物的质谱信息与对照品、相关文献信息比对,进行化合物的鉴定[7-8]。
1.3.2 抗氧化活性测试
1.3.2.1 块菌提取物的制备
将新鲜的假喜马拉雅块菌,冷冻干燥,后将冻干的假喜马拉雅块菌粉碎,称取适量本品粉末(过二号筛)约2 g,精密称定,置100 mL锥形瓶中,精密加入80%甲醇(纯水)50 mL,密塞,称定质量,浸泡1 h,超声处理(150 W,40 kHz)30 min,放冷,称定质量,用80%甲醇(纯水)补足减失的质量,摇匀,过滤,重复上述操作,合并2次滤液后,旋转浓缩至10 mL。后将提取物配制成所需浓度[3]。
1.3.2.2 DPPH自由基清除活性测定
DPPH自由基清除能力测定根据文献描述方法稍作修改[3]。将甲醇、水提取物的不同质量浓度(1~65 mg/mL)的等分试样80 μL与1 mL 25 μg/mL DPPH甲醇溶液混合,剧烈摇动混合物,黑暗条件下,静置30 min,以96孔板为反应载体,酶标仪在517 nm 处检测其OD值。以维生素C为阳性对照,每个样品平行测定3次,取平均值。根据公式(1)计算块菌提取物对DPPH自由基的清除率:
DPPH自由基清除率![]()
(1)
式中:A0为空白对照的OD值,Ai为加入样品或者阳性对照后的OD值。
1.3.2.3 ABTS阳离子自由基清除活性测定
ABTS阳离子自由基清除能力测定参照文献稍作改动[3],配制7 mmol/L ABTS阳离子和4.9 mmol/L过硫酸钾溶液,等体积混合均匀,室温避光贮存12 h以上,根据吸光度用无水乙醇稀释40~60倍至吸光度为0.7±0.02,即为ABTS阳离子储备液。将 0.2 mL ABTS阳离子储备液与10 μL不同质量浓度(0.0625、0.125、0.25、0.5、1、2、4 mg/mL)的块菌提取液混合,常温避光静置6 min,以96孔板为反应载体,酶标仪734 nm处测定OD值,每个样品平行测定3次,取平均值,用等量的超纯水代替样品作为空白对照,维生素C作阳性对照,根据公式(2)计算ABTS阳离子自由基清除率。
ABTS阳离子自由基清除率![]()
(2)
式中:A0为空白对照的OD值,Ai为加入样品或者阳性对照后的OD值。
1.3.2.4 羟自由基清除活性测定
羟自由基清除能力测定参照文献的方法稍作修改[3]。分别移取20 mmol/L水杨酸钠0.3 mL和1.5 mmol/L的硫酸亚铁1.0 mL于各试管中,再分别加入不同质量浓度(2~12 mg/mL)的块菌样品提取液1.0 mL,最后加入0.7 mL mmol/L H2O2,迅速混匀,37 ℃恒温水浴1 h,以96孔板为反应载体,酶标仪在510 nm下测定其OD值。每个样品平行测定3次,取其平均值。以80%甲醇作为空白对照,维生素C作为阳性对照。根据公式(3)计算块菌提取物对羟自由基的清除率:
羟自由基清除率![]()
(3)
式中:A0为空白对照的OD值,Ai为加入样品或者阳性对照后的OD值。
1.3.2.5 还原能力测定
还原能力测定参照文献[3]方法。将不同浓度的块菌样品提取液1 mL与2.5 mL磷酸缓冲液(200 mmol/L,pH 6.6)混合,加入10 g/L铁氰化钾溶液2.5 mL,混合物于50 ℃恒温20 min后加入1 mL 100 g/L三氯乙酸,3 000 r/min离心分离10 min,取上层清液2.5 mL,加入去离子水2.5 mL以及1 g/L新鲜配制的三氯化铁溶液0.5 mL,酶标仪700 nm处测定其OD值。OD值越高,说明反应混合物的还原性越强,每个样品平行测3次,取其平均值。用维生素C作为阳性对照,用等量的超纯水代替样品作为空白对照。
1.3.2.6 总酚含量的测定
总酚含量测定参照文献[3]方法稍作修改。将1 mL 质量浓度为8 mg/mL的块菌样品溶液与1 mL福林酚混合,静置3 min后,加入1 mL 350 g/L碳酸钠,然后加入去离子水使反应体系稀释至10 mL。混匀,室温下黑暗处放置90 min,酶标仪725 nm处测定其OD值。利用不同质量浓度(0.005、0.01、0.02、0.03、0.04 mg/mL)的没食子酸标准品(gallic acid equivalent, GAE)建立标准曲线计算块菌样品溶液中相应的总酚含量。每个样品平行测定3次,取其平均值。
1.3.2.7 数据处理
本文所用数据为3次平行测量,结果以平均值±标准偏差表示。各个数据均用Origin 9.0软件处理作图,采用SPSS 25.0统计分析软件对数据进行分析。数据比较采用t检验,P<0.05时认为样本间具有显著性差异;采用Pearson′s相关分析抗氧化活性与活性成分含量之间相关性[3]。
2 结果与分析
2.1 假喜马拉雅块菌的化学成分分析
假喜马拉雅块菌作为一种食药用真菌,不仅风味独特,也具有极高的营养价值,采用UPLC-Q-Orbitrap HRMS分析假喜马拉雅块菌80%甲醇提取物的营养成分,根据化合物的保留时间、一级准分子离子及二级碎片离子质量等信息,结合参考文献和数据库(mzCloud,mzVault)对其成分进行初步鉴定。初步鉴定出51种化合物,包括13个氨基酸、11个有机酸、8个核苷类、9个酰胺类及10个其他类。经与对照品比对其中8个成分可准确鉴定,正负离子流图见图1、图2,化合物的相关信息见表1。
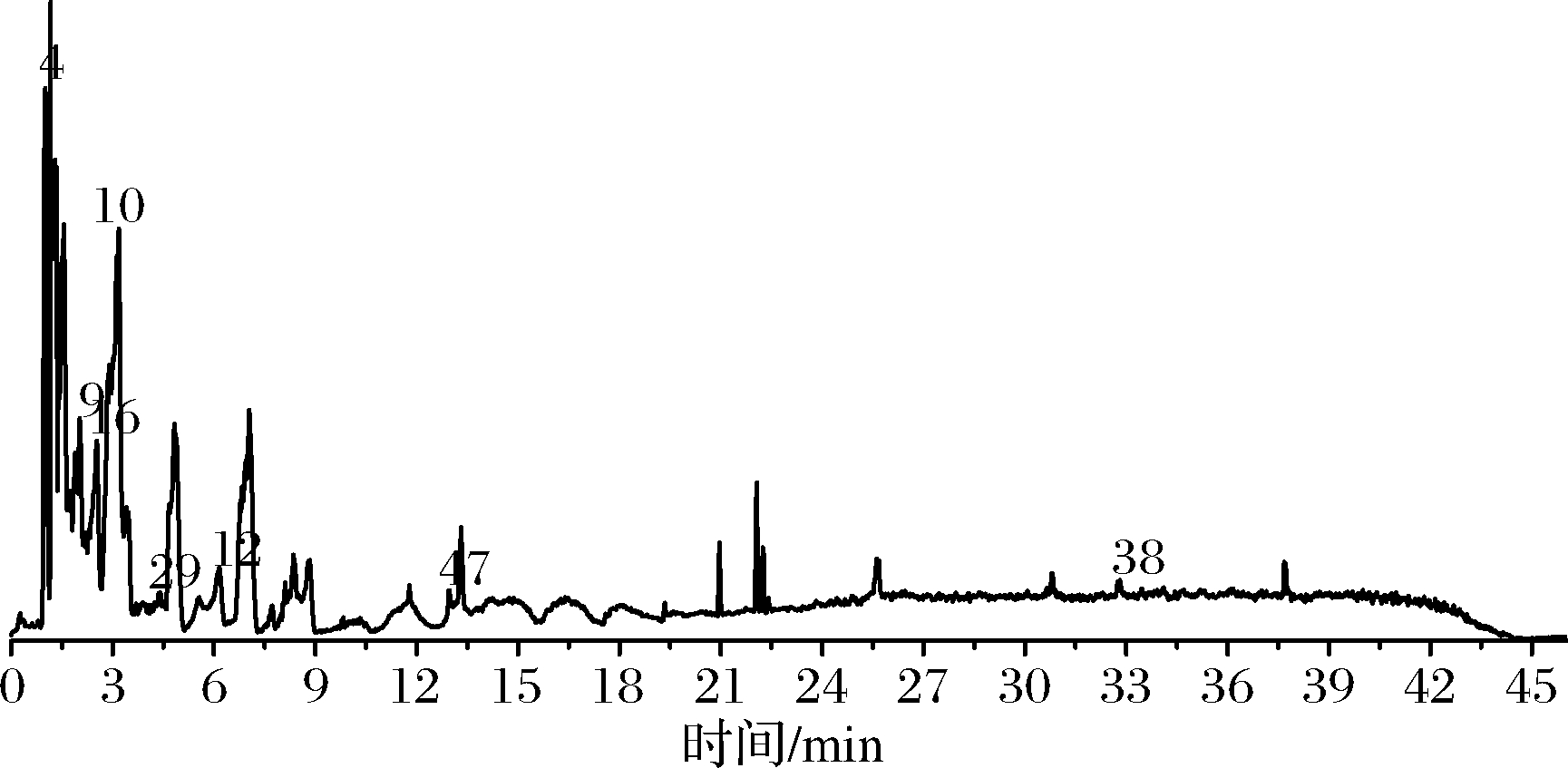
图1 假喜马拉雅块菌在UPLC-Q-Orbitrap HRMS 正离子模式下的总离子流
Fig.1 Total ion chromatogram of Tuber pesudohimalayense by UPLC-Q-Orbitrap HRMS in positive ion mode
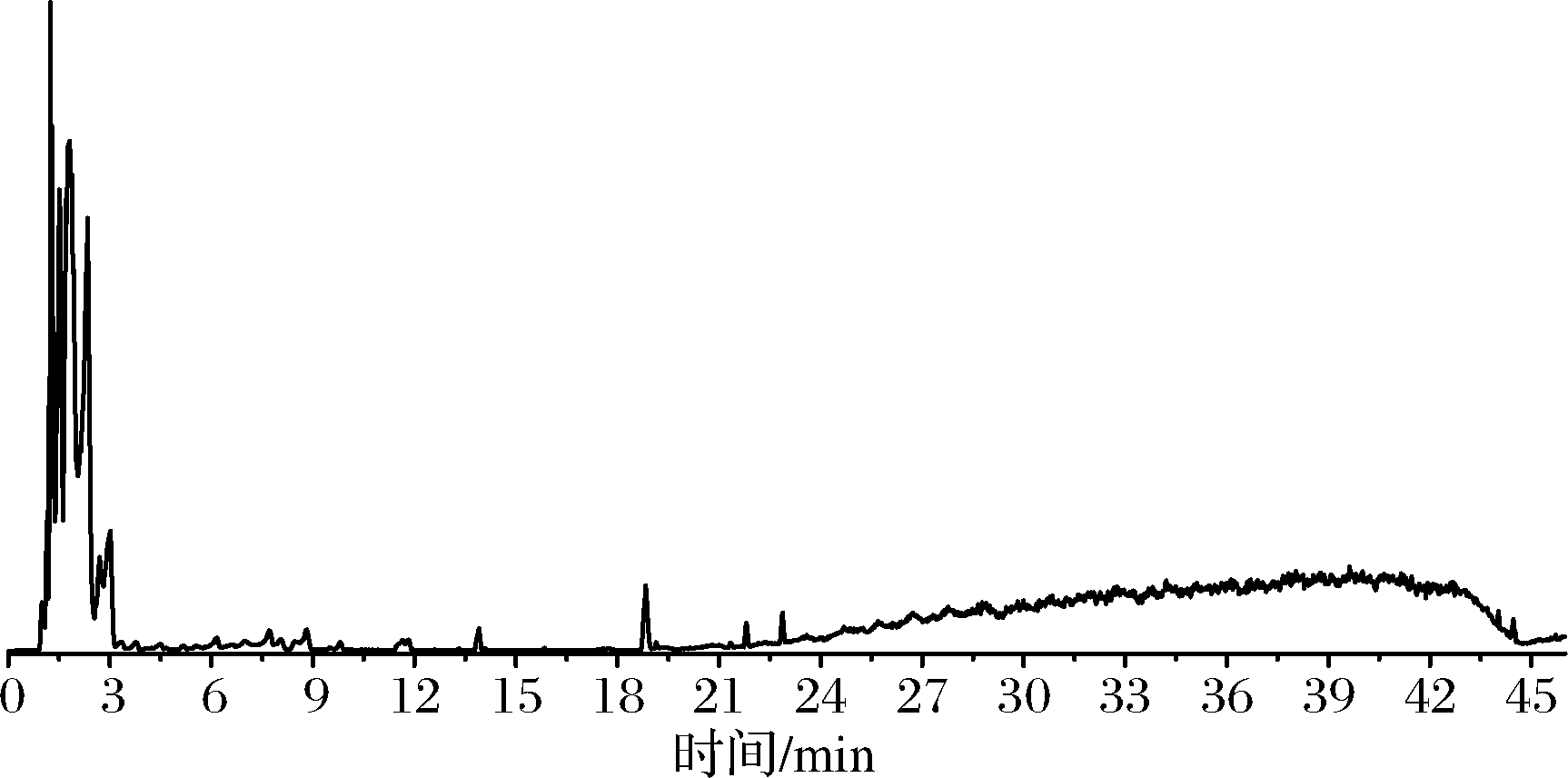
图2 假喜马拉雅块菌在UPLC-Q-Orbitrap HRMS负离子 模式下的总离子流
Fig.2 Total ion chromatogram of Tuber pesudohimalayense by UPLC-Q-Orbitrap HRMS in negative ion mode
2.2 各类化合物的裂解特征
2.2.1 氨基酸
氨基酸分子含有氨基和羧基2种官能团,保留时间主要集中在0.84~3.92 min,正离子模式下,氨基酸的准分子离子峰[M+H]+相对丰度较低,易失去H2O、CO、COOH、NH3(18、28、46、17)形成稳定的特征碎片,通过与数据库及参考文献比对,在假喜马拉雅块菌中推断出13个氨基酸,以DL-精氨酸为例,在ESI+模式下准分子离子峰175.119 1 [M+H]+,推测分子式为C6H14N4O2,在该化合物的二级质谱中丢失1个NH3,形成离子碎片为158.092 2 [M+H-NH3],丢失1个羧基,形成离子碎片130.097 3 [M+H-COOH],继续高能碰撞连续裂解失去1个亚甲基,形成碎片离子116.070 7 [M+H-COOH-CH2],综上与文献[4-8]报道一致,因此推断该化学成分为DL-精氨酸。
表1 假喜马拉雅块菌在UPLC-Q-Orbitrap HRMS正负离子模式下的化学成分鉴定
Table 1 Identification of chemical constituents in Tuber pesudohimalayense by UPLC-Q-Orbitrap HRMS in positive and negative ion mode
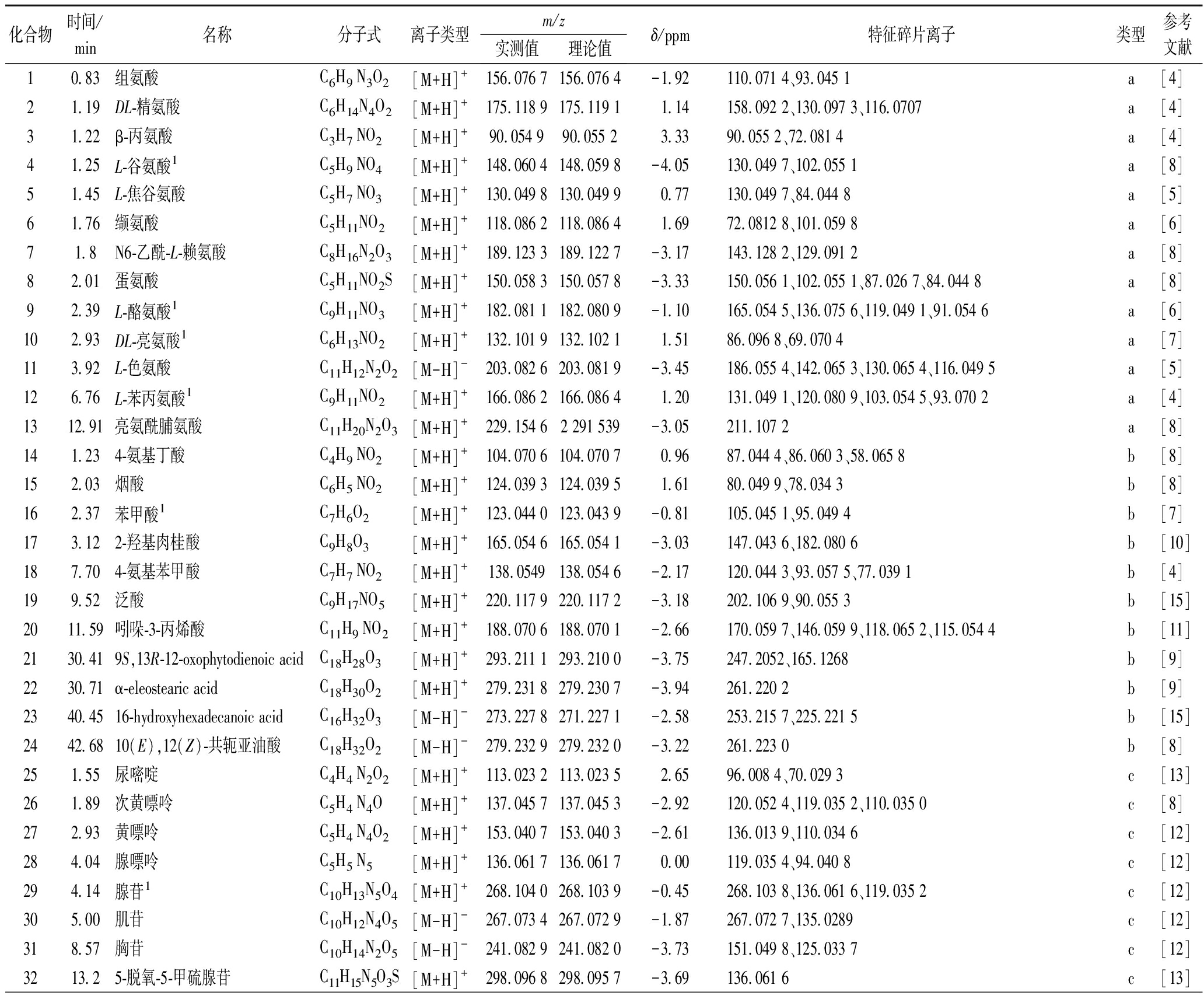
化合物时间/min名称分子式离子类型m/z实测值理论值δ/ppm特征碎片离子类型参考文献10.83组氨酸C6H9 N3O2[M+H]+156.076 7156.076 4-1.92110.071 4、93.045 1a[4]21.19DL-精氨酸C6H14N4O2[M+H]+175.118 9175.119 11.14158.092 2、130.097 3、116.0707a[4]31.22β-丙氨酸C3H7 NO2[M+H]+90.054 990.055 23.3390.055 2、72.081 4a[4]41.25L-谷氨酸1C5H9 NO4[M+H]+148.060 4148.059 8-4.05130.049 7、102.055 1a[8]51.45L-焦谷氨酸C5H7 NO3[M+H]+130.049 8130.049 90.77130.049 7、84.044 8a[5]61.76缬氨酸C5H11NO2[M+H]+118.086 2118.086 41.6972.0812 8、101.059 8a[6]71.8N6-乙酰-L-赖氨酸C8H16N2O3[M+H]+189.123 3189.122 7-3.17143.128 2、129.091 2a[8]82.01蛋氨酸C5H11NO2S[M+H]+150.058 3150.057 8-3.33150.056 1、102.055 1、87.026 7、84.044 8a[8]92.39L-酪氨酸1C9H11NO3[M+H]+182.081 1182.080 9-1.10165.054 5、136.075 6、119.049 1、91.054 6a[6]102.93DL-亮氨酸1C6H13NO2[M+H]+132.101 9132.102 11.5186.096 8、69.070 4a[7]113.92L-色氨酸C11H12N2O2[M-H]-203.082 6203.081 9-3.45186.055 4、142.065 3、130.065 4、116.049 5a[5]126.76L-苯丙氨酸1C9H11NO2[M+H]+166.086 2166.086 41.20131.049 1、120.080 9、103.054 5、93.070 2a[4]1312.91亮氨酰脯氨酸C11H20N2O3[M+H]+229.154 62 291 539-3.05211.107 2a[8]141.234-氨基丁酸C4H9 NO2[M+H]+104.070 6104.070 70.9687.044 4、86.060 3、58.065 8b[8]152.03烟酸C6H5 NO2[M+H]+124.039 3124.039 51.6180.049 9、78.034 3b[8]162.37苯甲酸1C7H6O2[M+H]+123.044 0123.043 9-0.81105.045 1、95.049 4b[7]173.122-羟基肉桂酸C9H8O3[M+H]+165.054 6165.054 1-3.03147.043 6、182.080 6b[10]187.704-氨基苯甲酸C7H7 NO2[M+H]+138.0549138.054 6-2.17120.044 3、93.057 5、77.039 1b[4]199.52泛酸C9H17NO5[M+H]+220.117 9220.117 2-3.18202.106 9、90.055 3b[15]2011.59吲哚-3-丙烯酸C11H9 NO2[M+H]+188.070 6188.070 1-2.66170.059 7、146.059 9、118.065 2、115.054 4b[11]2130.419S,13R-12-oxophytodienoic acidC18H28O3[M+H]+293.211 1293.210 0-3.75247.2052、165.1268b[9]2230.71α-eleostearic acidC18H30O2[M+H]+279.231 8279.230 7-3.94261.220 2b[9]2340.4516-hydroxyhexadecanoic acidC16H32O3[M-H]-273.227 8271.227 1-2.58253.215 7、225.221 5b[15]2442.6810(E),12(Z)-共轭亚油酸C18H32O2[M-H]-279.232 9279.232 0-3.22261.223 0b[8]251.55尿嘧啶C4H4 N2O2[M+H]+113.023 2113.023 52.6596.008 4、70.029 3c[13]261.89次黄嘌呤C5H4 N4O[M+H]+137.045 7137.045 3-2.92120.052 4、119.035 2、110.035 0c[8]272.93黄嘌呤C5H4 N4O2[M+H]+153.040 7153.040 3-2.61136.013 9、110.034 6c[12]284.04腺嘌呤C5H5 N5[M+H]+136.061 7136.061 70.00119.035 4、94.040 8c[12]294.14腺苷1C10H13N5O4[M+H]+268.104 0268.103 9-0.45268.103 8、136.061 6、119.035 2c[12]305.00肌苷C10H12N4O5[M-H]-267.073 4267.072 9-1.87267.072 7、135.0289c[12]318.57胸苷C10H14N2O5[M-H]-241.082 9241.082 0-3.73151.049 8、125.033 7c[12]3213.25-脱氧-5-甲硫腺苷C11H15N5O3S[M+H]+298.096 8298.095 7-3.69136.061 6c[13]
续表1

化合物时间/min名称分子式离子类型m/z实测值理论值δ/ppm特征碎片离子类型参考文献331.19磷酸胆碱C5H13NO[M+H]+104.107 0104.107 33.2760.081 4、58.065 8d[4]341.22DL-谷氨酰胺C5H10N2O3[M+H]+147.076 4147.076 3-0.68147.076 3、130.049 7、84.0448 1、105.055 2d[14]352.22烟酰胺C6H6 N2O[M+H]+123.055 2123.055 30.8196.044 6、95.049 4、80.049 9、78.034 2d[15]368.57δ-戊内酰胺C5H9 NO[M-H]-100.075 6100.075 82.0083.049 5、82.065 5d[16]3725.65月桂内酰胺C12H23NO[M+H]+198.185 2198.184 5-3.5383.085 9、55.054 9d[17]3832.98油酰胺1C18H35NO[M+H]+282.279 1282.278 0-3.9069.070 4、83.085 9、247.241 3、265.251 7d[9]3937.76亚油酰乙醇酰胺C20H37NO2[M+H]+324.289 7324.288 5-3.70306.278 0、109.101 2、95.085 8d[18]4044.17芥酸酰胺C22H43NO[M+H]+338.341 7338.340 4-3.8497.101 4d[6]4145.14硬脂酰胺C18H37NO[M+H]+284.294 7284.293 9-2.81102.091 5d[9]421.26甜菜碱C5H11NO2[M+H]+118.086 2118.086 0-1.6958.065 8e[21]431.34半乳糖醇C6H14O6[M-H]-181.071 7181.070 5-6.63163.060 5、149.044 9、119.034 1、101.023 4、89.023 3、71.012 3e[24]444.66异戊胺C5H13N[M+H]+88.112 088.112 33.4071.086 1、55.054 1e[22]456.854-哌啶酮C5H9 NO[M+H]+100.075 6100.075 82.0072.081 3、56.050 2、55.054 9e[8]469.264-吲哚甲醛C9H7 NO[M+H]+146.060 0146.060 00.00118.065 1e[23]4713.02吡嗪C12H16N2O4[M+H]+253.118 2253.117 3-3.56235.107 0e[20]4821.74磷酸三乙酯C6H15O4P[M+H]+183.078 0183.077 5-2.73155.046 3、127.015 3e[7]4925.74麦角甾-1,3,5,7-四烯-1-醇C28H42O[M+H]+395.330 8395.329 9-2.28377.319 1、311.236 1、269.189 2、251.178 6e[8]5025.98羟基茜草素C14H8O5[M-H]-255.029 8255.029 0-3.14227.033 9、183.043 9、171.043 9、155.049 0e[19]5136.19邻苯二甲酸苷C8H4O3[M+H]+149.023 3149.022 9-2.68121.028 3、93.033 8e[25]
注:a-氨基酸类;b-有机酸类;c-核苷类;d-酰胺类;e-其他类;名称1表示与对照品比对后准确鉴别
2.2.2 有机酸
本实验中在正负离子模式下,通过与数据库及参考文献比对,共推断出11个有机酸类化合物,有机酸类化合物易丢失H2O、HCOOH、CO2等中性分子形成稳定的碎片离子。以化合物苯甲酸为例,在ESI+模式下准分子离子峰123.043 9[M+H]+,推测分子式为C7H6O2,正离子模式下丢失1个H2O,形成离子碎片105.045 1[M+H-H2O],连续裂解丢失1个CO,形成碎片离子95.049 4[M+H-CO],通过与文献[9-11,13]比对,推断该化合物为苯甲酸。
2.2.3 核苷类
核苷类物质是生命活动过程中的重要代谢产物,具有多样生理活性,在抗肿瘤、保护心肌损伤等生命调节过程中起着重要作用。根据碱基不同,将核苷类物质分为嘧啶核苷及嘌呤核苷。本实验中核苷类成分保留时间在1.1~3.75 min,在正离子模式下根据文献及数据库比对推断出8种核苷类成分,以腺苷为例,在ESI+模式下准分子离子峰268.104 3[M+H]+,根据数据库匹配出分子式为C10H13N5O4,二级质谱出现136.060 6、119.034 1质谱峰,推测该化合物为腺苷,二级碎片离子为[M+H-C5H8O4]+、[M+H-C5H8O4-NH3]+,与文献[12-13]报道一致,因此推断该化学成分为腺苷。
2.2.4 其他类
根据数据库mzCloud,mzVault及本地中药成分高分辨质谱数据库OTCML与文献进行比对,从假喜马拉雅块菌中还推断出芳香醛类、甾醇类、油脂类等一些化合物[13]。
2.3 假喜马拉雅块菌的抗氧化活性测试结果
2.3.1 DPPH自由基清除活性测定
由图3可知,假喜马拉雅块菌醇提水提的提取液对DPPH自由基均有一定的清除能力,且随着样品质量浓度的增大自由基清除率也随之增加,在一定范围内存在量效关系。但与维生素C相比,维生素C的抗氧化能力要明显强于块菌提取物。由图3可以看出,块菌水提的DPPH自由基清除率的平均值要高于块菌80%甲醇提取的平均值。表1列出了各不同溶剂提取物的EC50值(mg/mL),块菌水提液的EC50值平均为14.97 mg/mL,80%甲醇提取液的EC50值平均为20.90 mg/mL(表2),对2组数据进行t检验,P<0.05,结果表明,块菌水提DPPH抗氧化活性与80%甲醇提取抗氧化活性有统计学差异。

图3 甲醇提取物、水提物、维生素C的DPPH自由基清除能力
Fig.3 DPPH radical scavenging activities of methanolic extracts, aqueous extracts and vitamin C
2.3.2 ABTS阳离子自由基清除活性测定
由图4可知,假喜马拉雅块菌80%甲醇和水提的提取液对ABTS阳离子自由基清除能力随着样品浓度的增大自由基清除率也随之增加,在一定范围内存在量效关系。维生素C在0.062 5~4 mg/mL的质量浓度范围内,自由基清除率无较大波动,维持在90%附近,说明维生素C具有较强的抗氧化活性。假喜马拉雅块菌醇提水提后提取液虽然具有一定自由基清除效果,但是清除效果低于维生素C。由图4可以看出,块菌水提醇提的ABTS阳离子自由基清除率相近,但是块菌水提ABTS阳离子自由基清除率的平均值要略高于块菌80%甲醇提取的平均值。表2列出了各不同溶剂提取物的EC50值(mg/mL),块菌水提液的EC50值平均为0.19 mg/mL,80%甲醇提取液的EC50值平均为0.26 mg/mL,对2组数据进行t检验,P>0.05,结果表明,块菌水提ABTS抗氧化活性与80%甲醇提取抗氧化活性无统计学差异。
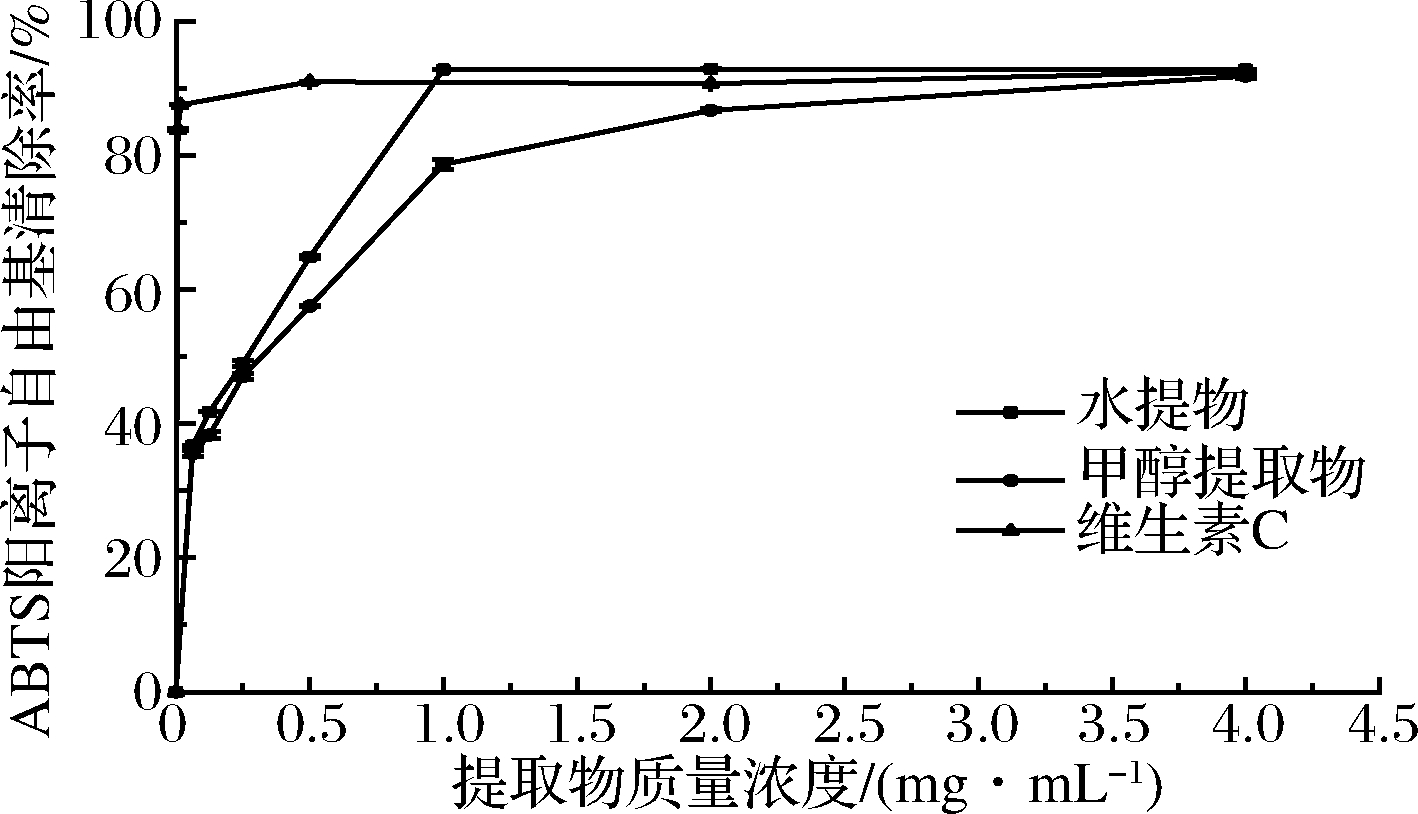
图4 甲醇提取物、水提物、维生素C的ABTS阳离子 自由基清除能力
Fig.4 ABTS radical scavenging activities of methanolic extracts, aqueous extracts and vitamin C
2.3.3 羟自由基清除活性测定
由图5可知,假喜马拉雅块菌羟自由基清除能力:维生素C>块菌水提物>块菌80%甲醇提取物,且随着块菌样品浓度的增大自由基清除率也增加,存在量效关系。维生素C在2~12 mg/mL,自由基清除率稳定维持在90%附近,说明维生素C具有较强的抗氧化活性。假喜马拉雅块菌醇提水提后提取液虽然具有一定自由基清除效果,但是清除效果低于维生素C。表2列出了各不同溶剂提取物的EC50值(mg/mL),块菌水提液的EC50值平均为3.21 mg/mL,80%甲醇提取液的EC50值平均为4.71 mg/mL,对2组数据进行t检验,P<0.05,结果表明,块菌水提抗氧化活性与80%甲醇提取抗氧化活性具有统计学差异。
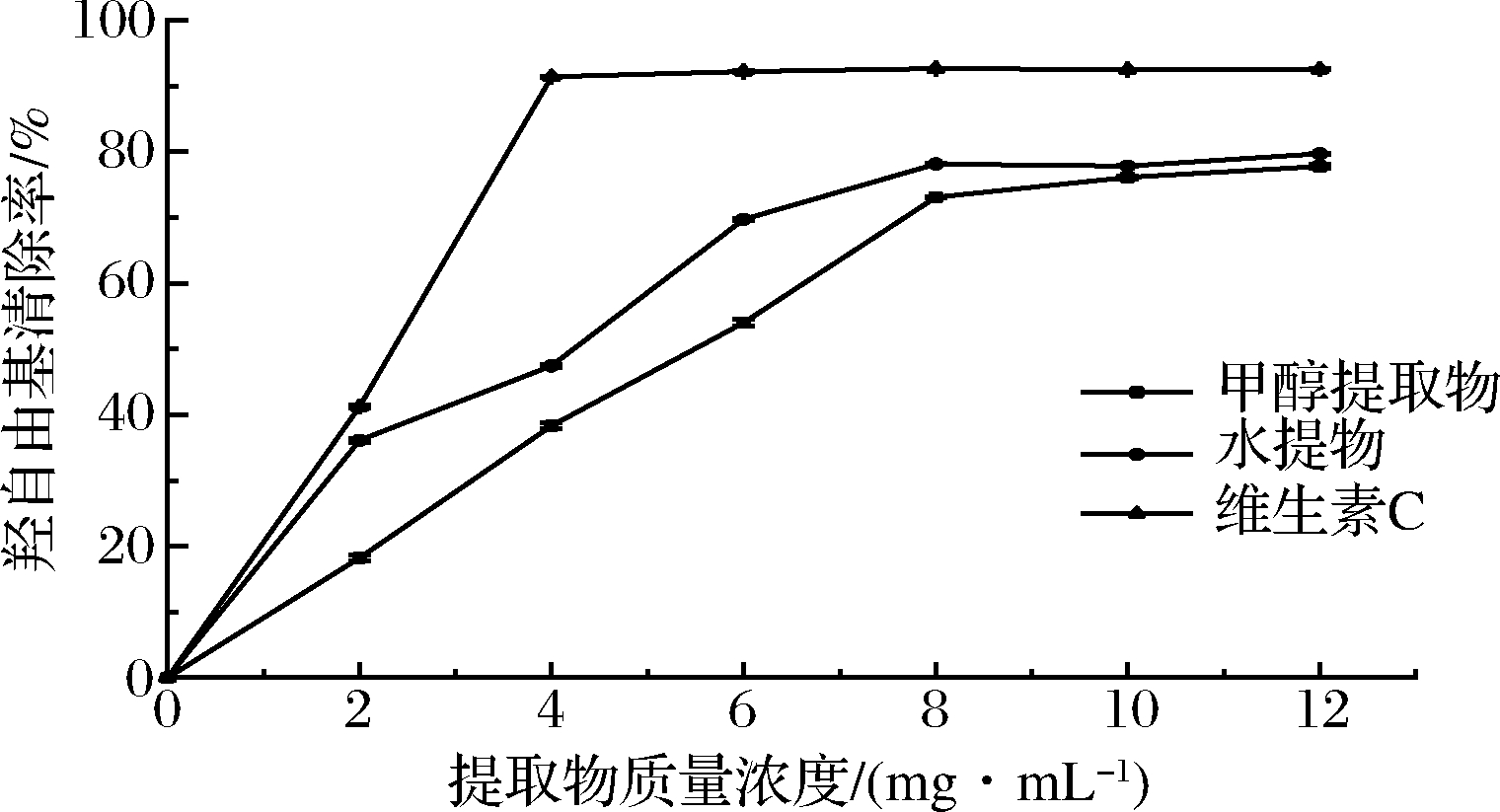
图5 甲醇提取物、水提物、维生素C的羟自由基清除能力
Fig.5 Hydroxyl radical scavenging activities of methanolic extracts, aqueous extracts and vitamin C
2.3.4 还原能力测定
由图6可知,在所测质量浓度范围内,块菌各提取物与维生素C,随着质量浓度的增加,还原能力都逐渐增强,并呈现出较好的量效关系。块菌还原能力大小关系为:维生素C>块菌水提物>块菌80%甲醇提取物,对块菌水提醇提2组数据进行t检验,P<0.05,结果表明,块菌水提抗氧化活性与80%甲醇提取抗氧化活性具有统计学差异。
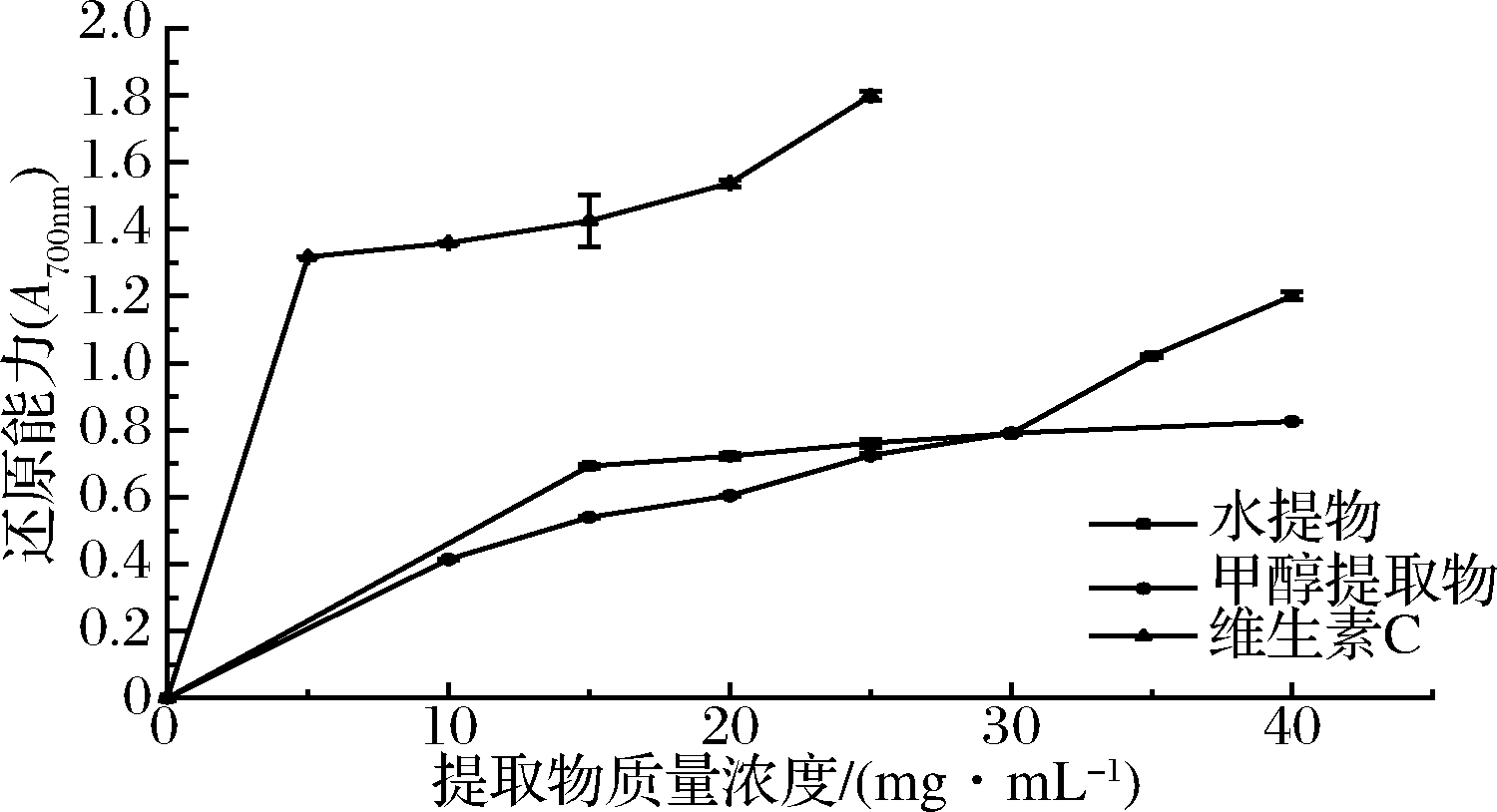
图6 甲醇提取物、水提物、维生素C的还原能力
Fig.6 Reducing power of methanolic extracts, aqueous extracts and vitamin C
2.3.5 总酚含量的测定
通过2种不同的提取溶剂对假喜马拉雅块菌的总酚进行提取,块菌水提总酚含量3.99 mg/g,块菌80%甲醇提取总酚含量为1.87 mg/g(表2),将不同提取物的总酚含量进行t检验,结果发现,块菌水提物总酚的含量与80%甲醇提取物存在显著性差异,水提物的总酚含量明显高于甲醇提取,水提物的DPPH自由基、ABTS阳离子自由基、羟自由基清除能力与还原能力也高于甲醇提取物,采用Pearson′s分析对抗氧化活性与总酚含量之间相关性进行分析。结果表明酚类物质含量与抗氧化活性存在一定相关性,总酚含量越高,抗氧化能力会越强。
3 结论
通过UPLC-Q-Orbitrap HRMS分析了假喜马拉雅块菌的化学成分,假喜马拉雅块菌中共鉴定出51种成分,其中氨基酸和有机酸含量较高,近年来,谷氨酸、精氨酸、天门冬氨酸、胱氨酸等氨基酸也单独作用治疗一些疾病,主要用于治疗肝病疾病、消化道疾病、脑病、心血管病、呼吸道疾病以及用于提高肌肉活力、儿科营养和解毒等[1,4,6]。有机酸一般无特殊生物活性,但是有些天然有机酸,则具有抑菌、降血糖、抗氧化以及调节机体免疫等作用,能够增加冠状动脉血流量、抑制脑组织脂质过氧化物生成、软化血管、还有预防疾病和促进新陈代谢等作用[10]。
表2 假喜马拉雅块菌提取物抗氧化能力的EC50值和总酚含量
Table 2 EC50 values obtained in the antioxidant activity assays and contents of total phenolics of different extracts from Tuber pesudohimalayense
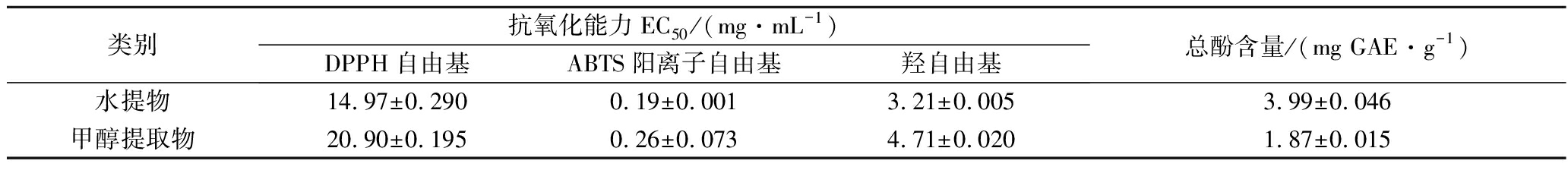
类别抗氧化能力EC50/(mg·mL-1)DPPH自由基ABTS阳离子自由基羟自由基总酚含量/(mg GAE·g-1)水提物14.97±0.2900.19±0.0013.21±0.0053.99±0.046甲醇提取物20.90±0.1950.26±0.0734.71±0.0201.87±0.015
抗氧化实验结果显示,同种块菌选择不同提取溶剂,可能会影响获得的抗氧化代谢产物含量,进而影响其抗氧化活性,假喜马拉雅块菌具有显著的清除ABTS阳离子自由基、DPPH自由基、羟自由基的能力,且水提物的自由基清除能力强于甲醇提取物,水提物的还原能力也强于甲醇提取物。通过对水提物和甲醇提取物的总酚含量测定发现,水提物的总酚含量明显高于甲醇提取物,这也说明块菌的抗氧化活性与总酚含量成正相关。
综上,通过对假喜马拉雅块菌的化学成分和抗氧化活性研究,发现块菌可以作为天然抗氧化剂的来源,未来应加快块菌化学成分和药理性质的研究,充分挖掘块菌的食药用价值,把块菌中的有效成分应用于药品、食品、保健品、化妆品中,推进块菌产业发展。
[1] 李杨, 郭顺星, 陈娟.珍稀名贵食药用真菌块菌属的化学成分及药理活性研究进展[J].菌物学报, 2021, 40(4):873-894.
LI Y, GUO S X, CHEN J.Research progress on chemical constituents and pharmacological effects of Tuber (Pezizales, Ascomycota)[J].Mycosystema, 2021(4):873-894.
[2] WIERNSPERGER N F.Oxidative stress:The special case of diabetes[J].BioActos, 2003, 19(1-2):11-18.
[3] 李晓勇, 范黎.李氏块菌提取物抗氧化活性的研究[J].菌物学报,.2015, 34(3):465-472.
LI X Y, FAN L.Antioxidant activities of different extracts from Tuber liyuanum[J].Mycosystema, 2015,34(3):465-472.
[4] LIU M H, TONG X, WANG J X, et al.Rapid separation and identification of multiple constituents in traditional Chinese medicine formula Shenqi Fuzheng injection by ultra-fast liquid chromatography combined with quadrupole-time-of-flight mass spectrometry[J].Journal of Pharmaceutical and Biomedical Analysis, 2013, 74:141-155.
[5] 任洪民, 张金莲, 邓亚羚, 等.基于UPLC-Q-TOF-MS的多花黄精酒制前后化学成分分析[J].中国实验方剂学杂志,2021, 27(4):110-121.
REN H M, ZHANG J L, DENG Y L, et al.Analysis of chemical constitutions of Polygonatum cyrtonema dried rhizomes before and after processing with wine based on UPLC-Q-TOF-MS[J].Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(4):110-121.
[6] 张婕, 葛永辉,杨慧, 等.LC-MS/MS法同时测定烟草中的16种游离氨基酸和6种Amadori化合物[J].烟草科技,2017, 50(11):58-65.
ZHANG J, GE Y H, YANG H, et al.Simultaneous determination of sixteen free amino acids and six Amadori products in tobacco by LC-MS/MS[J].Tobacco Science & Technology, 2017, 50(11):58-65.
[7] 盛节英, 周洪雷, 周倩, 等.基于UPLC-Q-Exactive Orbitrap-MS分析宣木瓜饮片化学成分[J].中草药,2018, 49(20):4 773-4 779.
SHENG J Y, ZHOU H L, ZHOU Q, et al.Analysis on chemical constituents of fruit of Chaenomeles speciosa by UPLC-Q-Exactive Orbitrap-MS[J].Chinese Traditional and Herbal Drugs, 2018, 49(20):4 773-4 779.
[8] 张玉, 董文婷, 霍金海, 等.基于UPLC-Q-TOF-MS技术的广地龙化学成分分析[J].中草药, 2017, 48(2):252-262.
ZHANG Y, DONG W T, HUO J H, et al.Analysis on chemical constituents of Pheretima aspergillum by UPLC-Q-TOF-MS[J].Chinese Traditional and Herbal Drugs, 2017, 48(2):252-262.
[9] ZHONG P P, CHEN Y, YU Q, et al.Determination of the polar compounds in vegetable oil by ultra-performance liquid chromatography-quadrupole-time-of-flight-mass spectrometry with chemometrics[J].Analytical Letters, 2019, 52(3):465-478.
[10] 吴文理, 黄保驾, 陈天乙, 等.UPLC-MS/MS法同时测定灵源万应茶中有机酸成分的含量[J].中南药学,2021, 19(6):1 201-1 205.
WU W L, HUANG B J, CHEN T Y, et al.Simultaneous determination of organic acids in Lingyuan Wanying medicinal teas by UPLC-MS/MS[J].Central South Pharmacy, 2021,19(6):1 201-1 205.
[11] SHI X L, YANG Y, REN H X, et al.Identification of multiple components in deep eutectic solvent extract of Acanthopanax senticosus root by ultra-high-performance liquid chromatography with quadrupole orbitrap mass spectrometry[J].Phytochemistry Letters, 2020, 35:175-185.
[12] 陈两绵, 刘晓谦, 张永欣, 等.茶藨子叶状层菌中核苷类成分的UPLC-Q/TOF-MS定性分析和HPLC含量测定[J].中国中药杂志, 2021, 46(12):2 912-2 922.
CHEN L M, LIU X Q, ZHANG Y X, et al.Qualitative and quantitative analysis of nucleosides and nucleobases in Phylloporia ribis by UPLC-Q-TOF-MS and HPLC[J].China Journal of Chinese Materia Medica,2021,46(12):2 912-2 922.
[13] 胡瀚文,赵永艳,杨天龙,等.基于UPLC-Q-Orbitrap HRMS的川佛手化学成分分析[J].中国实验方剂学杂志, 2020, 26(7):148-155.
HU H W, ZHAO Y Y, YANG T L, et al.Analysis and identification of chemical constituents of citri sarcodactylis fructus by UPLC-Q-Orbitrap HRMS[J].Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(7):148-155.
[14] 韩雨钊, 姜悦, 林茂, 等.LC-MS/MS法测定人体血浆中谷氨酰胺的含量[J].沈阳药科大学学报, 2016, 33(7):572-576;580.
HAN Y Z, JIANG Y, LIN M, et al.Determination of glutamine in human plasma by liquid chromatography-tandem mass spectrometry[J].Journal of Shenyang Pharmaceutical University, 2016, 33(7):572-576;580.
[15] 陶保华, 黄焘, 赖世云, 等.超高压液相色谱-串联质谱法同时测定人乳中的硫胺素、核黄素、烟酰胺、泛酸和吡哆醛[J].食品安全质量检测学报, 2014,5(7):2 087-2 094.
TAO B H, HUANG T, LAI S Y, et al.Determination of thiamin, riboflavin, nicotinamide, pantothenic acid and pyridoxal in human milk by UPLC-MS/MS[J].Journal of Food Safety & Quality, 2014,5(7):2 087-2 094.
[16] 邱永革, 李粉玲, 李丁.N-取代δ-戊内酰胺的一步法合成[J].韩山师范学院学报, 2008,29(3):47-50.
QIU Y G, LI F L, LI D.A new one-pot synthesis of n-alkyl 4-hydroxy-4-methyl-piperidin-2-one[J].Journal of Hanshan Teachers College, 2008,29(3):47-50.
[17] 赖佳佳, 陈旻实, 唐熙, 等.液相色谱-电喷雾串联质谱同时检测食品接触材料中9种有机胺物质的迁移量[J].中国口岸科学技术, 2021(4):68-77.
LAI J J, CHEN M S, TANG X, et al.Simultaneous detection of migrations of 9 organic amine substances in food contact materials by liquid chromatography electrospray ionisation tandem mass spectrometry[J].China Port Science and Technology, 2021(4):68-77.
[18] PALANDRA J, PRUSAKIEWICZ J, OZER J S, et al.Endogenous ethanolamide analysis in human plasma using HPLC tandem MS with electrospray ionization[J].Journal of Chromatography B, 2009, 877(22):2 052-2 060.
[19] PETROVICIU I, ALBU F, CRETU I, et al.Investigation of natural dyes in 15th c.documents seal threads from the Romanian Academy Library, by LC-DAD-MS (triple quadrupole)[J].Journal of Cultural Heritage, 2017, 28:164-171.
[20] UEMURA D, TOYA Y, WATANABE I, et al.Islation and structures of two new pyrazines, palythazine and isopalythazine from Palythoa tuberculosa[J].Chemistry Letters, 1979, 8(12):1 481-1 482.
[21] 张金磊, 邢丽杰, 王远, 等.超高效液相色谱-串联质谱法快速测定红枣中甜菜碱[J].安徽农业科学, 2020, 48(17):213-215;258.
ZHANG J L, XING L J, WANG Y, et al.Rapid determination of betaine in red date by UPLC-MS/MS[J].Journal of Anhui Agricultural Sciences, 2020, 48(17):213-215;258.
[22] JI C, LI M H, LI J L, et al.Synthesis of nitrosomethylisoamylamine from isoamylamine and sodium nitrite by fungi[J].Carcinogenesis, 1986, 7(2):301-303.
[23] MUSATADI M, GONZ LEZ-GAYA B, TRAZOLA M, et al.Multi-target analysis and suspect screening of xenobiotics in milk by UHPLC-HRMS/MS[J].Separations, 2021, 8(2):14.
LEZ-GAYA B, TRAZOLA M, et al.Multi-target analysis and suspect screening of xenobiotics in milk by UHPLC-HRMS/MS[J].Separations, 2021, 8(2):14.
[24] HINAWI ABDO MUSTAFA HASSANIN(阿杜).新型核糖醇脱氢酶的克隆表达、性质及其合成阿洛糖醇的应用研究[D].无锡:江南大学,2017.
HASSANIA H A M.Cloning and characterization of a new ribitol dehydrogenase and its application in allitol synthesis[D].Wuxi:Jiangnan University, 2017.
[25] 翟兴英, 张凌, 李冰涛,等.采用UPLC-Q-TOF-MS/MS分析半夏药材中的化学成分[J].中国实验方剂学杂志, 2019, 25(7):173-183.
ZHAI X Y, ZHANG L, LI B.T, et al.Chemical components in Pinelliae rhizoma by UPLC-Q-TOF-MS/MS[J].Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(7):173-183.