薏仁米属禾本科,又名薏米、六谷米等,是一种1年生或多年生草本植物,一直被用作营养膳食补充剂被人们所用[1]。薏仁米不仅富含淀粉、蛋白质、脂肪和多糖等营养成分,还含有丰富的多酚、黄酮和三萜类化合物等多种天然生物活性成分[1]。大量研究表明,薏仁米具有许多有益的健康功效,包括利尿、抗过敏、抗炎[2]和调节免疫系统[3]。我国是薏仁米种植和消费大国,拥有较为完整的薏仁米产业链[4],然而以薏仁米为原料的发酵饮品存在品质差和体外抗氧化活性不高等特点[5],严重限制了其营养和开发价值。探寻薏仁米的高值转化加工技术成为薏仁米加工企业和广大科研人员面临的重要问题。
微生物发酵是谷物生物技术加工中最古老和最经济的技术之一,因为其可延长谷物的货架期,并改善谷物的营养价值、风味和生理活性[6]。在谷物发酵过程中,微生物的代谢与谷物成分相互作用,会改变薏仁米淀粉结构、流变和糊化特性及消化率[7]。YIN等[6]研究发现接种植物乳杆菌(Lactobacillus plantarum,LP)发酵薏仁米能显著增加有机酸、游离氨基酸和可溶性膳食纤维的含量。王清爽等[8]研究发现干酪乳杆菌发酵脱脂薏仁米可显著提高总酚含量和抗氧化活性。XU等[9]研究发现酵母发酵薏仁米会显著增加低分子质量肽、游离氨基酸及总酚的含量。然而,利用多菌种协同发酵以提高薏仁米的营养和生物学特性的研究鲜有报道。
LP因其保健功能和产细菌素特性是工业发酵最常用的乳酸菌[10]。而酿酒酵母(Saccharomyces cerevisiae,SC)作为一种发酵特性优良的发酵剂,可在谷物发酵过程中产生多种水解酶,对谷物产品的结构和生物活性产生重大影响[9]。本研究分别采用LP、SC及其组合发酵薏仁米,探究多菌种协同发酵对薏仁米发酵液营养品质和抗氧化的增效性,为薏仁米的发酵工艺提供理论依据。
1 材料与方法
1.1 材料与试剂
材料:薏仁米,本地超市;LP(CICC20766)、SC(CICC33072),中国工业微生物菌种保藏管理中心。
试剂:葡萄糖、氢氧化钠、磺基水杨酸(分析纯),西陇科学股份有限公司;芦丁、没食子酸、甲醇(色谱纯),国药集团化学试剂有限公司;乳酸、乙酸、草酸、苹果酸、琥珀酸、柠檬酸,上海阿拉丁生化科技股份有限公司;DPPH自由基清除活性试剂盒、铁离子还原能力(ferric ion reducing antioxidant power,FRAP)检测试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
DHP-9082生化培养箱,上海东麓仪器设备有限公司;PHS-2F pH计,上海三信仪表厂;UV752N紫外可见分光光度计,上海佑科仪器仪表有限公司;L-8900氨基酸分析仪,日本日立公式;1260高效液相色谱仪,美国Agilent公司。
1.3 实验方法
1.3.1 菌悬液制备
将LP和SC甘油保藏管分别接入MRS和YPD液体培养基进行活化,活化2代后,4 500 r/min离心15 min,弃去上清液,无菌生理盐水重悬沉淀,分别得到活菌数为2.4×107、3.8×107 CFU/mL的LP和SC菌悬液。
1.3.2 薏仁米发酵工艺设计
参考YIN等[6]的发酵方法,并有所改动。取新鲜、无虫的干薏仁米,加入3倍质量的温水浸泡3 h,沥干水分置于垫有纱布的蒸笼中,105 ℃蒸煮15 min,将煮熟的薏仁米用2倍质量的无菌水进行打浆,分别加入0.1%(质量分数)α-淀粉酶(10 000 U)和0.2%(质量分数)纤维素酶(8 000 U),60 ℃酶解4 h,装入无菌玻璃罐,分别接种1% LP菌悬液、1%SC菌悬液和1%LP菌悬液及1%SC菌悬液的组合(LP+SC),混匀后置于37 ℃ 培养箱发酵36 h,得到发酵薏仁米,5 000 r/min离心15 min,收集上清液,-20 ℃冰箱贮存。未发酵的(non-fermented,NF)薏仁米按相同的步骤制备。
1.3.3 生物量测定
参考GB 4789.35—2016 《食品微生物学检验 乳酸菌检验》进行测定;参照GB 4789.15—2016 《食品微生物学检验 霉菌和酵母计数》进行测定。
1.3.4 pH、总酸、还原糖和可溶性蛋白的测定
使用pH计测定各组样品的pH值;采用GB 12456—2021《食品中总酸的测定》进行测定;利用GB 5009.7—2016《食品中还原糖的测定》进行测定;根据考马斯亮蓝法测定可溶性蛋白的含量[11]。
1.3.5 有机酸测定
根据杨希等[12]的方法,采用HPLC检测各种有机酸的含量。取适量发酵液,加入等体积的硫酸锌和亚铁氰化钾,8 000 r/min离心15 min取上清液,过0.22 μm滤膜后进行HPLC分析。色谱条件:色谱柱为YMC-ODS C18色谱柱,流动相为0.02 mol/L磷酸二氢钠溶液,流速为0.7 mL/min,进样量为10 μL,柱温为30 ℃,检测波长为210 nm[12]。
1.3.6 多肽分子质量分布测定
根据XU等[13]的方法,采用凝胶过滤色谱法对多肽分子质量分布进行分析。色谱条件:色谱柱为TSK-GEL G2000 SWXL凝胶色谱柱(300 mm×7.8 mm),流动相为含0.1%(体积分数)三氟乙酸的10%乙腈,流速为0.5 mL/min,检测波长为220 nm[13]。
1.3.7 游离氨基酸测定
参考XU等[13]的方法,采用氨基酸分析仪检测游离氨基酸的含量。将1 mL发酵液与9 mL 50 g/L磺基水杨酸混合均匀,室温下反应30 min,10 000 r/min离心5 min取上清液,过0.22 μm滤膜后进行氨基酸分析。分析条件:分离柱为TS263离子交换柱,流速为60 μL/min,进样量为10 μL,柱温为30 ℃,检测波长为440、570 nm[13]。
1.3.8 总黄酮、总多酚、可溶性膳食纤维和总三萜的测定
采用亚硝酸钠-硝酸铝比色法测定总黄酮的含量[14];利用Folin-Ciocalteu比色法测定总多酚的含量[14];根据GB 5009.88—2014 《食品中膳食纤维的测定》进行测定;使用香菜醛-高氯酸比色法测定总三萜的含量[15]。
1.3.9 抗氧化活性测定
使用DPPH自由基清除能力试剂盒检测DPPH自由基清除能力[14][DPPH自由基清除能力以水溶性维生素E(trolox)当量μmol TE/mL表示]及FRAP检测试剂盒检测总抗氧化能力[14][总抗氧化能力以亚铁离子(Fe2+)μmol FE/mL当量表示]。
1.4 数据处理
所有实验重复进行3次,数据结果以平均值±标准偏差的形式表示。使用GraphPad Prism 8.0和Excel 2017绘制图表。采用SPSS 21.0软件进行方差分析。
2 结果与分析
2.1 不同发酵剂对薏仁米发酵液菌落数量的影响
在谷物发酵过程中,酵母菌和乳酸菌的细胞数量对谷物产品品质和香气有显著影响[16]。由表1可知,接种发酵剂发酵的薏仁米发酵液中微生物菌落数量均远高于未发酵薏仁米,但不同发酵剂之间的微生物菌落数量差异较大。发酵36 h后,LP组中LP菌落数量可达8.85 lgCFU/mL,而SC中SC菌落数量则为8.37 lgCFU/mL。LP+SC组中LP和SC的菌落数量分别可达9.22、8.74 lgCFU/mL,均远高于只接种单一发酵剂实验组的菌落数量(P<0.05),表明乳酸菌和酵母菌在薏仁米发酵体系中呈现互利共生的关系。酵母菌分泌的脂肪酶、淀粉酶和蛋白酶分解基质物质为乳酸菌的生长提供了营养物质,同时以乳酸菌生长过程中产生的乳酸盐和半乳糖作为能源物质生长繁殖[17]。
表1 各组样品的LP和SC菌落数量的差异 单位:CFU/mL
Table 1 The difference in the number of colonies of LP and SC of each group samples
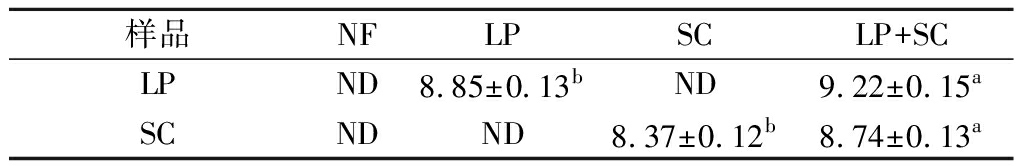
样品NFLPSCLP+SCLPND8.85±0.13bND9.22±0.15aSCNDND8.37±0.12b8.74±0.13a
注:ND表示未检出;同行不同小写字母表示差异显著(P<0.05)(下同)
2.2 不同发酵剂对薏仁米发酵液基础理化指标的影响
如图1所示,发酵36 h后,薏仁米发酵液的pH、还原糖含量和可溶性蛋白含量显著低于未发酵薏仁米(P<0.05),而总酸含量则显著高于未发酵薏仁米(P<0.05)。不同发酵剂发酵样品之间的基础理化指标存在较大差异。LP+SC组具有最低的pH和最高的总酸含量,分别为3.96、3.23 mg/mL;其次为LP组,pH和总酸含量分别为3.96、2.94 mg/mL;而SC组中pH和总酸含量分别为5.73、0.52 mg/mL,与LP+SC组和LP组差异明显。当发酵温度为37 ℃时,pH快速下降至5.3以下,可抑制沙门氏菌和金黄色葡萄球菌的生长[18]。因此,乳酸菌发酵可通过防止病原体的生长确保发酵薏仁米的安全性。乳酸菌和酵母菌的快速生长繁殖会导致薏仁米发酵液中还原糖和可溶性蛋白的迅速减少。LP+SC组具有最低的还原糖和可溶性蛋白含量,分别仅为5.67、0.42 mg/mL;LP组中可溶性蛋白含量则可达0.59 mg/mL;而SC组中还原糖含量为11.31 mg/mL,远高于LP+SC组。这是由于乳酸菌对还原糖的消耗速率强于酵母菌[19]。发酵环境的酸化会导致发酵体系中可溶性蛋白在大量H+水解作用下降解为氨基酸和多肽[10]。

a-pH;b-总酸;c-还原糖;d-可溶性蛋白
图1 各组样品的pH、总酸、还原糖和可溶性蛋白的差异
Fig.1 The differences in pH, total acid, reducing sugar and soluble protein of each group samples 注:不同小写字母表示差异显著(P<0.05)(下同)
2.3 不同发酵剂对薏仁米发酵液有机酸的影响
有机酸是微生物发酵的产物,其含量及比例会导致产品酸感的差异,并决定产品的口感[20]。由图2可知,未发酵薏仁米上清液中只检测出草酸、苹果酸、柠檬酸和琥珀酸等4种有机酸,其含量分别为73.04、158.42、22.96、23.62 μg/mL。而接种SC发酵不会改变有机酸的种类,但会改变其含量,柠檬酸和琥珀酸含量分别可达305.64、33.03 μg/mL。此外,在LP和LP+SC组中还检测到乳酸和乙酸,其中乳酸含量增加最显著,在LP和LP+SC组的含量分别可达2 150.58、2 312.67 μg/mL,分别占各组整个有机酸比例的72.63%和71.32%。乳酸作为乳酸菌的主要代谢产物,其含量会直接影响薏仁米发酵液的酸感,并且参与酯类化合物的合成[21]。柠檬酸是LP和LP+SC组中含量仅次与乳酸的有机酸,其含量分别可达435.64、538.92 μg/mL,分别占各组整个有机酸比例的14.71%和16.62%。徐磊等[22]研究发现碳水化合物酶协同干酪乳杆菌发酵可增加脱脂薏米水提取液的有机酸总含量,与本实验结果一致。
2.4 不同发酵剂对薏仁米发酵液多肽分子质量分布的影响
通常,来自植物基蛋白质水解的多肽具有多种生物活性,是一类独特的功能性食品成分[9]。由表2可知,15 000~10 000 Da的多肽占未发酵薏仁米上清液中整个多肽比例的20.26%,其次为10 000~5 000 Da的多肽。发酵36 h后,15 000~10 000、10 000~5 000、5 000~1 000、1 000~500 Da的多肽比例比未发酵薏仁米显著降低(P<0.05),而<180 Da和500~180 Da的多肽则显著增加(P<0.05),占发酵薏仁米发酵液中整个多肽比例的72.23%以上,表明发酵薏仁米发酵液中的多肽主要是二肽、三肽和氨基酸。LP+SC组中<180 Da和500~180 Da的多肽比例最高,分别可达40.44%和40.98%。这一结果与XU等[9]的研究结果相一致,说明LP和SC共发酵可将更多的长链多肽水解为短链多肽和氨基酸。

a-草酸;b-乳酸;c-苹果酸;d-柠檬酸;e-乙酸;f-琥珀酸
图2 各组样品的有机酸含量的差异
Fig.2 The differences in the contents of organic acid of each group samples
表2 各组样品的多肽分子质量分布的差异
Table 2 The difference in peptide molecular weight distribution of each group samples

多肽分子质量/DaNF/%LP/%SC/%LP+SC/%15 000~10 00020.26±1.18a5.22±0.29b4.13±0.26c3.64±0.23d10 000~5 00018.58±0.95a4.07±0.31b2.98±0.22c2.47±0.32d5 000~3 00012.34±0.72a3.43±0.33b2.61±0.19c2.23±0.18d3 000~1 00015.12±0.9a7.36±0.48b6.25±0.4c5.39±0.39d1 000~50014.73±0.87a7.69±0.45b6.22±0.42c4.85±0.38d500~18010.64±0.71d35.78±1.28c38.66±1.07b40.98±1.13a<1808.33±0.54c36.45±1.06b39.15±1.09a40.44±1.02a
2.5 不同发酵剂对薏仁米发酵液游离氨基酸的影响
如表3所示,未发酵薏仁米上清液中只检测出8种游离氨基酸,总含量为22.08 μg/mL。发酵可显著增加薏仁米发酵液中总游离氨基酸含量(P<0.05),尤其是LP+SC组的含量最高,可达120.5 μg/mL。未发酵薏仁米上清液中非必需氨基酸含量(13.47 μg/mL)是必需氨基酸(8.61 μg/mL)的1.6倍。然而,发酵36 h后,薏仁米发酵液中非必需氨基酸含量(48.34~59.79 μg/mL)与必需氨基酸(49.05~60.71 μg/mL)无显著差异。这一结果与XU等[9]的研究结果相一致,表明微生物发酵有助于提高必需氨基酸的比例。精氨酸和脯氨酸分别占未发酵薏仁米上清液非必需氨基酸的42.09%和24.79%。发酵36 h后,天冬氨酸、甘氨酸、丝氨酸、精氨酸和半胱氨酸的含量明显增加。未发酵薏仁米上清液必需氨基酸中组氨酸含量最高(5.48 μg/mL),其次是赖氨酸(3.13 μg/mL)和酪氨酸(3.13 μg/mL)。发酵后必需氨基酸含量是未发酵薏仁米的5.7~7.1倍。这一结果与YIN等[6]的研究结果相一致,说明必需氨基酸含量的增加来自微生物的代谢和其他氨基酸的转化。
表3 各组样品的游离氨基酸含量的差异 单位:μg/mL
Table 3 The difference in the contents of free amino acid of each group samples

游离氨基酸NFLPSCLP+SC天冬氨酸(Asp)ND3.49±0.16b4.02±0.21a4.35±0.23a谷氨酸(Glu)0.36±0.06d7.37±0.22c8.42±0.26b9.07±0.28a丙氨酸(Ala)2.89±0.11c14.63±0.38b17.97±0.4a18.78±0.37a甘氨酸(Gly)1.21±0.11c2.48±0.16b2.69±0.17ab2.83±0.16a丝氨酸(Ser)ND0.30±0.04b0.35±0.03ab0.39±0.04a苏氨酸(Thr)^ND0.01±0.01a0.02±0.01a0.02±0.01a赖氨酸(Lys)^3.13±0.14a2.23±0.09b1.93±0.09c1.67±0.1d脯氨酸(Pro)3.34±0.15a1.62±0.1b1.38±0.08c1.26±0.08c精氨酸(Arg)5.67±0.18b7.51±0.23a7.61±0.28a7.73±0.25a组氨酸(His)^5.48±0.19d19.79±0.42c21.77±0.45b22.75±0.42a异亮氨酸(Ile)^ND1.01±0.09b1.31±0.11a1.37±0.1a亮氨酸(Leu)^ND5.10±0.17c6.59±0.2b7.34±0.24a蛋氨酸(Met)^ND1.97±0.14b2.28±0.16ab2.53±0.16a苯丙氨酸(Phe)^ND9.05±0.31c10.88±0.34b12.01±0.36a缬氨酸(Val)^ND9.89±0.3c11.98±0.32b13.02±0.36a酪氨酸(Tyr)3.13±0.16a2.23±0.13b1.93±0.11c1.67±0.08d半胱氨酸(Cys)ND6.15±0.22c7.66±0.24b8.52±0.27a必需氨基酸8.61±0.25d49.05±1.38c56.76±1.54b60.71±1.61a非必需氨基酸13.47±0.34d48.34±1.29c56.05±1.51b59.79±1.58a总氨基酸22.08±0.48d97.39±2.23c112.81±2.83b120.5±3.02a
注:^表示必需氨基酸
2.6 不同发酵剂对薏仁米发酵液总黄酮、总多酚、总三萜和可溶性膳食纤维的影响
由图3-a和图3-b可知,未发酵薏仁米上清液中总黄酮和总多酚含量分别为32.53、433.63 μg/mL。发酵可显著增加薏仁米发酵液中总黄酮和总多酚含量(P<0.05),分别增加了79.37%~128.07%和68.53%~91.42%。在微生物发酵麦麸中也发现总黄酮和总多酚增加的类似情况[23]。发酵36 h后,LP+SC组中总黄酮和总多酚含量最高,分别可达74.19、830.06 μg/mL,表明乳酸菌和酵母菌共发酵促进黄酮和多酚类化合物的释放及转化。谷物中的多酚类化合物以游离和结合形式存在[24]。微生物代谢产生的蛋白酶、纤维素酶和果胶酶可从不溶性基质中释放结合酚类化合物,并将其水解为游离形式,增加发酵产物中多酚含量[9]。如图3-c和3-d所示,未发酵薏仁米上清液中总三萜和可溶性膳食纤维的含量分别为10.65、133.05 μg/mL。发酵后各组薏仁米发酵液中总三萜和可溶性膳食纤维的含量均显著增加(P<0.05)。其中,LP+SC组中总三萜和可溶性膳食纤维的含量最高,分别可达30.34、212.55 μg/mL,分别比未发酵薏仁米提高了184.88%和59.78%。乳酸菌和酵母菌互利共生生成更多的淀粉酶和蛋白酶,促进三萜类化合物和可溶性膳食纤维溶出及合成。发酵后产生的三萜类化合物和可溶性膳食纤维可能增加薏仁米发酵液的益生功效。

a-总黄酮;b-总多酚;c-总三萜;d-可溶性膳食纤维
图3 各组样品的总黄酮、总多酚、总三萜和可溶性 膳食纤维的含量差异
Fig.3 The differences in the contents of total flavonoids, total polyphenols, total triterpenes and soluble dietary fiber of each group samples
2.7 不同发酵剂对薏仁米发酵液抗氧化的影响
DPPH自由基清除活性和还原能力通常被用来评估目标物抗氧化活性强弱。由图4可知,未发酵薏仁米发酵液的DPPH自由基清除活性和FRAP分别为2.59 μmol TE/mL和3.12 μmol FE/mL。发酵后各组薏仁米发酵液中DPPH自由基清除活性和FRAP均显著增加(P<0.05)。LP组中DPPH自由基清除活性和FRAP分别为3.43 μmol TE/mL和3.87 μmol FE/mL,而SC组DPPH自由基清除活性和FRAP则分别为3.13 μmol TE/mL和3.96 μmol FE/mL。LP+SC组的DPPH自由基清除活性和FRAP最强,分别可达3.52 μmol TE/mL和4.04 μmol FE/mL。这可能与乳酸菌和酵母菌的代谢产物及薏仁米发酵液中活性物质变化有关[9]。徐磊等[25]研究结果表明不同蛋白酶血糖干酪乳杆菌发酵可以提高脱脂薏米水提取液的抗氧化能力,与本实验结果一致。

a-DPPH自由基清除活性;b-FRAP
图4 各组样品的抗氧化活性的差异
Fig.4 The differences in antioxidant activity of each group samples
3 结论
本文将LP、SC及其组合用于薏仁米发酵,研究不同发酵剂微生物的变化及其对薏仁米发酵液基础理化指标、有机酸、多肽分子质量分布、游离氨基酸、总黄酮、总多酚、总三萜和可溶性膳食纤维及体外抗氧化活性的影响。结果表明,LP和SC在薏仁米发酵过程中表现为互利共生的关系。此外,LP和SC共发酵可显著提高薏仁米发酵液中总酸、乳酸、总黄酮、总多酚、总三萜和可溶性膳食纤维的含量,加速pH的降低及还原糖及可溶性蛋白的消耗。多菌种混合发酵还会显著提高薏仁米发酵液中<180 Da和500~180 Da多肽的比例,并增加游离氨基酸的含量,尤其可提高必需氨基酸的比例。本研究发现,LP与SC共发酵薏仁米在品质和抗氧化方面具有增效性,为薏仁米的发酵工艺提供理论依据。
[1] ZHU F.Coix:Chemical composition and health effects[J].Trends in Food Science & Technology, 2017, 61(7):160-175.
[2] CHEN H J, CHUNG C P, CHIANG W C, et al.Anti-inflammatory effects and chemical study of a flavonoid-enriched fraction from adlay bran[J].Food Chemistry, 2010, 126(4):1 741-1 748.
[3] YIN H M, WANG S N, NIE S P, et al.Coix polysaccharides:Gut microbiota regulation and immunomodulatory[J].Bioactive Carbohydrates and Dietary Fibre, 2018, 16(10):53-61.
[4] 徐磊, 高珊, 王心, 等.米根霉发酵对脱脂薏米麸皮营养组成及抗氧化活性的影响[J].中国粮油学报, 2021, 36(2):16-22.
XU L, GAO S, WANG X, et al.Effect of Rhizopus oryzae fermentation on nutritional components and antioxidant activity of defatted adlay bran[J].Journal of the Chinese Cereals and Oils Association, 2021, 36(2):16-22.
[5] 汪琢, 梁鑫, 王虹玲.薏米与番石榴复合乳酸发酵饮料的研制[J].包装工程, 2021, 42(3):12-18.
WANG Z, LIANG X, WANG H L.Preparation of barley and guava compound lactic acid fermented beverage[J].Packaging Engineering, 2021, 42(3):12-18.
[6] YIN H M, ZHONG Y D, XIA S K, et al.Effects of fermentation with Lactobacillus plantarum NCU137 on nutritional, sensory and stability properties of Coix (Coix lachryma-jobi L.) seed[J].Food Chemistry, 2020, 314:126037.
[7] DING Y Y, CHENG J J, LIN Q Y, et al.Effects of endogenous proteins and lipids on structural, thermal, rheological, and pasting properties and digestibility of adlay seed (Coix lacryma-jobi L.) starch[J].Food Hydrocolloids, 2021, 111:106254.
[8] 王清爽, 高珊, 朱灵灵, 等.干酪乳杆菌发酵对脱脂薏米营养品质的影响[J].中国食品学报, 2021, 21(3):146-152.
WANG Q S, GAO S, ZHU L L, et al.Effect of Lactobacillus casei fermentation on the nutrition quality of defatted adlay[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(3):146-152.
[9] XU L, ZHU L L, DAI Y Q, et al.Impact of yeast fermentation on nutritional and biological properties of defatted adlay (Coix lachryma-jobi L.)[J].LWT, 2021, 137:110396.
[10] 王越, 赵文谨, 谢云飞, 等.强化发酵对诺丽果成分的影响及抗氧化活性研究[J].食品工业科技, 2020, 41(15):143-149;157.
WANG Y, ZHAO W J, XIE Y F, et al.Effects of intensified fermentation on the components of noni fruit and its antioxidant activity[J].Science and Technology of Food Industry, 2020, 41(15):143-149;157.
[11] 黄婉玉, 曹炜, 李菁, 等.考马斯亮蓝法测定果汁中蛋白质的含量[J].食品与发酵工业, 2009, 35(5):160-162.
HUANG W Y, CAO W, LI J, et al.Determination of protein content in juice by Coomassie brilliant blue[J].Food and Fermentation Industries, 2009, 35(5):160-162.
[12] 杨希, 武爱群.酸菜发酵过程中理化因子及原核微生物群落结构差异分析[J].食品与发酵工业, 2020, 46(22):245-251.
YANG X, WU A Q.Differences in physicochemical properties and prokaryotic microbial communities during the fermentation of Chinese sauerkraut[J].Food and Fermentation Industries, 2020, 46(22):245-251.
[13] XU L, GAO S, XU H, et al.Impact of incubation on nutritional and antioxidant properties of defatted adlay (Coix lachryma-jobi L.) bran[J].LWT, 2021, 137:110463.
[14] 赵荣敏. 不同益生菌发酵剂对复合果蔬汁品质的影响[J].食品研究与开发, 2021, 42(9):144-150.
ZHAO R M.Effects of fermentation with different probiotics on the quality of compound fruit and vegetable juice[J].Food Research and Development, 2021, 42(9):144-150.
[15] 李维嘉, 王志强, 许泽群, 等.分光光度法测定灵芝孢子油中总三萜的含量[J].食品研究与开发, 2019, 49(17):165-170.
LI W J, WANG Z Q, XU Z Q, et al.Determination of total triterpenoids in Ganoderma lucidum spore oil by spectrophotometry[J].Food Research and Development, 2019, 49(17):165-170.
[16] CHEN Z N, LIU T, YE T, et al.Effect of lactic acid bacteria and yeasts on the structure and fermentation properties of Tibetan kefir grains[J].International Dairy Journal, 2021, 114:104943.
[17] 段小果, 李博, 贺银凤.乳酸菌与酵母菌共生机理的研究进展[J].微生物学通报, 2017, 44(8):1 988-1 995.
DUAN X G, LI B, HE Y F.Progress in symbiotic mechanism between lactic acid bacteria and yeast[J].Microbiology China, 2017, 44(8):1 988-1 995.
[18] LÜCKE F K.Utilization of microbes to process and preserve meat[J].Meat Science, 2000, 56(2):105-115.
[19] 李佩佩, 颉向红, 王聪, 等.不同发酵方式下枸杞饮料主要成分及其抗氧化活性[J].食品与发酵工业, 2019, 45(24):90-97.
LI P P, XIE X H, WANG C, et al.Main components and antioxidant activities of Lycium barbarum L.beverages using two different fermentation processes[J].Food and Fermentation Industries, 2019, 45(24):90-97.
[20] 马艺荧, 孙波, 张宇, 等.东北酸菜不同发酵时间有机酸变化及其对产品酸感的影响[J].食品与发酵工业, 2019, 45(5):45-50.
MA Y Y, SUN B, ZHANG Y, et al.Changes in organic acids at different fermentation time of Northeastern sauerkraut and their effects on products sourness[J].Food and Fermentation Industries, 2019, 45(5):45-50.
[21] NSOGNING DONGMO S, PROCOPIO S, SACHER B, et al.Flavor of lactic acid fermented malt based beverages:Current status and perspectives[J].Trends in Food Science & Technology, 2016, 54:37-51.
[22] 徐磊, 戴玉淇, 王心, 等.碳水化合物酶协同发酵对脱脂薏米水提取液营养品质的影响[J].中国粮油学报, 2021, 36(5):142-148.
XU L, DAI Y Q, WANG X, et al.Effects of fermentation with carbohydrase addition on nutrition value of the defatted adlay water extract[J].Journal of the Chinese Cereals and Oils Association, 2021, 36(5):142-148.
[23] MOORE J, CHENG Z H, HAO J J, et al.Effects of solid-state yeast treatment on the antioxidant properties and protein and fiber compositions of common hard wheat bran[J].Journal of Agricultural and Food Chemistry, 2007, 55(25):10 173-10 182.
[24] ZHAO M M, ZHU D S, SUN-WATERHOUSE D X, et al.In vitro and in vivo studies on adlay-derived seed extracts:Phenolic profiles, antioxidant activities, serum uric acid suppression, and xanthine oxidase inhibitory effects[J].Journal of Agricultural and Food Chemistry, 2014, 62(31):7 771-7 778.
[25] 徐磊, 王清爽, 高珊, 等.菌酶协同处理提高脱脂薏米水提取液营养价值[J].农业工程学报, 2020, 36(12):303-309.
XU L, WANG Q S, GAO S, et al.Improving nutrition value of the defatted adlay water extract by using fermentation with enzyme[J].Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(12):303-309.