石花菜是一种海藻,是提取琼脂的重要原料,并广泛分布于亚洲国家。石花菜具有多种生物学活性,包括增强免疫活性,改善脂质代谢和预防饮食引起的肥胖症[1]。细毛石花菜(Gelidium crinale.)又名马毛(山东)、狗毛菜(广东)、岩衣(浙江),也是一种石花菜科石花菜属的海洋经济红藻,是一种传统的食用藻类,很可能表现出与石花菜相似的生物学活性,目前,仅见少数有关细毛石花菜的研究。多糖是石花菜中含量最多的生物活性组分,且以半乳聚糖含量最高、研究最广[2]。近年来从海藻中分离出的多糖引起了越来越多的关注。海藻中的硫酸多糖具有抗氧化,抗炎和其他药理活性[3-4],可用于营养保健,制药和化妆品行业。目前,尚不清楚来自细毛石花菜的多糖是否能表现出抗氧化活性。
活性氧(reactive oxygen species,ROS)是通过正常的代谢活动产生的。当ROS过量时,与蛋白质、脂质和核酸发生反应,破坏氧化还原平衡[5]。在生物系统中,ROS的形成和清除能力之间的平衡是至关重要的,这种平衡向ROS形成的转变被称为氧化应激[6]。ROS过量会导致衰老,增加患各种人类疾病的风险,如心血管[7]、糖尿病[8]、和癌症[9]等。因此,严格控制ROS水平显然对生物系统至关重要。目前,合成抗氧化剂能够有效地帮助人体减少氧化损伤,然而产生的副作用可能导致肝损伤和其他疾病。因此,利用和开发天然抗氧化剂是必要的,因为它们可以帮助人体消除过量产生的ROS[10]。近年来,从海洋动植物、细菌、真菌和高等植物等天然来源开发抗氧化剂在食品工业和预防医学领域引起了极大的兴趣。其中,海藻是生物活性物质最丰富的来源之一,海藻衍生产品的应用日益广泛。近几十年来,大量的研究表明,海藻中的硫酸多糖在体外可作为自由基清除剂、预防生物体氧化损伤的抗氧化剂以及肿瘤细胞的生长抑制剂[11-12]。因此,硫酸多糖具有有效的抗氧化活性。
本研究从细毛石花菜中分离出硫酸化多糖,并对其理化性质进行分析。在脂多糖(lipopolysaccharide,LPS)刺激的RAW264.7细胞中评估了来自细毛石花菜的硫酸多糖的抗氧化作用,本研究为细毛石花菜多糖的研究和开发提供了实验数据。
1 材料与方法
1.1 材料与仪器
新鲜细毛石花菜采集于广东省湛江市硇洲岛;小鼠巨噬细胞RAW264.7细胞,苏州北纳创联生物技术有限公司;高糖培养基(dulbecco′s modified eagle medium,DMEM)、胰蛋白酶、青霉素/链霉素(双抗)、胎牛血清(fetal bovine serum,FBS),美国Gibco公司;噻唑蓝(methyl thiazolyl tetrazolium,MTT)、LPS,美国Sigma公司;菲洛嗪、氯化亚铁,上海麦克林生化科技有限公司;2′,7′-二氯荧光黄双乙酸盐(2′,7′-dichlorofluorescent yellow diacetate,DCFH-DA)荧光探针,上海碧云天生物技术有限公司。
BC-J8二氧化碳培养箱,松下健康医疗器械株式会社;N-4000旋转蒸发,东京理化器械株式会社;ALPHA 1-2 LD plus冷冻干燥仪,德国Christ公司;Epoch酶标仪,Bioteck仪器公司;IX73倒置荧光显微镜,日本东京奥林巴斯有限公司。
1.2 实验方法
1.2.1 多糖的提取
多糖提取工艺流程如图1所示,称取500 g硇洲细毛石花菜,洗净、干燥、粉碎,以料液比1∶8(g∶mL)加入90%(体积分数)乙醇浸泡4 h,收集滤渣,干燥至恒重,以料液比1∶8(g∶mL)加入0.1 mol/L的HCl浸泡8 h,中和溶液后离心收集上清液,旋转蒸发浓缩,加入3倍体积的无水乙醇,4 ℃醇沉24 h,离心收集沉淀,透析48 h,冷冻干燥,即获得细毛石花菜多糖,备用。

图1 多糖提取流程图
Fig.1 Flow chart of polysaccharide extraction
1.2.2 细毛石花菜多糖化学组成分析
采用苯酚-硫酸比色法[13]测定细毛石花菜多糖的总糖含量;采用BCA(bicinchoninic acid)法[9]测定蛋白浓度;采用明胶比浊法[13]测定硫酸基团含量;采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)[14]法测定还原糖。
1.2.3 细毛石花菜多糖单糖组成分析
细毛石花菜多糖的单糖组成通过1-苯基-3-甲基-5-吡唑啉酮柱前衍生结合HPLC的方法测定[15]。首先,将样品多糖(10 mg)通过三氟乙酸溶液在110 ℃下水解6 h,然后冷却至环境温度。然后,加入甲醇(1 mL),用氮气干燥并再重复3~4次以除去过量的三氟乙酸。通过将0.3 mol/L NaOH溶液溶解在10 mL 恒定体积中获得多糖水解物。另外,通过使用1-苯基-3-甲基-5-吡唑啉酮作为衍生剂对标准单糖和样品单糖进行衍生。将混合标准单糖溶液和样品多糖水解产物与等体积的NaOH(0.6 mol/L)溶液混合。将化合物与1-苯基-3-甲基-5-吡唑啉酮混合后,反应在70 ℃下进行2 h。加入HCl将pH调至7,并加入水将溶液体积稀释至1 mL。加入氯仿,以4 000 r/min离心10 min,弃去有机溶液,重复萃取3次,并以恒定体积将水添加至2 mL。样品和标准物质首先通过0.45 μm的微孔过滤器,然后进行HPLC分析。最后,通过配备有带有30 ℃柱温检测器的UV检测器的Agilent Eclipse XDB-C18色谱柱(250 mm×4.6 mm,5 μm)的HPLC仪器进一步检测混合物。在等度洗脱条件下,流动相为磷酸盐缓冲溶液(pH=6.6)与乙腈按一定体积比(80∶20)混合。
1.2.4 细毛石花菜多糖分子质量测定
细毛石花菜多糖的分子质量通过凝胶渗透色谱系统(gel permeation chromatography,GPC)测量,该系统配备了Waters 515折射率检测器和Shodex SBOHPAK-806-803色谱柱。500 μL样品被注入,流速设定为1 mL/min。分子质量对数和时间分别用作纵坐标和横坐标。经过数据分析,获得了重均分子质量(Mw),数均分子质量(Mn)和多分散性(Mw/Mn)的信息。
1.2.5 红外光谱测定细毛石花菜多糖组分
参照JIA等[16]的方法,先将溴化钾用玛瑙研钵研磨,再过孔径为0.147 mm的网筛,并在红外灯下干燥4 h,以溴化钾压成半透明薄片做空白,以样品与溴化钾混合制成压片,在4 000~400 cm-1范围内进行扫描。
1.2.6 体外抗氧化活性
1.2.6.1 ABTS阳离子自由基清除能力测定
参考WANG等[17]所描述的方法稍作改动。将过硫酸钾储备液(2.45 mmol/L)与ABTS储备液(7 mmol/L)按体积比1∶1制备ABTS阳离子自由基储备溶液,并在黑暗中室温保持16 h。ABTS阳离子自由基储备溶液用10 mmol/L磷酸盐缓冲盐水(pH = 7.4)稀释,在734 nm处的吸光度为0.700±0.020。将0.5 mL不同质量浓度的细毛石花菜多糖(0.2、0.5、1.0、2.0、4.0和8.0 mg/mL)与2.5 mL ABTS阳离子自由基溶液混合并在室温下反应30 min,在734 nm处测量吸光值。多糖的ABTS阳离子自由基清除率计算如公式(1)所示:
ABTS阳离子自由基清除率![]()
(1)
式中:A1为0.5 mL不同质量浓度的细毛石花菜多糖+2.5 mL ABTS阳离子自由基溶液;A2为0.5 mL不同质量浓度的细毛石花菜多糖+2.5 mL磷酸盐缓冲溶液;A0为0.5 mL 超纯水+2.5 mL ABTS阳离子自由基溶液。
1.2.6.2 Fe2+螯合能力测定
根据AGRAWAL等[18]所描述的方法进行一些改动。将1 mL不同质量浓度(0.2、0.5、1.0、2.0、4.0和8.0 mg/mL)的细毛石花菜多糖与0.1 mL FeCl2(2 mmol/L)及0.2 mL菲洛嗪(5 mmol/L)混合,充分摇匀,在室温下静置15 min,并在562 nm处测定混合物的吸光度。Fe2+螯合能力计算如公式(2)所示:
Fe2+螯合能力![]()
(2)
式中:A1为1 mL不同质量浓度的细毛石花菜多糖+0.1 mL FeCl2+0.2 mL菲洛嗪;A2为1 mL不同质量浓度的细毛石花菜多糖+0.3 mL超纯水;A0为1 mL超纯水+0.1 mL FeCl2+0.2 mL菲洛嗪
1.2.6.3 DPPH自由基清除能力测定
参考JIA等[11]的方法测定并稍作修改。将2 mL不同质量浓度(0.2、0.5、1.0、2.0、4.0和8.0 mg/mL)的细毛石花菜多糖与4 mL DPPH-甲醇(0.05 mg/mL)溶液混合,在室温下避光反应30 min。在517 nm处测量吸光值。细毛石花菜多糖对DPPH自由基清除率计算如公式(3)所示:
DPPH自由基清除率![]()
(3)
式中:A1为2 mL不同质量浓度的细毛石花菜多糖+4 mL DPPH;A2为2 mL不同质量浓度的细毛石花菜多糖+4 mL甲醇;A0为2 mL超纯水+4 mL DPPH
1.2.6.4 羟自由基清除能力测定
根据WANG等[17]所描述的方法并稍作改动。分别加入2 mL H2O2(9 mmol/L),FeSO4(9 mmol/L)和不同质量浓度(0.2、0.5、1.0、2.0、4.0和8.0 mg/mL)的细毛石花菜多糖到15 mL比色管中。然后使混合溶液在25 ℃下反应10 min。然后,将2 mL的水杨酸(9 mmol/L)加入到混合物中,反应30 min,测量510 nm处吸光值。羟自由基清除率计算如公式(4)所示:
羟自由基清除率![]()
(4)
式中:A1为2 mL不同质量浓度的细毛石花菜多糖+2 mL FeSO4+2 mL H2O2+2 mL水杨酸;A2为2 mL不同质量浓度的细毛石花菜多糖+6 mL超纯水;A0为2 mL超纯水+2 mL FeSO4+2 mL H2O2+2 mL水杨酸
1.2.7 细胞培养
小鼠巨噬细胞RAW264.7细胞培养在的DMEM培养基中(含10%FBS和1%双抗,体积分数),放置在温度为37 ℃的CO2(5%,体积分数)培养箱中。
1.2.8 细毛石花菜多糖对RAW264.7细胞存活的影响
将RAW264.7细胞以5×103个/孔的浓度接种到96孔板中,每孔100 μL,然后再孵育24 h,然后将不同质量浓度(10、50、100、200 μg/mL)的100 μL的细毛石花菜多糖加入孔中孵育24 h。之后每孔加入100 μL(0.5 mg/mL)MTT,孵育4 h。弃掉上清液,并加入100 μL二甲基亚砜,使细胞中的沉淀充分溶解。用酶标仪在540 nm下测定混合物的吸光值。
1.2.9 ROS含量的测定
使用荧光探针DCFH-DA测量细胞内ROS的产生。将RAW264.7细胞以3×104个/孔的浓度接种到24孔板中,并用然后将不同质量浓度(10、50、100、200 μg/mL)的100 μL的细毛石花菜多糖加入孔中孵育2 h,再加入10 μL(1 μg/mL)的LPS孵育24 h。随后用灭菌的磷酸盐缓冲盐水洗涤3次。每孔加入500 μL(10 μmol/L)DCFH-DA后,避光孵育30 min,用荧光倒置显微镜拍照[19]。
DCFH-DA测量细胞内ROS水平。Hoechst 33342是一种用于对DNA进行染色的荧光染料,用于测量每个孔中剩余的RAW264.7细胞数量。将浓度为10 mol/L的DCF加入到96孔板。孵育25 min后用磷酸盐缓冲盐水洗涤细胞。然后加入质量浓度为5 μg/mL的Hoechst 33342孵育15 min。使用荧光酶标仪测定Hoechst 33342和DCFH-DA的荧光值。Hoechst 33342的激发长和发射波长分别为350 nm和460 nm,DCF的激发波长和发射波长分别为485 nm和530 nm[20]。
1.2.10 超氧化物歧化酶(superoxide dismutase,SOD)水平测定
RAW264.7细胞以5×106个/孔的浓度接种到6孔板中孵育24 h。吸弃旧培养基,然后将不同质量浓度(10、50、100、200 μg/mL)的100 μL的细毛石花菜多糖加入孔中孵育2 h,再加入10 μL(1 μg/mL)的LPS孵育24 h。吸弃旧培养基,用灭菌的磷酸盐缓冲盐水洗涤,并加入70 μL裂解缓冲液,在冰上裂解30 min。测定蛋白含量,并通过聚丙烯酰胺凝胶电泳和转移膜处理,将目标蛋白转移到硝酸纤维素膜上。然后用脱脂牛奶(质量分数为5%)封闭2 h,用一抗(稀释比例为1∶500)在4 ℃下孵育过夜。在室温下用二抗(稀释比例为1∶2 000)孵育2 h,然后用缓冲液洗涤3次,最后利用显色观察并拍照记录[21]。
1.2.11 统计学分析
每组实验重复3次,结果采用X±SD表示。采用Origin 2021、Image J和Graphpad Prism 8.0软件进行数据处理分析及制图。显著性差异使用单因素方差分析(one-way ANOVA)和t-test分析。
2 结果与分析
2.1 细毛石花菜多糖的化学组分
经测定细毛石花菜多糖中总糖占比为70.51%,蛋白质占比为5.27%,还原糖占比为8.42%,硫酸基团占比为16.50%。并对细毛石花菜多糖的单糖组成进行分析,结果如表1所示,细毛石花菜多糖主要是由核糖、鼠李糖、葡萄糖醛酸、氨基半乳糖、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖组成。其中半乳糖含量最高,岩藻糖和木糖次之。半乳糖所占的比例超过了所有单糖的一半,含量最少的是阿拉伯多糖。并且经GPC定细毛石花菜多糖的相对分子质量为25.80 kDa。
表1 细毛石花菜多糖的单糖组成
Table 1 Monosaccharide composition of polysaccharide from Gelidium crinale
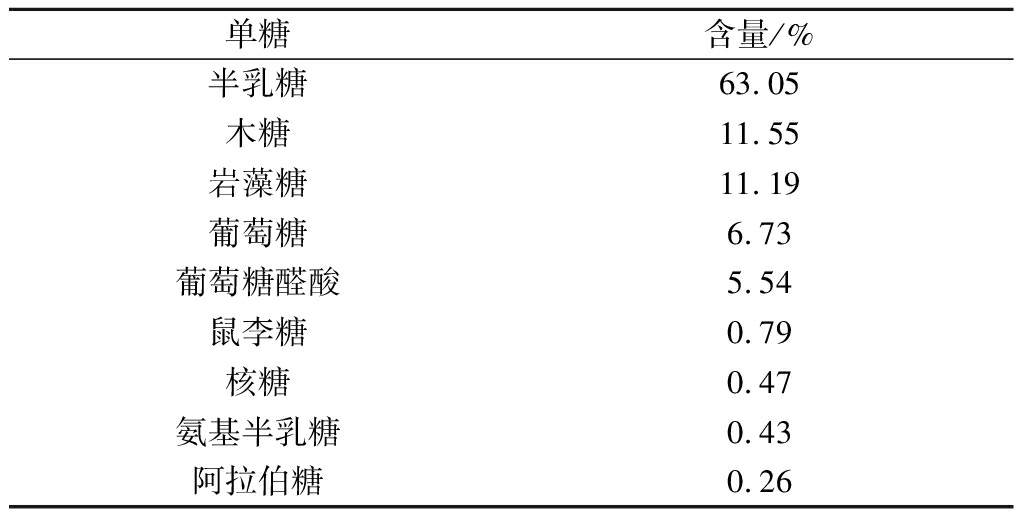
单糖含量/%半乳糖63.05木糖11.55岩藻糖11.19葡萄糖6.73葡萄糖醛酸5.54鼠李糖0.79核糖0.47氨基半乳糖0.43阿拉伯糖0.26
2.2 细毛石花菜多糖的结构表征
由图2可以看出,在大约3 400 cm-1处出现了O—H特征强带,表明多糖链之间存在强烈的分子内或分子间相互作用。约2 930 cm-1处的弱带归因于C—H拉伸振动。吸收带的范围从1 600~1 650 cm-1是由C![]() O非对称拉伸振动引起的,这证明糖醛酸的存在,是酸性多糖[16]。在1 200~1 250 cm-1处有S
O非对称拉伸振动引起的,这证明糖醛酸的存在,是酸性多糖[16]。在1 200~1 250 cm-1处有S![]() O 的伸缩振动,S
O 的伸缩振动,S![]() O为硫酸基的特征基团[13]。大约在1 000~1 200 cm-1处的强吸收带归因于存在C—O—C和C—O—H伸缩振动,其为吡喃糖环。此外,在896 cm-1处的特征吸收表明多糖中存在β构型[22]。
O为硫酸基的特征基团[13]。大约在1 000~1 200 cm-1处的强吸收带归因于存在C—O—C和C—O—H伸缩振动,其为吡喃糖环。此外,在896 cm-1处的特征吸收表明多糖中存在β构型[22]。

图2 细毛石花菜多糖的FT-IR光谱
Fig.2 FT-IR spectra of polysaccharide from Gelidium crinale
2.3 体外抗氧化活性
2.3.1 ABTS阳离子自由基清除能力测定
ABTS还经常用于测量食品和药品中天然化学物质的抗氧化能力。细毛石花菜多糖的ABTS阳离子自由基清除能力如图3所示。细毛石花菜多糖表现出良好的ABTS阳离子自由基清除活性,并且还观察到浓度依赖性自由基清除作用。当多糖质量浓度从0.2 mg/mL 增加到8 mg/mL时,细毛石花菜多糖的清除率从3.85%增加到89.10%,计算出ABTS阳离子自由基清除能力的IC50为2.215 mg/mL。在ABTS阳离子自由基系统中表现出出色的抗氧化活性。

图3 细毛石花菜多糖对ABTS阳离子自由基清除率的影响
Fig.3 The effect of polysaccharide from Gelidium crinale on the scavenging rate of ABTS free radicals
2.3.2 Fe2+螯合能力测定
铁是人体中重要的过度金属元素,通过Fe2+和Fe3+之间的转换直接参与人体内电子的传递过程以及氧化还原反应。细毛石花菜多糖的亚铁离子螯合能力评价见图4,细毛石花菜多糖表现出良好的亚铁离子螯合能力,并且还观察到浓度依赖性自由基清除作用。当多糖质量浓度从0.2 mg/mL增加到8 mg/mL时,细毛石花菜多糖的清除率从0.21%增加到76.81%,计算出Fe2+螯合能力的IC50为2.688 mg/mL,表现出出色的抗氧化活性。
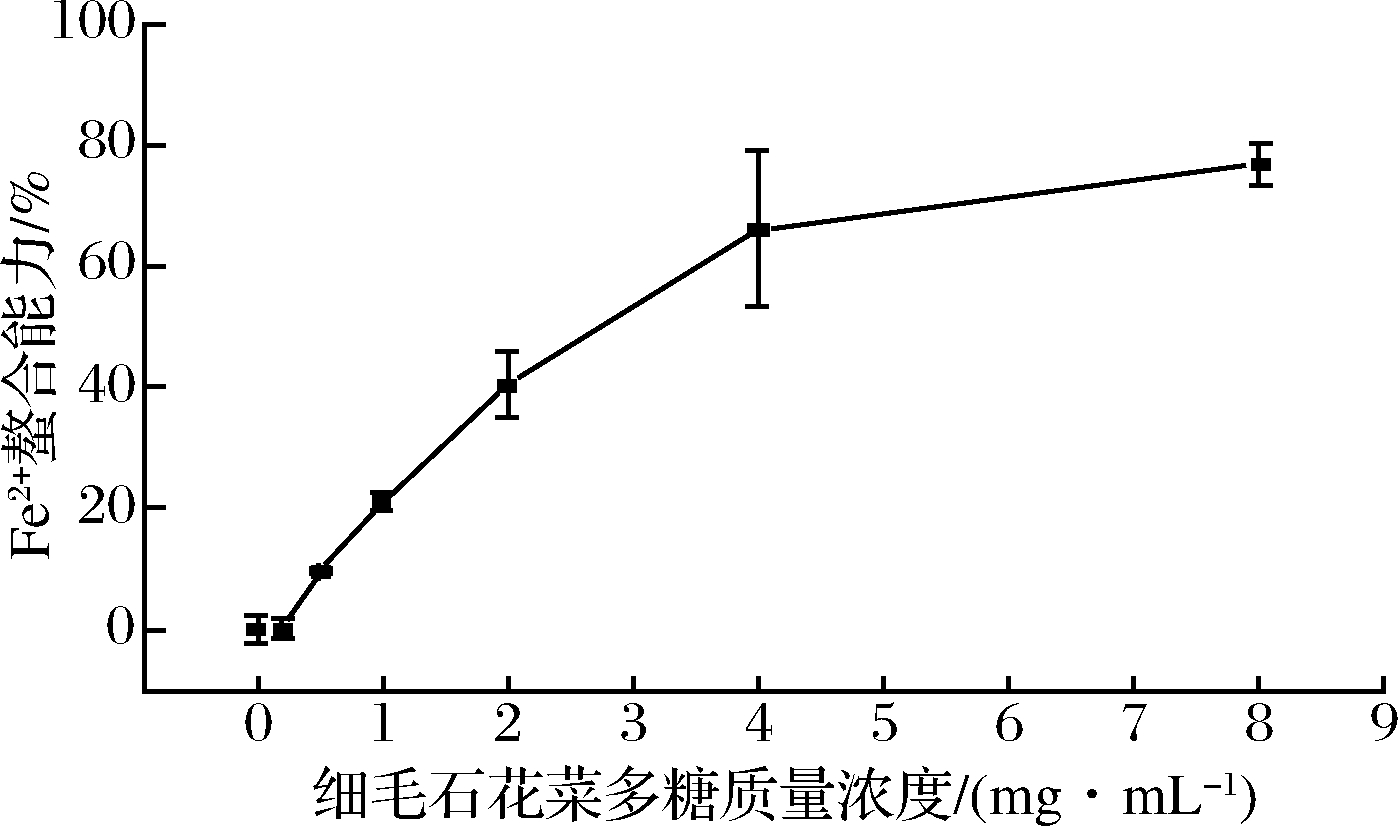
图4 细毛石花菜多糖对Fe2+螯合能力的影响
Fig.4 The effect of polysaccharide from Gelidium crinale on Fe2+ chelating ability
2.3.3 DPPH自由基清除能力测定
DPPH自由基能够接受自由基,成为稳定的抗磁性分子。因此,DPPH被广泛用于测试各种化合物的自由基清除能力。细毛石花菜多糖的DPPH自由基清除能力如图5所示。当多糖质量浓度从0.2 mg/mL增加到8 mg/mL时,DPPH自由基清除率从3.02%增加到56.11%,计算出DPPH自由基清除能力的IC50为7.408 mg/mL。结果表明,细毛石花菜多糖表现出较强的抗氧化活性。
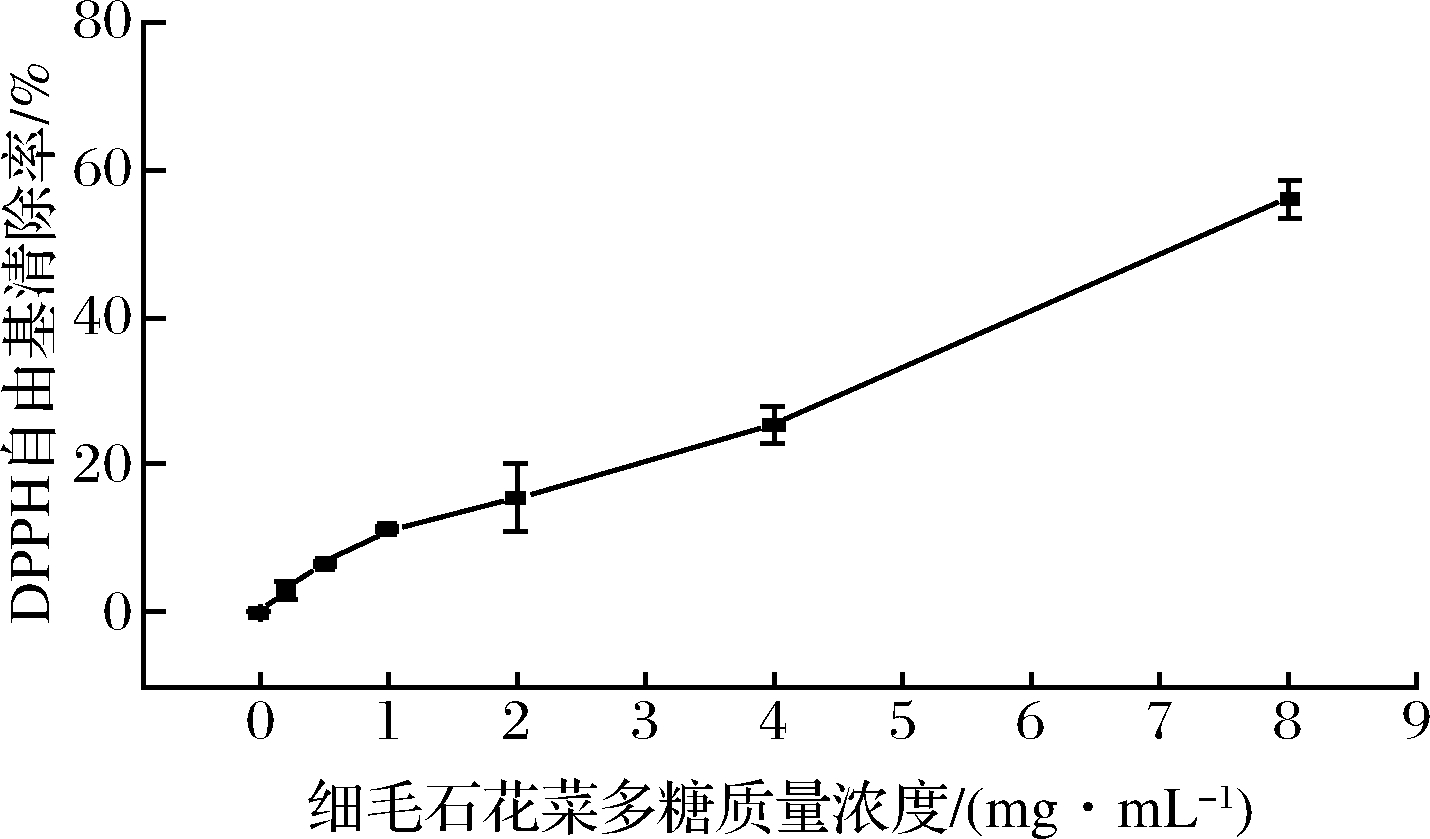
图5 细毛石花菜多糖对DPPH自由基清除率的影响
Fig.5 The effect of polysaccharide from Gelidium crinale on the scavenging rate of DPPH free radical
2.3.4 羟自由基清除能力测定
羟自由基非常活泼,并且在体内的寿命短,同时对有机体有害。因此,除去羟自由基对于抗氧化剂在细胞或食物系统中的防御至关重要。细毛石花菜多糖的羟自由基清除能力如图6所示。当多糖质量浓度从0.2 mg/mL增加到12 mg/mL时,羟自由基清除率分别从11.09%增加到50.43%,计算出羟自由基清除能力的IC50为13.56 mg/mL。结果表明,细毛石花菜多糖表现出较强的抗氧化活性。

图6 细毛石花菜多糖对羟自由基清除率的影响
Fig.6 The effect of polysaccharide from Gelidium crinale on the scavenging rate of hydroxyl free radical
2.4 细胞活力测定
由图7可以看出,与不加细毛石花菜多糖的空白组相比,加入细毛石花菜多糖(10、50、100、200 μg/mL)的实验组细胞存活率无明显变化。说明细毛石花菜多糖对RAW264.7细胞无毒性作用,可选择该质量浓度的细毛石花菜多糖做后续实验。

图7 细毛石花菜多糖对RAW264.7细胞活力的影响
Fig.7 The effect of polysaccharide from Gelidium crinale on the viability of RAW264.7 cells
2.5 细毛石花菜多糖对ROS的清除
氧化是许多生物体生产能量以推动生物过程所必需的。然而,在病理条件下,ROS常常过量表达,导致氧化应激[6]。如图8、图9所示,与空白组相比,加入LPS后DCF荧光值的增加,细胞内ROS的产生显著增加。细毛石花菜多糖处理的ROS的产生以浓度依赖的方式减少(P<0.001),这表明细毛石花菜多糖能够有效降低LPS诱导的ROS生成。

图8 细毛石花菜多糖对ROS的清除作用
Fig.8 Scavenging effect of polysaccharide from Gelidium crinale on ROS
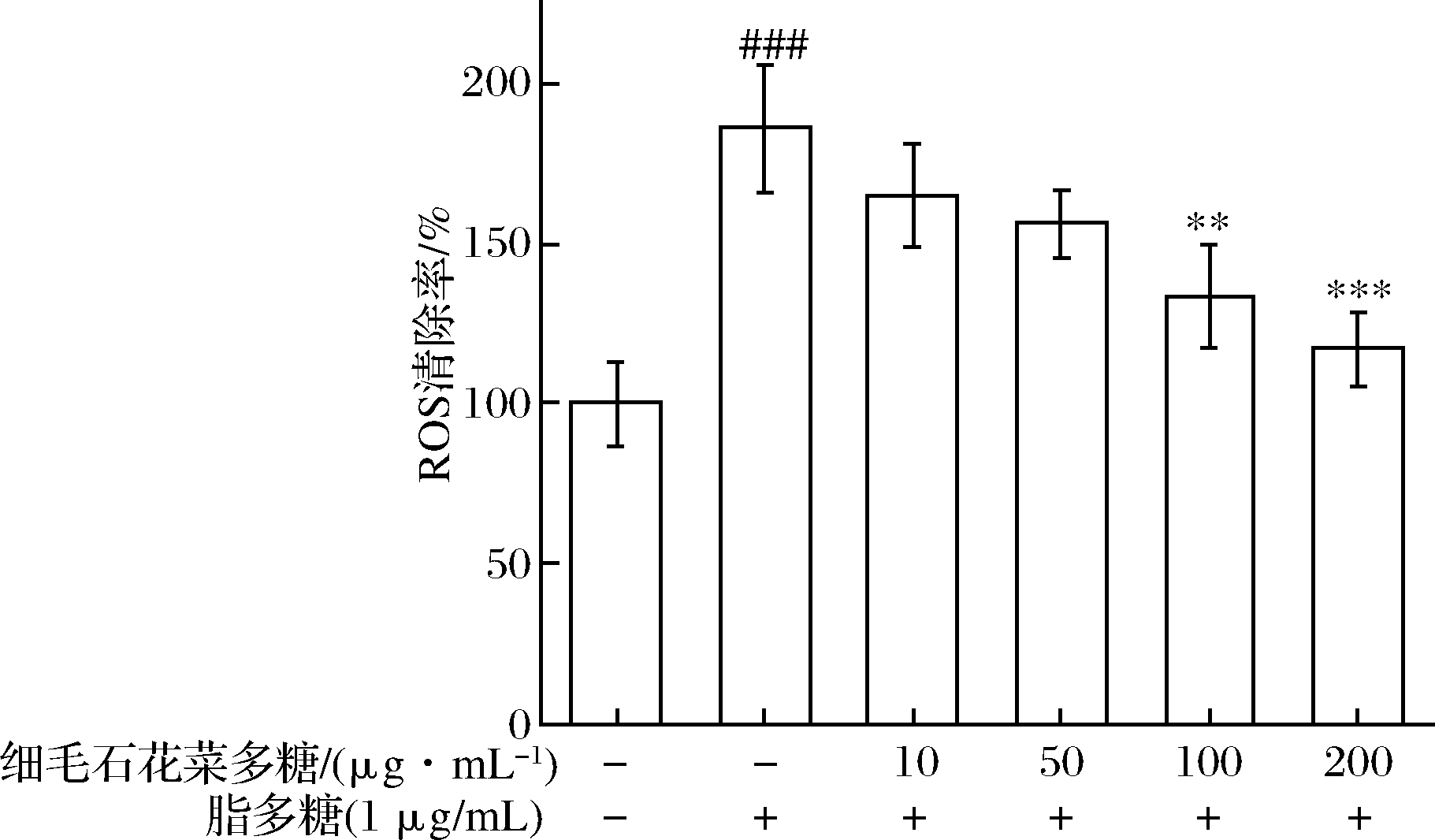
图9 细毛石花菜多糖对ROS的清除作用
Fig.9 Scavenging effect of polysaccharide from Gelidium crinale on ROS 注:图中###表示与空白组比较差异极显著(P<0.001); **表示与对照组比较差异极显著(P<0.01); ***表示与对照组比较差异极显著(P<0.001)
2.6 SOD活力水平测定
通过蛋白免疫印迹实验测定细毛石花菜多糖对SOD活力水平的影响,如图10所示,与空白组相比,加入LPS后SOD活力水平减小。细毛石花菜多糖处理后SOD活力水平以浓度依赖的方式增加(P<0.001)。这表明细毛石花菜多糖能够有效提高SOD活力水平。

图10 细毛石花菜多糖对SOD活力水平的影响
Fig.10 The effect of polysaccharide from Gelidium crinale on SOD activity level 注:图中###表示与空白组比较差异极显著(P<0.001);*表示 与对照组比较差异显著(P<0.05);**表示与对照组比较差异极 显著(P<0.01);***表示与对照组比较差异极显著(P<0.001)
3 讨论
本研究探讨了从细毛石花菜中分离出硫酸化多糖的理化性质及抗氧化活性。据报道,已经有研究者从其他地域其他种类的石花菜中提取多糖并对其理化性质及其活性进行研究,而本研究提取的硫酸化多糖的单糖组成主要由半乳糖(63.05%),岩藻糖(11.19%)和木糖(11.55%)组成,包含大量的半乳糖,测定的分子质量的结果为25.8 kDa,与前人的研究结果相似[23-25],符合红藻多糖的基本特征。但是,细毛石花菜多糖的的硫酸基团占比较高(16.50%),经过化学成分测定和FT-IR光谱分析也证明了硫酸基团的存在。据报道硫酸基团的占比越多,多糖活性越好[26],因此研究了细毛石花菜多糖的抗氧化活性。经比较发现,崔明晓等[27]证明大石花菜多糖质量浓度为20 mg/mL时,超声提取多糖的ABTS阳离子自由基清除率达到27.77%,在5 mg/mL时,超声提取多糖的DPPH自由基清除率为26.03%。而在8 mg/mL时,细毛石花菜多糖的DPPH自由基清除率和ABTS阳离子自由基清除率分别达到了56.11%和89.10%。由此可见,细毛石花菜多糖具有较好的抗氧化活性。除此以外,细毛石花菜多糖的抗氧化活性在细胞层面得到了进一步验证。研究结果表明,LPS诱导RAW264.7细胞产生大量ROS,而SOD酶活性显著下降。随着细毛石花菜多糖质量浓度的增加,SOD酶活性显著增强,ROS含量显著降低。证明了细毛石花菜多糖可以增强SOD酶活性,从而降低ROS含量。因此,细毛石花菜多糖是具有一定的抗氧化作用。
4 结论
本研究用0.1 mol/L的HCl提取细毛石花菜多糖。化学组成分析显示,细毛石花菜多糖中总糖占比为70.51%,蛋白质占比为5.27%,还原糖占比为8.42%,硫酸基团占比为16.50%。细毛石花菜多糖主要含有半乳糖,木糖和岩藻糖,且半乳糖所占的比例超过了所有单糖的一半,含量最少的是阿拉伯多糖。用GPC测定细毛石花菜多糖的相对分子质量为25.8 kDa。研究结果表明,细毛石花菜多糖具有清除自由基的能力,还可以增强SOD酶活性,具有一定的抗氧化活性,为后续深入研究奠定了基础。
[1] YANG T H, CHIU C Y, LU T J, et al.The anti-obesity effect of polysaccharide-rich red algae (Gelidium amansii) hot-water extracts in high-fat diet-induced obese hamsters[J].Marine Drugs, 2019, 17(9):532.
[2] 裴若楠, 翟红蕾, 戚勃, 等.红藻多糖的生物活性及应用研究进展[J].食品工业科技, 2019, 40(23):331-336.
PEI R N, ZHAI H L, QI B, et al.Research progress of bioactivity and application of polysaccharides from red algae[J].Food Industry Technology, 2019, 40(23):331-336.
[3] AZIZ E, BATOOL R, KHAN M U, et al.An overview on red algae bioactive compounds and their pharmaceutical applications[J].Journal of complementary & integrative medicine, 2020,17(4):20190203.
[4] DE CASTRO J P L, COSTA L E C, PINHEIRO M P.Polysaccharides of red alga Gracilaria intermedia:Structure, antioxidant activity and rheological behavior[J].Polímeros, 2018, 28(2):178-186.
[5] MITTLER R, VANDERAUWERA S, SUZUKI N, et al.ROS signaling:The new wave? [J].Trends in Plant Science, 2011, 16(6):300-309.
[6] GUPTA R K, PATEL A K, SHAH N, et al.Oxidative stress and antioxidants in disease and cancer:A review[J].Asian Pacific Journal of Cancer Prevention, 2014, 15(11):4 405-4 409.
[7] DOMINGUETI C P, DUSSE L M S A, CARVALHO M D G, et al.Diabetes mellitus:The linkage between oxidative stress, inflammation, hypercoagulability and vascular complications[J].Journal of diabetes and its complications, 2016, 30(4):738-745.
[8] FARIA A, PERSAUD S J.Cardiac oxidative stress in diabetes:Mechanisms and therapeutic potential[J].Pharmacology and Therapeutics, 2017, 172:50-62.
[9] SAHA S K, LEE S B, WON J, et al.Correlation between oxidative stress, nutrition, and cancer initiation[J].International journal of molecular sciences, 2017, 18(7):1 544.
[10] ZHANG D H, WU H X, XIA Z M, et al.Partial characterization, antioxidant and antitumor activities of three sulfated polysaccharides purified from Bullacta exarata[J].Journal of Functional Foods, 2012, 4(4):784-792.
[11] JIA X J, ZHANG C, HU J, et al.Ultrasound-assisted extraction, antioxidant and anticancer activities of the polysaccharides from Rhynchosia minima root[J].Molecules, 2015, 20(11):20 901-20 911.
[12] SUN Y J, HOU S T, SONG S, et al.Impact of acidic, water and alkaline extraction on structural features, antioxidant activities of Laminaria japonica polysaccharides[J].International Journal of Biological Macromolecules, 2018, 112:985-995.
[13] 林沛纯, 谌素华, 王维民, 等.亨氏马尾藻岩藻聚糖结构鉴定及其对氧化型低密度脂蛋白诱导HMVEC损伤的保护作用[J].广东海洋大学学报, 2020, 40(5):72-80.
LIN P C, ZHAN S H, WANG W M, et al.Structural identification of Sargassum henslowianum C.Agardh fucoidannd its protective effect on HMVEC damage induced by qxidized low density lipoprotein[J].Journal of Guangdong Ocean University, 2020, 40(5):72-80.
[14] 高文军, 李卫红, 王喜明, 等.3,5-二硝基水杨酸法测定蔓菁中还原糖和总糖含量[J].中国药业, 2020, 29(9):113-116.
GAO W J, LI W H, WANG X M, et al.Determination of reducing sugar and total sugar in turnip by 3,5-dinitrosalicylic acid colorimetry[J].China Pharmaceutical, 2020, 29(9):113-116.
[15] 裴若楠, 翟红蕾, 戚勃, 等.石花菜多糖的分离纯化及单糖组成分析[J].食品与发酵工业, 2020, 46(7):57-62.
PEI R N, ZHAI H L, QI B, et al.Isolation,purification and monosaccharide composition analysis of polysaccharide from Gelidium amansii[J].Food and Fermentation Industry, 2020, 46(7):57-62.
[16] JIA X J, ZHANG C, QIU J F, et al.Purification, structural characterization and anticancer activity of the novel polysaccharides from Rhynchosia minima root[J].Carbohydrate Polymers, 2015, 132:67-71.
[17] WANG Z C, LIU X Y, BAO Y R, et al.Characterization and anti-inflammation of a polysaccharide produced by Chaetomium globosum CGMCC 6882 on LPS-induced RAW 264.7 cells[J].Carbohydrate Polymers, 2021, 251:117129.
[18] AGRAWAL H, JOSGI R, GUPTA M.Isolation and characterisation of enzymatic hydrolysed peptides with antioxidant activities from green tender sorghum[J].LWT, 2017, 84:608-616.
[19] 萧振邦, 黄晓洋, 陈佳丽, 等.鲍鱼肠多肽对LPS诱导HUVEC炎症的抑制作用[J].广东海洋大学学报, 2020,40(6):108-115.
XIAO Z B, HUANG X Y, CHEN J L, et al.Effect of abalone polypeptide on LPS induced HUVEC cell inflammation[J].Journal of Guangdong Ocean University, 2020,40(6):108-115.
[20] YU J, LIU S, WU B, et al.Comparison of cytotoxicity and inhibition of membrane ABC transporters induced by MWCNTs with different length and functional groups[J].Environmental Science & Technology, 2016, 50(7):3 985-3 994.
[21] 杨胜涛, 陈佳丽, 刘怡, 等.异红藻糖苷对HT1080肿瘤细胞侵袭转移作用的影响[J].广东海洋大学学报, 2020, 40(6):116-122.
YANG S T, CHEN J L, LIU Y, et al.Effects of D-isofloridoside on invasion and metastasis of HT1080 tumor cells[J].Journal of Guangdong Ocean University, 2020, 40(6):116-122.
[22] 崔明晓. 大石花菜多糖的分离、结构表征及其抗炎活性研究[D].上海:上海海洋大学, 2019.
CUI X M.Isolation, characterization and anti-inflammatory activity of Gelidium pacificum Okamura polysaccharides[D].Shanghai:Shanghai Ocean University, 2019.
[23] 裴若楠. 石花菜多糖的提取、分离纯化及其生物活性研究[D].上海:上海海洋大学, 2020.
PEI R N.Isolation, purification and bioactivitier of polysaccharide from Gelidium amansii[D].Shanghai:Shanghai Ocean University, 2020.
[24] CUI M X, WU J W, WANG S Y, et al.Characterization and anti-inflam-matory effects of sulfated polysaccharide from the red seaweed Gelidium pacificum Okamura[J].International Journal of Biological Mac-romolecules, 2019, 129:377-385.
[25] 赵慧. 石花菜多糖的提取、分离纯化、理化性质及生物活性研究[D].南京:南京农业大学, 2018.
ZHAO H.Extraction, isolation, purification, physicochemical properties and biological activity of polysaccharide from Gelidium amansii[D].Nanjing:Nanjing Agricultural College, 2018.
[26] HOU C Y, CHEN L L, YANG L Z, et al.An insight into anti-inflammatory effects of natural polysaccharides[J].International Journal of Biological Macromolecules, 2020, 153:248-255.
[27] 崔明晓, 王晓晨, 王玉,等.超声辅助提取大石花菜多糖及其抗氧化研究[J].上海海洋大学学报, 2018, 27(5):797-804.
CUI X M, WANG X C, WANG Y, et al.Ultrasonic-assisted extraction and anti-oxidation of polysaccharides from Gelidium pacifium Okam.[J].Journal of Shanghai Ocean University 2018, 27(5):797-804.