南极磷虾(Euphausia superba)广泛分布于南极海域,据研究数据统计估计,南极磷虾的生物量高达3.7亿t左右[1],如今该资源在《南极海洋生物资源养护公约》的监督下得到可持续发展,是世界上最重要的动物蛋白及脂质的宝库之一[2]。南极磷虾约含有77.9%~83.1%的水分,11.9%~15.4%的蛋白质,0.4%~3.6%的脂肪和约2%的甲壳质[3-4]。南极磷虾粉是南极磷虾加工的主要产品之一,蛋白质含量一般在490~720 g/kg,脂肪含量在50~200 g/kg,其蛋白质和脂肪含量均较高[5-10]。由于南极磷虾粉的生产是在磷虾捕捞加工船上进行,受制于船上条件,加工过程中磷虾粉的品质检测工作难以完成,成为影响我国南极磷虾粉产品品质的因素之一,亟待解决。
近红外光谱(near infrared spectroscopy, NIR)技术是一种对有机物成分快速分析的新型分析技术,其工作原理是根据被测物质在不同波长下的吸光度差异来进行物质分析。随着近红外分析技术的不断进步,近红外光谱分析在石油、化工、农林、食品等领域得到了广泛应用[11-12]。与传统方法相比,该技术具有以下优点:待测样品无需预处理、多组分快速同步检测、对待测样品不造成伤害、对环境和人体健康不构成威胁[13]。在水产加工领域,应用近红外光谱法检测食品品质已有很多应用研究:曹小华等[14]以480个不同类型的鱼粉样品为原料,利用傅里叶近红外光谱建立了鱼粉挥发性盐基氮的定量分析模型,模型预测值与化学值之间的决定系数达0.94以上;王小燕等[15]采集了不同公司生产的多个批次的鱼糜样品共196个,建立了鱼糜样品中水分和蛋白质含量的近红外光谱校正模型,并采用独立样品集进行了预测;王卫军等[16]以94份具有代表性的长牡蛎鲜样组织样品的近红外数据和其对应的化学真实值数据为基础,研究了近红外技术预测长牡蛎鲜样组织中水分、糖原等成分含量的可行性。现有的对于磷虾粉品质的研究均采用传统的化学分析方法,从技术角度来看,实验室研究和实际应用市场都需要更准确快捷的分析方法[17-18]。基于近红外光谱分析技术,利用采集到的磷虾粉光谱数据,建立定性分析模型,有望实现南极磷虾粉品质指标的快速检测。
由于目前国内生产磷虾粉的企业少,磷虾粉样品收集不易,本研究采集了18个磷虾粉样品,首先利用采集到的样品进行定标模型的建立,并对该模型进行了评价。为提高预测模型的精确度,进一步按1∶1的质量比对磷虾粉样品进行了混合,增加了样品的数量,共获得50个磷虾粉混合样品,以此提升磷虾粉品质近红外检测模型的预测精度,为实现南极磷虾粉品质指标的近红外快速检测提供了参考依据。
1 材料与方法
1.1 仪器与设备
傅里叶变换近红外光谱仪(美国Antaris Ⅱ公司),配备RESULT M样品光谱采集的集成软件以及数据处理软件 TQ analyst(美国Thermo Fisher公司)。
1.2 样品采集
本实验在2018年10月—2019年11月,分别从辽渔集团有限公司获得样品6个,分别编号为辽渔1~辽渔6,从中水集团远洋股份有限公司获得磷虾粉样品12个,分别编号为中水1~中水12。样品无异味、霉变、结块现象,符合卫生标准,样品于-20 ℃冰箱中密封储存待用。
1.3 近红外光谱采集
系统采用漫反射方式采集光谱图像。仪器工作参数设置如下:正式扫描开始前,使光谱仪开机预热30 min;将样品加入至直径为5 cm的石英杯中,样品高度1.5~2 cm,样品均匀分布在石英杯中。光谱扫描波数为10 000~4 000 cm-1,扫描次数为32次,分辨率8 cm-1,扫描温度为室温,用吸光度表示吸收光谱。在近红外光谱扫描过程中,为减少仪器波动对光谱的影响,样品经过3次平行扫描测量。
1.4 化学真实值测定
样品光谱采集完成后,根据GB/T 19164—2003对18个初始样品的水分、蛋白质、脂肪含量进行了测定,每个样品平行测试3次,测量结果取算数平均值。
1.5 模型建立和验证
建模前,先采用TQ Analyst软件对采集的样品的原始近红外光谱数据进行预处理。分别采用导数和平滑结合的6种光谱前处理方法对采集的光谱进行处理,选取最优预处理方法,再用偏最小二乘法对预处理后的光谱数据进行运算处理,选择TQ analyst软件自动推荐的光谱范围,并对模型进行检验,模型的评价参数包括建模相关系数(correlation coefficient in calibration,RC)、交互验证残差均方根(root mean square error of cross validation,RMSECV)、交互验证相关系数(correlation coefficient in cross validation,RCV)、交叉验证用样品真实值标准差与RMSECV的比值(the ratio of the RMSECV to standard deviation of reference data in the validation,RPDCV)、外部验证残差均方根(root mean square error of external prediction,RMSEP)、外部验证相关系数(correlation coefficient in external validation,REV)以及外部验证用样品真实值的标准差与RMSEP的比值(the ratio of the RMSEP to standard deviation of reference data in the prediction, RPDEV)[16]。
利用交叉验证来完成模型的内部验证,校正样品中的每个样品依次作为临时验证样品,除被选中的临时验证样品外的其余样品作为建模样品,构成模型对临时验证样品进行预测,依次循环完所有样品以得到交叉预测值。
本研究进行了2种磷虾粉预测模型的构建,一种是利用18个原始样品直接进行建模,随机选取15个作为建模集,3个样品作为验证集;因脂肪含量是虾粉品质指标的关键因素,因此另一种挑选辽渔和中水样品组中脂肪含量最高和最低的2组4个样品(辽渔1、辽渔5、中水3和中水5),分别与同组的其他样品按1∶1的质量比混合均匀,获得32个混合磷虾粉样品,加上18个初始样品,共获得50个磷虾粉样品,并以此进行第2组近红外模型的建立,其中随机抽取40个样品作为建模集,10个样品作为验证集。
2 结果与分析
2.1 异常样品剔除
在异常样品存在的情况下进行建模将会对模型的预测精度造成影响,为确保磷虾粉样品数据的精度,需对光谱数据中的异常样品进行剔除。常用的异常值剔除方法有:浓度残差剔除法、马氏距离法(mahalanobis distance,MD)、蒙特卡洛采样算法、杠杆值法等。马氏距离是指数据的协方差距离,它是一种有效地计算2个未知样品集的相似度的方法。本文利用MD法对光谱数据进行异常样品剔除处理[19]。
2.2 光谱数据前处理,
图1显示了10 000~4 000 cm-1内所有样品的扫描全光谱。所有磷虾粉样品都呈现出相似的光谱分布图,虽然辽渔和中水的磷虾粉样品加工方式有一定差异,但辽渔和中水的磷虾粉样品未显示出明显差异,仅观察到光谱反射率的差异。在10 000~4 000 cm-1内,磷虾粉近红外光谱表现出蛋白质、脂肪、水分的较强的特征吸收峰,其中5 800 cm-1处为亚甲基C—H伸缩振动的一次倍频峰,5 100 cm-1处的特征峰体现了C![]() O伸缩振动的二次倍频,这主要是脂肪的特征吸收峰;4 500 cm-1处为蛋白质的特征峰,为一级胺与三级胺伸缩振动。
O伸缩振动的二次倍频,这主要是脂肪的特征吸收峰;4 500 cm-1处为蛋白质的特征峰,为一级胺与三级胺伸缩振动。
在进行粉末样品NIR漫反射光谱采集时,由于样品颗粒尺寸、均匀性等的影响,光程无法保持恒定,此时需要使用多元信号修正或标准正则变换(standard normal variate transform, SNV)来对光谱进行处理,以消除这些因素的干扰。本文采用SNV方式。
近红外光谱测量过程中,经常出现光谱偏移或飘移。导数处理是净化谱图较常用的预处理方法,可根据需要进行一阶或二阶微分处理。导数处理既可以消除基线偏移,还可以起到一定的放大和分离重叠信息的作用;平滑的作用是提高信噪比,减小随机噪音,从而也可以提高模型的稳健性[20-21]。有2种平滑方法可供使用,一种是经典的 Savitzky-Golay滤波(SG),它是一种多项式滤波方法,另一种是Norris导数滤波(Norris derivative filter, NDF),它只能用于一阶或二阶导数光谱,是红外光谱分析中一种很好的滤波方法。

图1 磷虾粉样品的NIR漫反射原始光谱
Fig.1 Raw NIR diffuse reflectance spectra of krill meal samples
本文分别采用一阶微分(first-order difference,FD)、二阶微分(second-order difference,SD)及其与SNV方式和2种平滑方式相结合的6种方式对磷虾粉样品近红外图谱进行预处理,近红外光谱预处理结果如表1~表3所示:
表1 磷虾粉蛋白近红外光谱预处理结果
Table 1 Krill meal protein NIR pretreatment results

数据预处理主成分因子RMSECRCRMSEPREVRMSECVRCVOrigin50.6740.953 22.010.689 51.250.844 6FD60.2580.993 22.550.696 20.9930.901 4SD11.840.554 22.260.446 02.070.410 2SNV+FD+SG11.880.528 72.400.318 92.070.414 7SNV+SD+SG11.840.553 72.310.397 82.070.436 2SNV+FD+NDF60.3220.989 31.90.917 20.5880.964 8SNV+SD+NDF70.2580.993 21.90.946 61.030.887 9
表2 磷虾粉水分近红外光谱预处理结果
Table 2 Krill meal moisture NIR pretreatment results

数据预处理主成分因子RCRMSECRMSEPREVRMSECVRCVOrigin30.987 00.4450.4920.995 20.5510.980 2FD10.982 30.5190.6850.981 00.5890.977 2SD20.968 80.6871.030.983 90.8660.950 9SNV+FD+SG40.983 30.5040.3530.993 40.6900.968 9SNV+SD+SG40.986 40.4561.240.943 81.240.894 2SNV+FD+NDF30.983 10.5080.3070.997 10.6800.971 0SNV+SD+NDF30.983 80.4960.5840.998 10.7620.962 2
表3 磷虾粉脂肪近红外光谱预处理结果
Table 3 Krill meal fat NIR pretreatment results
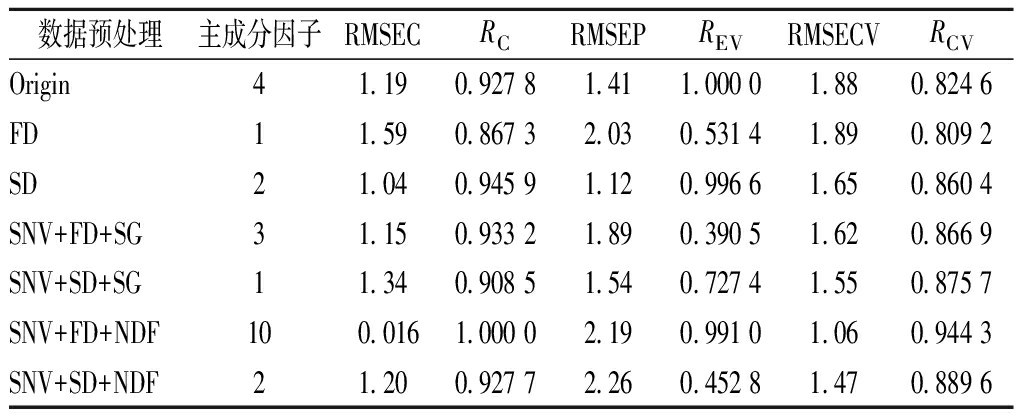
数据预处理主成分因子RMSECRCRMSEPREVRMSECVRCVOrigin41.190.927 81.411.000 01.880.824 6FD11.590.867 32.030.531 41.890.809 2SD21.040.945 91.120.996 61.650.860 4SNV+FD+SG31.150.933 21.890.390 51.620.866 9SNV+SD+SG11.340.908 51.540.727 41.550.875 7SNV+FD+NDF100.0161.000 02.190.991 01.060.944 3SNV+SD+NDF21.200.927 72.260.452 81.470.889 6
磷虾粉原始样品的原始光谱的蛋白质、水分、脂肪所对应的预处理结果如表1~表3所示,经RC、REV和RCV 3个参数综合比较,蛋白、脂肪和水分三者的最佳预处理方式均为SNV+FD+NDF,经预处理后,蛋白模型主成分数为6,RC为0.989 3,REV为0.917 2,RCV为0.964 8;水分模型主成分数为3,RC为0.983 1,REV为0.997 1,RCV为0.971 0;脂肪模型主成分数为10,RC为1.000 0,REV为0.991 0,RCV为0.944 3。
磷虾粉光谱数据预处理参数如表4所示,经谱图预处理后,模型的相关系数较未经过预处理得到明显提升,说明模型的预测精度也得到显著提升,预处理后的光谱图见图2。
表4 原始磷虾粉光谱数据预处理参数
Table 4 Pretreatment parameters of NIR spectral data of krill meal samples composition

成分主成分因子光谱范围/cm-1光谱预处理方式水分 35 164.43~4 940.73, 6 371.65~5 843.25蛋白质65 735.26~5 580.98, 8 415.83~8 246.12SNV+FD+NDF脂肪 108 307.83~7 922.14, 8 573.96~8 396.54
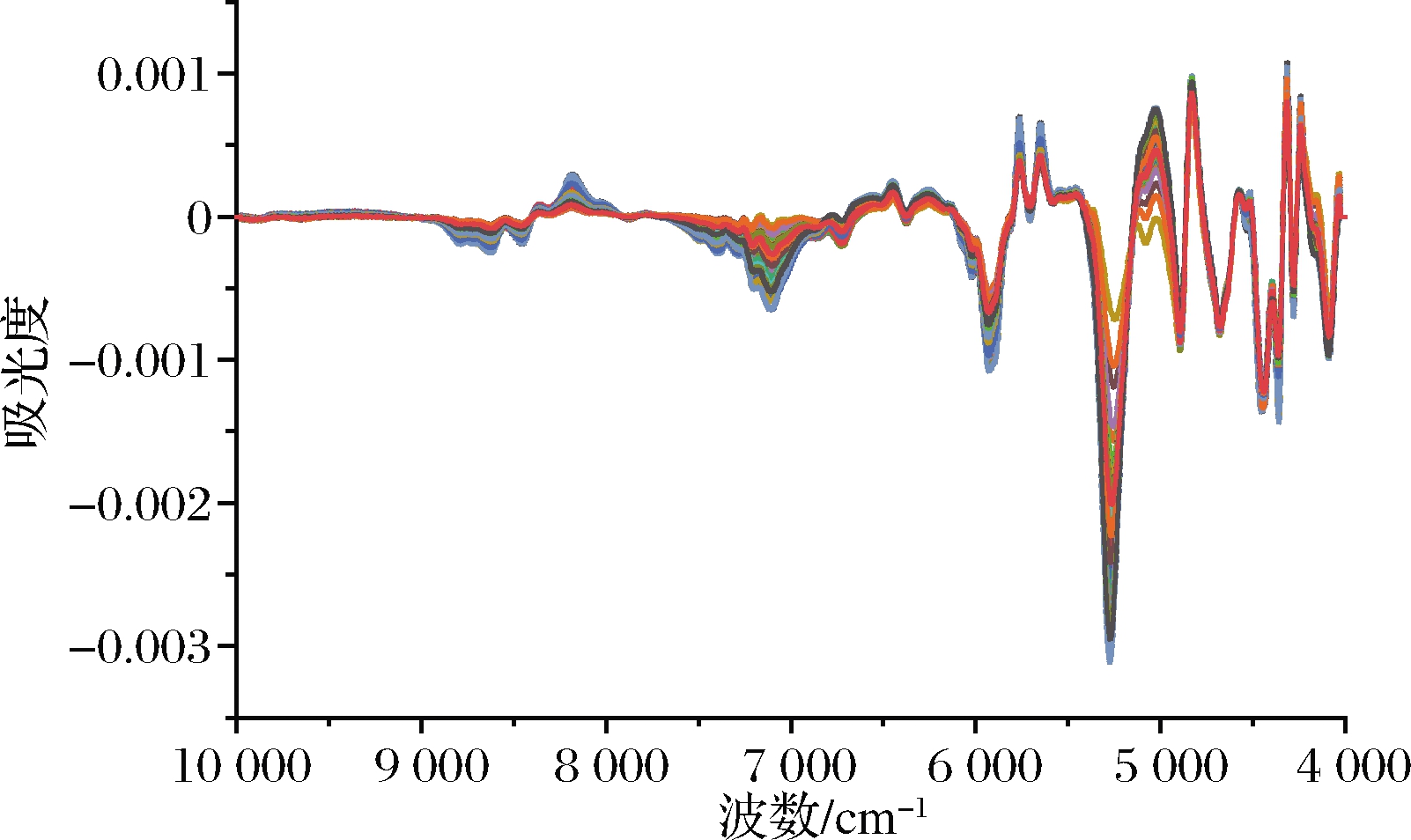
图2 磷虾粉样品的预处理后NIR光谱图
Fig.2 NIR spectra of krill meal samples after pretreatment
2.3 原始磷虾粉样品NIR模型分析
2.3.1 原始磷虾粉样品指标表述性统计
本实验中18份样品的建模集和验证集的样品数见表5,建模集样品共15个,其中辽渔磷虾粉样品5个,中水样品10个;验证集样品共3个,其中辽渔样品1个,中水样品2个。表5数据显示各组分间各个成分最大值分别为最小值的:水分(7.64倍)、蛋白质(1.13倍)、脂肪(1.98倍),各组分含量差异较大,样品成分含量范围足够广泛,证明此样品可以进行近红外光谱的建模分析。
表5 原始磷虾粉样品建模集和验证集样品成分含量
Table 5 Modeling set and validation set composition content of original krill meal samples
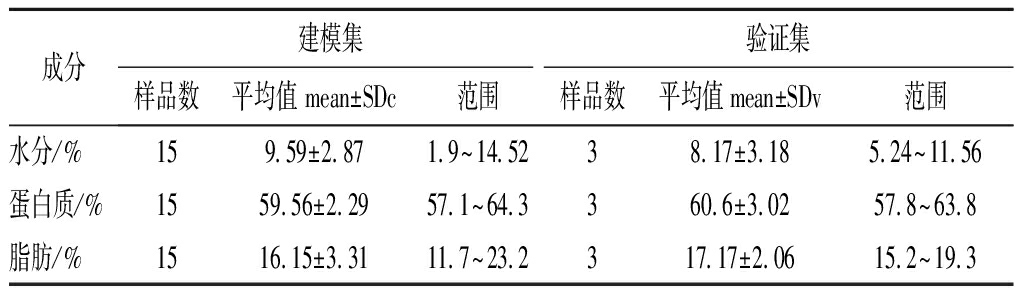
成分建模集验证集样品数平均值 mean±SDc范围样品数平均值mean±SDv范围水分/%159.59±2.871.9~14.5238.17±3.185.24~11.56蛋白质/%1559.56±2.2957.1~64.3360.6±3.0257.8~63.8脂肪/%1516.15±3.3111.7~23.2317.17±2.0615.2~19.3
注:SDc是建模集的标准偏差;SDv是验证集的标准偏差(下同)
2.3.2 预测模型建立与优化
原始样品建模结果如表6及图3~图5所示,不同成分样品无异常值被剔除。模型建立过程中的各个相关系数,即:RC、RCV和REV值越接近100%,模型的拟合程度越好[22];RMSECV、RMSEP也同样用来评价模型的优劣,RMSECV和RMSEP越小,证明模型的精确度越高,RMSECV和RMSEP越接近,证明模型的稳定性越高;同时模型的RPD值是模型评价的另一个重要指标,精准度高的模型具有高RPD值,当RPD值大于2.5时模型可以进行准确预测。
表6 磷虾粉原始样品建模过程中的指标描述
Table 6 Index description in the process of modeling the original krill sample
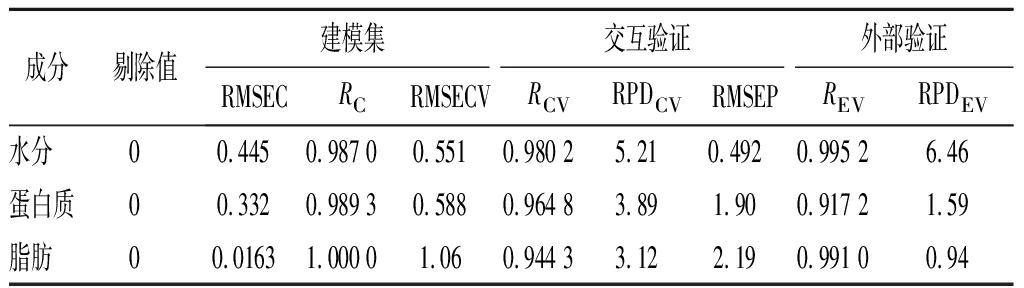
成分剔除值建模集交互验证外部验证RMSECRCRMSECVRCVRPDCVRMSEPREVRPDEV水分00.4450.987 00.5510.980 25.210.4920.995 26.46蛋白质00.3320.989 30.5880.964 83.891.900.917 21.59脂肪00.01631.000 01.060.944 33.122.190.991 00.94
在原始样品模型中,各组分的三类相关系数都在0.9以上,蛋白、脂肪和水分3个含量指标的建模相关系数RC均大于0.98,其RMSEC值均小于0.45,交叉验证相关系数RCV均在0.94以上,脂肪RMSECV略高(>1),但RPDCV均大于2.5,说明模型的精确度较好[23]。但在外部验证中,外部验证相关系数还比较理想,REV值大于0.91,但蛋白和脂肪的RMSEP值较高,RPDEV仅水分为6.46,蛋白质和脂肪均小于2.5,不甚理想,这可能主要由于验证集样本量较小导致。
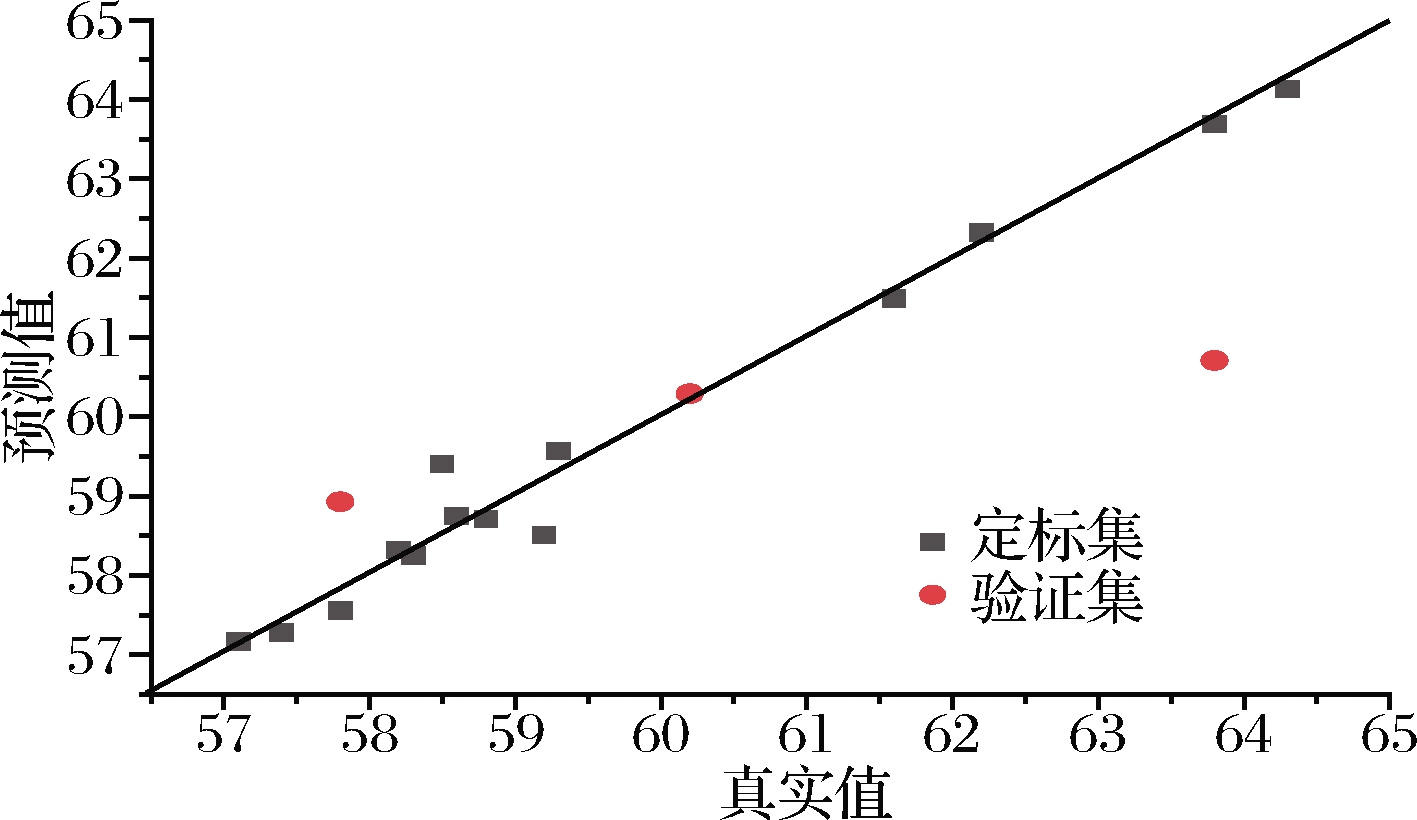
图3 原始样品模型蛋白含量NIR主要参数
Fig.3 NIR parameters of protein content in the original sample model

图4 原始样品模型脂肪含量NIR主要参数
Fig.4 NIR parameters of fat content of the original sample model

图5 原始样品模型水分含量NIR主要参数
Fig.5 NIR parameters of moisture content of the original sample model
2.4 混合磷虾粉样品的NIR模型分析
为提升NIR模型的预测精度,检测样品数量应越多越好。但由于有区分度的磷虾粉样品不易获得,厂家在生产过程中也未对样品进行分类,很难短时间内获得足量有区分度的样品。由于磷虾粉本身不是一种单一的分布均匀的原料,理论上通过混合后的样品依然符合磷虾粉样品的特征。如1.5所述,本实验采用40个原始样品加混合样品进行单独建模,与原始样品的NIR模型进行比较。光谱预处理方式采用2.2中最佳预处理方式:SNV+FD+NDF。
2.4.1 混合磷虾粉样品指标表述性统计
表7以及图6~图8数据表明,经SNV+FD+NDF预处理后,蛋白质模型主成分数为6,光谱范围为5 731.40~5 580.98 cm-1, 7 875.86~7 613.59 cm-1,8 396.54~8 219.13 cm-1;水分模型主成分数为4,光谱范围为5 164.43~4 971.56 cm-1,6 869.20~6 117.10 cm-1;脂肪模型主成分数为7,光谱范围为8 307.83~7 926.00 cm-1,8 573.96~8 396.54 cm-1。
表7 混合磷虾粉光谱数据预处理参数
Table 7 Pretreatment parameters of NIR spectral data of mixed krill meal samples composition

成分主成分因子光谱范围/cm-1光谱预处理方式水分45 164.43~4 971.56, 6 869.20~6 117.10蛋白质65 731.40~5 580.98, 7 875.86~7 613.59, 8 396.54~8 219.13SNV+FD+NDF脂肪78 307.83~7 926.00, 8 573.96~8 396.54
混合样品的建模集和验证集的样品数见表8,建模集样品共40个,其中辽渔原始磷虾粉样品4个,辽渔混合磷虾粉样品8个,中水原始磷虾粉样品9个,中水混合磷虾粉样品19个,验证集样品共10个,其中辽渔原始磷虾粉样品2个,辽渔混合磷虾粉样品2个,中水原始磷虾粉样品3个,中水混合磷虾粉样品3个。各组分间各个成分差异情况与原始样品相同,符合建模要求。

图6 混合样品水分、蛋白质和脂肪模型主成分因子数
Fig.6 Factors of mixed sample moisture, protein and fat models
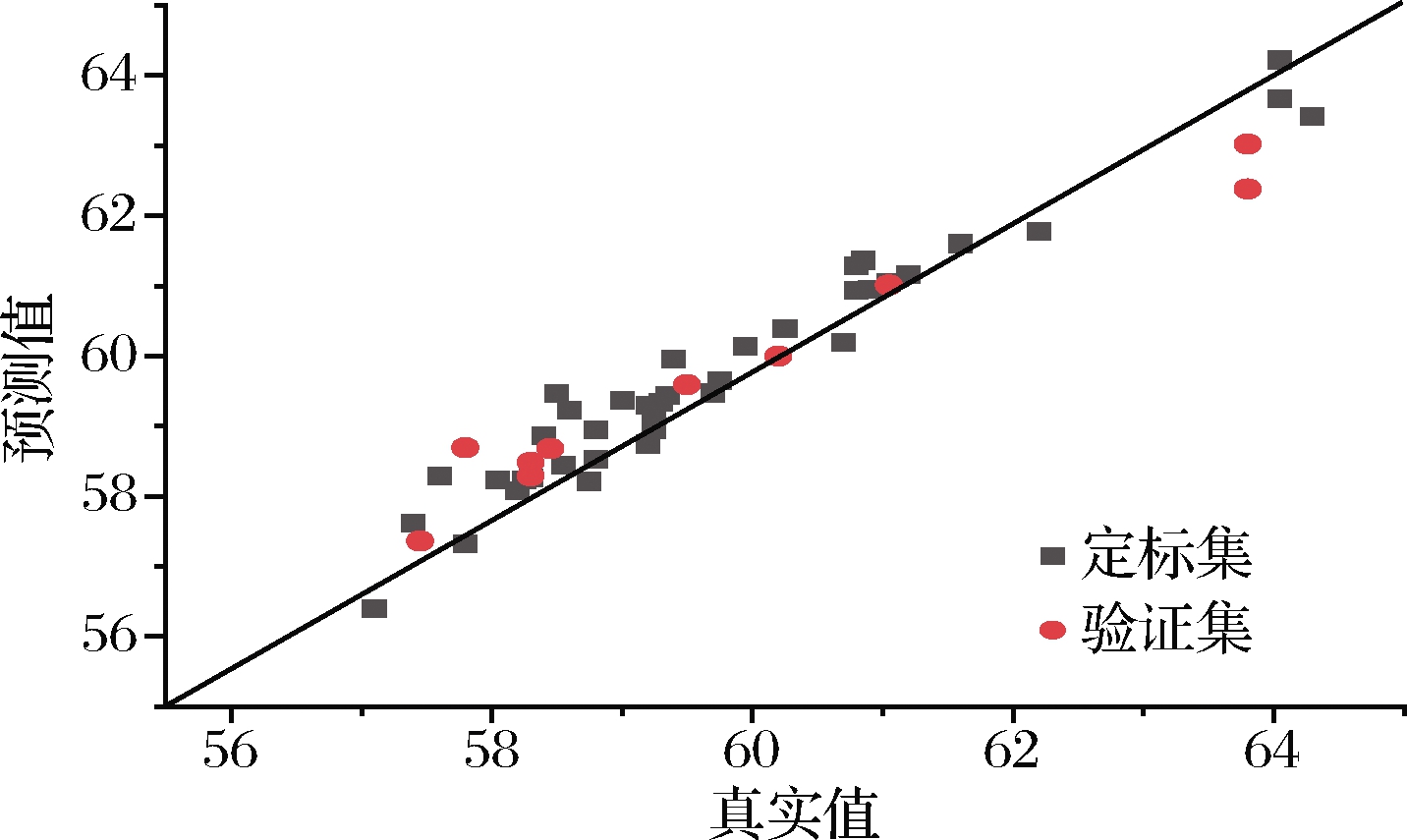
图7 混合样品模型蛋白质含量NIR主要参数
Fig.7 NIR parameters of protein content of the mixed sample model
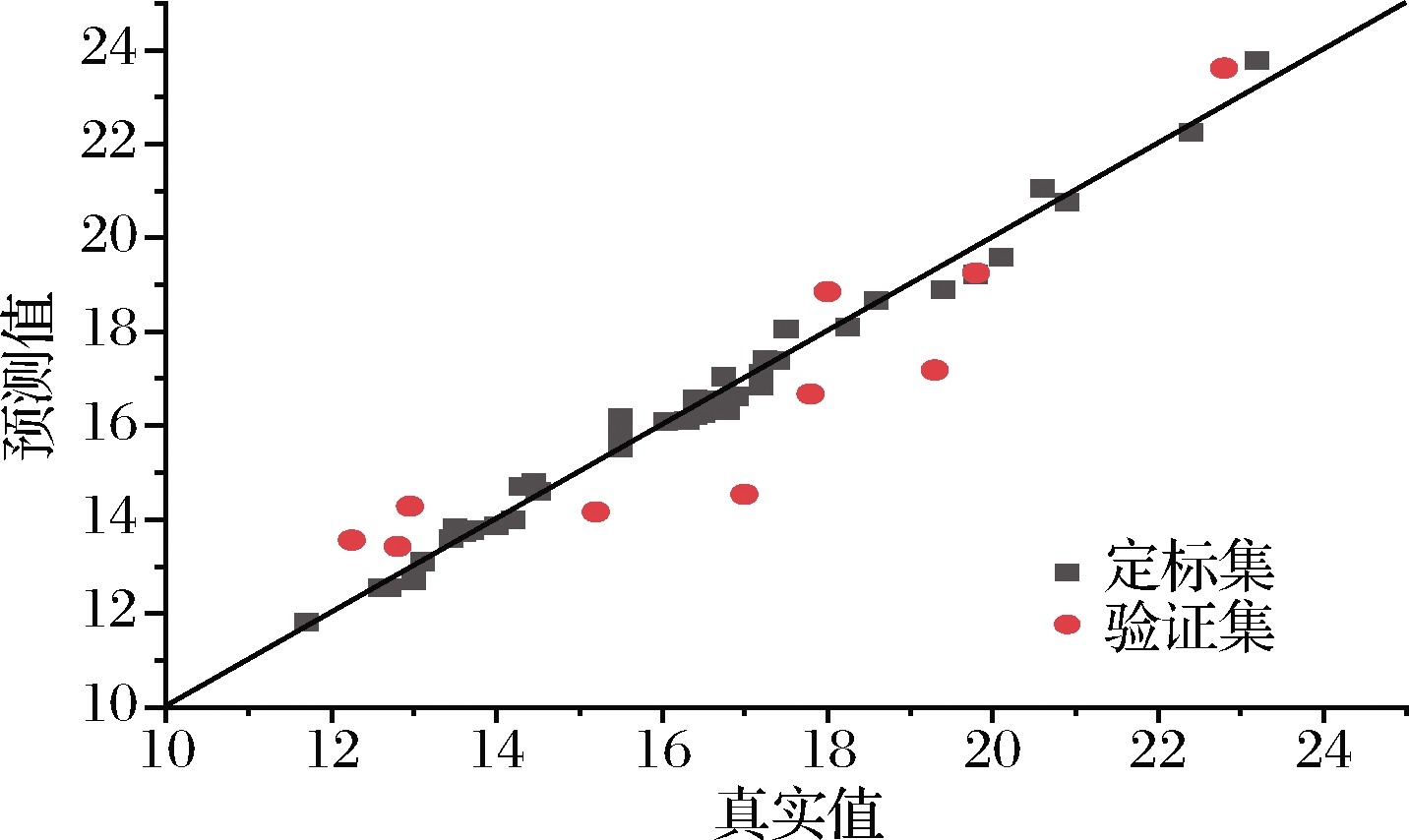
图8 混合样品模型脂肪含量NIR主要参数
Fig.8 NIR parameters of fat content of the mixed sample model
2.4.2 预测模型建立与优化
在原始样品模型中,各组分的RC、RCV和REV三类相关系数除脂肪的REV为0.905 8,其余均在0.94以上,水分、脂肪和蛋白质3个含量指标的建模相关系数RC均大于0.97,其RMSEC值均小于0.45,交叉验证相关系数RCV均在0.94以上,RMSECV在0.6左右,RPDCV均大于2.5,说明模型的精确度较好。在外部验证中,水分和蛋白质的REV分别为0.977 9和0.984 1,而脂肪的REV为0.905 8,较其他2个成分略差,脂肪的RMSEP也偏高,但RPDEV均大于2.5,说明该模型可以进行准确预测。
表8 混合磷虾粉建模集和验证集样品成分含量
Table 8 Modeling set and validation set composition content of mixed krill meal samples
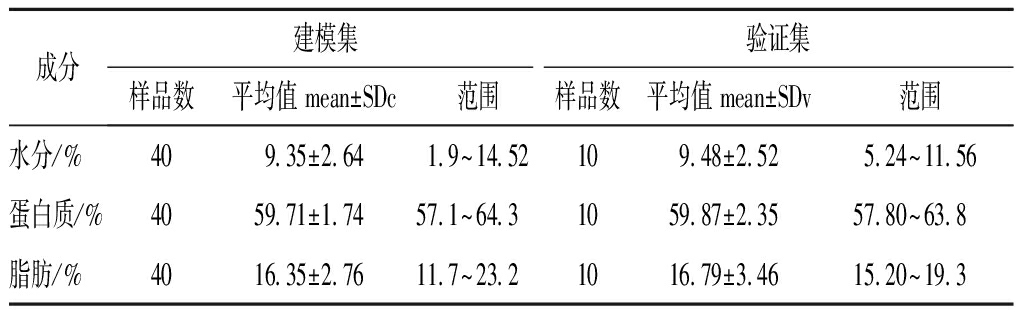
成分建模集验证集样品数平均值 mean±SDc范围样品数平均值 mean±SDv范围水分/%409.35±2.641.9~14.52109.48±2.525.24~11.56蛋白质/%4059.71±1.7457.1~64.31059.87±2.3557.80~63.8脂肪/%4016.35±2.7611.7~23.21016.79±3.4615.20~19.3
如图9、表9所示;磷虾粉混合样品构建的模型与磷虾粉原始样品构建的模型相比较,在三类相关系数方面并未体现出明显优势,但在脂肪的RMSECV以及蛋白质和脂肪的RMSEP和RPDEV等参数方面有所提升,说明通过混合样品数量的提升可以降低预测值的偏离程度,提升预测模型的准确性。
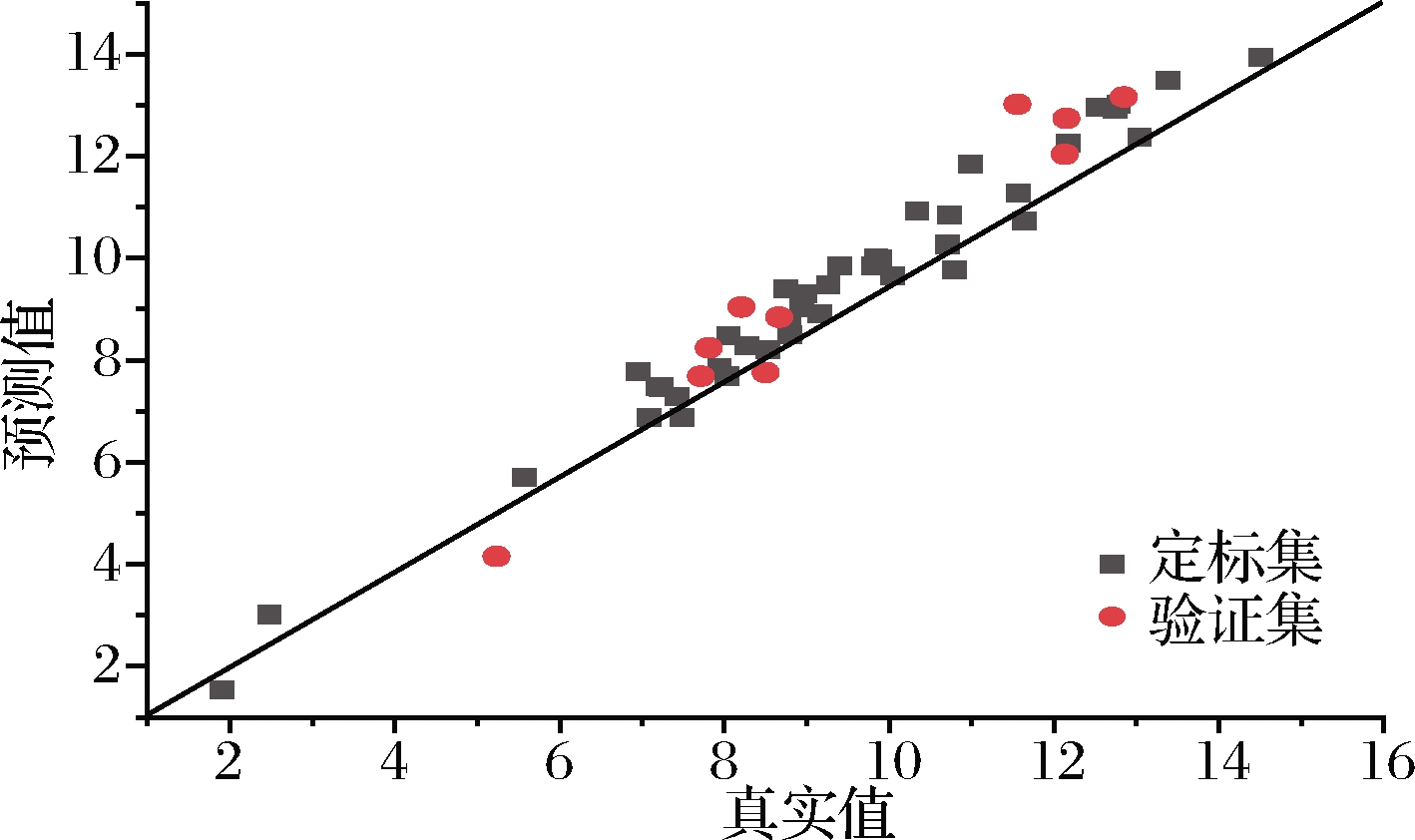
图9 混合样品模型水分含量NIR主要参数
Fig.9 NIR parameters of moisture content of the mixed sample model
表9 磷虾粉混合样品建模过程中的指标描述
Table 9 Description of indicators in the modeling process of mixed krill samples
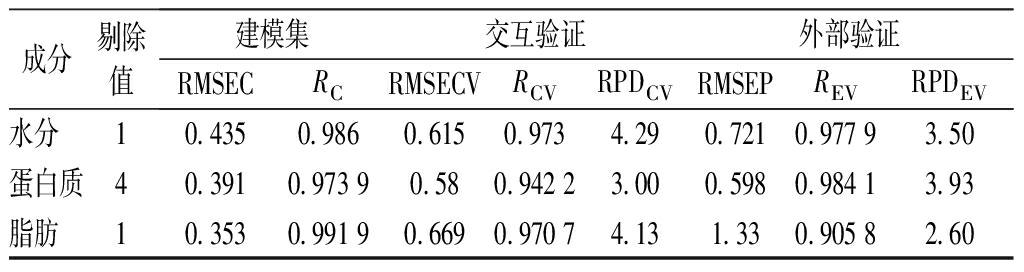
成分剔除值建模集交互验证外部验证RMSECRCRMSECVRCVRPDCVRMSEPREVRPDEV水分 10.4350.9860.6150.9734.290.7210.977 93.50蛋白质40.3910.973 90.580.942 23.000.5980.984 13.93脂肪 10.3530.991 90.6690.970 74.131.330.905 82.60
3 结论与讨论
本文采用最小偏二乘法建立并优化了磷虾粉中水分、脂肪和蛋白质的近红外定标模型,确定了磷虾粉近红外图谱最佳预处理方式为SNV+FD+NDF,经预处理后,通过交互验证和外部验证,各组分的RC、RCV和REV三类相关系数除脂肪的REV为0.905 8,其余均在0.94以上,RPD均大于2.5,证明磷虾粉近红外定标模型对3个成分均有较好的预测准确性,可以快速准确的进行磷虾粉中主要成分的定量。比较以原始磷虾粉样品构建的近红外定标模型和以混合磷虾粉样品构建的近红外定标模型,在相关系数方面并未体现出明显优势,但在RMSECV、RMSEP和RPDEV等参数方面有所提升,说明通过混合样品数量的增加可以降低预测值的偏离程度,提升预测模型的准确性。
本研究为磷虾粉中水分、脂肪和蛋白质含量近红外模型的构建以及快速检测提供了理论依据和数据支持。为进一步提升磷虾粉近红外定标模型的预测精度,下一步应继续扩大磷虾粉样品的采集范围,增加代表性原始磷虾粉样品的数量,使其能够满足不同来源磷虾粉样品的成分预测。另外,可以通过特征波场选择算法优化定标模型,使其预测精度进一步提升。
[1] ATKINSON A, SIEGEL V, PAKHOMO E, et al.A re-appraisal of the total biomass and annual production of Antarctic krill [J].International Deep Sea Research Part I:Oceanographic Research Papers, 2009, 56(5):727-740.
[2] LI Y F, ZENG Q H, LIU G, et al.Effects of ultrasound-assisted basic electrolyzed water (BEW) extraction on structural and functional properties of Antarctic krill (Euphausia superba) proteins [J].Ultrasonics Sonochemistry, 2021,71:105364.
[3] WANG Y C, WANG R, CHANG Y G, et al.Preparation and thermo-reversible gelling properties of protein isolate from defatted Antarctic krill (Euphausia superba) byproducts [J].Food Chemistry, 2015, 188:170-176.
[4] PISITSAK P, TUNGSOMBATVISIT N, SINGHANU K.Utilization of waste protein from Antarctic krill oil production and natural dye to impart durable UV-properties to cotton textiles [J].Journal of Cleaner Production, 2018, 174:1 215-1 223.
[5] BERGE K, ROBERTSON B, BURRI L.Safety assessment of SuperbaTM krill powder:Subchronic toxicity study in rats[J].Toxicology Reports, 2015,2:144-151.
[6] OLSEN R E, SUONTAMA J, LANGMYHR E, et al.The replacement of fish meal with Antarctic krill, Euphausia superba in diets for Atlantic salmon, Salmo salar[J].Aquaculture Nutrition, 2006,12(4):280-290.
[7] TIBBETTS S M, MILLEY J E, LALL S P.Apparent protein and energy digestibility of common and alternative feed ingredients by Atlantic cod, Gadus morhua (Linnaeus, 1758)[J].Aquaculture, 2006,261(4):1 314-1 327.
[8] YOSHITOMI B, AOKI M, OSHIMA S I, et al.Evaluation of krill (Euphausia superba) meal as a partial replacement for fish meal in rainbow trout (Oncorhynchus mykiss) diets[J].Aquaculture, 2006,261(1):440-446.
[9] YOSHITOMI B, AOKI M, OSHIMA S I.Effect of total replacement of dietary fish meal by low fluoride krill (Euphausia superba) meal on growth performance of rainbow trout (Oncorhynchus mykiss) in fresh water[J].Aquaculture, 2007,266(1-4):219-225.
[10] 刘志东, 陈雪忠, 黄洪亮,等.南极磷虾粉的营养成分分析及评价[J].中国海洋药物, 2012(2):43-48.
LIU Z D, CHEN X Z, HUANG H L, et al.Analysis and evaluation of the nutritional components of Antarctic krill powder [J].Chinese Journal of Marine Medicine Drugs, 2012(2):43-48.
[11] 高荣强,范世福.现代近红外光谱分析技术的原理及应用 [J].分析仪器, 2002, 3:9-12.
GAO R Q, FAN S F.Principles and applications of modern near infrared spectroscopic techniques [J].Analytical Instrumentation, 2002(3):9-12.
[12] 张宁.现代近红外光谱技术的发展和应用[J].中国兽药杂志, 2002,36(10):22-25.
ZHANG N.Development and application of modern near infrared spectroscopy technology[J].Chinese Journal of Veterinary Drug, 2002,36(10):22-25.
[13] WILLIAMS P C, THOMPSON B N.Influence of whole meal granularity on analysis of HRS wheat for protein and moisture by near infrared reflectance spectroscopy(NIRS)[J].Cereal Chemistry,1978,55(6):1 014-1 037.
[14] 曹小华, 蔡懋成, 余维三, 等.近红外光谱分析技术在鱼粉新鲜度检测中的应用研究[J].广东饲料, 2018, 27(3):42-45.
CAO X H, CAI M C, YU W S, et al.Research of application of near-infrared reflectance spectroscopy in detecting fish meal freshness[J].Guangdong Feed, 2018, 27(3):42-45.
[15] 王小燕, 王锡昌, 刘源, 等.基于SVM算法的近红外光谱技术在鱼糜水分和蛋白质检测中的应用[J].光谱学与光谱分析, 2012(9):2 418-2 421.
WANG X Y, WANG X C, LIU Y, et al.Application of near infrared spectroscopy technique based on support vector machine in the measurement of moisture and protein contents in surimi[J].Spectroscopy and Spectral Analysis, 2012(9):2 418-2 421.
[16] 王卫军, 杨建敏,董迎辉,等.长牡蛎(Crassostrea gigas)鲜样组织八种成分含量近红外(NIR)模型的建立[J].海洋与湖沼, 2015, 46(4):845-852.
WANG W J, YANG J M, DONG Y H, et al.Establishment of near infrared model of eight components on fresh tissues of Crassostrea gigas [J].Oceanologia et Limnologia Sinica, 2015, 46(4):845-852.
[17] ZHOU L J, WU H, LI J T, et al.Determination of fatty acids in broiler breast meat by near-infrared reflectance spectroscopy[J].Meat Science, 2012, 90(3):658-664.
[18] CHRISTY A A, KASEMSUMRAN S, DU Y P, et al.The detection and quantification of adulteration in olive oil by near-infrared spectroscopy and chemometrics[J].Analytical Sciences, 2004, 20(6):935-940.
[19] 何佳艳, 李亭, 郭长凯, 等.近红外光谱法快速无损测定奶粉的脂肪含量[J].食品与发酵工业, 2017,43(10):228-233.
HE J Y, LI T, GUO C K, et al.Rapid nondestructive determination of milk power fat content by near-infrared spectroscopy (NIR) [J].Food and Fermentation Industries, 2017,43(10):228-233.
[20] PÉREZ-MARIN D C, GARRIDO-VARO A, GUERRERO-GINEL J E, et al.Near-infrared reflectance spectroscopy (NIRS) for the mandatory labelling of compound feedingstuffs:Chemical composition and open-declaration[J].Animal Feed Science & Technology, 2004, 116(3-4):333-349.
[21] THISSEN U, PEPERS M, ÜSTÜN B, et al.Comparing support vector machines to PLS for spectral regression applications[J].Chemometrics & Intelligent Laboratory Systems, 2004, 73(2):169-179.
[22] 张慧恩, 金依楠, 季成子, 等.近红外光谱法快速测定海产品处理过程中牛磺酸含量的研究[J].农产品加工, 2016(2):26-28.
ZHANG H E, JIN Y N, JI C Z, et al.Rapid determination of taurinein seafood processing by near infrared spectroscopy [J].Farm Products Processing, 2016(2):26-28.
[23] ZHU L L, HOU Z L, WANG Y B, et al.Fast detection method of Antarctic krill meat quality based on near infrared spectroscopy [J].Revista Cientifica-facultad de Ciencias Veterinarias, 2020, 30(3):1 293-1 304.