柚子在我国栽培时间悠久,种植面积广,具有清香、凉润等优良特点,被人们誉为果中珍品之一。柠檬苦素类化合物为一类三萜类物质,是植物次生代谢产物,主要存在于芸香科和楝科植物中,其中芸香科柑桔属植物是柠檬苦素类化合物的主要来源。
近年来,随着研究的不断深入,柠檬苦素类化合物的生物活性与药理功能日益受到重视。有研究表明,柠檬苦素类化合物具有显著的抗癌活性[1-2],如结肠癌,胃癌等,还可防治骨质疏松症,提高骨矿物质的密度和含量,调节体内胆固醇水平,抗炎化保护肝脏等[3-4],柠檬苦素类具有与维生素C相当的抗氧化生物活性[5],且具有一定抗菌性[6],可用于食品防腐,在药品原料和天然食品添加剂方面具有广阔的应用开发前景。此外,柠檬苦素类物质还具有催眠、抗焦虑、调节细胞色素及改善心脑血管循环的作用[7]。在农业方面,柠檬苦素类物质被认为具有部分昆虫拒食、调节作物生长等作用,作为植保方面的绿色杀虫剂,用于生防也具有较好的前景[8]。将其添加至饲料中可增强动物抗应激和解毒能力,有利于动物健康,同时还有利于饲料保藏等[9]。
目前国内外报道的关于测定柠檬苦素类化合物的方法有荧光检测法[10]、分光光度法[11]、放射免疫法[12]、高HPLC法及液相色谱串联质谱法等[13-16],但主要测定到的物质仅局限于柠檬苦素和诺米林,同时测定柠檬苦素、诺米林、黄柏酮3种化合物的方法较少。且大多数是局限于某一种柚类果实或者相同部位的方法,针对不同种类柚类果实中不同部位的柠檬苦素化合物测定分析尚未有报道。目前带二极管阵列检测器(diode array detector,DAD)的HPLC仪应用普遍,可对目标物进行纯度分析。我国柚类果实加工的大量副产物被当作废弃物丢弃,其中的柠檬苦素类化合物若能被高效合理地利用,将会带来显著的经济和社会效益。
本研究采用QuEChERS-HPLC法同时测定柚类果实中柠檬苦素、诺米林、黄柏酮3种柠檬苦素类化合物,高效便捷,并测定比较了不同品种柚类果实以及不同果实组织部位中含量的差异,为柚类果实中柠檬苦素类化合物在食品和医药等方面利用研究提供参考。
1 材料与方法
1.1 材料与试剂
3种柠檬苦素类似物标准品:柠檬苦素(CAS:80226-00-2,纯度≥98%)、诺米林(CAS:1063-77-0,纯度≥98%)、黄柏酮(CAS:751-03-1,纯度≥98%),中国药品生物制品检定所;乙腈、甲醇均为色谱纯,赛默飞世尔科技;磷酸(分析纯),上海凌峰化学试剂有限公司;试验用水为超纯水。
样品均为种植基地采摘的‘楚门文旦’、‘早熟暹罗柚’、‘五布红心柚’、‘强德勒柚’、‘舒化柚’、‘脆香甜柚’和‘马家柚’,将果实的果肉、囊衣、白皮层、油胞层4个部位分离,经冷冻粉碎后,四分法缩分出适量备用。
1.2 仪器与设备
1260 HPLC仪,带DAD检测器,美国Agilent公司;AR2140电子分析天平,常州奥豪斯仪器有限公司;KS-300EI超声波清仪,宁波海曙科生超声设备公司;Centrifug-5804R台式离心机,德国Eppendorf公司;均质器,德国弗鲁克公司;Milli-Q纯水,美国Millpore公司。
1.3 分析方法
1.3.1 样品前处理
准确称取样品5.00 g(精确至0.01 g)至离心管,加25.00 mL乙腈,均质匀浆,加5.0 g氯化钠后再次匀浆,放入超声波中超声提取20 min,离心分层后取10.0 mL上清液加入装有900 mg MgSO4,450 mg N-丙基乙二胺(N-propylenediamine,PSA)和50 mg石墨化炭黑(graphitized carbon black,GCB)净化管中净化,离心取上清液,经0.22 μm微孔滤膜过滤后供HPLC分析。
1.3.2 标准溶液的配制
准确称取柠檬苦素、诺米林、黄柏酮标准品各0.01 g(精确至0.000 1 g)于同一10.00 mL棕色容量瓶中,用甲醇溶解并定容刻度,得到柠檬苦素、诺米林、黄柏酮质量浓度均为1.0 mg/mL的混合标准储备液,在-20 ℃避光保存。将混合标准储备液用甲醇稀释配制成系列浓度的标准工作溶液。
1.3.3 色谱条件
色谱柱:CAPCELL PAK C18 MG(250 mm×4.6 mm,5 μm);流速1.0 mL/min;进样量:10.0 μL;柱温:35 ℃;检测器:DAD,检测波长:210 nm;流动相:A为0.2%(体积分数)磷酸水溶液,B为乙腈;梯度洗脱程序见表1。
表1 梯度洗脱程序
Table 1 Gradient elution procedure

时间/min流动相A/%流动相B/%0901039010104060151090191090209010
2 结果与分析
2.1 色谱条件确认
本方法用DAD在190~700 nm对柠檬苦素、诺米林和黄柏酮的色谱峰进行扫描,选择210 nm为检测波长。
本研究选用了3种C18色谱柱,分别为Inertsil ODS-3 C18(250 mm×4.6 mm,5 μm)、Eclipse XDB C18(250 mm×4.6 mm,5 μm)、CAPCELL PAK C18 MG (250 mm×4.6 mm,5 μm),并对其分离效果进行了比较。结果表明,3种色谱柱在分离效果方面相当,目标峰对称性均良好。相比较3种色谱柱,CAPCELL PAK C18 MG (250 mm×4.6 mm,5 μm)色谱分析柱基线波动较小,目标峰附近基线平稳,故选之。不同色谱柱分离效果色谱图见图1。
流动相选用0.2%磷酸水溶液和乙腈两相体系进行梯度洗脱,经优化,确定了表1的梯度洗脱程序,3种检测目标物得到完全分离。

1-柠檬苦素;2-诺米林;3-黄柏酮(下同) a-Inertsil ODS-3 C18;b-Eclipse XDB C18;c-CAPCELL PAK C18 MG
图1 不同色谱柱分离效果色谱图
Fig.1 Chromatogram of separation effect of different chromatographic column
2.2 提取与净化
根据该3种化合物的性质,本方法考察了不同溶剂对其提取效率,比较了甲醇、乙醇、乙腈、丙酮、二氯甲烷及乙酸乙酯溶液的提取效果。由图2可知,以乙腈作为提取剂时,3种柠檬苦素类化合物响应均高于其他提取溶剂,且测定过程不需要转换溶剂,所以本方法采取乙腈作为提取溶剂。

图2 不同溶剂提取效果
Fig.2 Extraction effects of different solvents
在实际样品测定时,部分样品有干扰物存在,本方法考察了3种QuEChERS净化管对其净化效果,分别是a(900 mg MgSO4+450 mg PSA+50 mg GCB),b(900 mg MgSO4+300 mg C18),c(900 mg MgSO4+150 mg PSA)。该3种净化管对样品净化效果如图3所示。结果表明净化管中的PSA可有效去除糖和有机酸等糖类等极性干扰物,GCB可去除色素等干扰物。测定时比较了通过各净化管得到的色谱图峰高,无显著差异,说明净化管对样品中目标物无吸附。如图3-a所示,3种柠檬苦素类化合物色谱峰对称,除杂效果明显,尤其是柠檬苦素色谱峰无杂质影响,所以本方法采取a(900 mg MgSO4+450 mg PSA+50 mg GCB)作为净化管。

a-(900 mg MgSO4+450 mg PSA+50 mg GCB);b-(900 mg MgSO4+300 mg C18);c-(900 mg MgSO4+150 mg PSA)
图3 不同净化管的色谱图
Fig.3 Chromatograms of different purification tubes
2.3 方法线性、检出限
配制0.1、1.0、10.0、50.0、100.0、200.0 μg/mL系列质量浓度标准工作液,分别注入液相色谱仪中,测定相应的峰面积,以标准系列工作液中各组分的浓度为横坐标,以峰面积的响应值为纵坐标,绘制标准曲线。采用逐级稀释的方法,以3倍信噪比确定检出限。线性方程、相关系数和检出限分别见表2。结果显示,柠檬苦素、诺米林和黄柏酮在0.1~200.0 μg/mL 线性关系良好。
2.4 回收率试验
在1.3方法条件下,选取‘楚门文旦’样品,加入适量的混合标准储备液,按照1.3.1重复测定6次,由表3可知,各样品测得加标回收率为99.0%~100.3%,相对标准偏差为1.0%~2.1%。实验结果表明本方法精密度和回收率均良好。
表2 线性方程、相关系数和检出限
Table 2 Linear equation, correlation coefficient and detection limit
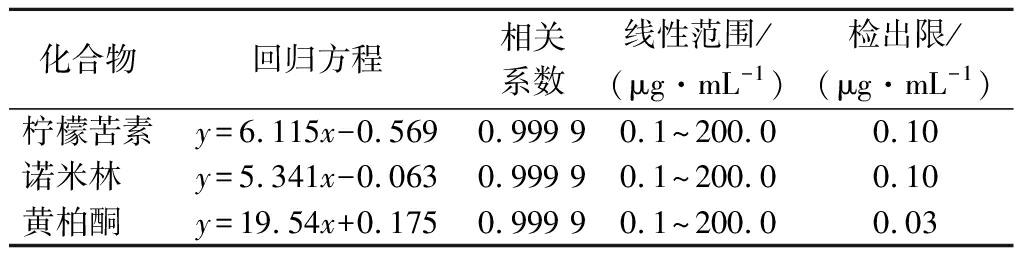
化合物回归方程相关系数线性范围/(μg·mL-1)检出限/(μg·mL-1)柠檬苦素y=6.115x-0.5690.999 90.1~200.00.10诺米林 y=5.341x-0.0630.999 90.1~200.00.10黄柏酮 y=19.54x+0.1750.999 90.1~200.00.03
表3 加标回收率结果(n=6)
Table 3 Results of recovery rate(n=6)
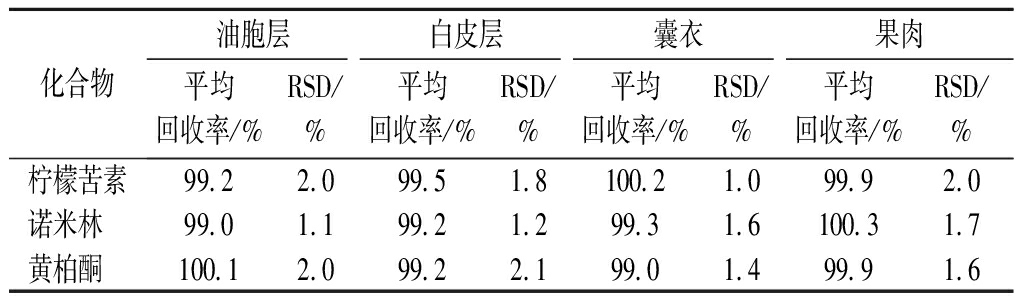
化合物油胞层白皮层囊衣果肉平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%柠檬苦素99.22.099.51.8100.21.099.92.0诺米林 99.01.199.21.299.31.6100.31.7黄柏酮 100.12.099.22.199.01.499.91.6
注:RSD为相对标准偏差(relative standard deviation)
2.5 柚类果实含量测定
采用本方法分别测定不同品种柚子果实的果肉、囊衣、白皮层、油胞层不同部位柠檬苦素、诺米林、黄柏酮的含量,结果见表4。4个组织部位中,囊衣中的3种柠檬苦素类似物含量较高,与其他部位差异显著。3种柠檬苦素类化合物中,柠檬苦素和诺米林的含量高于黄柏酮。几个柚类果实品种中,‘早熟暹罗柚’、‘强德勒柚’和‘舒华柚’的柠檬苦素类化合物的含量较高,其中‘舒华柚’的囊衣中诺米林含量达678.9 mg/kg。‘脆香甜柚’和‘马家柚’的柠檬苦素类化合物含量较低,其中‘脆香甜柚’的囊衣中诺米林含量仅为269.7 mg/kg,而‘马家柚’囊衣中的柠檬苦素含量仅为193.6 mg/kg。
表4 不同品种柚类果实的不同部位中柠檬苦素类化合物含量 单位:mg/kg
Table 4 Contents of limonoids in different parts of pomelo fruits of different cultivars

品种部位柠檬苦素诺米林黄柏酮油胞层17.5±0.35.4±0.1ND ‘楚门文旦’白皮层17.7±0.315.7±0.30.55±0.01囊衣374.7±3.1527.9±2.730.4±0.20果肉23.6±0.427.8±0.41.6±0.01油胞层64.1±0.7102.1±0.76.3±0.10‘早熟暹罗柚’白皮层4.5±0.27.3±0.1ND 囊衣402.8±5.4635.5±2.532.8±0.70果肉23.7±0.840.4±0.32.3±0.04油胞层13.6±0.39.6±0.2ND ‘五布红心柚’白皮层14.0±0.411.42±0.2ND 囊衣290.5±4.6397.8±3.522.2±0.50果肉65.4±3.171.0±0.43.9±0.04油胞层14.7±0.126.5±0.31.4±0.02‘强德勒柚’白皮层31.5±0.653.4±0.53.2±0.04囊衣406.6±5.2669.9±3.335.5±0.30果肉49.2±0.979.3±0.74.3±0.10油胞层5.5±0.119.1±0.21.5±0.03‘舒化柚’白皮层9.6±0.222.5±0.31.1±0.02囊衣350.5±6.7678.9±3.241.3±0.60果肉55.1±1.2107.4±1.15.9±0.10油胞层8.7±0.31.2±0.1ND ‘脆香甜柚’白皮层9.1±0.46.2±0.2ND 囊衣286.1±4.8269.7±3.710.1±0.50果肉19.7±0.56.8±0.2ND 油胞层2.6±0.12.0±0.1ND ‘马家柚’白皮层4.9±0.111.9±0.3ND 囊衣193.6±2.9395.9±2.520.2±0.60果肉2.4±0.14.8±0.1ND
注:“ND”表示未检出
3 结论与讨论
本方法建立了柠檬苦素类似物的QuEChERS-HPLC检测方法,并测定柚类果实中柠檬苦素、诺米林、黄柏酮含量。样品净化选择了900 mg MgSO4+450 mg PSA+50 mg GCB QuEChERS净化管处理方式,有效去除了柚类果实中糖、有机酸、色素等干扰杂质。方法操作简单,快速高效,具有较强抗干扰能力,线性、精密度和回收率均良好。
应用本方法测定比较了柚类果实不同品种以及不同果实组织部位中柠檬苦素、诺米林、黄柏酮含量,发现存在较大差异,各组织部位中,囊衣中的柠檬苦素含量最高,且柠檬苦素和诺米林的含量高于黄柏酮的含量。‘早熟暹罗柚’、‘强德勒柚’和‘舒华柚’品种中柠檬苦素类化合物的含量较高量。这一规律可为柚类果实中柠檬苦素类化合物在食品和医药等方面进行利用研究提供参考。
[1] KAUR J, KAUR G. An insight into the role of Citrus bioactives in modulation of colon cancer[J].Journal of Functional Foods, 2015, 13(11):239-261.
[2] ZHAO W, WU M Y, CUI L J, et al.Limonin attenuates the stemness of cervical carcinoma cells by promoting YAP nuclear-cytoplasmic translocation[J].Food and Chemical Toxicology, 2019, 125:621-628.
[3] 尤文挺, 王洒, 何龙, 等.柠檬苦素单体的药理活性研究进展[J].中药材, 2017, 40(1):242-246.
YOU W T, WANG S, HE L, et al.Research progress in the pharmacological activities of limonin monomer[J].Journal of Chinese Medicinal Materials, 2017,40(1):242-246.
[4] YANG R Y, SONG C Q, CHEN J X, et al.Limonin ameliorates acetaminophen-induced hepatotoxicity by activating Nrf2 antioxidative pathway and inhibiting NF-κB inflammatory response via upregulating Sirt1[J].Phytomedicine, 2020, 69:153211.
[5] YU J, WANG L M, WALZEM R L, et al.Antioxidant activity of citrus limonoids, flavonoids, and coumarins[J].Journal of Agricultural and Food Chemistry, 2005, 53(6):2 009-2 014.
[6] 王辉, 曾晓房, 冯卫华, 等.柠檬皮中的柠檬苦素对青霉的抑菌活性和机理研究[J].食品与发酵工业, 2019, 45(5):75-79.
WANG H, ZENG X F, FENG W H, et al.Antifungal activity and mechanism of limonoids from lemon peel against Penicillium[J].Food and Fermentation Industries, 2019, 45(5):75-79.
[7] 孙崇德. 柑桔中柠檬苦素、诺米林、吖啶酮的检测及相关含量与生物活性研究[D].杭州: 浙江大学, 2006.
SUN C D.Determination of limonin, nomilin and acridone in citrus and study on their relative contents and bioactivities[D].Hangzhou: Zhejiang University, 2006.
[8] 李彪, 施蕊, 熊智, 等.柚皮柠檬苦素的提取及其杀虫活性研究[J].中国农学通报, 2012, 28(1):284-288.
LI B, SHI R, XIONG Z, et al.Extraction and insecticidal activities of limonin in peel of Citrus maxima[J].Chinese Agricultural Science Bulletin, 2012, 28(1):284-288.
[9] 晏敏, 周宇, 贺肖寒, 等.柑橘籽中柠檬苦素及类似物的生物活性研究进展[J].食品与发酵工业, 2018, 44(2):290-296.
YAN M, ZHOU Y, HE X H, et al.Research progress on the bioactivity of limonin and its analogues in Citrus[J].Food and Fermentation Industries, 2018, 44(2):290-296.
[10] BREKSA A P, MANNERS G D.Determination of limonin D-ring lactone hydrolase activity by solid phase extraction with indirect fluorescence detection[J].Journal of Agricultural and Food Chemistry, 2004, 52(12):3 772-3 775.
[11] 许海丹, 顾霞敏, 梁丹霞,等.柑橘中类柠檬苦素的含量测定方法研究[J].应用化工, 2012, 41(11):2 006-2 008.
XU H D, GU X M, LIANG D X, et al.Determination of limonoids in Citrus fruits[J].Applied Chemical Industry, 2012, 41(11):2 006-2 008.
[12] MCINTOSH C A . Quantification of limonin and limonoate A-ring monolactone during growth and development of Citrus fruit and vegetative tissues by radioimmunoassay[C]. Acs Symposium Series, 2000.
[13] 刘亮, 戚向阳, 董绪燕, 等.高效液相色谱法测定柑橘中的柠檬苦素类似物[J].食品与发酵工业, 2007, 33(4):130-133.
LIU L, QI X Y, DONG X Y, et al.Determination of limonoids in Citrus by high performance liquid chromatography[J].Food and Fermentation Industries, 2007, 33(4):130-133.
[14] 郁林娜,程盛勇,付洋,等.响应面法优化橘核中3种柠檬苦素类成分的超声辅助提取工艺[J].食品研究与开发, 2019, 40(5):133-137.
YU L N, CHENG S Y, FU Y, et al.Optimization of the ultrasonic-assisted extraction process of three limonoids constituents in Citrus seed by response surface methodology[J]. Food Research and Development, 2019, 40(5):133-137.
[15] 涂勋良,张利, 秦帆,等.HPLC法测定不同产地和品种柠檬果皮中柠檬苦素和诺米林含量[J].广西植物, 2020, 40(5):744-750.
TU X L,ZHANG L, QIN F, et al.Determination of limomin and nomilin of different varieties of lemon peel from different areas by HPLC[J].Guihaia, 2020, 40(5):744-750.
[16] 江海, 李新生, 吴三桥, 等.UPLC-MS/MS分析橘汁发酵液中柠檬苦素的变化趋势[J].食品科学, 2013, 34(4):208-211.
JIANG H, LI X S, WU S Q, et al.UPLC-MS/MS analysis of the change trend of limonin in fermented orange juice[J].Food Science, 2013, 34(4):208-211.