精酿啤酒不同于工业啤酒,因其麦汁浓度高、酒精度高、浓烈香郁的风味越来越受到消费者的喜爱[1]。国内一般的工业啤酒的酒精度普遍在2.5%~3.5%(体积分数,全文同),进口啤酒普遍在4.5%~5.5%,精酿啤酒酒精度更高,甚至高达10%以上。高酒精度啤酒发酵过程中,酿酒酵母往往会受到各种环境因子胁迫,如温度、渗透压、以及终产物乙醇浓度等[2]。高浓度的乙醇环境是影响啤酒酵母活力的关键因素,其中主要表现为影响细胞的形态及生长,使细胞活力下降[3],呼吸能力下降,葡萄糖同化能力减弱,发酵性能下降,膜的通透性增加[4],膜内pH值下降等[5]。高酒精度对酿酒酵母的毒性作用成为高酒精度精酿啤酒提升的瓶颈,随着精酿啤酒的酒精含量的提高,必然会对啤酒酵母产生一系列的胁迫作用,这种乙醇胁迫影响已经成为高酒精度精酿啤酒酿造的关键制约因素。
本文介绍了国内外精酿啤酒发展现状,结合精酿啤酒的乙醇胁迫问题和酿酒酵母酒精耐受机理从菌种选育,增加海藻糖(trehalose,TRE)含量、提高麦角甾醇(ergosterol,ERG)、添加氮源方面探讨了高酒精度精酿啤酒酿造中乙醇胁迫这一瓶颈的对策。
1 高酒精度精酿啤酒的发展现状
啤酒在传入我国后经历了飞速发展,于2002年超越美国成为世界第一大啤酒市场,但是我国的啤酒消费市场多为工业啤酒。工业啤酒是以大麦芽、玉米、大米、水、啤酒花为原料,采用拉格工艺生产,原麦汁浓度为8~9 °P,多属于淡色啤酒,且口感单一。因此导致了啤酒市场中各啤酒产品间同质化、低质化严重,另随着国人对啤酒多样化的需求从而致使近年来的啤酒消费市场低糜[6]。但是由于西欧国家的精酿啤酒风格独特多样且风味丰富,因此在国内大受追捧。精酿啤酒是由小型啤酒厂或是工坊以大(小)麦芽、水、啤酒花及为了风味和口感添加的新型酿造原料为原材料,利用传统的酿造工艺生产的具有独特风味的啤酒[7]。精酿啤酒为了追求丰富的口感和浓郁的风味多采用高浓酿造技术,其原麦汁浓度高达14 °P以上,并且酒精度也基本上都在4.5%以上,属于高酒精度啤酒[8]。表1为工业啤酒与精酿啤酒的区别。
表1 工业啤酒与精酿啤酒的差别
Table 1 The difference between industrial beer and craft beer
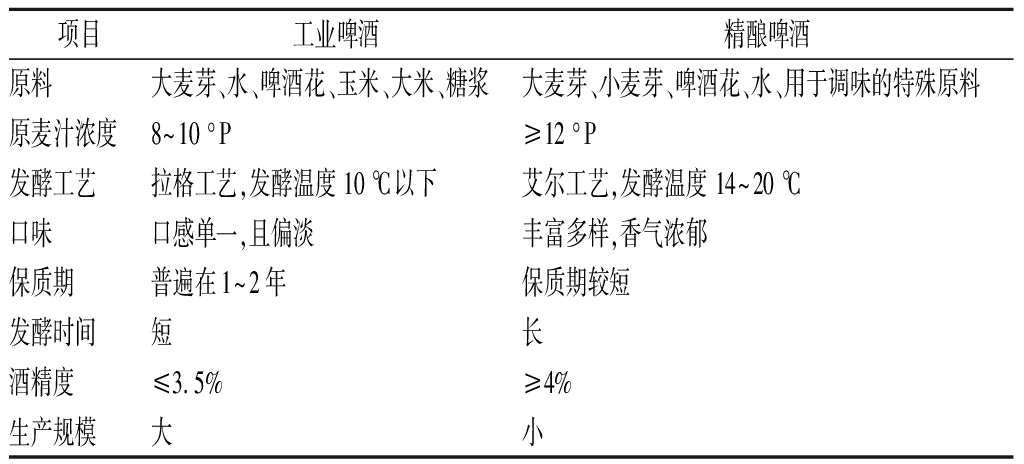
项目工业啤酒精酿啤酒原料大麦芽、水、啤酒花、玉米、大米、糖浆大麦芽、小麦芽、啤酒花、水、用于调味的特殊原料原麦汁浓度8~10 °P≥12 °P发酵工艺拉格工艺,发酵温度 10 ℃以下艾尔工艺,发酵温度 14~20 ℃口味口感单一,且偏淡丰富多样,香气浓郁保质期普遍在1~2年保质期较短发酵时间短长酒精度≤3.5%≥4%生产规模大小
随着精酿啤酒的浪潮席卷全球,市场精酿啤酒风格也是逐渐丰富多样,但是原麦汁浓度和营养价值愈来愈高、香味复杂且浓郁、口感厚重且伴随而来的就是酒精度也在不断提高。常见精酿啤酒的原麦汁浓度和酒精度见表2。
表2 常见精酿啤酒酒精度和原麦汁浓度
Table 2 Alcohol content and original wort concentration of common craft beer

啤酒类型精酿种类代表酒精度/%原麦汁浓度/°P皮尔森4.2~5.412拉格德国黑啤4.4~5.416~18博克9.0~14>18修道院4.5~1220印度淡色艾尔3.0~9.511.5英式波特4.0~5.414艾尔德式小麦白啤4.3~5.611.5帝国世涛4.0~9.712~20水果啤酒8.0~1213.5~22
目前高酒精度精酿啤酒主要在西欧和亚太市场上比较流行,如丹麦、捷克、爱尔兰、波兰、菲律宾和印度等[9]。国外市场上主要的高酒精度啤酒品种见表3。据统计,在印度Kingfisher,Haywards 5000,蛇王啤酒的King Cobra等高酒精度啤酒消费在整个啤酒消费市场的占有份额高达1/2,在菲律宾,Red Horse成为了仅次于生力啤酒的第二大啤酒品牌,其酒精度可达到7.0%~8.0%,而国内生产高酒精度啤酒的则是凤毛麟角,如蓝带船长啤酒,酒精度为10.0%[10]。中国消费者崇尚白酒,喜好高酒精度的酒水饮品,随着我国精酿啤酒的兴起,高酒精度精酿啤酒与国内消费者对高酒精度的推崇及对啤酒高品质需求相吻合,是我国精酿啤酒开发的重要领域,其研究开发不仅可满足广大啤酒爱好者的需求,对于酿酒商提升市场竞争力进入高端啤酒市场也具有重要意义[11]。
表3 国外高酒精度啤酒品种
Table 3 Varieties of foreign high alcohol beers
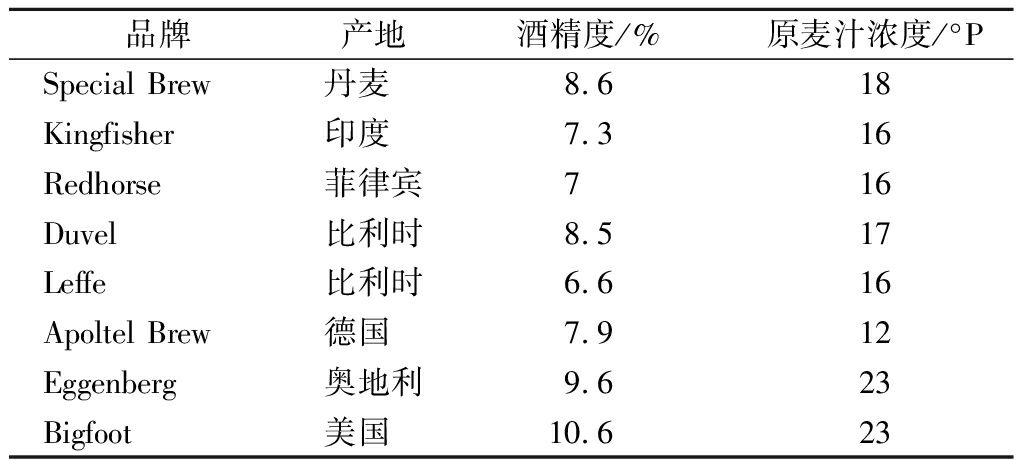
品牌产地酒精度/%原麦汁浓度/°PSpecial Brew丹麦 8.618Kingfisher印度 7.316Redhorse菲律宾716Duvel比利时8.517Leffe比利时6.616Apoltel Brew德国 7.912Eggenberg奥地利9.623Bigfoot美国 10.623
2 精酿啤酒的乙醇胁迫问题
酿酒酵母作为乙醇生产主要微生物,在实际发酵过程中,随着发酵醪液中酒精含量的不断积累,会对酵母菌株产生毒害作用。在相对较低的浓度,可抑制细胞分裂,降低细胞体积和比生长率,当发酵液中的酒精度高于5%时,乙醇则会对细胞造成损伤和细胞活力衰弱,甚至当乙醇浓度过高时会造成细胞死亡[12]。高浓度的乙醇胁迫作用表现为影响细胞膜的完整性和流动性,改变离子的通透性,引起跨膜电化学势的消失,进而导致细胞内pH降低,酶活性改变和细胞死亡。还会改变蛋白质的立体结构,导致蛋白质变性和功能失活,例如糖酵解中关键酶丙酮酸激酶和己酮激酶。高浓度的乙醇还会影响酵母细胞对麦芽糖、葡萄糖、氨基酸(amino acid,AA)的摄取,并导致细胞AA、核苷酸、蛋白质和钾离子的外渗。乙醇对酵母细胞的主要胁迫作用[5],见表4。
在啤酒领域中,10%高酒精度的啤酒酿造一直是个难题,而对于国外目前存在的超高酒精度啤酒,如历史终结者(The End of History)、封顶之作(Schorschbock)、蛇毒(Snake Venom)等,但是这3种啤酒并不是传统的经过发酵而来的啤酒,因为这些超高度的啤酒经过了特殊的后期冷冻或蒸馏处理,这种制作工艺已经超出了传统啤酒酿造的范畴。高酒精度对啤酒酵母的胁迫作用是精酿啤酒酒精度提升的瓶颈,降低高酒精度对酵母的毒害已经成为高酒精度精酿啤酒酿造亟待解决的关键问题。
表4 乙醇对酵母细胞的主要毒性[5]
Table 4 Some effects of ethanol on yeast physiology

酒精对细胞功能的影响来源细胞活力和生长抑制细胞的生长、分裂和活力STANLEY et al.(1997)细胞体积的减少BIRCH和WALKER(2000)新陈代谢降低了mRNA和蛋白的表达水平CHANDLER et al.(2004),HU et al.(2007)蛋白质变性和糖酵解酶活性降低HALLSWORTH et al.(1998)诱导热休克蛋白和其他压力反应蛋白质TECHAPARIN et al., (2017)胞内TRE积累LU CE RO et al.(2000)细胞结构和膜功能改变液泡形态MEADEN et al.(1999)抑制胞吞作用LU CE RO et al.(2000)增加细胞膜中不饱和/饱和脂肪酸的比例CHEN et al.(2019)增加膜内麦角固醇的含量VANEGAS et al.(2012)失去电化学梯度的和质子动力PETROV AND OKOROKOV(1990)运输过程的抑制LEAO AND VAN UDEN (1984)H+~ ATP酶活性的抑制CHAROENBHAKDI et al.(2016)增加了膜的流动性MISHRA AND PRASAD (1989),YANG et al.(2019)
3 酿酒酵母的乙醇耐受机理
3.1 TRE与乙醇耐受
TRE水合能力强和稳定性高,在胁迫条件下起到作为保护剂维持细胞活力作用,已经成为评价酵母乙醇耐受性的重要指标[13]。SHARMA[14]以高浓度NaCl及乙醇作为选择压力,筛选获得乙醇耐受突变菌株,研究表明选育的酵母菌株TRE和存活率显著高于野生型菌株。王宪斌等[15]研究显示酵母存活率与TRE量关系密切,存活率随着胞内TRE累积量增加而增加。当酵母处在乙醇胁迫环境中时,TRE可通过取代酵母细胞膜上的水和乙醇,与脂质极性基团之间形成氢键,起到稳定酵母细胞膜作用[16],也可防止蛋白质聚集和羰基化来保护细胞质蛋白,还可以帮助菌体蛋白进行适当折叠达到修复变性蛋白的效果,同时,TRE在流体条件下可以维持脂质双分子层结构[17]。酵母TRE合成基因涉及TPS1、TPS2、TPS3和TSL1 4个基因,而其分解与海藻糖酶基因NTH1、NTH2、ATH1有关,这些基因与酵母的乙醇耐受能力密切相关。ALEXANDRE等[18]发现乙醇胁迫引起酵母TRE合成基因TPS1、TPS2、TPS3和TSL1表达水平呈现上调的趋势,乙醇诱导TRE合成基因的表达产生更多TRE抵御乙醇胁迫。MAHMUD等[16]将中性海藻糖酶基因NTH1、NTH2和酸性海藻糖酶基因ATH1同时敲除,并对TRE酶缺陷菌株进行乙醇耐受性分析,发现缺陷菌株TRE合成基因TPS1和TPS2表达增强,缺陷菌株TRE含量比原始菌株FY834高,海藻糖酶基因缺失可提高TRE表达进而增强酵母的乙醇耐受能力。
3.2 ERG与乙醇耐受
膜脂包括磷脂、鞘脂和固醇类等,除了磷脂和鞘脂脂肪酸会对酵母乙醇耐受性产生影响外,固醇含量及其他组成基团的变化也会改变酵母细胞乙醇耐受性[4]。研究发现许多真菌都可以合成ERG,是质膜上的主要甾醇成分,特别是酵母细胞可能将其作为首选甾醇,它参与细胞膜完整性、流动性、通透性和膜结合酶的活性等,是一种公认的具有多种功能的甾醇[19]。高浓度的麦角固醇与酵母的乙醇耐受性呈现一定的正相关关系[20],DONG等[21]通过研究酵母细胞乙醇发酵时不同时期细胞的细胞膜成分变化来了解酵母细胞的应激机制,结果发现在指数期和稳定期细胞的ERG含量升高。并且GIBSON等[22]也发现与乙醇敏感型的工业酵母菌相比,产高浓度乙醇的酵母在有氧分批培养过程中能合成较多的麦角固醇,更关键的是,在应对高浓度乙醇冲击时,死亡速率明显慢于乙醇敏感型酵母,这说明麦角固醇与酵母耐高浓度乙醇有密切关系。ZHANG等[23]对酿酒酵母菌株ZTW1进行诱变并进行酒精发酵实验,发现突变菌株ZG27的ERG3基因发生突变,致使突变菌株ZG27酒精产量比ZTW1高7.9%,ERG产量比ZTW1高43.2%,证明ERG的含量与乙醇耐受密切相关。KUBOTA等[24]敲除ERG相关基因ERG2、ERG3、ERG5、ERG6、ERG24、ERG28后相关突变株不能在乙醇的胁迫下生长。
3.3 AA与乙醇耐受
在乙醇压力下,AA通过调节渗透压稳定细胞内的生物大分子结构,增加微溶蛋白的溶解性,降低DNA的溶解温度值等,以促使提高酵母细胞的乙醇耐受性。酵母的发酵过程中,脯氨酸对保护酵母细胞免于逆境胁迫表现出重要的作用,它可以提高蛋白质的稳定性,同时,还可避免蛋白质在折叠过程中发生凝集[25]。TAKAGI等[26]将野生型酵母的PRO1基因替换为pro1d154n基因后,酵母的脯氨酸合成含量明显增加,同时酵母的乙醇耐受性也得到了提高。除此之外,TAKAGI等[27]的研究结果表明PRO1基因敲除菌的乙醇耐受性明显较野生型酵母差,也阐明了脯氨酸对酵母乙醇耐受性的重要贡献。色氨酸是另一种被认为与酵母乙醇耐受性密切相关的AA,HIRASAWA等[28]采用DNA微阵列技术对清酒酿造酵母与酿酒酵母FY834进行分析,发现色氨酸合成基因与酵母的乙醇耐受性有紧密的联系,过表达色氨酸合成基因TRP1~5、色氨酸通透酶基因TAT2,或在培养基中补充色氨酸,均可以提高酵母的乙醇耐受性。
综上所述,酵母的乙醇耐受性与TRE、ERG、AA密切性关,因此整合了与酵母的乙醇耐受相关研究文献并总结了酵母的乙醇耐受与TRE、ERG、AA可能存在的相关机制如图1 所示。

图1 酵母的乙醇耐受与TRE、ERG、AA的关系
Fig.1 Relationship between ethanol tolerance and TRE, ERG, AA in Saccharomyces cerevisiae
4 精酿啤酒乙醇胁迫问题的对策
高浓麦汁酿造工艺前期的高渗透压导致啤酒酵母的起发酵困难,并且随着发酵的进行,乙醇浓度不断增加又会给细胞带来损伤,严重制约了精酿啤酒的发展。精酿啤酒酿造过程中高浓度乙醇带来的压力可通过选育高乙醇耐受性啤酒酵母和改良发酵培养基的成分来缓解。
4.1 选育酒精耐受性啤酒酵母
精酿啤酒所需的乙醇耐受性菌株可通过自然选育、诱变、杂交、原生质体融合、基因工程及基因组改组等途径获得。
自然选育是从特殊环境(高渗透压、高温、高酒精度)中存在的自发突变体中筛选具有优良特性的菌株,该方法简单实用,目前仍是筛选高乙醇耐受性酵母菌株的常用方法之一。ARACHCHIGE等[29]从斯里兰卡的棕榈酒中分离得到18种酿酒酵母菌株,并且通过分批发酵培养发现这些菌株产生的酒精度要高于对照菌株。EDGARDO等[30]通过自然选育和适应进化筛选到能够耐受42 ℃高温的优良菌株,且乙醇产量可以达到理论值的75%。
诱变选育是通过物理或化学方式使微生物发生基因突变,并通过定向筛选得到优良的目的菌株,目前仍然被工厂广泛采用。王犁烨等[31]报道了利用紫外诱变得到的突变株Y6-5能够耐受更高的乙醇浓度,且能够稳定遗传,与原始菌株Y6相比较,其产酒精能力提高了28.13%。近年来,研究者开发出了更易操作和高效的常压室温等离子体(atmospheric and room remperature plasma ARTP)技术,梁若楠[10]采用ARTP技术进行诱变处理,选育的突变株SC16在24 °P的超高浓发酵过程中发酵速度更快,并且与出发菌株相比,其酒精度提高了8.1%。
杂交育种是将同一种属的2株具有不同优良性状菌体进行杂交,遗传物质的结构被打乱然后又重新组合,最后在它们的杂交子代中甄选出具有这两株亲本菌株优良性状纯合子的育种方法。ORIGONE等[32]报道了利用Saccharomyces eubayanus NPCC1292与Saccharomyces uvarum两种酵母作为亲本进行种间杂交获得能够稳定遗传且可耐受12.57%酒精度的H19菌株。KROGERUS等[33]通过种间杂交技术构建了不同倍体的杂交菌株,通过在高浓麦汁15 °P 和超高浓麦汁25 °P进行发酵实验,研究结果表明杂交菌株比亲本菌株有更好乙醇耐受性。SANHEZ等[34]利用经典遗传学的方法获得了Saccharomyces cerevisiae和S.eubayanus的杂交菌株,并且经过发酵试验验证,证明获得的新型突变株有更好乙醇耐受性和发酵性能。
原生质体融合技术是指将两种菌种的原生质体相互融合,进而其基因组会相互接触并进行基因交换,最终2株菌种的基因再进行重组,获得双亲本都具有的优良性状的突变菌株[35]。SHI等[36]利用原生质体融合技术得到1株菌株,对其进行紫外辐照诱变,最终筛选到1株能够耐受20%(体积分数)乙醇的菌株。XIN等[37]利用菌株Q和菌株L进行原生质体融合技术得到了1株融合菌株Q/Lf2,可以耐受14%(体积分数)的乙醇。
基因工程育种通常是通过基因工程手段删除或过表达与乙醇耐受基因相关的某一基因或多个基因,从而达到使突变菌株能够耐受更高乙醇浓度的目的。与传统育种相比,基因工程育种技术具有很清晰的目标靶点,特别是在生物育种方面,利用构建目的DNA片段,从而获得理想的菌株。李佳等[38]采用基因工程手段构建了18S rDNA介导的FKS1基因过表达菌株,该菌株能够耐受8%(体积分数)的乙醇。OOMURO等[39]通过基因工程手段构建了Δrim15突变株,该突变株能够耐受20%高浓麦汁或是高浓度的糖液,并且能够明显提高发酵速率和酒精度。
基因组改组使得子代筛选群体内的遗传多样性更加丰富,从而使具有优良性状的菌株获得概率显著提高,1998年STEMMER提出了全基因组改组技术,随即该技术被各个领域的研究者用于自己的相关研究中。SHI等[36]以工业酿酒酵母SM-3作为出发菌株,对其进行3轮基因组改组,获得乙醇高耐受菌株F34,其不仅可以在20%葡萄糖下保持发酵活力,而且其产酒精量高达9.95%。王灏等[40]利用对利用原生质体融合技术对f4、f5及f6融合,并经过紫外照射后再经过2轮的基因组改组,获得了相较于出发菌株有更高的乙醇浓度耐受性酵母菌株R24。陆筑凤等[41]对5株酵母菌株作为出发菌进行多轮基因组改组,并对融合后的子代菌株遴选,最终获得的酵母菌能耐受16%(体积分数)乙醇。因此,应用基因组改组技术可以将多种优良性状菌株的基因组进行整合重组,构建出理想的酵母菌株,将对乙醇生产与酿酒工业的发展具有重要的意义。
4.2 增加TRE增强酵母乙醇耐受
TRE与酿酒酵母细胞乙醇耐受关系密切,提高TRE含量增强酵母的乙醇耐受能力。目前研究报道表明可通过促使海藻糖合成酶相关基因的表达或是提高外源性TRE的含量两种途径达到提高TRE的目的。提高酵母细胞内海藻糖合成酶相关基因的表达量的方式是多种多样,如适当的环境胁迫,优化培养基的培养成分和通过基因工程手段等。利用基因工程手段对TRE合成及降解基因进行改良可显著提高酵母细胞内TRE含量[42]。研究同时发现,在培养基中添加外源性TRE,同样可以有效提高酿酒酵母的乙醇耐受性[43]。O′SHEA等[44]的研究发现通过外源添加TRE的方式提高了乙醇胁迫下酵母细胞的存活率。刘琦等[45]将葡萄酒泥酵母中的TRE提取物以300 mg/L的添加量加入到模拟葡萄汁中,研究其对酵母乙醇耐受性的影响。结果表明,酵母在稳定期的生物量和存活率都大幅提高,且其可耐受10%(体积分数)的乙醇胁迫,说明TRE可以提高酵母的乙醇耐受性。可见,外源添加TRE提高酿酒酵母乙醇耐受性,可以有效改善酿酒酵母发酵特性,有利于酿酒工业的发展。
4.3 增加ERG增强酵母乙醇耐受
ERG是酵母细胞膜脂质的重要组成成分之一,与酿酒酵母耐受酒精关系密切。在酒精刺激条件下,酵母细胞通过启动ERG的相关基因合成ERG,通过ERG含量的增加来提高酿酒酵母细胞对酒精的抗性[21]。HAYASHIDA等[46]在发酵培养基中添加一定量的TRE后证明Saccharomyces sake Kyokai No.7的生长和活力明显增强,并且其酒精产量高达20%(体积分数)。随后,周进等[47]在培养基中添加不同剂量的ERG,其酒精产量提高了10.1%~23.5%。因此通过外源添加提高酵母细胞内ERG的含量的方式是完全可行的。培养基中添加ERG后,不仅能促进酵母的发酵速率和提高乙醇产量,而且当酿酒酵母细胞膜中含有丰富的ERG时比含有或胆固醇时乙醇耐受性更强。推测ERG可以增加细胞膜的坚韧性,减少膜的流动性。
4.4 添加氮源提高酵母乙醇耐受
很多研究显示添加氮源可以加快酵母的发酵进程,并且能够提高酵母的耐受乙醇的抗性。YANG等[3]研究在10%(体积分数)的乙醇培养基中添加不同分解度的面筋蛋白发现分解度越高酵母细胞的活性及耐受能力越高。OOMURO等[48]研究在培养基上加入S-腺苷甲硫氨酸显著提高了巴氏酵母菌株的发酵速率。研究发现同时添加两种及以上氨基酸对提高酵母乙醇耐受效果更好,LEI等[49]向培养基中添加赖氨酸和组氨酸,结果证实乙醇的产量显著提高。YANG等[50]通过添加赖氨酸和异亮氨酸研究高糖环境下酵母细胞发酵速率和乙醇耐受,发现将2种氨基酸混合添加更有利于提高酵母细胞对于乙醇的抗性。
5 结束语
随着中国经济的持续稳定增长,国内啤酒消费升级带动产品结构优化和价格提升,啤酒市场消费由增量向增质方向转变,差异化、高品质渐成消费趋势。目前我国精酿啤酒的年市场增速高达40%,并且国内的精酿啤酒毛利率和净利率分别能达到50%和30%,高酒精度精酿啤酒成为消费者更高层次的追求趋势。乙醇高耐性优良菌株的选育及精酿啤酒高酒精度酿造工艺探索可能是未来精酿啤酒研发的重要领域,高酒精度对精酿啤酒酿造制约问题的探明及解决可能成为促进精酿啤酒酿造生产的助推剂。
[1] LI T L, WU C Y, LIAO J Q, et al.Application of protein hydrolysates from defatted walnut meal in high-gravity brewing to improve fermentation performance of lager yeast[J].Applied Biochemistry and Biotechnology, 2020, 190(2):360-372.
[2] BABAZADEH R, LAHTVEE P J, ADIELS C B, et al.The yeast osmostress response is carbon source dependent[J].Scientific Reports.2017, 7(1):990.
[3] YANG H R, ZONG X Y, CUI C, et al.Wheat gluten hydrolysates separated by macroporous resins enhance the stress tolerance in brewer′s yeast[J].Food Chemistry, 2018, 268:162-170.
[4] 张苗苗, 陆栋, 剡倩, 等.细胞膜对酿酒酵母乙醇耐受性影响的研究进展[J].中国酿造,2016, 35(9):16-19.
ZHANG M M, LU D, YAN Q, et al.Research progress on effect of cell membrane on ethanol tolerance of Saccharomyces cerevisiae[J].China Brewing, 2016, 35(9):16-19.
[5] STANLEY D, BANDARA A, FRASER S, et al.The ethanol stress response and ethanol tolerance of Saccharomyces cerevisiae[J].Journal of Applied Microbiology, 2010, 109(1):13-24.
[6] 杨婧娀,王佐民,于宏伟,等.精酿啤酒的发展前景[J].酿酒, 2018, 45(4):29-31.
YANG J S, WANG Z M, YU H W et al.Prospect of craft beer[J].Liquor Making, 2018, 45(4):29-31.
[7] BAIANO A.Craft beer:An overview[J].Comprehensive Reviews in Food Science and Food Safety,2021, 20(2):1 829-1 856.
[8] STEWART.A selective history of high gravity and high-alcohol beers[J].Master Brewers Association of the Americas Technical Quarterly, 2010, 47(2):1-6.
[9] 阚欣. 高酒精度啤酒的初步研究[D].无锡:江南大学;2012.
KAN X.Preliminary study of high alcohol beer[D].Wuxi:Jiangnan University, 2012.
[10] 梁若楠. 高耐性啤酒酵母选育及高浓度特种啤酒酿造工艺优化[D].广州:华南理工大学, 2018.
LIANG R N.Selection of high tolerance brewer′s yeast and optimization of high gravity specialty beer brewing[D].Guangzhou:South China University of Technology, 2018.
[11] 王蕾, 薛一鸣, 王杰, 等.中国精酿啤酒现状及发展[J].现代食品, 2020(14):18-20.
WANG L, XUE Y M, WANG J, et al.The status and development of China craft beer[J].Modern Food, 2020(14):18-20.
[12] BIRCH R M, WALKER G.M.Influence of magnesium ions on heat shock and ethanol stress responses of Saccharomyces cerevisiae[J].Enzyme Microb Technol, 2000, 26(9-10):678-687.
[13] VAN DIJCK P, COLAVIZZA D, SMET P, et al.Differential importance- of trehalose in stress resistance in fermenting and nonfermenting Saccharomyces cerevisiae cells[J].Appl Environ Microbiol, 1995, 61(1):109-115.
[14] SHARMA S C.A possible role of trehalose in osmotolerancce and ethanol tolerance in Saccharomyces cerevisiae[J].FEMS Microbiology Letters,1997,152(1):11-15.
[15] 王宪斌, 冯霞, 张蓓蓓, 等.一株生香酵母冻干菌剂的制备研究[J].食品与发酵科技, 2019, 55(6):9-12.
WANG X B, FENG X, ZHANG B B, et al.Study on the freeze-drying microbial agent preparation of an aroma-producing yeast[J].Food and Fermentation Sciences & Technology, 2019, 55(6):9-12.
[16] MAHMUD S A, HIRASAWA T, SHIMIZU H.Differential importance of trehalose accumulation in Saccharomyces cerevisiae in response to various environmental stresses[J].Journal of Bioscience & Bioengineering, 2010, 109(3):262-266.
[17] TREVISOL E T V, PANEK A D, MANNARINO S C, et al.The effect of trehalose on the fermentation performance of aged cells of Saccharomyces cerevisiae[J].Applied Microbiology & Biotechnology, 2011, 90(2):697-704.
[18] ALEXANDRE H, ANSANAY-GALEOTE V, DEQUIN S, et al.Global gene expression during short-term ethanol stress in Saccharomyces cerevisiae[J].FEBS Letters.2001, 498(1):98-103.
[19] PARKS L W, CASEY W M.Physiological implications of sterol biosynthesis in yeast[J].Annual Review of Microbiology, 1995, 49(1):95-116.
[20] 易晨峰. 酿酒酵母不同生长周期细胞对乙醇胁迫的响应 [D].北京:北京化工大学, 2015.
YI C F.Response of the yeast cells at different phases to the ethanol stress of Saccharomyces cerevisiae[D].Beijing:Beijing University of Chemical Technology, 2015.
[21] DONG S J, YI C F, LI H.Changes of Saccharomyces cerevisiae cell membrane components and promotion to ethanol tolerance during the bioethanol fermentation[J].The International Journal of Biochemistry & Cell Biology,2015, 69:196-203.
[22] GIBSON B R, LAWRENCE S J, LECLAIRE J P R, et al.Yeast responses to stresses associated with industrial brewery handling[J].FEMS Microbiology Reviews, 2007, 31(5):535-569.
[23] ZHANG K, TONG M M, GAO K H, et al.Genomic reconstruction to improve bioethanol and ergosterol production of industrial yeast Saccharomyces cerevisiae[J].Journal of Industrial Microbiology & Biotechnology, 2015, 42(2):207-218.
[24] KUBOTA S, TAKEO I, KUME K, et al.Effect of ethanol on cell growth of budding yeast:Genes that are important for cell growth in the presence of ethanol[J].Bioscience, Biotechnology, and Biochemistry, 2004, 68(4):968-972.
[25] MORITA Y, NAKAMORI S, TAKAGI H.L-Proline accumulation and freeze tolerance in Saccharomyces cerevisiae are caused by a mutation in the PRO1 gene encoding γ-glutamyl kinase[J].Applied and Environmental Microbiology, 2003, 69(1):212-219.
[26] TAKAGI H, TAKAOKA M, KAWAGUCHI A, et al.Effect of L-Proline on sake brewing and ethanol stress in Saccharomyces cerevisiae[J].Applied and Environmental Microbiology, 2005, 71(12):8 656-8 662.
[27] TAKAGI H, MATSUI F, KAWAGUCHI A, et al.Construction and analysis of self-cloning sake yeasts that accumulate proline[J].Journal of Bioscience & Bioengineering, 2007, 103(4):377-380.
[28] HIRASAWA T, YAMADA K, NAGAHISA K, et al.Proteomic analysis of responses to osmotic stress in laboratory and sake-brewing strains of Saccharomyces cerevisiae[J].Process Biochemistry, 2009, 44(6):647-653.
[29] ARACHCHIGE M, YOSHIDA S, TOYAMA H.Thermo-and salt-tolerant Saccharomyces cerevisiae strains isolated from fermenting coconut toddy from Sri Lanka[J].Biotechnology & Biotechnological Equipment, 2019, 33(1):937-944.
[30] EDGARDO A, CAROLINA P, MANUEL R, et al.Selection of thermotolerant yeast strains Saccharomyces cerevisiae for bioethanol production[J].Enzyme and Microbial Technology, 2008,43(2):120-123.
[31] 王犁烨, 陈新军, 卢丕超, 等.紫外诱变选育高产酒精及酸的酿酒酵母[J].中国酿造, 2019, 38(1):104-108.
WANG L Y, CHEN X J, LU P C, et al.Breeding of Saccharomyces cerevisiae with high-yield alcohol and acid by ultraviolet mutation[J].China Brewing, 2019, 38(1):104-108.
[32] ORIGONE A C, RODR GUEZ M E, OTEIZA J M, et al.Saccharomyces cerevisiae×Saccharomyces uvarum hybrids generated under different conditions share similar winemaking features[J].Yeast,2018,35(1):157-171.
GUEZ M E, OTEIZA J M, et al.Saccharomyces cerevisiae×Saccharomyces uvarum hybrids generated under different conditions share similar winemaking features[J].Yeast,2018,35(1):157-171.
[33] KROGERUS K, ARVAS M, DE CHIARA M, et al.Ploidy influences the functional attributes of de novo lager yeast hybrids[J].Applied Microbiology and Biotechnology, 2016, 100(16):7 203-7 222.
[34] SANCHEZ R G, SOLODOVNIKOVA N, WENDLAND J.Breeding of lager yeast with Saccharomyces cerevisiae improves stress resistance and fermentation performance[J].Yeast,2012,29(8):343-355.
[35] FERENCZY L, MAR Z A.Transfer of mitochondria by protoplast fusion in Saccharomyces cerevisiae[J].Nature,1977,268(5 620):524-525.
Z A.Transfer of mitochondria by protoplast fusion in Saccharomyces cerevisiae[J].Nature,1977,268(5 620):524-525.
[36] SHI D J,WANG C L,WANG K M.Genome shuffling to improve thermotolerance, ethanol tolerance and ethanol productivity of Saccharomyces cerevisiae[J].Journal of Industrial Microbiology & Biotechnology, 2009, 36(1):139-147.
[37] XIN Y, YANG M, YIN H, et al.Improvement of ethanol tolerance by inactive protoplast fusion in Saccharomyces cerevisiae[J].BioMed Research International, 2020(2):1-10.
[38] 李佳, 王金晶, 李崎.18S rDNA介导的FKS1基因过表达对酵母自溶性能的影响[J].生物工程学报, 2015, 31(9):1 344-1 354.
LI J, WANG J J, LI Q.Overexpression of FKS1 to improve yeast autolysis-stress[J].Chinese Journal of Biotechnology,2015, 31(9):1 344-1 354.
[39] OOMURO M, KATO T, ZHOU Y, et al.Defective quiescence entry promotes the fermentation performance of bottom-fermenting brewer′s yeast[J].Journal of Bioscience and Bioengineering,2016,122(5):577-582.
[40] 王灏, 王航,孟春,等.基因组改组技术选育耐高温、耐高乙醇酿酒酵母菌株的研究[J].工业微生物学通报, 2007, 34(4):705-708.
WANG H, WANG H,MENG C,et al.Study of breeding Saccharomyces cerevisiae with improved temperature and ethanol tolerance by genome shuffling[J].Microbiology China, 2007, 34(4):705-708.
[41] 陆筑凤, 李超, 王昌禄, 等.Genome shuffling技术选育高耐性酿酒酵母[J].酿酒科技, 2008(7):23-25.
LU Z F, LI C, WANG C L, et al.Breeding of Saccharomyces cerevisiae with high temperature and ethanol tolerance by genome shuffling techniques[J].Liquor- Making Science & Technology, 2008(7):23-25.
[42] 陈敦武, 陈雄, 李欣.酵母内源性海藻糖代谢调控研究进展[J].微生物学报, 2019, 59(12):2 276-2 284.
CHEN D W, CHEN X, LI X.Advances in regulation of endogenous trehalose metabolism in yeast[J].Acta Microbiologica Sinica, 2019, 59(12):2 276-2 284.
[43] 杨昳津, 林祥娜, 夏永军, 等.不同营养添加物对黄酒酵母的乙醇耐受及发酵性能的影响[J].食品与发酵工业, 2018, 44(1):37-43.
YANG Y J, LIN X N, XIA Y J, et al.Effects of different nutrition additives on ethanol tolerance and fermentation performance of Chinese rice wine yeast[J].Food and Fermentation Industries, 2018, 44(1):37-43.
[44] O′SHEA T M, WEBBER M J, AIMETTI A A, et al.Covalent incorporation of trehalose within hydrogels for enhanced long-term functional stability and controlled release of biomacromolecules[J].Advanced Healthcare Materials, 2015, 4(12): 1 802-1 812.
[45] 刘琦, 祝霞, 赵丹丹, 等.葡萄酒泥酵母海藻糖提取工艺优化及对3株非酿酒酵母乙醇耐受性的影响[J].甘肃农业大学学报, 2018,53(4):152-158.
LIU Q, ZHU X, ZHAO D D, et al.Optimization of extracting processing condition of trehalose from wine yeast and its effect on ethanol tolerance of three non-Saccharomyces cerevisiae[J].Journal of Gansu Agricultural University, 2018,53(4):152-158.
[46] HAYASHIDA S, OHTA K.Effects of phosphatidylcholine or ergosteryl oleate on physiological properties of Saccharomyces sake[J].Journal of the Agricultural Chemical Society of Japan, 2008, 44(11):2 561-2 567.
[47] 周进, 储炬, 王永红, 等.麦角甾醇对酿酒酵母乙醇产率和耐受性的作用(英文)[J].上海交通大学学报(农业科学版), 2007,25(1):12-16.
ZHOU J, CHU J, WANG Y H, et al.Role of ergosterol on ethanol production and tolerance by Saccharomyces cerevisiae[J].Journal of Shanghai Jiaotong University (Agricultural Science), 2007,25(1):12-16.
[48] OOMURO M, WATANABE D, SUGIMOTO Y, et al. Accumulation of intracellular S-adenosylmethionine increases the fermentation rate of bottom-fermenting brewer′s yeast during high-gravity brewing[J]. Journal of Bioscience and Bioengineering, 2018, 126(6): 736-741.
[49] LEI H, LI H, MO F, et al.Effects of Lys and His supplementations on the regulation of nitrogen metabolism in lager yeast[J].Appl Microbiol Biotechnol, 2013, 97(20):8 913-8 921.
[50] YANG H R, ZONG X Y, CUI C, et al.Peptide (Lys-Leu) and amino acids (Lys and Leu) supplementations improve physiological activity and fermentation performance of brewer′s yeast during very high-gravity (VHG) wort fermentation[J].Biotechnol Appl Biochem, 2018, 65(4):630-638.