胆碱是卵磷脂的主要成分,也是神经递质乙酰胆碱生物合成的前体[1]。胆碱对人体具有极其重要的作用,它能够促进脂肪的分解,传递神经信号。胆碱的缺乏会影响记忆力,并且容易导致肝功能障碍,甚至引发癌症。此外,阿尔茨海默病和帕金森病等神经退行性疾病也与胆碱的异常代谢有关[2]。虽然人体可以合成胆碱,但是饮食中也需要胆碱的摄入[3]。一些国家的儿科学会、食品和营养委员会为婴儿以及成人制定关于胆碱每日摄入量的标准[4],因此食品中胆碱含量的检测具有重要的意义。检测食品中的胆碱含量通常采用气相色谱法[5]、高效液相色谱法[6]、离子色谱[7]、色谱-质谱联用法[8]、荧光检测法[9]、比色法[10]等传统检测方法,但这些检测方法普遍成本高、操作复杂、分析速度慢、难以快速实时检测,因此研究新型便携的食品中胆碱检测技术是极其必要的。
利用光电化学分析原理,研制敏感化的光敏电极,能够实现食品中胆碱的快速实时检测。胆碱氧化酶(choline oxidase,ChOx)是光电化学检测胆碱的关键用酶,可以催化胆碱生成电子供体H2O2,在光激发下,电极上的光活性物质会得到H2O2的电子,组成光致电化学循环系统,利用光电化学手段,探究光电化学信号对胆碱的响应。由于游离态的酶分析精度、稳定性和循环利用性较差[11],所以ChOx作为生物敏感元件固定于光敏电极可有效提高其检测的效率。固定化的酶需要保持其结构、功能和生物活性,在光敏酶电极使用的过程中不易发生解吸,理想的酶电极同时具有重现性和贮藏稳定性,酶的固定化方法直接影响着光敏酶电极的精度和稳定性[12],因此要选择合适的光敏电极上酶的固定化方法。
用于电极上酶的固定化方法主要有吸附法[13]、包埋法[14]、共价结合法[15]、交联法[16]以及亲和法[17]等。ZHANG等[18]将乙酰辅酶A和辅酶A吸附固定于金电极上,基于阴极溶出伏安法进行肉碱的灵敏测定。LIU等[19]利用Nafion将酪氨酸酶与碱性磷酸酶固定在生物炭纳米颗粒修饰的玻碳电极上,用于双酚A的检测,具有较好的重现性和稳定性。RAHMAN等[20]采用共价结合法将ChOx固定于修饰电极上,用于胆碱的快速检测。但是由于共价结合法的反应条件比较强烈,会引起酶蛋白高级结构的改变,降低了固定ChOx的比活力,因此需探究更适宜的光敏电极上ChOx固定化方法用于胆碱的快速检测。
本文基于二氧化锡纳米粒子(SnO2 nanoparticles,SnO2 NPs)和聚硫堇(polythioine,PTh)修饰的氧化铟锡(indium tin oxide,ITO)光敏电极,采用壳聚糖包埋和戊二醛交联相结合的方法固定ChOx,这种复合的固定化方法能够使光敏电极达到更好的酶固定效果。试验表征了ITO/ SnO2 NPs/PTh电极固定ChOx前后的形貌变化,考察了壳聚糖浓度、戊二醛浓度、固定时间对ChOx相对酶活力的影响,通过响应面优化出最佳的ChOx固定化条件,并研究了光敏电极固定化酶的重复利用性和贮存稳定性,对于生物酶光敏电极能够更好的应用于食品中胆碱的光电化学检测提供了一定的理论支撑。
1 材料与方法
1.1 材料与试剂
ChOx(10 units/mg)、过氧化物酶(250 units/mg),美国Sigma公司;壳聚糖,上海麦克林生化科技有限公司;ABTS,上海阿拉丁生化科技股份有限公司;戊二醛(分析纯),天津市大茂化学试剂厂;磷酸氢二钠、磷酸二氢钠(分析纯),天津市凯通化学试剂有限公司。
1.2 仪器与设备
HITACHI S-4300扫描式电子显微镜(scanning eletrn microscope,SEM),日本日立公司;UV-5100紫外可见分光光度计,上海元析仪器有限公司。
1.3 实验方法
1.3.1 光敏电极ChOx的固定
用移液枪将5 μL壳聚糖溶液转移到自制的ITO/SnO2 NPs/PTh电极表面,室温干燥成膜。然后用pH 6.0的PBS洗涤,晾干。电极表面涂以5 μL戊二醛溶液,硬化30 min后,用pH 6.0的PBS洗涤电极干燥,并滴加5 μL ChOx溶液,室温固定化反应一段时间。用去离子水冲洗备用。
1.3.2 ChOx活性的测定
参考HEINZE等[21]的分光光度法测定ChOx活性并稍作修改,过氧化物酶偶联系统氧化ABTS会导致414 nm处吸光度增加,1单位ChOx的活性对应1 μmol/min ABTS的氧化。在试管中依次加入0.8 mL的PBS(50 mmol/L、pH 7.0)、0.1 mL的胆碱(0.5 mmol/L)、0.05 mL ABTS溶液(50 mmol/L)和1.3.1所制的ChOx固定化酶膜,然后加入0.05 mL的过氧化物酶溶液(25 U/mL),所有溶液均采用50 mmol/L的PBS(pH 7.0)配制,混匀,25 ℃反应5 min,测定样品在414 nm处吸光度,空白对照组添加灭活固定化酶膜,其余不变。设定同组酶活力最高的相对酶活力为100%,以同组最高酶活力为参照,计算出的比值为ChOx相对酶活力。
1.3.3 ChOx固定化单因素试验
1.3.3.1 壳聚糖浓度对固定化ChOx相对酶活力的影响
在戊二醛质量分数为0.3%、交联时间为1 h时,考察壳聚糖质量分数为0.2%、0.6%、1%、1.4%、1.8%对ChOx相对酶活力的影响。
1.3.3.2 戊二醛浓度对固定化ChOx相对酶活力的影响
在壳聚糖质量分数为1%、交联时间为1 h时,考察戊二醛质量分数为0.05%、0.3%、0.55%、0.8%、1.05%对ChOx相对酶活力的影响。
1.3.3.3 固定时间对固定化ChOx相对酶活力的影响
在壳聚糖质量分数为1%、戊二醛质量分数为0.3%,考察固定时间为0.2、0.6、1、1.4、1.8 h对ChOx相对酶活力的影响。
1.3.4 响应面法优化固定条件
基于单因素试验结果,以ChOx的酶活力为考察指标,根据Box-Behnken原理设计3因素3水平响应面试验,因素和水平试验设计见表1。
表1 响应面分析因素水平表
Table 1 Factors and levels of the response surface methodology
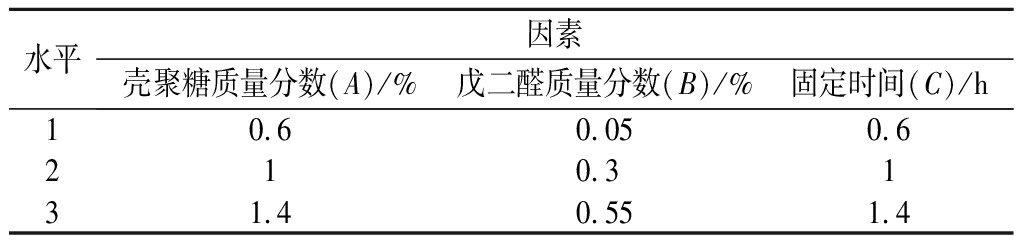
水平因素壳聚糖质量分数(A)/%戊二醛质量分数(B)/%固定时间(C)/h10.60.050.6210.3131.40.551.4
1.4 固定化酶的重复利用性
将固定化酶在相同条件下连续操作10次,测定ChOx相对酶活力。
1.5 固定化酶的贮存稳定性
分别取固定化酶保存于0~4 ℃冰箱中,每隔4 d取出测定两者的残余酶活力。
1.6 数据处理
所有样品进行3次平行试验,采用Excel 2016进行数据统计分析,计算其平均值和标准误差;实验数据以“均值±标准差”表示并使用Origin 9绘图;通过Design-Expert 8.0.6软件对光敏电极固定化ChOx条件进行优化。
2 结果与分析
2.1 单因素试验结果
2.1.1 壳聚糖浓度对固定化酶活力的影响
如图1所示,固定化ChOx相对酶活力随壳聚糖浓度的增加而逐渐升高,在壳聚糖质量分数为1%时酶活力达到最大值,与其他浓度相对酶活力的差异是极显著的(P<0.01),随着壳聚糖浓度的继续增加而显著降低。壳聚糖是无毒的,具有生物相容性,为酶提供天然的微环境,并且有利于电子在酶和电极之间穿梭,在电极的酶固定领域应用广泛[22]。当壳聚糖的浓度较低时,ChOx的包埋不紧密,酶会逐渐泄露,所以包埋效果较差,固定化酶活力较低。当壳聚糖质量分数>1%时,溶液黏度过大,酶液分布不均匀,降低了ChOx对胆碱的催化速率,所以固定化酶的活性降低,壳聚糖的最佳质量分数选择为1%。
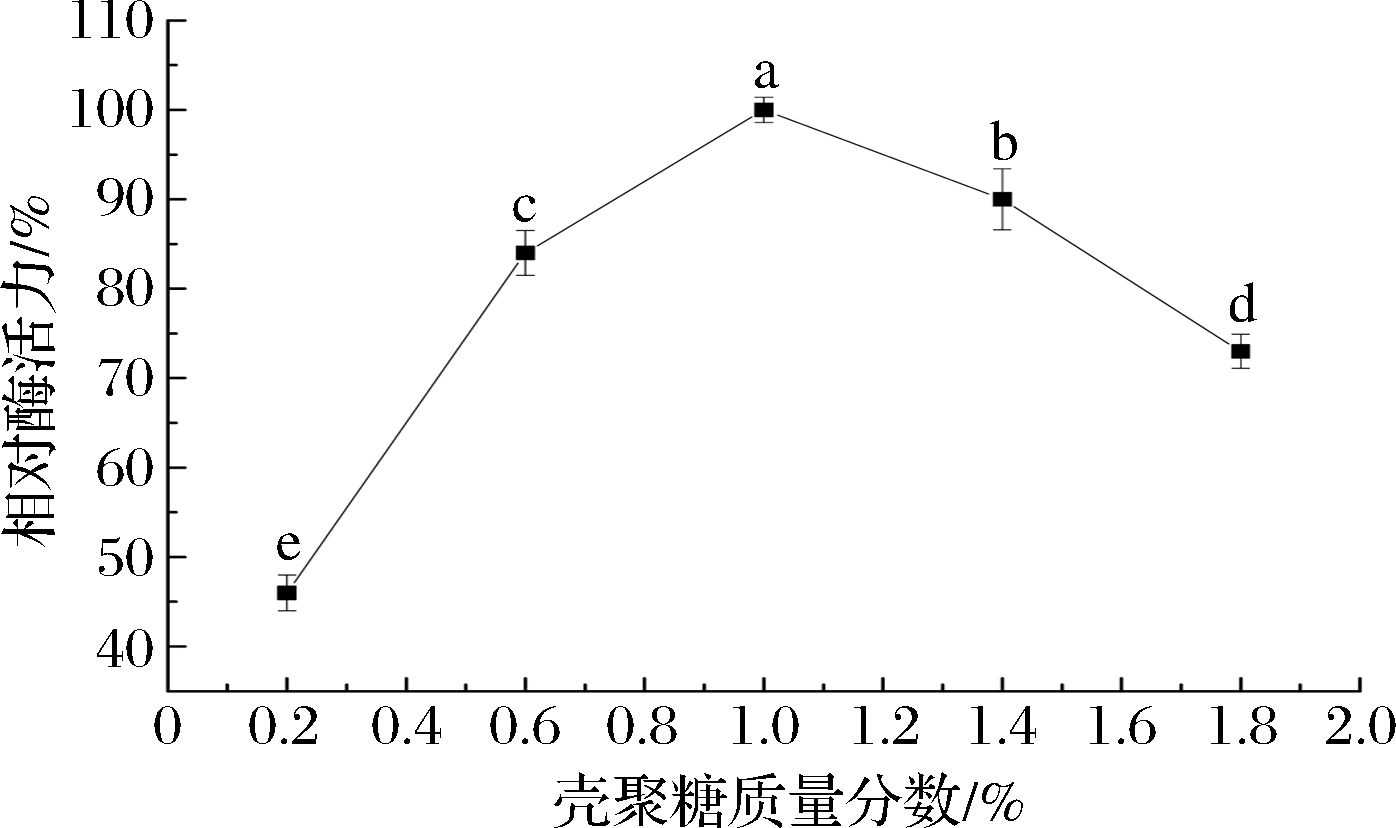
图1 壳聚糖浓度对固定化酶活力的影响
Fig.1 Effect of chitosan concentration on the immobilized enzyme activity 注:不同小写字母表示差异显著(P<0.05)(下同)
2.1.2 戊二醛浓度对固定化酶活力的影响
如图2所示,随着戊二醛浓度的增加,固定化ChOx的相对酶活力呈先升高后降低的趋势,当戊二醛质量分数为0.3%时,ChOx的相对酶活力达到最大值,与其他戊二醛浓度的相对酶活力具有极显著差异(P<0.01)。戊二醛的浓度较低时,交联度较低。包埋的不紧实,酶容易流失,所以酶的相对活力不高。当戊二醛的质量分数>0.3%时,戊二醛中的醛基具有较大的范德华力,可以与壳聚糖以及酶中的—OH、—NH3等基团共价结合形成共价键,占用了酶蛋白中的有效基团,影响了酶与底物的有效结合,进而降低了酶对底物的催化氧化效率,同时戊二醛也是一种变性剂,高浓度的戊二醛会使酶的活性部位发生改变,致使酶失活,所以ChOx的酶活力降低,这与HUANG等[23]研究结果相一致,戊二醛的最佳质量分数选择为0.3%。
2.1.3 固定时间对固定化酶活力的影响
如图3所示,随着固定化反应时间的延长,ChOx的相对酶活力呈逐渐升高的趋势,在固定化时间超过1 h时,酶活力有所降低。酶的固定量会随着固定化时间的延长而逐渐增加,酶活力也随之升高。当酶的固定时间为1 h时,酶的固定量趋于饱和,ChOx的相对酶活力达到最大值,与其他固定时间相对酶活力之间的差异是极显著的(P<0.01)。随着固定时间继续延长,过长的固定时间会导致酶的交联程度过高,增加了空间网络结构的紧密程度,阻碍了底物的扩散,促使ChOx的相对酶活力略有降低,而且固定时间的延长也会导致酶的结构发生改变,酶活力也会随之降低,这与PAN等[24]的研究结果相一致,因此选择固定时间为1 h。
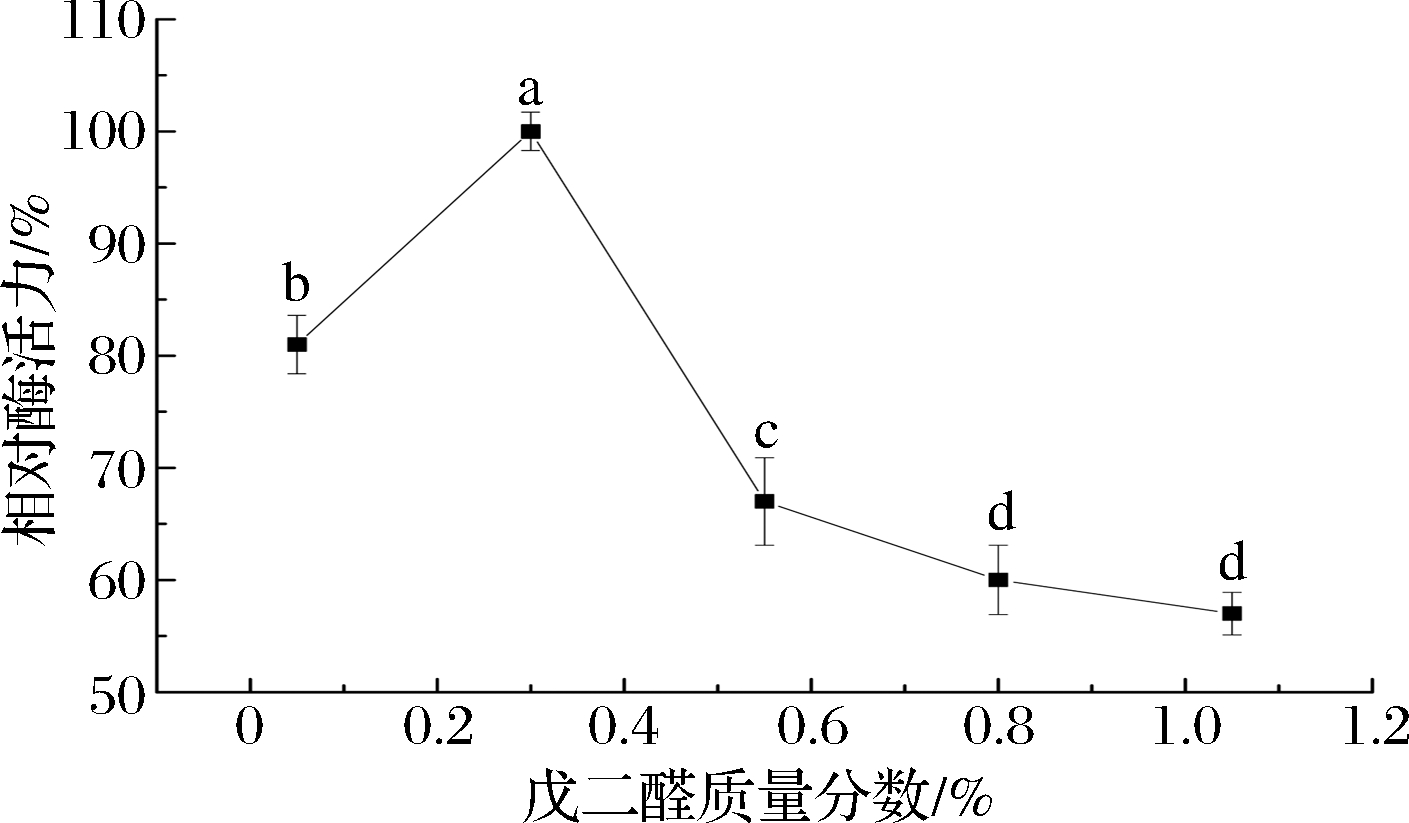
图2 戊二醛浓度对固定化酶活力的影响
Fig.2 Effect of glutaraldehyde concentration on the immobilized enzyme activity
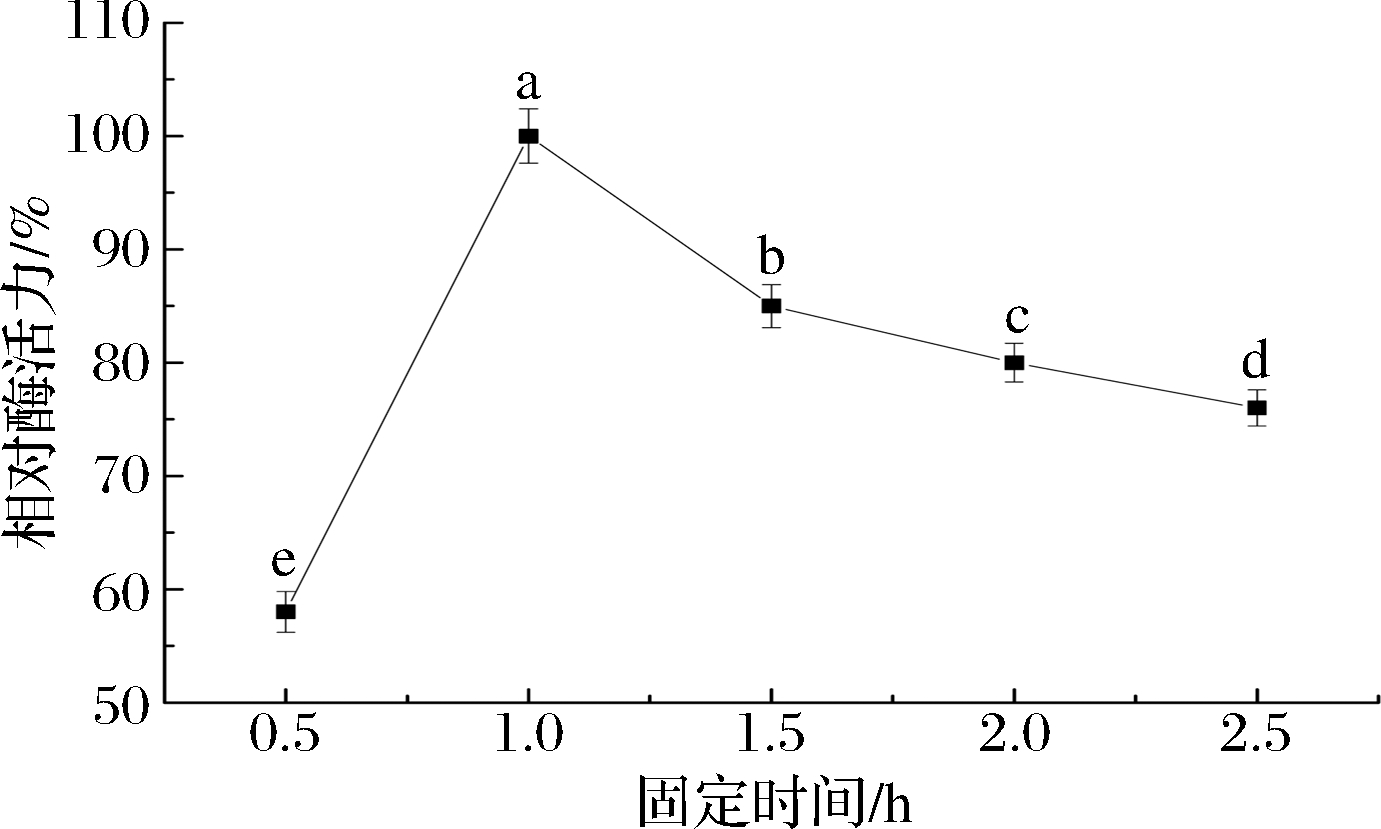
图3 固定时间对固定化酶活力的影响
Fig.3 Effect of immobilized time on the immobilized enzyme activity
2.2 电极上ChOx固定化的响应面分析
在单因素试验的基础上,以壳聚糖质量分数(A)、戊二醛质量分数(B)、固定时间(C)为自变量,以酶活力为响应值,进行响应面分析实验,实验结果见表2。
利用Design Expert 8.0.6软件设计实验方案,对实验结果进行二次回归方程的分析,可以得出,ChOx活力Y的二次回归方程,并采用方差的方法分析(表3)可知。酶活力Y的标准回归方程为:Y=16.72-0.14A+0.050B+0.013C-0.70AB+0.12AC+0.00BC-2.65A2+0.43B2-5.30C2。
模型的决定系数与调整决定系数分别为0.994 5、0.987 4,说明此模型与试验之间拟合程度较高,证明用此模型优化壳聚糖浓度、戊二醛浓度和固定时间对固定化ChOx活力的影响具有可行性。由壳聚糖浓度、戊二醛浓度、固定时间对响应值的影响可以得出,回归方程Y中的AB、A2、C2对固定化ChOx的酶活力都有极其显著的影响,B2对固定化ChOx的酶活力有显著的影响,而其他因素影响不是很明显,表明各影响因素对于固定化ChOx活力的影响不是简单的线性关系。用中心标准化处理回归方程,Y回归方程一次项回归系数的绝对值大小依次为A、B、C,因此,3个影响因素对酶活力影响顺序为:壳聚糖质量分数(A)>戊二醛质量分数(B)>固定时间(C)。
表2 响应面的实验设计与结果
Table 2 Experimental design and results of response surface methodology

试验号壳聚糖质量分数(A)/%戊二醛质量分数(B)/%固定时间(C)/h酶活力/U1-1018.8200016.7311013.7401-111.951019.1600016.471-1014.780-1111.8900016.610-10-18.71101111.6120-1-112.11300016.81400017.115-11015.71610-18.517-1-1013.9
表3 酶活力试验结果的方差分析表
Table 3 ANOVA for the experimental results of enzyme activity

变异来源平方和自由度均方F值P值显著性模型156.51917.39139.84< 0.000 1显著A0.1510.151.220.306 6B0.02010.0200.160.700 4C1.250E-00311.250E-0030.0100.923 0AB1.9611.9615.760.005 4AC0.06310.0630.500.501 3BC0.00010.0000.0001.000 0A229.51129.51237.32< 0.000 1B20.7710.776.190.041 7C2118.161118.16950.18< 0.000 1残差0.8770.12失拟误差0.6030.203.000.158 3不显著纯误差0.2740.067总和157.3816
对模型中的壳聚糖质量分数(A)、戊二醛质量分数(B)、固定时间(C)其中的1个因素让它在0水平不动时,由此可知,另外2个影响因素相互交叉作用对酶活力Y的子模型,并根据子模型,分别绘制出3个3维响应曲面图,如图4所示。

a-壳聚糖浓度和戊二醛浓度对酶活力的影响; b-壳聚糖浓度和固定时间对酶活力的影响; c-戊二醛浓度和固定时间对酶活力的影响
图4 固定化酶活力的响应面图
Fig.4 The response surface of immobilized enzyme activity
图4说明了各因素对固定化ChOx活力的影响。由图4-a、图4-c可以看出,壳聚糖浓度和固定时间之间以及戊二醛浓度和固定时间之间交互作用较强,而壳聚糖浓度和戊二醛浓度之间交互作用较弱。并且由图4-a、图4-b可以看出,与壳聚糖浓度和戊二醛浓度相比,固定时间对酶活力的影响相对较小。
通过所得到的模型,可预测ITO/SnO2 NPs/PTh光敏电极固定ChOx的最佳工艺条件为:壳聚糖质量分数1%、戊二醛质量分数0.55%、固定时间1 h。在此条件下,固定化ChOx的酶活力在理论上可达17.3 U。
2.3 验证实验
根据上述结果进行近似验证试验,检测真实值是否与试验结果相一致。在最佳工艺条件下进行3次平行试验,测得固定化ChOx活力为17.2 U,与理论值相比,相对误差在±1%以内,而且重复性好,说明优化结果是准确可靠的。
2.4 光敏电极表征
图5为ITO/SnO2 NPs/PTh光敏电极固定化ChOx前后的扫描电镜对比图。图5-a中PTh在SnO2 NPs表面呈块状均匀分布,形成1层蓝色PTh膜;图5-b中ITO/SnO2 NPs/PTh光敏电极固定化ChOx后,有层状结构的蛋白质沉积于纳米材料修饰的电极表面,表明酶已固定在PTh膜之上,因此ChOx被成功固定在光敏电极的表面。

a-ITO/SnO2 NPs/PTh;b-ITO/ SnO2 NPs/PTh/ChOx
图5 ITO/SnO2 NPs/PTh和ITO/ SnO2 NPs/PTh/ChOx 光敏电极扫描电镜图
Fig.5 SEM of ITO/SnO2 NPs和ITO/ SnO2 NPs/ChOx photosensitive electrode
2.5 固定化酶的重复利用性
固定于ITO/SnO2 NPs/PTh光敏电极的ChOx的重复利用性如图6所示,固定化的ChOx活性随着使用次数的增多而略有下降,这是由于重复的操作会使酶的包埋强度降低,致使酶有所流失,从而降低了ChOx活性。在重复利用6次后,固定化ChOx可保持最高酶活力的90%,经过10次利用以后,固定化ChOx可酶活力仍然保持在83%以上,表明ITO/SnO2 NPs/PTh光敏电极上固定ChOx具有良好的重复利用性。与共价交联法固定ChOx相比,酶活力的损失较小,重复利用多次后仍保证较高的酶活力[20]。

图6 固定化Chox的重复利用性
Fig.6 Reuse of the immobilized ChOx
2.6 固定化酶的贮存稳定性
固定于ITO/SnO2 NPs/PTh光敏电极的ChOx的贮存稳定性结果如图7所示,随着贮存时间的延长,固定化ChOx的酶活力略有降低,但总体下降幅度不大,20 d后ChOx的酶活力还能保持到86%,表明ITO/SnO2 NPs/PTh光敏电极上固定ChOx具有良好的贮存稳定性。与吸附法固定ChOx相比,反应更加温和,载体不易脱落,具有更好的重复利用性[25]。

图7 固定化Chox的贮存稳定性
Fig.7 Storage stability of the immobilized ChOx
3 结论
为了实现新型光敏电极对食品中胆碱的快速检测,根据ChOx对胆碱的特异性催化作用,探究光敏电极上ChOx的固定化方法。采用壳聚糖包埋与戊二醛交联相结合的方法固定ChOx,以ChOx固定化酶活力的显著影响因素壳聚糖浓度、戊二醛浓度、固定时间进行单因素试验以及响应面分析,确定ChOx的最佳固定化条件为壳聚糖质量分数1%,戊二醛质量分数0.55%、固定时间1 h,在此条件下固定化Chox的酶活力为17.2 U,与理论值接近;SEM证明了ChOx成功固定于ITO/ SnO2 NPs/PTh光敏电极的表面;光敏电极上固定化ChOx重复利用10次以后酶活力仍能保持83%,贮存20 d后酶活力仍能保持86%,具有良好的重复利用性和贮存稳定性,固定ChOx的光敏电极将应用于后续食品中胆碱的光电化学检测之中。
[1] ZHAO Y Y, XIONG Y P, CURTIS J M.Measurement of phospholipids by hydrophilic interaction liquid chromatography coupled to tandem mass spectrometry:The determination of choline containing compounds in foods[J].Journal of Chromatography A, 2011, 1 218(32):5 470-5 479.
[2] MICHEL V, YUAN Z F, RAMSUBIR S, et al.Choline transport for phospholipid synthesis[J].Experimental Biology & Medicine, 2006, 231(5):490-504.
[3] PATI S, PALMISANO F, QUINTO M, et al.Quantitation of major choline fractions in milk and dietary supplements using a phospholipase D bioreactor coupled to a choline amperometric biosensor[J].Journal of Agricultural & Food Chemistry, 2005, 53(18):6 974-6 979.
[4] BAI Y H, DU Y, XU J J, et al.Choline biosensors based on a bi-electrocatalytic property of MnO2 nanoparticles modified electrodes to H2O2[J].Electrochemistry Communications, 2007, 9(10):2 611-2 616.
[5] SZILAGYI P I, SCHMIDT D E, GREEN J P.Microanalytical determination of acetylcholine, other choline esters, and choline by pyrolysis-gas chromatography[J].Analytical Chemistry, 1968, 40(13):2 009-2 013.
[6] HEFNI M, MCENTYRE C, LEVER M, et al.A simple HPLC method with fluorescence detection for choline quantification in foods[J].Food Analytical Methods, 2015, 8(9):2 401-2 408.
[7] LAIKHTMAN M, ROHRER J S.Determination of choline in infant formula by ion chromatography[J].Journal of Aoac International, 1999, 82(5):1 156-1 162.
[8] ANDEIEUX P, KILINC T, PERRIN C, et al.Simultaneous determination of free carnitine and total choline by liquid chromatography/mass spectrometry in infant formula and health-care products:Single-laboratory validation[J].Journal of Aoac International, 2008, 91(4):777-785.
[9] WEI J F, REN J, LIU J, et al.An eco-friendly, simple, and sensitive fluorescence biosensor for the detection of choline and acetylcholine based on C-dots and the Fenton reaction[J].Biosensors & Bioelectronics, 2014, 52:304-309.
[10] KHAN S M, KHAN T M, WELLS R D, et al.A sensitive enzyme-based colorimetric assay for choline-containing phospholipids[J].Journal of the Science of Food and Agriculture, 1992, 58(3):443-445.
[11] WANG H, HOU W M, LIU Y Z, et al.Janus surface micelles on silica particles:Synthesis and application in enzyme immobilization[J].Macromolecular Rapid Communications, 2020, 42(4):e2000589.
[12] SASSOLAS A, BLUM L J, LECA-BOUVIER B D.Immobilization strategies to develop enzymatic biosensors[J].Biotechnology Advances, 2012, 30(3):489-511.
[13] WANG J W, WANG L P, DI J W, et al.Electrodeposition of gold nanoparticles on indium/tin oxide electrode for fabrication of a disposable hydrogen peroxide biosensor[J].Talanta, 2009, 77(4):1 454-1 459.
[14] ALONSO-LOMILLO M A, DOMíNGUEZ-RENEDO O, MATOS P, et al.Electrochemical determination of levetiracetam by screen-printed based biosensors[J].Bioelectrochemistry, 2009, 74(2):306-309.
[15] NAN C F, ZHANG Y, ZHANG G M, et al.Activation of nylon net and its application to a biosensor for determination of glucose in human serum[J].Enzyme & Microbial Technology, 2009, 44(5):249-253.
[16] ASAV E, YORGANCI E, AKYILMAZ E.An inhibition type amperometric biosensor based on tyrosinase enzyme for fluoride determination[J].Talanta, 2009, 78(2):553-556.
[17] ESSEGHAIER C, BERGAOUI Y, BEN FREDJ H, et al.Impedance spectroscopy on immobilized streptavidin horseradish peroxidase layer for biosensing[J].Sensors & Actuators B Chemical, 2008, 134(1):112-116.
[18] ZHANG Z X, NIWA O, SHIBA S, et al.Electrochemical enzyme biosensor for carnitine detection based on cathodic stripping voltammetry[J].Sensors and Actuators B Chemical, 2020, 321:128473.
[19] LIU Y, YAO L, HE L Z, et al.Electrochemical enzyme biosensor bearing biochar nanoparticle as signal enhancer for bisphenol a detection in water[J].Sensors, 2019, 19(7):1 619.
[20] RAHMAN M A, PARK D S, SHIM Y B.A performance comparison of choline biosensors:Anodic or cathodic detections of H2O2 generated by enzyme immobilized on a conducting polymer[J].Biosensors & Bioelectronics, 2004, 19(12):1 565-1 571.
[21] HEINZE B, HOVEN N, O′CONNELL T, et al.Recovery of choline oxidase activity by in vitro recombination of individual segments[J].Applied Microbiology & Biotechnology, 2008, 81(2):275-282.
[22] SASSOLAS A, BLUM L J, LECA-BOUVIER B D.Immobilization strategies to develop enzymatic biosensors[J].Biotechnology Advances, 2012, 30(3):489-511.
[23] HUANG M P, WU M, XU Q S, et al.Highly efficient synthesis of fructooligosaccharides by extracellular fructooligosaccharide-producing enzymes and immobilized cells of Aspergillus aculeatus M105 and purification and biochemical characterization of a fructosyltransferase from the fungus[J].Journal of Agricultural and Food Chemistry, 2016, 64(33):6 425-6 432.
[24] PAN C L, HU B, LI W, et al.Novel and efficient method for immobilization and stabilization of β-D-galactosidase by covalent attachment onto magnetic Fe3O4-chitosan nanoparticles[J].Journal of Molecular Catalysis B:Enzymatic, 2009, 61(3):208-215.
[25] SHI H B, YANGY, HUANG J D, et al.Amperometric choline biosensors prepared by layer-by-layer deposition of choline oxidase on the Prussian blue modified platinum electrode[J].Talanta, 2006, 70(4):852-858.