植物细胞壁中有丰富的多糖成分,包括纤维素、半纤维素和木质素。其中,半纤维素是仅次于纤维素的可再生资源,但转化率较低,是亟待开发的生物物质[1]。木聚糖酶是一类能将木聚糖降解为低聚木糖和木单糖的酶系。其中,β-D-1,4内切木聚糖酶(β-D-1,4 endoxylanase,xynA)(EC 3.2.1.8) 以内切的方式降解主链上的β-1,4糖苷键,生成低聚木糖。其次,β-D-1,4木糖苷酶 (EC 3.2.1.37)从还原端释放木糖。此外,α-L-阿拉伯糖苷酶 (EC 3.2.1.55) 和α-L-葡萄糖醛酸苷酶 (EC 3.2.1.139) 催化木聚糖中支链糖苷键的断裂,加速低聚木糖的形成[2]。在上述酶系当中,β-D-1,4内切木聚糖酶是木聚糖水解过程中的关键酶,受到的关注最多。
迄今为止,国内外相继报道了约400种不同来源的xynA基因。大部分木聚糖酶基因来源于括黑曲霉[3]、米曲霉[4]和里氏木霉[5]等真菌。不同微生物来源的木聚糖酶的热稳定性、pH稳定性等酶学性质差异较大[6]。真菌木聚糖酶的酶分子质量较小,在18~33 kDa,最适反应温度和最适反应pH分别为45~60 ℃和3.0~6.5。在酶的稳定性方面,多数真菌来源的酶在40~60 ℃较为稳定,而pH在2.5~10.0都有较好的稳定性[7-8]。为提高木聚糖酶的发酵水平,近百种不同来源的木聚糖酶基因已在大肠杆菌(Escherichia coli)中成功实现高效表达[9]。然而,木聚糖酶在E.coli中主要为胞内表达,不利于酶分离提取。
在本研究中,克隆了来源于黑曲霉(Aspergillus niger) AG11的xynA基因 (GenBank No.XM_001388485.2),并表达于E.coli BL21(DE3),构建得到能分泌xynA的重组菌。通过诱导条件优化提高xynA分泌表达水平,并研究了其酶学性质。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
A.niger AG11、E.coli JM109、BL21(DE)感受肽细胞、质粒pET28a(+)和质粒pET22b(+)均由实验室保藏。
1.1.2 试验试剂
柱回收试剂盒,Thermo公司;大肠杆菌感受态制备试剂盒、限制性内切酶、PrimerSTAR Max DNA 聚合酶,大连TaKaRa公司;氨苄青霉素、质粒提取试剂盒、真菌基因组快速提取试剂盒,上海生工公司;一步克隆试剂盒,南京诺维赞公司;酵母粉与胰蛋白胨,Oxoid 公司;底物桦木聚糖,Sigma公司(美国);蛋白质marker和BCA蛋白浓度检测试剂盒,上海翊圣公司;蛋白电泳Loading buffer与Bis-Tris预制凝胶,Invitrogen公司。其他常规试剂及药品为国产或进口分装。
1.1.3 培养基
LB培养基 (g/L):酵母提取物 5,蛋白胨 10,NaCl 5,自然pH。
PDA培养基 (g/L):土豆 200,葡萄糖 20,琼脂 15,自然pH。
1.2 试验方法
1.2.1 黑曲霉基因组的提取
将孢子悬液涂布于PDA固体培养基,30 ℃静置培养4~7 d。用无菌水缓慢刮取固体培养基表面孢子,经滤膜过滤获得高活性的孢子悬液。将接种于PDA液体培养基中,30 ℃、220 r/min条件下培养24 h。通过离心及纱布过滤收集黑曲霉菌丝体,置于灭菌的研钵中(加液氮)研磨至细小粉末,用离心管收集待用。使用真菌基因组DNA快速抽提试剂盒提取黑曲霉基因组。
1.2.2 xynA基因的克隆与表达载体的构建
以A.niger AG11基因组为模板,利用引物xynA primerF和xynA pimerR(表1)进行PCR扩增,得到xynA基因。扩增程序为:94 ℃预变性3 min;94 ℃变性10 s,55 ℃退火15 s,72 ℃ 延伸50 s,循环34次;最后72 ℃延伸5 min。将PCR扩增产物用琼脂糖凝胶电泳检测,并对产物进行纯化并测序。分别用Nco I和Xho I对PCR产物、pET-28a(+)和pET-22b(+)载体进行双酶切。PCR产物经Solution I分别连接至pET-28a(+)和pET-22b(+)载体的双酶切片段,并转化E.coli JM109。为去除内含子,以intron primeF和intro primerR(表1)对重组载体进行扩增,所得PCR产物用磷酸化酶处理后,用Solution I连接酶连接,得到xynA表达载体pET-28a(+)-xynA和pET-22b(+)-xynA。其中,pET-22b(+)载体由于在多克隆位点的上游添加了信号肽序列,可将外源蛋白从大肠杆菌中高效地引导出胞外,减少包涵体形成,常被用于胞外异源表达。同时,由于pelB信号肽融合在xynA的N端,可能对xynA的表达有影响,所以需要实验验证。
1.2.3 重组xynA的表达
将构建的pET-28a(+)-xynA和pET-22b(+)-xynA转化至E.coli BL21(DE),得到重组菌pET-28a(+)-xynA/BL21(DE)和pET-22b(+)-xynA/BL21(DE)。重组菌分别接种于含100 μg/mL氨苄青霉素的LB液体培养基中。经37 ℃,220 r/min条件下培养12 h,再转接至含100 μg/mL氨苄青霉素的TB发酵培养基中。经37 ℃,220 r/min摇瓶培养至OD600值为1.0时,用终浓度为0.1 mmol/L的异丙基-β-D-硫代吡喃半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)诱导,并于25 ℃和220 r/min下发酵24 h。
表1 本研究使用的引物
Table 1 Primers used in this study
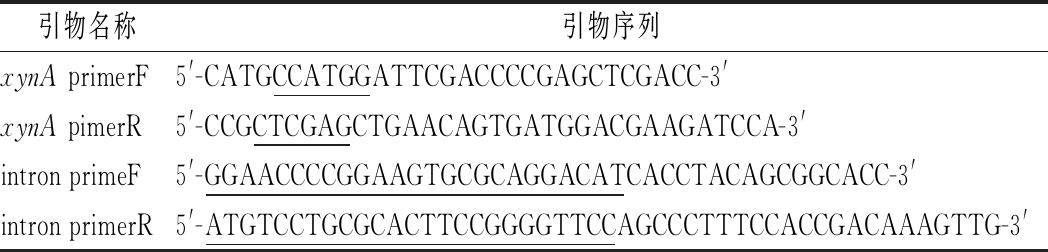
引物名称引物序列xynA primerF5'-CATGCCATGGATTCGACCCCGAGCTCGACC-3'xynA pimerR5'-CCGCTCGAGCTGAACAGTGATGGACGAAGATCCA-3'intron primeF5'-GGAACCCCGGAAGTGCGCAGGACATCACCTACAGCGGCACC-3'intron primerR5'-ATGTCCTGCGCACTTCCGGGGTTCCAGCCCTTTCCACCGACAAAGTTG-3'
注:下划线为酶切位点或一步克隆对应的同源臂序列
将重组菌发酵液离心并收集菌体,用Na2HPO4-NaH2PO4缓冲液(pH 7.5)重悬后于冰水浴中超声破碎(200 W,超声3 s,间隔4 s,50次),在4 ℃,12 000 r/min条件下离心15 min后将上清液和沉淀分别测定酶活力,并进行SDS-PAGE检测。将上清液中的目标条带切胶回收,用MALDI-TOF/MS对样品进行质谱分析[10]。同时将pET-22b-xynA/BL21(DE)发酵上清液进行SDS-PAGE和酶活力检测。
1.2.4 正交实验优化胞外表达水平
以IPTG诱导浓度、诱导温度、诱导OD600值为xynA胞外表达的因素,设计正交试验(表2)。将pET-22b(+)-xynA/BL21(DE)重组菌在不同条件下进行发酵并比较不同条件对胞外表达的木聚糖酶的影响。并通过计算各条件下的k值和极差R,确定xynA胞外表达影响最大的因素[11]。
表2 大肠杆菌分泌表达xynA的L9(33)正交试验表
Table 2 L9 (33) orthogonal table of the extracellular xynA expresion in E.coli
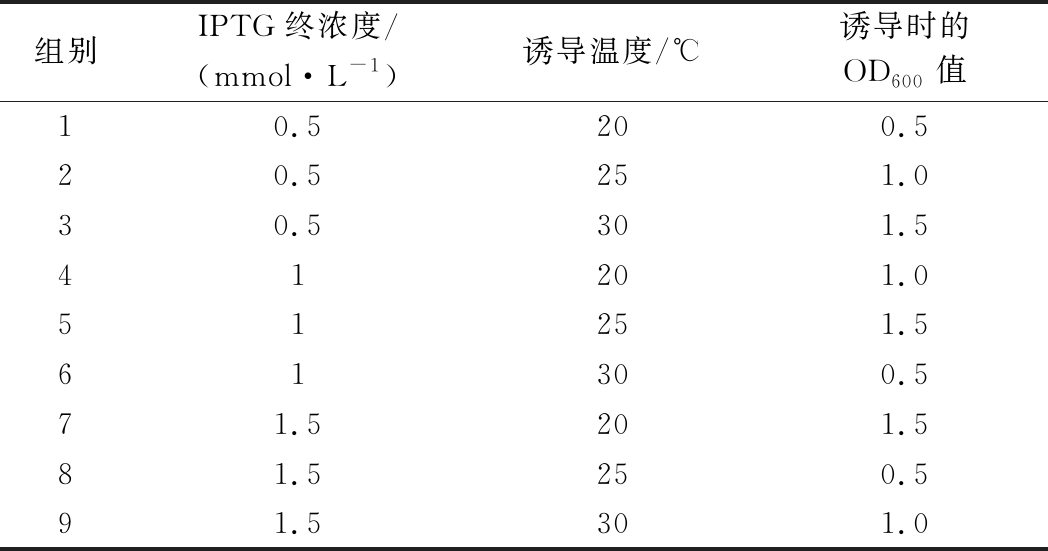
组别IPTG终浓度/(mmol·L-1)诱导温度/℃诱导时的OD600值10.5200.520.5251.030.5301.541201.051251.561300.571.5201.581.5250.591.5301.0
1.2.5 重组xynA的分离纯化
使用镍亲和层析柱对表达的xynA进行分离纯化。将重组菌发酵液在4 ℃、12 000 r/min离心5 min。取25 mL上清液于0.22 μm水系膜过滤后,上样至用缓冲液A(50 mmol/L NaH2PO4-Na2HPO4,pH 7.5)平衡的HisTrapTM FF。用8%的缓冲液B(50 mmol/L NaH2PO4-Na2HPO4,pH 7.5,500 mmol/L咪唑)冲洗纯化柱后,xynA于20% B缓冲液(100 mmol/L咪唑)洗脱。用脱盐柱Sephadex G25脱盐,置于4 ℃保存,用SDS-PAGE检测其纯度。
1.2.6 重组xynA酶学性质测定
最适反应温度:纯化后的酶液经NaH2PO4-Na2HPO4缓冲液(50 mmol/L,pH 7.5)稀释至适当浓度,分别测定在35~60 ℃的酶活力。以最高酶活力为100%,计算各温度下的相对酶活力。
温度稳定性:将上述稀释后酶液分别在40~60 ℃条件下孵育0~90 min后置于冰上保存,测定各条件下的酶活力。以孵育0 min时的酶活力为100%,计算各孵育时间下的相对酶活力。在上述温度稳定性测定的基础上拟合不同温度下的回归方程,计算各温度下木聚糖酶的半衰期[12]。
最适反应pH:分别用Na2HPO4-柠檬酸(pH 2.0~5.0)、Na2HPO4- NaH2PO4(pH 6.0~7.0)、Tris-HCl(pH 8.0)和甘氨酸-NaOH(pH 9.0)缓冲液将pH调至2.0~9.0后测定酶活力。以最高酶活力为100%,计算各pH下的相对酶活力。
用上述相同的缓冲液,将酶液pH调至2.0~9.0,在40 ℃条件下孵育1 h后,再将pH调至4.0测定酶活力。以孵育0 min时的酶活力为100%,计算各孵育条件下的相对酶活力。
1.2.7 木聚糖酶酶反应动力学参数测定
在酶的最适条件下测定质量浓度为0~25 mg/mL的桦木木聚糖的初始酶活力。基于上述酶反应数据,作Lineweaver-Burk双倒数图,计算重组木聚糖酶的Km和kcat[13]。
1.2.8 木聚糖酶酶活力和蛋白含量的测定
采用3, 5-二硝基水杨酸法测定木聚糖酶酶活力[14]。将500 μL稀释至适当浓度的酶液与500 μL桦木木聚糖底物(pH 4.0,10 mg/mL)混合,在50 ℃条件下反应10 min后用3, 5-二硝基水杨酸试剂终止反应。反应的样品于沸水内显色5 min后立即用水冷却,并在545 nm条件下测定吸光度。酶活力单位(U/mL)定义为1 min水解木聚糖所产生的1 μmol还原糖所需的酶量。蛋白浓度的测定采用了BCA法,以牛血清蛋白为标准品。
2 结果与分析
2.1 xynA基因的克隆与载体的构建
以A.niger AG11基因组为模板,通过PCR扩增xynA基因。电泳分析显示,PCR产物大小约为750 bp,与理论值相似(图1-a)。将PCR产物分别克隆至pET-28a(+)和pET-22b(+)-xynA的Nco I-Xho I位点,得到编码xynA的质粒pET-28a(+)-xynA′和pET-22b(+)-xynA′。基于一步克隆法删除pET-28a(+)-xynA′和pET-22b(+)-xynA′中xynA的内含子序列,进一步构建得到xynA表达质粒pET-28a(+)-xynA和pET-22b(+)-xynA(图1-b)。其中,pET-22b(+)-xynA编码了pelB信号肽,将促进融合在其下游xynA的分泌表达。上述表达质粒序列均经测序验证。
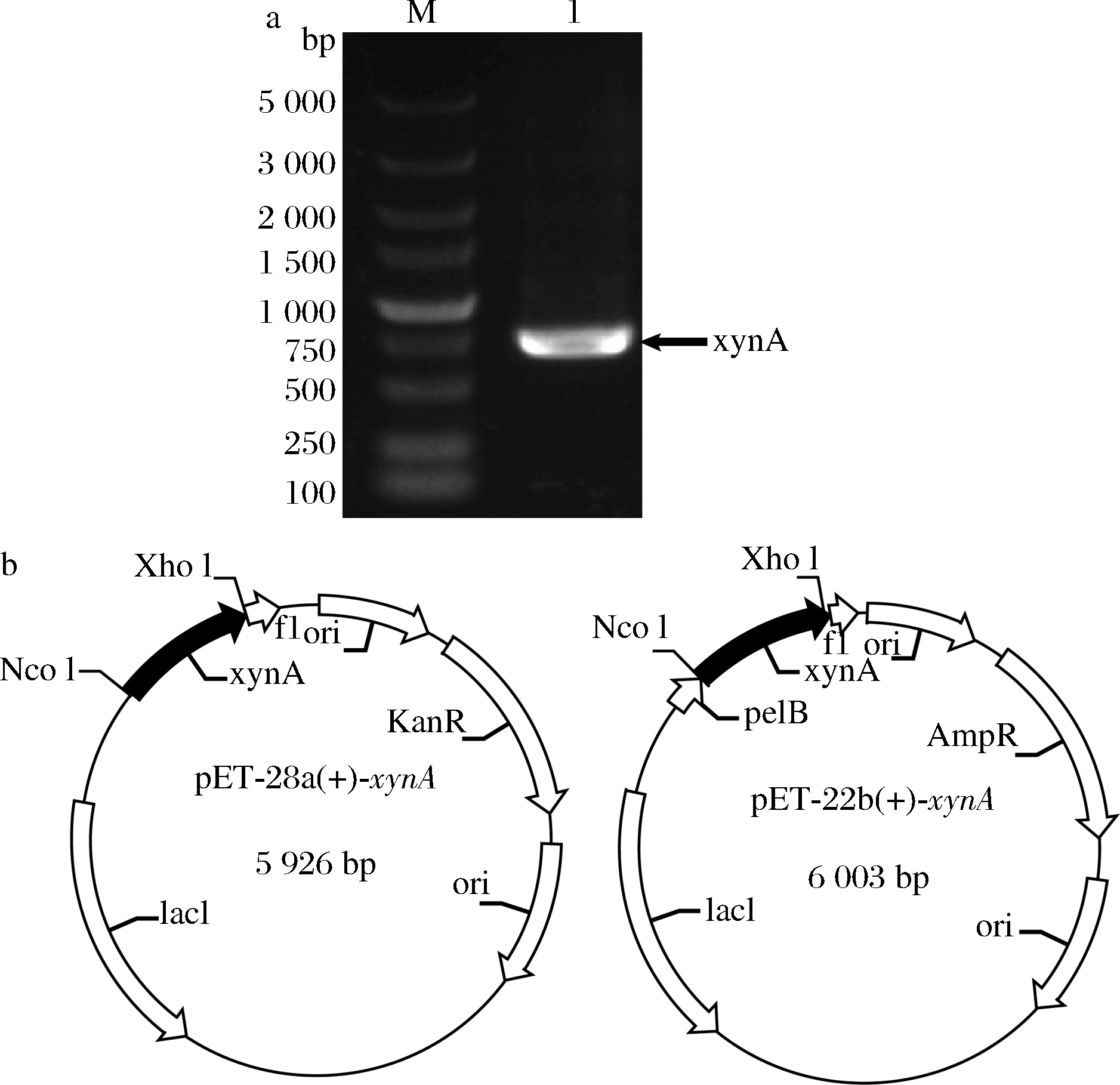
M-DNA marker; 1-xynA
a-xynA基因的扩增产物核酸胶图;b-pET-28a(+)-xynA和pET-22b(+)-xynA载体图谱
图1 xynA基因的克隆与载体构建
Fig.1 Cloning of xynA gene and vectors construction
2.2 重组xynA的表达
将pET-28a(+)-xynA载体转入E.coli BL21(DE)中,转接后OD600值达到1.0时添加IPTG,使终浓度为0.1 mmol/L,25 ℃发酵24 h并收集菌体。经超声破碎,在沉淀和上清液中都有20 kDa左右的条带(图2-a),但空白对照中不存在该条带,初步判断E.coli BL21(DE)成功表达xynA,同时存在部分包涵体。用MALDI-TOF/MS对该条带进行质谱分析,确定为A.niger CBS 513.88来源的木聚糖酶(图3)。对胞内上清液和沉淀分别测定酶活力,上清液中xynA活力为10.4 U/mL(图2-c),而沉淀中的包涵体不具有活性。
为实现胞外表达,将pET-22b(+)-xynA转入E.coli BL21(DE)并进行摇瓶发酵。分别对胞外上清液、胞内上清液和沉淀进行酶活力测定和SDS-PAGE检测(图2-b)。结果显示在胞外上清液中存在xynA条带,而胞内上清液和沉淀中也存在对应条带。其中,pelB作为大肠杆菌中高效的信号肽,被融合到xynA的N端,可将外源蛋白引导至周质空间并转移到胞外,提高xynA的可溶性。在胞外上清液中可测得xynA活力为8.5 U/mL(图2-c)。与空白对照组比较,在SDS-PAGE图中可基本确定目的条带(图2-b),而在不添加pelB信号肽的重组菌胞外上清液中未测得酶活力。以上结果说明,在添加信号肽后胞内部分xynA成功分泌至胞外。同时,在胞内上清液中也检测到xynA活力为0.8 U/mL(图2-c),并在SDS-PAGE图上显示对应条带(图2-b),表明胞内依然存在部分包涵体,需进一步优化诱导条件。
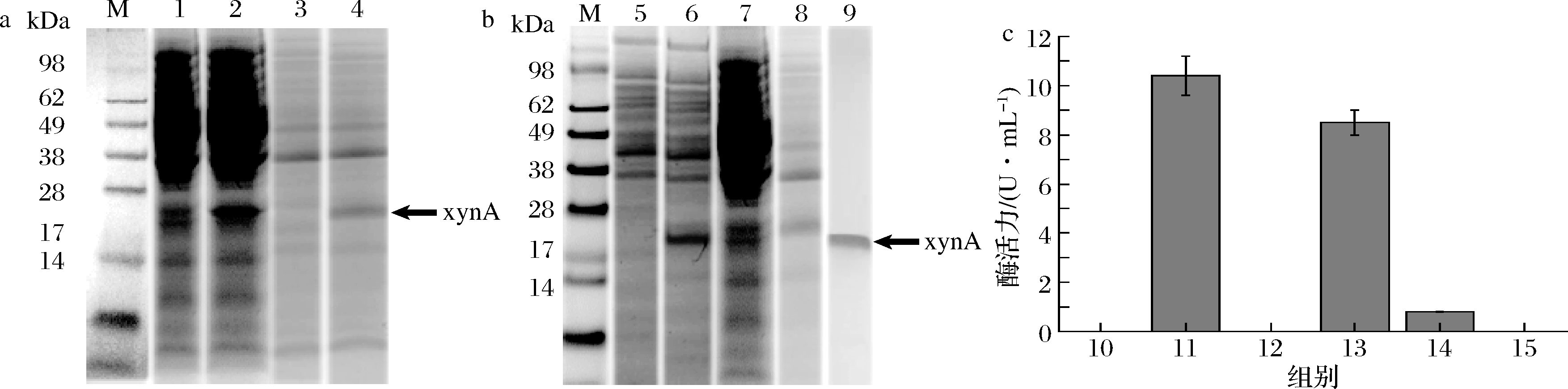
M-蛋白质marker;1-pET-28a(+)胞内上清液空白对照;2-pET-28a(+)-xynA胞内上清液;3-pET-28a(+)胞内胞内沉淀空白对照;
4-pET-28a(+)-xynA胞内沉淀;5-pET-22b(+)胞内上清液空白对照;6-pET-22b(+)-xynA胞外上清液;
7-pET-22b(+)-xynA胞内上清液;8-pET-22b(+)-xynA胞内沉淀;9-纯化后的xynA条带;10-pET-28a(+)/BL21(DE)空白对照;
11-pET-28a(+)-xynA/BL21(DE)胞内上清液酶活力;12-pET-28a(+)-xynA/BL21(DE)胞内沉淀酶活力;13-pET-22b(+)-xynA/BL21(DE)
胞外上清液酶活力;14- pET-22b(+)-xynA/BL21(DE)胞内上清液酶活力;15-pET-22b(+)-xynA/BL21(DE)胞内沉淀酶活力
a-pET-28a(+)-xynA在E.coli BL21(DE)中表达的SDS-PAGE图;b-pET-22b(+)-xynA在E.coli BL21(DE)中表达的SDS-PAGE图;
c-pET-28a(+)-xynA和pET-22b(+)-xynA在E.coli BL21(DE)中表达的酶活力柱状图
图2 重组xynA的表达情况分析
Fig.2 Expression analysis of recombinant xynA
图3 重组xynA的MALDI-TOF/MS检测结果
Fig.3 MALDI-TOF/MS result of recombinant xynA
2.3 重组xynA的分泌表达优化
分别取各组24 h和36 h时的发酵液,对比胞外上清液中的xynA活力。在IPTG诱导浓度为0.1 mmol/L、诱导温度为20 ℃、诱导OD600值为0.5,发酵至24 h时的酶活力为10.2 U/mL,比未经优化的条件下,发酵至24 h时的酶活力提高20%。在发酵36 h时胞外有15.8 U/mL的最高酶活力,比初始条件下提高85.9%(图4-a)。对该组收集的细胞进行超声破碎并进行SDS-PAGE检测,显示胞内沉淀中的包涵体量有较明显的减少(图4-b)。
对36 h时各组胞外酶活力的数据进行处理,分别计算各因素下的k值和极差R,结果如表3所示。IPTG浓度和诱导温度的极差R高于诱导OD600值的极差,表明前2个因素对xynA胞外表达水平的影响更大。IPTG终浓度为0.1 mmol/L,诱导温度为20 ℃时可减少包涵体的形成。但发酵36 h的胞外酶活力比24 h的酶活力高55%,说明20 ℃低温诱导xynA需要更长的时间表达。而30 ℃发酵36 h的胞外酶活力低于24 h,较高温度下诱导可以加速xynA的分泌表达,但发酵时间过长致使xynA部分失活。适当地降低诱导温度,延长发酵时间可以提高xynA的可溶性表达水平。
表3 36 h发酵时间下不同因素的k值和极差R
Table 3 The k value and the range R of different factors under 36 h fermentation time
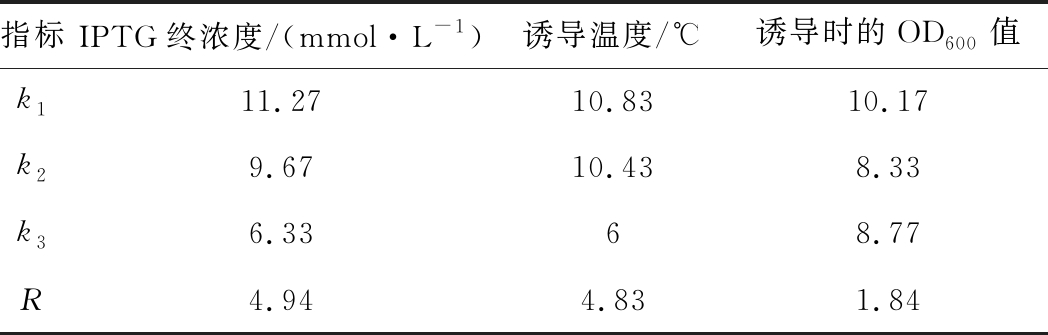
指标IPTG终浓度/(mmol·L-1)诱导温度/℃诱导时的OD600值k111.2710.8310.17k29.6710.438.33k36.3368.77R4.944.831.84
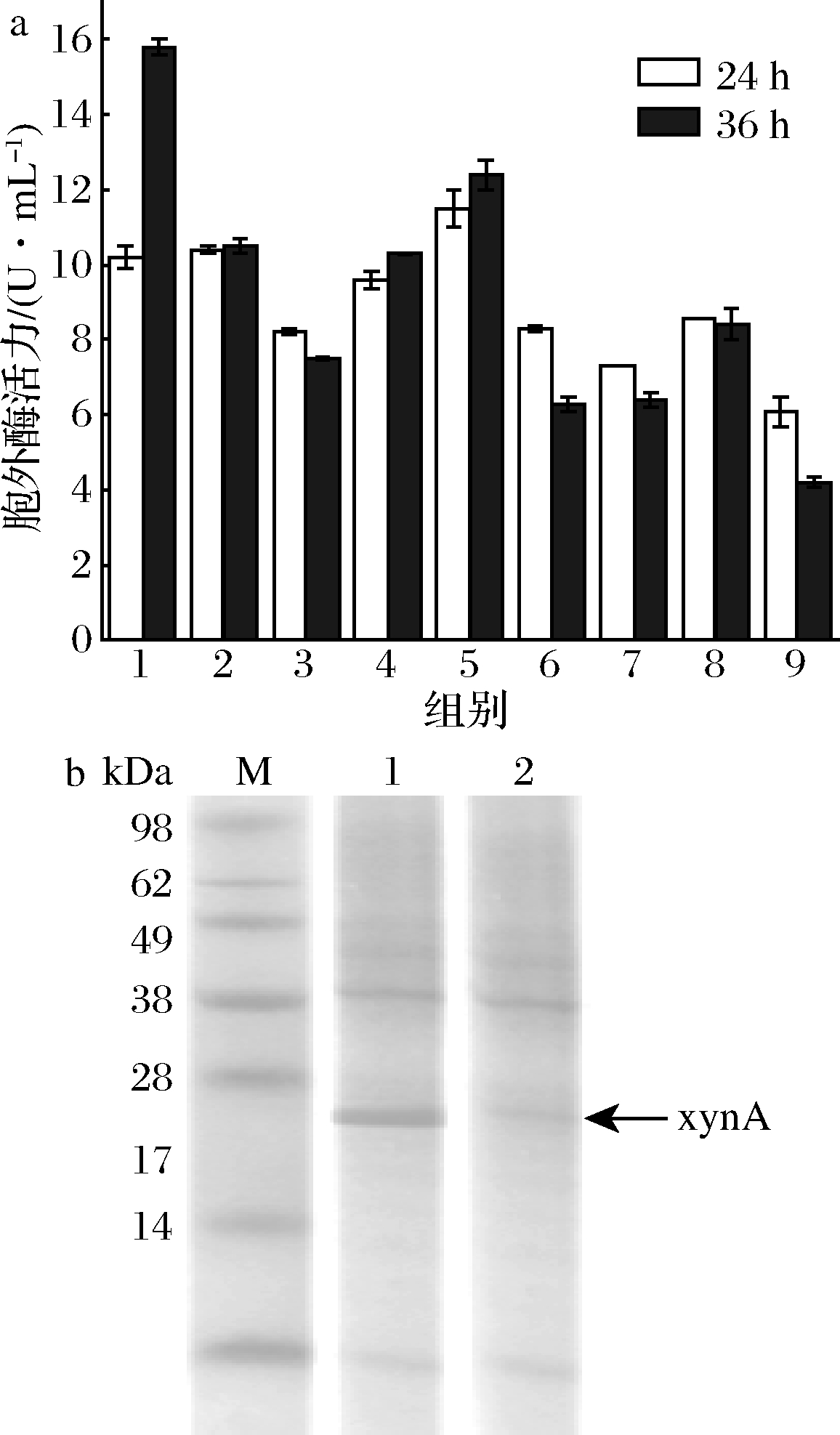
M-蛋白质marker;1-初始条件下的胞内沉淀;
2-最佳优化条件下的胞内沉淀
a-正交试验各组条件下胞外xynA活力柱状图;b-初始条件与最佳条件下胞外沉淀的SDS-PAGE图
图4 重组xynA胞外表达条件优化
Fig.4 Optimizing extracellular expression of recombinant xynA
2.4 重组xynA的酶学性质
2.4.1 重组xynA的纯化和动力学参数测定
对发酵液进行离心并用0.22 μm的滤膜过滤,用20%的500 mmol/L B液洗脱xynA,获得单一的目的蛋白条带。蛋白条带与理论值相符,且无杂带(图2-b)。脱盐后分别测定蛋白浓度和酶活力,计算得重组xynA的比酶活为175.1 U/mg。当以桦木木聚糖为底物时,测定重组xynA的动力学参数如表4所示。
表4 以桦木木聚糖为底物时的重组xynA动力学参数
Table 4 Kinetic parameters of xynA with betula xylan as substrate

木聚糖酶Km/(g·L-1)kcat/(s-1)kcat/Km/[L·(g·s)-1]比酶活力/(U·mg-1)xynA3.4558.5116.96175.1
2.4.2 重组xynA的最适反应温度和温度稳定性测定
如图5所示,在25~60 ℃,重组xynA的酶活力呈现先上升后下降的趋势,50 ℃时测得最高酶活力。在25~50 ℃酶活力缓慢上升,25 ℃反应条件下有60%以上的相对酶活,说明在该温度范围内xynA较稳定。但当反应温度超过50 ℃,xynA的相对酶活显著下降,55 ℃时相对酶活力下降了40%,反应温度为60 ℃时,相对酶活力降至50%以下 (图5-a)。以上结果说明50 ℃ 为xynA的最适反应温度,但当反应温度超过50 ℃,相对酶活显著下降,xynA在该反应温度下表现出较差的酶活力。

a-重组xynA最佳反应温度曲线;b-重组xynA温度稳定性曲线;c-重组xynA不同温度下的半衰期柱状图;d-重组xynA最佳反应pH和pH稳定性曲线
图5 温度和pH对重组xynA活性的影响
Fig.5 The influence of temperature and pH on the activity of recombinant xynA
孵育温度为40 ℃时xynA呈现较好的稳定性,相对酶活力保持在97%以上,孵育时间为90 min时未表现出下降趋势。但当温度上升至55 ℃,孵育5 min时残留酶活力仅为8%,10 min时xynA全部失活,而60 ℃ 孵育5 min时已检测不到xynA的酶活力(图5-b)。经计算得xynA在40 ℃的半衰期为182 min。而45、50、55 ℃的半衰期分别仅为40 ℃时的33.3%、10%和2.6% (图5-c)。表明xynA在40 ℃时具有最佳的热稳定性,而高于40 ℃热稳定性显著下降。
2.4.3 重组xynA的最适反应pH和pH稳定性测定
当反应体系的pH为4.0时测得xynA的最高酶活力,在pH为2.0~5.0相对酶活力都高于70%,说明在该反应条件下xynA具有较高的活力。而当pH高于6.0,酶的活力有较大程度的下降,pH为9.0时,相对酶活力仅为10%(图5-d)。由此可知,重组xynA的最佳反应pH为4.0,在酸性反应条件下具有较好的酶活力,而在碱性条件下酶的活力显著降低。
为了测定xynA在不同pH条件下的耐受性,设定孵育pH为2.0~9.0。在pH为4.0时有最佳的相对酶活力,说明在该条件下xynA最为稳定。而在其他pH条件下,相对酶活力保持在70%以上(图5-d)。重组xynA具有较大范围的pH稳定性,在酸碱条件下保存较长时间依然具有较高的酶活力。
3 结论与讨论
木聚糖酶能够催化植物细胞中的半纤维素生成能够利用的低聚木糖,在生产生活中有较多应用,包括食品、医药、饲料和生物能源等方面[15-16]。其中,不同来源的木聚糖酶在大肠杆菌中异源表达的报道最多[17]。虽然大肠杆菌繁殖速度快,操作方便,是比较理想的宿主细胞,但是由于蛋白质常存在于细胞内无法分泌至胞外,只能通过破壁的方法将目的蛋白释放出来,从而增加酶的损失[18]。本研究成功构建了重组xynA在大肠杆菌中的分泌表达系统,通过正交试验减少包涵体的形成,提高了胞外表达水平。从而降低工业生产中的成本,提高生产效率。同时对xynA 的酶学性质进行测定,最适反应温度和pH分别为50 ℃和4.0,在pH为2.0~9.0都有较好的稳定性,在饲料、生物乙醇等酸性制作过程中都有较高的使用潜力[19]。但由于在高温下较差的稳定性限制了其广泛应用。
为了满足实际生产时对热稳定性的要求,需要通过蛋白质工程对酶进行改造。本文构建的木聚糖酶表达菌株成功将xynA分泌至胞外,可通过定向进化或者理性改造技术提高该酶的热稳定性[20]。同时,利用易错PCR、饱和突变等扩大突变文库,并结合高通量筛选技术,大大方便正向突变株的筛选,为后续重组xynA的分子改造提供重要数据基础[21]。
[1] LONG L F, ZHANG Y B, REN H Y, et al.Recombinant expression of Aspergillus niger GH10 endo-xylanase in Pichia pastoris by constructing a double-plasmid co-expression system[J].Journal of Chemical Technology and Biotechnology, 2020, 95(3):535-543.
[2] NIDERHAUS C, GARRIDO M, INSANI M, et al.Heterologous production and characterization of a thermostable GH10 family endo-xylanase from Pycnoporus sanguineus BAFC 2126[J].Process Biochemistry, 2018, 67:92-98.
[3] DE LIMA DAMASIO A R, SILVA T M, ALMEIDA F B D R, et al.Heterologous expression of an Aspergillus niveus xylanase GH11 in Aspergillus nidulans and its characterization and application[J].Process Biochemistry, 2011, 46(6):1 236-1 242.
[4] SILANO V, BARAT BAVIERA J M, BOLOGNESI C, et al.Safety evaluation of the food enzyme endo-1,4-beta-xylanase from a genetically modified Aspergillus oryzae (strain NZYM-FA)[J].EFSA Journal, 2018, 16(11):1-16.
[5] LIU M, YU H W.Cocktail production of an endo-beta-xylanase and a beta-glucosidase from Trichoderma reesei QM 9414 in Escherichia coli[J].Biochemical Engineering Journal, 2012, 68:1-6.
[6] CHAKDAR H, KUMAR M, PANDIYAN K, et al.Bacterial xylanases:Biology to biotechnology[J].3 Biotech, 2016, 6(2):150.
[7] 李吉萍, 包昌杰, 陈光, 等.木聚糖酶异源表达的研究进展[J].中国生物工程杂志, 2019, 39(7):91-99.
LI J P, BAO C J, CHEN G, et al.Research advances in heterologous expression of xylanase[J].China Biotechnology, 2019, 39(7):91-99.
[8] ALOKIKA, SINGH B.Production, characteristics, and biotechnological applications of microbial xylanases[J].Applied Microbiology and Biotechnology, 2019, 103(21-22):8 763-8 784.
[9] AHMED S, RIAZ S, JAMIL A.Molecular cloning of fungal xylanases:An overview[J].Applied Microbiology and Biotechnology, 2009, 84(1):19-35.
[10] 吴占东, 韩文杰, 周同, 等.通过理性改造提高11家族木聚糖酶热稳定性研究进展[J].微生物学杂志, 2017, 37(5):103-107.
WU Z D, HAN W J, ZHOU T.et al.Advances in improving xylanase family 11 thermostability by rational reconstruction[J].Journal of Microbiology, 2017, 37(5):103-107.
[11] 林丹敏, 宋彩燕, 余林金, 等.应用正交实验法优化大肠杆菌表达CTB-PSMA624-632蛋白的条件[J].基因组学与应用生物学, 2019, 38(2):636-643.
LIN D M, SONG C Y, YU L J, et al.Conditions for optimizing expression of CTB-PSMA624-632 protein in E.coli by orthogonal experiment[J].Genomics and Applied Biology, 2019, 38(2):636-643.
[12] ZHANG S, ZHANG K, CHEN X Z, et al.Five mutations in N-terminus confer thermostability on mesophilic xylanase[J].Biochemical and Biophysical Research Communications, 2010, 395(2):200-206.
[13] SHIVUDU G, CHANDRARAJ K, SELVAM P.Production of xylooligosaccharides from xylan catalyzed by endo-1,4-β-D-xylanase-immobilized nanoscale carbon, silica and zirconia matrices[J].Molecular Catalysis, 2020, 484(6):110745.
[14] 武玉波, 冯秀燕.木聚糖酶酶活测定方法的研究[J].中国饲料, 2008(4):34-36.
WU Y B, FENG X Y.Determination of xylanase activity[J].China Feed, 2008(4):34-36.
[15] LIU T Y, ZHANG J G.High-level expression and characterization of Aspergillus niger ATCC 1015 xylanase B in Komagataella phaffii[J].Applied Biological Chemistry, 2018, 61 (4):373-381.
[16] ZHANG M, CAI G Y, ZHENG E Q, et al.Transgenic pigs expressing β-xylanase in the parotid gland improve nutrient utilization[J].Transgenic Research, 2019, 28 (2):189-198.
[17] 王丹丹, 周晨妍, 付冠华.木聚糖酶基因克隆和表达的研究进展[J].中国生物制品学杂志, 2013, 26 (8):1 193-1 196.
WANG D D, ZHOU C Y, FU G H.Progress in research on cloning and expression of xylanase gene[J].Chinese Journal of Biologicals, 2013, 26 (8):1 193-1 196.
[18] 周晨妍, 刘振华, 王丹丹, 等.木聚糖酶Xyn43A基因在大肠杆菌及毕赤酵母中的表达比较[J].食品与发酵工业, 2016, 42(6):15-19.
ZHOU C Y, LIU Z H, WANG D D, et al.Expression of xylanase Xyn43A gene in Escherichia coli and Pichia pastoris[J].Food And Fermentation Industries, 2016, 42 (6):15-19.
[19] RABELLO G C, PIROTA R D P B, BARROS G O F, et al.Simultaneous biosynthesis of biomass-degrading enzymes using co-cultivation of Aspergillus niger and Trichoderma reesei[J].Biocatalysis and Biotransformation, 2014, 32 (4):236-243.
[20] HAN H W, LING Z M, KHAN A, et al.Improvements of thermophilic enzymes:From genetic modifications to applications[J].Bioresource Technology, 2019, 279:350-361.
[21] XU X, LIU M Q, HUO W K, et al.Obtaining a mutant of Bacillus amyloliquefaciens xylanase A with improved catalytic activity by directed evolution[J].Enzyme and Microbial Technology, 2016, 86:59-66.