川味香肠是中国西南地区知名的传统发酵肉制品,因自然发酵风味浓郁、特点突出而深受消费者喜爱,消费市场和消费潜力巨大[1]。川味香肠高度依赖自然发酵,在生产过程中极易被微生物污染、易受季节及气候等因素影响,使得成品中的生物胺种类多、含量高。生物胺是由氨基酸脱羧酶将肉中游离氨基酸脱羧形成的一类含氮小分子化合物[2]。生物胺是人体生理代谢所需物质,但当机体内的生物胺积累到一定量时就会发生中毒反应,甚至危及生命[3]。
目前,降低肉制品中生物胺含量的研究主要集中在将具有生物胺氧化酶活性的微生物作为发酵剂接种到肉制品中,生物胺氧化酶能将已存在的生物胺分解为相应的醛、氨气和过氧化氢[4]。根据底物氨基个数通常可以将生物胺氧化酶分为单胺氧化酶、二胺氧化酶和多胺氧化酶。单胺氧化酶主要作用于酪胺、苯乙胺[5];二胺氧化酶通常作用于组胺、尸胺和腐胺[6];多胺氧化酶主要作用于精胺和亚精胺及腐胺[7]。翟钰佳[8]筛选到1株具有较强胺氧化酶活性的植物乳杆菌,将其作为发酵剂添加到羊肉发酵香肠中,发现香肠中生物胺含量显著降低。然而该种方法可能造成轻发酵食品发酵过度的情况[9]。黄瑶等[10]通过破碎黑曲霉细胞得到胺氧化酶的粗酶液,添加到自制酱油和市售酱油中,使市售酱油和自制酱油中总生物胺分别降低了69.5%和78.29%。NAILA等[11]在金枪鱼鱼汤中添加二胺氧化酶,发现组胺含量显著降低,在10 h时几乎降为0。
利用生物胺氧化酶控制生物胺的技术目前主要应用于酱油和水产品中,在肉制品中的应用尚未见报道,并且在复杂的食品基质中添加生物胺氧化酶是否会对食品品质造成影响还有待探究。本研究基于生物胺氧化酶不具有底物特异性的特点[12],将二胺氧化酶预添加到川味香肠中,探究该酶在川味香肠发酵、成熟过程中对感官品质以及对生物胺含量的影响,为实际生产中通过外源添加生物胺氧化酶的方式来控制发酵肉制品中生物胺的含量提供依据和理论参考。
1 材料与方法
1.1 材料与试剂
新鲜猪肉、肠衣、食盐、花椒、白酒等调料,四川雅安市雨城区苍坪山农贸市场;二胺氧化酶(提取自猪肝脏),美国Sigma Aldrich公司;MRS培养基等培养基,青岛日水生物技术有限公司;组胺、酪胺、腐胺、尸胺标准品、丹磺酰氯等,美国Sigma公司。
1.2 仪器与设备
PHS-3C pH计,杭州奥立龙仪器有限公司;LC-2010CHT高效液相色谱仪,美国Thermo Fisher Scientific 公司;BMS602均质机,德国BRT公司;(ANGGUANG)SC-8全自动色差计,北京康光仪器有限公司。
1.3 实验方法
1.3.1 川味香肠的制作与样品采集
参照张雪梅[13]的配方,孙霞[14]的工艺流程、参数制作香肠。具体参数如下:
(1)配方:猪肉[m(肥肉)∶m(瘦肉)=3∶7],食盐2.8%,白砂糖1%,白酒1.5%,辣椒粉1%,花椒粉0.5%,胡椒粉0.05%,五香粉0.1%,硝酸盐0.015%,亚硝酸盐0.007 5%(均为质量分数),50 mg/kg二胺氧化酶。
(2)工艺流程:原料肉→预处理→添加配料→加酶→搅拌→灌肠→发酵→成熟→包装→成品。
(3)工艺参数:发酵温度20 ℃,相对湿度85%,时间2 d;成熟温度13 ℃,成熟相对湿度75%,成熟时间28 d。
实验取样:取香肠加工过程中的7个工艺点,即0 d(原料肉)、2 d(发酵结束)、5 d(成熟第3天)、9 d(成熟第7天)、16 d(成熟第14天)、23 d(成熟第21天)、30 d(成熟结束)进行采样。
1.3.2 感官品质
1.3.2.1 感官评价
选择具有一定感官评定经验的10位品评员,从外观、组织形态、风味3个方面进行评价,具体感官评价标准如表1所示。
表1 感官评价标准
Table 1 The table for sensory evaluation standard

指标标准肠衣干燥完整且紧贴肉馅,紧实富有弹性(11~12分)表面(12分)肠衣干燥完整,部分肠衣剥离,部分肉馅易分离(9~10分)外观(满分20分)肠衣稍有湿润且柔软,肉馅易分离,有霉点,抹后无痕迹(7~8分)肠衣易分离,易撕裂,表面有霉点,抹后有痕迹(7以下分)切面肌肉玫红色,脂肪白色(7~8分)切面(8分)切面肌肉灰暗色,脂肪发黄(5~6分)部分肉馅深部呈咖啡色,脂肪发黄(5以下分)弹性好(8~10分)弹性(10分)弹性较好(5~7分)弹性差(5分以下)组织状态切面齐,整齐无裂隙(18~20分)(满分30分)切面(20分)切面齐,切面有明显裂隙(15~17分)切面齐,切面有明显裂隙(12~14分)切面不齐,有明显裂隙,中心有软化现象(12分以下)柔和的芳香味,有特殊香(18~20分)气味(20分)气味较正常,芳香不足(15~17分)略有异味(12~14分)风味(满分50分)异味浓(12分以下)酸味适中,麻辣爽口(28~30分)滋味(30分)有酸味,麻辣可接受(25~27分)过酸或麻辣不可接受(22~24分)特酸,麻辣强烈不可接受或者无麻辣感(22分以下)
1.3.2.2 香气和滋味的电子鼻、电子舌检测
电子鼻参照周兰[15]的方法;电子舌参照张楠[16]的方法。
1.3.2.3 颜色检测
每组准备14个重复样品,将样品切割成1 cm3,测定样品的L值,a*值、b*值。
1.3.2.4 质构检测
参照张楠[16]的方法。
1.3.3 生物胺检测
1.3.3.1 取样
参照张楠[16]的方法。
1.3.3.2 柱前衍生
参考HUANG等[17]的方法,对样品中组胺、酪胺、尸胺、腐胺进行柱前衍生。
1.3.3.3 色谱条件
参考HUANG等[17]的方法略作修改。色谱柱为C18(4.6 mm×250 mm,5 μm),流速为0.8 mL/min,紫外检测器波长为254 nm,进样量10 μL,柱温30 ℃,流动相A为超纯水,流动相B为色谱级乙腈,采用梯度洗脱程序进行分离:0 min,35%A+65%B;5 min,30%A+70%B;20 min,0%A+100%B;25 min 35%A+65%B,持续至30 min结束。
1.3.4 数据处理
实验数据测量3次,所有数据均以平均值±标准差表示,数据分析采用软件SPSS 27.0,作图采用软件Origin 2020进行。
2 结果与分析
2.1 感官品质测定结果
2.1.1 感官分析结果
以外源添加50 mg/kg二胺氧化酶的川味香肠为实验组,相同条件下未添加二胺氧化酶的为对照组,感官评价结果如表2所示。2组香肠在外观、组织形态、风味及总分方面无显著差异。表明添加二胺氧化酶对川味香肠的感官品质并无影响,这可能是因为2组香肠采用了同样的原料及加工工艺。
表2 感官评分表 单位:分
Table 2 Results of sensory evaluation

指标加酶组对照组外观 18.2±3.4a18.0±3.0a组织状态21.6±2.8a21.8±2.4a风味 46.4±4.2a45.8±4.8a总分 86.2±14.7a85.6±14.4a
注:相同小写字母表示差异不显著
2.1.2 香气和滋味的电子鼻及电子舌分析结果
电子鼻的反应过程是模拟人体嗅觉形成的过程,而后通过主成分分析将信息进行降维处理。主成分分析贡献率越大,越能反应更多的指标[18]。从图1-a可以看出,第1主成分(PC1)与第2主成分(PC2)贡献率之和为99.988 9%,大于90%,说明这2种主成分能较好的反应原始数据的全部信息。2组香肠在主成分分析图上有部分重合,加酶组的覆盖面积相对较大,说明二胺氧化酶能够在一定程度上增加川味香肠的风味。但2组香肠在电子鼻雷达图中形成的图形形状差异不大(图1-c),可能是因为使用相同的配方和加工工艺。与其他4根传感器相比,2组样品主要在P30/1及T30/1传感器上有较明显的响应,其中传感器P30/1响应最为显著,说明其中挥发性风味物质主要是有机化合物、极性化合物等[19]。
电子舌是模拟人体味觉系统,并能识别出5种基本味道——酸、甜、苦、咸、鲜,可以客观体现食品滋味[20]。由图1-b可以看出,PC1与PC2之和为99.796 1%,2组川味香肠滋味较为类似,加酶组所占面积比对照组稍大,说明滋味更加丰富。由电子舌雷达图1-d可以看出,2组川味香肠在各个传感器的响应值差距不大,反映出添加二胺氧化酶对香肠的滋味无显著性影响,呈味物质的组成和含量较为类似,这与感官结果相似。JE、JB、HA、CA、BB探头响应都较高,说明样品在酸味、鲜味、咸味方面较为突出,而在苦味上不显著[21]。

a-电子鼻主成分分析图;b-电子舌主成分分析图;c-电子鼻雷达图;d-电子舌雷达图
图1 不同组川味香肠滋味及香气电子鼻及电子舌分析
Fig.1 Analysis of the taste and aroma of different groups of Sichuan sausages by electronic nose and electronic tongue
2.1.3 质构检测结果
质构会直接影响产品的感官,受水分含量、离子强度等多因素影响[16]。由表3可知,加酶组在硬度、弹性、黏结性、黏性、咀嚼性及回复性方面与对照组相比均没有显著性差异,这说明加酶不会对川味香肠质构产生显著影响。
2.1.4 色差测定结果
2组香肠的色差检测结果如表4所示。与对照组相比,香肠成熟结束时加酶组的色差仅在a*值上有显著性差异。加酶组a*值随着发酵和成熟的进行,呈现先下降后上升,最后降低的趋势。可能是因为发酵过程中原料肉被空气中的氧气氧化,颜色变深,随后亚硝酸盐、硝酸盐被原料肉中微生物利用,进行了发色作用,颜色部分恢复,但随着产品中水分含量降低,色素浓缩,颜色再次加深,a*值随之下降,与![]() 等[22]研究结果一致。随着香肠的成熟,加酶组的L值在发酵和成熟前期相较于原料肉无显著变化(P>0.05),仅在成熟末期有显著性上升(P<0.05),b*值变化趋势几乎一致且无显著性差异。
等[22]研究结果一致。随着香肠的成熟,加酶组的L值在发酵和成熟前期相较于原料肉无显著变化(P>0.05),仅在成熟末期有显著性上升(P<0.05),b*值变化趋势几乎一致且无显著性差异。
表3 两组川味香肠质构特性
Table 3 Textural characteristics of two groups of Sichuan sausage
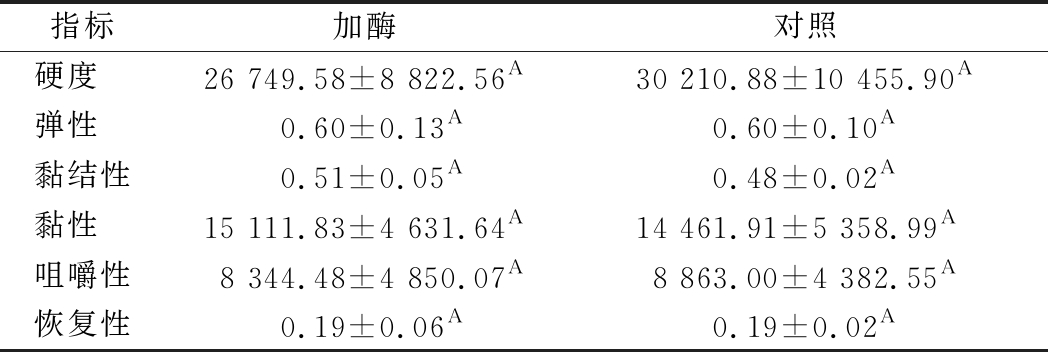
指标加酶对照硬度 26 749.58±8 822.56A30 210.88±10 455.90A弹性 0.60±0.13A0.60±0.10A黏结性0.51±0.05A0.48±0.02A黏性 15 111.83±4 631.64A14 461.91±5 358.99A咀嚼性8 344.48±4 850.07A8 863.00±4 382.55A恢复性0.19±0.06A0.19±0.02A
注:不同大写字母表示同行之间差异显著(下同)
2.2 川味香肠加工过程中生物胺含量的变化
2.2.1 川味香肠加工过程中总生物胺含量的变化情况
川味香肠发酵、成熟过程中总生物胺含量变化情况如表5所示。随着香肠加工时间的推进,2组样品的总生物胺含量不断升高,表明加酶并不能完全抑制生物胺的积累。与对照组相比,加酶组香肠中总胺含量增长较为缓慢,加酶组总生物胺含量显著低于对照组,表明添加二胺氧化酶能有效降低生物胺含量及其增长速率。
表4 川味香肠在加工过程中色差的变化
Table 4 Color difference of Sichuan-style sausages during fermentation and ripening

时间/dL值a*值b*值对照加酶对照加酶对照加酶014.40±5.8aA16.44±1.85aA39.38±4.68cB48.85±6.04bB36.49±2.88abcD46.87±3.19bE217.14±0.89aA20.73±4.17abA25.72±1.59bB23.08±3.45aB31.35±2.87abcD25.82±1.32aD540.49±5.93cB20.07±3.85abA18.30±3.73abB26.77±3.12aB46.70±2.70cD62.48±1.98cD921.12±5.03abA26.77±4.09abA21.36±3.48abB18.19±6.99aB38.35±5.00bcD31.79±3.92abD1634.07±3.62abA26.37±5.55abA13.19±2.15aB16.24±0.84aB21.42±4.41aD25.00±1.61aD2321.99±4.70abA26.66±3.26abA23.84±0.74bC13.70±0.36aB55.33±7.00cD34.04±10.31abD3036.32±5.69bcA31.51±0.11bA23.25±0.49bC15.24±0.54aB25.99±7.96abD21.62±0.54aD
注:不同小写字母表示同列之间差异显著(下同)
表5 川味香肠发酵、成熟过程中总生物胺的变化
Table 5 Changes in the total amount of biogenic amines during the processing of Sichuan sausage

时间/d对照加酶066.31±3.22aA51.72±1.79aB279.58±2.90abA59.09±1.68aB592.52±2.06bA61.94±1.58aB9162.12±9.23cA83.27±1.71bB16214.07±6.28dA108.88±1.60cB23261.41±2.19eA121.14±1.61dB30316.54±11.75fA160.91±12.98eB
2.2.2 川味香肠加工过程中组胺含量的变化情况
组胺在常见生物胺中毒性最强,过量摄入组胺会引起机体过敏反应,甚至休克,美国食品及药物管理局(Food and Drug Administration,FDA)对水产品中组胺限定为50 mg/kg。由图2可知,川味香肠中的组胺含量变化与总生物胺的趋势一致,对照组中组胺含量刚开始增加较为缓慢,从第9天开始快速增长,这可能是因为成熟温度、湿度适宜产组氨酸脱羧酶微生物的生长,利用原料肉中蛋白质降解产生的丰富游离组氨酸生成组胺。加酶组中的组胺含量在第30天时增加明显,达到61.79 mg/kg,略高于FDA限量标准。与张楠[16]接菌生产的川味香肠成熟结束时组胺降解率(30.26%)相比,二胺氧化酶(54.47%)控制组胺效果更显著。
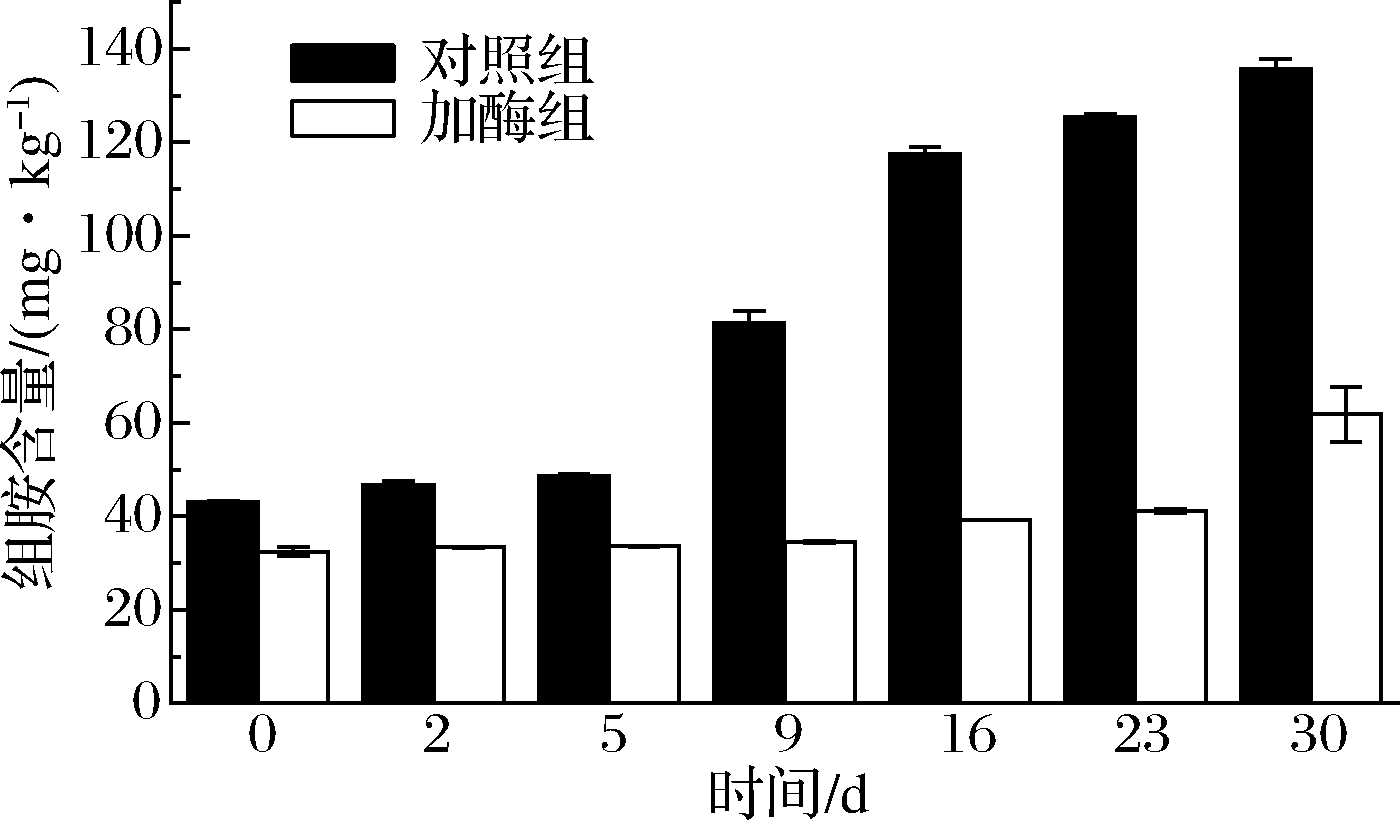
图2 两组川味香肠发酵、成熟过程中组胺含量的变化
Fig.2 Changes in histamine content during the processing of Sichuan sausages
2.2.3 川味香肠加工过程中酪胺含量的变化情况
酪胺属于单胺,和组胺一样是毒性最强的生物胺之一,口服超过100 mg就会出现中毒现象[23]。由图3可以看出,2组川味香肠在加工过程中酪胺含量不断升高,但均未超过100 mg/kg,对照组在成熟结束时达到83.4 mg/kg。加酶组在整个加工过程中酪胺含量明显低于对照组,这说明二胺氧化酶能在一定程度上控制酪胺的含量。加酶组在第2天时酪胺含量增长较为显著,可能是原料肉中含有丰富的游离酪氨酸、酪胺酸脱羧酶,在适宜条件下产生的;在成熟后期的第23~30天,酪胺增长可能是因为蛋白质进一步降解氧化,产生大量酪氨酸所导致,这与孙霞[14]未加菌发酵川味香肠检测结果一致。对比组胺降解情况可以看出二胺氧化酶对于酪胺的控制效果不如组胺强,可能是酪胺是单胺,主要是由单胺氧化酶降解,而二胺氧化酶虽然也能降解,但效果不强。与孙霞等[24]混菌发酵生产的香肠(38.17%)相比,二胺氧化酶对酪胺的降解率(52.86%)更高。
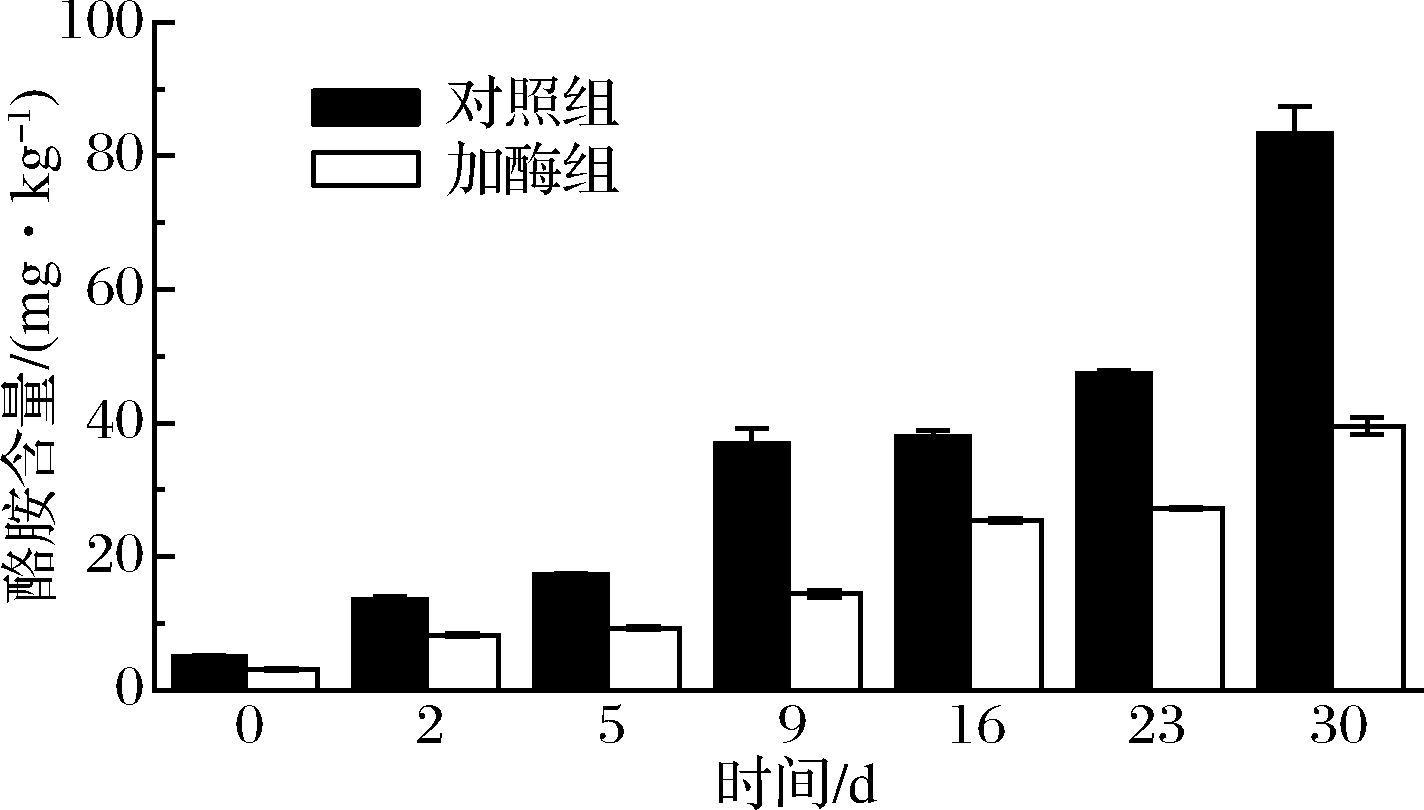
图3 两组川味香肠发酵、成熟过程中酪胺含量的变化
Fig.3 Changes in tyramine content during the processing of Sichuan sausages
2.2.4 川味香肠加工过程中腐胺含量的变化情况
腐胺是一种二胺,过量的腐胺会产生不良气味,并抑制人体对组胺的分解,加强组胺的毒性[25]。由图4可以看出2组川味香肠在整个加工过程中腐胺含量呈上升趋势。从第5天开始明显增长,这可能是因为随着加工的进行,香肠的pH值逐渐降低,肉中产胺微生物为了抵御外界酸环境开始产生大量生物胺,同时pH值的降低也影响了二胺氧化酶的活性,因而对腐胺的降解速度不及其产生的速度,导致腐胺的积累;在成熟终点加酶组中腐胺含量低于对照组,降解率为6.29%,表明添加二胺氧化酶能降低川味香肠中腐胺含量。
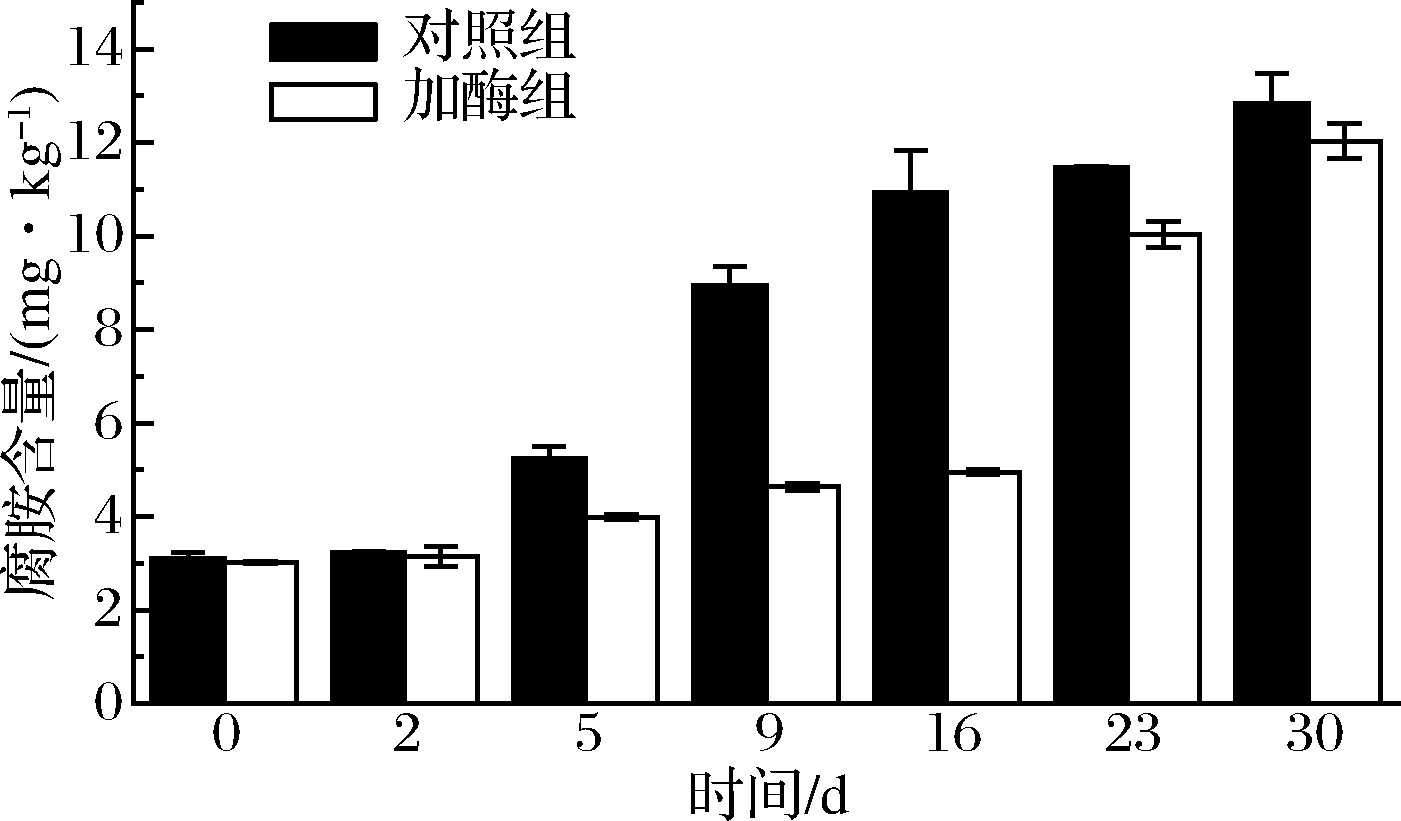
图4 两组川味香肠发酵、成熟过程中腐胺含量的变化
Fig.4 Changes in putrescine content during the processing of Sichuan sausages
2.2.5 川味香肠加工过程中尸胺含量的变化情况
尸胺也是一种二胺,虽然本身毒性不强,但其能与亚硝酸盐形成强致癌物——N-亚硝胺,还能在一定程度上增强组胺毒性。由图5可以看出加酶组的尸胺含量随着加工的进行始终低于对照组,这说明二胺氧化酶对尸胺有较好的控制作用。在加工前5 d,加酶组尸胺含量增加不显著,一方面可能是原料肉品质较好,尸胺的前体物质游离赖氨酸较少,所产生的尸胺也较少;另一方面,添加的二胺氧化酶能够分解一部分已生成的尸胺。从第9天起至成熟结束,加酶组尸胺含量出现了显著性的增长,达到46.07 mg/kg。这可能与香肠成熟中后期环境变化所导致的二胺氧化酶活性降低有关。在成熟结束时,二胺氧化酶对尸胺降解率达到了43.69%,略低于组胺和酪胺。
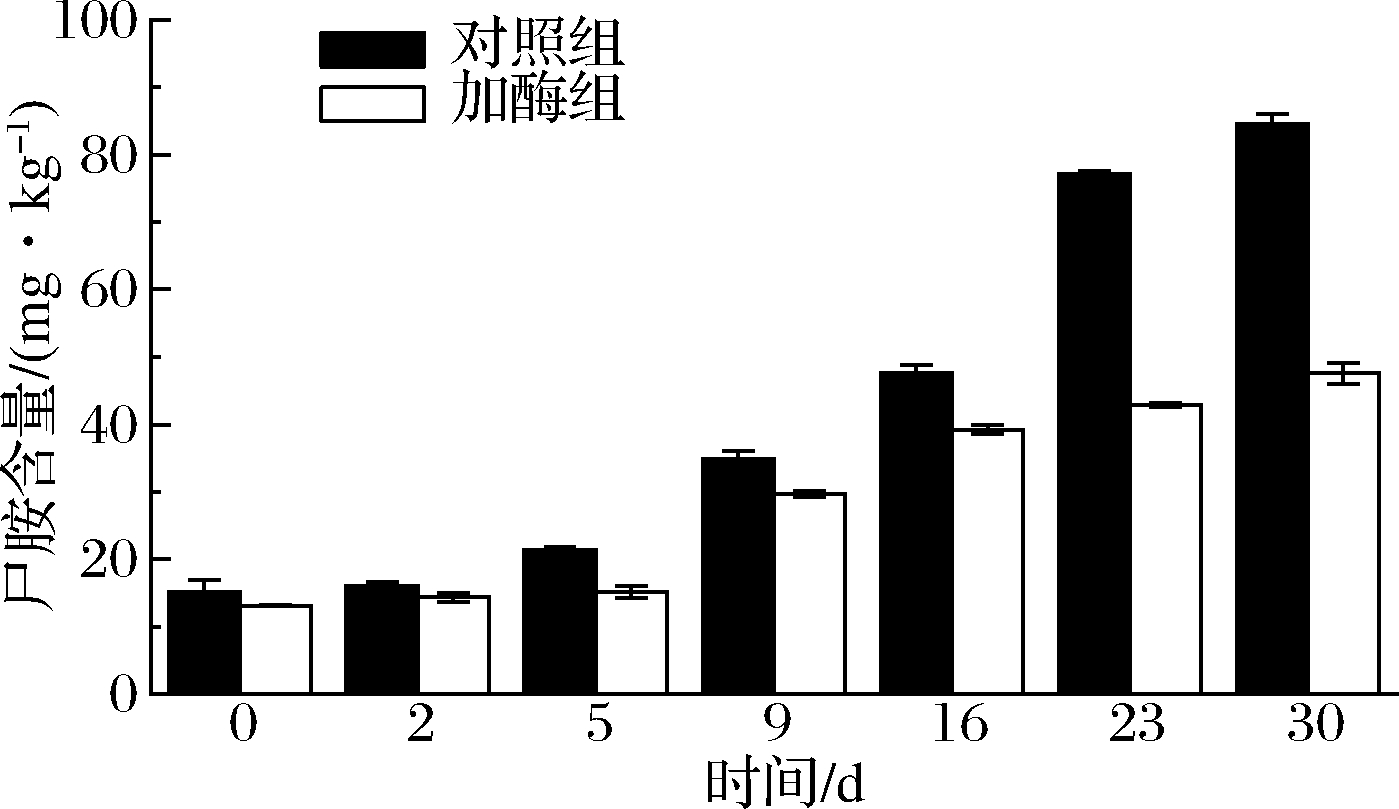
图5 两组川味香肠发酵、成熟过程中尸胺含量的变化
Fig.5 Changes in cadaverine content during the processing of Sichuan sausages
综上所述,添加二胺氧化酶能在香肠发酵、成熟前期控制其中的生物胺增长速率,但随着成熟时间的延长,香肠中自身产胺微生物的生长繁殖及其内环境的变化使得生物胺氧化酶活性受到抑制引起生物胺含量在成熟的中后期不断积累,含量增高。纵观本研究中川味香肠的加工过程,二胺氧化酶的添加能有效降低川味香肠加工成熟过程中的生物胺含量,对其中4种主要生物胺的控制能力为组胺>酪胺>尸胺>腐胺。
3 结论
本文通过在川式香肠中加入二胺氧化酶,研究二胺氧化酶对川味香肠感官品质及生物胺含量的影响。结果表明,二胺氧化酶的添加对川味香肠的感官品质无显著影响,进一步利用电子鼻、电子舌和质构仪检测香肠的气味、滋味和质构,结果显示实验组和对照组均无显著差异,但实验组的红度值(a*)显著升高(P<0.05)。二胺氧化酶的添加能显著降低川味香肠发酵、成熟过程中总生物胺含量,对4种主要生物胺的抑制情况为组胺>酪胺>尸胺>腐胺,并且添加二胺氧化酶能从发酵初期就控制生物胺含量,但在后期生物胺含量仍会逐渐增高,故后期研究可以进一步优化二胺氧化酶的添加量及香肠的发酵成熟条件,从而提高二胺氧化酶对生物胺含量的控制。综上,添加二胺氧化酶不会对川味香肠感官品质产生不良影响,但可显著的降低川味香肠中生物胺的含量。
[1] 张雅琳. 川味香肠发酵过程菌群结构变化与组胺生成相关性的研究[D].成都:成都大学, 2020.
ZHANG Y L.Study on the correlation between the changes of bacterial community structure changing and histamine production of Sichuan-flavor sausage during fermentation[D].Chengdu:Chengdu University, 2020.
[2] MAIJALA R, NURMI E, FISCHER A.Influence of processing temperature on the formation of biogenic amines in dry sausages[J].Meat Science, 1995, 39(1):9-22.
[3] DEABES M M, NAGUIB K H, AYESH A M, et al.Comparison of the HPLC and the TLC techniques for the determination of biogenic amines spiked to sausage and smoked herring samples[J].Enliven:Toxicology & Allied Clinical Pharmacology, 2018, 5(1):1-7.
[4] 李彬彬, 宋桂森, 全鑫杰, 等.屎肠球菌Ef2的安全性评估及其产生物胺氧化酶培养和诱导条件的优化[J].食品与发酵工业, 2019, 45(9):41-48.
LI B B, SONG G S, QUAN X J, et al.Safety assessment and optimized cultural and induction conditions for Enterococcus faecium Ef2 producing amine oxidase[J].Food and Fermentation Industries, 2019, 45(9):41-48.
[5] BIJI K B, RAVISHANKAR C N, VENKATESWARLU R, et al.Biogenic amines in seafood:A review[J].Journal of Food Science and Technology, 2016, 53(5):2 210-2 218.
[6] NAVARRO J, SANZ-VICENTE I, LOZANO R, et al.Analytical possibilities of putrescine and cadaverine enzymatic colorimetric determination in tuna based on diamine oxidase:A critical study of the use of ABTS[J].Talanta, 2020, 208:120392.
[7] HOLBERT C E, DUNWORTH M, FOLEY J R, et al.Autophagy induction by exogenous polyamines is an artifact of bovine serum amine oxidase activity in culture serum[J].Journal of Biological Chemistry, 2020, 295(27):9 061-9 068.
[8] 翟钰佳. 植物乳杆菌对羊肉发酵香肠生物胺形成的影响[D].呼和浩特:内蒙古农业大学, 2019.
ZHAI Y J.Effect of Lactobacillus plantarum on the formation of biogenic amines in mutton fermented sausage[D].Hohhot:Inner Mongolia Agricultural University, 2019.
[9] 刘梦, 陈松, 张顺亮, 等.微发酵对牛肉干风味的影响[J].食品科学, 2021,42(14):232-239.
LIU M, CHEN S, ZHANG S L, et al.Effects of light-fermentation on the flavor of beef jerky[J].Food Science, 2021,42(14):232-239.
[10] 黄瑶, 朱霞, 彭铭烨, 等.黑曲霉胺氧化酶的粗酶液酶学特性及降解生物胺的研究[J].中国酿造, 2017, 36(3):121-125.
HUANG Y, ZHU X, PENG M Y, et al.Characterization of crude enzyme from Aspergillus niger amine oxidase and study on its degradation of biogenic amines[J].China Brewing, 2017, 36(3):121-125.
[11] NAILA A, FLINT S, FLETCHER G, et al.Histamine degradation by diamine oxidase, Lactobacillus and Vergibacillus halodonitrificans Nai18[J].Food Processing & Technology, 2012, 3(6):158.
[12] CALLEJ N S, SENDRA R, FERRER S, et al.Ability of Kocuria varians LTH 1540 to degrade putrescine:Identification and characterization of a novel amine oxidase[J].Journal of Agricultural and Food Chemistry, 2015, 63(16):4 170-4 178.
N S, SENDRA R, FERRER S, et al.Ability of Kocuria varians LTH 1540 to degrade putrescine:Identification and characterization of a novel amine oxidase[J].Journal of Agricultural and Food Chemistry, 2015, 63(16):4 170-4 178.
[13] 张雪梅. 四川香肠生产过程中理化特性、微生物特性及产香葡萄球菌的筛选与应用[D].雅安:四川农业大学, 2010.
ZHANG X M.Physical, chemical and microbial property of Sichuan sausage during processing and selection and application of Staphylococcus[D].Ya′an:Sichuan Agricultural University, 2010.
[14] 孙霞. 四川香肠中生物胺降解菌的筛选鉴定及其初步应用[D].雅安:四川农业大学, 2016.
SUN X.Screening, identification and preliminary application of biogenic amines degrading bacterium in Sichuan sausage[D].Ya′an:Sichuan Agricultural University, 2016.
[15] 周兰. 冷鲜调理烧烤牛肉的配方优化及其品质研究[D].雅安:四川农业大学, 2018.
ZHOU L.Pre-conditioned barbecue chilled beef formula optimization and its quality research[D].Ya′an:Sichuan Agricultural University, 2018.
[16] 张楠. 川味香肠中组胺降解菌的筛选鉴定及其对组氨酸脱羧酶基因表达的影响[D].雅安:四川农业大学, 2018.
ZHANG N.Screening, identification and influence on of histamine decarboxylase gene expression of histidine degrading bacteriums in Sichuan-style sausage[D].Ya′an:Sichuan Agricultural University, 2018.
[17] HUANG L Y, WANG Y, LI R T, et al.Thyme essential oil and sausage diameter effects on biogenic amine formation and microbiological load in smoked horse meat sausage[J].Food Bioscience, 2021, 40:100885.
[18] 贾洪锋, 卢一, 何江红, 等.电子鼻在牦牛肉和牛肉猪肉识别中的应用[J].农业工程学报, 2011, 27(5):358-363.
JIA H F, LU Y, HE J H, et al.Recognition of yak meat, beef and pork by electronic nose[J].Transactions of the Chinese Society of Agricultural Engineering, 2011, 27(5):358-363.
[19] GU D C, LIU W, YAN Y, et al.A novel method for rapid quantitative evaluating formaldehyde in squid based on electronic nose[J].LWT, 2019, 101:382-388.
[20] ROSS C F.Considerations of the use of the electronic tongue in sensory science[J].Current Opinion in Food Science, 2021, 40:87-93.
[21] 田晓静. 基于电子鼻和电子舌的羊肉品质检测[D].杭州:浙江大学, 2014.
TIAN X J.Mutton quality detection based on electronic nose and electronic tongue[D].Hangzhou:Zhejiang University, 2014.
[22] ![]() V, et al.Influence of smoking in traditional and industrial conditions on colour and content of polycyclic aromatic hydrocarbons in dry fermented sausage “Petrovská klobása”[J].LWT, 2018, 87:158-162.
V, et al.Influence of smoking in traditional and industrial conditions on colour and content of polycyclic aromatic hydrocarbons in dry fermented sausage “Petrovská klobása”[J].LWT, 2018, 87:158-162.
[23] DEL RIO B, REDRUELLO B, LINARES D M, et al.The dietary biogenic amines tyramine and histamine show synergistic toxicity towards intestinal cells in culture[J].Food Chemistry, 2017, 218:249-255.
[24] 孙霞, 杨勇, 巩洋, 等.混合发酵剂对川味香肠发酵成熟过程中生物胺含量变化的影响[J].食品与发酵工业, 2015, 41(9):63-68.
SUN X, YANG Y, GONG Y, et al.Effects of mixed starter culture on biogenic amine content during fermentation and maturation of Sichuan sausage[J].Food and Fermentation Industries, 2015, 41(9):63-68.
[25] 张敏, 赵晓娟, 曾晓房, 等.食品中腐胺和尸胺检测方法研究及应用进展[J].食品工业, 2019, 40(4):215-219.
ZHANG M, ZHAO X J, ZENG X F, et al.Research and application progress of determination methods of putrescine and cadaverine in foods[J].The Food Industry, 2019, 40(4):215-219.