蜂花粉是蜜蜂通过采集显花植物的花粉,并添加花蜜等物质后形成的颗粒物,富含多酚、纤维素等物质,在我国作为保健食品已有几百年的历史。蜂花粉中的酚类化合物可以清除自由基,从而改善氧化应激对机体造成的危害,如炎症、心血管疾病和癌症等,因此蜂花粉多酚的吸收和利用与人体的健康息息相关[1]。
生物有效性指数是用来评估从食物中释放出来可以被人体吸收的化合物的量[2],因此要提高多酚在体内的利用率就必须提高其生物有效性。根据溶解度可将多酚分为两类:通过有机溶剂提取的可溶性游离态多酚,和保留在剩余残渣中的不可溶键合态多酚。膳食摄入的游离态多酚不到膳食总酚的10%,大部分键合多酚以共价键结合在细胞壁结构成分上,不能被胃和小肠消化,只有在肠道微生物作用下才能从食物基质中释放出来,从而被人体吸收利用[3]。另一方面,花粉粒外壁较厚,而且对酸、碱等理化因素有一定的耐受性,因此不利于多酚等营养物质的释放。有研究表明,通过某些微生物对蜂花粉进行发酵,不仅能达到破壁的目的,还能促进营养物质的释放,提高其生物有效性[4]。因此,肠道微生物对蜂花粉的作用可能是蜂花粉在体内发挥生物学功效的关键环节,但目前尚未有这方面的研究。
体外消化和结肠发酵模型广泛应用于研究食物和药物在体内的吸收和利用情况,与体内模型相比,体外实验不仅没有道德争议,而且重现性高、简便易行,能够更加客观系统地评估营养物质在体内各个阶段的生物有效性[5]。体外消化一般是指胃和肠消化,该过程模拟了体内生理条件,如消化时间、温度、pH值、酶的种类及其浓度、盐浓度等[6],这些条件均会对营养物质产生影响。体外结肠发酵一般是利用人类粪菌对体外消化后的残余物进行发酵,促进营养物质从食物基质中释放,提高营养物质的生物有效性。许多研究者通过体外模型研究食物基质中酚类化合物的生物有效性,发现角豆粉[7]、坚果[8]经结肠发酵后,其抗氧化活性以及生物有效性得到较大提高。蜂花粉中含有丰富的酚类物质,如山奈酚、柚皮素、没食子酸等[9],但目前尚未有文献通过体外模型研究不同蜂花粉酚类化合物的生物有效性。因此,本研究以油菜蜂花粉、茶花粉、五味子蜂花粉为原料,研究3种蜂花粉在不同消化阶段以及发酵时间总酚、总黄酮和抗氧化活性的变化规律,并进一步分析其生物有效性,为开发新型蜂花粉功能食品提供理论依据。
1 材料与方法
1.1 材料与试剂
油菜蜂花粉、五味子蜂花粉、茶花粉均购自蜂农处,并通过孢粉学鉴定植物源[10],以确定3种蜂花粉的种类。
α-淀粉酶、胃蛋白酶、胰蛋白酶、猪胆盐,上海阿拉丁生化科技有限公司;DPPH、没食子酸、福林酚、FeSO4·7H2O、CaCl2·6H2O、MnSO4·H2O、CoCl2·6H2O、MgCl2·6H2O、ZnSO4·7H2O、NiCl2、CuSO4·5H2O 等,均为国产分析纯。
1.2 仪器与设备
200T粉磨机,永康市铂欧五金制品有限公司;NDK200-1氮吹仪,上海皓庄仪器有限公司;CXG-1微生物培养箱,上海青浦沪西仪器厂;UV1800分光光度计,上海仪电分析仪器有限公司制造;52AA旋转蒸发仪,上海亚荣生化仪器厂;PHS-3C实验室pH计,上海佑科仪器有限公司;SHA-B恒温摇床,常州国华电器有限公司。
1.3 试验方法
1.3.1 样品前处理
将油菜蜂花粉、五味子蜂花粉、茶花粉除杂,磨粉过50目筛,密封贮存于-20 ℃。
1.3.2 蜂花粉总可溶酚类化合物的提取
参照陈壁等[11]的方法,分别称取2.4 g 3种蜂花粉粉末,用70%(体积分数)丙酮超声提取20 min后离心,取上清液,即为总可溶多酚化合物。
1.3.3 体外模拟胃肠消化
参照GULLON等[12]的方法,先进行胃消化,再将胃消化后的残余物进行肠消化。用1 mmol/L CaCl2配制的100 U/mL α-淀粉酶溶液,用5 mL 0.1 mol/L HCl溶解0.06 g胃蛋白酶配制胃消化液;用5 mL 0.5 mol/L NaHCO3溶液溶解250 mg胆盐配制胆汁溶液,用5 mL 0.5 mol/L NaHCO3溶液溶解0.04 g胰蛋白酶并与1.2 mL胆汁溶液混匀配制肠消化液。
模拟胃消化:分别称取2.4 g 3种蜂花粉粉末,依次加入1 ml配制好的α-淀粉酶溶液、9 mL蒸馏水,混合均匀后,于37 ℃恒温振摇2 min。然后用6 mol/L HCl将3种蜂花粉悬液调至pH 2,分别与1 mL模拟胃液混合均匀,于37 ℃恒温振摇消化2 h。模拟胃肠消化:用6 mol/L NaOH将3种蜂花粉胃消化后的悬浊液调至pH 7,分别加入2.4 mL模拟肠液混合均匀,于37 ℃恒温振摇消化2 h。模拟小肠吸收:将模拟体外消化结束后的3种蜂花粉悬浊液于37 ℃,10 mmol/L NaCl 溶液中透析过夜(3 kDa)。
1.3.4 体外模拟结肠发酵
选择3名3个月内未服用过任何抗生素的健康成年人作为新鲜粪便提供者,粪便样品以质量比1∶1∶1混合,依据MOSELE等[13]的方法配制肠道发酵菌液,贮存于-20 ℃备用,37 ℃恒温解冻后使用。其中发酵菌液的配制要在1 h内完成。参考LEBET等[14]方法配制体外发酵培养液。将经过模拟体外消化和小肠吸收后的残余物与体外发酵培养液、肠道发酵菌液以1∶2∶2的比例混合均匀,充氮气4 h,在37 ℃厌氧条件下分别培养0、3、6、12、24 h。
1.3.5 多酚提取以及生物有效性
收集体外消化以及结肠发酵各个阶段的上清液,用乙酸乙酯萃取后真空旋干,甲醇定溶,于-20 ℃冰箱贮存,用于测定各项指标,并按照公式(1)计算生物有效性:
生物有效性![]()
(1)
式中:PCA(polyphenolic compounds content in samples after in vitro digestion or colonic fermentation):不同体外消化阶段或不同结肠发酵时间样品中酚类物质的量;PCB(polyphenolic compounds content in samples before in vitro digestion):体外消化之前样品中酚类物质的量。
1.3.6 总酚含量测定
总酚含量测定参考BOUAYED等[15]的方法,以没食子酸(gallic acid equivalents,GAE)为标准品绘制标准曲线,所得结果用没食子酸当量来表示,结果表示为mg GAE/g样品。
1.3.7 总黄酮含量测定
总黄酮含量测定参考BLASA等[16]的方法,以芦丁为标准品绘制标准曲线,所得结果用芦丁当量(rutin equivalents,RE)表示,结果表示为mg RE/g样品。
1.3.8 DPPH自由基清除能力的测定
参考JAYAPRAKASHA等[17]的方法并经适当修改,利用维生素C绘制标准曲线,取适量样品溶液与4 mL 0.04 mg/mL DPPH的甲醇溶液充分混合后,避光反应并测定吸光度,DPPH自由基清除能力以每克样品中相当于维生素C的物质的量表示,单位为mg维生素C/g样品。
1.3.9 铁离子还原力测定
参考ULUSOY等[18]的方法并经适当修改。取适量样品溶液与4 mL 2,4,6-三吡啶基三嗪(2,4, 6-tripyridyl triazine,TPTZ)工作液混合,于37 ℃水浴10 min,在593 nm处测定吸光度。结果表示为mg Trolox/g样品。
1.3.10 亚铁离子络合力测定
参考SINGH等[19]的方法对样品的亚铁离子络合能力进行了测定。取适量样品溶液与100 μL 1 mmol/L FeSO4、300 mL 1 mmol/L铁试剂混合,用甲醇定容至1 mL,在562 nm处测量吸光度。结果以每克样品相当于乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,Na2EDTA)的质量来表示,单位为mg Na2EDTA/g样品。
1.4 数据统计分析
所有实验结果均测定3次,结果表示为平均值±标准偏差。通过SPSS 19.0软件进行单因素方差分析和Tukey多重比较,对数据进行显著性差异分析(P<0.05);运用Origin 2018软件作图。
2 结果与分析
2.1 体外模拟消化过程中3种蜂花粉酚类化合物含量及其抗氧化活性
蜂花粉的抗氧化活性与酚类化合物的含量有关,其抗氧化活性可能会因胃肠消化过程中的环境不同而发生变化[20]。另外,由于食品的抗氧化活性是由多种反应机理决定的,因此本文结合多种方法来测定蜂花粉体外消化各阶段的抗氧化能力。由表1可以看出,3种蜂花粉未消化阶段的总酚、总黄酮含量均高于体外消化阶段,这可能是由于体外消化阶段测定的是消化后样品的上清液,而未消化阶段测定的是蜂花粉样品的总可溶性多酚。SHU等[21]在研究茶粉多酚的体外消化特性时发现,未消化比消化过的样品呈现出更高的抗氧化活性,该研究与本实验结果相似。ARGYRI等[22]发现酚酸、类黄酮等酚类化合物的溶解性和可利用性受到pH条件以及与膳食成分(如铁、纤维或蛋白质)相互作用的影响。经过体外消化后,蜂花粉中酚类化合物在酸碱环境和消化酶作用下从基质中释放出来。由表1可知,茶花粉的多酚溶出量最多,在胃消化和胃肠消化结束后酚类物质的含量分别是2.76、2.69 mg/g。这可能是茶花粉中可溶性游离态酚类化合物含量较高,易于溶出,而五味子蜂花粉、茶花粉中不可溶性结合态酚类化合物含量较高,对胃肠消化液的抵抗力较强。与胃消化相比,3种蜂花粉经过模拟胃肠消化后酚类化合物的含量均降低。这一结果与郑慧等[23]研究一致,蜂花粉经模拟胃肠消化后酚类物质的含量降低,这可能是由于肠道的溶解氧和碱性环境引起了儿茶素等酚类物质的自氧化[24]。事实上,在胃肠消化条件下不同酚类化合物的稳定性不同。李俶等[25]研究了体外模拟消化对7种酚类物质稳定性的影响,结果发现经过胃消化后儿茶素和表儿茶素的含量分别降低了16.6%和6%;经过胃肠消化后,只有阿魏酸的含量略有上升,其余酚类化合物的含量均呈降低趋势,其中没食子酸下降了71%,绿原酸下降了35%。有研究显示,油菜蜂花粉、五味子蜂花粉、茶花粉均含有丰富的没食子酸、对羟基苯甲酸、鞣花酸等酚类化合物[9],这可能是3种蜂花粉多酚在胃肠消化阶段不稳定的原因。
表1 体外消化后蜂花粉中酚类化合物含量以及抗氧化活性 单位:mg/g
Table 1 Phenolic compounds contents and antioxidant activities of bee pollen after digestion in vitro

测试指标油菜蜂花粉五味子蜂花粉茶花粉未消化胃消化胃肠消化未消化胃消化胃肠消化未消化胃消化胃肠消化总酚含量4.72±0.15a2.60±0.07b2.22±0.11c5.13±0.06a2.55±0.13b2.34±0.14b5.30±0.09a2.76±0.09b2.69±0.09b总黄酮含量2.95±0.16a1.31±0.10b1.11±0.15b3.25±0.25a1.06±0.26b0.94±0.06b3.66±0.34a1.12±0.02b1.00±0.04b铁离子还原力2.00±0.12a1.85±0.16b1.48±0.02c2.44±0.42a1.88±0.07b1.82±0.01b2.33±0.33a1.85±0.10a1.76±0.11a亚铁离子络合力1.60±0.03a0.64±0.04b0.62±0.01b1.73±0.30a0.64±0.02b0.54±0.01b2.08±0.37a0.61±0.01b0.53±0.02bDPPH清除力3.11±0.10a2.69±0.09ab2.38±0.07b3.23±0.23a2.36±0.05b2.20±0.06b3.54±0.12a3.18±0.15ab2.59±0.14c
注:表中不同字母代表差异显著(P<0.05)(下同)
2.2 体外结肠发酵过程中3种蜂花粉酚类化合物和抗氧化活性
由图1可知,在模拟体外结肠发酵过程中,随发酵时间的延长,3种蜂花粉中总酚和总黄酮含量呈显著上升趋势(P<0.05)。结肠发酵24 h时,3种蜂花粉的总酚含量分别达到5.99、7.17、6.38 mg/g,总黄酮含量分别达到4.27、4.62、3.68 mg/g;与发酵0 h相比,3种蜂花粉的总酚含量分别提高了67.75%、70.11%、75.31%,总黄酮含量分别提高74.55%、80.96%、78.52%,其中五味子蜂花粉在体外结肠发酵过程中释放的酚类物质最多。这可能是由于在结肠微生物发酵的过程中,蜂花粉中的键合态多酚与细胞壁成分相连接的共价键、氢键和疏水键在微生物和酶的作用下发生断裂,这些多酚以可溶性游离态的形式释放出来,导致酚类化合物的含量提高[26]。DONG等[27]研究发现,与体外消化相比,结肠发酵显著释放并转化了大量胡萝卜结合态多酚,微生物途径可能是对羟基苯甲酸、阿魏酸、没食子酸和原儿茶酸等26种酚类物质释放及代谢的主要途径。除此以外,结肠发酵过程中酚类化合物含量的增加可能还与微生物发酵促进蜂花粉破壁有关。有研究发现,乳酸菌、酵母菌、植物乳杆菌、保加利亚杆菌等均可以通过发酵作用使蜂花粉破壁,并促进营养物质的释放[4]。
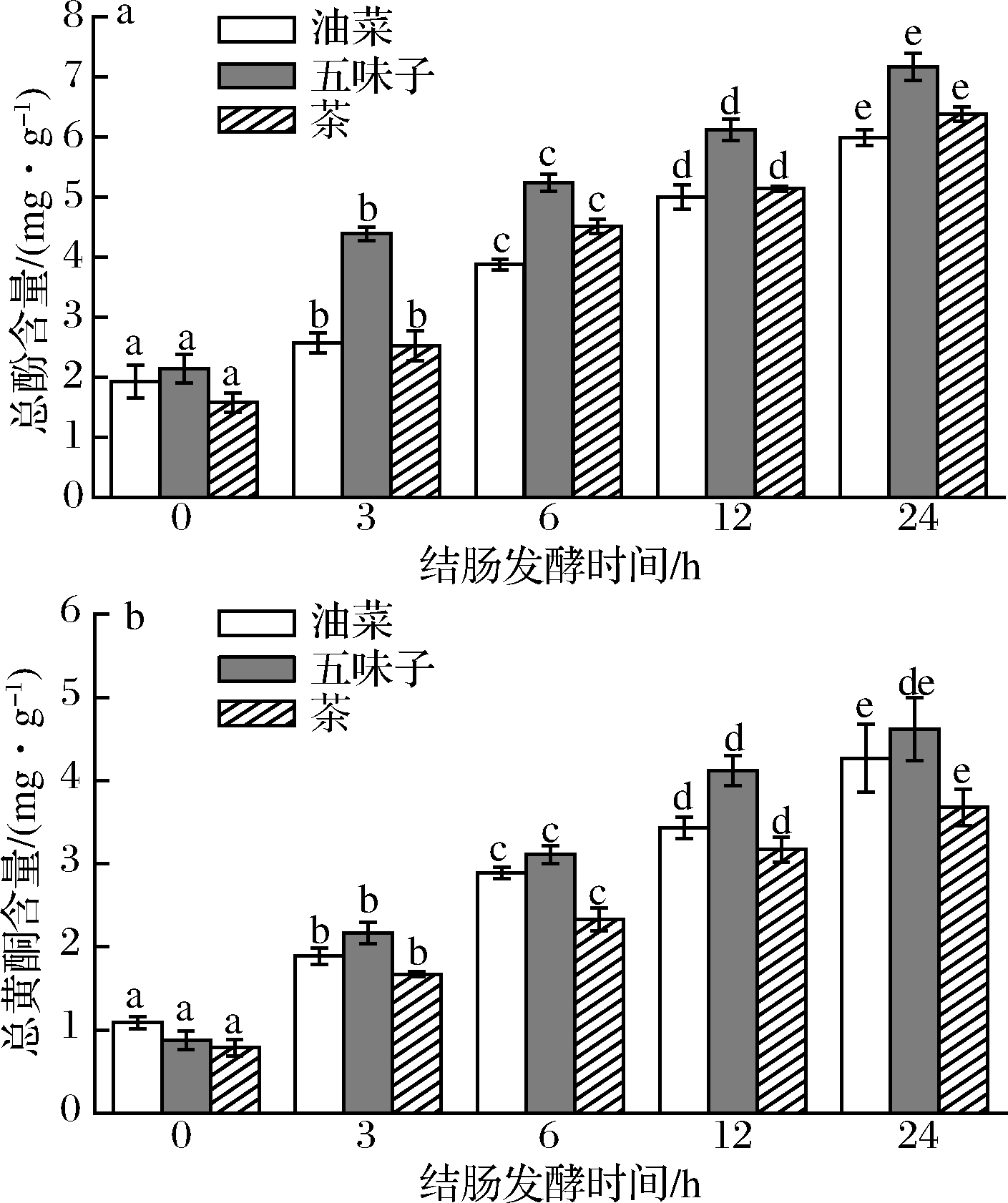
a-多酚含量;b-黄酮含量
图1 体外结肠发酵后蜂花粉中总酚和总黄酮的含量
Fig.1 The total phenolic content and total flavonoids content of bee pollen after colonic fermentation in vitro
注:图中相同样品肩标不同字母代表差异显著(P<0.05)(下同)
由图2可以看出,在体外结肠发酵的24 h过程中,3种蜂花粉的铁离子还原力、亚铁离子络合力、DPPH自由基清除力均呈逐渐增加的趋势,这与3种蜂花粉在发酵过程中酚类化合物含量增加有关。结肠发酵24 h时,与发酵0 h相比,3种蜂花粉的铁离子还原力分别提高了49.38%、59.31%、60.91%;3种蜂花粉对亚铁离子的络合力分别提高了69.33%、71.69%、84.93%;3种蜂花粉的DPPH自由基清除能力分别提高了69.47%、73.57%、68.57%。研究发现,对青稞进行体外结肠发酵前30 h内,酚类化合物含量与抗氧化活性显著升高[28],巴西莓的抗氧化活性在体外结肠发酵过程中也呈逐渐升高的趋势[29],这与我们的研究结果一致。胃肠系统由于经常暴露于活性氧(reactive oxygen species,ROS)和源于饮食的病原体自由基中,从而发生过度氧化应激反应[30],膳食摄入的多酚等抗氧化剂可以中和氧自由基,缓解由氧化应激引起的胃肠疾病。由图2可知,与体外消化相比,结肠发酵显著提高了3种蜂花粉的抗氧化能力,因此,肠道微生物对蜂花粉多酚的作用,可能是蜂花粉摄入后能够缓解胃肠疾病的关键环节。

a-铁离子还原力;b-亚铁离子络合力;c-DPPH自由基清除力
图2 体外结肠发酵后蜂花粉中酚类化合物的抗氧化活性
Fig.2 Antioxidant activities of phenolic compounds in bee pollen after colonic fermentation in vitro
2.3 体外胃肠消化及结肠发酵过程中3种蜂花粉酚类化合的生物有效性
食物中多酚等生物活性物质含量的测定通常经过化学试剂提取后进行,但所有生物活性物质在体内发挥其生物学功效前都会受多种因素的影响,如食物基质、胃肠道的酸碱环境、酶、肠道微生物等,因此通过体外模型计算生物有效性才能更加客观的评估人体实际利用的活性物质的量。由表2~表4可以看出,3种蜂花粉总酚、总黄酮以及抗氧化活性的生物有效性在体外消化和结肠微生物发酵过程中呈现先降低后上升的趋势,其中在模拟小肠吸收后(发酵0 h)达到最低,在结肠发酵过程中逐渐升高。结肠发酵24 h时,3种蜂花粉多酚生物有效性均超过未消化时生物有效性,分别达到126.96%、139.74%、120.54%,与发酵0 h相比,分别提高了67.87%、73.01%、75.36%。实际上,存在于食物和草药当中的天然酚类物质主要与糖和有机酸如奎尼酸结合,以缩合单宁等低聚物的形式存在。这些缩合物吸收不良或者根本不能被小肠吸收,需要在肠道微生物的作用下水解(脱糖基和酯水解)、裂解(碳环裂解;去脂化、去甲基化)和还原(脱羟基化和双键还原)成更多生物可利用的小分子代谢物,从而提高生物利用率[31]。因此,为了提高蜂花粉多酚的生物利用率,可以通过体外益生菌发酵来辅助蜂花粉酚类物质的释放。
表2 体外消化及结肠发酵后油菜蜂花粉中酚类化合物和抗氧化活性的生物有效性 单位:%
Table 2 Bioavailability of phenolic compounds and antioxidant activities of rape bee pollen after digestion and colonic fermentation in vitro

生物有效性未消化胃消化胃肠消化发酵时间0 h3 h6 h12 h24 h总酚含量100.00b55.19±3.24d47.16±3.83de40.79±4.46e54.29±1.90de82.16±0.70c105.86±0.92b126.96±1.29a总黄酮含量100.00b44.64±5.73c37.46±3.05c36.82±0.26c64.02±0.07c98.08±3.01b116.90±10.68b146.08±25.25a铁离子还原力100.00b92.50±2.61bc74.30±5.68bc68.91±1.45c75.83±1.36bc93.47±0.66bc100.01±10.39bc136.64±5.51a亚铁离子络合力100.00a40.05±2.98c38.76±0.16cd23.01±0.72e31.24±1.48de45.01±1.67c67.27±0.67b75.09±2.04bDPPH自由基清除力100.00c86.60±0.04d76.77±0.36e40.16±2.83g58.87±1.41f101.54±0.47c109.57±1.74b131.90±1.06a
表3 体外消化及结肠发酵后五味子蜂花粉中酚类化合物和抗氧化活性生物有效性 单位:%
Table 3 Bioavailability of phenolic compounds and antioxidant activities of Schisandra chinensis bee pollen after digestion and colonic fermentation in vitro

生物有效性未消化胃消化胃肠消化发酵时间0 h3 h6 h12 h24 h总酚含量100.00c49.68±1.95e45.59±2.20e37.72±0.24e85.63±3.09d102.10±1.45c119.36±4.97b139.74±2.84a总黄酮含量100.00c32.23±5.59e28.89±0.48e27.53±5.47e66.96±1.11d96.20±3.83c124.30±3.96b142.37±0.89a铁离子还原力100.00ab78.72±10.52ab76.84±13.68ab55.78±17.67b87.58±13.11ab101.20±25.87ab110.14±13.63ab133.08±20.14a亚铁离子络合力100.00a37.71±5.24b32.51±6.42b30.69±6.78b36.94±5.61b54.55±12.07ab69.53±13.22ab80.50±15.74abDPPH自由基清除力100.00b73.54±6.72c68.29±2.81c39.71±0.62d74.41±2.76c103.88±6.45b130.35±7.29a150.22±2.11a
表4 体外消化及结肠发酵后茶花粉中酚类化合物和抗氧化活性生物有效性 单位:%
Table 4 Bioavailability of phenolic compounds and antioxidant activities of Camellia japonica bee pollen after digestion and colonic fermentation in vitro
生物有效性未消化胃消化胃肠消化发酵时间0 h3 h6 h12 h24 h总酚含量100.00ab52.02±0.77c50.75±2.42c29.71±2.45c47.79±10.24c85.24±0.92b97.18±2.41ab120.54±4.14a总黄酮含量100.00a30.99±3.42e27.62±2.80e22.04±4.75e46.20±5.10d63.83±2.13c87.02±3.91b100.85±3.11a铁离子还原力100.00ab81.78±15.63ab77.85±15.76ab49.06±10.94b74.88±4.19ab85.32±10.35ab110.27±4.99ab124.53±20.97ab亚铁离子络合力100.00a30.29±5.65cde26.19±5.47de9.44±0.50e22.01±5.14de42.05±9.13bcd51.17±9.62bc63.76±9.84bDPPH自由基清除力100.00ab89.71±1.29bc73.38±6.54cd37.90±2.16e65.21±6.75d89.51±6.24bc108.54±1.98ab120.43±2.67a
3 结论
研究结果表明,3种蜂花粉经体外模拟胃肠消化后,多酚生物有效性分别达到47.16%、45.59%、50.75%,在体外结肠发酵24 h过程中,总酚、总黄酮含量以及抗氧化活性显著提高,多酚的生物有效性达到126.96%、139.74%、120.54%。这可能是由于蜂花粉中含有大量不可溶性键合态酚类物质,能抵抗胃肠消化液作用,而在结肠微生物的发酵作用下大量释放。此外,不同种类蜂花粉在体外结肠发酵过程中多酚的释放量不同,在3种蜂花粉中,五味子蜂花粉在结肠微生物发酵的作用下释放的总酚、总黄酮的量最高,因此其抗氧化活性最高。研究结果表明,结肠发酵可以释放键合态多酚以提高酚类化合物的生物有效性,是蜂花粉多酚在体内发挥作用的关键环节。该研究为开发蜂花粉抗氧化功能性食品提供理论依据。
[1] KHALIFA S A M, ELASHAL M H, YOSRI N, et al. Bee pollen: Current status and therapeutic potential[J]. Nutrients, 2021, 13(6): 1 876.
[2] JU NIZ I, LUDWIG I A, BRESCIANI L, et al. Bioaccessibility of (poly) phenolic compounds of raw and cooked cardoon (Cynara cardunculus L.) after simulated gastrointestinal digestion and fermentation by human colonic microbiota[J]. Journal of Functional Foods, 2017, 32: 195-207.
NIZ I, LUDWIG I A, BRESCIANI L, et al. Bioaccessibility of (poly) phenolic compounds of raw and cooked cardoon (Cynara cardunculus L.) after simulated gastrointestinal digestion and fermentation by human colonic microbiota[J]. Journal of Functional Foods, 2017, 32: 195-207.
[3] SHARMA R, PADWAD Y. Plant polyphenols based second generation synbiotics: Emerging concepts, challenges and opportunities[J]. Nutrition, 2020, 77: 110785.
[4] 延莎, 赵柳微, 吴黎明. 蜂粮及发酵蜂花粉产品的研究进展[J]. 中国食物与营养, 2019, 25(7): 9-15.
YAN S, ZHAO L W, WU L M. Research advancement on bee bread and fermented bee pollen food[J]. Food and Nutrition in China, 2019, 25(7): 9-15.
[5] MINEKUS M, ALMINGER M, ALVITO P, et al. A standardised static in vitro digestion method suitable for food—An international consensus[J]. Food & Function, 2014, 5(6): 1 113-1 124.
[6] SIRISENA S, AJLOUNI S, NG K. Simulated gastrointestinal digestion and in vitro colonic fermentation of date (Phoenix dactylifera L.) seed polyphenols[J]. International Journal of Food Science and Technology, 2018, 53(2): 412-422.
[7] ORTEGA N, MACI A, ROMERO M P, et al. Matrix composition effect on the digestibility of carob flour phenols by an in vitro digestion model[J]. Food Chemistry, 2011, 124(1): 65-71.
A, ROMERO M P, et al. Matrix composition effect on the digestibility of carob flour phenols by an in vitro digestion model[J]. Food Chemistry, 2011, 124(1): 65-71.
[8] ROCCHETTI G, CHIODELLI G, GIUBERTI G, et al. Bioaccessibility of phenolic compounds following in vitro large intestine fermentation of nuts for human consumption[J]. Food Chemistry, 2018, 245: 633-640.
[9] 王悦, 徐元元, 杨二林, 等. 酶解结合高剪切破壁技术对蜂花粉酚类物质及抗氧化活性的影响[J]. 农业工程学报, 2021, 37(2): 313-320.
WANG Y, XU Y Y, YANG E L, et al. Effects of enzymatic hydrolysis combined with high-shear wall breaking technology on phenolic compounds and antioxidant activity of bee pollen[J]. Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(2): 313-320.
[10] 徐万林. 中国蜜粉源植物[M]. 哈尔滨: 黑龙江科学技术出版社, 1992.
XU W L. Chinese Honey Powder Source Plant[M]. Harbin: Heilongjiang Science and Technology Press, 1992.
[11] 陈壁, 黄勇桦, 张建平, 等. 体外模拟胃肠道消化和结肠发酵对长黑青稞多酚生物有效性和抗氧化活性的影响[J]. 食品科学, 2020, 41(21): 28-35.
CHEN B, HUANG Y H, ZHANG J P, et al. Effects of in vitro gastrointestinal digestion and colonic fermentation on bioaccessibility and antioxidant activity of phenolic compounds in Changhei hulless barley[J]. Food Science, 2020, 41(21): 28-35.
[12] GULLON B, PINTADO M E, FERN NDEZ-L
NDEZ-L PEZ J, et al. In vitro, gastrointestinal digestion of pomegranate peel (Punica granatum) flour obtained from co-products: Changes in the antioxidant potential and bioactive compounds stability[J]. Journal of Functional Foods, 2015, 19: 617-628.
PEZ J, et al. In vitro, gastrointestinal digestion of pomegranate peel (Punica granatum) flour obtained from co-products: Changes in the antioxidant potential and bioactive compounds stability[J]. Journal of Functional Foods, 2015, 19: 617-628.
[13] MOSELE J I, MACIA A, ROMERO M P, et al. Application of in vitro gastrointestinal digestion and colonic fermentation models to pomegranate products (juice, pulp and peel extract) to study the stability and catabolism of phenolic compounds[J]. Journal of Functional Foods, 2015, 14: 529-540.
[14] LEBET V, ARRIGONI E, AMAD R, et al. Measurement of fermentation products and substrate disappearance during incubation of dietary fibre sources with human faecal flora[J]. LWT-Food Science and Technology, 1998, 31(5): 473-479.
R, et al. Measurement of fermentation products and substrate disappearance during incubation of dietary fibre sources with human faecal flora[J]. LWT-Food Science and Technology, 1998, 31(5): 473-479.
[15] BOUAYED J, HOFFMANN L, BOHN T. Total phenolics, flavonoids, anthocyanins and antioxidant activity following simulated gastrointestinal digestion and dialysis of apple varieties: Bioaccessibility and potential uptake[J]. Food Chemistry, 2011, 128(1): 14-21.
[16] BLASA M, CANDIRACCI M, ACCORSI A, et al. Raw Millefiori honey is packed full of antioxidants[J]. Food Chemistry, 2006, 97(2): 217-222.
[17] JAYAPRAKASHA G K, PATIL B S. In vitro evaluation of the antioxidant activities in fruit extracts from citron and blood orange[J]. Food Chemistry, 2007, 101(1): 410-418.
[18] ULUSOY E, KOLAYLI S. Phenolic composition and antioxidant properties of Anzer bee pollen[J]. Journal of Food Biochemistry, 2014, 38(1): 73-82.
[19] SINGH N, RAJINI P S. Free radical scavenging activity of an aqueous extract of potato peel[J]. Food Chemistry, 2004, 85(4): 611-616.
[20] BOUAYED J, DEUßER H, HOFFMANN L, et al. Bioaccessible and dialysable polyphenols in selected apple varieties following in vitro digestion vs. their native patterns[J]. Food Chemistry, 2012, 131(4): 1 466-1 472.
[21] SHU Y, LI J, YANG X P, et al. Effect of particle size on the bioaccessibility of polyphenols and polysaccharides in green tea powder and its antioxidant activity after simulated human digestion[J]. Journal of Food Science and Technology, 2019, 56(3): 1 127-1 133.
[22] ARGYRI K, KOMAITIS M, KAPSOKEFALOU M. Iron decreases the antioxidant capacity of red wine under conditions of in vitro digestion[J]. Food Chemistry, 2006, 96(2): 281-289.
[23] 郑慧, 郑淘, 王睿捷, 等. 粉碎粒径对油菜蜂花粉在体外模拟消化中多酚含量及发酵产酸的影响[J]. 食品与发酵工业, 2019, 45(7): 59-64.
ZHENG H, ZHENG T, WANG R J, et al. Effects of particle size of rape bee pollen on polyphenols contents and acids production during in vitro digestion[J]. Food and Fermentation Industries, 2019, 45(7): 59-64.
[24] TENORE G C, CAMPIGLIA P, GIANNETTI D, et al. Simulated gastrointestinal digestion, intestinal permeation and plasma protein interaction of white, green, and black tea polyphenols[J]. Food Chemistry, 2015, 169: 320-326.
[25] 李俶, 王谢祎, 翟宇鑫, 等. 多酚化合物体外模拟消化的稳定性分析[J]. 食品科学, 2016, 37(13): 1-5.
LI T, WANG X Y, ZHAI Y X, et al. Stability of polyphenols during in vitro digestion[J]. Food Science, 2016, 37(13): 1-5.
[26] CHANDRASEKARA A, SHAHIDI F. Bioaccessibility and antioxidant potential of millet grain phenolics as affected by simulated in vitro digestion and microbial fermentation[J]. Journal of Functional Foods, 2012, 4(1): 226-237.
[27] DONG R H, LIU S, ZHENG Y T, et al. Release and metabolism of bound polyphenols from carrot dietary fiber and their potential activity in in vitro digestion and colonic fermentation[J]. Food & Function, 2020, 11(7): 6 652-6 665.
[28] 邹青飞, 杨士花, 李永强, 等. 体外结肠发酵对青稞膳食纤维中酚类化合物的含量及抗氧化活性的影响[J]. 食品科学, 2020, 41(2): 94-100.
ZOU Q F, YANG S H, LI Y Q, et al. Effects of in vitro colonic fermentation on phenolic content and antioxidant activity in dietary fiber from highland barley[J]. Food Science, 2020, 41(2): 94-100.
[29] ALQURASHI R M, ALARIFI S N, WALTON G E, et al. In vitro, approaches to assess the effects of açai (Euterpe oleracea) digestion on polyphenol availability and the subsequent impact on the faecal microbiota[J]. Food Chemistry, 2017, 234: 190-198.
[30] WANG B N, HUANG Q Y, VENKITASAMY C, et al. Changes in phenolic compounds and their antioxidant capacities in jujube (Ziziphus jujuba Miller) during three edible maturity stages[J]. LWT-Food Science and Technology, 2016, 66: 56-62.
[31] ESPIN J C, GONZ LEZ-SARR
LEZ-SARR AS A, TOM
AS A, TOM S-BARBER
S-BARBER N F A. The gut microbiota: A key factor in the therapeutic effects of (poly) phenols[J]. Biochemical Pharmacology, 2017, 139: 82-93.
N F A. The gut microbiota: A key factor in the therapeutic effects of (poly) phenols[J]. Biochemical Pharmacology, 2017, 139: 82-93.