颜色是红葡萄酒主要的感官特征之一,是葡萄酒质量控制的关键参数,影响着产品的品质和消费者的评价[1]。花色苷作为红葡萄酒颜色的重要物质基础,其含量和组成直接影响着红葡萄酒的色泽特点及颜色稳定性[2]。然而花色苷不稳定,易受多种因素影响(温度、光线、pH、溶剂和氧化剂等),从而使红葡萄酒的颜色发生改变甚至失色,进而影响其质量[3]。研究发现,辅色作用作为一种绿色、自然、安全的食品增色方法,不仅可对新鲜红葡萄酒颜色有积极影响,对陈年葡萄酒的色泽也有一定贡献[4]。因此,辅色作用越来越多地被科研人员关注,目前已成为葡萄酒化学领域研究的热点[5-7]。
常见的辅色作用可分为分子内辅色、分子间辅色和自聚合作用。此外,葡萄酒中存在的一些金属离子也可与部分花色苷通过络合形式来稳定葡萄酒的颜色(金属离子辅色)[8]。多见报道的金属离子有Sn2+、Cu2+、Fe3+、Fe2+、Al3+、Mg2+和K+等[9]。CZIBULYA等[6]研究发现,在红葡萄酒中添加K+和Ca2+可提高其颜色的热稳定性,且K+还可以提高溶液体系的颜色强度。而利用不同金属离子处理刺葡萄皮色素溶液后发现,Ca2+、Zn2+、Al3+和Fe3+等产生的作用效果存在明显的不同,其中Ca2+、Zn2+和Al3+等的辅色效果随离子浓度的升高逐渐增强,而Fe3+则会使色素溶液产生黑褐色沉淀,失去花色苷的特性[10-11]。
辅色效果不仅与参与的辅色因子种类有关,也受反应溶液基质效应的影响,例如溶液pH、乙醇含量、反应体系温度[8]、以及其他基质物质[12]等。与仅添加羟基肉桂酸的处理相比,Al3+的添加会使其与花色苷之间的相互作用增强,使色素溶液呈现更明显的蓝-紫色色泽[13]。Al3+和Fe3+不仅可使紫薯花色苷提取液在近中性的条件下(pH=6.0~8.5)呈现蓝-紫色特征,还可减缓体系中因咖啡酸氧化造成的色素降解[14]。此外,有研究发现,在花色苷溶液中添加Fe2+可增加鞣花酸与花色苷配合物的稳定性,但其三价态结构(Fe3+)却可与鞣花酸形成配合物,从而导致鞣花酸的辅色效果降低[15]。
虽然目前对葡萄酒辅色作用的研究已有一定数量的报道,但多数文献集中在酚类辅色物质方面,对涉及金属离子的辅色研究目前还很有限[7-8],特别是有关金属离子和酚类物质共同参与的辅色反应更是鲜有报道。考虑到真实葡萄酒溶液中基质物质的复杂性,本试验拟采用紫外-可见分光光度法和CIELab颜色空间法,测定和分析K+、Mg2+和Al3+等葡萄酒中常见金属元素在不同浓度及不同酚酸(香草酸和原儿茶酸)条件下的辅色效果,以期为金属辅色化作用在葡萄酒颜色品质方面的研究提供一定的数据参考。
花青素-3-O-葡萄糖苷(葡萄酒中常见的单体花色苷及自然界中最主要的花色苷之一,纯度≥95%),上海源叶生物科技有限公司;氯化钾(纯度≥99.99%)、氯化镁六水合物(纯度99.99%)、氯化铝六水合物(纯度99%),上海麦克林生化科技有限公司;氯化钠、酒石酸(分析纯),天津市光复科技发展有限公司;氢氧化钠(分析纯)、无水乙醇(色谱纯),烟台市双双化工有限公司。
T9CS 双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;PHS-3E pH计,上海雷磁有限责任公司;DKT-100干式恒温器,杭州米欧仪器有限公司;涡旋混合/振荡器,美国Scientific Industries公司;F-100S 超声波清洗机,深圳福洋科技集团有限公司。
1.2.1 模拟葡萄酒溶液配制
模拟葡萄酒溶液:酒石酸(5 g/L),12%vol乙醇,加入氯化钠调整离子强度至0.2 mol/L,用强酸强碱调整pH为3.6,置于容量瓶保存备用[16]。
1.2.2 不同金属离子对花色苷颜色的影响
准确称取花青素-3-O-葡萄糖苷0.009 7 g于100 mL容量瓶,并用上述配制的模拟葡萄酒溶液进行溶解定容,使其浓度为0.2 mmol/L。用同样的方法溶解辅色素氯化钾、氯化镁、氯化铝(浓度均为0.2、1.0、10.0、20.0 mmol/L),与花色苷溶液各1 mL等体积混合,得到花色苷/辅色素摩尔浓度比为1∶0、1∶1、1∶5、1∶50、1∶100 的模拟酒溶液。将混合液置在恒温器中20 ℃下避光反应30 min后测定,以纯净水作为空白。
1.2.3 添加酚酸对不同金属离子辅色的影响
不同浓度酚酸溶液配制:用配制的模拟葡萄酒溶液(100 mL)溶解花青素-3-O-葡萄糖苷(0.013 6 g),使其浓度为0.3 mmol/L,使用同样的方法对3种金属离子辅色素和香草酸及原儿茶酸进行溶解(0.3、1.5、7.5、15、30 mmol/L),使用花色苷、金属离子、酚酸溶液各1 mL加入离心管,配制成花色苷/酚酸/金属离子摩尔比为1∶0∶0、1∶25∶0、1∶25∶1、1∶25∶5、1∶25∶50、1∶25∶100的模拟葡萄酒溶液,将混合液置于恒温器中20 ℃下避光反应30 min后测定,以纯净水作为空白。
同理,按照上述方法配制花色苷/金属离子/酚酸摩尔比为1∶0∶0、1∶25∶0、1∶25∶1、1∶25∶5、1∶25∶50、1∶25∶100 的模拟酒溶液,将混合液置于恒温器中20 ℃ 下避光反应30 min后测定,以纯净水作为空白。
通过比较最大吸收波长下吸光值增加的百分比M以及最大吸光值对应的波长λmax的偏移估计辅色作用产生的增色效应(M)和红移效应(Δλ)[17],如公式(1)、公式(2)所示。
(1)
Δλ=λ-λmax
(2)
式中:A、A0分别为515 nm处添加辅色素的模拟酒溶液与对照组吸光度值;λ为偏移后的最大吸收波长。
使用紫外可见分光光度计,以纯净水作为空白,在2 mm路径比色皿中进行400~700 nm的全波长扫描,扫描间隔为1 nm。计算相应的透光率,再依据GB/T 7921—2008 均匀色空间和色差公式,在D65和10°的观察条件下,计算CIE 1976(L* a* b*)色空间的颜色参数![]() 和ΔE),并计算亮度,色度和色调对总色差的相对贡献ΔL、ΔC、ΔH[17],计算方法如公式(3)~公式(7)所示。
和ΔE),并计算亮度,色度和色调对总色差的相对贡献ΔL、ΔC、ΔH[17],计算方法如公式(3)~公式(7)所示。
(3)
(4)
(5)
(6)
(7)
采用Microsoft Office Excel 2010 进行数据处理,Origin 2018绘图,IBM SPSS Statistics 25对数据进行方差分析,利用Duncan’s多重比较在置信区0.05下对数据进行差异显著性分析。
2.1.1 金属离子对模拟葡萄酒辅色作用的影响
一般来说,辅色作用的特征主要是增色(M)和(或)红移(Δλ)变化[4]。由表1数据可知,随着金属离子溶度的增加,模拟葡萄酒溶液表现出明显的增色变化,其中Al3+的作用效果最强(M=3.48%~23.24%),其次为Mg2+(M=0.86%~8.58%),而K+的效果相对较弱(M=0.09%~0.12%)。特别是在摩尔比为1∶100时,Al3+的增色强度是初始时(1∶1,摩尔浓度比,下同)的6.68倍,相比同浓度的K+和Mg2+,较后者高出99.48%和63.08%,呈现Al3+>Mg2+>K+的趋势,表现出较高价态的金属辅色因子可能具有较好作用效果的现象。这一结果与LI等[18]的研究发现相似,推测可能与高价态金属离子易与花色苷B环上的游离羟基结合有关[19]。而比较添加处理产生的红移量发现,Al3+处理可使模拟葡萄酒溶液产生明显的红移变化(Δλ=3~7 nm),而K+和Mg2+处理后却未表现出红移现象(Δλ=0 nm),这也在一定程度上进一步印证了上述结果所表现出的辅色效果趋势。
表1 金属离子对模拟葡萄酒增色(M)和红移效应(Δλ)的影响
Table 1 The hyperchromic effect (M) and bathochromic shift (Δλ) of different metal ions on simulated wine solution
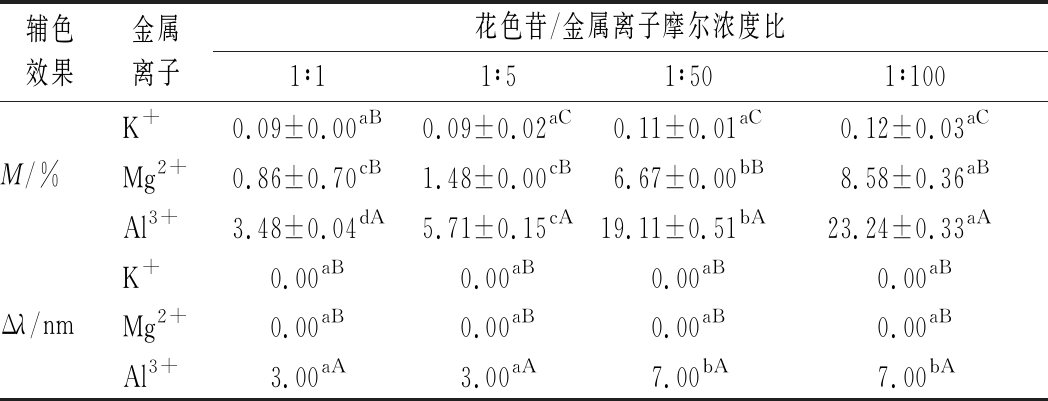
辅色效果金属离子花色苷/金属离子摩尔浓度比1∶11∶51∶501∶100K+0.09±0.00aB0.09±0.02aC0.11±0.01aC0.12±0.03aCM/%Mg2+0.86±0.70cB1.48±0.00cB6.67±0.00bB8.58±0.36aBAl3+3.48±0.04dA5.71±0.15cA19.11±0.51bA23.24±0.33aAK+0.00aB0.00aB0.00aB0.00aBΔλ/nmMg2+0.00aB0.00aB0.00aB0.00aBAl3+3.00aA3.00aA7.00bA7.00bA
注:不同小写字母代表同一离子不同摩尔比之间存在显著差异(表3、表4同),不同大写字母代表同一摩尔比不同离子间存在显著差异(P<0.05)
2.1.2 金属离子对模拟葡萄酒CIELab颜色参数的影响
由表2数据结果可知,添加供试金属离子对模拟葡萄酒溶液的呈色也产生积极影响。例如,同未添加的对照溶液相比![]() 分别为94.30、12.47、-0.58、12.48、-0.05 a.u.),随着金属离子浓度的增加,Al3+和Mg2+处理可明显降低溶液的L*值(94.30~91.02 a.u.和94.30~93.80 a.u.)和b*值(-0.58~4.03 a.u.和-0.05~-0.25 a.u.),并使溶液的a*和
分别为94.30、12.47、-0.58、12.48、-0.05 a.u.),随着金属离子浓度的增加,Al3+和Mg2+处理可明显降低溶液的L*值(94.30~91.02 a.u.和94.30~93.80 a.u.)和b*值(-0.58~4.03 a.u.和-0.05~-0.25 a.u.),并使溶液的a*和![]() 增加(12.47~15.59 a.u.和12.47~13.63 a.u.,12.84~16.11 a.u.和12.84~13.64 a.u.)。一般而言,L*值的降低是由增色效应导致,而b*值的改变则主要与溶液的红移变化有关[17]。因此通过计算CIELab参数可知,添加Al3+和Mg2+的溶液显示出较为明显的暗紫红色特征。但由表2数据也可看到,对于前期辅色效果较差的K+而言,所表现出的颜色变化却相对有限,与对照溶液相比,L*、a*和b*值的变化幅度均较小(分别为-0.07~0.01、0.09~0.14、-0.03~0.05 a.u.),且
增加(12.47~15.59 a.u.和12.47~13.63 a.u.,12.84~16.11 a.u.和12.84~13.64 a.u.)。一般而言,L*值的降低是由增色效应导致,而b*值的改变则主要与溶液的红移变化有关[17]。因此通过计算CIELab参数可知,添加Al3+和Mg2+的溶液显示出较为明显的暗紫红色特征。但由表2数据也可看到,对于前期辅色效果较差的K+而言,所表现出的颜色变化却相对有限,与对照溶液相比,L*、a*和b*值的变化幅度均较小(分别为-0.07~0.01、0.09~0.14、-0.03~0.05 a.u.),且![]() 和h*也无明显变化(P<0.05)。相比于Al3+和Mg2+,K+处理样品在最高浓度时(1∶100)的L*、b*和a*值分别是前者的103.60%和100.48%、96.64%和13.15%、92.53%和80.88%。
和h*也无明显变化(P<0.05)。相比于Al3+和Mg2+,K+处理样品在最高浓度时(1∶100)的L*、b*和a*值分别是前者的103.60%和100.48%、96.64%和13.15%、92.53%和80.88%。
利用颜色色差参数![]() 可以分辨不同样品的颜色差别[3]。通过计算模拟葡萄酒溶液的
可以分辨不同样品的颜色差别[3]。通过计算模拟葡萄酒溶液的![]() 发现,随添加离子浓度的升高,样品间的颜色差异也逐渐增大(K+、Mg2+和Al3+处理较对照分别提高了0.03~0.06、0.12~1.04、0.42~5.29 a.u.),但不同金属离子所产生的效果不同。例如,Al3+处理在浓度为1∶50时便可与对照表现出较为明显的视觉差别
发现,随添加离子浓度的升高,样品间的颜色差异也逐渐增大(K+、Mg2+和Al3+处理较对照分别提高了0.03~0.06、0.12~1.04、0.42~5.29 a.u.),但不同金属离子所产生的效果不同。例如,Al3+处理在浓度为1∶50时便可与对照表现出较为明显的视觉差别![]() 但对Mg2+,其在1∶50浓度时的
但对Mg2+,其在1∶50浓度时的![]() 为0.95 a.u.,比前者低74.53%(P<0.05),甚至当Mg2+在最高处理浓度时(1∶100),其
为0.95 a.u.,比前者低74.53%(P<0.05),甚至当Mg2+在最高处理浓度时(1∶100),其![]() 也仅为1.25 a.u.,比Al3+处理低78.07%(P<0.05)。而对于辅色效果相对较差的K+,其与对照溶液形成的颜色差异更小(< 0.25 a.u.)。例如,K+在浓度1∶100时的
也仅为1.25 a.u.,比Al3+处理低78.07%(P<0.05)。而对于辅色效果相对较差的K+,其与对照溶液形成的颜色差异更小(< 0.25 a.u.)。例如,K+在浓度1∶100时的![]() 分别是Al3+和Mg2+的4.21%和19.20%(P<0.05)。
分别是Al3+和Mg2+的4.21%和19.20%(P<0.05)。
为更全面地了解供试金属离子的辅色作用与模拟葡萄酒颜色间的变化关系,对其由量变(ΔL+ΔC)和质变(ΔH)因素所引起的色差(ΔE)贡献情况进行分析。结果显示(图1),K+、Mg2+和Al3+处理所造成的ΔE变化主要与量变因素有关(ΔL+ΔC=73.61~99.77),而质变因素贡献较小(ΔH=0.23%~26.81%)。同时,比较不同浓度处理的样品发现,当金属离子的添加浓度较低时(<1∶5),色度变化(ΔC)在量变因素中的作用较高(>60.00%),但随着金属离子添加浓度的增加,由于色调变化(ΔH)的逐渐增强,特别是Al3+处理,使得ΔH所占比例相应提高,导致质变对色差的贡献由初始的3.68%升高至26.81%。
表2 金属离子对模拟葡萄酒CIELab参数的影响
Table 2 The effect of different metal ions on CIELab parameters of simulated wine solution

颜色参数α金属离子花色苷/金属离子摩尔浓度比1∶01∶11∶51∶501∶100K+94.30±0.04aA94.31±0.03aA94.23±0.05abA94.27±0.03abA94.29±0.01abAL*Mg2+94.30±0.04aA94.22±0.10abA94.20±0.02bA93.91±0.03cB93.84±0.03cBAl3+94.30±0.04aA94.08±0.07bA93.84±0.04cB92.35±0.05deC91.02±0.02eCK+12.47±0.05abA12.38±0.06abA12.63±0.02aB12.66±0.06aC12.61±0.10aCa*Mg2+12.47±0.05eA12.66±0.05dA12.77±0.09cB13.33±0.05bB13.63±0.06aBAl3+12.47±0.05eA12.78±0.09dA13.09±0.08cA14.38±0.01bA15.59±0.05aAK+-0.58±0.04aA-0.61±0.06aA-0.54±0.07aA-0.51±0.06aA-0.53±0.05aAb*Mg2+-0.58±0.04aA-0.57±0.04aA-0.59±0.04aA-0.60±0.02aA-0.56±0.04aAAl3+-0.58±0.04aA-0.67±0.05aA-0.88±0.06bB-2.55±0.06cB-4.03±0.07dBK+12.48±0.05abA12.39±0.06abA12.65±0.02aB12.67±0.06aA12.62±0.10aCC*abMg2+12.48±0.05eA12.67±0.05dA12.78±0.09cB13.35±0.05bB13.64±0.06aBAl3+12.48±0.05eA12.8±0.09dA13.12±0.08cA14.60±0.00bA16.11±0.05aAK+-0.05±0.00aA-0.05±0.00aA-0.04±0.01aA-0.04±0.00aA-0.04±0.00aAhabMg2+-0.05±0.00aA-0.04±0.00aA-0.05±0.00aA-0.05±0.01aA-0.04±0.00aAAl3+-0.05±0.00aA-0.05±0.00aA-0.07±0.00bB-0.18±0.01cB-0.25±0.01dBK+/0.18±0.06aB0.21±0.02aC0.21±0.02aC0.24±0.10aCΔE*abMg2+/0.21±0.08cB0.33±0.11cB0.95±0.01bB1.25±0.05aBAl3+/0.41±0.04dA0.83±0.10cA3.37±0.03bA5.70±0.08aA
注:α表示表中数据的单位为a.u.(下同);同一行中不同小写字母表示同一离子不同摩尔比之间存在显著差异,不同大写字母代表不同金属离子存在显著差异(表5同)(P<0.05)

a-K+;b-Mg2+;c-Al3+
图1 金属离子对模拟葡萄酒ΔE的影响
Fig.1 The effect of different metal ions on ΔE of simulated wine solution
2.2.1 酚酸添加对含金属离子模拟葡萄酒辅色作用的影响
酚类物质是葡萄酒溶液中常见辅色因子,同时也是酒中重要的基质组分[8]。因此在上文试验的基础上,通过在模拟体系中添加固定浓度的酚酸(香草酸和原儿茶酸,其与花色苷的摩尔浓度比为1∶25),以此来初步研究基质中酚类成分对金属离子辅色效果的影响。比较表1和表3数据可知,对于含Al3+和K+的模拟葡萄酒溶液来说,酚酸的加入可使原溶液的辅色效果进一步增强(4.26%~10.70%和0.87%~27.85%)。而比较不同结构的酚酸发现,香草酸和原儿茶酸所产生的效果有所区别。对于含Al3+和K+的溶液来说,香草酸所产生的增色和红移效果较同浓度的原儿茶酸高6.38%~65.01%和30.00%~66.67%。研究发现,酚酸化合物结构中的取代基团种类和数量会影响其辅色能力的大小,当酚环中羟基被甲氧基取代时,相同类型酚酸的辅色作用效果会明显提高[20-21]。因此,比较香草酸(3-甲氧基-4-羟基苯甲酸)和原儿茶酸(3, 4-二羟基苯甲酸)的化学结构可知,香草酸的辅色能力要强于后者,这同样也解释了本试验所观察到的结果。
与Al3+和K+的表现相异,试验发现在含Mg2+的模拟葡萄酒溶液中加入酚酸后,并未产生类似前者的现象。相反,当Mg2+添加量<1∶50时,酚酸处理可使模拟葡萄酒的吸光值下降11.04%~22.19%,呈现出一定程度的“减色效应”(即反辅色作用)[22]。不过值得注意的是,当Mg2+浓度升至1∶100时,其溶液的吸光值会出现一定的回复现象(14.32%)。BOULTON[4]研究认为,在复杂的溶液体系中,辅色现象是体系中各类辅色因子竞争平衡的结果。各辅色因子的浓度高低,以及与花色苷结合能力的强弱将决定反应体系最终的辅色效果和观察到的颜色特征。例如,在含花色苷-辅色因子的溶液体系中加入葡萄籽粗体物,会破坏已建立的辅色平衡,造成溶液体系光吸收值的降低,产生“反辅色作用”[20]。比较本试验中Mg2+和酚酸处理,我们认为,酚酸的加入可能会破坏原本由Mg2+和花色苷所建立的辅色体系(推测酚酸与Mg2+可能会产生结合),导致溶液体系增色效果的丧失。但当Mg2+浓度超过一定数量后(即酚酸与Mg2+的结合达到饱和),剩余的Mg2+会继续与花色苷反应,再次产生溶液吸光值的增加。不过相关的机制原因还需做进一步的研究。
表3 酚酸添加对含金属离子模拟葡萄酒增色(M)和红移效应(Δλ)的影响
Table 3 The hyperchromic effect (M) and bathochromic shift (Δλ) of different phenolic acids on the pigment/metal ion simulated wine solution
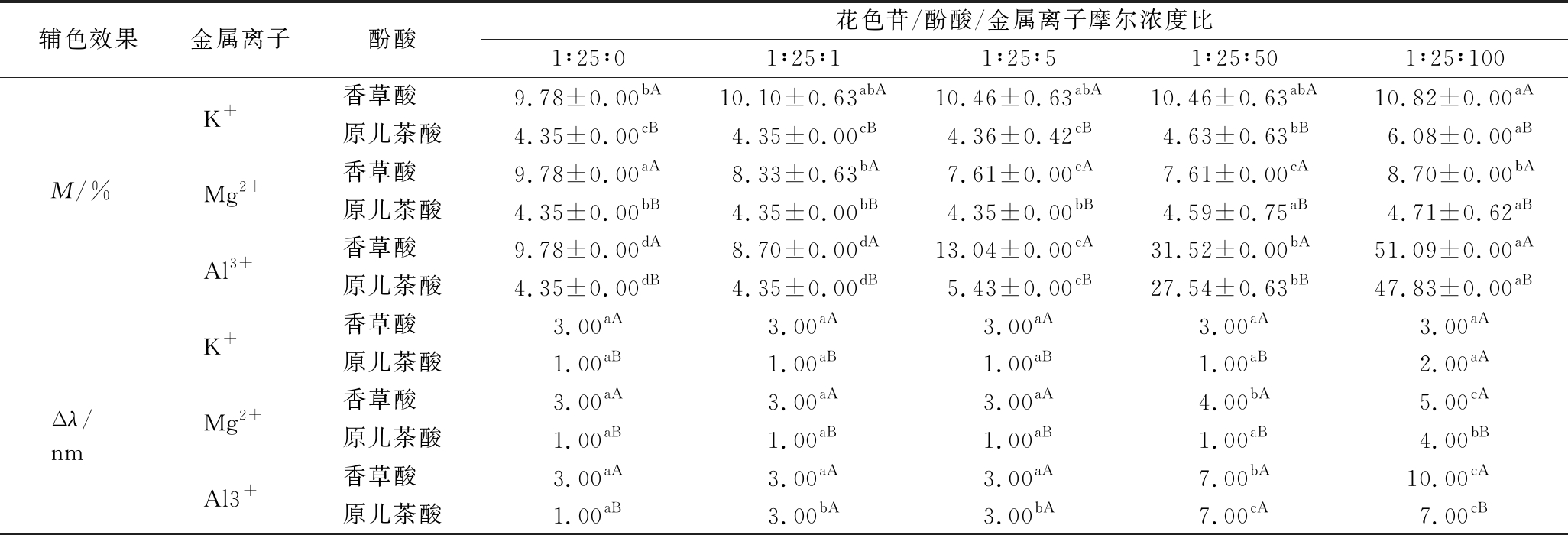
辅色效果金属离子酚酸花色苷/酚酸/金属离子摩尔浓度比1∶25∶01∶25∶11∶25∶51∶25∶501∶25∶100K+香草酸 9.78±0.00bA10.10±0.63abA10.46±0.63abA10.46±0.63abA10.82±0.00aA原儿茶酸4.35±0.00cB4.35±0.00cB4.36±0.42cB4.63±0.63bB6.08±0.00aBM/%Mg2+香草酸 9.78±0.00aA8.33±0.63bA7.61±0.00cA7.61±0.00cA8.70±0.00bA原儿茶酸4.35±0.00bB4.35±0.00bB4.35±0.00bB4.59±0.75aB4.71±0.62aBAl3+香草酸 9.78±0.00dA8.70±0.00dA13.04±0.00cA31.52±0.00bA51.09±0.00aA原儿茶酸4.35±0.00dB4.35±0.00dB5.43±0.00cB27.54±0.63bB47.83±0.00aBK+香草酸 3.00aA3.00aA3.00aA3.00aA3.00aA原儿茶酸1.00aB1.00aB1.00aB1.00aB2.00aAΔλ/nmMg2+香草酸 3.00aA3.00aA3.00aA4.00bA5.00cA原儿茶酸1.00aB1.00aB1.00aB1.00aB4.00bBAl3+香草酸 3.00aA3.00aA3.00aA7.00bA10.00cA原儿茶酸1.00aB3.00bA3.00bA7.00cA7.00cB
注:不同大写字母代表同一摩尔比不同酚酸处理存在显著差异(P<0.05)(表4同)
2.2.2 酚酸添加对含金属离子模拟葡萄酒CIELab颜色参数的影响
酚酸的加入对含金属离子的模拟葡萄酒溶液呈色也会产生影响。比较表2和表4数据可知,添加酚酸后随着离子摩尔浓度的升高,Al3+和K+处理溶液的L*值呈降低趋势(下降0.22~1.84 a.u.和0.45~0.95 a.u)、a*和![]() 值均为上升变化(升高0.73~3.86 a.u.和1.10~1.83 a.u.,以及0.73~3.94 a.u.和1.09~1.83 a.u.),使溶液呈现出深红色特征,并最终使
值均为上升变化(升高0.73~3.86 a.u.和1.10~1.83 a.u.,以及0.73~3.94 a.u.和1.09~1.83 a.u.),使溶液呈现出深红色特征,并最终使![]() 值提高(0.73~1.68 a.u.和0.58~3.85 a.u.)。同时,香草酸所产生的效果要优于原儿茶酸,例如,在浓度为1∶25∶100(花色苷/酚酸/金属离子)时,添加香草酸的Al3+处理溶液比使用原儿茶酸的样品L*值低0.48 a.u.(P<0.05),而a*和
值提高(0.73~1.68 a.u.和0.58~3.85 a.u.)。同时,香草酸所产生的效果要优于原儿茶酸,例如,在浓度为1∶25∶100(花色苷/酚酸/金属离子)时,添加香草酸的Al3+处理溶液比使用原儿茶酸的样品L*值低0.48 a.u.(P<0.05),而a*和![]() 值高出0.51 a.u.和0.48 a.u.(P<0.05)。但对含Mg2+的模拟葡萄酒溶液我们试验发现,当其浓度在<1∶50 mol/L时,酚酸的加入将导致L*的升高(0.04~0.10 a.u.),以及a*和
值高出0.51 a.u.和0.48 a.u.(P<0.05)。但对含Mg2+的模拟葡萄酒溶液我们试验发现,当其浓度在<1∶50 mol/L时,酚酸的加入将导致L*的升高(0.04~0.10 a.u.),以及a*和![]() 的降低(0.04~0.15 a.u.和0.03~0.23 a.u.),表现出淡红色状态。同时,分析溶液的
的降低(0.04~0.15 a.u.和0.03~0.23 a.u.),表现出淡红色状态。同时,分析溶液的![]() 值发现,酚酸的添加可以增大金属离子处理样品的色差效果,与仅含金属离子的模拟葡萄酒溶液相比,添加香草酸和原儿茶酸的样品平均较原溶液分别提高了3.80和2.00倍。
值发现,酚酸的添加可以增大金属离子处理样品的色差效果,与仅含金属离子的模拟葡萄酒溶液相比,添加香草酸和原儿茶酸的样品平均较原溶液分别提高了3.80和2.00倍。
分析图2可知,添加酚酸并未改变金属离子辅色所造成的颜色贡献效果,仍然表现为量变因素(ΔL%+ΔC%>80%)大于质变因素(ΔH%<20%)的特征,但在程度上有所差别。例如,酚酸处理使ΔL%的反应效果由仅加入金属离子时的2.24%~33.59%,变化为酚酸和金属离子共同作用时的7.87%~26.62%。此外,不同的金属离子与酚类组合产生的效果也不相同,例如与仅添加Al3+的模拟葡萄酒体系相比,Al3+与香草酸共同处理的样品,其量变因素对ΔE的贡献较前者增加了1.86%~13.56%。而Al3+与原儿茶酸共同处理的溶液,却表现出在低浓度时(花色苷/酚酸/金属离子≤1∶25∶5)量变因素降低(较单独使用Al3+的溶液降低10.34%~14.15%),在高浓度时量变效果增加(较单独使用Al3+的溶液提高8.48%~9.73%)的现象。但是对于Mg2+处理,添加酚酸将减弱量变对色差的作用效果(香草酸和原儿茶酸添加分别造成0.59%~2.03%和0.23%~3.59%的下降)。
表4 酚酸添加对含金属离子模拟葡萄酒CIELab颜色参数的影响
Table 4 The effect of different phenolic acids on CIELab parameters of the pigment/metal ion simulated wine solution

颜色参数金属离子酚酸花色苷/酚酸/金属离子摩尔浓度比1∶0∶01∶25∶01∶25∶11∶25∶51∶25∶501∶25∶100K+香草酸 94.10±0.03aA93.51±0.03cB93.38±0.02bB93.39±0.05bB93.29±0.02cB93.34±0.01bcB原儿茶酸94.10±0.03aA93.86±0.04bA93.75±0.04cA93.71±0.03cA93.68±0.01cA93.58±0.01dAL*Mg2+香草酸 94.10±0.03aA93.51±0.03cB93.55±0.03bcB93.61±0.03bB93.57±0.02bB93.51±0.03cB原儿茶酸94.10±0.03aA93.86±0.04bA93.83±0.02bA93.84±0.03bA93.86±0.02bA93.83±0.06bAAl3+香草酸 94.10±0.03aA93.51±0.01bB93.47±0.03bB93.22±0.03cB91.14±0.02dB89.18±0.07eB原儿茶酸94.10±0.03aA93.86±0.04bA93.79±0.05cA93.58±0.05dA91.41±0.05eA89.56±0.03fAK+香草酸 12.69±0.10cA14.18±0.08bA14.19±0.11bA14.30±0.13bcA14.25±0.05bA14.44±0.04aA原儿茶酸12.69±0.10dA13.39±0.08bB13.48±0.03cB13.58±0.06bcB13.77±0.03aB13.84±0.10aBa*Mg2+香草酸 12.69±0.10dA14.18±0.06abA14.14±0.06cA14.03±0.11cA14.04±0.05bcA14.20±0.07aA原儿茶酸12.69±0.10cA13.39±0.06bB13.39±0.08bB13.41±0.05bB13.47±0.11abB13.59±0.02aBAl3+香草酸 12.69±0.10fA14.25±0.05dA14.00±0.13eA14.45±0.10cA16.95±0.04bA19.45±0.04aA原儿茶酸12.69±0.10eA13.39±0.06dB13.51±0.06dB13.76±0.09cB16.68±0.11bB18.94±0.06aBK+香草酸 -0.25±0.04aA-0.42±0.07bA-0.39±0.12abB-0.36±0.04abA-0.35±0.04abA-0.45±0.09bA原儿茶酸-0.25±0.04aA-0.39±0.06bA-0.21±0.10aA-0.42±0.09bA-0.32±0.10abA-0.41±0.05bAb*Mg2+香草酸 -0.25±0.04aA-0.46±0.09bA-0.48±0.09bB-0.52±0.12bB-0.51±0.04bA-0.52±0.06bB原儿茶酸-0.25±0.04aA-0.51±0.12bB-0.36±0.06abA-0.42±0.04bcA-0.51±0.05cA-0.47±0.02bcAAl3+香草酸 -0.25±0.04aA-0.47±0.08bA-0.49±0.04bA-0.76±0.04cA-2.77±0.04dA-4.84±0.10eA原儿茶酸-0.25±0.04aA-0.51±0.12bB-0.70±0.13cB-0.93±0.07dB-3.09±0.02eB-4.92±0.09fBK+香草酸 12.69±0.10cA14.24±0.08bA14.20±0.11bA14.31±0.13abA14.25±0.04bA14.45±0.05aA原儿茶酸12.69±0.10dA13.40±0.06bB13.49±0.03cB13.59±0.07bcB13.77±0.03aB13.85±0.10aBC*abMg2+香草酸 12.69±0.10dA14.24±0.08abA14.01±0.07bA14.04±0.12bcA14.05±0.04bcA14.21±0.08aA原儿茶酸12.69±0.10cA13.40±0.06bB13.40±0.08bB13.42±0.05bB13.48±0.11abB13.60±0.02aBAl3+香草酸 12.69±0.10fA14.24±0.05dA14.01±0.13eA14.46±0.10cA17.17±0.04bA20.05±0.06aA原儿茶酸12.69±0.10eA13.4±0.06dB13.53±0.06dB13.79±0.09cB16.97±0.12bB19.57±0.07aBK+香草酸 -0.02±0.00aA-0.03±0.00abA-0.03±0.01abA-0.03±0.00abA-0.02±0.00abA-0.03±0.01abA原儿茶酸-0.02±0.00aA-0.03±0.00abA-0.02±0.01aA-0.03±0.01abA-0.02±0.01aA-0.03±0.00abAhabMg2+香草酸 -0.02±0.00aA-0.03±0.01abA-0.03±0.01abA-0.04±0.01bA-0.04±0.00bA-0.04±0.00bA原儿茶酸-0.02±0.00aA-0.04±0.01bA-0.03±0.00abA-0.03±0.00abA-0.04±0.00bA-0.03±0.00abAAl3+香草酸 -0.02±0.00aA-0.03±0.01abA-0.03±0.00abA-0.05±0.00cA-0.16±0.00dA-0.24±0.00eA原儿茶酸-0.02±0.00aA-0.04±0.01bB-0.05±0.01cB-0.07±0.01dB-0.18±0.00eB-0.25±0.00fBK+香草酸 /1.69±0.17aA1.64±0.05aA1.77±0.23aA1.71±0.16aA1.92±0.05aA原儿茶酸/0.99±0.10cB0.91±0.13cB0.99±0.12bcB1.17±0.11abB1.29±0.14aBΔE*abMg2+香草酸 /1.69±0.17aA1.45±0.07aA1.46±0.15aA1.48±0.10aA1.65±0.10aA原儿茶酸/0.99±0.10aB0.77±0.10aB0.79±0.10aB0.86±0.09aB0.97±0.14aBAl3+香草酸 /1.69±0.17dA1.48±0.10dA2.02±0.12cA5.77±0.11bA9.55±0.12aA原儿茶酸/0.99±0.10edB0.99±0.19cdB1.37±0.22cB5.59±0.02bB9.03±0.15aB
2.2.3 酚酸浓度对含金属离子模拟葡萄酒辅色作用的影响
为了明确酚酸在不同浓度水平下的作用,试验在固定金属离子添加比例的基础上(金属离子与花色苷的摩尔浓度比为1∶25)继续做进一步的研究。由表5试验结果可知,随着酚酸浓度的增加,含Al3+模拟葡萄酒溶液所产生的增色效果逐渐增强(M=9.78%~53.99%)(P<0.05)。但是对含K+和Mg2+的模拟酒溶液,其光吸收值却表现出先降低后升高的变化趋势,这使得酚酸添加量在≤1∶25∶5(花色苷/金属离子/酚酸)时将出现减色现象,特别当浓度为1∶25∶1时,与仅添加金属离子的样品(花色苷/金属离子/酚酸摩尔浓度比1∶25∶0)相比,前者的吸光度分别降低1.48%(香草酸/K+)和4.35%(香草酸/Mg2+),0.72%(原儿茶酸/K+)和5.44%(原儿茶酸/Mg2+)。此外,随着酚酸浓度的逐步升高,各样品的红移量也逐渐增大(Δλ=1~10 nm),并在最高添加浓度时效果最强,这与先前的研究相似[8]。

a-K+添加香草酸;b-Mg2+添加香草酸;c-Al3+添加香草酸;d-K+添加原儿茶酸;e-Mg2+添加原儿茶酸;f-Al3+添加原儿茶酸
图2 酚酸添加对含金属离子模拟葡萄酒ΔE的影响
Fig.2 The effect of different phenolic acids on ΔE of the pigment/metal ion simulated wine solution
表5 不同酚酸浓度对含金属离子模拟葡萄酒增色(M)和红移效应(Δλ)的影响
Table 5 The hyperchromic effect (M) and bathochromic shift (Δλ) of different phenolic acid concentrations on the pigment/metal ion simulated wine solution
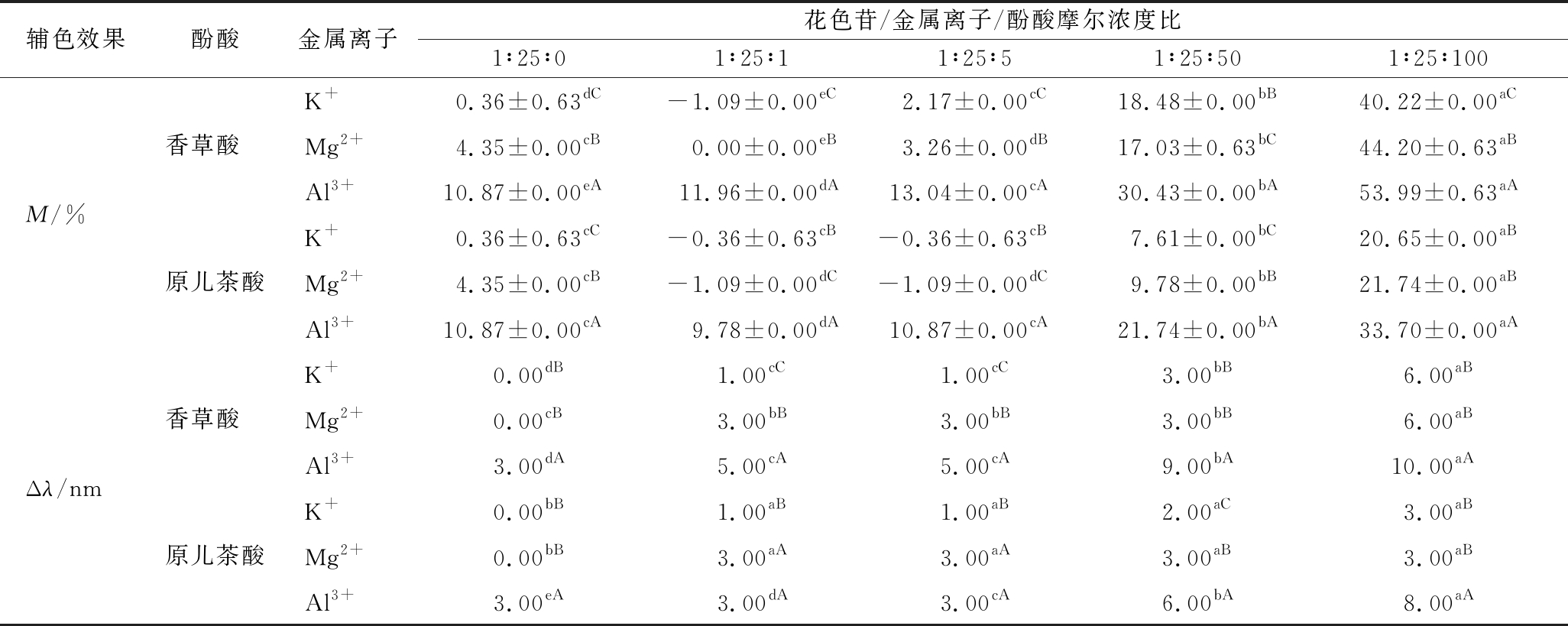
辅色效果酚酸金属离子花色苷/金属离子/酚酸摩尔浓度比1∶25∶01∶25∶11∶25∶51∶25∶501∶25∶100K+0.36±0.63dC-1.09±0.00eC2.17±0.00cC18.48±0.00bB40.22±0.00aC香草酸 Mg2+4.35±0.00cB0.00±0.00eB3.26±0.00dB17.03±0.63bC44.20±0.63aBM/%Al3+10.87±0.00eA11.96±0.00dA13.04±0.00cA30.43±0.00bA53.99±0.63aAK+0.36±0.63cC-0.36±0.63cB-0.36±0.63cB7.61±0.00bC20.65±0.00aB原儿茶酸Mg2+4.35±0.00cB-1.09±0.00dC-1.09±0.00dC9.78±0.00bB21.74±0.00aBAl3+10.87±0.00cA9.78±0.00dA10.87±0.00cA21.74±0.00bA33.70±0.00aAK+0.00dB1.00cC1.00cC3.00bB6.00aB香草酸 Mg2+0.00cB3.00bB3.00bB3.00bB6.00aBΔλ/nmAl3+3.00dA5.00cA5.00cA9.00bA10.00aAK+0.00bB1.00aB1.00aB2.00aC3.00aB原儿茶酸Mg2+0.00bB3.00aA3.00aA3.00aB3.00aBAl3+3.00eA3.00dA3.00cA6.00bA8.00aA
2.2.4 酚酸浓度对含金属离子模拟葡萄酒CIELab颜色参数的影响
分析表6数据可知,相比于未添加任何辅色因子的模拟葡萄酒样品(花色苷/金属离子/酚酸摩尔浓度比1∶0∶0)而言,在含Al3+的模拟酒中改变酚酸的添加浓度,将使其L*和b*值降低(分别降低了1.43~4.26 a.u.和1.28~1.98 a.u.,P<0.05),a*值增加(1.53~7.37%)。但是对于含Mg2+和K+的样品却只有在酚酸浓度>1∶25∶5(花色苷/金属离子/酚酸)时才能产生类似的效果(L*值和b*值降低0.57~2.51 a.u.和0.22~0.51 a.u.,a*值增加1.49~6.16 a.u.)。同时,与前述的结果相似,添加香草酸的溶液仍表现出较好的效果。例如,与添加原儿茶酸的金属辅色溶液相比,香草酸处理样品的颜色呈现出更深的红-紫色状态(其L*和b*值较原儿茶酸样品分别降低了1.51%和6.73%,a*值升高了12.86%)。
表6 不同酚酸浓度对含金属离子模拟葡萄酒CIELab颜色参数的影响
Table 6 The effect of different phenolic acid concentrations on CIELab parameters of the pigment/metal ion simulated wine solution

颜色参数α酚酸金属离子花色苷/金属离子/酚酸摩尔浓度比1∶0∶01∶25∶01∶25∶11∶25∶51∶25∶501∶25∶100K+94.10±0.03bA94.07±0.00bA94.17±0.00aA93.97±0.03cA93.00±0.04dA91.59±0.02eA香草酸Mg2+94.10±0.03aA93.90±0.02bB94.06±0.01aB93.91±0.05bA93.03±0.03cA91.44±0.01dBL*Al3+94.10±0.03aA92.85±0.02bC92.87±0.01bC92.77±0.04cB91.63±0.04dB90.02±0.03eCK+94.10±0.03aA94.07±0.00bA94.14±0.04aA94.11±0.01aB93.53±0.07bA92.81±0.05cA原儿茶酸Mg2+94.10±0.03bA93.90±0.02bB94.19±0.05aA94.20±0.04aA93.52±0.05dA92.76±0.04eBAl3+94.10±0.03aA92.85±0.02bC93.05±0.00bB92.94±0.00cC92.21±0.01eB91.40±0.02fCK+12.69±0.10dA12.85±0.00cC12.54±0.00eC12.90±0.06cC15.31±0.07bB18.46±0.04aC香草酸Mg2+12.69±0.10dA13.24±0.09cB12.78±0.03dB13.27±0.00cB15.23±0.08bC18.85±0.02aBa*Al3+12.69±0.10eA14.33±0.04dA14.36±0.03dA14.51±0.04cA16.84±0.07bA20.06±0.06aAK+12.69±0.10dA12.85±0.00cC12.57±0.09dC12.65±0.02dC14.18±0.05bC15.81±0.14aC原儿茶酸Mg2+12.69±0.10dA13.24±0.09cB12.62±0.06dB12.75±0.06dB14.37±0.11bB16.02±0.12aBAl3+12.69±0.10eA14.33±0.04cA14.22±0.00dA14.26±0.00cdA15.77±0.03bA17.48±0.04aAK+-0.25±0.04aA-0.47±0.00cB-0.30±0.00abA-0.36±0.09cA-0.47±0.06cA-0.56±0.04dA香草酸Mg2+-0.25±0.04aA-0.35±0.14abA-0.24±0.10aA-0.32±0.00abA-0.47±0.07cA-0.61±0.02dAb*Al3+-0.25±0.04aA-1.63±0.04bC-1.53±0.10bB-1.62±0.13bB-1.89±0.06cB-2.08±0.06dBK+-0.25±0.04aA-0.47±0.00bB-0.21±0.09aA-0.21±0.02aA-0.61±0.04cA-0.73±0.01dA原儿茶酸Mg2+-0.25±0.04aA-0.35±0.14abA-0.45±0.05bB-0.48±0.14bcB-0.65±0.12cdA-0.76±0.06dAAl3+-0.25±0.04aA-1.63±0.04bC-1.72±0.00bC-1.69±0.00bC-1.93±0.10cB-2.23±0.04dB香草酸K+12.69±0.10dA12.66±0.00dC12.55±0.00dC12.91±0.07cC15.32±0.07bB18.47±0.04aCC*abMg2+12.69±0.10dA13.24±0.10cB12.79±0.03dB13.27±0.00cB15.24±0.08bB18.86±0.02aBAl3+12.69±0.10eA14.42±0.04dA14.45±0.04dA14.60±0.04cA16.94±0.08bA20.17±0.05aA原儿茶酸K+12.69±0.10cA12.66±0.00cC12.57±0.09cdB12.66±0.02cB14.19±0.05bB15.83±0.14aBMg2+12.69±0.10eA13.24±0.10cB12.63±0.06dB12.76±0.06dB14.38±0.12bB16.04±0.12aBAl3+12.69±0.10eA14.42±0.04cA14.32±0.00dA14.36±0.00cdA15.88±0.04bA17.62±0.04aAK+-0.02±0.00aA-0.03±0.00bA-0.02±0.00aA-0.03±0.01abA-0.03±0.00abA-0.03±0.00abA香草酸Mg2+-0.02±0.00aA-0.03±0.01aA-0.02±0.01aA-0.02±0.00aA-0.03±0.00aA-0.03±0.00aAhabAl3+-0.02±0.00aA-0.11±0.00bB-0.11±0.01bB-0.11±0.01bB-0.11±0.00bB-0.10±0.00bBK+-0.02±0.00aA-0.03±0.00abA-0.02±0.01aA-0.02±0.00aA-0.04±0.00bA-0.05±0.00cA原儿茶酸Mg2+-0.02±0.00aA-0.03±0.01abA-0.04±0.00bcA-0.04±0.01bcA-0.05±0.01cA-0.05±0.00cAAl3+-0.02±0.00aA-0.11±0.00bB-0.12±0.00cC-0.12±0.00bcB-0.12±0.01cdB-0.13±0.00dBK+/0.28±0.09cC0.17±0.09cB0.29±0.10cC2.86±0.09bB6.30±0.09aB香草酸Mg2+/0.61±0.07cB0.19±0.01dB0.62±0.10cB2.77±0.14bB6.72±0.12aBΔE*abAl3+/2.49±0.10cA2.44±0.09cA2.64±0.08cA5.10±0.12bA8.63±0.08aAK+/0.28±0.09cC0.15±0.03cC0.11±0.09cC1.64±0.08bB3.42±0.23aB原儿茶酸Mg2+/0.61±0.07cB0.24±0.06dB0.29±0.11dB1.83±0.24bB3.63±0.05aBAl3+/2.49±0.10cA2.37±0.10cA2.43±0.10cA3.99±0.15bA5.84±0.13aA
由图3可知,随酚酸浓度的增加,金属离子处理的模拟葡萄酒颜色差别仍然以量变为主(ΔL+ΔC=67.28%~99.76%),但不同金属离子和不同酚酸添加所形成的效果有所区别,其中随酚酸浓度升高(花色苷/金属离子/酚酸摩尔浓度比1∶25∶1~1∶25∶100),K+和Al3+处理的量变作用逐渐增强(分别提高10.21%和30.31%,P<0.05),而Mg2+处理样品的量变贡献却变化有限(≤1.50%)。
葡萄酒中一些金属离子作为其基本组成成分,可通过络合作用与部分花色苷结合,从而起到稳定和保护葡萄酒颜色的作用[7]。研究表明,与二价离子Mg2+相比,Fe3+、Ga3+和Al3+等三价金属离子对花色苷的光谱特性和颜色特征的影响更加明显,并且随着价电子数的增加,花色苷溶液红移的程度也显著提高[19]。进一步的研究发现,花色苷与金属离子可通过离子-偶极静电相互作用达到稳定[19,23]。通过选择较高价态或是较多电荷的金属离子,可增强花色苷与金属离子的相互作用能力。例如,相比于Fe2+,Fe3+由于最外层电子轨道只有1个电子占据,并呈高自旋状态,这将更有利其与花色苷分子的结合[23]。此外,有学者发现,某些多糖、蛋白和多酚类物质亦能够与金属离子作用,从而促进和提升后者的辅色效果[24]。对照本试验发现,通过添加酚酸后,Al3+和K+处理的模拟葡萄酒增色和红移效果均有所增强,同样对其CIELab颜色参数也产生积极影响。而对于辅色效果较好的Mg2+却出现“反辅色作用”。ELHABIRI等[25]研究发现,儿茶素等酚类物质能与Fe3+形成稳定的化合物,从而影响Fe3+与溶液中其他物质的相互作用。因此,我们推测,酚酸和Mg2+之间可能会发生相互作用,从而减弱Mg2+的作用效果。但由于本试验所涉及的金属离子和酚酸种类相对较少,具体的反应机理还有待进一步的研究。

a-K+添加香草酸;b-Mg2+添加香草酸;c-Al3+添加香草酸;d-K+添加原几茶酸;e-Mg2+添加原几茶酸;f-Al3+添加原几茶酸
图3 不同酚酸浓度含金属离子模拟葡萄酒ΔE的影响
Fig.3 The effect of different phenolic acid concentrations on ΔE of the pigment/metal ion simulated wine solution
本试验采用紫外-分光光度法和CIELab颜色空间法,研究了K+、Mg2+和Al3+在不同浓度及添加酚酸条件下对模拟葡萄酒溶液产生的辅色效果,结果表明:
(1)随金属离子摩尔浓度增加,Al3+处理可使模拟葡萄酒溶液呈现明显的增色和红移效应,Mg2+可使模拟酒产生增色效应但不产生红移效应,K+处理未产生明显的辅色效果。同时,Al3+和Mg2+处理均会明显改善模拟酒的CIELab颜色参数,在相同摩尔浓度比下,3种离子的辅色效果表现为Al3+>Mg2+>K+的作用趋势。进一步分析颜色参数对ΔE的贡献发现,ΔE变化主要与量变因素有关。
(2)在含花色苷-金属离子的模拟葡萄酒中分别添加固定浓度的原儿茶酸和香草酸,与仅添加花色苷-金属离子的模拟酒相比,添加酚酸可使K+和Al3+处理的模拟酒辅色效果有所增强,且香草酸的效果优于原儿茶酸。而含Mg2+的模拟酒中的酚酸处理却具有反辅色作用。
(3)在固定金属离子摩尔浓度的模拟葡萄酒中添加不同浓度酚酸发现,较低浓度的酚酸会对3种离子的辅色效果及颜色参数产生一定的负面影响,但随酚酸浓度升高,三者的辅色效果均有所提升,且Al3+的辅色效果优于Mg2+和K+。
[1] BIMPILAS A, PANAGOPOULOU M, TSIMOGIANNIS D, et al.Anthocyanin copigmentation and color of wine:The effect of naturally obtained hydroxycinnamic acids as cofactors[J].Food Chemistry, 2016, 197:39-46.
[2] 黄小晶, 牛锐敏, 沈甜, 等.不同整形方式对‘梅鹿辄’葡萄酒品质及CIELAB色空间特征的影响[J].食品与发酵工业, 2020, 46(14):28-33.
HUANG X J, NIU R M, SHEN T, et al.Effect of different trellis system on phenolic substances and CIELAB color space of ‘Merlot’ wine[J].Food and Fermentation Industries, 2020, 46(14):28-33.
[3] FANZONE M, GONZ LEZ-MANZANO S, PÉREZ-ALONSO J, et al.Evaluation of dihydroquercetin-3-O-glucoside from malbec grapes as copigment of malvidin-3-O-glucoside[J].Food Chemistry, 2015, 175:166-173.
LEZ-MANZANO S, PÉREZ-ALONSO J, et al.Evaluation of dihydroquercetin-3-O-glucoside from malbec grapes as copigment of malvidin-3-O-glucoside[J].Food Chemistry, 2015, 175:166-173.
[4] BOULTON R.The copigmentation of anthocyanins and its role in the color of red wine:A critical review[J].American Journal of Enology and Viticulture, 2001, 52:67-87.
[5] XUE Z D, ZHANG Q G, WANG T T.Co-pigmentation of caffeic acid and catechin on wine color and the effect of ultrasound in model wine solutions[J].Journal of AOAC International, 2020, 104(6): 1 703-1 709.
[6] CZIBULYA Z, HORV TH I, KOLL
TH I, KOLL L L, et al.The effect of temperature, pH, and ionic strength on color stability of red wine[J].Tetrahedron, 2015, 71(20):3 027-3 031.
L L, et al.The effect of temperature, pH, and ionic strength on color stability of red wine[J].Tetrahedron, 2015, 71(20):3 027-3 031.
[7] 刘丽媛, 苑伟, 刘延琳.红葡萄酒中花色苷辅助成色作用的研究进展[J].中国农业科学, 2010,43(12):2 518-2 526.
LIU L Y, YUAN W, LIU Y L.Advances in research of red wine′s anthocyanin copigmentation[J].Scientia Agricultura Sinica, 2010,43(12):2 518-2 526.
[8] 张波, 祝霞, 盛文军, 等.红葡萄酒中花色苷辅色化反应研究进展[J].中国农业科技导报, 2017, 19(8):92-104.
ZHANG B, ZHU X, SHENG W J, et al.Studious on copigmentation of anthocyanins in red wines[J].Journal of Agricultural Science and Technology, 2017, 19(8):92-104.
[9] CAVALCANTI R N, SANTOS D T, MEIRELES M A A.Non-thermal stabilization mechanisms of anthocyanins in model and food systems-an overview[J].Food Research International, 2011, 44(2):499-509.
[10] 邓洁红, 谭兴和, 王锋, 等.金属离子及辅色剂对刺葡萄皮色素稳定性的影响[J].食品研究与开发, 2009, 30(11):48-53.
DENG J H, TAN X H, WANG F, et al.Effects of metal ions and copigments on the stability of Vitis skin pigment[J].Food Research and Development, 2009, 30(11):48-53.
[11] STARR M S, FRANCIS F J.Effect of metallic ions on color and pigment content of cranberry juice cocktai[J].Journal of Food Science, 1973, 38(6):1 043-1 046.
[12] FERNANDES A, BR S N F, OLIVEIRA J, et al.Impact of a pectic polysaccharide on oenin copigmentation mechanism[J].Food Chemistry, 2016, 209(15):17-26.
S N F, OLIVEIRA J, et al.Impact of a pectic polysaccharide on oenin copigmentation mechanism[J].Food Chemistry, 2016, 209(15):17-26.
[13] SIGURDSON G T, ROBBINS R J, COLLINS T M, et al.Effects of hydroxycinnamic acids on blue color expression of cyanidin derivatives and their metal chelates[J].Food Chemistry, 2017, 234:131-138.
[14] FENGER J A, ROUX H, ROBBINS R J, et al.The influence of phenolic acyl groups on the color of purple sweet potato anthocyanins and their metal complexes[J].Dyes and Pigments, 2021, 185:108792.
[15] KUNS GI-M
GI-M TÉ S, STAMPEL E, KOLL
TÉ S, STAMPEL E, KOLL R L, et al.The effect of the oxidation state of iron ions on the competitive complexation of malvidin by caffeic or ellagic acid[J].Food Research International, 2008, 41(7):693-696.
R L, et al.The effect of the oxidation state of iron ions on the competitive complexation of malvidin by caffeic or ellagic acid[J].Food Research International, 2008, 41(7):693-696.
[16] ZHANG B, LIU R, HE F, et al.Copigmentation of malvidin-3-O-glucoside with five hydroxybenzoic acids in red wine model solutions:Experimental and theoretical investigations[J].Food Chemistry, 2015, 170:226-233.
[17] 李宁宁, 张波, 牛见明, 等.基于CIELab参数的葡萄酒基本花色苷与原儿茶酸的辅色评估[J].食品与发酵工业, 2019, 45(15):44-52.
LI N N, ZHANG B, NIU J M, et al.Evaluation of copigmentation of basic wine anthocyanins and protocatechuic acid based on CIELab parameters[J].Food and Fermentation Industries, 2019, 45(15):44-52.
[18] LI X D, LI J, WANG M, et al.Copigmentation effects and thermal degradation kinetics of purple sweet potato anthocyanins with metal ions and sugars[J].Applied Biological Chemistry, 2016, 59(1):15-24.
[19] SIGURDSON G T, ROBBINS R J, COLLINS T M, et al.Evaluating the role of metal ions in the bathochromic and hyperchromic responses of cyanidin derivatives in acidic and alkaline pH[J].Food Chemistry, 2016, 208(1):26-34.
[20] MAZZA G, BROUILLARD R.The mechanism of co-pigmentation of anthocyanins in aqueous solutions[J].Phytochemistry, 1990, 29(4):1 097-1 102.
[21] 苏帆, 薛佳, 杨曦, 等.酚酸对红肉苹果花色苷辅色效果及稳定性的影响[J].中国农业科学, 2017, 50(4):732-742.
SU F, XUE J, YANG X, et al.Effects of phenolic acids on copigmentation and stability of anthocyanins in red-fleshed apple[J].Scientia Agricultura Sinica, 2017, 50(4):732-742.
[22] RUSTIONI L, BEDGOOD J R D R, FAILLA O, et al.Copigmentation and anti-copigmentation in grape extracts studied by spectrophotometry and post-column-reaction HPLC[J].Food Chemistry, 2012, 132(4):2 194-2 201.
[23] KUNS GI-M
GI-M TÉ S, ORTMANN E, KOLL
TÉ S, ORTMANN E, KOLL R L, et al.Effect of ferrous and ferric ions on copigmentation in model solutions[J].Journal of Molecular Structure, 2008, 891(1-3):471-474.
R L, et al.Effect of ferrous and ferric ions on copigmentation in model solutions[J].Journal of Molecular Structure, 2008, 891(1-3):471-474.
[24] LUNA-VITAL D, CORTEZ R, ONGKOWIJOYO P, et al.Protection of color and chemical degradation of anthocyanin from purple corn (Zea mays L.) by zinc ions and alginate through chemical interaction in a beverage model[J].Food Research International, 2018, 105:169-177.
[25] ELHABIRI M, CARRЁR C, MARMOLLE F, et al.Complexation of iron(III) by catecholate-type polyphenols[J].Inorganica Chimica Acta, 2007, 360(1):353-359.