红茶菌(kombucha),又称茶菌,是以糖茶水为原料,经由酵母、醋酸菌和乳酸菌组成的共生菌群发酵而成的传统发酵茶饮料[1]。用来发酵红茶菌的茶叶一般为红茶,大量文献报道也可以利用其他原料来替代红茶,如不同类型茶叶、水果、草药和香料等,开发出新型风味和功能的产品[2-3]。银杏是一种广泛分布在我国的药食同源植物,其叶片中化学物质种类繁多、含量丰富,活性成分如黄酮类化合物(16.6 mg/g)多达20几种,萜类和总多酚含量分别占比0.42%和6.89%,必需氨基酸含量约占总氨基酸含量的40%,维生素、微量元素和酚酸类含量占比也很高[4]。有研究发现银杏叶的主要提取物,如多糖类、黄酮类化合物和银杏酚酸对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌有明显的抑制作用[5-6]。使用替代原料在发酵过程中不仅可以为茶菌的生长提供碳、氮源,其成分的生物转化也赋予茶菌不同的理化性质和更强的生物活性[2-3]。
红茶菌发酵液能有效抑制革兰氏阴性和阳性细菌生长[7],但对霉菌的抑制作用有限[8]。目前对茶菌发酵液的抑菌作用研究基本集中在对抗生素敏感性致病菌,如金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和幽门螺杆菌等的敏感性菌株[9],而对耐药菌的抑菌效果研究很少。病原菌的耐药性问题日趋严重,究其原因是抗菌药物的滥用,其中大肠杆菌与鲍曼不动杆菌传播广泛,极易对抗生素产生耐药性,在外界不断刺激下,亦可产生多重耐药性[10-11],如何有效抑制及感染后治疗是目前亟待解决的难题。
本研究以红茶、绿茶和银杏叶3种材料制备茶菌发酵液,观察并检测发酵液的理化性质;采用琼脂扩散法和牛津杯法体外检测3种茶菌发酵液对大肠杆菌、金黄色葡萄球菌、肺炎链球菌等病原细菌的敏感性菌株和大肠杆菌、鲍曼不动杆菌的多重耐药菌株的抑制效果;并选取铜绿假单胞杆菌和大肠杆菌T5菌株,探究不同发酵时间对银杏茶菌发酵液抑菌效果的影响。通过有益微生物的发酵作用提高茶叶和银杏的抑菌生理活性,发展对病原细菌(特别是耐药菌)具有抑制作用的功能微生物发酵产品。以期在大力倡导减少抗生素滥用的背景下,为新型食品防腐剂和抑菌药物的开发提供理论基础。
1 材料与方法
1.1 供试菌株和培养基
红茶菌菌种、大肠杆菌(Escherichia coli)01菌株、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、铜绿假单胞杆菌(Pseudomonas aeruginosa)、肺炎链球菌(Streptococcus pneumoniae)、痤疮丙酸杆菌(Propionibacterium acnes),由福建师范大学生命科学学院微生物实验室提供;多重耐药性菌株大肠杆菌T5(耐氨苄青霉素、氯霉素、庆大霉素和妥布霉素)、大肠杆菌P1-D6(耐氨苄青霉素、氯霉素和庆大霉素)和鲍曼不动杆菌(Acinetobacter baumannii ,耐庆大霉素、妥布霉素、浏阳霉素、卡那霉素和氨苄青霉素),由福建师范大学生命科学学院付新苗教授惠赠。所有菌株使用前暂存于-4 ℃冰箱。
LB液体培养基(g/L):胰蛋白胨10.0,酵母提取物5.0,氯化钠5.0,121 ℃灭菌30 min。LB固体培养基(g/L):胰蛋白胨10.0,酵母提取物5.0,氯化钠10.0,琼脂20,121 ℃灭菌30 min。哥伦比亚血琼脂平板培养基购自成都彼样生物科技有限公司。红茶糖水培养液:红茶5 g,白砂糖40 g,蒸馏水800 mL。绿茶糖水培养液:绿茶5 g,白砂糖40 g,蒸馏水800 mL。银杏茶糖水培养液(g/L):银杏5 g,白砂糖40 g,蒸馏水800 mL。
1.2 茶叶及试剂
红茶、绿茶、银杏叶,福建省福州市市场;氢氧化钠、酵母浸膏、琼脂等,国药化学试剂公司;细菌学蛋白胨,广东环凯微生物公司。
1.3 供试菌培养
挑取1环供试菌(芽孢杆菌、铜绿假单胞菌、鲍曼不动杆菌、大肠杆菌T5、01、P1-D6、痤疮丙酸杆菌)在LB固体平板上划线,划线后平板置于37 ℃恒温培养箱培养24 h,然后挑选大小适中的单菌落通过划线进行2次纯化培养。从纯化的平板上挑取菌体接种于50 mL LB液体培养基内,置于摇床37 ℃,220 r/min培养24 h后,获得菌悬液。
肺炎链球菌活化,挑取1环肺炎链球菌在哥伦比亚血琼脂平板上划线,划线平板置于37 ℃,5%~10% CO2恒温培养箱培养24 h,然后挑选单菌落通过划线进行2次纯化培养。用移液枪吸取1 mL无菌水于纯化的平板上,并用接种环刮取菌体混于无菌水中,制备菌悬液。
1.4 茶菌发酵及样品制备
参照汪鹏辉等[12]的方法培养茶菌和制备发酵液样品。发酵液分别以红茶、绿茶、银杏为原料。首先用沸水将所用器具纱布等清洁杀菌,在800 mL沸水中分别加入5 g红茶、绿茶和银杏叶,待浸泡10 min后用4层灭菌纱布过滤,在滤液中加入40 g白砂糖,充分搅拌得到糖茶水。待糖茶水冷却至室温后,用ddH2O补充至800 mL。在无菌环境中加入200 mL发酵7~10 d的茶菌母液,混匀,并以4层灭菌纱布封口,在28 ℃ 恒温培养箱中发酵7 d,得到茶菌发酵液。
茶菌发酵液经滤纸过滤去除发酵液中较大颗粒杂质后,8 000 r/min离心5 min,取上清液用孔径0.22 μm的滤膜过滤。收集滤液至100 mL,经冻干处理48 h后得到发酵液干粉,用1 mL无菌水稀释,存放于-20 ℃待用。
1.5 茶菌发酵过程观察和理化指标测定
茶菌发酵后,每天观察发酵液的变化,至发酵后7 d记录发酵液中菌膜、发酵液浑浊度、风味的数据;测定发酵液OD值、pH值、酸度和还原糖含量[12]。
1.6 抑菌试验
采用牛津杯-琼脂扩散法检测不同茶菌样品的抑菌能力[13]。LB培养基于超净工作台中混匀倒平板并冷却至室温后,加入100 μL供试菌悬浮液,涂布均匀。将灭菌后的牛津杯用无菌镊子固定在涂布有供试菌悬液的培养基平板上,每个平板中放置3个牛津杯。待牛津杯固定后,向杯中加入200 μL以上冻干后稀释的发酵液,置于37 ℃下恒温培养24 h。观察有无抑菌作用,测量并记录抑菌圈的大小。
将100 μL肺炎链球菌悬浮液涂布于哥伦比亚血琼脂平板上,用直径为9 mm的无菌打孔器在哥伦比亚血琼脂平板上打孔,每孔加入200 μL发酵液样品,置于37 ℃,5%~10% CO2恒温培养箱恒温培养24 h后。观察抑菌圈的大小并做记录。
将平板倒置于光线充足处,用游标卡尺“十”字法测量抑菌圈大小,并计算相对抑菌圈大小。相对抑菌圈大小计算如公式(1)所示:
相对抑菌圈/mm=D-d
(1)
式中:D,抑菌圈直径,mm;d,打孔器直径,mm。
1.7 发酵时间对茶菌抑菌作用的影响
按以上银杏培养液的配方和培养方法,分别在发酵后第5、9、13、17、21天取样,发酵液经过滤灭菌和冻干处理,编号后放置冰箱冻藏。按以上抑菌试验方法观察和测定不同发酵时间样品对铜绿假单胞杆菌和大肠杆菌T5菌株的抑制效果。
1.8 数据处理及分析
实验图像采用图像分析软件Adobe Illustrator进行处理。实验数据采用数据分析软件Graph Pad Prism 6和Oringin 8.0进行统计分析和作图。所得的结果表示为平均值±标准误差![]()
2 结果与分析
2.1 发酵液理化性质比较
经多次预试验,红茶菌在银杏叶粉配制的糖水培养液中生长良好,培养5~14 d,在培养液表面形成明显的菌膜。因此,进一步比较茶菌在不同原料配制的培养液中的表现。发酵7 d后,观察和测定红茶、绿茶、银杏发酵液的理化表现和数据如表1所示。在绿茶和红茶配制的茶糖水培养液中,菌体生长明显,发酵后第2天即可见培养液中不断产生细小气泡,发酵后第3天在培养液表面形成明显的菌膜。在银杏糖水培养液中,菌体生长较慢,气泡产生迟,数量也相对较少;菌膜的形成相比绿茶和红茶糖水培养液慢,菌膜薄。未溶解的银杏固形物易被絮状的膜吸附,使发酵液变澄清。银杏糖水经发酵后更加清亮,具有酸甜风味和清香。银杏糖水发酵液在色、香、味方面要优于红茶与绿茶,但银杏茶菌的生长较慢,培养周期略长。发酵7 d后,红茶、绿茶和银杏发酵液的pH值分别为3.08、2.83和2.75。
表1 发酵7 d后3种茶菌发酵液理化性质比较
Table 1 Comparison of physicochemical properties of three different kombucha tea after 7 days of fermentation

发酵原料菌膜外观口感pH酸度/(g·L-1)还原糖/(g·L-1)菌浓度(OD600)红茶表面平整,带褐色,较厚红褐色、浑浊、气泡多酸、甜适中、茶香、清爽3.085.20.580.341绿茶表面较平整,白色、较厚黄褐色、较浑浊,有气泡甜、偏酸、清爽2.836.70.590.356银杏叶表面略粗糙,菌膜形成慢,白色、薄清亮、初始较浑浊,发酵2 d后变得清亮微甜、偏酸、清爽,淡杏香2.756.80.330.234
2.2 茶菌发酵液对病原细菌的抑制作用
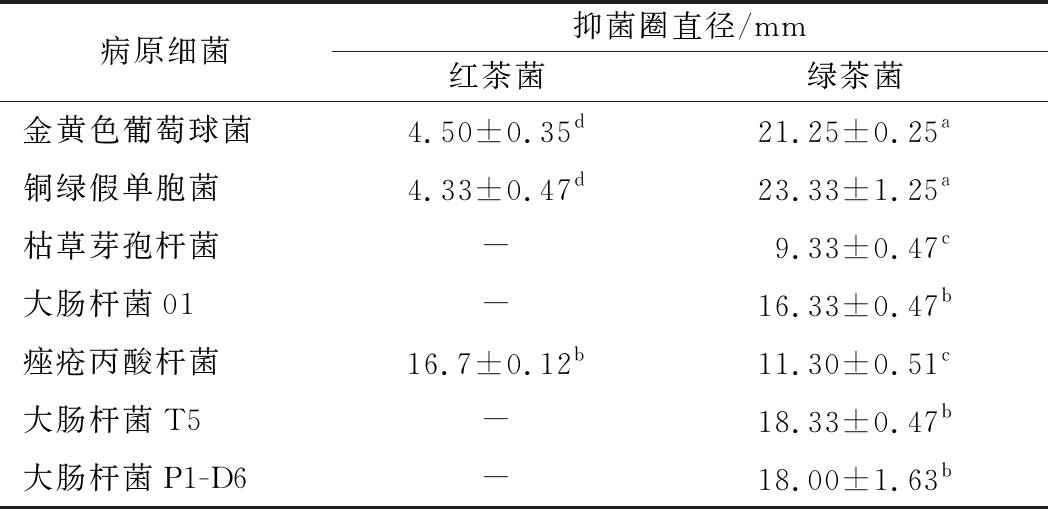
以红茶为原料的茶菌发酵液对金黄色葡萄球菌、铜绿假单胞菌和痤疮丙酸杆菌的相对抑菌圈直径分别为4.5、4.33、16.7 mm(表2,图1),对痤疮丙酸杆菌的抑制效果最为明显;对枯草芽孢杆菌、大肠杆菌01菌株、大肠杆菌T5和大肠杆菌P1-D6等菌株没有抑制效果。以绿茶为原料的茶菌发酵液对供试的铜绿假单胞杆菌、大肠杆菌和金黄色葡萄球菌等菌株均有抑制作用;其中,对铜绿假单胞杆菌的抑制效果最为明显,抑菌圈直径达到23.33 mm,与其他菌株相比差异显著(P<0.05)。和红茶为原料的发酵液相比,以绿茶为原料的发酵液对大肠杆菌多重耐药菌株T5和P1-D6也有较强的抑制作用,相对抑菌圈直径达到18 mm左右(表2)。
表2 茶菌发酵液对致病菌的抑制作用![]()
Table 2 Inhibitory effects of tea fungus broth on growth of pathogenic bacteria ![]() N=3)
N=3)
病原细菌抑菌圈直径/mm红茶菌绿茶菌金黄色葡萄球菌4.50±0.35d21.25±0.25a铜绿假单胞菌4.33±0.47d23.33±1.25a枯草芽孢杆菌-9.33±0.47c大肠杆菌01-16.33±0.47b痤疮丙酸杆菌16.7±0.12b11.30±0.51c大肠杆菌T5-18.33±0.47b大肠杆菌P1-D6-18.00±1.63b
注:相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)(下同)
A-红茶菌发酵液对铜绿假单胞菌的抑制作用;B-红茶菌发酵液对
金黄色葡萄球菌的抑制作用;C-红茶菌发酵液对大肠杆菌T5菌株的
抑制作用;D-绿茶菌发酵液对铜绿假单胞菌的抑制作用;E-绿茶菌
发酵液对金黄色葡萄球菌的抑制作用;F-绿茶菌发酵液对大肠杆菌T5
菌株的抑制作用
图1 茶菌发酵液对病原菌的抑菌作用比较
Fig.1 Inhibitory effects of tea fungus broth on growth of pathogenic bacteria
2.3 银杏茶菌发酵液对病原细菌的抑制作用
2.3.1 对敏感菌的抑制效果
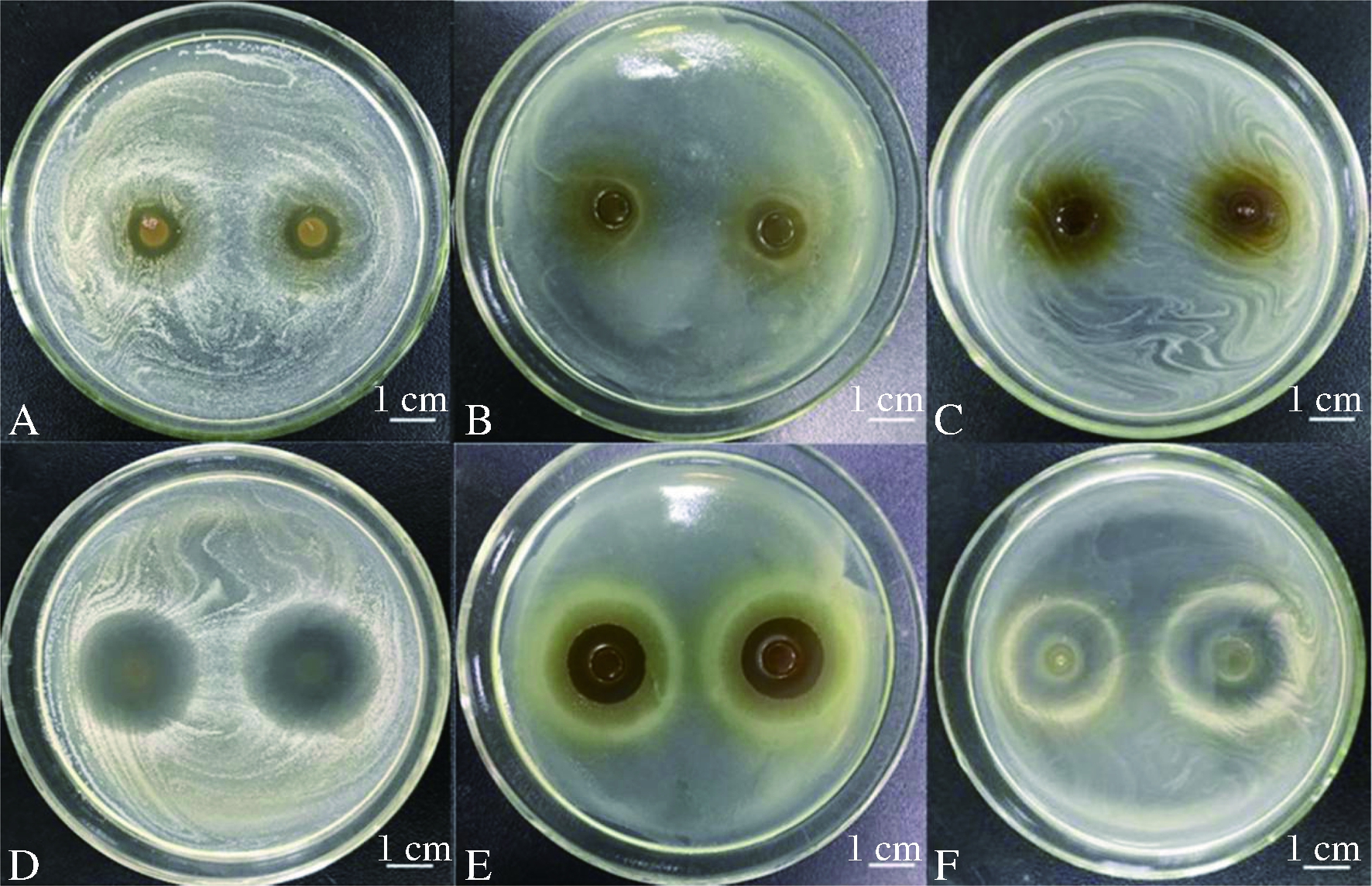
银杏茶菌发酵液对金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌和大肠杆菌01菌株等抗生素敏感菌株的相对抑菌圈大小分别为21.67、12.50、2.03、4.33 mm(图2)。银杏茶菌发酵液对3株肺炎链球菌也有一定的抑制效果。对Ⅰ型肺炎链球菌、Ⅱ型肺炎链球菌和Ⅲ型肺炎链球菌的相对抑菌圈大小分别为3.67、9.83、6.50 mm(图2)。

A-银杏茶菌发酵液对不同病原细菌抑菌圈大小比较;
B-银杏茶菌对金黄色葡萄球菌的抑制作用;C-银杏茶菌
对Ⅱ型肺炎链球菌的抑制作用
图2 银杏茶菌发酵液对病原细菌的抑菌作用
Fig.2 Inhibitory effects of ginkgo kombucha broth on growth of pathogenic bacteria
2.3.2 对多重耐药菌的抑制效果
银杏茶菌发酵液对多重耐药性菌株鲍曼不动杆菌、大肠杆菌T5和大肠杆菌P1-D6的相对抑菌圈大小分别为7.83、13.00、15.33 mm(图2-A,图3)。
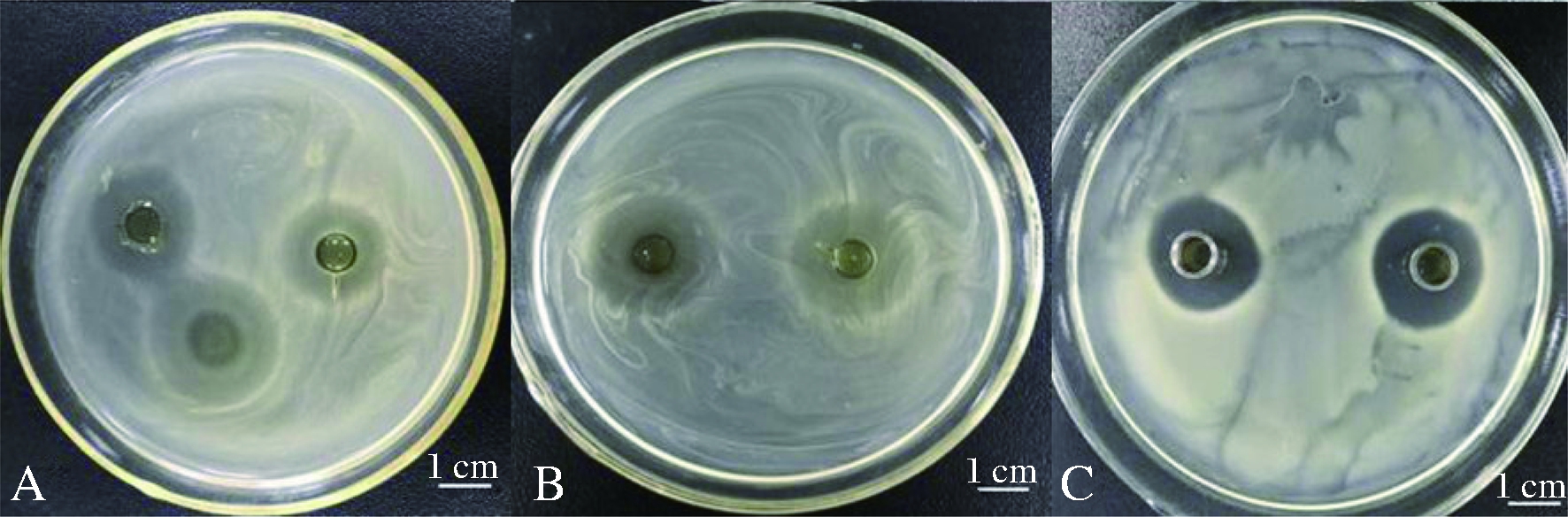
A-大肠杆菌T5菌株;B-大肠杆菌P1-D6菌株;C-鲍曼不动杆菌
图3 银杏茶菌发酵液对多重耐药菌的抑菌作用
Fig.3 Inhibitory effects of ginkgo kombucha on growth of multidrug resistant bacteria
2.4 发酵时间对银杏茶菌抑菌作用的影响
在17 d的发酵时间内,银杏茶菌发酵液的抑菌作用随时间变化而增强;发酵后第17天对铜绿假单胞菌和大肠杆菌T5抑制作用最强,抑菌圈大小分别达到2.91、3.69 cm(表3,图4)。但是,发酵后21 d进一步观察发现,在抑菌圈的范围内,逐渐可见有细菌的生长,抑菌效果逐渐较弱。
表3 发酵时间对银杏茶菌抑菌效果的影响![]() 单位:cm
单位:cm
Table 3 Effect of fermentation time on antibacterial effect of ginkgo kombucha ![]()

菌株0 d5 d9 d13 d17 d21 d铜绿假单胞菌-2.19±0.12b2.37±0.10b2.20±0.29b2.91±0.37a2.87±0.31a大肠杆菌T5 -1.97±0.20c2.50±0.45b3.52±0.42a3.69±0.12a2.93±0.58b
注:-表示未出现抑菌圈
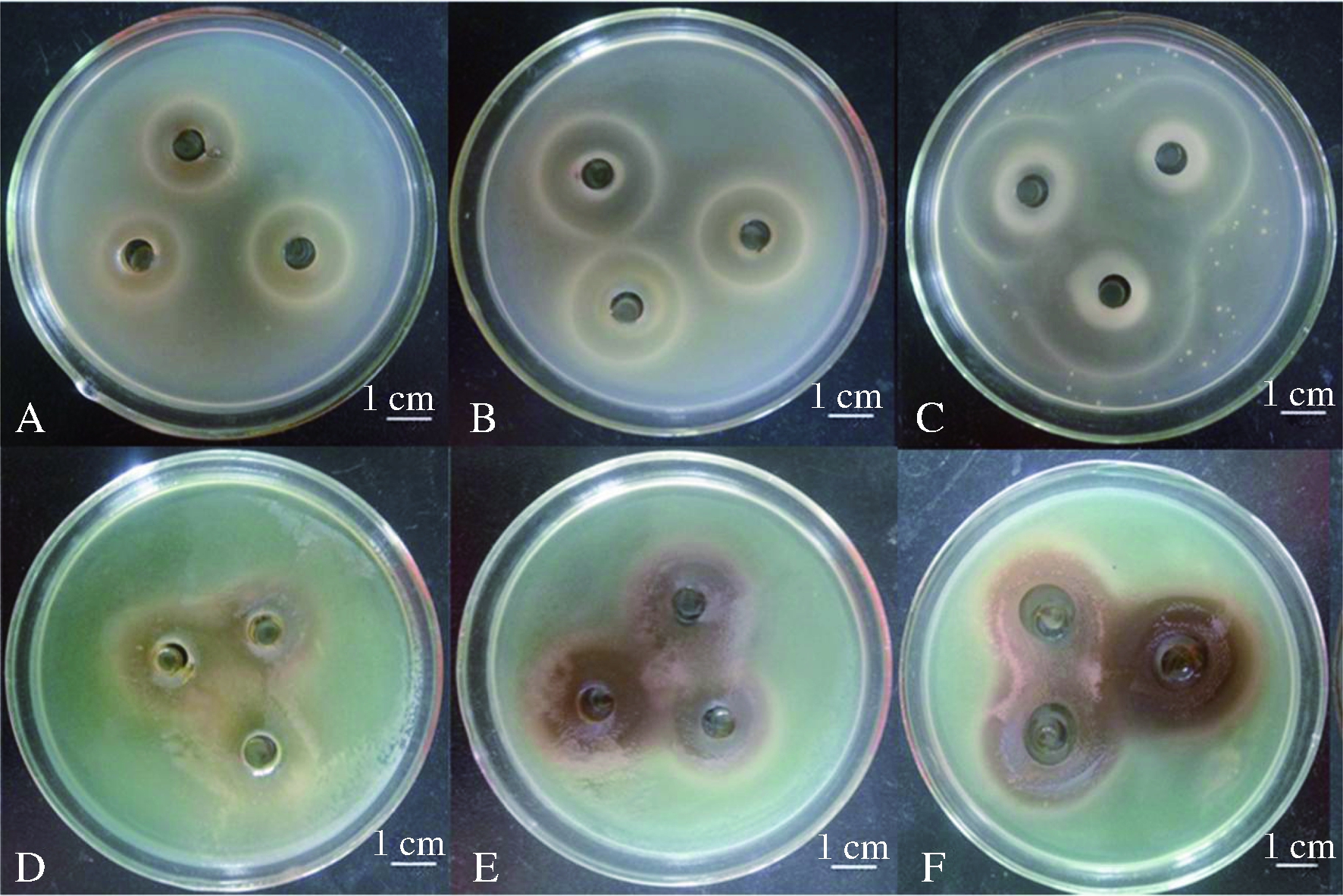
A-发酵5 d银杏茶菌对铜绿假单胞杆菌的抑制作用;B-发酵9 d银杏茶菌对铜绿假单胞杆菌的抑制作用;C-发酵17 d银杏茶菌对铜绿假单胞杆菌的抑制作用;D-发酵5 d银杏茶菌对大肠杆菌T5菌株的抑制作用;E-发酵9 d银杏茶菌对大肠杆菌T5菌株的抑制作用;F-发酵17 d银杏茶菌对大肠杆菌T5菌株的抑制作用
图4 不同发酵时间对银杏茶菌抑菌作用的影响
Fig.4 Effects of fermentation time on inhibition activities of ginkgo kombucha
3 结论
本研究结果显示,3种茶菌发酵液对不同细菌的抑菌活性存在显著差异。绿茶菌发酵液对供试病原细菌的敏感菌株和耐药菌株均有明显的抑制作用,其中对铜绿假单胞菌的抑制活性最强,对大肠杆菌01菌株的抑制活性最弱;银杏茶菌发酵液对敏感菌株和耐药菌株均有抑制作用,对金黄葡萄球菌的抑制活性最强,对大肠杆菌01菌株的抑制活性最弱。而红茶菌发酵液只对痤疮丙酸杆菌、金黄葡萄球菌和铜绿假单胞菌有一定的抑制作用,对芽孢杆菌和鲍曼不动杆菌、大肠杆菌T5和大肠杆菌P1-D6等3个耐药菌株均无抑菌活性。总体上,3种茶菌发酵液的抑菌活性强弱依次为:绿茶菌>银杏茶菌>红茶菌。
除了痤疮丙酸杆菌,绿茶菌发酵液对其他供试菌的抑制作用明显优于红茶菌发酵液。已有的研究结果表明,不同茶叶或不同植物经红茶菌发酵后,其发酵液的抑菌效果存在差异[14-16]。如BATTIKH等[14]评估了红茶、绿茶发酵21 d后的抗细菌和抗真菌活性,发现对所测试的病原微生物(Candida krusei除外)具有抗菌潜力,而绿茶菌的抑菌潜力最强。与红茶发酵后的发酵液相比,绿茶发酵液具有更宽的抑菌谱和更强的抑菌活性。红茶和绿茶发酵后的抑菌能力存在差异,可能和以下因素有关:一是不同茶叶和植物叶片所含有的成分存在差异,如绿茶在儿茶素、黄酮类、酚酸类等化合物的种类和含量上与红茶不同,因而其发酵后的产物存在差异[16-17];经茶菌发酵后,发酵原料的生物转化产物可能呈现不同的抑菌作用[16]。二是不同植物原料发酵后,发酵液中有机酸的种类和含量不同。实验结果表明绿茶菌发酵后的酸度显著高于红茶菌;pH值的降低及大量有机酸的产生,尤其乙酸的产生也是茶菌具有抑菌效果的重要机制之一[8-9,18]。绿茶菌相比红茶菌抗菌作用更强,未来可以深入研究其抑菌作用原理,并期望应用于医疗或食品领域。
红茶菌在银杏糖水中生长良好,发酵过程中pH值、酸度和还原糖变化与红茶菌和绿茶菌相似,而菌膜形成表明使用银杏发酵是可行的。银杏叶中含有丰富的化学物质,药用有效成分多达170余种[19]。银杏叶提取物对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌等革兰氏阴性和阳性菌均有很好的抑制作用[5-6,13,20],其中含有的多糖类化合物、黄酮类化合物及银杏酚酸是抑菌的主要成分[4,20-21]。银杏茶菌发酵液对供试的普通病原菌均有不同的抑制效果,而对肺炎链球菌和多重耐药菌株的抑制作用,则进一步拓展了银杏发酵产物的抗菌谱。随着发酵时间延长,银杏茶菌发酵液对铜绿假单胞菌和多重耐药性大肠杆菌T5菌株的抑菌效果均显著提高,在第17天达到最高,之后略有降低。推测在一定的发酵时间内,随着微生物发酵过程的不断进行,发酵液中有机酸、抗菌物质的产生和pH值的下降,促进发酵液的抑菌效果显著提升。VALIYAN等[22]使用红茶、绿茶、柠檬叶和薄荷叶为原料进行茶菌发酵,在第21天时显示出最强的抑菌活性。VOHRA等[23]比较红茶菌和绿茶菌发酵7、14、28、60 d的抑菌效果,发现第7天两者均无抑菌效果,而第60天的抑菌效果最好,抑菌效果随发酵时间增加而增强。添加银杏提取物,利用豆酱发酵剂可以增强发酵产品的抑菌功能[24]。利用银杏叶作为红茶菌的替代原料发酵进行抑菌作用研究尚属首次,银杏叶经红茶菌发酵后如何改变其活性成分种类和含量,是否增强抑菌活性,需要做进一步的研究。
过度使用抗生素导致致病菌产生耐药性,伴随着环境的筛选作用,可同时耐受多种抗生素的多重耐药菌也不断出现,病原菌的耐药性已成为日益紧迫的全球健康问题[9]。茶叶主要成分及其制品在抑制耐药菌株方面已经呈现一定的潜力[25]。以茶叶和银杏为原料的茶菌发酵液作为一种天然发酵饮品,其对病原细菌(尤其是多重耐药菌株)抑制作用的研究,将有助于食品、饲料防腐剂、抗生素替代品和功能饮料的创新和发展。
[1] COELHO R M D, DE ALMEIDA A L, AMARAL R Q G D, et al.Kombucha:Review[J].International Journal of Gastronomy and Food Science, 2020, 22:100272.
[2] BATTIKH H, BAKHROUF A, AMMAR E.Antimicrobial effect of kombucha analogues[J].LWT, 2012, 47(1):71-77.
[3] AHMED R F, HIKAL M S, ABOU-TALEB K A.Biological, chemical and antioxidant activities of different types kombucha[J].Annals of Agricultural Sciences, 2020, 65(1):35-41.
[4] 吴平, 姚芳, 祁兴普, 等.银杏全资源主要成分与功能活性[J].食品工业科技, 2021.
WU P, YAO F, QI X P, et al.Main components and functional activities of Ginkgo biloba[J].Science and Technology of Food Industry, 2021.
[5] ZHANG N N, LAN W Q, WANG Q, et al.Antibacterial mechanism of Ginkgo biloba leaf extract when applied to Shewanella putrefaciens and Saprophytic staphylococcus[J].Aquaculture and Fisheries, 2018, 3(4):163-169.
[6] ![]() E, et al.Properties of Ginkgo biloba L.:Antioxidant characterization, antimicrobial activities, and genomic microRNA based marker fingerprints[J].International Journal of Molecular Sciences, 2020, 21(9):3 087.
E, et al.Properties of Ginkgo biloba L.:Antioxidant characterization, antimicrobial activities, and genomic microRNA based marker fingerprints[J].International Journal of Molecular Sciences, 2020, 21(9):3 087.
[7] HOU J, LUO R, NI H, et al.Antimicrobial potential of kombucha against foodborne pathogens[J].Quality Assurance and Safety of Crops & Foods, 2021, 13(3):53-61.
[8] SREERAMULU G, ZHU Y, KNOL W.Characterization of antimicrobial activity in kombucha fermentation[J].Acta Biotechnologica, 2001, 21(1):49-56.
[9] AL-MOHAMMADI A R, ISMAIEL A A, IBRAHIM R A, et al.Chemical constitution and antimicrobial activity of kombucha fermented beverage[J].Molecules China, 2021, 26(16):5 026.
[10] 高海涛, 韩俊丽, 关道明.大肠杆菌耐药现状的严峻性[J].生命科学, 2017, 29(5):514-520.
GAO H T, HAN J L, GUAN D M.The grim situation of drug resistance in Escherichia coli[J].Chinese Bulletin of Life Sciences, 2017, 29(5):514-520.
[11] 王斌, 林英, 马婧涵, 等.1083株鲍曼不动杆菌临床特点及耐药性分析[J].中国实验诊断学, 2021, 25(8):1 158-1 160.
WANG B, LIN Y, MA J H, et al.Clinical characteristics and drug resistance of 1083 strains of Acinetobacter baumannii[J].Chinese Journal of Laboratory Diagnosis, 2021, 25(8):1 158-1 160.
[12] 汪鹏辉, 张慧霞, 刘斌杰, 等.红茶菌群中菌株相互作用影响菌体生长和代谢[J].微生物学通报, 2021, 48(2):426-436.
WANG P H, ZHANG H X, LIU B J, et al.Interaction of strains in kombucha microbial community affects their growth and metabolism[J].Microbiology China, 2021, 48(2):426-436.
[13] SATI S C, JOSHI S.Antibacterial activities of Ginkgo biloba L.leaf extracts[J].The Scientific World Journal, 2011, 11:2 237-2 242.
[14] BATTIKH H, CHAIEB K, BAKHROUF A, et al.Antibacterial and antifungal activities of black and green kombucha teas[J].Journal of Food Biochemistry, 2013, 37(2):231-236.
[15] SILVA K A, UEKANE T M, DE MIRANDA J F, et al.Kombucha beverage from non-conventional edible plant infusion and green tea:Characterization, toxicity, antioxidant activities and antimicrobial properties[J].Biocatalysis and Agricultural Biotechnology, 2021, 34:102032.
[16] CARDOSO R R, NETO R O, DOS SANTOS D'ALMEIDA C T, et al.Kombuchas from green and black teas have different phenolic profile, which impacts their antioxidant capacities, antibacterial and antiproliferative activities[J].Food Research International, 2020, 128:108782.
[17] BHATTACHARYA D, BHATTACHARYA S, PATRA M, et al.Antibacterial activity of polyphenolic fraction of kombucha against enteric bacterial pathogens[J].Current Microbiology, 2016, 73(6):885-896.
[18] ANSARI F, POURJAFAR H, KANGARI A, et al.Evaluation of the glucuronic acid production and antibacterial properties of kombucha black tea[J].Current Pharmaceutical Biotechnology, 2019, 20(11):985-990.
[19] TAO R, WANG C Z, KONG Z W.Antibacterial/antifungal activity and synergistic interactions between polyprenols and other lipids isolated from Ginkgo biloba L.leaves[J].Molecules, 2013, 18(2):2 166-2 182.
[20] CARRATURO A, RAIETA K, TEDESCO I, et al.Antibacterial activity of phenolic compounds derived from Ginkgo biloba sarcotestas against food-borne pathogens[J].British Microbiology Research Journal, 2014, 4(1):18-27.
[21] 陈华海, 赵昌会, 朱家良, 等.银杏双黄酮和银杏内酯B与人体肠道菌群体外互作研究[J].微生物学报, 2021, 61(8):2 413-2 426.
CHEN H H, ZHAO C H, ZHU J L, et al.Study the interactions between ginkgetin and ginkgolide B with human gut microbiota in vitro[J].Acta Microbiologica Sinica, 2021, 61(8):2 413-2 426.
[22] VALIYAN F, KOOHSARI H, FADAVI A.Use of response surface methodology to investigate the effect of several fermentation conditions on the antibacterial activity of several kombucha beverages[J].Journal of Food Science and Technology, 2021, 58(5):1 877-1 891.
[23] VOHRA B M, FAZRY S, SAIRI F, et al.Effects of medium variation and fermentation time on the antioxidant and antimicrobial properties of kombucha[J].Malaysian Journal of Fundamental and Applied Sciences, 2019, 15(2-1):298-302.
[24] SHUKLA S, PARK J, PARK J H, et al.Development of novel Meju starter culture using plant extracts with reduced Bacillus cereus counts and enhanced functional properties[J].Scientific Reports, 2017, 7(1):11409.
[25] GIRI K, SHRESTHA B K, SHAKYA J, et al.Antibacterial effect of green tea extract against multi drug resistant Escherichia coli isolated from urine sample of patients visiting tertiary care hospital of Eastern Nepal[J].International Journal of Applied Sciences and Biotechnology, 2020, 8(1):45-51.