低度黄酒的酒精度一般为8.0%vol~12.5%vol,适合年轻一代消费者的口味喜好[1],近年来得到迅速发展。目前低度黄酒生产工艺主要有原酒稀释法和醪液稀释发酵法2种[2-3],由于醪液稀释发酵法酿造的低度黄酒在坛中贮存容易污染微生物导致酸败变质[1,4],因此目前大多数厂家采用原酒稀释法生产低度黄酒,即先酿成酒精度较高的黄酒,然后加水稀释。但加水稀释后总酸较低,而酸类物质是黄酒的重要口味物质,总酸低的黄酒口感淡薄[5]。为解决该问题,在实际生产中通常采用添加贮存或发酵过程中酸败黄酒样来提高总酸。但有的酸败黄酒有异气异味,且酸败黄酒的生物胺含量远高于正常酿造的黄酒[6]。生物胺具有一定的生理副作用,是引起黄酒饮后不适症状的主要成分之一[7-8]。
乳酸菌(lactic acid bacteria)是参与黄酒发酵的重要微生物之一,浸米和发酵过程都离不开乳酸菌[9-10]。乳酸菌产酸可以为黄酒醪液提供酸性发酵环境,抑制其他杂菌生长。在黄酒酿造中,通过接种乳酸菌浸米能消除浸米环节的异嗅味,改善浸米品质,大幅降低米浆水中生物胺含量[11-12]。此外,生物强化技术被广泛应用于传统发酵食品的酿造中,ZHANG等[13]通过强化曼舒里毕赤酵母(Pichia manshurica)发酵山西老陈醋大曲,提高了醋中总酸和总酯含量;WANG等[14]在醋酸发酵开始时接种巴斯德醋酸杆菌(Acetobacter pasteurianus),增加了镇江香醋的风味,缩短了醋酸发酵周期,同时提高了总酸和2,3-丁二醇的含量;王晓勇[15]通过接种酵母菌和醋酸菌强化大曲生产汾酒醋酸调味酒,使汾酒的香气成分更加丰富,风味更加协调。为改善低度黄酒生产中由酸败黄酒调酸引起的异气异味和生物胺问题,提高低度黄酒品质和安全水平,本研究采用前期筛选的1株低产生物胺、高产乳酸的乳酸菌进行强化发酵,以期酿造出酸度高且能较好地保持黄酒风味的调酸用高酸黄酒。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌种
植物乳杆菌(Lactobacillus plantarum)CGMCC No.12757,从黄酒发酵醪液中筛选得到,该菌产酸能力较强且低产生物胺;工业黄酒酵母(Saccharomyces cerevisiae)N85,由本实验室保藏。
1.1.2 实验材料
糯米、麦曲,浙江古越龙山绍兴酒股份有限公司。
1.2 仪器与设备
Agilent 1260高效液相色谱,美国Agilent公司;QP2010Ultra GS/MS气质联用仪,日本Shimadzu公司;PHS-3E pH计,瑞士Mettler Toledo公司。
1.3 实验方法
1.3.1 酵母和乳酸菌培养
米汁的制备:糯米浸泡2 d,蒸饭,按100 g糯米饭质量加入300 mL水、5 g熟麦曲和10 000 U糖化酶,于55~60 ℃下糖化5 h,稠袋过滤,调整糖度为12 °Bx,分装后于115 ℃灭菌20 min。
培养方法:将酵母和乳酸菌种子液分别接种于米汁中,接种量为10%,酵母于30 ℃下振荡培养12 h,乳酸菌于37 ℃下静止培养12 h。
1.3.2 黄酒酿造实验
配方∶m(糯米)∶m(水)=1∶1.7、酵母培养液5%、乳酸菌培养液2%、麦曲用量17%;工艺参数:浸米时间2 d,前发酵(主酵)在30 ℃下发酵4 d,后发酵在15 ℃下发酵15 d。黄酒酿造工艺流程如下:
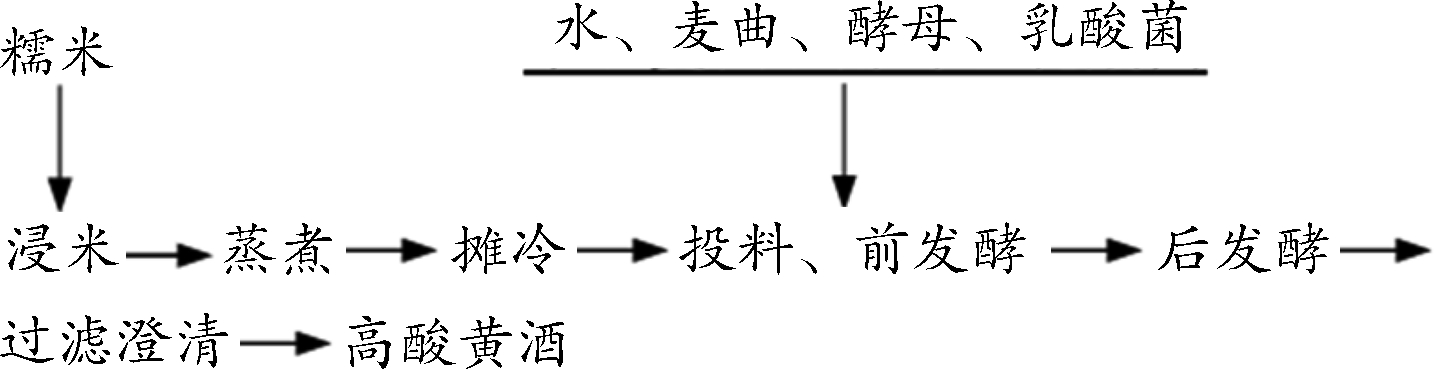
1.3.3 高酸黄酒酿造单因素试验
1.3.3.1 乳酸菌接入时间对黄酒总酸的影响
其他因素不变,乳酸菌接种时间分别设定为0、1、2、3、4 d进行黄酒酿造实验,并以不接乳酸菌的黄酒发酵作为空白对照。
1.3.3.2 麦曲添加量对黄酒总酸的影响
其他因素不变,麦曲添加量分别设定为10%、14%、17%、20%、23%(质量分数)进行黄酒酿酒实验。
1.3.4 均匀设计优化高酸黄酒酿造工艺
以酿制黄酒的总酸和酒精度为指标,选取乳酸菌接种量、料水比和主酵温度作为实验因素,按照DPS9.5 软件设计3因素8水平均匀设计表进行实验。
1.3.5 黄酒常规理化指标的测定
发酵液中酒精度、总酸、pH、氨基酸态氮含量的测定方法参考GB/T 13662—2018 《黄酒》。
1.3.6 黄酒中有机酸含量的测定
前处理:取10 mL样品于100 mL容量瓶中,加入2 mL 30%硫酸锌溶液和2 mL 15%亚铁氰化钾溶液,摇匀,用超纯水定容,静置30 min,用滤纸过滤,再经0.22 μm膜过滤后用于HPLC分析。
色谱条件:参考文献[16]并稍作改动,色谱柱为Waters Atlantis T3 d C18(4.6 mm×250 mm,5 μm),柱温35 ℃,流动相20 mmol/L NaH2PO4(用磷酸调pH至2.7),进样量20 μL,流速1 mL/min,检测波长210 nm。
1.3.7 黄酒中生物胺含量的测定
采用HPLC法测定黄酒中生物胺含量[17]。
1.3.8 黄酒游离氨基酸含量的测定
采用HPLC法测定黄酒中16种游离氨基酸含量[18]。
1.3.9 黄酒挥发性风味物质含量的测定[19-20]
顶空固相微萃取条件:黄酒样品先经3 000 r/min离心20 min,取2 mL上清液,加入4 mL纯净水,2.5 g氯化钠,10 μL内标物(2-辛醇,89.65 mg/L),萃取温度50 ℃,预热15 min,萃取时间40 min,GC解吸5 min(250 ℃)。
GC-MS条件:色谱柱型号DB-Wax毛细管柱(30 m×0.25 mm×0.25 μm),柱初始温度40 ℃保持5 min,以5 ℃/min上升至150 ℃,再以10 ℃/min上升至230 ℃,然后保持10 min。载气为高纯度氦气,流速1.0 mL/min,进样口温度为250 ℃,进样方式为不分流进样。MS接口温度为230 ℃,电子轰击离子源,扫描范围(m/z)为30~550 amu,电子能量为70 eV,离子源温度为210 ℃。
以2-辛醇为内标进行半定量。
1.3.10 数据分析
数据分析采用 SPSS 25进行,每个试验均重复3次,数据以平均值±标准偏差表示,并进行单因素方差分析(P<0.05)。
2 结果与分析
2.1 单因素试验优化黄酒酿造工艺
2.1.1 乳酸菌接种时间对黄酒发酵的影响
不同乳酸菌接种时间酿制黄酒的酒精度和总酸含量检测结果如图1所示。在发酵1、2、3、4 d接入乳酸菌与未接入乳酸菌(对照)相比,黄酒的酒精度具有显著差异,总酸略有提高,但差异不显著。而在投料时(0 d)接种乳酸菌能显著提高总酸含量,发酵结束时总酸达到11.9 g/L、酒精度为13.2%vol,与对照黄酒相比,总酸提高了190%、酒精度下降17.5%。在发酵1 d后接入乳酸菌,由于醪液中已有较高含量的酒精[21],可能对乳酸菌的生长产生抑制,因而无法达到增酸效果。因此,选择在投料时接种乳酸菌为最佳接种时间。

图1 乳酸菌接种时间对黄酒酒精度和总酸含量的影响
Fig.1 Effect of inoculation time of lactic acid bacteria on the contents of alcohol and total acid in Huangjiu
2.1.2 麦曲添加量对黄酒发酵的影响
麦曲在黄酒酿造过程中具有极其重要的作用,传统黄酒酿造中麦曲的用量约为原料米的1/6[22-23]。麦曲添加量对黄酒发酵的影响如图2所示,麦曲添加量(质量分数)从10%增加到17%时,黄酒的酒精度和总酸含量逐渐增加,而麦曲添加量从17%增加到23%时,黄酒的酒精度和总酸含量略有上升。较高的麦曲添加量会增加生产成本,而黄酒厂进行常规黄酒酿造时,麦曲添加量一般为17%左右,故选择麦曲添加量为17%。

图2 麦曲添加量对黄酒酒精度和总酸含量的影响
Fig.2 Effect of dosage of wheat Qu on the contents of alcohol and total acid in Huangjiu
2.2 均匀设计优化发酵工艺
以乳酸菌接种量(X1)、料水比(X2)和主酵温度(X3)为优化因素,利用DPS的优化系统建立3因素8水平的均匀设计,所得设计方案的中心偏差较高(CD=0.102 4),为此将实验次数由8次提高到16次,以降低试验的中心偏差(CD=0.078 4),实验方案及结果如表1所示。
以所酿黄酒的总酸含量为评价指标,采用二次多项式逐步回归分析方法对实验结果进行分析,得回归方程Y=6.412 2+0.437 1X1+14.996 8X2-0.400 6X3-0.053 2X12-0.802 3X22+0.012 0X32-0.016 8X1X2-0.324 2X2X3+ 0.006 9X1X3,相关系数R=0.971 9,F值=11.41,显著水平P= 0.003 9。由回归方程得到最优工艺参数为乳酸菌接种量5.3%、料水比1∶2.5(g∶mL)、前酵温度24 ℃,总酸最高值为18.2 g/L。对得到的最优工艺进行验证:即以乳酸菌投料时加入、麦曲用量17%、乳酸菌接种量5.3%、料水比1∶2.5(g∶mL)、前酵温度24 ℃ 的工艺进行黄酒发酵试验,重复3次,对检测结果取平均值。所酿黄酒的酒精度为12.5%vol、总酸达17.5 g/L,实验结果与模型预测较吻合。高酸黄酒的总酸含量较高可以减少勾兑时的用量,而酒精度12.5%vol既能较好地保持黄酒风味,又与低度黄酒的酒精度较为一致,方便勾调操作。
表1 实验设计方案及结果
Table 1 Mixed-levels uniform experimental design and result
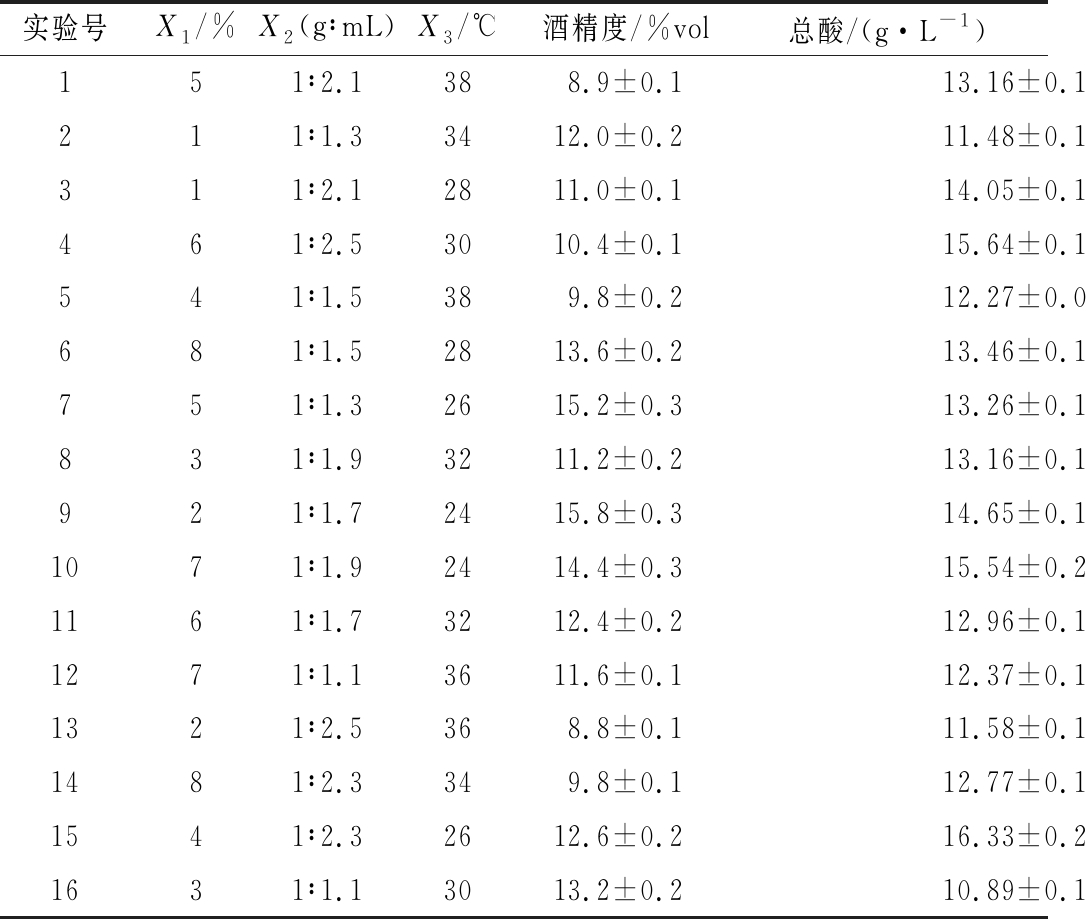
实验号X1/%X2(g∶mL)X3/℃酒精度/%vol总酸/(g·L-1)151∶2.1388.9±0.113.16±0.14211∶1.33412.0±0.211.48±0.12311∶2.12811.0±0.114.05±0.11461∶2.53010.4±0.115.64±0.15541∶1.5389.8±0.212.27±0.09681∶1.52813.6±0.213.46±0.13751∶1.32615.2±0.313.26±0.15831∶1.93211.2±0.213.16±0.12921∶1.72415.8±0.314.65±0.181071∶1.92414.4±0.315.54±0.211161∶1.73212.4±0.212.96±0.141271∶1.13611.6±0.112.37±0.131321∶2.5368.8±0.111.58±0.121481∶2.3349.8±0.112.77±0.131541∶2.32612.6±0.216.33±0.231631∶1.13013.2±0.210.89±0.10
2.3 高酸黄酒的理化指标、微理组分及风味组分分析
2.3.1 常规理化指标
高酸黄酒和对照黄酒的理化指标见表2。与对照组黄酒相比,高酸黄酒的酒精度和氨基酸态氮含量分别降低了21.8%和27.9%,而总酸含量提高了326.8%。
表2 高酸黄酒和对照黄酒的理化指标
Table 2 Detection of physiochemical indexes in high-acidity Huangjiu and control Huangjiu

指标高酸黄酒对照黄酒酒精度/%vol12.50±0.216.00±0.3总糖/(g·L-1)6.40±0.310.40±0.7总酸/(g·L-1)17.50±0.264.10±0.08pH3.55±0.024.40±0.03氨基酸态氮/(g·L-1)0.67±0.050.93±0.08
2.3.2 黄酒中主要有机酸含量
乳酸是黄酒中含量最高的有机酸,能给黄酒带来醇厚感;乙酸是黄酒中的主要挥发性酸,其含量过高时会使黄酒产生不愉悦甚至酸败气味,而酸败黄酒往往乙酸含量很高[24]。高酸黄酒和对照黄酒中主要有机酸含量见表3,与对照黄酒相比,高酸黄酒中乳酸和乙酸含量分别提高了397.2%和79.3%,乳酸与乙酸质量比由1.7∶1提高至4.6∶1。因此,高酸黄酒用于低度黄酒生产中的调酸有利于改善产品风味。
表3 高酸黄酒和对照黄酒中有机酸含量的检测
Table 3 Detection of the content organic acids in high-acidity Huangjiu and control Huangjiu

有机酸高酸黄酒对照黄酒乳酸/(mg·L-1)12 602.1±28.12 534.5±21.9乙酸/(mg·L-1)2 754.1±19.21 535.9±15.5m(乳酸)∶m(乙酸)4.6∶11.7∶1
2.3.3 黄酒中生物胺含量
高酸黄酒和对照黄酒中生物胺含量见表4。与对照黄酒相比,高酸黄酒中3种生物胺总量下降34.3%,用于低度黄酒调酸可提高产品的安全性。生物胺主要通过微生物分泌的氨基酸脱羧酶作用于游离氨基酸产生的,一方面本研究所用乳酸菌为筛选的低产生物胺植物乳杆菌,另一方面在发酵初期接种乳酸菌,降低了黄酒发酵体系中的pH,抑制了杂菌的生长,使所酿黄酒中生物胺含量低于常规黄酒[25-26]。
表4 高酸黄酒和对照黄酒的生物胺含量 单位:mg/L
Table 4 Contents of biogenic amines in high-acidity Huangjiu and control Huangjiu

生物胺高酸黄酒对照黄酒腐胺11.65±0.0614.21±0.13组胺14.13±0.0916.54±0.17酪胺26.14±0.1548.32±0.33总计51.9279.07
2.3.4 黄酒中游离氨基酸含量
高酸黄酒和对照黄酒中游离氨基酸含量见表5。与对照黄酒相比,高酸黄酒中16种游离氨基酸含量下降43.4%。其原因可能是:一方面低pH抑制了麦曲中蛋白酶的活性,导致蛋白质的降解不完全;另一方面乳酸菌生长繁殖需要消耗氨基酸作为氮源。
2.3.5 黄酒中挥发性风味物质含量
高级醇是酒类重要的风味物质之一,但含量过高时易产生杂味和致醉[27-28]。与对照黄酒相比,高酸黄酒中高级醇总量下降35.3%(表6),其中黄酒的主要高级醇——异戊醇和异丁醇分别降低了50.3%和58.9%。一方面可能由于强化乳酸菌使醪液中总酸含量提高,从而抑制了酵母代谢形成高级醇;另一方面可能由于采用较低的主酵温度(24 ℃)所致[21]。酯类是黄酒最重要的香气化合物,高酸黄酒中总酯含量较对照黄酒有所提高,可能由于高含量的有机酸促进了酯化反应。
表5 高酸黄酒和对照黄酒中游离氨基酸含量 单位:mg/L
Table 5 Contents of free amino acids in high-acidity Huangjiu and control Huangjiu

氨基酸高酸黄酒对照黄酒天冬氨酸149.21±1.22278.67±3.19甘氨酸 115.56±4.92198.81±2.48丙氨酸 366.52±4.92739.00±6.20丝氨酸 200.03±3.98496.70±4.28苏氨酸 79.15±0.28160.68±2.13半胱氨酸68.36±0.8793.78±0.95脯氨酸 215.28±2.10367.79±2.95组氨酸 59.78±0.58104.55±0.29精氨酸 745.54±4.18775.18±4.79缬氨酸 105.67±1.39225.93±2.03亮氨酸 238.13±2.44360.40±2.78异亮氨酸83.26±0.43147.84±0.55苯丙氨酸134.88±1.32228.34±1.30赖氨酸 161.09±3.61253.23±2.34酪氨酸 126.23±2.11248.67±3.49谷氨酸 347.41±4.20652.57±5.32总计 3 016.105 332.15
表6 高酸黄酒和对照黄酒中主要挥发性风味物质含量 单位:mg/L
Table 6 Contents of volatile flavor compounds in high-acidity Huangjiu and control Huangjiu
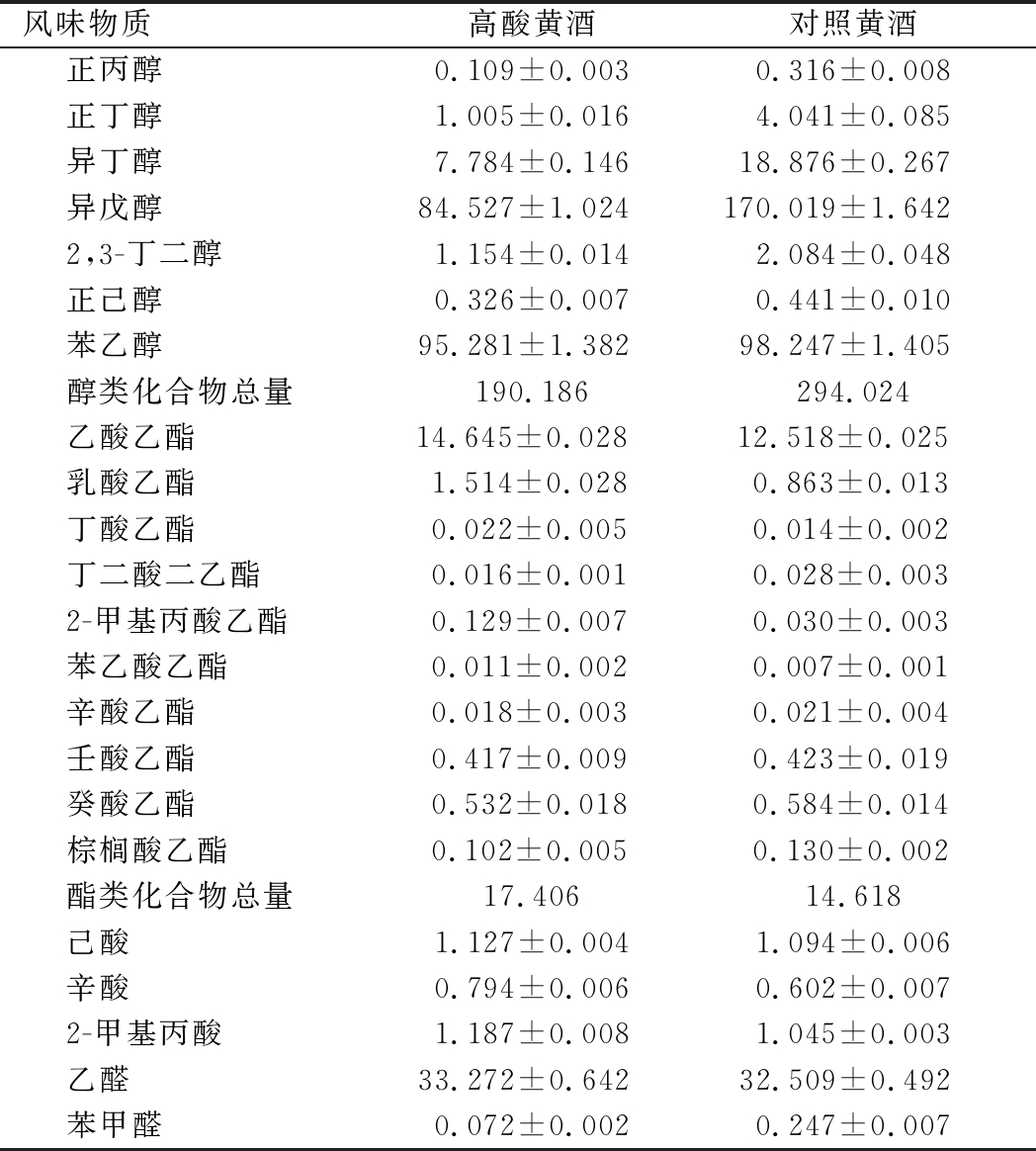
风味物质高酸黄酒对照黄酒正丙醇0.109±0.0030.316±0.008正丁醇1.005±0.0164.041±0.085异丁醇7.784±0.14618.876±0.267异戊醇84.527±1.024170.019±1.6422,3-丁二醇1.154±0.0142.084±0.048正己醇0.326±0.0070.441±0.010苯乙醇95.281±1.38298.247±1.405醇类化合物总量190.186294.024乙酸乙酯14.645±0.028 12.518±0.025 乳酸乙酯1.514±0.0280.863±0.013丁酸乙酯0.022±0.0050.014±0.002丁二酸二乙酯0.016±0.0010.028±0.0032-甲基丙酸乙酯0.129±0.0070.030±0.003苯乙酸乙酯0.011±0.0020.007±0.001辛酸乙酯0.018±0.0030.021±0.004壬酸乙酯0.417±0.0090.423±0.019癸酸乙酯0.532±0.0180.584±0.014棕榈酸乙酯0.102±0.0050.130±0.002酯类化合物总量17.40614.618己酸1.127±0.0041.094±0.006辛酸0.794±0.0060.602±0.0072-甲基丙酸1.187±0.0081.045±0.003乙醛33.272±0.64232.509±0.492苯甲醛0.072±0.0020.247±0.007
3 结论
通过单因素试验和均匀实验设计优化,得到强化乳酸菌酿造高酸黄酒的最佳工艺为乳酸菌投料时接种、接种量为5.3%、麦曲添加量为17%(质量分数)、料水比为1∶2.5(g∶mL)、主酵温度为24 ℃。在此条件下,酿制的高酸黄酒酒精度为12.5%vol,总酸含量高达17.5 g/L。与对照黄酒相比,高酸黄酒中总酸和乳酸含量分别提高326.8%和397.2%,3种生物胺含量下降34.5%,高级醇总量下降35.3%。因此,通过强化乳酸菌酿造高酸黄酒,用于低度黄酒生产的调酸能提高产品品质和安全。该工艺与常规黄酒酿造工艺相比,除强化乳酸菌发酵、降低主酵温度、提高料水比外,其他工艺条件基本不变,因而便于推广应用。
[1] 马建军, 黄东红.低度黄酒的生产工艺[J].酿酒, 2005, 32(4):65.
MA J J, HUANG D H.Production techniques of low degree yellow rice wine[J].Liquor Making, 2005, 32(4):65.
[2] 杨国军. 低度保健型黄酒的研制开发[J].酿酒, 2001, 28(3):81-82.
YANG G J.Development of low alcohol health yellow rice wine[J].Liquor Making, 2001, 28(3):81-82.
[3] 周广麒, 尹丽杰, 王培忠.黄酒降度的工艺研究[J].大连工业大学学报, 2011, 30(6):420-422.
ZHOU G Q, YIN L J, WANG P Z.Process of reducing alcohol degree of rice wine[J].Journal of Dalian Polytechnic University, 2011, 30(6):420-422.
[4] 刘文容, 陈双, 徐岩.黄酒贮存酸败关键微生物的分离鉴定[J].微生物学通报, 2018, 45(1):120-128.
LIU W R, CHEN S, XU Y.Identification and characterization of spoilage microorganisms in aging Chinese rice wine by culture-independent and culture-dependent technologies[J].Microbiology China, 2018, 45(1):120-128.
[5] PERES R G, MORAES E P, MICKE G A, et al.Rapid method for the determination of organic acids in wine by capillary electrophoresis with indirect UV detection[J].Food Control, 2009, 20(6):548-552.
[6] 陈历水, 沈雪梅, 刘蕾, 等.黄酒生产过程中细菌群落结构与生物胺含量变化分析[J].食品研究与开发, 2018, 39(11):76-83.
CHEN L S, SHEN X M, LIU L.Analysis of changes about bacterial community structure and biogenic amines during the production of rice wine[J].Food Research and Development, 2018, 39(11):76-83.
[7] 彭林, 金建顺, 傅祖康, 等.黄酒饮后不同物质的代谢差异[J].酿酒科技, 2019, 301(7):17-22.
PENG L, JIN J S, FU Z K, et al.Pharmacokinetic difference of various compounds after drinking Huangjiu[J].Liquor-Making Science & Technology, 2019, 301(7):17-22.
[8] SUN H L, LIU S P, MAO J Q, et al.New insights into the impacts of Huangjiu compontents on intoxication[J].Food Chemistry, 2020, 317:126420.
[9] 朱小芳, 张凤杰, 俞剑燊, 等.黄酒浸米水中细菌群落结构及优势菌代谢分析[J].食品科学, 2017, 38(10):82-86.
ZHU X F, ZHANG F J, YU J S, et al.Analysis of microbial community structure and metabolic characteristics of dominant microbes in rice milk for yellow wine[J].Food Science, 2017, 38(10):82-86.
[10] LIU S P, CHEN Q L, ZOU H J, et al.A metagenomic analysis of the relationship between microorganisms and flavor development in Shaoxing mechanized Huangjiu fermentation mashes[J].International Journal of Food Microbiology, 2019, 303:9-18.
[11] 张振东, 王菲, 王丹丹, 等.乳酸菌干预浸米过程对黄酒品质的影响[J].保鲜与加工, 2019, 19(6):90-95.
ZHANG Z D, WANG F, WANG D D, et al.Effect of lactic acid bacteria intervention on quality of rice wine during rice soaking[J].Storage and Process, 2019, 19(6):90-95.
[12] 谢广发, 曹钰, 程斐, 等.应用生物酸化浸米技术生产黄酒[J].食品与生物技术学报, 2014, 33(2):217-223.
XIE G F, CAO Y, CHENG F, et al.Effect of biological acidification soaking technology on Chinese rice wine brewing[J].Journal of Food Science and Biotechnology, 2014, 33(2):217-223.
[13] ZHANG Q, HUO N R, WANG Y H, et al.Aroma-enhancing role of Pichia manshurica isolated from Daqu in the brewing of Shanxi Aged Vinegar[J].International Journal of Food Properites, 2017, 20(9):2 169-2 179.
[14] WANG Z M, LU Z M, SHI J S, et al.Exploring flavour-producing core microbiota in multispecies solid-state fermentation of traditional Chinese vinegar[J].Scientific Reports, 2016, 6:26818.
[15] 王晓勇. 汾酒醋酸调味酒发酵工艺研究[D].太原:山西大学, 2011.
WANG X Y.Study on the fermentation production of acetic acid flavoring liquors for Fen liquors[D].Taiyuan:Shanxi University, 2011.
[16] 余永建, 邓晓阳, 陆震鸣, 等.高效液相色谱法定量分析固态发酵食醋中有机酸的方法优化[J].食品科学, 2014, 35(4):55-59.
YU Y J, DENG X Y, LU Z M, et al.An optimized method for the analysis of organic acids in solid-state fermented vinegars by high performance liquid chromatography[J].Food Science, 2014, 35(4):55-59.
[17] 栾光辉, 刘春凤, 李崎.不同啤酒生物胺含量的比较[J].食品与发酵工业, 2013, 39(1):176-180.
LUAN G H, LIU C F, LI Q.The comparison of biogenic amine content in different beers[J].Food and Fermentation Industries, 2013, 39(1):176-180.
[18] 芮鸿飞, 张晓瑜, 刘兴泉, 等.PITC柱前衍生-反相高效液相色谱法测定黄酒中游离氨基酸和生物胺[J].食品科学, 2016, 37(8):159-163.
RUI H F, ZHANG X Y, LIU X Q, et al.Simultaneous determination of free amino acids and biogenic amines in Chinese rice wine by RP-HPLC with pre-column phenylisothiocyanate (PITC) derivatization[J].Food Science, 2016, 37(8):159-163.
[19] LUO T, FAN W L, XU Y.Characterization of volatile and semi-volatile compounds in Chinese rice wines by headspace solid phase microextraction followed by gas chromatography-mass spectrometry[J].Journal of the Institute of Brewing, 2008, 114(2):172-179.
[20] CHEN S, XU Y, QIAN M C.Comparison of the aromatic profile of traditional and modern types of HuangJiu (Chinese rice wine) by aroma extract dilution analysis and chemical analysis[J].Flavour and Fragrance Journal, 2018, 33(3):263-271.
[21] 陈青柳, 刘双平, 唐雅凤, 等.绍兴机械黄酒发酵过程中风味物质变化[J].食品科学, 2018, 39(14):221-228.
CHEN Q L, LIU S P, TANG Y F, et al.Changes in flavor components during fermentation process of mechanically produced Shaoxing rice wine[J].Food Science, 2018, 39(14):221-228.
[22] 谢广发,寿虹志,周建弟. 黄酒酿造技术[M].第三版.北京:中国轻工业出版社, 2020:48-90.
XIE G F,SHOU H Z,ZHOU J D.Brewing Technology of Huangjiu[M].3th ed.Beijing:China Light Industry Press, 2020:48-90.
[23] CHEN S, XU Y.Effect of ‘wheat Qu’ on the fermentation processes and volatile flavour-active compounds of Chinese rice wine (Huangjiu)[J].Journal of the Institute of Brewing, 2013, 119(1-2):71-77.
[24] 陈红兰, 吴宗文, 谢广发.贮存酸败黄酒有机酸分析[J].酿酒科技, 2017, 272(2):78-81.
CHEN H L, WU Z W, XIE G F.Detection of organic acids in rancid yellow rice wine in storage[J].Liquor-Making Science & Technology, 2017, 272(2):78-81.
[25] 王然然, 李晓敏, 陈柳, 等.黄酒发酵过程中乳酸菌的分离及对其产生物胺能力的评价[J].食品与发酵工业, 2017, 43(1):12-17.
WANG R R, LI X M, CHEN L, et al.Detection of biogenic amines produced by lactic acid bacteria isolated from the fermentation process of Chinese rice wine[J].Food and Fermentation Industries, 2017, 43(1):12-17.
[26] 徐建芬, 毛杰琪, 魏晓璐, 等.黄酒中不产生物胺乳酸菌的筛选及应用[J].食品与机械, 2017, 33(9):20-25.
XU J F, MAO J Q, WEI X L, et al.Study on isolation and application of lactic acid bacteria without biogenic amine formation from Chinese rice wine[J].Food & Machinery, 2017, 33(9):20-25.
[27] 李童, 孙军勇, 吴殿辉, 等.YDL080C和LEU2基因敲除对工业黄酒酵母异戊醇生成量的影响[J].食品工业科技, 2015, 36(15):189-193.
LI T, SUN J Y, WU D H, et al.Effect of YDL080C and LEU2 gene knockout on isoamyl alcohol production in industrial yellow rice wine yeast[J].Science and Technology of Food Industry, 2015, 36(15):189-193.
[28] 黄桂东, 吴子蓥, 唐素婷, 等.黄酒中高级醇含量控制与检测研究进展[J].中国酿造, 2018, 37(1):7-11.
HUANG G D, WU Z Y, TANG S T, et al.Research progress on control and detection of higher alcohols contents from Chinese rice wine[J].China Brewing, 2018, 37 (1):7-11.