膳食纤维(dietary fiber, DF)是一种广泛分布于天然植物中但不能被人体消化的多糖[1]。近年来大量研究表明,DF具有多种重要的生理功能,如改变肠胃对营养物质的消化与吸收,降低人体高血糖和高血脂的发生概率;限制胆盐的吸收水平,调节血浆中的胆固醇含量;影响肠道转运,微生物的生长和代谢,降低糖代谢紊乱和心血管疾病等作用[2]。此外,DF对于肠道菌群还具有益生效应,DF的摄入不足会使肠道微生物群降解富含糖蛋白的黏液层来代替DF的功能,从而降低黏液层对肠道的保护,最终致使肠道环境暂时或永久性转变,表现为细菌多样性和丰富度降低[3]。
竹笋膳食纤维(bamboo shoot dietary fiber,BSDF),主要由纤维素、木质素和不溶性的半纤维素等组成,具有较高的持水能力和膨胀能力[4]。BSDF具有抗氧化、抗炎、抗糖尿病、预防肥胖等多种功能。研究证实,BSDF可以显著的减轻体重,通过抑制肝脏合成脂肪的基因,减少脂质的合成,从而降低血清中的总胆固醇和甲状腺球蛋白[5];同时,增加食品系统中的黏度,降低人血糖和血清胆固醇含量,显著缩短食物糜的转运时间,增加粪便体积,预防便秘[6];改变胆汁盐酸的含量,影响肠道菌群生长和丰度[2]。乳酸菌是人体内必不可少的且具有重要生理功能的益生菌,广泛存在于人体肠道中[7]。研究表明,菊粉作为益生元通过调节乳酸菌能量代谢,产生短链脂肪酸促进乳酸菌生长[8]。因此,我们假设BSDF在调节人体肠道菌群以及作为益生元等方面也具有相似的作用效果。所以,本文以BSDF为原料,测定其基本成分、单糖组成以及重均分子量,并以菊粉为阳性对照,探究BSDF在消化液中的抗消化能力,同时选取乳酸菌L1(Lactobacillus fermentum)和乳酸菌L2(Lactobacillus plantaum)作为乳酸菌模型,研究BSDF对乳酸菌生长的影响,以期为BSDF益生功能的研究及产品开发提供理论参考。
1 材料与方法
1.1 材料与试剂
金佛山方竹笋加工副产物,重庆特珍农业开发有限公司;乳酸菌L1(Lactobacillus fermentum)、L2(Lactobacillus plantaum),中匈食品科学合作研究中心;牛肉膏、蛋白胨、酵母浸膏,北京奥博星生物有限公司;菊粉、胃蛋白酶(2 500 U/g)、胰蛋白酶(2 500 U/g)、木瓜蛋白酶(800 U/g),上海源叶生物科技有限公司;DNS试剂,索莱宝公司;吐温80、乙酸钠、柠檬酸三铵、葡萄糖、苯酚、硫酸镁、硫酸锰、氯化钠、磷酸氢二钾等试剂均为分析纯,成都科隆化学品有限公司;三氟乙酸为色谱纯、甲醇为分析纯,上海安谱公司;单糖标准品,Sigma公司。
1.2 仪器与设备
HH-ZK8数显恒温水浴锅,巩义市予化仪器有限责任公司;FA1004A电子分析天平,上海精天电子仪器有限公司;GR60DA高压灭菌锅,美国Zealway公司;LRHS-150-℃恒温恒湿培养箱,上海跃进医疗器械有限公司;SW-CJ-1FD洁净工作台,苏净集团苏州安泰空气技术有限公司;BPH-7100ApH计,贝尔分析仪器有限公司;ICS 5000离子色谱,美国Thermo;BI-200SM动静态光散射仪,美国Brookhaven。
1.3 BSDF的制备
根据汪楠等[9]的方法制备BSDF。取方竹笋笋头、笋脚等加工副产物,洗净切片,用沸水将笋肉漂烫7 min,60 ℃烘干,粉碎过筛得到全粉。全粉中加入800 U/g的木瓜蛋白酶,控制料液比为1∶20(g∶mL),55 ℃酶解2 h后灭菌,纯水洗涤后过滤,收集滤渣,冷冻干燥并粉碎,获得BSDF粉末。
1.4 BSDF基本成分、重均分子量及单糖组成测定
1.4.1 BSDF基本成分测定
水分含量测定:参照GB 5009.3—2016《食品中水分的测定》;蛋白质含量测定:参照GB 5009.5—2016《食品中蛋白质的测定》;膳食纤维含量测定:参照GB 5009.88—2014《食品中膳食纤维的测定》;脂肪含量的测定:参照GB/T 5009.6—2003《食品中脂肪的测定》;总灰分含量的测定:参照GB 5009.4—2016《食品中灰分的测定》。
1.4.2 BSDF重均分子量测定
将BSDF分别配制成质量浓度为0.2、0.4、0.6、0.8、1.0 mg/mL的溶液,通过0.45 μm微孔滤膜过滤4次。采用动静态光散射仪在640 nm下对样品的静态光散射进行测量,25 ℃下测量角范围为30°~150°,用甲苯作为参比物。数据分析采用Zimm plot方法。
1.4.3 BSDF单糖组成的测定
根据LI等[7]的方法,采用高效阴离子色谱分析逐级醇沉多糖组分的单糖组成,利用离子色谱系统及电化学检测器对BSDF的单糖组分进行分析检测。
1.5 BSDF在胃中的抗消化能力
根据ZHANG等[10]的方法并略加修改,配制人工胃液:称量8.0 g氯化钠、0.2 g氯化钾、8.25 g二水合磷酸氢二钠,14.35 g磷酸二氢钠、0.1 g二水氯化钙、0.18 g六水合氯化镁、5.0 g胃蛋白酶,溶解于500 mL蒸馏水中搅拌均匀定容至1 000 mL。并用1 mol/L盐酸分别调节pH为1.5、2.5、3.5。称取1.0 g BSDF加入人工胃液后,于37 ℃恒温加热,在0、1、2、3、4、5、6 h定时取样,按照1.4.2的方法测定重均分子量,并用DNS法测定还原糖含量计算水解率。同时以菊粉作为对照。如公式(1)所示:
水解率![]()
(1)
式中:n0为消化前的总糖含量;n1为初始消化的还原糖含量;n2为不同时间测得的还原糖含量。
1.6 BSDF在肠道中的抗消化能力
根据ZHANG等[10]的方法并略加修改,配制人工肠液:称量3.4 g磷酸二氢钾溶于250 mL蒸馏水,搅拌均匀后调节pH至6.8,后将5.0 g胰蛋白酶溶于100 mL蒸馏水,两者混合定容至500 mL。随后用0.1 mol/L NaOH分别调节pH为7、7.5、8.5。称取1.0 g BSDF加入人工肠液后,于37 ℃恒温加热,在0、1、2、3、4、5、6 h定时取样,按照1.4.2的方法测定重均分子量,并用DNS法测定还原糖含量并计算水解率。同样以菊粉作为对照,水解率计算同公式(1)。
1.7 BSDF对乳酸菌生长的影响
1.7.1 培养基制备
根据张梦云[11]的方法并改进,制备BSDF为碳源的基础培养基。按照1∶100、2∶100、3∶100(g∶mL)将BSDF加入100 mL蒸馏水中,振荡均匀后于80 ℃恒温水浴搅拌1 h,随后加入1.0 g蛋白胨、1.0 g牛肉膏、0.5 g酵母浸膏、0.5 g乙酸钠、0.2 g柠檬酸三铵、0.1 g吐温80、0.2 g磷酸氢二钾、0.05 g硫酸镁、0.005 g硫酸锰。混合均匀后放入灭菌锅中,121 ℃灭菌20 min后倒入无菌离心管,8 000×g离心5 min。之后放入灭菌后的锥形瓶中备用。按照相同步骤及比例,制备菊粉为碳源的基础培养基(10、20、30 g/L);制备20 g/L葡萄糖为碳源的基础培养基,作为阳性对照,以不添加葡萄糖的培养基为空白对照。
1.7.2 乳酸菌接种
在洁净工作台上,用无菌移液枪移取100 μL菌液注入培养基中,振荡均匀后,放入37 ℃培养箱中培养24 h。
1.7.3 乳酸菌生长过程中pH的测定
在接种乳酸菌之后的0、2、4、6、8、10、12、24 h取菌液5 mL,用pH计测定并记录时间所对应菌液的pH值。
1.7.4 乳酸菌产酸能力的测定
在接种乳酸菌之后的0、2、4、6、8、10、12、24 h取菌液5 mL,装入灭菌的烧杯中,加入10 mL蒸馏水,滴加0.3 mL酚酞显色剂,用0.1 mol/L NaOH溶液滴定,直至有粉红色产生并且30 s内不褪色,记录所消耗的溶液体积。
1.7.5 乳酸菌生长曲线的测定
在接种乳酸菌之后的0、2、4、6、8、10、12、24 h取1 mL菌液加入灭菌离心管中,3 000 r/min离心5 min后,将2 mL生理盐水加入沉淀中,生理盐水作为对照,测定600 nm下的吸光度,并绘制生长曲线。
1.8 数据分析
使用SPSS 25统计软件,对数据进行方差分析;实验数据通过数据分析系统软件对数值进行差异显著性分析(P<0.05)。每个实验重复3次。使用Origin 2018软件对数据进行处理绘图。
2 结果与分析
2.1 BSDF基本成分及单糖组成
BSDF的基本成分如表1所示。含量最高的组分为膳食纤维(64.90%),其次是蛋白质(11.41%)、水分(10.44%)和灰分(8.61%)。而总膳食纤维(total dietary fiber,TDF)含量为64.90%,不溶性膳食纤维(insoluble dietary fiber,IDF)含量为58.12%,水溶性膳食纤维(soluble dietary fiber,SDF)含量为6.78%。这说明提取的BSDF为粗提物,原料中的蛋白质并未全部除去,可能有部分膳食纤维与蛋白结合较紧密。BSDF的重均分子量为2.02×107 g/mol,这说明BSDF是一种混合高聚物。
表1 BSDF的基本成分及重均分子量
Table 1 Basic composition and weight average molecular of BSDF
样品水分/%蛋白质/%脂肪/%灰分/%TDF/%IDF/%SDF/%重均分子量/(g·mol-1)BSDF10.44±1.5011.41±1.123.30±0.018.61±0.6664.90±1.2858.12±1.116.78±0.17(2.02±0.36)×107
表2为BSDF的单糖组成。BSDF由10种单糖组成,分别为岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、甘露糖醛酸、半乳糖醛酸和核糖,其中相对含量较高的单糖有葡萄糖、阿拉伯糖、木糖、半乳糖醛酸和甘露糖,分别为39.72%、12.77%、12.69%、9.30%和8.67%。这一结果与万仁口等[12]对BSDF研究中的单糖种类大体相同,但含量略有不同,可能是由于竹笋种类和取样部位不同而导致的。BSDF中的阿拉伯糖、木糖、半乳糖醛酸、甘露糖等单糖均可促进乳酸菌的产酸能力[11],而葡萄糖可以作为能量供应的主要来源。因此,BSDF作为一种新型的益生元具有潜在应用价值。
表2 BSDF的单糖组成 单位:%(相对含量)
Table 2 Monosaccharide composition of BSDF
样品岩藻糖鼠李糖阿拉伯糖半乳糖葡萄糖木糖甘露糖核糖半乳糖醛酸甘露糖醛酸BSDF0.60±0.321.86±1.6412.77±2.136.55±1.3239.72±3.9412.69±4.468.67±2.506.11±1.229.30±0.971.72±0.23
2.2 BSDF在人工胃液中的抗消化能力
在健康人体内,胃液pH值大致在1.5~3.5,而食物在进入人体内大约6 h后排出,当食物进入胃中,pH一般会升高至3.5左右[13]。因此,本实验研究了BSDF在pH值分别为1.5、2.5、3.5的人工胃液中6 h的消化性。水解率可以反映出模拟胃液中BSDF 的抗消化能力。如图1-a所示,BSDF在人工胃液中处理1~2 h,其水解率变化较大,2 h后水解率变化逐渐平缓;而菊粉在0~1 h内水解率的变化较大,1 h后变化趋于平缓。6 h时,pH值1.5时菊粉的水解率为18.37%,高于pH值为2.5与3.5时的水解率,这说明酸性越强,越有利于菊粉分解。6 h后,两种样品在相同的pH值下的水解率相差不大,这说明此时在人工胃液中,菊粉和BSDF的抗消化能力没有显著性差别。
由图1-b可知,经人工胃液消化后,BSDF的重均分子量均呈下降趋势。0 h时,BSDF在pH值为1.5、2.5、3.5的消化液中重均分子量分别为2.02×107、2.11×107、1.98×107 g/mol,经过6 h消化,pH为1.5 环境下BSDF的重均分子量降到7.0×106 g/mol。此外,在pH为1.5和2.5环境下BSDF的重均分子量要低于pH值为3.5的重均分子量,表明pH值越低越能促进BSDF的降解。
2.3 BSDF在人工肠液中的抗消化能力
健康人体肠道偏碱性(pH值7.5~8.5),一般进食后6 h内,pH会升高。人工肠液中不同时间点的水解率和重均分子量的变化可以反映出BSDF在肠液中的抗消化能力[14]。因此,本实验研究了BSDF在pH值分别为7、7.5、8.5的人工肠液中6 h的消化性。如图2-a所示,BSDF在人工肠液中的水解率变化较菊粉平缓,在处理6 h、pH值为7时,BSDF的水解率为31.08%,低于菊粉的水解率(45.46%),说明BSDF对肠液的抗消化能力较菊粉更强。经人工肠液消化后,BSDF的重均分子量均呈现下降趋势(图2-b)。0 h时,BSDF在pH值为7、7.5、8.5的消化液中重均分子量分别为2.02×107、2.26×107、2.14×107 g/mol,6 h消化后,BSDF的重均分子量分别降低至5.9×106、5.8×106、5.4×106 g/mol。
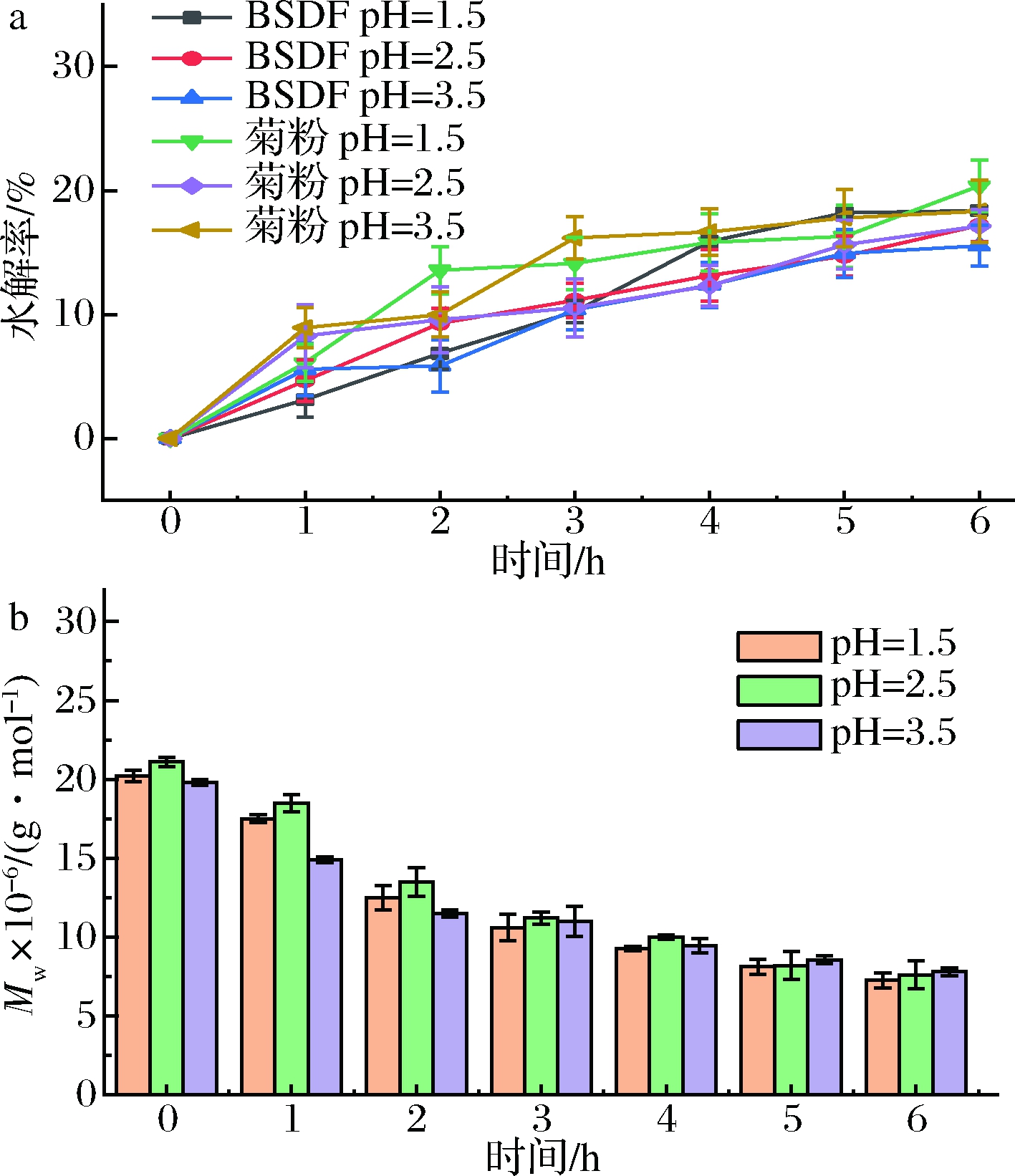
a-水解率;b-重均分子量
图1 BSDF在人工胃液中水解率与重均分子量的变化
Fig.1 The changes of hydrolysis rate and weight average molecular weight of BSDF in artificial gastric fluid
2.4 BSDF对乳酸菌生长的影响
2.4.1 BSDF对乳酸菌生长过程中pH的影响
在乳酸菌生长的过程中,pH值可以作为一项重要的参考指标来反映乳酸菌的生长情况[15]。如图3-a所示,处理0~4 h,不同BSDF浓度的培养基中pH值变化不明显,而处理4~12 h,pH值发生较大变化,12 h后变化趋于平缓。在质量浓度为10、20 g/L 时,BSDF促进乳酸菌L1产酸能力要强于菊粉,但是30 g/L的BSDF促进乳酸菌L1产酸能力要弱于菊粉。乳酸菌L2在BSDF培养基中pH值变化趋势与乳酸菌L1相同(图3-b)。随着时间增加,BSDF浓度越大,pH变化越强烈,说明产生酸性物质的能力更强。但是相同浓度下,乳酸菌L2在菊粉培养基pH值的变化较BSDF大,这说明菊粉对于乳酸菌L2的产游离酸能力更强。
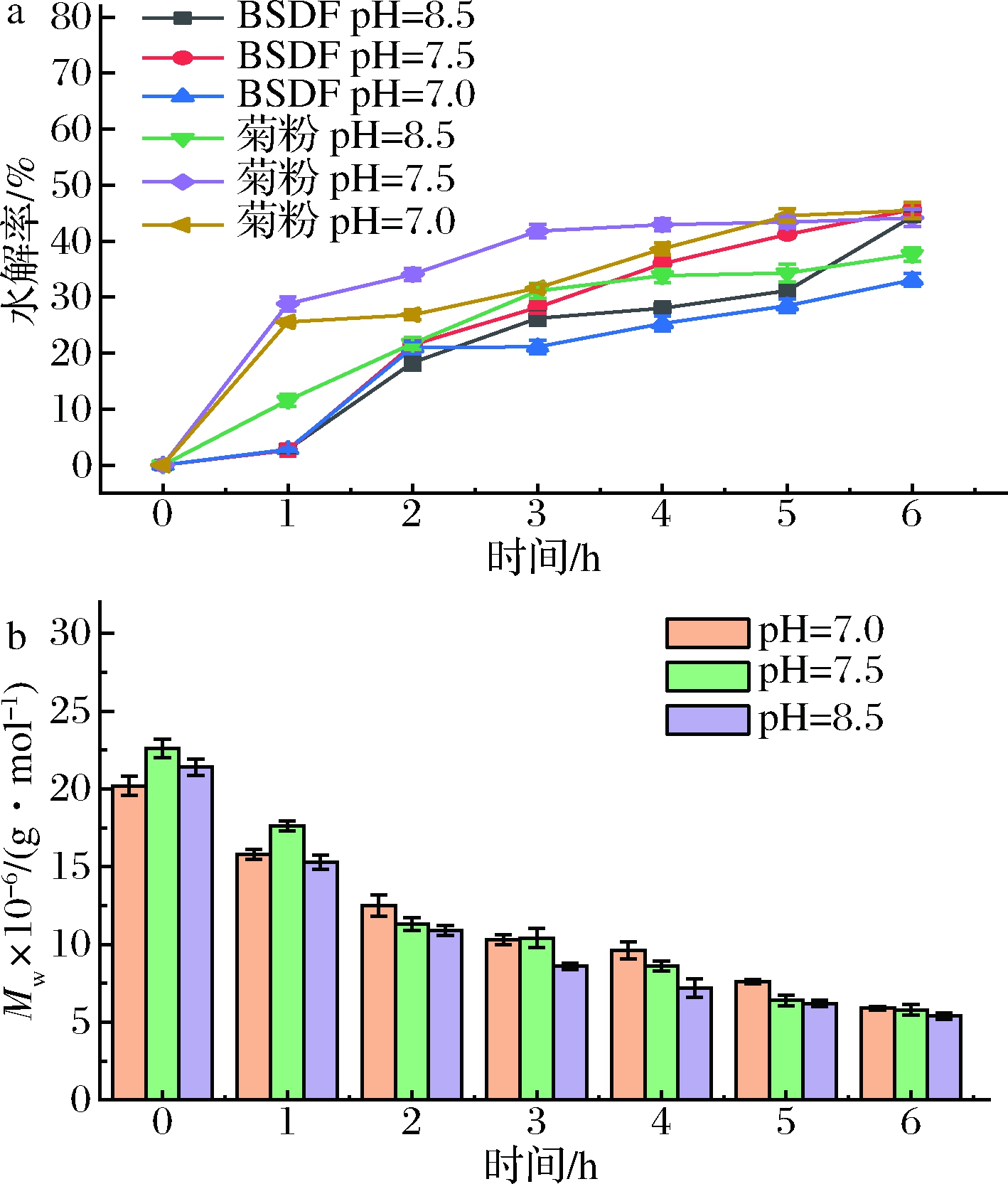
a-水解率;b-重均分子量
图2 BSDF在人工肠液中水解率与重均分子量的变化
Fig.2 The changes of hydrolysis rate and weight average molecular weight of BSDF in artificial intestinal fluid

a-乳酸菌L1;b-乳酸菌L2
图3 乳酸菌L1与乳酸菌L2在不同碳源培养基中pH值的变化曲线
Fig.3 pH value curve of L1 and L2 in different carbon source medium
2.4.2 BSDF对乳酸菌产酸能力的影响
益生菌在人体肠道中利用碳源发酵产生乳酸、短链脂肪酸等弱酸性物质,由于弱酸无法完全电离,导致有一部分氢离子无法被pH值衡量,因此总酸含量也是作为衡量乳酸菌益生效果的重要指标[15]。如图4-a所示,处理6~8 h,乳酸菌L1在BSDF培养基中的总酸含量均明显增加,而其他时间变化较为平缓,且无碳源组变化不明显,这说明BSDF可以提升乳酸菌L1的产总酸能力。随着BSDF浓度增大,乳酸菌L1产生酸性物质的能力也在增加。在相同浓度下,BSDF相较于菊粉对乳酸菌L1有更强促进产酸的能力。
如图4-b所示,乳酸菌L2在不同碳源培养基中总酸含量的变化与乳酸菌L1基本一致。处理至6~8 h,BSDF培养基中总酸的含量均明显增加,而其他时间变化较为平缓,且无碳源组变化不明显,说明BSDF可以提升乳酸菌L2的产总酸能力。随着BSDF浓度的增加,总酸的浓度均明显增加。在相同浓度下,BSDF与菊粉对乳酸菌L2所产生的影响基本一致。

a-乳酸菌L1;b-乳酸菌L2
图4 乳酸菌L1与乳酸菌L2在不同碳源培养基中总酸含量的变化曲线
Fig.4 The curve of the total acid content of L1 and L2 in different carbon source medium
2.4.3 BSDF对乳酸菌生长曲线的影响
生长曲线主要反映了微生物生长情况及微生物所在的生长期,且主要是菌体数量的生长情况。由图5-a可知,处理0~4 h,乳酸菌L1在BSDF培养基中浊度变化很小,处理4~12 h,BSDF培养基中均产生了显著的浊度变化,12 h后变化趋于平缓,且无碳源组,浊度基本不变,说明BSDF对乳酸菌L1生长具有促进作用。当BSDF的浓度增加时,浊度也相应增加。相同浓度下,BSDF处理的浊度变化要高于菊粉,这表明BSDF对于乳酸菌L1的生长具有更强的促进作用。乳酸菌L2在不同碳源培养基中的生长曲线与乳酸菌L1大体相同(图5-b),相同浓度的BSDF和菊粉对乳酸菌L2的浊度变化影响也基本一致,表明BSDF和菊粉对促进乳酸菌L2生长的能力相当。
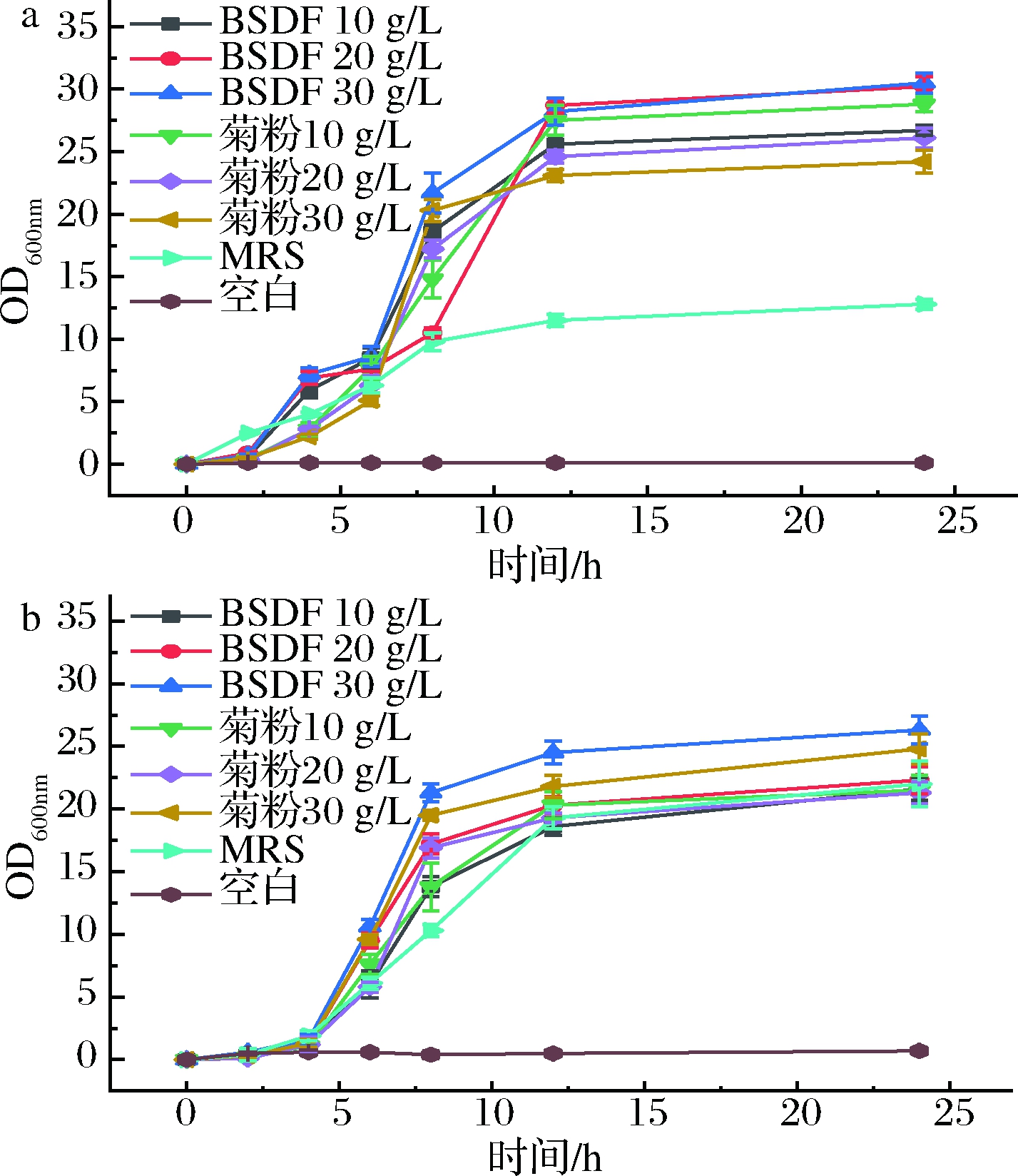
a-乳酸菌L1;b-乳酸菌L2
图5 乳酸菌L1与乳酸菌L2在不同碳源培养基中的生长曲线
Fig.5 Growth curves of L1 and L2 in different carbon source media
3 讨论
本文以BSDF为研究对象,并以菊粉作为对照,通过培养两种不同的乳酸菌(乳酸菌L1、乳酸菌L2),并在不同时间下对BSDF的抗胃液消化能力、抗肠液消化能力以及对乳酸菌生长的pH、总酸含量、生长曲线等指标进行了测定。
(1)BSDF的体外抗消化能力
体外消化是一种模拟食物在人体胃肠道内消化过程的方法,测定BSDF的抗消化性可以作为判断其能否进入结肠产生功能的依据。在消化液中BSDF的重均分子量下降,水解率上升,这可能是由于消化过程中BSDF的部分蛋白质分解所致。研究表明,高分子量的膳食纤维可通过增加胃肠道内容物黏度阻碍酶与底物的接触,降低葡萄糖等小分子的扩散速率,降低消化液中还原糖含量,产生抗消化性[16]。BSDF具有结构无定型区域含量低,区域结构不易破坏,糖苷键种类繁多的特点[17];菊粉的长链大分子中糖苷键主要为β(1→2)糖苷键,糖苷键种类相较于BSDF简单,断裂更为容易[15]。在人工胃液中,pH值越低越不利于食糜黏度的增加,使更多的底物被水解为还原糖,同时BSDF在pH值为8.5的环境下,一些分子间的相互作用力减小,破坏了BSDF的微观结构,不定性区域增加,结构不稳定,更多亲水基暴露,使BSDF更容易大面积的与酶进行结合,使糖苷键断裂,从而表现出不同的消化性[18]。综上所述,BSDF的抗肠胃液消化能力要高于菊粉,且胃液pH值降低或肠液pH值的增高都会导致BSDF的抗消化性降低。
(2)BSDF对乳酸菌生长的影响
BSDF作为一种从高纤维食品竹笋中提取出的DF,在维持膳食平衡方面发挥着重要的作用。BSDF影响糖尿病小鼠的空腹血糖、糖耐受量和胰岛素水平,表明其具有降血糖作用[5]。此外,BSDF可通过促进肠道蠕动[2],吸收胆汁酸降低血液中胆固醇的含量。本研究发现,随着发酵时间的延长,发酵产物的pH值下降,总酸含量及菌体浊度升高,说明两种乳酸菌均能够利用BSDF产酸。LI等[19]研究结果表明肠道菌群能够发酵膳食纤维,产生短链脂肪酸、乳酸等物质,从而增加总酸含量,降低pH值,这与本研究结果相似。与此同时,乳酸菌L1和乳酸菌L2的菌体浊度均有显著性提高,说明BSDF对两种乳酸菌产生了一定的益生作用。
对于乳酸菌L1来说,产酸能力随着BSDF浓度增加而增大。BSDF中的单糖为乳酸菌L1的生长提供了良好的碳源单糖,这也与实验中MRS培养基的结果一致。同时由于10 g/L的BSDF相较于20 g/L所提供的碳源浓度较少,BSDF水解产生的益生单糖浓度较少,而具有益生效应的单糖可以促进乳酸菌L1的生长繁殖,在一定范围内浓度越高,益生效果越好[20]。同时,菌体浊度的变化表明,在一定范围内增加BSDF的浓度,会促进乳酸菌L1的生长。而总酸的产量与pH值结果类似,高浓度BSDF产生的总酸含量较高,可能是由于乳酸菌L1大量利用BSDF产生弱酸,在pH值降低过快的环境中,无法更好的电离出游离氢离子,从而导致总酸的堆积,这与ZHU等[20]的研究结果一致。相较而言,高浓度的菊粉对于乳酸菌L1的pH值前期影响较小,产生酸性物质较少,pH值更适合乳酸菌L1产游离酸,而在总酸与菌体浊度上效果较差。总体而言,BSDF相比于菊粉更有利于乳酸菌L1生长。
对于乳酸菌L2,在BSDF培养基中pH值逐渐降低最后趋于平缓。这可能是BSDF大分子裂解后,具有益生效果的单糖得以暴露[20],有利于乳酸菌L2发酵。当pH值过低时,乳酸菌L2繁殖与代谢受到抑制,pH值、总酸含量和菌体浊度变化趋于平缓,表明pH值过低不利于BSDF对于乳酸菌L2的益生作用。这与TANG等[21]对于葡萄柚皮黄酮的研究结果基本一致。而相同浓度的菊粉相比于BSDF而言,pH值变化范围要广,这可能是由于菊粉的分子质量小,空间结构较简单,乳酸菌L2对菊粉利用性更好,能产生更多的游离酸。30 g/L的BSDF对于乳酸菌的益生效果要高于10、20 g/L 的BSDF,这可能是30 g/L的BSDF所提供的碳源浓度更大,使乳酸菌L1的产游离酸能力更好。总酸由游离酸与非游离酸组成,且影响pH值的通常为游离酸水解所产生的氢离子的浓度,而还有一部分酸以结合态出现。相同浓度的BSDF相较于菊粉产总酸的含量较高,与pH值变化不同,说明乳酸菌L2利用BSDF产生更多的非游离酸。同时,在10、20 g/L的BSDF与菊粉处理中浊度变化大致相同,而30 g/L BSDF处理中浊度变化略微高于菊粉,这可能与菊粉发酵产生的低pH值环境不适合乳酸菌L2生长有关[22]。综上,BSDF培养基中乳酸菌L2产生游离酸含量少于菊粉培养基,但乳酸菌L2的生长数量却要优于菊粉对照组。
4 结论
本文以BSDF为研究对象,并以菊粉作为对照,研究了BSDF在人工胃液和人工肠液的抗消化能力,以及对两种乳酸菌生长情况的影响。结果表明,BSDF在胃液中的抗消化能力与菊粉相当,但是在肠液中BSDF比菊粉的抗消化能力更强;通过比较BSDF培养基与菊粉培养基中乳酸菌生长过程中pH值、总酸含量、生长曲线,发现BSDF培养基对两种乳酸菌生长均表现出优良的益生效果。研究结果说明BSDF对乳酸菌的生长具有益生作用,为BSDF作为益生元的开发利用提供了理论依据。
[1] ZIELINSKI G, DEVRIES J W, CRAIG S A, et al.Dietary fiber methods in codex ahmentarius:Current status and ongoing discussions[J].Cereal Foods World, 2013, 58(3):148-152.
[2] GILL S K, ROSSI M, BAJKA B, et al.Dietary fibre in gastrointestinal health and disease[J].Nature Reviews Gastroenterology & Hepatology, 2021, 18(2):101-116.
[3] EARLE K A, BILLINGS G, SIGAL M, et al.Quantitative imaging of gut microbiota spatial organization[J].Cell Host & Microbe, 2015, 18(4):478-488.
[4] LI Q, FANG X, CHEN H, et al.Retarding effect of dietary fibers from bamboo shoot (Phyllostachys edulis) in hyperlipidemic rats induced by a high-fat diet[J].Food & Function, 2021, 12(10):4 696-4 706.
[5] 林良美. 笋壳活性膳食纤维的提取及降糖降脂功能特性研究[D].福州:福建农林大学, 2016.
LIN L M.Extraction, hypoglycemic and hypolipidemic effects of bioactive dietary fiber from bamboo shoot shell[D].Fuzhou:Fujian Agriculture and Forestry University, 2016.
[6] CHRISTODOULIDES S, DIMIDI E, FRAGKOS K C, et al.Systematic review with meta-analysis:Effect of fibre supplementation on chronic idiopathic constipation in adults[J].Alimentary Pharmacology & Therapeutics, 2016, 44(2):103-116.
[7] LI X Z, LIU S Q.Effect of co-inoculation and sequential inoculation of Lactobacillus fermentum and Pichia kluyveri on pork hydrolysates fermentation[J].Food Bioscience, 2021, 44:101400.
[8] 胡婷, 李键, 张玉, 等.菊粉调节能量代谢紊乱机制的研究进展[J].食品科学, 2019, 40(17):325-330.
HU T, LI J, ZHANG Y, et al.Progress in the understanding of the mechanism by which inulin regulates energy metabolism disorders[J].Food Science, 2019, 40(17):325-330.
[9] 汪楠, 黄山, 张月, 等.高温蒸煮协同纤维素酶改性竹笋膳食纤维[J].食品与发酵工业, 2020, 46(4):13-18.
WANG N, HUANG S, ZHANG Y, et al.Modification of bamboo shoot dietary fiber by high temperature cooking combined with cellulase[J].Food and Fermentation Industries, 2020, 46(4):13-18.
[10] ZHANG Y, WANG Y, ZHENG B, et al.The in vitro effects of retrograded starch (resistant starch type 3) from lotus seed starch on the proliferation of Bifidobacterium adolescentis[J].Food & Function, 2013, 4(11):1 609-1 616.
[11] 张梦云. 麦麸膳食纤维的改性和应用及其对乳酸菌的益生效应[D].合肥:合肥工业大学, 2020.
ZHANG M Y.Modification and application of wheat bran dietary fiber and its probiotic effect on lactic acid bacteria[D].Hefei:Hefei Polytechnic University, 2020.
[12] 万仁口, 李功景, 贺杨正, 等.竹笋膳食纤维的结构特性及其功能性质[J].中国食品学报, 2021, 21(5):75-82.
WAN R K, LI G J, HE Y Z, et al.Structural and functional properties of dietary fiber from bamboo shoots[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(5):75-82.
[13] KARADA C,FISHER A,KARA D.The effects of gastric juice acidity on bioaccessibility of some elements in selected foods[J].Journal of Food Composition and Analysis, 2020, 90:103485.
C,FISHER A,KARA D.The effects of gastric juice acidity on bioaccessibility of some elements in selected foods[J].Journal of Food Composition and Analysis, 2020, 90:103485.
[14] HU J L, NIE S P, MIN F F, et al.Artificial simulated saliva, gastric and intestinal digestion of polysaccharide from the seeds of Plantago asiatica L.[J].Carbohydrate Polymers, 2013, 92(2):1 143-1 150.
[15] VALERO-CASES E, FRUTOS M J.Effect of inulin on the viability of L.plantarum during storage and in vitro digestion and on composition parameters of vegetable fermented juices[J].Plant Foods for Human Nutrition, 2017, 72(2):161-167.
![]() LU
LU  ,HERKEN E N.Effect of dietary fibre addition on the selected nutritional properties of cookies[J].Journal of Food Engineering, 2007, 78(1):86-89.
,HERKEN E N.Effect of dietary fibre addition on the selected nutritional properties of cookies[J].Journal of Food Engineering, 2007, 78(1):86-89.
[17] WANG N, WU L R, HUANG S, et al.Combination treatment of bamboo shoot dietary fiber and dynamic high-pressure microfluidization on rice starch:Influence on physicochemical, structural, and in vitro digestion properties[J].Food Chemistry, 2021, 350:128724.
[18] HONG Y S, AHN Y J, PARK J C, et al.1H NMR-based metabonomic assessment of probiotic effects in a colitis mouse model[J].Archives of Pharmacal Research, 2010, 33(7):1 091-1 101.
[19] LI Q, WU W, CHEN H, et al.In vitro fecal fermentation characteristics of bamboo shoot (Phyllostachys edulis) polysaccharide[J].Food Chemistry:X, 2021, 11:100129.
[20] ZHU K X, FAN H F, ZENG S J, et al.Polysaccharide from Artocarpus heterophyllus Lam.(jackfruit) pulp modulates gut microbiota composition and improves short-chain fatty acids production[J].Food Chemistry, 2021, 364:130434.
[21] TANG R X, YU H F, RUAN Z, et al.Effects of food matrix elements (dietary fibres) on grapefruit peel flavanone profile and on faecal microbiota during in vitro fermentation[J].Food Chemistry, 2022, 371:131065.
[22] GONZ LEZ E, G
LEZ E, G MEZ-CARAVACA A M,GIMÉNEZ B, et al.Role of maltodextrin and inulin as encapsulating agents on the protection of oleuropein during in vitro gastrointestinal digestion[J].Food Chemistry, 2020, 310:125976.
MEZ-CARAVACA A M,GIMÉNEZ B, et al.Role of maltodextrin and inulin as encapsulating agents on the protection of oleuropein during in vitro gastrointestinal digestion[J].Food Chemistry, 2020, 310:125976.