我国白酒酿造工艺历史悠久,并随培曲技术的发明与改进,推动了白酒生产的规模化、规范化发展。不同白酒大曲的原料及其配比不同,但多以小麦、大麦、豌豆等为原料压制成曲坯,入曲房自然发酵而成。大曲含有多种微生物和各种酶系,构成酿酒的内在动力;同时大曲自身所含的微生物代谢产物及原料分解产物,直接或间接构成白酒的风味物质,使白酒具有各种不同的独特风味[1-3],故有“曲为酒之骨”之美誉。
堆曲培养(培曲工艺)是决定大曲质量优劣的关键环节,堆曲方式与培曲条件的改变均对大曲质量造成不同程度的影响。李伟安等[4]采用传统与架式2种大曲培养方式,比较两者大曲理化指标与微生物群落结构差异,表明架式大曲更有利于细菌、乳酸菌和霉菌的生长。陈可丹等[5]分析不同顶温的特香型大曲理化指标及微生物群落演替差异,表明中顶温曲的酸性蛋白酶、糖化力、酯化力均高于高顶温曲。邢钢等[6]跟踪测定了3种不同温度大曲制作过程中理化指标变化,结果显示大曲糖化力、酯化力、液化力、发酵力4项指标相差较大,其中中温大曲最优,低温大曲居中,高温大曲最小。明红梅等[7]通过提高制曲品温来探究制曲温度对酱香型大曲质量的影响,结果表明超高温大曲的感官质量优于普通高温大曲,但糖化力与酯化力明显较普通高温大曲更低。
特香型白酒具有“整粒大米为原料、大曲面麸加酒糟、红褚条石垒酒窖”的工艺特征,以及“浓头酱尾清中间、三香俱备犹不靠”的风味特点[8]。目前对特香型大曲的研究多集中在大曲理化指标及采用可培养手段对大曲进行微生物群落分析[9],大曲制作过程中培曲方法对其微生物群落结构影响的报道较少见。本研究以特香型大曲为研究对象,研究不同培曲方法对大曲微生物群落结构的影响,以期解决前期发酵上霉过快、中后期品温下降迅速的问题,为进一步提高特香型大曲质量提供理论与技术参考。
1 材料与方法
1.1 试验材料
1.1.1 大曲样品采集
在江西四特酒有限责任公司大曲车间,取4间曲房,其中2间为常规培曲工艺(traditional culture techniques of Daqu,TT),2间为新培曲工艺(new culture Techniques of Daqu,NT),4间曲房分别于0(曲坯入房)、5、10、15、20、25 d(曲坯出房)5点取样,粉碎后混匀、过筛,置-80 ℃冰箱贮存。
1.1.2 试验试剂
碘、干酪素、可溶性淀粉、硫代硫酸钠、乳酸钠、柠檬酸、乳酸、三氯乙酸、羧甲基纤维素钠、L-酪氨酸、3,5-二硝基水杨、己酸,均为分析纯,西陇科学股份有限公司;α-淀粉酶试剂盒,南京建成生物科技有限公司;Omega提取试剂盒 Mag-Bind Soil DNA Kit。
1.1.3 仪器与设备
FA2004B电子天平,上海佑科仪器仪表有限公司;PHS-3G雷磁电子pH计,上海精密科学仪器有限公司;TCL20M高速冷冻离心机,常州百密思仪器有限公司;HH-3数显恒温水浴锅,国华电器有限公司;ZFD-5040电热恒温鼓风干燥箱,上海跃进医疗器械厂;T1可见光分光光度计,上海屹谱仪器有限公司;K9860全自动凯氏定氮仪、SH220 N石墨消解仪,海能仪器有限公司。
1.2 试验方法
1.2.1 培曲工艺
大曲原料配方、曲坯制作方法参考文献[10]。
TT与NT的工艺区别在于:推迟曲坯覆盖稻草及翻曲时间,详见表1。
表1 特香型大曲不同培曲工艺盖稻草与翻曲时间 单位:d
Table 1 Straw-covering times and manual Daqu-turning in different Texiang Daqu culturing techniques

培曲工艺曲坯入房覆盖稻草第一次翻曲第二次翻曲第三次翻曲(打拢收堆)曲坯出房TT04 7 10 25 NT17 12 16 25
1.2.2 大曲理化指标及酶活力测定
大曲温度:每天上午和下午各1次,将温度计插入大曲约2 cm深度,随机测定3个曲坯温度。分别计算测定温度平均值即为大曲温度。
水分、酸度、酸性蛋白酶活力、纤维素酶活力、糖化力、液化力、酯化力的测定方法参考文献[11]。
1.2.3 大曲微生物量碳、氮测定
大曲中微生物量碳、氮含量的测定采用熏蒸浸提法[12-13]。取新鲜的大曲研磨后,置于真空干燥器内用去乙醇氯仿黑暗熏蒸24 h,用0.5 mol/L硫酸钾溶液浸提,取浸提液,抽滤(滤膜< 0.5 μm),获得滤液,取滤液分别用重铬酸钾氧化法与凯氏法测定碳、氮含量;另将不熏蒸大曲浸提、抽滤,测定滤液碳、氮含量,作为对照。
大曲微生物量碳(microbial biomass carbon,MBC)与大曲微生物量氮(microbial biomass nitrogen,MBN)测定如公式(1)、公式(2)所示:
(1)
(2)
式中:EC、EN分别为熏蒸与未熏蒸大曲浸提液有机碳、氮的差值;0.38、0.45为校正系数;详细测定、计算方法参考文献[14-16]。
1.2.4 大曲总DNA提取及高通量测序
样品的前处理方法参考文献[17]。采用Omega的提取试剂盒 Mag-Bind Soil DNA Kit提取宏基因组DNA。用正向引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)、反向引物806R(5′-GGACTACHVGGGT WTCTAAT-3′)扩增细菌核糖体16S rRNA的V3~V4区。用正向引物ITS5F(5′-GGAAGTAAAAGTCGTAACAAGG-3′)、反向引物ITS1R(5′-GCTGCGTTCTTCATCGATGC-3′)扩增真菌核糖体ITS1。细菌、真菌扩增产物的Illumina MiSeq测序由派森诺科技有限公司(中国上海)完成。本文细菌、真菌群落测序数据已提交至NCBI SRA数据库(http://www.ncbi.nlm.nih.gov/traces/sra),登录号为PRJNA716114、PRJNA716120。
1.2.5 数据处理
本文所有实验设置3组重复,数据以平均值±标准差表示。采用Microsoft Office Excel 2016与R语言进行数据计算和分析;单因素ANOVA 分析理化指标间显著性,Adonis法分析微生物群落组间显著性,P< 0.05表示在0.05水平上具有显著性差异;GraphPad Prism绘制折线图、R语言绘制丰度图、Canoco5绘制冗余分析(redundancy analysis,RDA)图。
2 结果与分析
2.1 大曲发酵的理化指标及酶活性变化
TT和NT培曲过程中温度变化如图1所示,TT与NT工艺大曲品温均呈现先上升后下降趋势。TT
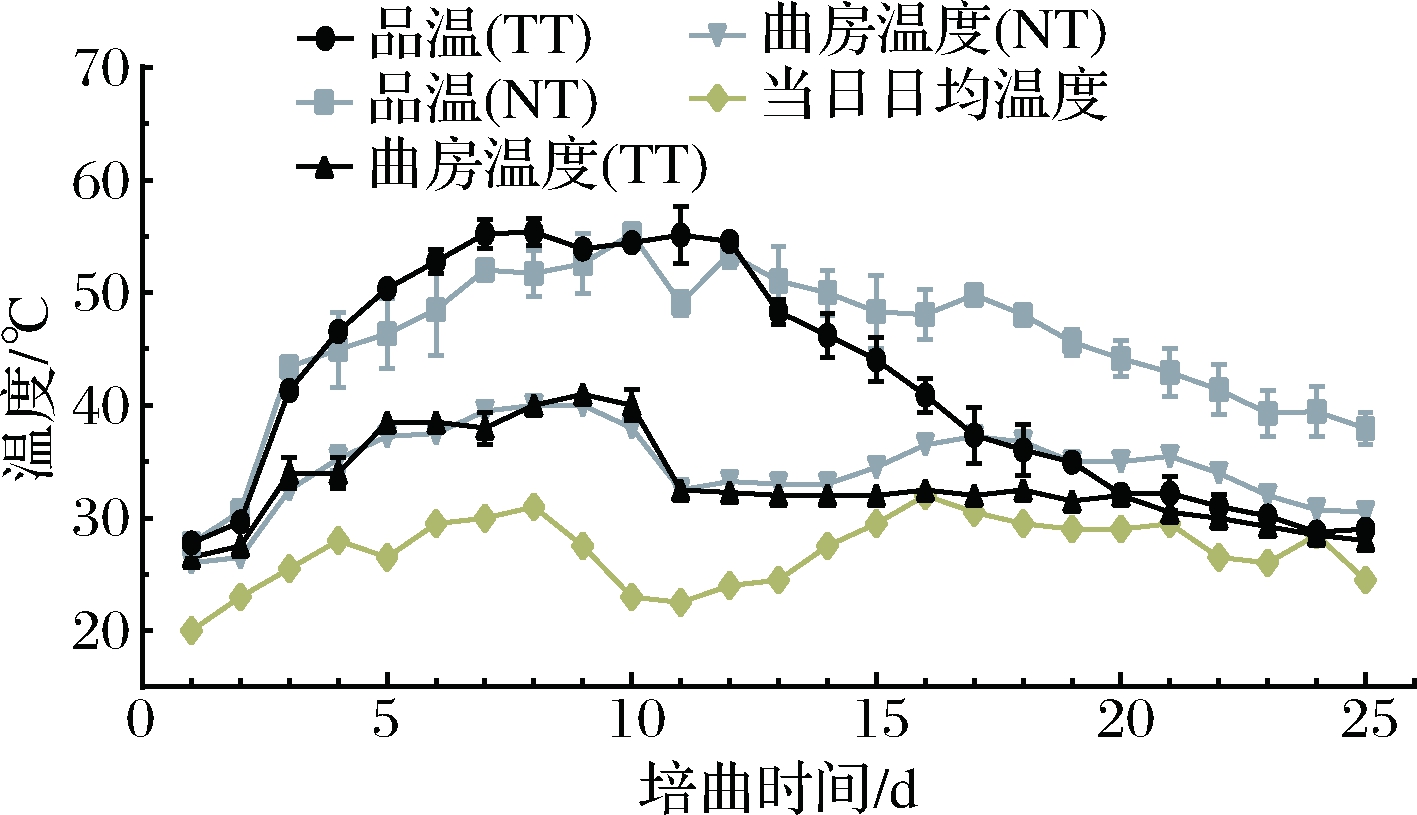
图1 不同培菌工艺的曲房与大曲温度变化
Fig.1 Deviation of Daqu core temperature from room temperature with different culture techniques
注:当日日均温度数据源于天气网
大曲在发酵4~9 d时,品温较NT的上升快,高出2~6 ℃;在第3次翻曲(10 d)后,从12 d开始TT品温较NT下降迅速,从12 d至发酵结束时较NT的品温降低3~12 ℃。表明NT工艺可使曲坯发酵前期减缓升温速度、后期放缓降温速度。
大曲理化指标及酶活力变化规律如图2所示。NT工艺大曲的纤维素酶活力、糖化力、液化力、酸性蛋白酶活力均显著高于TT(P<0.05),酸度低于TT,而两者的含水量与酯化力差异不显著。纤维素酶活力和糖化力从发酵5 d开始NT高于TT,而液化力和酸性蛋白酶活力从发酵开始后NT一直高于TT,至25 d结束分别高出63.46%、78.7%。综上结果表明NT工艺曲的酶活力优于TT。

a-含水量;b-酸度;c-纤维素酶活力;d-糖化力;e-液化力;f-酸性蛋白酶活力;g-酯化力
图2 不同培曲工艺大曲的理化指标及酶活力变化
Fig.2 Effects of different culture techniques on Daqu physicochemical indices and enzymatic activities
2.2 大曲发酵的MBC、MBN变化
大曲发酵过程中MBC、MBN动态变化如图3所示。TT与NT的MBC、MBN差异明显,但均在15 d时达到峰值。NT的MBC在10 d前低于TT,15 d后高于TT,表明在0~10 d期间,TT曲坯微生物生物量大于NT,并在15 d时达到最大值,15 d以后后者生物量大于前者。MBN是微生物对氮素矿化和固持作用的综合反映[18],由于MBN大小受微生物生物量、环境氮素等多重因素影响,NT的MBN仅在发酵结束时高于TT,提高了59%。
2.3 不同培曲工艺大曲微生物多样性分析
为比较不同培曲工艺对大曲微生物多样性的影响,基于Illumina HiSeq测序平台,对TT、NT曲坯进行α多样性评价,结果见表2。每个样品文库的覆盖率(coverage)高达99.8%以上,说明此次测序结果可靠。比较各样品的α指数发现,细菌各项α多样性指数均表现上升趋势,而真菌α多样性指数则呈现先下降后升高,TT曲坯细菌的Chao1、ACE、Simpson和Shannon指数高于同期的NT,NT真菌各项指数高于同期的TT。综上结果表明,TT的细菌丰度、多样性高于NT,而真菌则相反,NT高于TT。
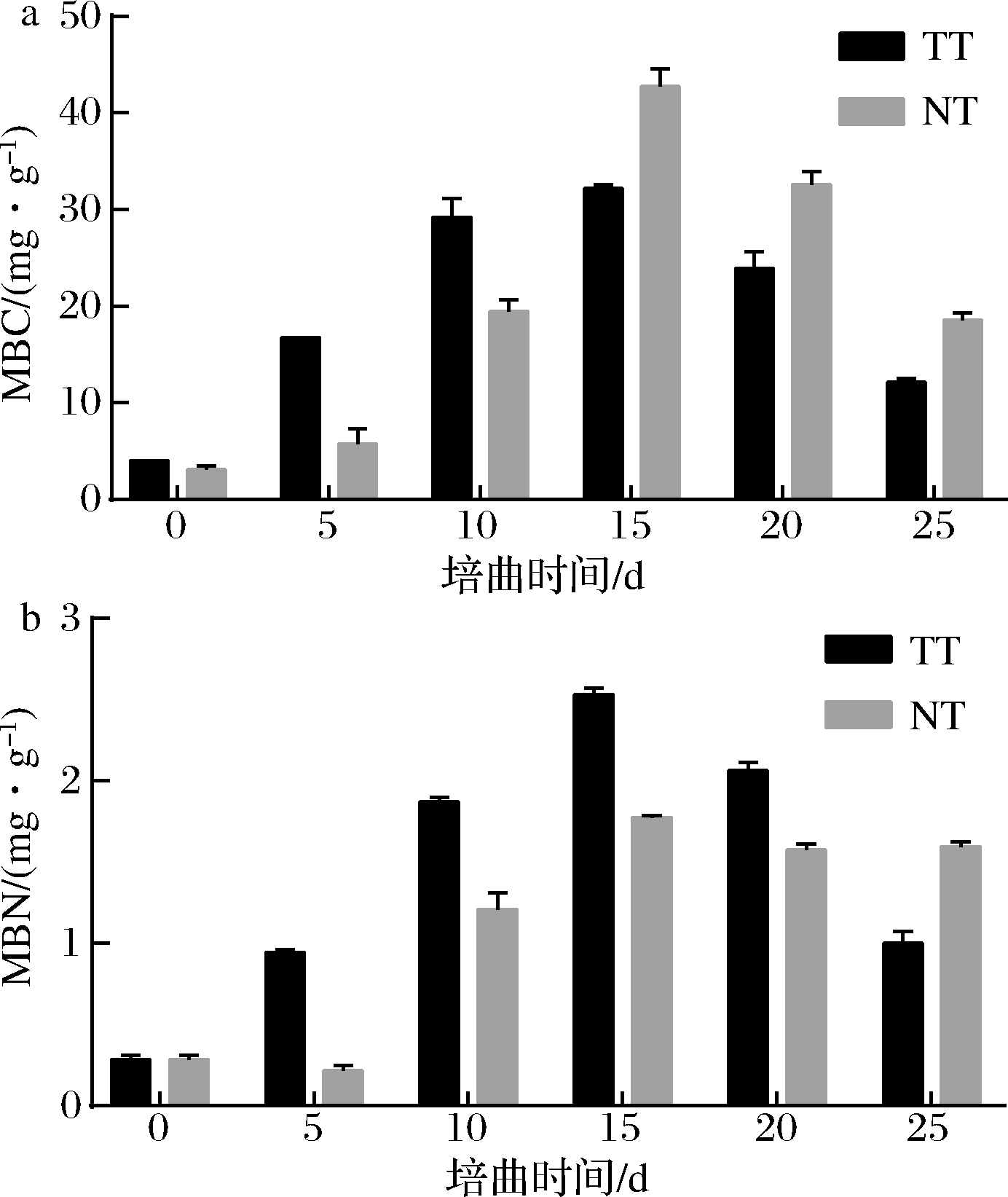
a-大曲MBC;b-大曲MBN
图3 不同培曲工艺对大曲MBC、MBN的影响
Fig.3 Effects of different culture techniques on microbial carbon and nitrogen biomass in Daqu
表2 不同培曲工艺的大曲微生物群落多样性和丰度
Table 2 Effect of different culture techniques on Daqu microbial abundance and community diversity

样品培曲期/dOTUChao1ACESimpsonShannoncoverage/%入房曲坯0537824.35820.610.311.5699.99TT108401 202.071 233.560.864.7899.91细菌201 1901 544.161 531.680.956.3699.99NT107931 078.191 067.670.925.2499.83209601 322.061 333.770.955.6599.80入房曲坯0205437.17431.900.733.2999.89TT10285352.13353.540.331.7599.89真菌20312512.82465.790.602.4799.88NT10289412.11412.870.783.1099.8720421552.80557.470.793.6199.80
注:OTU为分类操作单元(operational taxonomic units)
2.4 不同培曲工艺对大曲微生物群落结构的影响
选取TT、NT细菌、真菌OTU总数前10的序列,绘制物种(属水平)相对丰度柱状图,如图4-a、图4-b所示。NT和TT大曲的优势细菌属无显著性差异。魏斯氏菌属(Weissella)、乳杆菌属(Lactobacilus)、醋酸杆菌属(Acetobacter)、芽孢杆菌属(Bacillus)和片球菌属(Pediococcus)是整个发酵过程优势菌(图4-a)。其中,Weissella在第0天占据主导地位(相对丰度83.46%),第20天时TT降低至23.8%,NT降低至13.34%;Lactobacilus在0 d时相对丰度为2.2%,随后逐渐成为主要优势菌属,尤其在NT第10天相对丰度达到66.9%,20 d降至53.62%,TT中分别为19.28%和16.76%;Acetobacter在NT中由第10天相对丰度20.5%降到20 d的4.2%,而在TT中由10 d相对丰度0.047%升高到20 d的4.86%。
TT与NT发酵过程中优势真菌属群落间差异显著。其中嗜热子囊菌(Thermoascus)、曲霉(Aspergillus)、根毛霉(Rhizomucor)、根霉(Rhizopus)为NT、TT大曲的优势真菌(图4-b)。丝孢毕赤酵母(Hyphopichia)和假丝酵母(Candida)在第0天时占据主导地位,相对丰度分别为68.2%和15%,随后不断降低,20 d 时在NT中的相对丰度分别为2.1%、5.5%,而在TT大曲中仅为0.3%、0.2%。值得注意的是,Thermoascus是TT大曲发酵中后期的主要优势真菌,10 d时相对丰度达到95.72%,20 d时降至26.7%;在NT 10 d时仅为0.3%,20 d时提升至22.7%,是NT大曲后期的主要优势真菌。Aspergillus、Rhizomucor、Rhizopus

a-细菌属水平;b-真菌属水平;c-细菌群落PCoA;d-真菌群落PCoA
图4 不同培曲工艺大曲微生物群落结构及PCoA
Fig.4 Microbial community structure and PCoA of Daqu produced with different culture techniques
在第0天相对丰度分别为0.08%、0.01%、0.1%,并随着发酵进行逐渐成为优势菌。Aspergillus在发酵第20天 时相对丰度分别为TT 68.1%、NT 39.6%,是2种大曲发酵后期的主要优势真菌。Rhizomucor、Rhizopus则主要在NT大曲中占据主导地位,第20天时相对丰度为50.6%与13.8%(NT)远高于TT大曲第20天时相对丰度3.6%与0.8%(TT)。
基于Weighted UniFrac距离主坐标分析(principal coordinates analysis,PCoA)(图4-c、图4-d),细菌群落结构的第一主成分得分为64.97%,第二主成分得分为26.97%,前2个主成分积累得分91.94%(解释度大于50%),故可基于图4-c分析样品之间细菌群落差异。0 d时细菌群落结构与TT、NT的10 d、20 d差异显著,而TT与NT细菌群落间无明显差异,但TT 10 d与TT 20 d、NT 10 d与NT 20 d的细菌群落结构更相近。对于真菌群落结构,第一主成分得分48.63%,第二主成分得分为35.22%,前2个主成分积累得分83.85%,解释度大于50%。样品0 d、TT与NT三者之间差异显著,其中TT 10 d与TT 20 d倾向聚为一簇,而NT 10 d与NT 20 d间并没有明显的成簇。
2.5 大曲微生物群落与环境因子、大曲理化指标间的RDA
将大曲样品中主要细菌属、真菌属与大曲的糖化力、液化力、酯化力、纤维素酶活力、酸性蛋白酶活力5个酶活力及酸度、含水量、品温、曲房温度4个理化指标进行RDA,如图5所示。
如图5-a所示,第一与第二主轴分别解释了主要优势细菌相对丰度变化的86.11%和8.28%,总解释度为94.39%,图5-b中,第一与第二主轴分别解释了主要真核生物群落相对丰度变化的46.16%与28.9%,总解释度为75.06%,说明微生物在属水平上的分布与理化指标及酶活力之间关系密切。
大曲酸度、品温、曲房温度的变化与Lactobacilus、Acetobacter、Bacillus、Thermoascus、Aspergillus、Rhizomucor和Rhizopus呈正相关,与Weissella、Hyphopichia和Candida呈负相关;而含水量与上述菌群的相关性和酸度、品温等的相反(图5)。酸性蛋白酶活力和液化力主要与细菌属Lactobacilus、Acetobacter呈正相关;在真菌属中Aspergillus、Rhizopus与酸性蛋白酶活力呈正相关,液化力主要与Candida、Rhizopus和Hyphopichia呈正相关。酯化力、糖化力主要与细菌属Weissella及真菌属Hyphopichia、Candida呈正相关;纤维素酶活力主要与细菌属Weissella呈负相关、与真菌属Aspergillus、Rhizopus呈正相关。
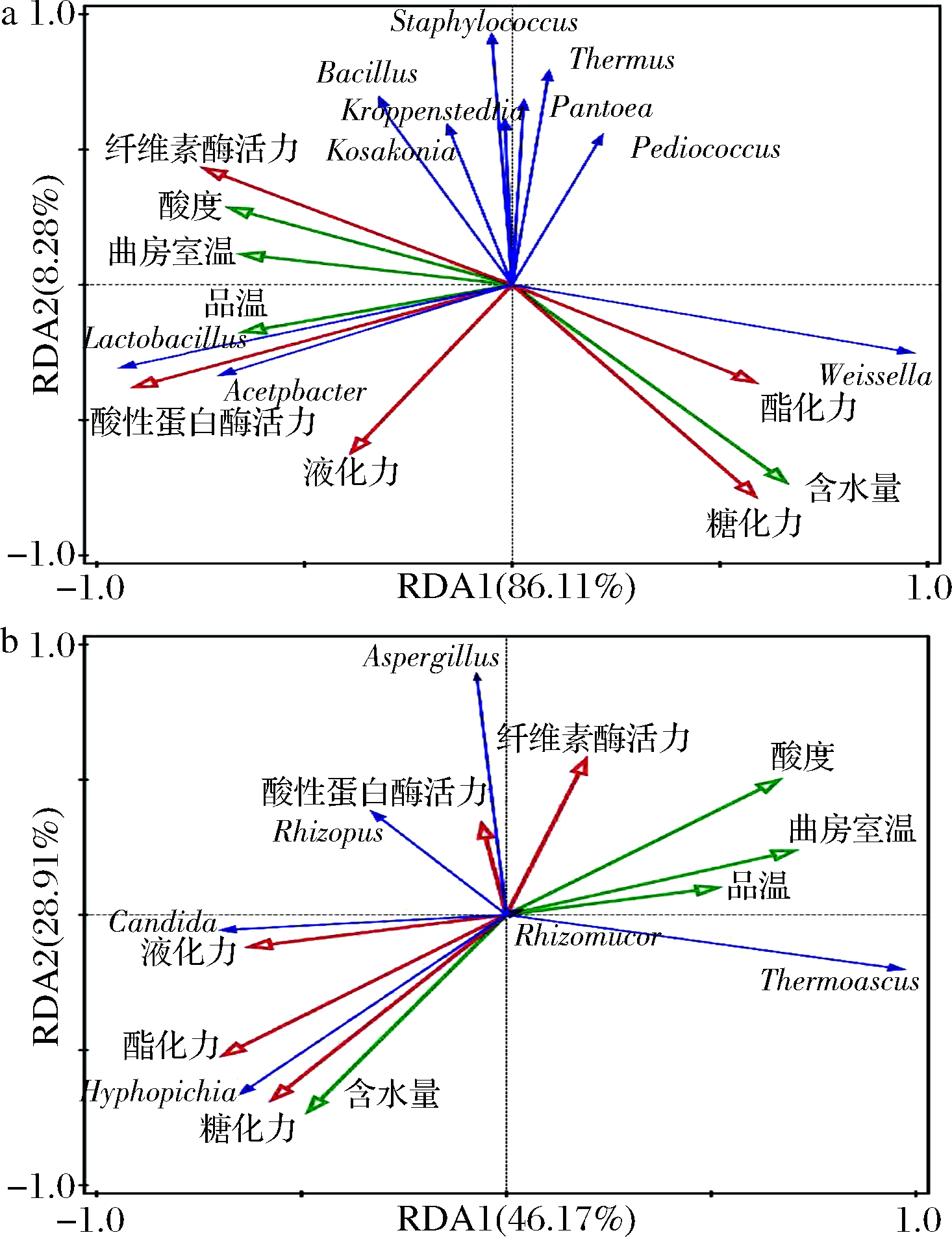
a-细菌群落;b-真菌群落
图5 大曲微生物群落与酶活力、理化指标冗余分析
Fig.5 Redundancy analyses between microbial community and enzyme activity and physicochemical indices in Daqu
注:优势菌群为蓝色线、酶活力为红色线、理化指标为绿色线
3 讨论
为解决特香型大曲前期发酵上霉过快、中后期品温下降迅速的问题,本文采取NT,即延迟覆盖稻草和推迟翻曲时间。与TT相比,发酵前期NT工艺推迟1 d覆盖稻草、仅翻曲1次,减缓了品温上升速度;发酵后期NT再经历第2、3次翻曲,减缓了品温下降速度,高温期得到延长,而曲坯后期坚挺的品温有利于曲香生成[19]。
微生物量碳氮常作为土壤微生物生物量及土壤肥力的检测指标[20],本文首次尝试将该检测方法用于大曲的微生物生物量分析。由于NT品温前期低于TT,微生物量碳、氮均低于TT,但在15 d后发生逆转,微生物生物量高于TT。即NT较TT前期微生物生长减慢,后期生长优于TT。
培曲工艺调整后,微生物多样性及群落结构出现明显变化。NT的真菌丰度、多样性高于TT,而细菌则相反,TT高于NT。0 d时因曲坯制作过程中添加丟糟,Weissella、Hyphopichia和Candida占据主导地位,随后NT在10 d时Lactobacilus、Aspergillus、Hyphopichia和Rhizopus相对丰度高,而TT则是Weissella、Lactobacilus、Thermoascus相对丰度高,特别是Thermoascus高达95.72%,推测与品温关系密切,此时TT正处于高温发酵阶段。在20 d时,NT中的真菌是Thermoascus、Rhizomucor、Rhizopus相对丰度偏高,TT是Thermoascus、Aspergillus偏高。
LI等[2]发现微生物群落替代与白酒发酵过程中物理化学参数的变化密切相关。有研究表明Candida具有分泌酯酶的能力[21];Hyphopichia存在于传统发酵中,是酵母属的一种具有产香气的能力,对发酵产品风味的形成有潜在的作用[22-23];酸性蛋白酶活力与Aspergillus、Rhizopus与呈正相关[24]。NT的酸性蛋白酶活力在发酵10~15 d达到最大值,随后下降,而TT从10 d开始下降,20 d后上升,其变化趋势与Aspergillus、Rhizopus菌群相对丰度的变化趋势一致。大曲的液化力主要与Lactobacilus、Acetobacter、Candida、Rhizopus、Hyphopichia呈正相关,这与NT大曲在10 d时上述菌群相对丰度显著高于TT有关。据报道Bacillus是酱香大曲的核心菌群,同样也存在于特香型大曲中,其主要功能是产生蛋白水解酶、淀粉酶、有机酸等[19,25],它与温度、酸度呈正相关而与水分呈负相关,具有抵抗和耐受热、酸、干旱等能力[26-27]。Lactobacilus被认为是一种专性异养发酵属,是谷物发酵中所必需的属[28],也是浓香型白酒发酵中的标志微生物[29]。上述这些属被认为是具有降解功能的群体,可以生产各种水解酶和香味物质[30]。NT大曲在纤维素酶活力、糖化力、液化力、酸性蛋白酶活力均显著高于TT工艺的大曲,与微生物生物量、微生物群落结构不同于TT有关。
4 结论
本研究通过调整特香型培曲工艺,使大曲发酵过程中曲温呈现前缓、后坚挺,大曲微生物多样性及群落结构发生改变。NT大曲的优势真菌种类与相对丰度较常规大曲更为丰富与均衡,纤维素酶、酸性蛋白酶、液化力、糖化力均高于后者。本研究结果有利于推动培曲工艺的技术升级及大曲质量提高,为特香型白酒酿造控制工艺提供理论参考。
[1] GAN S H, YANG F, SAHU S K, et al.Deciphering the composition and functional profile of the microbial communities in Chinese Moutai liquor starters[J].Frontiers in Microbiology, 2019.DOI:10.3389/fmicb.2019.01540.
[2] LI K M, CHEN Y R, LIU T, et al.Analysis of spatial distribution of bacterial community associated with accumulation of volatile compounds in Jiupei during the brewing of special-flavor liquor[J].LWT, 2020, 130(3):109620.
[3] WU Q, LING J, XU Y.Starter culture selection for making Chinese sesame-flavored liquor based on microbial metabolic activity in mixed-culture fermentation[J].Applied and Environmental Microbiology, 2014, 80(14):4 450-4 459.
[4] 李伟安, 赵德义, 曹建全, 等.景芝浓香大曲不同培养方式的对比分析[J].酿酒, 2020, 47(2):70-73.
LI W A, ZHAO D Y, CAO J Q, et al.Contrastive analysis of different culture modes of Jingzhi Luzhou-flavor Daqu[J].Liquor Making, 2020, 47(2):70-73.
[5] 陈可丹, 吴晓江, 陈延儒, 等.顶温对特香型大曲理化指标及菌群演替的影响[J].食品与发酵工业, 2020, 46(5):52-58.
CHEN K D, WU X J, CHEN Y R, et al.Effect of peak temperature on the succession of physicochemical index and microbial community of Special-flavor Daqu[J].Food and Fermentation Industries, 2020, 46(5):52-58.
[6] 邢钢, 敖宗华, 王松涛, 等.不同温度大曲制曲过程理化指标变化分析研究[J].酿酒科技, 2014(6):20-23.
XING G, AO Z H, WANG S T, et al.Analysis of the change in physiochemical indexes during the production process of Daqu of different temperature[J].Liquor-Making Science & Technology, 2014(6):20-23.
[7] 明红梅, 刘宇驰, 卓毓崇, 等.制曲温度对酱香型大曲质量的影响[J].中国酿造, 2010,29(7):157-160.
MING H M, LIU Y C, ZHUO Y C, et al.Effect of temperature on the quality of Moutai-flavor Daqu[J].China Brewing, 2010,29(7):157-160.
[8] 李凯敏, 付桂明, 吴酬飞, 等.特香型白酒酿造过程中真核微生物菌群演替[J].食品科学, 2017, 38(22):131-136.
LI K M, FU G M, WU C F, et al.Dynamics of eukaryotic microbial community succession during the traditional fermentation of special-flavor liquor[J].Food Science, 2017, 38(22):131-136.
[9] 严伟, 刘建文, 吴生文, 等.特香型大曲存储过程中霉菌、酵母菌、细菌数量变化规律的研究 [J].酿酒, 2014, 41(1):27-28.
YAN W, LIU J W, WU S W, et al.Analysis of the quantity of mycete and yeast and bacterium in the storage process of site-flavour Daqu[J].Liquor Making, 2014, 41(1):27-28.
[10] 沈剑. 特香型大曲主要微生物区系研究[D].南昌:江西农业大学, 2012.
SHEN J.Study on main microflora of Daqu of special flavor type[D].Nanchang:Jiangxi Agricultural University, 2012.
[11] 周斐成, 吴生文, 朱庆圣, 等.特香型大曲发酵过程中曲块不同部位理化指标及主要酶系动态分析[J].中国酿造, 2019, 38(4):58-64.
ZHOU F C, WU S W, ZHU Q S, et al.Physicochemical indexes and dynamic analysis of main enzymes in different layers of Te-flavor Daqu during fermentation process[J].China Brewing, 2019, 38(4):58-64.
[12] VANCE E D, BROOKES P C, JENKINSON D S.An extraction method for measuring soil microbial biomass C[J].Soil Biology and Biochemistry, 1987, 19(6):703-707.
[13] WU J, JOERGENSEN R G, POMMERENING B, et al.Measurement of soil microbial biomass C by fumigation-extraction—an automated procedure[J].Soil Biology, 1990, 22(8):1 167-1 169.
[14] JOERGENSEN R G, BROOKES P C.Ninhydrin-reactive nitrogen measurements of microbial biomass in 0.5 mol/L K2SO4 soil extracts[J].Soil Biology and Biochemistry, 1990, 22(8):1 023-1 027.
[15] SAPKOTA M, YOUNG J, SLAUGHTER L, et al.Soil microbial biomass and composition from urban landscapes in a semiarid climate[J].Applied Soil Ecology, 2021, 158(1):103810.
[16] 侯萌, 陈一民, 焦晓光, 等.两种气候条件下不同有机质含量农田黑土真菌群落结构特征[J].微生物学通报, 2020, 47(9):2 822-2 832.
HOU M, CHEN Y M, JIAO X G, et al.Characteristics of fungal community structure in arable mollisols with different organic matter content under two climatic conditions[J].Microbiology, 2020, 47(9):2 822-2 832.
[17] 胡小霞, 黄永光, 蒋想, 等.清酱香型白酒陶坛发酵细菌群落结构多样性分析[J].食品科学, 2020, 41(8):130-138.
HU X X, HUANG Y G, JIANG X, et al.Bacterial community structure and diversity during fermentation of Chinese Fen-Maotai-Flavored liquor in pottery jars[J].Food Science, 2020, 41(8):130-138.
[18] 刘恩科, 赵秉强, 李秀英, 等.不同施肥制度土壤微生物量碳氮变化及细菌群落16S rDNA V3片段PCR产物的DGGE分析[J].生态学报, 2007,27(3):1 079-1 085.
LIU E K, ZHAO B Q, LI X Y, et al.Microbial C and N biomass and soil community analysis using DGGE of 16S rDNA V3 fragment PCR products under different long-term fertilization systems[J].Acta Ecologica Sinica, 2007,27(3):1 079-1 085.
[19] YI Z L, JIN Y L, XIAO Y, et al.Unraveling the contribution of high temperature stage to Jiang-flavor daqu, A liquor starter for production of Chinese Jiang-flavor baijiu, With special reference to metatranscriptomics[J].Frontiers in Microbiology, 2019, 10:472.
[20] HUA B, LI Z W, GAO W K, et al.Soil amendment in plastic greenhouse using modified biochar:Soil bacterial diversity responses and microbial biomass carbon and nitrogen[J].Biotechnology Letters, 2021, 43(3):655-666.
[21] YAN S B, TONG Q Q, GUANG J Q.Yeast dynamics and changes in volatile compounds during the fermentation of the traditional Chinese strong-flavor Daqu[J].LWT, 2019, 106:57-63.
[22] SUO B, NIE W J, WANG Y X, et al.Microbial diversity of fermented dough and volatile compounds in steamed bread prepared with traditional Chinese starters[J].LWT, 2020, 126:109350.
[23] HEITMANN M, ZANNINI E, ARENDT E.Impact of Saccharomyces cerevisiae metabolites produced during fermentation on bread quality parameters:A review[J].Critical Reviews in Food Science & Nutrition, 2018,58(7):1 152-1 164.
[24] 王鹏, 吴群, 徐岩.中国白酒发酵过程中的核心微生物群及其与环境因子的关系[J].微生物学报, 2018, 58(1):142-153.
WANG P, WU Q, XU Y.Core microbiota in Chinese liquor fermentation and associations with environmental factors[J].Acta Microbiologica Sinica, 2018, 58(1):142-153.
[25] CAI H Y, ZHANG T, ZHANG Q, et al.Microbial diversity and chemical analysis of the starters used in traditional Chinese sweet rice wine[J].Food Microbiology, 2018, 73:319-326.
[26] LE LAY J, BAHLOUL H, SÉRINO S, et al.Reducing activity, glucose metabolism and acid tolerance response of Bacillus cereus grown at various pH and oxydo-reduction potential levels[J].Food Microbiology, 2015, 46:314-321.
[27] WANG W Y, LIU R L, SHEN Y, et al.The potential correlation between bacterial sporulation and the characteristic flavor of Chinese Maotai liquor[J].Frontiers in Microbiology, 2018, 9:1435.
[28] GAGLIO R, ALFONZO A, BARBERA M, et al.Persistence of a mixed lactic acid bacterial starter culture during lysine fortification of sourdough breads by addition of pistachio powder[J].Food Microbiology, 2020, 86:103349.
[29] TAN Y W, ZHONG H P, ZHAO D, et al.Succession rate of microbial community causes flavor difference in strong-aroma Baijiu making process[J].International Journal of Food Microbiology, 2019, 311:108350.
[30] HE G Q, DONG Y, HUANG J, et al.Alteration of microbial community for improving flavor character of Daqu by inoculation with Bacillus velezensis and Bacillus subtilis[J].LWT, 2019, 111:1-8.