芽孢杆菌是一类能够耐受极端恶劣环境的革兰氏阳性细菌,能够产生20多种不同类型的抗菌化合物[1],根据抗菌物质生物合成机制可分为核糖体合成的细菌素和非核糖体合成的抗菌肽[2]。细菌素是细菌产生的抗菌多肽,不同来源的细菌素其抑菌谱不同,迄今已经分离鉴定了一些细菌素,如枯草芽孢杆菌产生的枯草菌素和枯草杆菌素A[3],凝结芽孢杆菌产生的凝固素[4];苏云金芽孢杆菌产生的Bacthuricin F4和系列苏云金素[5],地衣芽孢杆菌P40和蜡样芽胞杆菌ATCC 4579产生的类细菌素物质[6]。虽然已经鉴定出多种细菌素,且由乳酸乳球菌产生的乳酸链球菌素和由嗜酸片球菌产生的片球菌素PA-1已在食品工业中商业化使用,但其在抗菌谱及稳定性方面还存在局限,故开发芽孢杆菌中的另一类抗菌物质——脂肽具有现实应用意义。脂肽类化合物包括芬芥素(fengycin)、伊枯草菌素(iturin)、表面活性素家族,其主要由1个肽环和脂肪酸链组成,是一类具有亲水亲油特性的化合物[7]。因其具有广泛的生物活性如广谱抗细菌、抗病毒、抗霉菌、抗癌和免疫抑制等[8],并具有影响细胞膜通透性并最终导致细胞破裂菌体死亡的特定机制,在生物防治、环境保护、医药治疗和食品健康等方面具有潜在的利用价值,因此受到越来越多的关注。
表面活性素主要是芽孢杆菌属细菌所产生的一类重要环状脂肽[9],包含多种同系物和同分异构体,如表面活性素(surfactin)、普米拉西丁(pumilacidin)和地衣菌素(lichenysin),它们因其脂肪酸链长度和分支变化以及肽环中的氨基酸不同而有差异。表面活性素除了具有较强的抗细菌功能外,还具有溶血、抗凝血和抗肿瘤等活性,其活性与它们与生物大分子的相互作用有关[10]。虽然国内外对表面活性素的研究较多,但主要围绕表面活性和植物病虫害防治方面。近年来脂肽在食品防腐领域也有一些报道,但存在抗菌谱窄、稳定性差、产量低等各种缺陷,限制了脂肽在食品防腐领域的应用。脂肽在芽孢杆菌属细菌中广泛存在,不同的芽孢杆菌所产生的脂肽其结构和抑菌特性往往不同,故深入挖掘产脂肽菌种资源,寻找新的脂肽并研究其特性对开发天然安全健康的食品防腐剂具有重要意义。
在本研究中,我们从中国传统香肠中分离出1种产脂肽的菌株XZK-18,对菌株进行分类鉴定,从其发酵液中分离纯化抗菌脂肽,并鉴定脂肽类别,研究脂肽的抑菌机理、理化特性及抗菌谱,为开发新型天然防腐剂、保障消费者的饮食健康奠定理论基础。
1 材料与方法
1.1 样品、培养基与仪器
1.1.1 实验样品
分离筛选产生抗菌脂肽菌株的样品取自江苏省睢宁县农村传统方法自制香肠。
1.1.2 培养基
种子培养基(LB培养基,g/L):NaCl 10,酵母提取物5,胰蛋白胨10,调pH至7.2。
发酵培养基(g/L):蔗糖20,蛋白胨10,NH4NO32,KH2PO4 3,Na2HPO4 2,MgSO4 0.2,酵母膏0.2,CaCl2 0.000 7,MnSO4 0.001,pH自然。
1.1.3 仪器与设备
TC-C18高效液相色谱半制备柱(250 mm×4.6 mm,5 μm)、1100 series高效液相色谱仪,美国安捷伦公司;3K30型台式冷冻离心机,德国Sigma公司;AKTA EXPLORER蛋白纯化系统,美国GE Healthcare公司;Nicolet 380型傅里叶变换红外光谱仪,美国Thermo Fisher Scientific公司;SHB-Ⅲ型旋转蒸发仪,郑州长城科工贸有限公司;GeneAmp 9700 PCR仪,美国应用生物系统公司。
1.2 实验方法
1.2.1 产抗菌脂肽芽孢杆菌的筛选
称取香肠20 g,切成1 cm长,转移至装有180 mL无菌水的匀浆机中,经充分匀浆后静置10 min,吸取经适当稀释的匀浆液100 μL涂布于LB培养基中,37 ℃培养2~4 d,氯仿熏蒸法筛选拮抗菌株[11]。琼脂孔扩散法[11]检测发酵液抑菌活性,挑选1株抑菌活性较强、抑菌谱广的菌株深入研究。
1.2.2 菌株形态、生理生化及分子生物学鉴定
1.2.2.1 形态学和生理生化鉴定
筛选到的菌株在牛肉膏蛋白胨平板上划线,于37 ℃恒温培养箱中培养48 h,观察单菌落的颜色、形状、光滑度等指标,并进行革兰氏染色,光学显微镜下观察菌体形态特征和产芽孢情况。
1.2.2.2 16S rRNA序列分析鉴定
16S rRNA序列扩增采用引物:27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-GGTTACCTTGTTACG-ACTT-3′。PCR扩增反应体系为25 μL,包含有1 μL DNA模板,引物(10 μmol/L)各1 μL,2.5 μL 10×PCR buffer,2 μL dNTPs(2.5 mmol/L),0.3 μL Tap DNA polymerase和17.2 μL ddH2O。扩增条件:95 ℃下3 min,95 ℃下30 s,55 ℃下30 s,72 ℃下1.5 min,30个循环;72 ℃ 10 min。PCR的产物用1.0%的琼脂糖凝胶检测。PCR产物测序后,将16 S rRNA序列与GenBank数据库中的核苷酸序列进行BLAST比对分析。选取相相似度高的相关菌株序列,用MEGA 6.0软件进行多序列匹配分析并采用Neighbour-joining方法构建系统进化树,并进行1 000次的Bootstrap检验。
1.2.3 抗菌脂肽的发酵
取甘油保藏的菌株用接种环挑取1环进行平板划线,37 ℃倒置培养24 h,挑取平板上的单菌落至LB琼脂斜面,静置培养24 h。挑取斜面菌种接种于LB液体培养基中,37 ℃,180 r/min振荡培养18 h,即为种子液。按照2%的接种量接种至发酵培养基中,在37 ℃下180 r/min振荡发酵48 h。每隔2~4 h,取3 mL发酵液检测OD600吸光值以及所产脂肽对蜡状芽孢杆菌和金黄色葡萄球菌的抑菌活性,以抑菌圈直径大小表示抑菌活性高低。
1.2.4 抗菌脂肽的分离纯化
1.2.4.1 抗菌脂肽粗提
将上述发酵48 h的发酵液于-4 ℃的环境下8 000 r/min离心15 min;取上清液用6 mol/L的HCl溶液将上清液调至pH 2.0,静置过夜;8 000 r/min离心,取沉淀,用甲醇抽提3次,8 000 r/min 离心10 min;上清液于旋转蒸发器50 ℃减压浓缩,得到脂肽粗提物,-20 ℃保存备用。
1.2.4.2 抗菌脂肽Sephadex LH-20层析
Sephadex LH-20柱层析纯化脂肽参照文献[12]方法并稍微改动。凝胶干粉用去离子水充分溶胀后,利用重力沉降原理装填入15 mm×800 mm 层析柱中,50%甲醇充分平衡;脂肽粗提物溶解于50%甲醇中,并通过0.45 μm过滤器过滤后上样于Sephadex LH-20色谱柱,洗脱缓冲液为50%甲醇,流速为1 mL/min,每管收集3 mL,琼脂孔扩散法分析检测每个洗脱峰的抑菌活性。多个循环洗脱后,将活性组分混合并用50 ℃的吹氮仪干燥。
琼脂孔扩散法测定抑菌活性具体为在LB琼脂平板上均匀涂布150 μL过夜培养好的浓度为1×107CFU/mL的指示菌菌液,表面晾干后以6 mm直径的打孔器平板上打孔,取相同量的收集液注入孔中,37 ℃培养12~18 h后查看抑菌圈情况并测定抑菌圈直径,以该直径表示抑菌活性大小。
1.2.4.3 抗菌脂肽半制备反向高效液相色谱(reverse-phase high performance liquid chromatography,RP-HPLC)法分离纯化
将经Sephadex LH-20分离获得的活性组分进一步使用RP-HPLC法纯化,具体参照文献[13]方法。流动相A:0.1%三氟乙酸(trifluoroacetic acid,TFA)水溶液,流动相B:0.1% TFA乙腈。洗脱速度:2 mL/min,检测波长220 nm。梯度洗脱条件:0~60 min内溶剂B的线性梯度从10%增加到90%。滤纸片法检测各洗脱峰抑菌活性。
1.2.5 抗菌脂肽的鉴定
1.2.5.1 抗菌脂肽薄层色谱分析
经酸沉淀并萃取得到的粗提物样品进行薄层层析(thin-layer chromatography,TLC)法分析。具体参照文献[14]并稍作改动。溶解在甲醇中的样品在硅胶薄层色谱板上点样,以体积比65∶25∶4的氯仿、甲醇和水的混合溶液为流动相展开色谱板。展开结束后将色谱板放在封闭的层析缸中碘蒸汽熏蒸,观察层析板上是否有黄色斑点出现以确定样品分子中是否有脂质存在;另一块薄层色谱板干燥后,喷洒茚三酮溶液,在110 ℃下烘烤30 min,观察是否出现粉红色或红色斑点,确定是否有肽的存在。测定所显示斑点的迁移率(retention factor,Rf),并与文献报道的特征Rf值比较。
TLC-生物自显影参照文献方法[14]。展开后的层析板晾干后置于空的灭过菌的培养皿中,倒入60 ℃左右的LB琼脂培养基,充分凝固后,分别涂布150 μL浓度为1.0×108 CFU/mL的大肠杆菌和金黄色葡萄球菌菌液,表面晾干后置于37 ℃培养箱,12~24 h观察抑菌圈并测定抑菌圈Rf值。检测对霉菌的抑制作用,将层析板置于培养皿,覆盖熔化好的PDA培养基,涂布150 μL浓度为1.0×106个/mL的黑曲霉分生孢子悬液,表面晾干后28 ℃孵育2~4 d,检测培养皿中是否有抑菌圈出现。
1.2.5.2 抗菌脂肽傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)扫描
利用FT-IR推断经过纯化的抑菌活性成分存在的化学键和官能团,初步鉴定抑菌成分。光谱数据采集范围为378~4 000 cm-1,光谱分辨率为4.0 cm-1,收集的数据是整个范围内50次扫描的平均值。
1.2.6 扫描电镜分析细菌形态结构变化
扫描电镜观察经过脂肽处理后的菌体显微结构变化,探索脂肽抑菌机理。参照文献方法[15]制备菌体样品,将大肠杆菌37 ℃ LB培养基中培养过夜,按照10%的接种量接种至新的LB培养基中,37 ℃ 180 r/min振荡培养至OD600值为0.5~0.6,取2 mL至离心管,加入纯化后的脂肽,37 ℃ 120 r/min摇床振荡2 h,立即冰浴2 min,4 ℃ 5 000 r/min离心5 min,去上清液,加入100 mmol/L pH 8.0的磷酸缓冲液,吹打悬浮,再次离心,倒掉上清液,再次重复加缓冲液,再离心。倒掉上清液,加入2.5%体积分数的戊二醛溶液,4 ℃固定过夜。使用75%~100%的乙醇逐级脱水,真空冷冻干燥,再将样品在真空镀膜机内把金喷镀到样品表面,扫描电镜进行观察。未经过脂肽处理的大肠杆菌作为对照。
1.2.7 抗菌脂肽抑菌谱测定
采用琼脂扩散法测定脂肽抑菌谱。选择5株革兰氏阳性细菌、5株革兰氏阴性细菌、3株真菌作为指示菌,检测脂肽对这些菌株的抑菌性能。细菌使用LB琼脂培养基,真菌使用PDA培养基,28 ℃培养2~4 d,游标卡尺测量抑菌圈直径。
1.2.8 抗菌脂肽稳定性
1.2.8.1 热稳定性
将纯化后的脂肽分别于70、80、90、100、110、120 ℃ 下各处理30 min,以蜡样芽胞杆菌为指示菌琼脂孔扩散法检测抑菌活性。
1.2.8.2 酸碱稳定性
将纯化的脂肽用1.2 mol/L NaOH溶液和1 mol/L HCl溶液分别调pH至3.0、5.0、7.0、9.0、11.0,4 ℃处理1~10 d,再调pH至7.0,以蜡样芽胞杆菌为指示菌琼脂孔扩散法检测抑菌活性。
1.2.9 统计分析
采用SPSS 19.0数据处理软件进行误差分析。脂肽抑菌活性测定中,每个处理设置3个平行样,计算平均值及标准偏差,采用t-检验显著性分析,P<0.05认为有统计学意义。
2 结果与分析
2.1 产脂肽菌株筛选鉴定
筛选得到1株抑菌活性较强的菌株XZK-18,其发酵液对金黄色葡萄球菌和蜡样芽胞杆菌抑菌活性如图1所示,对2种菌株均产生了强烈的抑制作用。在牛肉膏蛋白胨培养基上培养48 h后菌落呈圆形、边缘整齐、乳白色、表面不光滑有褶皱、不透明。油镜下观察,革兰氏阳性,菌体形态呈杆状,两短钝圆,芽孢呈椭圆形中生。生理生化试验显示,明胶液化、接触酶试验、V.P试验、柠檬酸盐利用为阳性,甲基红试验、硝酸盐还原、吲哚试验、淀粉水解、H2S试验为阴性,能利用阿拉伯糖、D-山梨醇、纤维二塘、蔗糖、麦芽糖、葡萄糖,不能利用α-乳糖、D-木糖、D-甘露糖,可在7%~10%的含盐培养基中正常生长。根据典型的生理生化特征初步确定菌株XZK-18为短小芽孢杆菌。
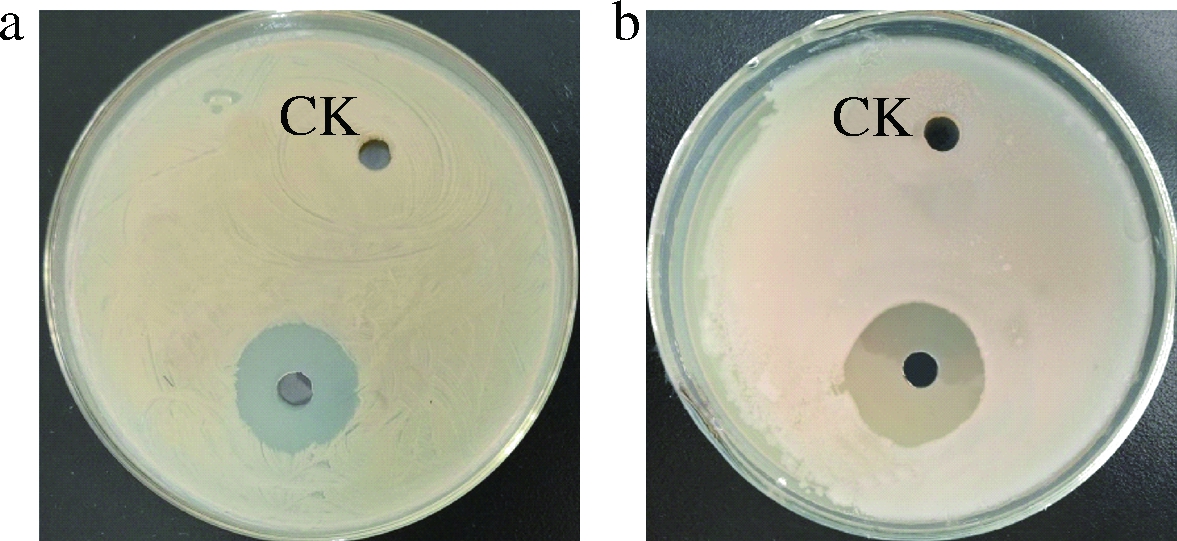
CK-磷酸缓冲溶液为空白对照
a-金黄色葡萄球菌;b-蜡样芽胞杆菌
图1 菌株XZK-18发酵液的抑菌活性
Fig.1 Antibacterial activity of the fermentation broth of strain XZK-18
菌株16S rRNA扩增到大小约1 500 bp的PCR特征性条带,测序结果在GenBank中与己知序列进行BLAST比对,与短小芽孢杆菌SAFR-032的16 S rRNA一致性为100%。以菌株XZK-18的16 S rRNA序列与相近序列的比对,通过MEGA 6.0软件软件进行多序列匹配分析,构建系统发育树,结果显示,菌株XZK-18与Bacillus pumilus SAFR-032在同一个分支上(图2),综合形态结构及生理生化试验结果,鉴定XZK-18为短小芽孢杆菌。芽孢杆菌被广泛应用于工业生产中,近年来文献报道了大量产脂肽的不同类型的芽孢杆菌属菌株如解淀粉芽孢杆菌(Bacillus amyloliquefaciens)[16]等,但大多脂肽研究主要围绕其表面活性剂特性或者在生物防治中的抗真菌特性,本研究的脂肽前期筛选中使用了大量细菌指示菌株,主要目的是筛选应用于食品防腐的抗细菌脂肽产生菌株,筛选到的短小芽孢杆菌XZK-18是1株有应用潜力的广谱细菌拮抗菌株。
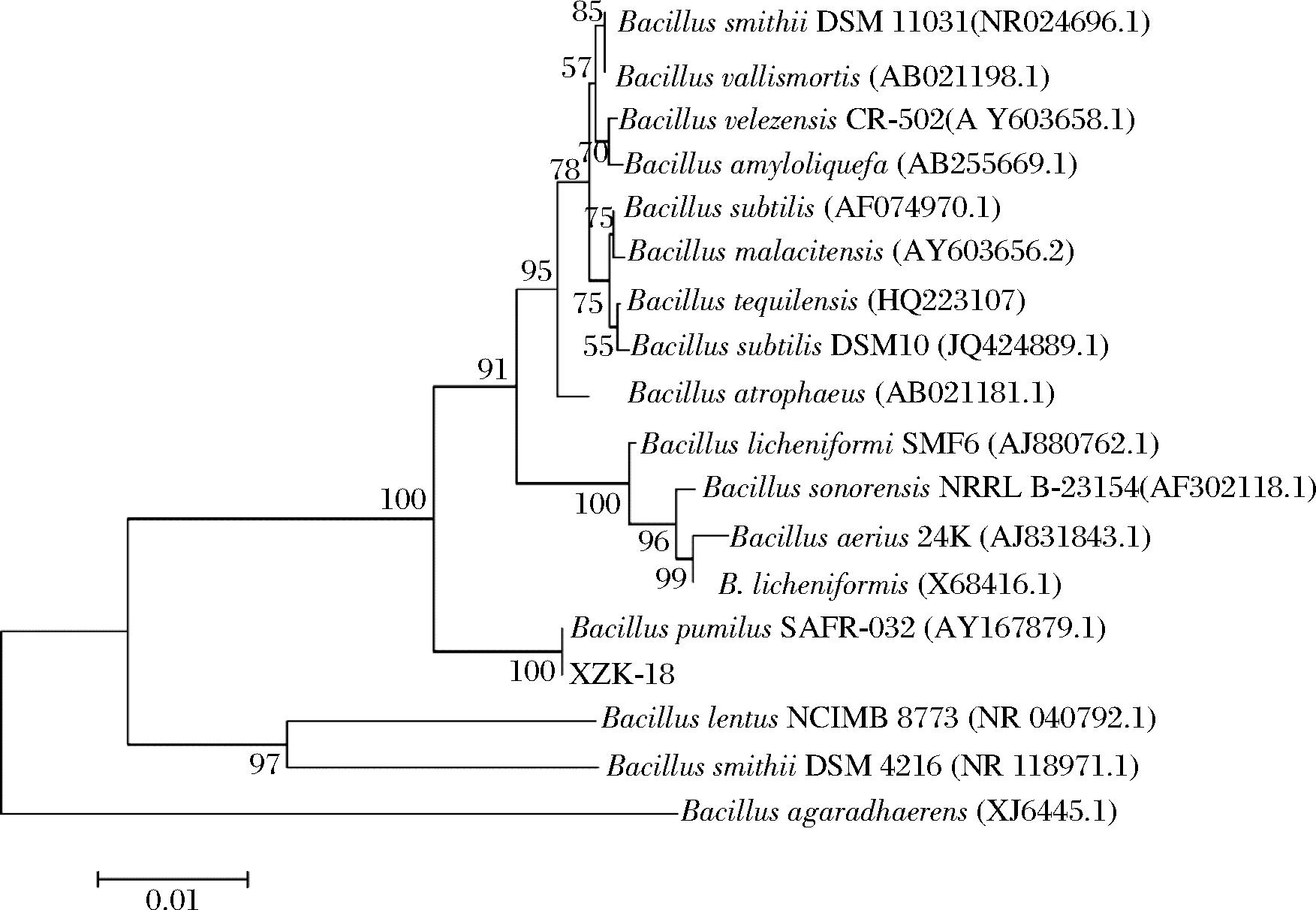
图2 菌株XZK-18 16S rRNA基因系统发育进化树
Fig.2 Phylogenetic tree of strain XZK-18 16S rRNA
2.2 抗菌脂肽发酵制备
为了研究抗菌脂肽产量变化与细菌生长的关系,本实验连续48 h测定菌株XZK-18 OD600值与其发酵液对金黄色葡萄球菌和蜡状芽孢杆菌的抑菌圈直径,结果见图3。培养至8 h后,发酵上清液开始对2种指示菌表现出抑菌活性,在8~24 h,随着发酵时间延长,抑菌活性增强。培养24 h后,抑菌活性达到最大,并随着发酵时间延长抑菌活性保持不变,直到48 h。菌株XZK-18所产脂肽对蜡状芽孢杆菌抑菌活性相对金黄色葡萄球菌要高。对照细菌生长曲线,脂肽合成主要在对数期的末期大量合成,并在稳定期前期达到峰值,稳定期脂肽抑菌活性基本无变化,整体看出脂肽合成同菌体的生长呈现部分相关性,这与GONZ LEZ-JARAMILLO等[17]报道的脂肽合成曲线相类似;而BALAN等[18]研究的Aneurinibacillus aneurinilyticus SBP-11脂肽同菌体生长曲线完全吻合,呈现典型的初级代谢产物合成特性。菌株XZK-18脂肽合成曲线看出,在稳定期后期,脂肽活性没有降低,而肽类抑菌物质细菌素往往后期活性会显著降低,间接这证实菌株XZK-18所产抑菌物质不是细菌素。
LEZ-JARAMILLO等[17]报道的脂肽合成曲线相类似;而BALAN等[18]研究的Aneurinibacillus aneurinilyticus SBP-11脂肽同菌体生长曲线完全吻合,呈现典型的初级代谢产物合成特性。菌株XZK-18脂肽合成曲线看出,在稳定期后期,脂肽活性没有降低,而肽类抑菌物质细菌素往往后期活性会显著降低,间接这证实菌株XZK-18所产抑菌物质不是细菌素。
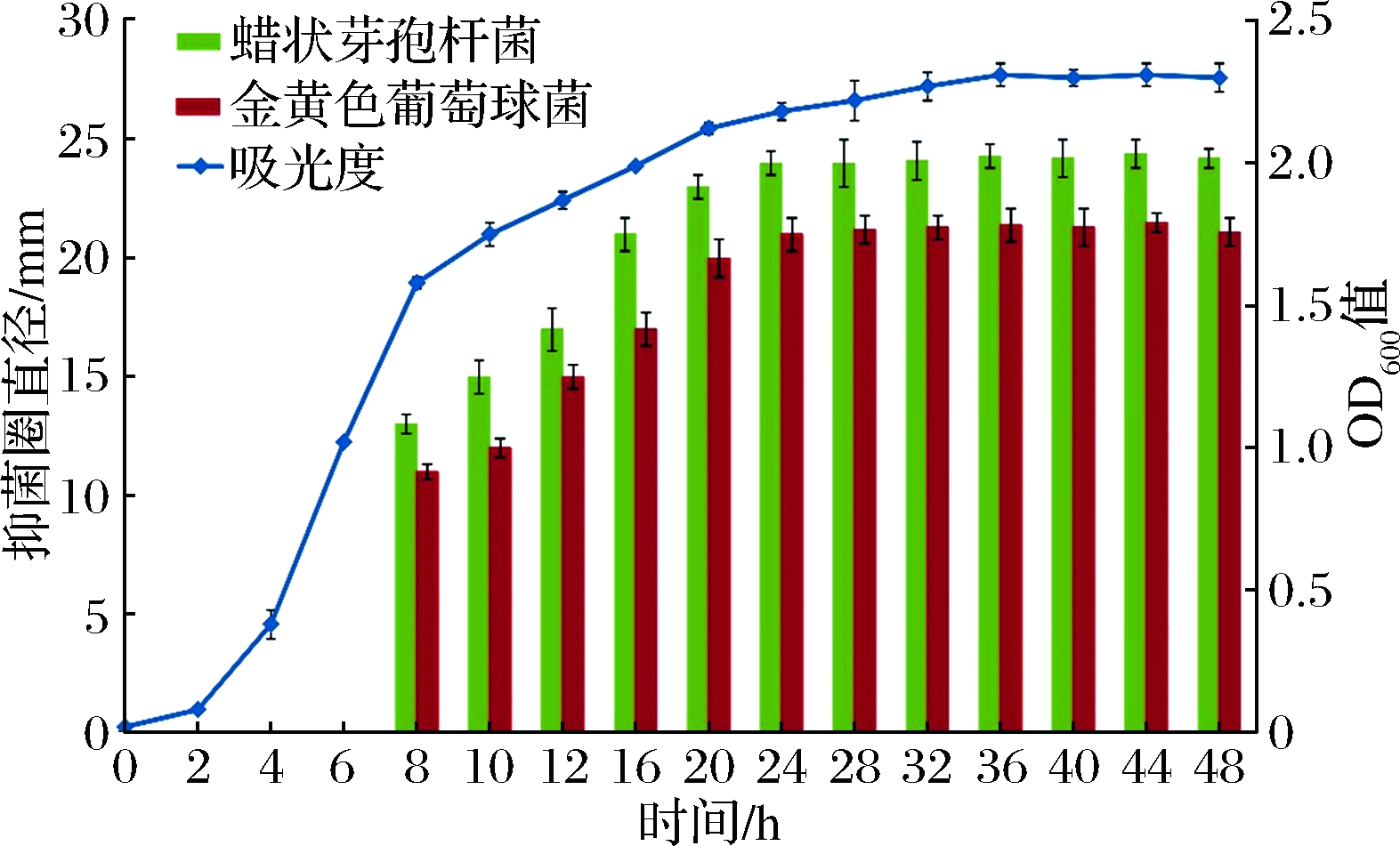
图3 短小芽孢杆菌XZK-18抗菌脂肽合成和菌体生长曲线
Fig.3 Antimicrobial substance synthesis and growth curve of Bacillus pumilus XZK-18
2.3 抗菌脂肽的薄层层析及生物自显影
为初步确定抗菌物质的种类,用碘蒸汽和茚三酮显色对抗菌脂肽TLC分析,结果如图4所示,碘蒸气熏蒸后的层析板出现多个黄色斑点,其中3个斑点较为明显,对应Rf值分别为0.78、0.50和0.11(见图4-a),其中Rf值得为0.78的斑点显色最为强烈,说明对应斑点分子中含有脂质[19];茚三酮喷洒后在对应相同的位置也出现了3个明显的粉红色斑点,斑点强弱程度同碘蒸气熏蒸板斑点相一致,证明分子中含有氨基酸的存在。由以上可以判断样品中至少含有3种类型的化合物且分子由肽和脂质组成,推测属于脂肽类。根据文献报道[20],Rf值为0.5和0.78的脂肽属于表面活性素,这分别与SRIRAM等[21]报道的Bacillus cereus NK1脂肽表面活性素(surfactant)(0.52)相接近,表面活性素是芽孢杆菌属一种典型的脂肽类,具有较大的抗细菌活性;对比文献[22]Rf值0.11的脂肽属于伊枯草菌素类,含量较低。
分别以革兰氏阴性菌大肠杆菌和革兰氏阳性菌金黄色葡萄球菌为指示菌通过TLC-生物自显影分析建立脂肽与其抑菌活性的直接关系,进一步确定脂肽化合物的分子类型。结果表明,所有斑点对霉菌均没有抑制作用,但Rf值0.78对应的位点对两种细菌大肠杆菌和金黄色葡萄球菌均有抑制作用,且抑制活性较强(如图4-c~图4-d),这同文献报道的芬芥素和伊枯草菌素脂肽对应的抑菌带(Rffen=0.1~0.2,Rfitu=0.3~0.4)不同[14],但与SRIRAM等[21]报道的表面活性素脂肽(Rfsrf=0.7)对大肠杆菌的抑菌情况相类似。Rf值为0.11的,没有检测到对真菌指示菌的抑菌活性,这有可能是因为菌体合成量偏低所至,从层析板所显示的较弱的斑点也可以证实。综上可知,发酵液的抑菌活性可能主要源于芽孢杆菌合成的表面活性素。

a-碘熏蒸;b-茚三酮显色;c-大肠杆菌;d-金黄色葡萄球
图4 短小芽孢杆菌XZK-18脂肽TLC和TLC-生物自显影分析
Fig.4 TLC and TLC-bioautographic analysis of lipopeptides from Bacillus pumilus XZK-18
2.4 抗菌脂肽的分离纯化
经酸沉淀甲醇萃取后的样品进一步葡聚糖凝胶Sephadex LH-20层析,洗脱曲线如图5-a所示,共得到4个洗脱峰,分别命名为组分F1、F2、F3、F4。对各个峰的收集液抑菌活性检测(图5-b),仅检测到吸收峰F2处收集液有明显抑菌活性,因此判断洗脱峰F2为活性峰,收集活性洗脱液,进一步通过RT-HPLC纯化。

a-Sephadex LH-20层析;b-抑菌活性检测
图5 短小芽孢杆菌XZK-18抗菌脂肽Sephadex LH-20层析
Fig.5 Sephadex LH-20 chromatography of Bacillus pumilus XZK-18 antibacterial substance
经Sephadex LH-20纯化的得到的洗脱峰F2活性样品再通过RP-HPLC层析纯化,得到的洗脱曲线如图6-a所示,洗脱出9个比较大的吸收峰,对每个洗脱峰检测抑菌活性,如图6-b所示,P4洗脱峰有显著的抑菌活性,P6洗脱峰仅显示略微的抑菌圈。进一步证实短小芽孢杆菌XZK-18菌株可以产生不止1种脂肽,这与文献报道的脂肽通常以多种亚型或同系物的形式存在相一致[9],特别是报道的一些芽孢杆菌属细菌更为普遍,如解淀粉芽孢杆菌SR1所产抗菌脂肽为表面活性素,同时含有伊枯草菌素和芬芥素[18];B.amyloliquefaciens PGPBacCA1在核盘菌(Sclerotinia sclerotiorum)和茄病镰刀菌(Fusarium solani)存在的情况下同时产生不同的脂肽同系物表面活性素、伊枯菌素和芬芥素[23];Bacillus sp.SL-6其发酵液中检测到4种芬芥素A和2种芬芥素B。整体显示,本研究脂肽分离纯化中先通过Sephadex LH-20初步纯化,去除对后续纯化影响较大的色素及大分子等杂质成分,再使用RP-HPLC将物质按照极性强弱分开,得到活性组分P4,分离效果好,可以将绝大部分杂质同脂肽分离,本研究所用分离方法可为脂肽的纯化提供借鉴。
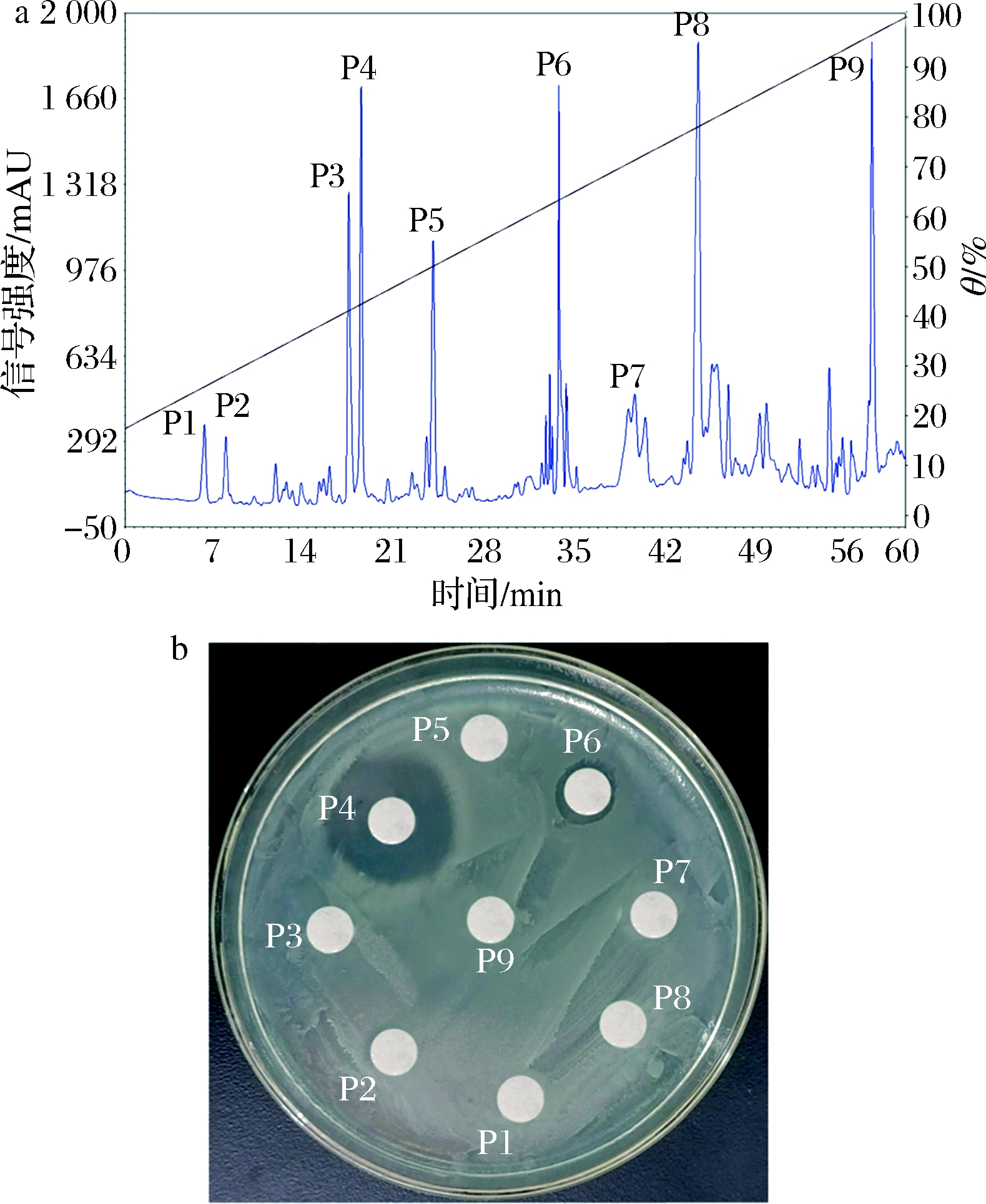
a-RP-HPLC洗脱曲线;b-抑菌活性检测
图6 短小芽孢杆菌XZK-18抗菌脂肽RP-HPLC纯化
Fig.6 Purification of antibacterial substance of Bacillus pumilus XZK-18 by RP-HPLC
2.5 脂肽类抑菌成分的FT-IR分析
菌株XZK-18所产脂肽FT-IR分析如图7所示,在3 432.74、3 387.36 cm-1的吸收峰是由N—H拉伸模式产生[15],在1 646.18 cm-1处强烈的吸收谱带为CO—N键的拉伸模式产生,而在1 541.26 cm-1的吸收峰是由于N—H键结合C—N键的变形模式产生,由此确定抗菌物质分子中存在多肽结构。在2 957.54~2 861.34 cm-1和1 402.30~1 205.22 cm-1处的吸收峰是由于的C—H拉伸模式产生,由此确定分子中存在脂肪酸链。而且1 724.17-1处的谱带是由于内酯羰基吸收而形成,说明分子中含有环肽结构。这些结果有力表明,该抗菌物质含有有脂肪烃和肽片段。经分离纯化的脂肽FT-IR与文献报道的环状芽孢杆菌(Bacillus circulans)等芽孢杆菌属细菌产生的表面活性素分子的特征有明显的相似性[16],由此进一步证实短小芽孢杆菌XZK-18所产抗菌脂肽主要为表面活性素。

图7 短小芽孢杆菌XZK-18抗菌脂肽FT-IR扫描
Fig.7 FT-IR of antimicrobial substance of Bacillus pumilus XZK-18
2.6 大肠杆菌经脂肽处理后的扫描电镜
未经脂肽处理和经脂肽处理后的大肠杆菌扫描电镜如图8所示,未经处理的大肠杆菌具有完整的生物膜结构,菌体饱满、表面光滑(图8-a),而用纯化脂肽处理2 h后的大肠杆菌与未处理的对照菌株比较发现,脂肽致使菌体表面形成孔洞,其周围细胞膜向内塌陷,而且孔多分布在菌体头部(图8-b),部分菌体收缩变形,表面不平整,这表明脂肽对菌体细胞壁细胞膜有破坏作用。推测,菌株XZK-18所产表面活性素对大肠杆菌等敏感细胞的杀菌或抑菌作用,是因其致使菌体细胞膜穿孔,细胞内容物向外渗漏,致使菌体死亡,这是其抑菌作用的主要作用机制,这与文献报道的脂肽家族中的表面活性素杀菌机制相吻合[18],有力证实了短小芽孢杆菌XZK-18所产脂肽主要为表面活性素。SONG等[24]报道的解淀粉芽孢杆菌R3所产表面活性素对大肠杆菌的细胞膜也有类似的破坏作用。细胞膜是细菌自产的胞外聚合物,可以使菌体更好地适应外界环境,增加其自身毒性和增强对外界抗生素或病毒的抗性。在食品工业中,食源性致病菌或腐败菌容易附着在设备表面形成生物膜,特别是在难以直接清洗接触到的设备部件位置,难以彻底清洗,容易引起交叉污染,带来严重的食品安全问题。脂肽通过生物膜的破坏作用杀灭病原菌,这在食品防腐及医药应用中具有重要应用前途。
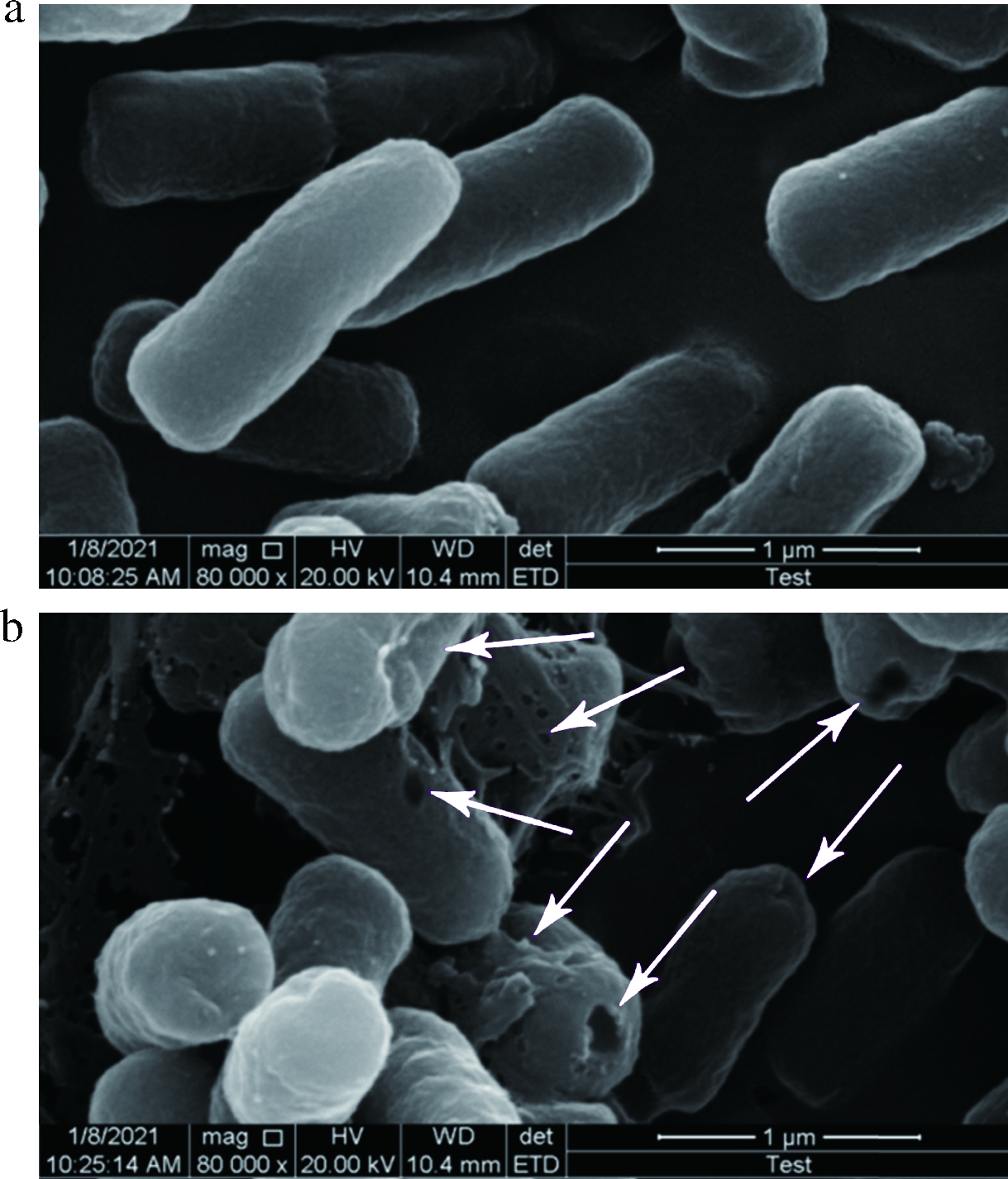
a-未经脂肽处理;b-经脂肽处理
图8 大肠杆菌经脂肽处理前后的扫描电镜
Fig.8 Scanning electron microscopes of untreated and treated with lipopeptide
2.7 脂肽抗菌谱检测
在本研究中,选用了13株指示菌,其中5株革兰氏阴性菌,5株革兰氏阳性菌,3株真菌。其中大多数为食源性致病菌或腐败菌,如金黄色葡萄球菌、单核增生李斯特菌、伤寒沙门氏菌、副溶血性弧菌、福氏志贺氏菌、大肠杆菌、铜绿假单胞菌等。琼脂孔扩散法检测抑菌活性显示,孔周围出现了大小不等的显著的抑菌圈,具体大小如表1所示。菌株XZK-18所产脂肽对所有细菌均具有抑菌活性,其中对革兰氏阳性菌的抑菌效果最为明显,尤其是金黄色葡萄球菌和蜡样芽胞杆菌抑菌活性最强,其抑菌圈直径达到22 mm以上。对革兰氏阴性菌也有一定的抑菌效果,抑菌圈直径在13~21 mm。对比脂肽对革兰氏阳性菌和阴性菌的抑菌活性,存在显著性差异(P<0.05)。脂肽对白色念珠菌、毕赤酵母、黑曲霉等真菌的抑菌活性同空白对照(磷酸缓冲溶液)没有显著性差异(P>0.05),说明无抑菌活性。推测脂肽对不同类型的微生物的抑菌活性与细胞壁或细胞膜的结构构成有重要关系。脂肽对细菌的抑制作用多有报道,如韦露等[25]研究报道的1株短小芽孢杆菌B1对溶藻弧菌、杀鲑气单胞菌、哈氏弧菌等水产养殖病原菌有抑制作用,但同样对例如金黄色葡萄球菌的食源性病原性无抑制作用。而本研究脂肽在抑制食源性致病菌腐败菌方面具有显著优势,有潜力作为生物防腐剂应用于食品工业中,减少化学合成防腐剂的使用,延长食品保货架期。
表1 短小芽孢杆菌XZK-18脂肽抑菌谱
Table 1 Antimicrobial spectrum of Bacillus pumilus XZK-18 lipopeptide
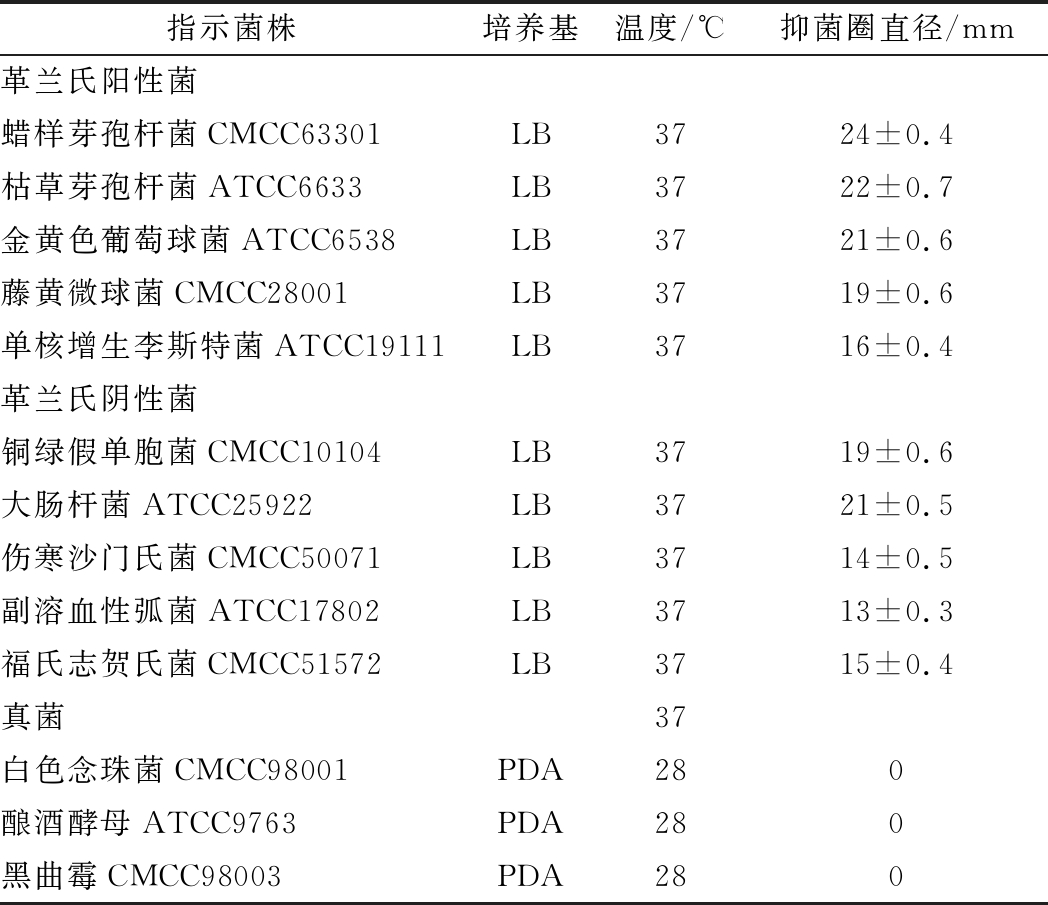
指示菌株培养基温度/℃抑菌圈直径/mm革兰氏阳性菌蜡样芽孢杆菌CMCC63301LB3724±0.4枯草芽孢杆菌ATCC6633LB3722±0.7金黄色葡萄球菌ATCC6538LB3721±0.6藤黄微球菌CMCC28001LB3719±0.6单核增生李斯特菌ATCC19111LB3716±0.4革兰氏阴性菌铜绿假单胞菌CMCC10104LB3719±0.6大肠杆菌ATCC25922LB3721±0.5伤寒沙门氏菌CMCC50071LB3714±0.5副溶血性弧菌ATCC17802LB3713±0.3福氏志贺氏菌CMCC51572LB3715±0.4真菌37白色念珠菌CMCC98001PDA280酿酒酵母ATCC9763PDA280黑曲霉CMCC98003PDA280
2.8 抗菌脂肽稳定性分析
2.8.1 抗菌脂肽热稳定特性
脂肽热稳定性如图9所示,在70~100 ℃保温30 min脂肽抑菌抑菌活性基本无变化,差异显著性分析表明,70~100 ℃处理后的脂肽抑菌圈同磷酸缓冲液空白对照没有显著性差异(P>0.05),说明70~100 ℃脂肽耐热性较好。110 ℃ 30 min后抑菌活性略微减少,但加热至120 ℃ 30 min后,抑菌活性明显下降,但仍能看出显著的抑菌活性。可见脂肽在110 ℃以下耐热性较好。不同来源的脂肽其热稳定性区别较大,如BEN AYED等[26]报道的莫海威芽孢杆菌(Bacillus mojavensis A21)脂肽也具有良好的热稳定性,但其在90、100 ℃保温15 min抑菌活性就开始出现下降。脂肽良好的耐热性使其应用范围更为广泛,可以在更为极端的热环境下使用。食品工业防腐中,使用单一的抗菌物质很难确保完全的防腐效果,故通常将1种抗菌物质和其他几种抗菌化合物或抗菌技术联合使用,例如适当的热消毒、脉冲电场、射线消毒等,本研究脂肽完全能够承受食品加工过程中的巴氏杀菌等热处理过程。
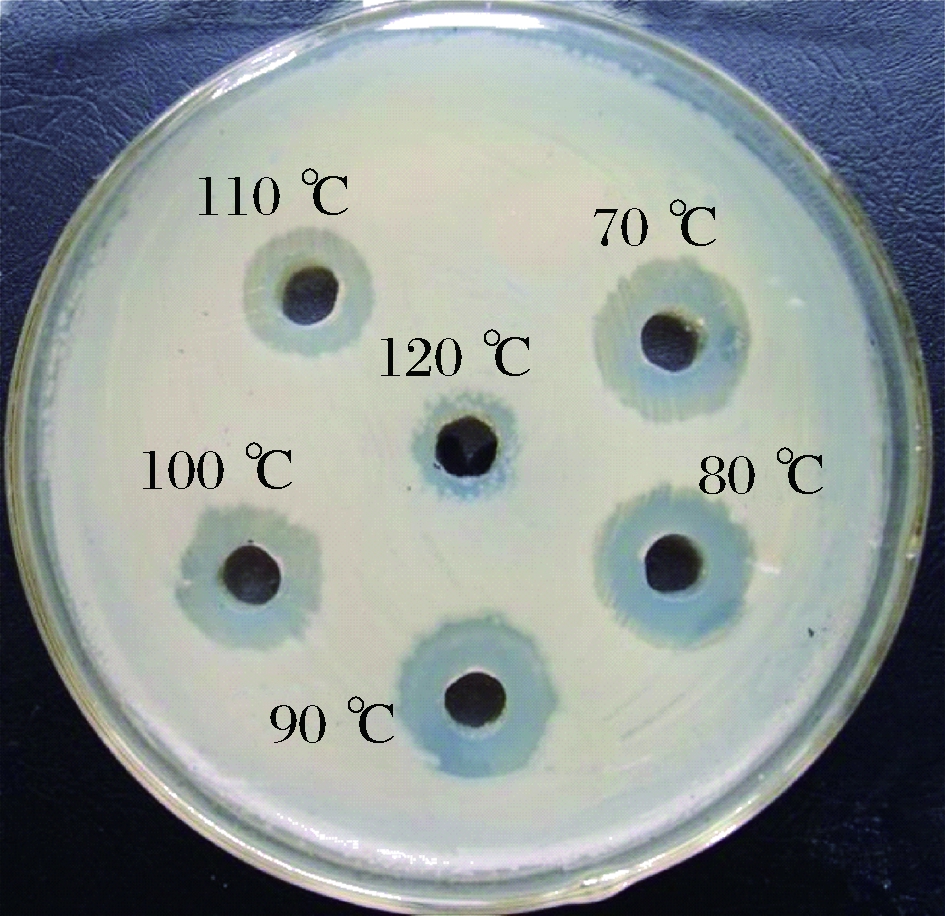
图9 不同温度对抗菌脂肽抑菌活性的影响
Fig.9 Effects of different temperatures on antibacterial activity of antimicrobial lipopeptid
2.8.2 抗菌脂肽酸碱稳定性
在恶劣的贮存环境下具备良好的稳定性是脂肽开发应用的重要前提。脂肽酸碱稳定性情况如图10所示,抗菌脂肽在pH 5~9环境下保存1~10 d相对抑菌活性都处在85%以上,具有较稳定的抑菌活性;而pH在3.0和11.0时,随着贮存时间延长,抑菌活性均出现降低,但贮存10 d抑菌活性仍然在70%以上。因此脂肽具有非常好的酸碱稳定性,与李旭等[27]报道的枯草芽孢杆菌抗菌脂肽酸碱稳定性类似。但不同来源的脂肽酸碱抑菌稳定性区别较大,陆雅琴等[28]报道的芽孢杆菌P6抗菌脂肽在pH>9.0时抑菌活性丧失,但李红晓等[29]研究的解淀粉芽孢杆菌MH71脂肽在pH 5~11的环境下抑菌活性较强,pH<4时稳定性显著下降。整体看,脂肽在宽泛的pH范围内具有良好的稳定性,有潜力在不同酸碱度的食品中使用。

图10 不同pH对抗菌脂肽抑菌活性的影响
Fig.10 Effect of different pH on antibacterial activity of antimicrobial lipopeptid
3 结论
本研究从徐州市睢宁县农村自制香肠中分离到1株对多种食源性病原菌有抑菌活性的短小芽孢杆菌XZK-18。菌株发酵液中提取的抗菌物质经TLC及TLC-生物自显影分析确定为脂肽类混合物,包括表面活性素和伊枯草菌素。分离纯化的脂肽不仅可以抑制致病性的革兰氏阳性菌如蜡样芽孢杆菌、金黄色葡萄球菌、藤黄微球菌和单核增生李斯特菌,还对容易引起人类重大疾病的革兰氏阴性菌如铜绿假单胞菌、大肠杆菌、伤寒沙门氏菌、副溶血性弧菌和福氏志贺氏菌也有抑制作用,故该脂肽有潜力开发为食品防腐剂,抑制食源性致病菌;同时可以在医药领域中使用。扫描电镜显示脂肽通过破坏细胞膜完整性、使细胞壁穿孔、细胞膜通透性增强杀灭大肠杆菌。脂肽良好的热稳定性、酸碱耐受性和广谱杀菌活性表明其在多种工业领域如环境生物修复、制药、生物防治、化妆品、饲料和食品加工等多个行业特别是食品工业中具有广阔的应用前景。
[1] STEIN T.Bacillus subtilis antibiotics:Structures, syntheses and specific functions[J].Molecular Microbiology, 2005, 56(4):845-857.
[2] ARNISON P G, BIBB M J, BIERBAUM G, et al.Ribosomally synthesized and post-translationally modified peptide natural products:Overview and recommendations for a universal nomenclature[J].Natural Product Reports, 2013, 30(1):108-160.
[3] LA ROSA P S, BROOKS J P, DEYCH E, et al.Hypothesis testing and power calculations for taxonomic-based human microbiome data[J].PLoS One, 2012, 7(12):e52078.
[4] HYRONIMUS B, LE MARREC C, URDACI M C.Coagulin, a bacteriocin-like inhibitory substance produced by Bacillus coagulans I4[J].Journal of Applied Microbiology, 1998, 85(1):42-50.
[5] GRAY E J, LEE K D, SOULEIMANOV A M, et al.A novel bacteriocin, thuricin 17, produced by plant growth promoting rhizobacteria strain Bacillus thuringiensis NEB17:Isolation and classification[J].Journal of Applied Microbiology, 2006, 100(3):545-554.
[6] SANSINENEA E, ORTIZ A.Secondary metabolites of soil Bacillus spp[J].Biotechnology Letters, 2011, 33(8):1 523-1 538.
[7] ZOUARI I, JLAIEL L, TOUNSI S, et al.Biocontrol activity of the endophytic Bacillus amyloliquefaciens strain CEIZ-11 against Pythium aphanidermatum and purification of its bioactive compounds[J].Biological Control, 2016, 100:54-62.
[8] MONDOL M A M, SHIN H J, ISLAM M T.Diversity of secondary metabolites from marine Bacillus species:Chemistry and biological activity[J].Marine Drugs, 2013, 11(8):2 846-2 872.
[9] ZHOU H, CONG B L, TIAN Y Q, et al.Characterization of novel cyclic lipopeptides produced by Bacillus sp. SY27F[J].Process Biochemistry, 2019, 83:206-213.
[10] HWANG Y H, PARK B K, LIM J H, et al.Lipopolysaccharide-binding and neutralizing activities of surfactin C in experimental models of septic shock[J].European Journal of Pharmacology, 2007, 556(1-3):166-171.
[11] 高兆建, 王秋芬, 丁飞鸿, 等.广谱拮抗菌株的筛选诱变及抗菌物质分离鉴定[J].食品科学, 2021, 42(2):143-150.
GAO Z J, WANG Q F, DING F H, et al.Screening and mutagenesis of broad-spectrum antagonistic Bacillus licheniformis and purification and identification of antimicrobial substances produced by its mutant[J].Food Science, 2021, 42(2):143-150.
[12] ZHENG D H, ZENG Z Y, XUE B B, et al.Bacillus thuringiensis produces the lipopeptide thumolycin to antagonize microbes and nematodes[J].Microbiological Research, 2018, 215:22-28.
[13] BIONDA N, FLEEMAN R M, DE LA ![]() C, et al.Identification of novel cyclic lipopeptides from a positional scanning combinatorial library with enhanced antibacterial and antibiofilm activities[J].European Journal of Medicinal Chemistry, 2016, 108:354-363.
C, et al.Identification of novel cyclic lipopeptides from a positional scanning combinatorial library with enhanced antibacterial and antibiofilm activities[J].European Journal of Medicinal Chemistry, 2016, 108:354-363.
[14] COZZOLINO M E, DISTEL J S, GARC A P A, et al.Control of postharvest fungal pathogens in pome fruits by lipopeptides from a Bacillus sp.isolate SL-6[J].Scientia Horticulturae, 2020, 261:108957.
A P A, et al.Control of postharvest fungal pathogens in pome fruits by lipopeptides from a Bacillus sp.isolate SL-6[J].Scientia Horticulturae, 2020, 261:108957.
[15] DALILI D, AMINI M, FARAMARZI M A, et al.Isolation and structural characterization of Coryxin, a novel cyclic lipopeptide from Corynebacterium xerosis NS5 having emulsifying and anti-biofilm activity[J].Colloids and Surfaces B Biointerfaces, 2015, 135:425-432.
[16] NANJUNDAN J, RAMASAMY R, UTHANDI S, et al.Antimicrobial activity and spectroscopic characterization of surfactin class of lipopeptides from Bacillus amyloliquefaciens SR1[J].Microbial Pathogenesis, 2019, 128:374-380.
[17] GONZ LEZ-JARAMILLO L M, ARANDA F J, TERUEL J A, et al.Antimycotic activity of fengycin C biosurfactant and its interaction with phosphatidylcholine model membranes[J].Colloids and Surfaces B Biointerfaces, 2017, 156:114-122.
LEZ-JARAMILLO L M, ARANDA F J, TERUEL J A, et al.Antimycotic activity of fengycin C biosurfactant and its interaction with phosphatidylcholine model membranes[J].Colloids and Surfaces B Biointerfaces, 2017, 156:114-122.
[18] BALAN S S, KUMAR C G, JAYALAKSHMI S.Aneurinifactin, a new lipopeptide biosurfactant produced by a marine Aneurinibacillus aneurinilyticus SBP-11 isolated from Gulf of Mannar:Purification, characterization and its biological evaluation[J].Microbiological Research, 2017, 194:1-9.
[19] RAMALINGAM V, VARUNKUMAR K, RAVIKUMAR V, et al.Production and structure elucidation of anticancer potential surfactin from marine actinomycete Micromonospora marina[J].Process Biochemistry, 2019, 78:169-177.
[20] MEENA K R, SHARMA A, KUMAR R, et al.Two factor at a time approach by response surface methodology to aggrandize the Bacillus subtilis KLP2015 surfactin lipopeptide to use as antifungal agent[J].Journal of King Saud University-Science, 2020, 32(1):337-348.
[21] SRIRAM M I, KALISHWARALAL K, DEEPAK V, et al.Biofilm inhibition and antimicrobial action of lipopeptide biosurfactant produced by heavy metal tolerant strain Bacillus cereus NK1[J].Colloids and Surfaces B:Biointerfaces, 2011, 85(2):174-181.
[22] Y NEZ-MENDIZ
NEZ-MENDIZ BAL V, FALCON
BAL V, FALCON C E.Efficacy of Bacillus spp. to biocontrol of anthracnose and enhance plant growth on Andean lupin seeds by lipopeptide production[J].Biological Control, 2018, 122:67-75.
C E.Efficacy of Bacillus spp. to biocontrol of anthracnose and enhance plant growth on Andean lupin seeds by lipopeptide production[J].Biological Control, 2018, 122:67-75.
[23] TORRES M J, PÉREZ Brandan C, SABATÉ D C, et al.Biological activity of the lipopeptide-producing Bacillus amyloliquefaciens PGPBacCA1 on common bean Phaseolus vulgaris L.pathogens[J].Biological Control, 2017, 105:93-99.
[24] SONG B, WANG Y Z, WANG G Y, et al.The lipopeptide 6-2 produced by Bacillus amyloliquefaciens anti-CA has potent activity against the biofilm-forming organisms[J].Marine Pollution Bulletin, 2016, 108(1-2):62-69.
[25] 韦露, 陈偿, 龙云映, 等.1株短小芽孢杆菌B1的筛选鉴定及其抗菌特性研究[J].水产科学, 2015, 34(3):161-168.
WEI L, CHEN C, LONG Y Y, et al.Isolation, identification and antimicrobial activity of Bacillus pumilus B1[J].Fisheries Science, 2015, 34(3):161-168.
[26] BEN AYED H, HMIDET N, BÉCHET M, et al.Identification and biochemical characteristics of lipopeptides from Bacillus mojavensis A21[J].Process Biochemistry, 2014, 49(10):1 699-1 707.
[27] 李旭, 马福海, 王秀娟, 等.大豆根腐病生防菌KJB04-11的鉴定及其产生的脂肽类抗生素[J].生态学杂志, 2012, 31(6):1 453-1 460.
LI X, MA F H, WANG X J, et al.Identification of bio-control bacterial strain KJB04-11 against soybean root rot disease and the produced lipopeptide antibiotics by the strain[J].Chinese Journal of Ecology, 2012, 31(6):1 453-1 460.
[28] 陆雅琴, 郭丽琼, 孙丽仪, 等.芽孢杆菌P6产抗菌脂肽条件优化及发酵液性质研究[J].中国食品学报, 2018, 18(11):90-96.
LU Y Q, GUO L Q, SUN L Y, et al.Conditions optimization of Bacteria bacillus P6 producing antibacterial lipopeptides and studies on it′s physical and chemical property[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(11):90-96.
[29] 李红晓, 张殿朋, 赵洪新, 等.解淀粉芽胞杆菌MH71抗菌物质理化特性及对番茄灰霉病菌的抑菌活性[J].中国生物防治学报, 2016, 32(4):485-492.
LI H X, ZHANG D P, ZHAO H X, et al.Physical and chemical properties of antimicrobial from Bacillus amyloliquefaciens strain MH71 and its inhibition activities against Botrytis cinerea[J].Chinese Journal of Biological Control, 2016, 32(4):485-492.