蜂王幼虫又称蜂子、蜂王胎或蜂皇胎,由蜜蜂的受精卵孵化约3日龄而成的幼虫体,始终以工蜂分泌的蜂王浆为食物,是蜂王浆生产过程中的必然产品。我国蜂王浆年产量约3 000 t,产量和出口量占全球总量的90%以上,一般每生产1 kg蜂王浆,可收获蜂王幼虫0.2~0.3 kg[1]。蜂王幼虫营养成分丰富,是一类高蛋白且氨基酸组成全面、维生素含量丰富的可食用昆虫,然而其蛋白制品通常只是进行简易的加工,技术含量和附加值低,近年来蜂王幼虫肽产品开发受到关注。主要研究侧重于不同的商业酶酶解蜂王幼虫的工艺优化以及活性研究,但得到的多肽抗氧化活性并不强,对多肽的结构表征也少[2]。
已有研究发现,从蚕蛹、蜂蛹、黄粉虫等昆虫蛋白中制备得到的活性肽均表现出较好的抗氧化活性,生产应用前景广阔[3-5]。蜂王幼虫和蜂蛹相似,都是蜜蜂发育过程中的幼虫体,富含高度同源的蛋白质,值得开发利用,而且我国蜂王幼虫资源充足,与畜牧行业生产动物性蛋白相比碳排放量低,可实现绿色生产,有工业化生产潜力,然而大多数的蜂王幼虫蛋白资源仍未得到有效利用。相比酶解法,微生物发酵法所产蛋白酶系丰富,能将微生物产酶和酶解蛋白工艺同时进行,酶解效率更高,省去酶的分离和提纯的步骤,降低了生产成本[6];微生物发酵法在蜂王幼虫活性肽产品开发和应用上研究较少,这也为工业化生产蜂王幼虫活性肽提供一条可行的途径。枯草芽孢杆菌和黑曲霉都是蛋白酶分泌能力强的菌株[7],根据它们的产酶特点复配使用,理论上会使多肽不仅得率高而且风味好。蛋白酶可以水解蛋白质产生小分子的活性肽和氨基酸[8],蛋白酶活力和多肽的产率成正比,要提高多肽的得率就要调控发酵条件提高微生物产蛋白酶的活力。本文利用枯草芽孢杆菌和黑曲霉复配发酵蜂王幼虫冻干粉制备抗氧化肽,重点研究不同发酵条件对多肽得率和发酵体系中蛋白酶活力的影响,并对目标抗氧化肽进行分离纯化,测定其体外抗氧化活性并表征其结构,期望为蜂王幼虫的生物活性研究、开发高营养、高附加值的产品提供新的思路。
1 材料与方法
1.1 实验材料
1.1.1 主要实验材料
蜂王幼虫冻干粉,湖北某蜂业公司;枯草芽孢杆菌M2020782,本实验室从蜂粮中分离鉴定,保藏于中国典型培养物保藏中心;黑曲霉91006,中国典型培养物保藏中心;其余试剂均为国产分析纯。
1.1.2 仪器与设备
YXQ-LS-30S立式压力蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂;HZQ-160全温振荡培养箱,太仓市实验设备厂;Multiskan GO全波长酶标仪,美国Thermo Fisher公司;Allegra X-15R低温高速离心机,美国贝克曼公司;BONA-GM-18有机膜分离试验机,济南博纳生物技术有限公司;A300全自动氨基酸分析仪,德国曼默博尔公司;AL204真空冷冻干燥机,梅特勒-托利多仪器(上海)有限公司;Ultimate 3000液相色谱仪、Q Exactive质谱仪,美国Thermo Scientific公司。
1.2 实验方法
1.2.1 种子液的制备[7]
挑取3~5环活化后的菌种接于已灭菌的装有100 mL液体种子培养基的250 mL锥形瓶中,放入恒温振荡摇床中进行扩大培养一段时间,即得到种子液。
1.2.2 制备工艺
蜂王幼虫粗肽样品制备工艺如下:
蜂王幼虫冻干粉→加水混合(发酵总量50 mL/250mL锥形瓶)→高温灭菌(105 ℃,20 min)→接种→发酵→沸水浴(100 ℃,15 min)→冷却→离心(4 000 r/min,15 min)→取上清液→蜂王幼虫粗肽样品
1.2.3 蜂王幼虫多肽得率的测定
参考徐萍[9]的方法测定蜂王幼虫多肽得率,以肽的质量浓度为横坐标X(mg/mL),OD值为纵坐标Y,制作标准曲线y=0.063 7x-0.001 8(R2=0.998 7)。
样品的测定:取2 mL发酵上清液,加入1 mL 10%的三氯乙酸(trichloroacetic acid,TCA),混匀后静置30 min,沉淀大分子蛋白,4 000 r/min离心15 min,取上清液1.5 mL,并加入1 mL双缩脲试剂[V(样液)∶V(双缩脲试剂)=3∶2],混匀后室温静置30 min,测定540 nm处的吸光值,代入标准曲线计算上清液多肽浓度。根据公式(1)计算多肽得率:
多肽得率![]()
(1)
式中:c,发酵液中多肽质量浓度,g/mL;V,发酵粗肽液体积,mL;X1,蜂王幼虫蛋白质的质量分数,%;m,蜂王幼虫原料质量,g。
1.2.4 蛋白酶活力的测定
参照GB/T 23527—2009《蛋白酶制剂》中的福林法进行测定。根据不同L-酪氨酸浓度对应波长680 nm处的吸光值绘制标准曲线y=0.007 1x-0.001 2(R2=0.999 7)。
1.2.5 发酵工艺的优化
在发酵总量50 mL、料水比5%、摇床转速180 r/min、pH为6.5、发酵温度30 ℃、初始枯草芽孢杆菌∶黑曲霉复配体积比=2∶1、接种量5%(体积分数)、发酵时间60 h等基础条件下,考察复配体积比(1∶1、1∶2、2∶1、3∶1、1∶3)、接种量(3%、5%、7%、9%、11%)和发酵时间(24、36、48、60、72 h)对发酵液多肽得率和蛋白酶活力的影响。在单因素试验的基础上,采用响应面分析法中Box-Benhnken试验设计优化发酵工艺。
1.2.6 氨基酸组成的测定
测定参照GB 5009.124—2016《食品中氨基酸的测定》。
1.2.7 超滤分离
在室温条件下,选择10、5、3、1 kDa的卷式超滤膜将发酵液进行逐级分离,分别得到5个分离级分,分别是分子质量>10 kDa的组分F5,5~10 kDa的组分F4,3~5 kDa的组分F3,1~3 kDa组分F2,<1 kDa组分F1。滤液流速为0.5~8 L/h,膜元件压力0~0.8 MPa。将收集到的各个组分浓缩、真空冷冻干燥得到各组分的冻干粉,-20 ℃保存,测定其抗氧化活性。
1.2.8 体外抗氧化活性测定
1.2.8.1 DPPH自由基清除率的测定
将经过超滤处理的不同组分的粗多肽冻干粉依次配成0.5、1、1.5、2、2.5 mg/mL的多肽液。参考涂宗财等[10]的方法,分别测定50 μL各浓度待测粗肽液与150 μL的0.2 mmol/L DPPH反应后吸光值A1。以50 μL去离子水与150 μL DPPH溶液混合作为空白对照组A2,以50 μL粗肽样品与150 μL 95%乙醇混合作为本底对照组A0。按公式(2)计算DPPH自由基清除率:
DPPH自由基清除率![]()
(2)
计算半抑制浓度(half maximal inhibitory concentration,IC50),IC50越小表示DPPH自由基清除力越强。
1.2.8.2 ABTS阳离子自由基清除率的测定
称取经过超滤处理的不同组分蜂王幼虫粗多肽冻干粉,分别配成0.1、0.2、0.3、0.4、0.5 mg/mL多肽液,参考白海娜等[11]的方法,分别测定50 μL各浓度待测粗多肽液与100 μL ABTS阳离子工作液反应后的吸光值A1,以50 μL去离子水与100 μL ABTS阳离子工作液混合作为空白对照组A2,以50 μL粗肽样品与100 μL去离子水作为本底对照组A0,按公式(3)计算ABTS阳离子自由基清除率:
ABTS阳离子自由基清除率![]()
(3)
1.2.8.3 还原力的测定
参考LASSOUED等[12]的氰化钾氧化法,向试管中加入1 mL 2 mg/mL粗多肽液并依次加入各反应液后,静置10 min,以蒸馏水代替样品作为空白,700 nm测定吸光值,吸光值越大,说明样品还原力越强。
1.2.9 蜂王幼虫低聚肽序列LC-MS/MS鉴定[13]
抗氧化活性最好的超滤组分多肽序列采用LC-MS/MS进行鉴定。色谱条件:流动相:流动相A:0.1%甲酸,流动相B:0.1%甲酸、80%乙腈(acetonitrile,ACN),流速300 nL/min;洗脱时间0~5 min,5% B;5~45 min,5%~50% B;45~50 min,50%~90% B;50~55 min,90%B;55~65 min,90%~5% B。质谱条件:分离后的肽段直接进入质谱仪Thermo Scientific Q Exactive进行在线检测,参数如下:(1)一级质谱参数:分辨率:70 000;自动增益控制(auto gain control,AGC)target:3e6;最大驻留时间(maximum IT):40 ms;扫描范围:100~2 000 m/z;(2)二级质谱参数:分辨率:17 500;AGC target:1e5;最大IT:60 ms;TopN:20;NCE/stepped NCE:27。数据库检索软件为Mascot。
1.2.10 实验数据处理
所有实验进行至少3次重复,实验结果以平均值±标准差(mean±SD)表示,利用IBM SPSS Statistics 20.0对实验结果进行显著性分析,P<0.05表示各组数据之间的差异具有统计学意义。图表采用GraphPad Prism 8绘制及Design Expert 10进行响应面优化。
2 结果与分析
2.1 单因素结果分析
2.1.1 复配比对混菌发酵蜂王幼虫冻干粉的影响
枯草芽孢杆菌和黑曲霉所产蛋白酶的性质差异较大,前者主要为内肽酶,而且蛋白酶活力高,能够增加蜂王幼虫多肽的产率,但发酵产物臭味重,很难除去;后者则为端肽酶,可以改善蜂王幼虫多肽的风味。由图1可知,当枯草芽孢杆菌的接种量≥黑曲霉时,多肽得率和酶活力较高,在接种比为2∶1时,达到最大值。这一结果与采用用枯草芽孢杆菌和黑曲霉混合发酵绿豆蛋白粉时结果吻合,同样是枯草芽孢杆菌比例高时多肽浓度更高[14]。这可能是因为枯草芽孢杆菌在发酵初期利用营养物质及生长繁殖能力强于黑曲霉,会成为主要优势菌,增加多肽的产率。选择枯草芽孢杆菌与黑曲霉的接种比例为1∶1、2∶1以及3∶1作为响应面试验的3个水平。
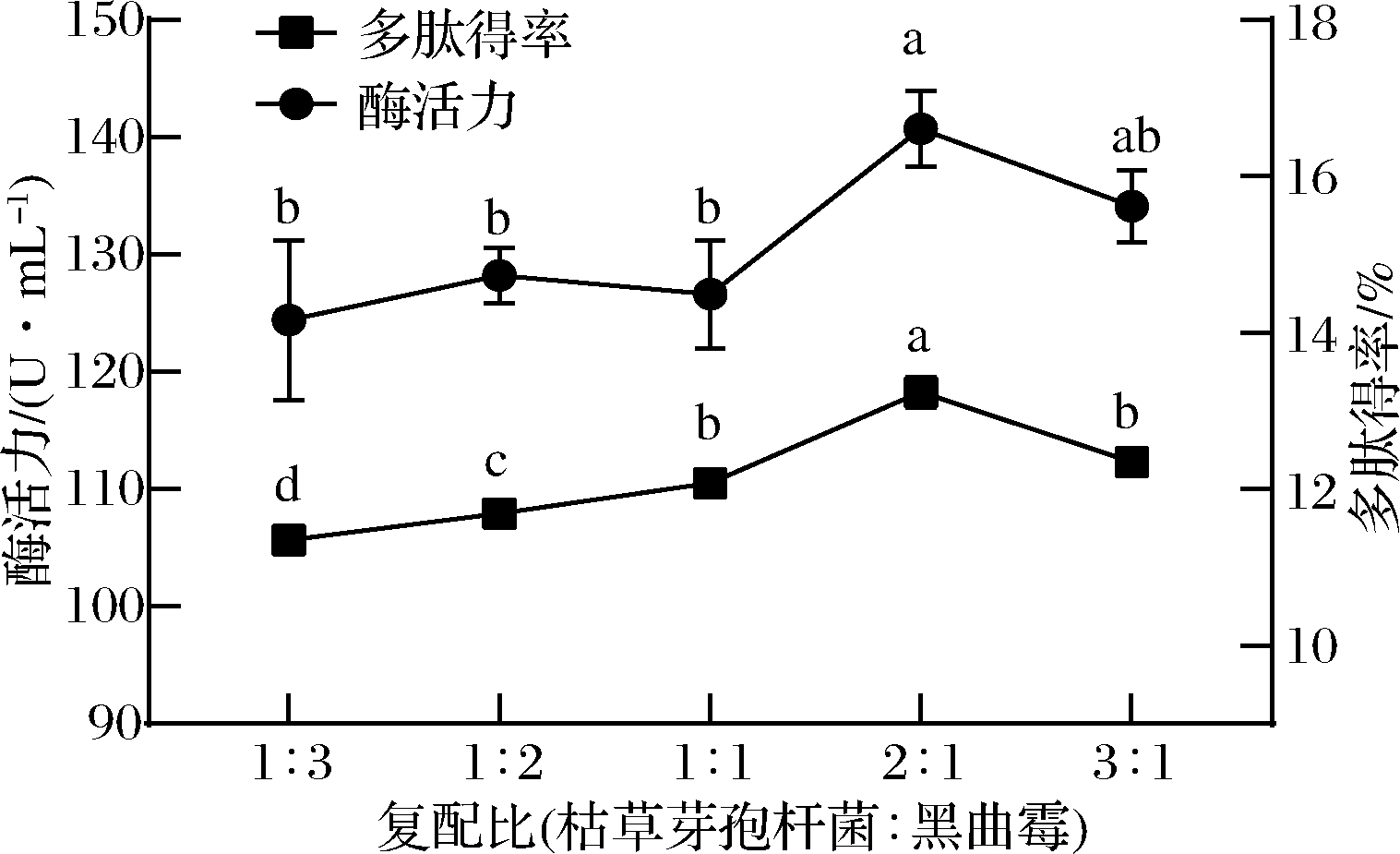
图1 复配比对酶活力和多肽得率的影响
Fig.1 Effect of Bacillus subtilis to Aspergillus niger ratio on enzyme activity and peptide yield
注:不同小写字母表示差异显著(P<0.05)(下同)
2.1.2 接种量对混菌发酵蜂王幼虫冻干粉的影响
适宜的接种量可以将微生物的延滞期变短,能更快利用底物进行发酵。如图2所示,在接种量为3%~7%时,发酵液的多肽得率和蛋白酶活力呈现上升的趋势,达到7%后,随着接种量的增加,其多肽得率和酶活力不再增加。这一变化趋势与枯草芽孢杆菌发酵燕麦制备血管紧张素转换酶(angiotensin converting enzyme,ACE)肽接种量与多肽得率变化结果相似[15]。当接种量浓度太低时,底物中的蛋白质无法被枯草芽孢杆菌和黑曲霉完全利用,只有部分得到水解;接种量超过一定浓度时会使微生物生长繁殖过快,得到的蜂王幼虫多肽可能会被菌体优先利用,此外培养基黏度增大,溶解氧不足,微生物生长受到抑制,导致酶活性和多肽得率不高。根据接种量对发酵产物的影响,响应面试验中接种浓度选定为5%~9%。
2.1.3 发酵时间对混菌发酵蜂王幼虫冻干粉的影响
合理把控发酵时间是在充分发酵物料的基础上,避免营养物质浪费、保证发酵产物质量的关键因素。如图3所示,发酵时间在24~60 h,枯草芽孢杆菌和黑曲霉快速繁殖,产生大量的蛋白酶,因此多肽得率和发酵体系蛋白酶活力都呈现上升的趋势,在60 h达到最大。随着时间的延长,微生物从稳定期进入衰亡期,蛋白酶产量和活力降低,培养基中的营养物质不断被利用,而菌种的生化反应过程并未终止,可能积累其他影响发酵液质量的有害代谢产物,微生物生长受到抑制[16]。还有可能随着时间的增加,产生的多肽类会被进一步水解成氨基酸,多肽得率有所下降[17]。因此选择发酵时间为48~72 h。
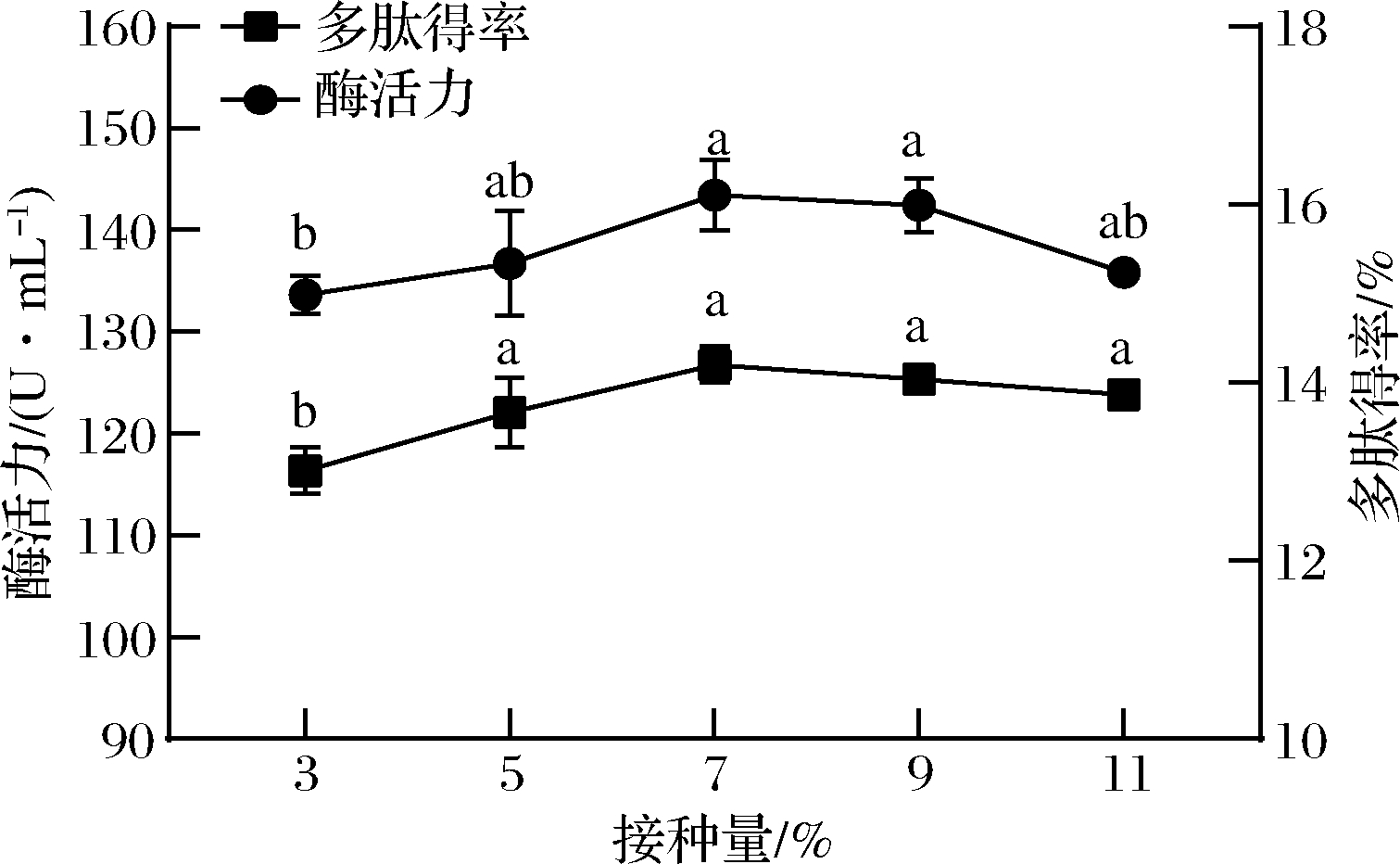
图2 接种量对酶活力和多肽得率的影响
Fig.2 Effect of inoculation amount on enzyme activity and peptide yield
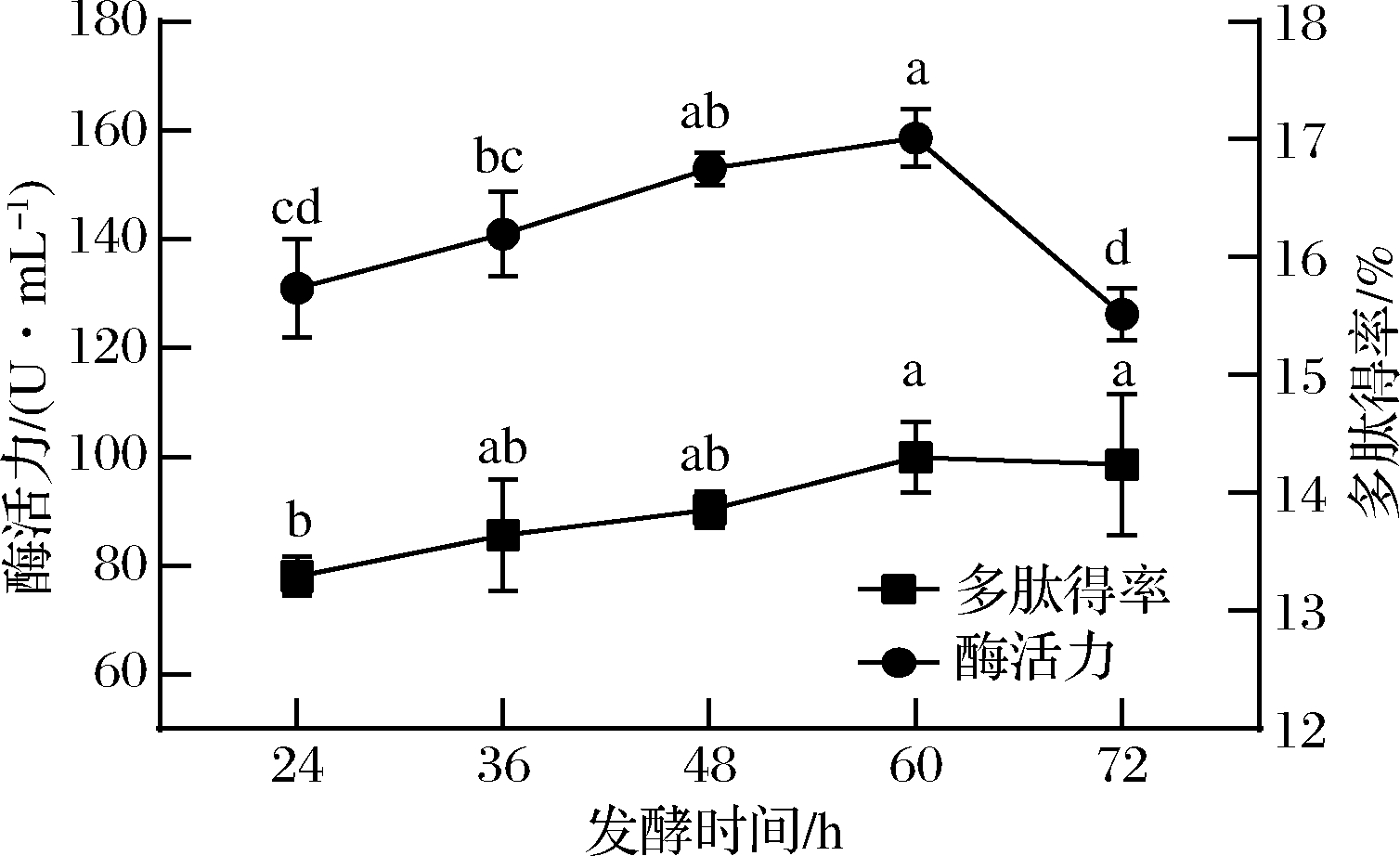
图3 发酵时间对酶活力和多肽得率的影响
Fig.3 Effect of fermentation time on enzyme activity and peptide yield
2.2 响应面试验结果与分析
2.2.1 响应面设计方案与结果
在单因素试验的基础上,采用软件Design Expert 10建立3因素3水平的实验设计,以多肽得率(Y1)和酶活力(Y2)为考察指标,选取复配比(A)、接种量(B)、发酵时间(C)为响应变量,每个因素设置低(-1)、中(0)、高(1)3个水平,采用响应面分析法优化枯草芽孢杆菌和黑曲霉复配发酵蜂王幼虫工艺。响应面试验因素水平见表1,设计及结果见表2。
表1 响应面试验因素水平表
Table 1 Response surface test factor level table

因素水平A(复配比)B(接种量)/%C(发酵时间)/h-11∶154802∶176013∶1972
表2 响应面试验设计及结果
Table 2 Response surface experimental design and results
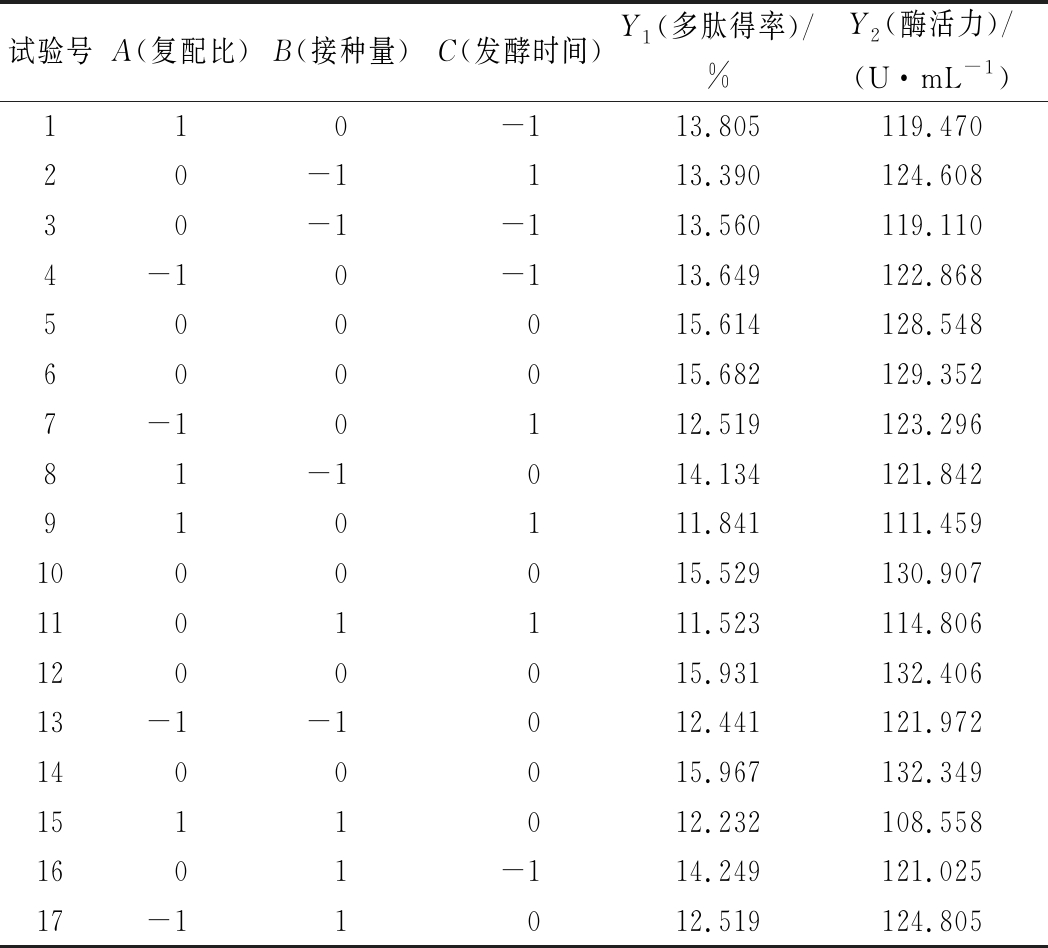
试验号A(复配比)B(接种量)C(发酵时间)Y1(多肽得率)/%Y2(酶活力)/(U·mL-1)110-113.805119.47020-1113.390124.60830-1-113.560119.1104-10-113.649122.868500015.614128.548600015.682129.3527-10112.519123.29681-1014.134121.842910111.841111.4591000015.529130.9071101111.523114.8061200015.931132.40613-1-1012.441121.9721400015.967132.3491511012.232108.5581601-114.249121.02517-11012.519124.805
2.2.2 回归模型分析及优化工艺条件确定与结果验证
利用Design-Expert 10.0统计软件将多肽得率和酶活力的实验结果分别进行二次回归拟合,并对二次多项回归方程进行方差分析,所建立的模型能比较准确地分析和预测蜂王幼虫液态发酵条件与多肽得率及酶活力的关系,并对正交试验结果进行方差分析,明确了3个因素对多肽得率和酶活力影响的主次顺序。在此基础上,得到枯草芽孢杆菌和黑曲霉复配发酵蜂王幼虫制备活性肽的最佳工艺条件为:复配比2.426∶1,接种量6.512%,发酵时间57.553 h,在此发酵条件下,多肽得率和酶活力的理论值是15.624%和128.38 U/mL。为验证响应面的可行性以及为方便操作,将发酵参数设为复配比2.4∶1,接种量6.5%,发酵时间57.5 h,在此条件下进行3次平行试验,测得平均多肽得率为(15.494±0.153)%,酶活力为(133.55±1.694) U/mL,均与理论预测值接近,由此说明用响应面回归模型拟合良好,对最佳发酵条件的优化具有一定的实用指导意义。
2.3 蜂王幼虫粗多肽的氨基酸测定
氨基酸组成是影响多肽抗氧化活性的重要因素之一[18]。采用氨基酸分析仪测定最优条件下发酵后的蜂王幼虫粗多肽冻干样品,氨基酸组成结果如表3所示,发现含量最高的是谷氨酸,达到14.17%,其次是脯氨酸(11.13%)、天冬氨酸(10.09%)、赖氨酸(8.78%)以及亮氨酸(7.84%)。抗氧化氨基酸的含量达到58.11%,疏水氨基酸为47.2%。有研究指出多肽序列碳端相邻的氨基酸残基为疏水性较低的氨基酸(如谷氨酸、天冬氨酸、精氨酸等)会提高多肽的抗氧化活性[19],预示发酵得到的粗多肽样品具有良好的抗氧化潜力。
表3 蜂王幼虫粗多肽冻干粉氨基酸组成分析
Table 3 Analysis of amino acid composition of queen bee larvae crude peptides freeze-dried powder

氨基酸名称含量/[g·(100 g)-1]含量/%氨基酸名称含量/[g·(100 g)-1]含量/%天冬氨酸(Asp)4.9310.09酪氨酸(Tyr)2.695.51苏氨酸(Thr)*2.374.86苯丙氨酸(Phe)*2.685.50丝氨酸(Ser)2.645.42组氨酸(His)0.470.97谷氨酸(Glu)6.9214.17赖氨酸(Lys)*4.298.78甘氨酸(Gly)2.124.35精氨酸(Arg)1.573.22丙氨酸(Ala)2.354.83脯氨酸(Pro)5.4311.13半胱氨酸(Cys)0.280.58必需氨基酸19.3839.71缬氨酸(Val)*2.996.12抗氧化氨基酸28.3658.11蛋氨酸(Met)*0.951.95疏水性氨基酸23.1947.52异亮氨酸(Ile)*2.274.65总氨基酸48.80100.00亮氨酸(Leu)*3.837.84
注:*为必需氨基酸;抗氧化氨基酸包括:天冬氨酸、谷氨酸、脯氨酸、蛋氨酸、酪氨酸、苯丙氨酸、组氨酸、赖氨酸;疏水氨基酸:脯氨酸、丙氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、酪氨酸、苯丙氨酸
2.4 超滤分离纯化组分的抗氧化性分析
2.4.1 不同分子段蜂王幼虫多肽DPPH自由基清除活性
由图4可知,发酵液各组分对DPPH自由基的清除率与质量浓度呈现一定的线性量效关系。在相同浓度条件下,<1 kDa的组分表现出最强的DPPH自由基清除效果,并且与其他组分的抗氧化活性存在显著性差异,其IC50为1.06 mg/mL,结果见表4。产生上述差异的原因可能由于分子质量小的低聚肽对应的空间位阻小,能够更好地靠近DPPH自由基,并与之发生反应[20]。虽然各组分对自由基清除率均低于抗坏血酸的清除能力,但有研究指出当某种物质的自由基清除率IC50值<10 mg/mL时,即可推断其具备一定的抗氧化能力[21]。可见,本实验中获得的蜂王幼虫发酵产物对DPPH自由基清除能力较强,而且优于贾歌[2]制备的蜂王幼虫酶解产物,其<1 kDa的组分DPPH自由基清除率的IC50值为21.86 mg/mL。
2.4.2 不同分子段蜂王幼虫多肽ABTS阳离子自由基清除活性
由图5可知,在含量为0.1~0.5 mg/mL时,各组分对ABTS阳离子自由基清除率均呈现一定的正向剂量效应,其中,<1 kDa组分和1~3 kDa组分的IC50值无显著性差异,但当多肽质量浓度>0.2 mg/mL时,<1 kDa组分在所有浓度都表现出最强的ABTS阳离子自由基清除能力,这可能是因为<1 kDa的肽段含有较多的游离氨基酸作为额外的电子和质子来源[22]。如表5所示,蜂王幼虫发酵产物<1 kDa组分清除ABTS阳离子自由基的IC50值为0.165 mg/mL,优于徐萍[9]制备的蜂蛹多肽(IC50=0.67 mg/mL)。

图4 不同分子段蜂王幼虫多肽DPPH自由基清除活性
Fig.4 DPPH radical scavenging activity of queen bee larvae polypeptides with different molecular weights
表4 不同分子段蜂王幼虫多肽清除DPPH自由基的IC50值
Table 4 The IC50 value of DPPH radical scavenging activity from queen bee larvae polypeptides with different molecular weights

组分IC50/(mg·mL-1)>10 kDa1.98±0.08a5~10 kDa1.57±0.09b3~5 kDa1.44±0.06cd1~3 kDa1.36±0.06d<1 kDa1.06±0.01e维生素C0.0204±0.0008
注:不同字母标注表示在Duncan分析下存在显著性差异(P<0.05)(下同)
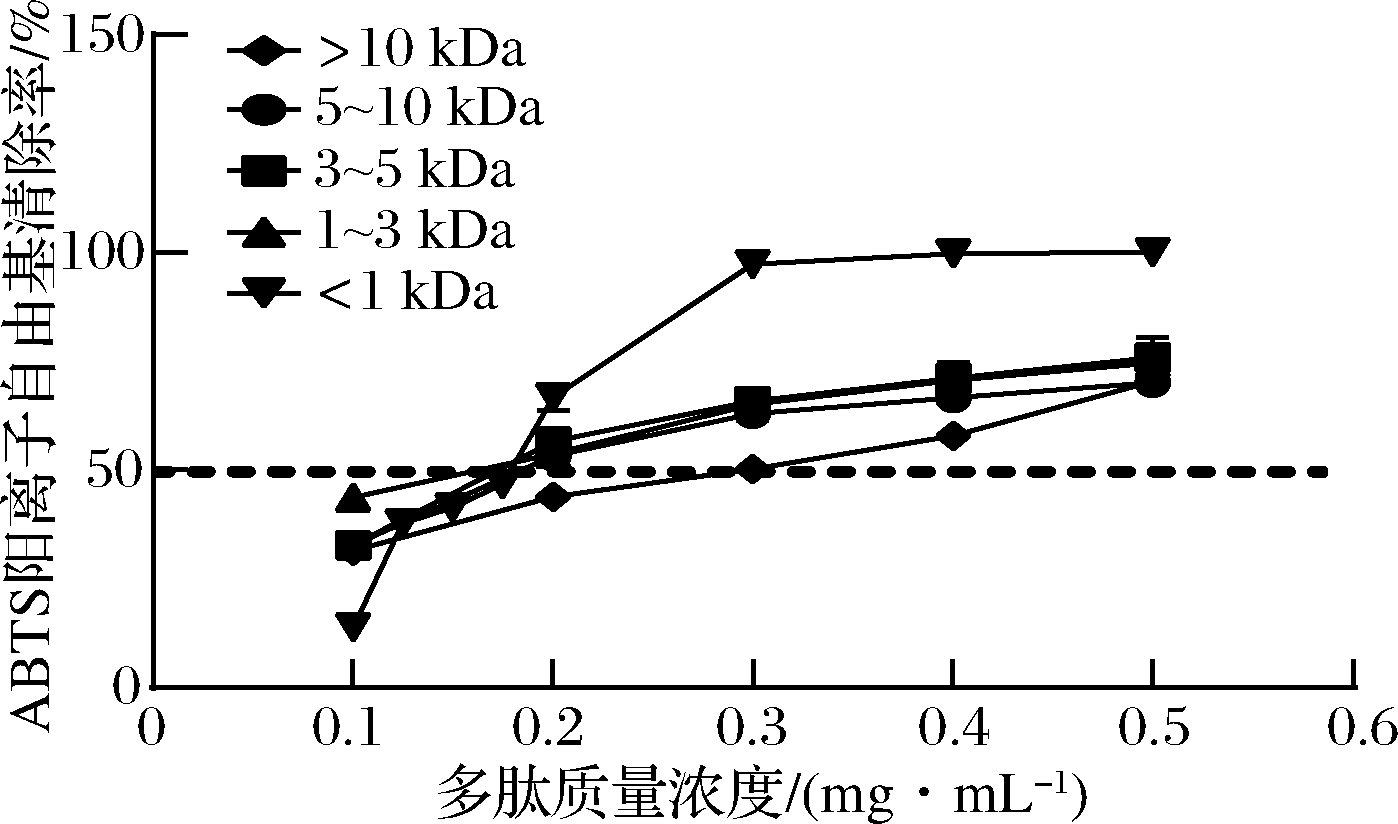
图5 不同分子段蜂王幼虫多肽ABTS阳离子自由基清除活性
Fig.5 ABTS cation radical scavenging activity of queen bee larvae polypeptides with different molecular weights
表5 不同分子段蜂王幼虫多肽清除ABTS阳离子自由基的IC50值
Table 5 The IC50 value of ABTS cation radical scavenging activity from queen bee larvae polypeptides with different molecular weights

组分IC50/(mg·mL-1)>10 kDa0.256±0.014a5~10 kDa0.191±0.005b3~5 kDa0.176±0.010bc1~3 kDa0.146±0.005cd<1 kDa0.165±0.004d维生素C0.00767±0.00022
2.4.3 不同分子段蜂王幼虫多肽还原力
当样品具有一定的抗氧化能力时,可将铁氰化钾中的Fe3+还原成亚铁形式,这种还原能力可以视为其具有潜在抗氧化活性的一个重要指标[23]。如图6所示,在质量浓度均为2 mg/mL时,蜂王幼虫发酵产物的还原能力随不同分子段的大小而有所差异,分子质量<1 kDa的组分还原力显著高于其他超滤组分(P<0.05)。在本研究中,2 mg/mL的蜂王幼虫<1 kDa 组分多肽测得的吸光值为0.389,还原力高于用酶解法制备的蜂蛹多肽[9]以及用枯草芽孢杆菌发酵虎斑乌贼得到的抗氧化肽[24],说明蜂王幼虫<<1 kDa 组分具有较好的还原能力。
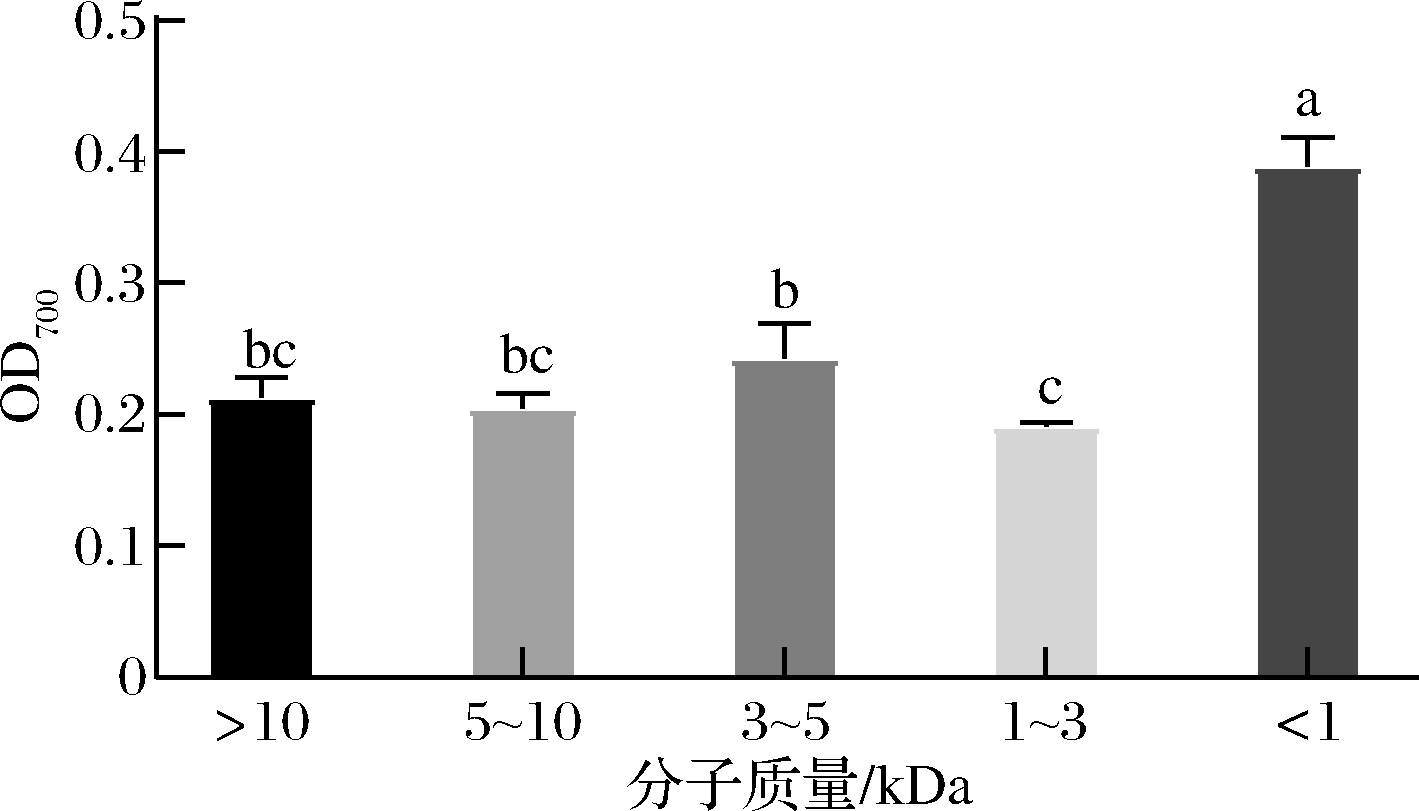
图6 不同分子段蜂王幼虫多肽的还原力
Fig.6 The reducing power of queen bee larvae polypeptides with different molecular weights
2.5 蜂王幼虫抗氧化肽的结构鉴定
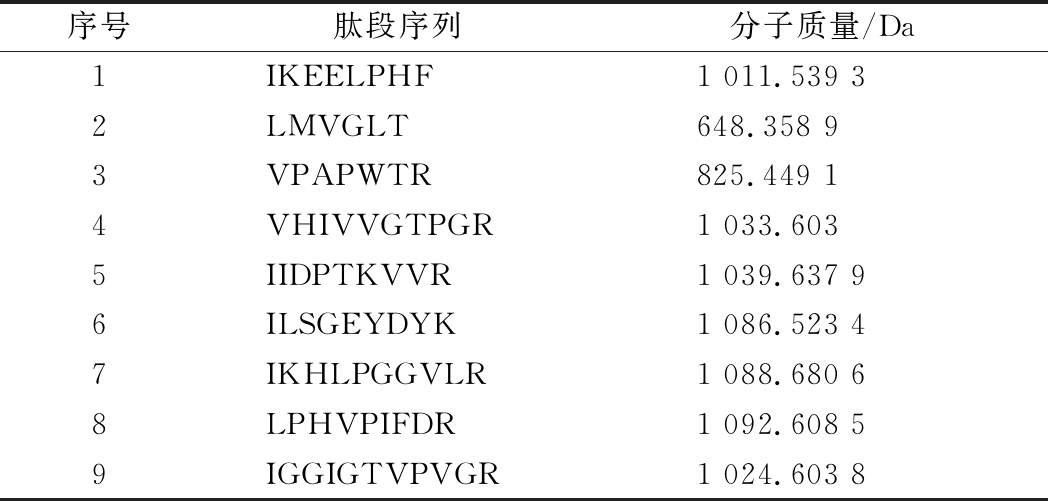
采用LC-MS/MS对蜂王幼虫发酵产物抗氧化活性最强组分F1进行分离鉴定,用MASCOT软件检索多肽数据库,比对得到9个可能的肽段,多肽序列结果如表6所示。这些肽均为六肽以上,最长为十一肽,分子质量在600~1 100 Da。多肽的抗氧化性与其氨基酸序列与组成存在构效关系,报道指出分子质量在500~1 800 Da的低聚肽的抗氧化性强于母体蛋白质和长链多肽[25]。此外,多肽的抗氧化活性很大程度上还取决于氨基酸的组成,依据氨基酸抗氧化活性的强弱可分为四类,强抗氧化活性氨基酸包括Tyr、Trp、Cys、Met和His,芳香族氨基酸Tyr和Trp是良好的氢供体从而捕获自由基,Cys和Met的侧链基团分别含有1个巯基,具有供电子和供氢的能力,His侧链上的咪唑基团是决定其抗氧化能力的关键因素[26]。中等抗氧化活性氨基酸包括Leu、Pro、Phe和Val,在多肽的N端存在疏水氨基酸,能提高多肽在脂质中的溶解性,促进肽与脂相中的自由基发挥作用[27];弱抗氧化活性氨基酸包括Asp和Glu,侧链基团可以螯合金属离子。其余7种氨基酸,抗氧化性微弱或没有抗氧化活性。
观察表6的结果,所鉴定的肽段都包含疏水性氨基酸(包括Pro、Ala、Val、Met、Ile、Leu、Tyr、Phe、Gly),其中7条多肽链含有至少1个强抗氧化氨基酸(Tyr、Trp、Cys、Met和His)。因此可推测蜂王幼虫多肽的抗氧化活性与这些短肽链关系密切。然而,为确定这些多肽链是否具有较强的抗氧化活性,需进一步研究探索。
表6 鉴定的可信度较高多肽序列
Table 6 Identified peptide sequences with high reliability
序号肽段序列分子质量/Da1IKEELPHF1 011.539 32LMVGLT648.358 93VPAPWTR825.449 14VHIVVGTPGR1 033.6035IIDPTKVVR1 039.637 96ILSGEYDYK1 086.523 47IKHLPGGVLR1 088.680 68LPHVPIFDR1 092.608 59IGGIGTVPVGR1 024.603 8
3 结论
通过单因素和响应面试验优化得到混菌发酵蜂王幼虫最佳工艺为枯草芽孢杆菌与黑曲霉的复配比为2.4∶1,接种量6.5%,发酵时间57.5 h,该条件下多肽得率为15.49%,发酵体系中酶活力为133.55 U/mL。蜂王幼虫粗多肽的抗氧化氨基酸达到58.11%,疏水氨基酸为47.2%,说明其具有很好的抗氧化潜力。经超滤分离后<1 kDa的组分F1相较于其他组分有更好的抗氧化活性,DPPH自由基清除率、ABTS阳离子自由基清除率的IC50值分别为(1.06±0.01)、(0.165±0.004) mg/mL,铁还原力OD700 = 0.389。通过LC-MS/MS对组分F1进行结构鉴定,筛选得到9肽段,分子质量在600~1 100 Da。研究结果为蜂王幼虫的高值化利用开发提供实验依据。
[1] 马仁公. 蜂王幼虫、工蜂幼虫和雄蜂蛹的新用途[J].中国蜂业, 2007, 58(5):32-33.
MA R G.Different uses of the honeybee queen brood, workerbee larva and drone pupa[J].Apiculture of China, 2007, 58(5):32-33.
[2] 贾歌. 蜂王幼虫蛋白质酶解物的制备及抗氧化活性的研究[D].西安:西北大学, 2014.
JIA G.Preparation and antioxidant activity of protein hydrolysate from queen bee larvae[D].Xi′an:Northwest University, 2014.
[3] 杨绍伟, 冯玄, 兰新强, 等.蜂蛹提取物对顺铂诱导小鼠肾损伤的保护作用试验[J].中国兽医杂志, 2020, 56(1):116-120;124;128.
YANG S W, FENG X, LAN X Q, et al.Protective effects of honeybee pupae extracts on cisplatin-induced kidney injury in mice[J].Chinese Journal of Veterinary Medicine, 2020, 56(1):116-120;124;128.
[4] 刘竹青, 李岩, 崔旋旋, 等.黄粉虫酶解物体内外抗氧化及免疫活性研究[J].中国食品学报, 2019, 19(5):45-50.
LIU Z Q, LI Y, CUI X X, et al.Studies on the antioxidant activity and immune function of Tenebrio molitor hydrolysate in vivo and in vitro[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(5):45-50.
[5] ZHANG Y, WANG J H, ZHU Z Y, et al.Identification and characterization of two novel antioxidant peptides from silkworm pupae protein hydrolysates[J].European Food Research and Technology, 2021, 247(2):343-352.
[6] KAUR A, KEHINDE B A, SHARMA P, et al.Recently isolated food-derived antihypertensive hydrolysates and peptides:A review[J].Food Chemistry, 2021, 346:128719.
[7] 刘潇, 郭丽娜, 马海乐, 等.枯草芽孢杆菌和黑曲霉固态发酵制备核桃多肽的工艺条件优化[J].现代食品科技, 2018, 34(8):130-137.
LIU X, GUO L N, MA H L, et al.Optimization of the process conditions of walnut meal peptides by solid state fermentation-Bacillus subtilis and Aspergillus niger[J].Modern Food Science and Technology, 2018, 34(8):130-137.
[8] MADA S B, UGWU C P, ABARSHI M M.Health promoting effects of food-derived bioactive peptides:A review[J].International Journal of Peptide Research and Therapeutics, 2020, 26(2):831-848.
[9] 徐萍. 蜂蛹多肽的制备、初步纯化及抗氧化活性研究[D].镇江:江苏大学, 2018.
XU P.Preparation, purification and antioxidant activity of bee pupa polypeptide[D].Zhenjiang:Jiangsu University, 2018.
[10] 涂宗财, 唐平平, 郑婷婷, 等.响应面优化鱼鳔胶原肽制备工艺及其抗氧化活性研究[J].食品与发酵工业, 2017, 43(5):160-166.
TU Z C, TANG P P, ZHENG T T, et al.Optimization of swimming bladder collagen peptide preparation using response surface methodology and its antioxidant activity research[J].Food and Fermentation Industries, 2017, 43(5):160-166.
[11] 白海娜, 王振宇, 刘瑞海, 等.白藜芦醇与黑木耳多糖协同清除ABTS自由基活性的研究[J].现代食品科技, 2014, 30(3):64-68.
BAI H N, WANG Z Y, LIU R H, et al.Synergistic ABTS radical scavenging activity of resveratrol with Auricularia auricular polysaccharides[J].Modern Food Science and Technology, 2014, 30(3):64-68.
[12] LASSOUED I, MORA L, NASRI R, et al.Characterization, antioxidative and ACE inhibitory properties of hydrolysates obtained from thornback ray (Raja clavata) muscle[J].Journal of Proteomics, 2015, 128:458-468.
[13] 高威芳, 何魁芳, 朱鹏, 等.活性多肽序列结构分析鉴定技术的研究进展[J].生物技术, 2016, 26(2):199-204.
GAO W F, HE K F, ZHU P, et al.Recent advances in the technologies progress of bioactive polypeptides identification[J].Biotechnology, 2016, 26(2):199-204.
[14] 张树华. 发酵法制备绿豆多肽[D].济南:齐鲁工业大学, 2014.
ZHANG S H.Study on mung bean peptides prepared by fermentation[D].Jinan:Qilu University of Technology, 2014.
[15] 盖梦. 液态发酵法制备燕麦ACE抑制肽的研究[D].呼和浩特:内蒙古农业大学, 2014.
GAI M.Study on producing ACE inhibitory peptides from oat by liquid-state fermentation[D].Hohhot:Inner Mongolia Agricultural University, 2014.
[16] 兰光群. 混菌发酵对纳豆感官特性的影响及功能性研究[D].贵阳:贵州大学, 2020.
LAN G Q.Effects of mixed fermentation on sensory characteristics and functional properties of natto[D].Guiyang:Guizhou University, 2020.
[17] 尹乐斌, 周娟, 何平, 等.乳酸菌发酵豆清液制备多肽及其体外抗氧化活性研究[J].食品与发酵工业, 2020, 46(11):131-137.
YIN L B, ZHOU J, HE P, et al.Preparation of peptide from soybean processing waste water by lactic acid bacteria fermentation and its antioxidant activity in vitro[J].Food and Fermentation Industries, 2020, 46(11):131-137.
[18] KARAMI Z, AKBARI-ADERGANI B.Bioactive food derived peptides:A review on correlation between structure of bioactive peptides and their functional properties[J].Journal of Food Science and Technology, 2019, 56(2):535-547.
[19] 胡廷, 青维, 李美凤, 等.大鲵多肽体外抗氧化活性研究[J].食品科技, 2018, 43(6):254-259.
HU T, QING W, LI M F, et al.The antioxidant activity of Andrias davidianus polypeptide in vitro[J].Food Science and Technology, 2018, 43(6):254-259.
[20] 季晓彤. 桃仁抗氧化肽的制备及其抗氧化作用的研究[D].无锡:江南大学, 2018.
JI X T.Study on preparation of peach seed antioxidant peptides and their antioxidant effect[D].Wuxi:Jiangnan University, 2018.
[21] 徐杰, 林泽安, 李子青, 等.响应面法优化珍珠龙胆石斑鱼肉肽的酶法制备工艺及酶解产物的抗氧化活性[J].食品工业科技, 2020, 41(19):205-211;239.
XU J, LIN Z A, LI Z Q, et al.Optimization of enzymatic preparation process of peptides from pearl gentian grouper by response surface methodology and the antioxidant activity of the enzymatic hydrolysis products[J].Science and Technology of Food Industry, 2020, 41(19):205-211;239.
[22] 冯晓文, 赵晓涵, 潘骁琦, 等.海洋鱼蛋白低聚肽结构和抗氧化活性的体外消化稳定性[J].现代食品科技, 2021, 37(5):109-116.
FENG X W, ZHAO X H, PAN X Q, et al.In Vitro digestion stability of structure and antioxidant activity of marine fish protein oligopeptides[J].Modern Food Science and Technology, 2021, 37(5):109-116.
[23] SAHAN Y, GURBUZ O, GULDAS M, et al.Phenolics, antioxidant capacity and bioaccessibility of chicory varieties (Cichorium spp.) grown in Turkey[J].Food Chemistry, 2017, 217:483-489.
[24] 陈敏. 虎斑乌贼生殖腺多肽的制备、纯化及其抗氧化活性的研究[D].广州:华南理工大学, 2019.
CHEN M.Study on the preparation, purification and antioxidant activity of peptides from cuttlefish (Sepia pharaonis) gonads[D].Guangzhou:South China University of Technology, 2019.
[25] 瞿杰. 牡丹籽油脂的理化性质研究及抗氧化肽的分离鉴定[D].合肥:合肥工业大学, 2017.
QU J.Physicochemical properties of peony seed oil and isolation and identification of antioxidant peptide[D].Hefei:Hefei University of Technology, 2017.
[26] 朱敏方. 草鱼鱼肉抗氧化肽的制备、分离鉴定及其活性研究[D].南昌:江西师范大学, 2020.
ZHU M F.Preparation, isolation, identification and activity of antioxidant peptides from grass carp (Ctenopharyngodon Idella) muscle[D].Nanchang:Jiangxi Normal University, 2020.
[27] 赵谋明, 邹颖, 林恋竹, 等.纳豆菌液态发酵荞麦产物中抗氧化活性物质的分离鉴定[J].食品科学, 2019, 40(13):60-67.
ZHAO M M, ZOU Y, LIN L Z, et al.Identification of antioxidants produced by Bacillus subtilis natto in liquid-state fermentation of buckwheat[J].Food Science, 2019, 40(13):60-67.