鲜切果蔬作为一种经清洗、去皮、切割后包装,具有新鲜果蔬品质的方便果蔬产品[1],备受人们喜爱。甘蔗多汁味甘、风味醇厚,富含多种矿物质、维生素等营养物质,而且具有消痰止咳、除胸烦热、解酒毒、止呕哕等功效[2]。鲜切甘蔗可打破因茎长携带不便,送礼不雅观,现场去皮切段影响城市卫生环境等因素所致的销售限制,但切割后的甘蔗受到机械损伤,会引发一系列生理生化反应,导致3 d左右即会出现干燥、变色等质量下降现象,因此采用有效的保鲜技术来保护鲜切甘蔗的贮藏品质至为关键。
据报道,将紫外线尤其是200~280 nm的短波紫外线(UV-C)用于鲜切苹果[3]、甜瓜[4]、萝卜[5]、莴苣[6]、蘑菇[7]、菠菜[8]等果蔬的保鲜研究发现,其可通过损伤微生物遗传物质而有效抑制微生物的繁殖,也可通过对细胞膜通透性改变促进细胞内容物溶出,且具有有效抑制酶活性的作用;壳聚糖涂膜(chitosan coating,CH-C)具有较好的成膜性和一定杀菌作用,可一定程度上减少氧气与鲜切果蔬组织的接触,从而抑制酶促褐变和微生物繁殖,在草莓[9]、香芋[10]、果蔗[11]等抑制微生物和酶促褐变等方面具较好效果。二者的保鲜作用机理不同,效果也有差异。近几年对复合保鲜技术应用于果蔬保鲜的研究也有较多报道,如肉桂油复合涂膜对鲜切菠萝蜜果苞保鲜效果[12]、CH-C与牛至精油复配对鲜切菠萝的保鲜效果[13]、壳聚糖复合UV-C对鲜切淮山的保鲜效果[14]等的研究发现,复合技术的保鲜效果均显著优于单一处理。目前已有壳聚糖、乙醇、抗菌包装材料等保鲜技术单一应用于鲜切甘蔗保鲜效果的研究,本研究将UV-C保鲜技术复合15 g/L CH-C处理应用于鲜切甘蔗贮藏保鲜中,并以未处理和单一处理做对照,分析其协同保鲜效果,以期为鲜切甘蔗及其他果蔬的有效贮藏提供一定的参考。
1 材料与方法
1.1 材料与试剂
甘蔗,淮南市水果批发市场;壳聚糖(脱乙酰度95%),食品级,山东陆海蓝圣生物科技有限公司;牛肉膏、蛋白胨、琼脂粉、葡萄糖、氢氧化钠、邻苯二酚、磷酸氢二钠、磷酸二氢钠、愈创木酚、三氯乙酸、硫代巴比妥酸等(均为分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
JYZ-E3C九阳多功能榨汁机,九阳股份有限公司;DZ-260真空包装机,东莞樟木头佳威机械厂;PHSJ-3F pH计,长沙科怡仪器有限公司;T5系列UVC紫外线灯管,南京华强电子有限公司;GL-21M冷冻离心机,湖南湘立科学仪器有限公司;T6系列紫外可见分光光度计,北京普析通用仪器有限公司。
1.3 实验方法
1.3.1 鲜切甘蔗的制备
制备流程如下:
甘蔗→去梢、去根→清水清洗→去皮、切段(约10 cm)
1.3.2 鲜切甘蔗保鲜处理
将鲜切甘蔗随机分成4组:(1)UV-C照射处理(以下简称UV-C):UV-C灯管安装于超净工作台,鲜切甘蔗置于距30 cm处照射15 min,翻转,另一面继续照射15 min;(2)15 g/L CH-C处理(以下简称CH-C):鲜切甘蔗置于配制好的壳聚糖溶液(1 000 mL蒸馏水中+15 g壳聚糖+10 g抗坏血酸+10 g柠檬酸+15 mL甘油)中浸没3 min后,置于超净工作台内,沥水晾干;(3)UV-C协同15 g/L CH-C处理(以下简称UV-C+CH-C):鲜切甘蔗依次按(1)和(2)处理;(4)空白对照组(以下简称CK):鲜切甘蔗不做处理。以上各组样品均用聚乙烯袋真空包装后,置于4 ℃冰箱保藏,分别于第0、6、12、18、24、30天进行相关指标检测。以上每个处理重复3次。
1.3.3 各指标测定方法
pH值:pH计法;可溶性固形物(soluble solids content,SSC):手持式折光仪法;褐变度:参照尹琳琳等[15]一级反应动力学法;菌落总数(total bacteria count,TBC)和霉菌酵母菌数(mold and yeast count,MYC):GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》和GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》;总酚含量:采用福林-酚比色法[16];丙二醛(malondialdehyde,MDA)含量:硫代巴比妥酸法[17];多酚氧化酶(polyphenol oxidase,PPO)和过氧化物酶(peroxidase,POD)活性:邻苯二酚法和愈创木酚法[17],酶活力以1 min 吸光度增加0.01为一个活力单位U/(min·g)。
1.3.4 数据处理与分析
采用Microcal Origin 8.6软件制图,SPSS进行显著性分析,显著性水平取0.05,即 P<0.05时,差异显著。每个样品重复3次,数据以平均值±标准差表示。
2 结果与分析
2.1 UV-C和CH-C处理鲜切甘蔗冷藏期间pH值的变化
酸度是影响果蔬风味的重要因素,赋予了果蔬特殊的口感。pH值是评价食品酸度的重要指标,其数值变化程度可反映食品酸度的稳定性[18]。由图1可看出,新鲜甘蔗的pH值为5.51,CK组在冷藏初期即显著降低(P<0.05),6 d后无显著变化,可能与鲜切甘蔗贮藏中失水、微生物大量繁殖产酸、酒精发酵有关。UV-C组在第0天及冷藏期间,比CH-C组降低幅度明显,这可能与前人研究发现的UV-C可促使果蔬中部分有机酸及衍生物含量增加的作用有关[19]。UV-C+CH-C处理组甘蔗的pH值在贮藏至30 d时仍保持在5.15,无显著变化(P>0.05),说明本处理组对鲜切甘蔗冷藏期间酸度稳定性的保持效果显著优于二者单独处理。
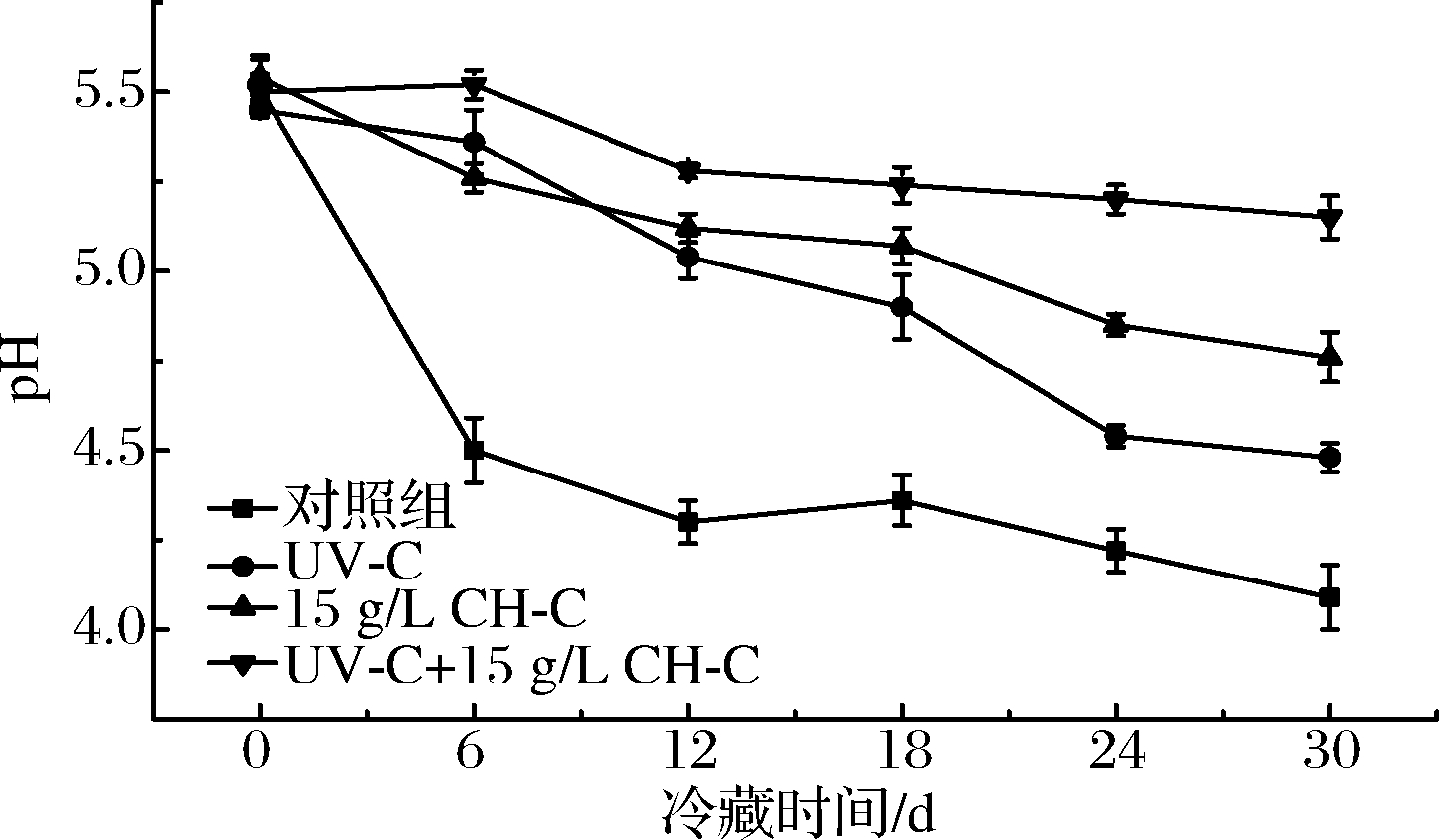
图1 UV-C和CH-C处理鲜切甘蔗冷藏期间pH值变化
Fig.1 pH changes of fresh-cut sugarcane treated by UV-C and CH-C during cold storage
2.2 UV-C和CH-C处理鲜切甘蔗冷藏期间SSC的变化
SSC是指果蔬中所有能溶于水的糖、矿物质、蛋白质和维生素等物质的总称,是反映果蔬品质的重要指标之一。由图2可知,在0~12 d期间,所有处理组SSC均无显著降低现象,且UV-C与UV-C+CH-C组出现增加,这可能由于:(1)CK组中同时存在不溶性大分子物质降解溶出和可溶性物质的消耗,致使此期间可检测SSC较稳定,不能说明其品质稳定;(2)CH-C组SSC无显著变化,可能是由于CH-C的保鲜效果,减缓了物质分解和消耗所致;(3)UV-C和UV-C+CH-C组均出现SSC增加现象,可能是由于紫外线短波照射促进了物质的溶出,这与黄镜如[5]对研究UV-C对鲜切萝卜在贮藏期间SSC的影响规律一致。随着贮藏时间的延长,CK组、UV-C组和CH-C组SSC含量均出现显著降低(P<0.05),其中CK组降低幅度显著大于后两者。在0~24 d,UV-C+CH-C处理组鲜切甘蔗的SSC含量均无显著变化(P>0.05),在冷藏至30 d时与0 d相比降低了11.4%。整体来看,UV-C+CH-C组鲜切甘蔗的SSC值稳定性最好。

图2 UV-C和CH-C处理鲜切甘蔗冷藏期间SSC值变化
Fig.2 SSC changes of fresh-cut sugarcane treated by UV-C and CH-C during cold storage
2.3 UV-C和CH-C处理鲜切甘蔗冷藏期间褐变度的变化
切面褐变是鲜切果蔬在加工和销售过程中的发生的主要品质问题,采用一级动力学方程拟合,以拟合曲线的相关系数R2判断拟合度,以常数K反映变化速率来评价鲜切甘蔗的褐变情况[15],可以更为直观地分析其在贮藏期间与新鲜甘蔗相比所发生褐变的程度和变化速度。由表1可知,各处理组褐变度曲线的R2均在0.85以上,符合以此来分析鲜切甘蔗褐变规律的要求。图3显示,各处理组鲜切甘蔗的褐变度在贮藏期间均呈现增大的趋势,且CK组K值最大,褐变速度最快。CH-C组与UV-C组相比,褐变速度减缓,胡位荣等[10]认为壳聚糖薄膜使鲜切香芋表面的O2浓度维持在较低水平,减轻了褐变程度;UV-C可有效抑制相关褐变酶活性,但效果不够理想。UV-C+CH-C组鲜切甘蔗在30 d冷藏期间褐变速度K值为0.006 3,小于单一处理组,说明二者协同可显著减缓鲜切甘蔗的褐变现象。
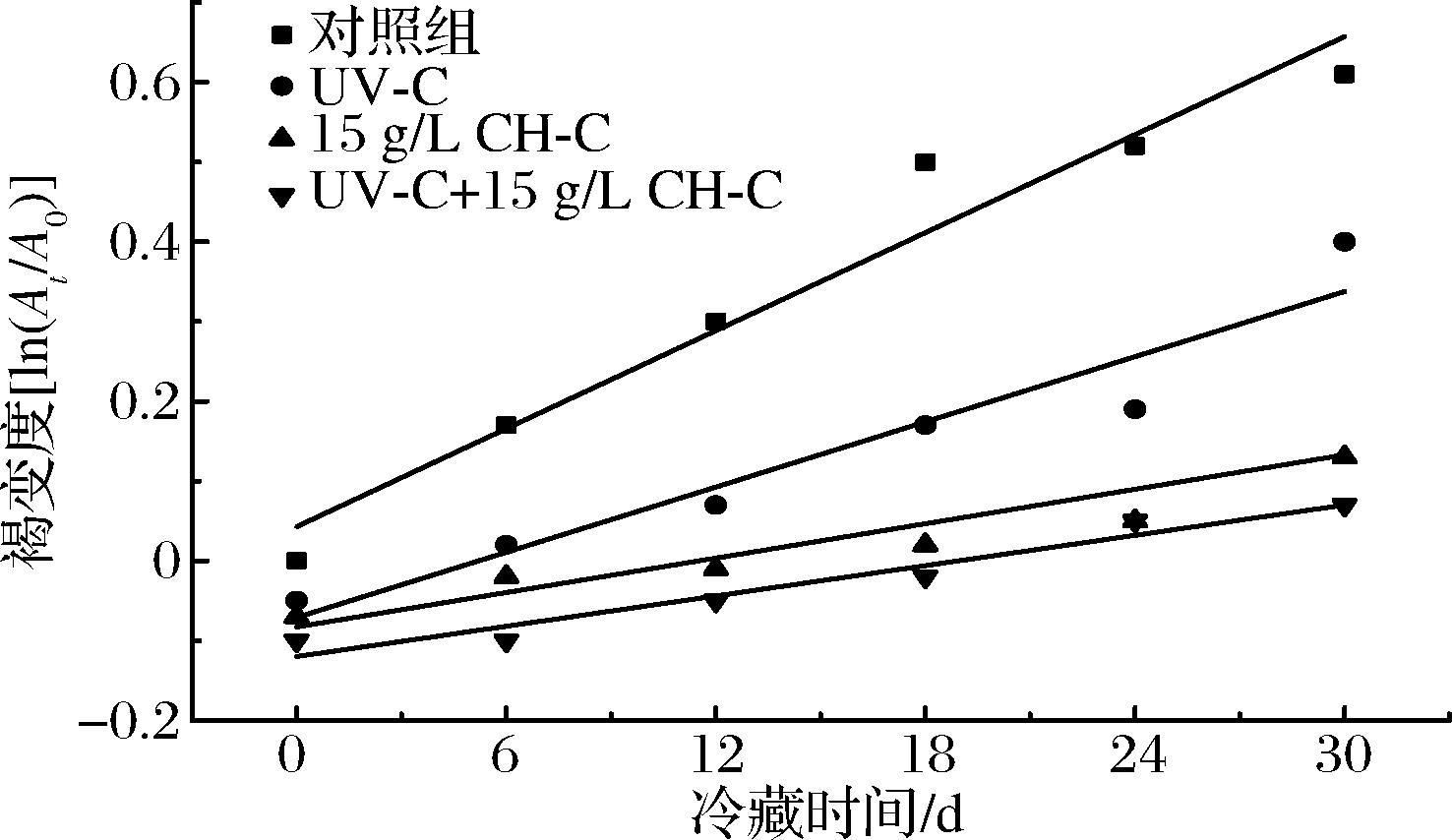
图3 UV-C和CH-C处理鲜切甘蔗冷藏期间褐变度ln(At/A0)变化
Fig.3 Browning degree ln(At/A0) changes of fresh-cut sugarcane treated by UV-C and CH-C during cold storage
表1 UV-C和CH-C处理鲜切甘蔗冷藏期间褐变速度参数
Table 1 Parameters of browning speed of fresh-cut sugarcane treated by UV-C and CH-C during cold storage
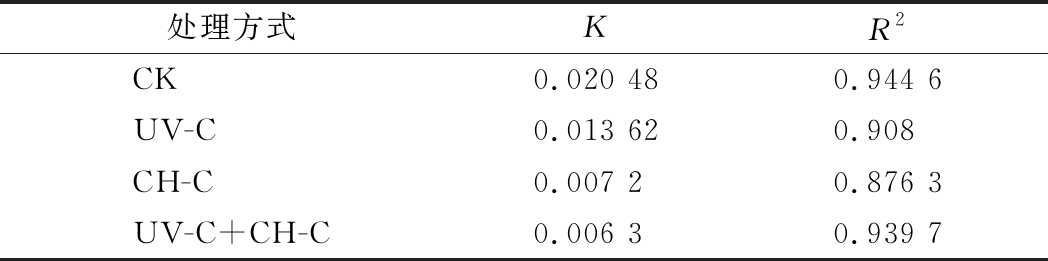
处理方式KR2CK0.020 480.944 6UV-C 0.013 620.908CH-C0.007 20.876 3UV-C+CH-C0.006 30.939 7
2.4 UV-C和CH-C处理鲜切甘蔗冷藏期间TBC和MYC变化
微生物增殖是导致鲜切食品腐败的根本原因,通过检测贮藏期间的微生物数量可判断鲜切甘蔗的卫生品质变化。由图4可知,在0~24 d,CK组鲜切甘蔗的TBC急剧增加(P<0.05),此后出现显著下降,这是由于CK组鲜切甘蔗在贮藏后期已严重腐败,发生产酸、乙醇等代谢物的积累,致使大量微生物被抑制或致死所致,这与大东[20]研究的乙醇处理鲜切甘蔗在贮藏期间TBC的变化规律一致。UV-C和CH-C组TBC在0~24 d的增长速度显著低于CK组(P<0.05),说明两者均在一定程度上抑制了微生物的增殖,与UV-C具有损伤微生物遗传物质的能力以及壳聚糖可形成涂膜,减少微生物的侵入作用有关,而CH-C组在冷藏后期抑制微生物生长的作用显著减弱。UV-C与CH-C+CH-C组冷藏期间TBC增长均不显著(P>0.05),说明UV-C 与二者协同处理对TBC抑制效果均较好,且协同处理组效果更佳。
由图5可知,鲜切甘蔗MYC的变化规律与TBC相近,即CK组呈现先增加后降低的趋势,其他处理组均呈逐步增加现象,其中UV-C+CH-C组抑制效果最佳。本研究中CH-C+CH-C处理鲜切甘蔗在冷藏至30 d时TBC和MYC低于6 lgCFU/g,仍在微生物安全范围内。

图4 UV-C和CH-C处理鲜切甘蔗冷藏期间TBC变化
Fig.4 TBC changes of fresh-cut sugarcane treated by UV-C and CH-C during cold storage
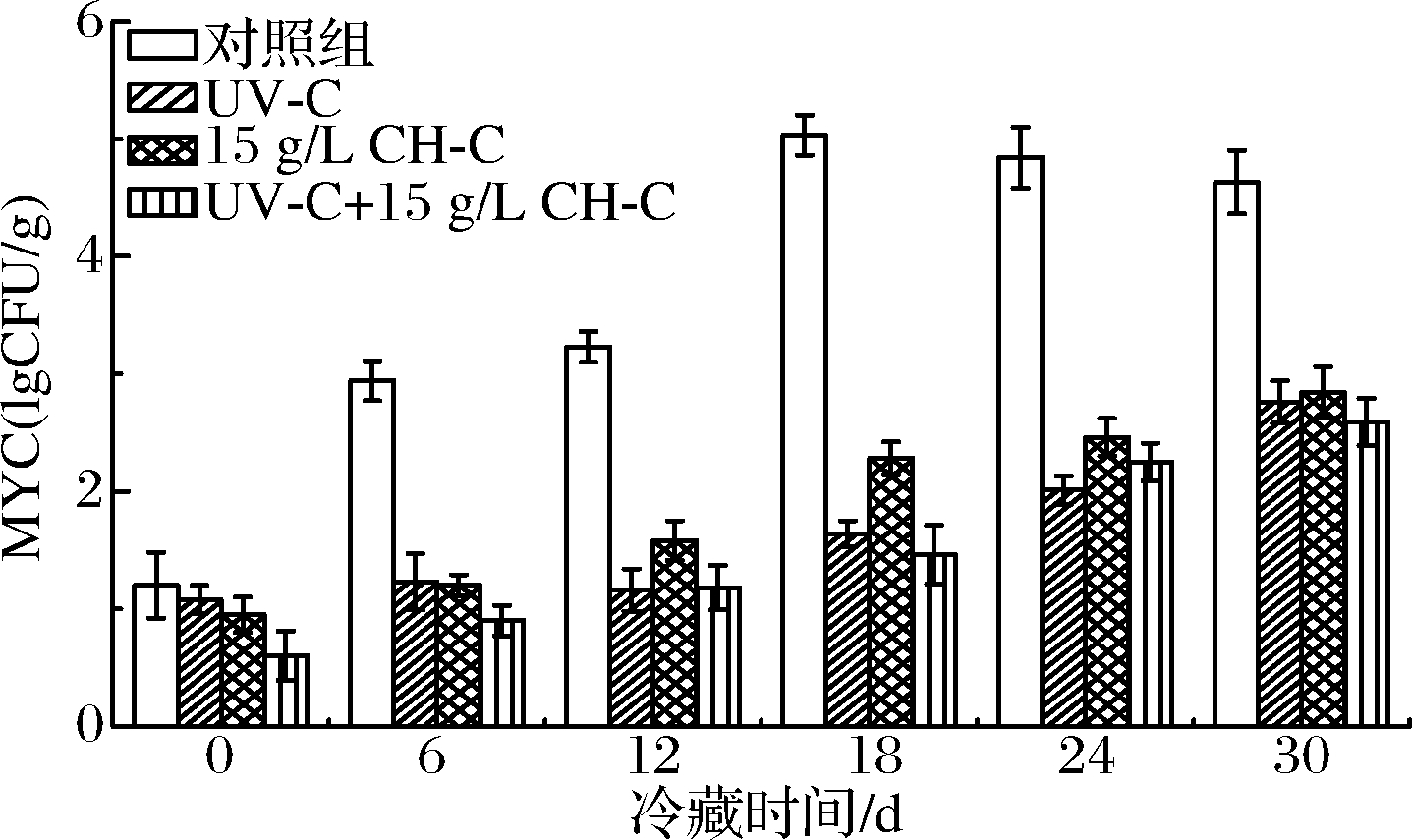
图5 UV-C和CH-C处理鲜切甘蔗冷藏期间MYC变化
Fig.5 MYC changes of fresh-cut sugarcane treated by
UV-C and CH-C during cold storage
2.5 UV-C和CH-C处理鲜切甘蔗冷藏期间总酚含量的变化
酚类物质是酶促褐变的底物,是果蔬食品中含量较高的次生代谢产物,具有多种生理功能[21]。图6 为在线性回归方程y=1.701 8x+0.000 6(R2=0.998)基础上,计算得到的鲜切甘蔗在冷藏期间总酚含量变化规律图。第0天(鲜切甘蔗经处理前后未贮藏)时,与CK组相比,UV-C和CH-C+CH-C组总酚含量显著增加。随着贮藏时间的延长各组均呈现先增加后降低的趋势,CK组在第18天时总酚含量增加了82.7%,UV-C组增加了33.8%,在18 d后又出现了显著下降(P<0.05),这可能是由于鲜切处理及UV-C在贮藏前期对果蔬中的酚类物质的形成有一定诱导作用[22],在贮藏后期出现降低,可能是由于酚类物质被氧化或被微生物繁殖产酸抑制。这与研究者在对鲜切淮山和乙醇处理鲜切甘蔗在贮藏中总酚类物质的变化规律相近[14,20]。在6~30 d冷藏期间,CH-C和UV-C+CH-C组总酚含量也呈先增后降的趋势,但均无显著变化(P>0.05),因酚类物质与褐变密切相关,因此两处理方式均对鲜切甘蔗在贮藏期间褐变的加深有较好的抑制效果。
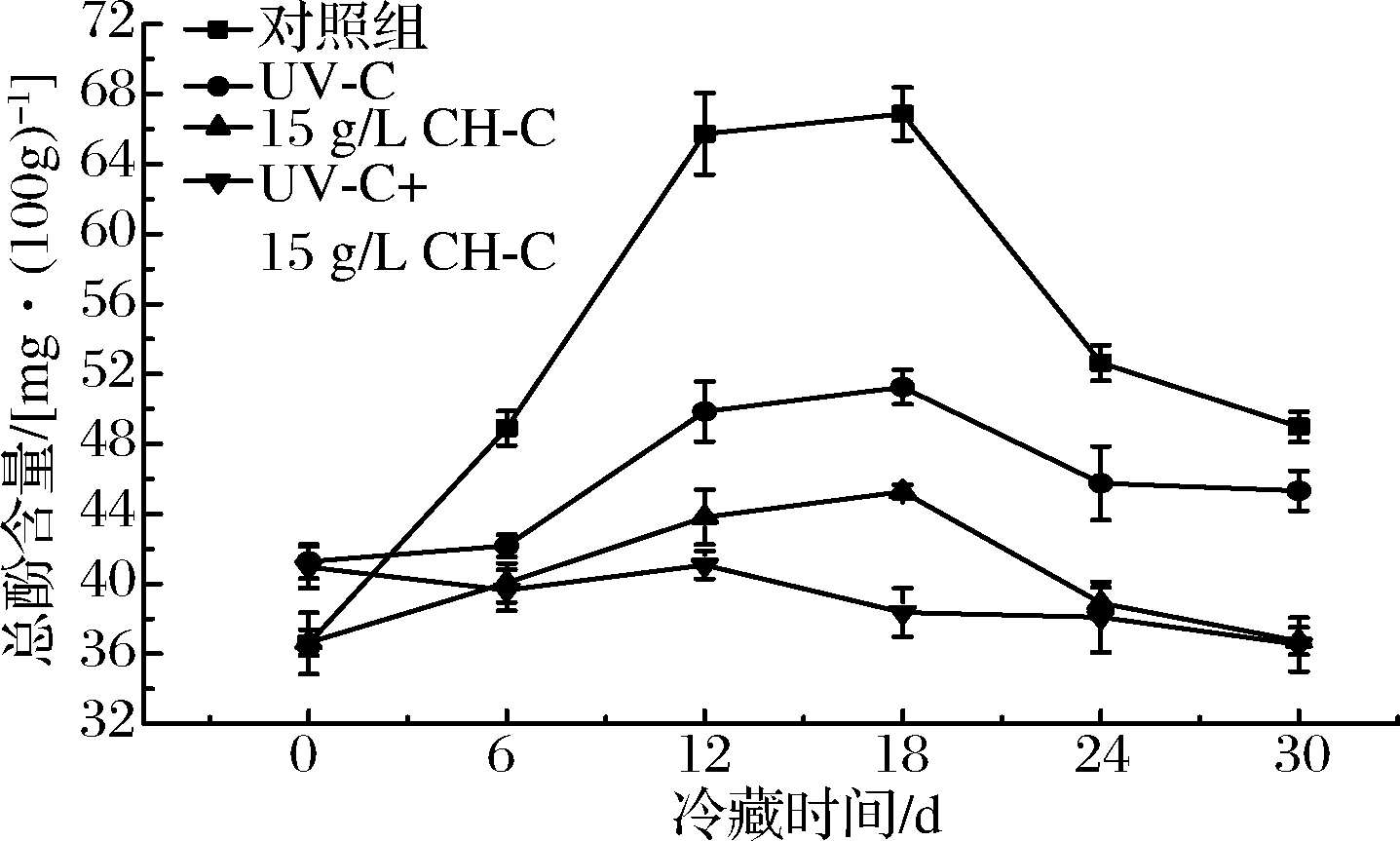
图6 UV-C和CH-C处理鲜切甘蔗冷藏期间总酚含量变化
Fig.6 Total phenol content changes of fresh-cut sugarcane treated by UV-C and CH-C during cold storage
2.6 UV-CH和CH-C处理鲜切甘蔗冷藏期间MDA含量的变化
果蔬组织在衰老过程中,会因细胞膜的过氧化作用产生脂质自由基,使膜脂质进一步氧化,细胞严重受损,MDA是膜脂质过氧化的主要产物[23],因此其可作为衡量鲜切果蔬细胞被氧化的重要指标。由图7可知,鲜切甘蔗经处理前后在贮藏期间MDA含量均呈现增加趋势,其中CK组随着贮藏时间的延长呈线性增加。CH-C组与CK组相比增速显著减缓,但也呈现出显著增加的现象(P<0.05),尤其在24 d后增速加快。UV-C组在0~24 d内无显著变化(P>0.05),UV-C+CH-C组在0~30 d贮藏期间MDA含量均无显著增加(P>0.05)。因此,UV-C和UV-C+CH-C能够有效抑制MDA含量的增加,结合本研究中总酚含量变化,推测该处理方式可促进酚类物质等抗氧化物质的生成,对细胞膜过氧化有一定的保护作用,从而延缓了鲜切甘蔗的氧化老化,延长了保藏期。
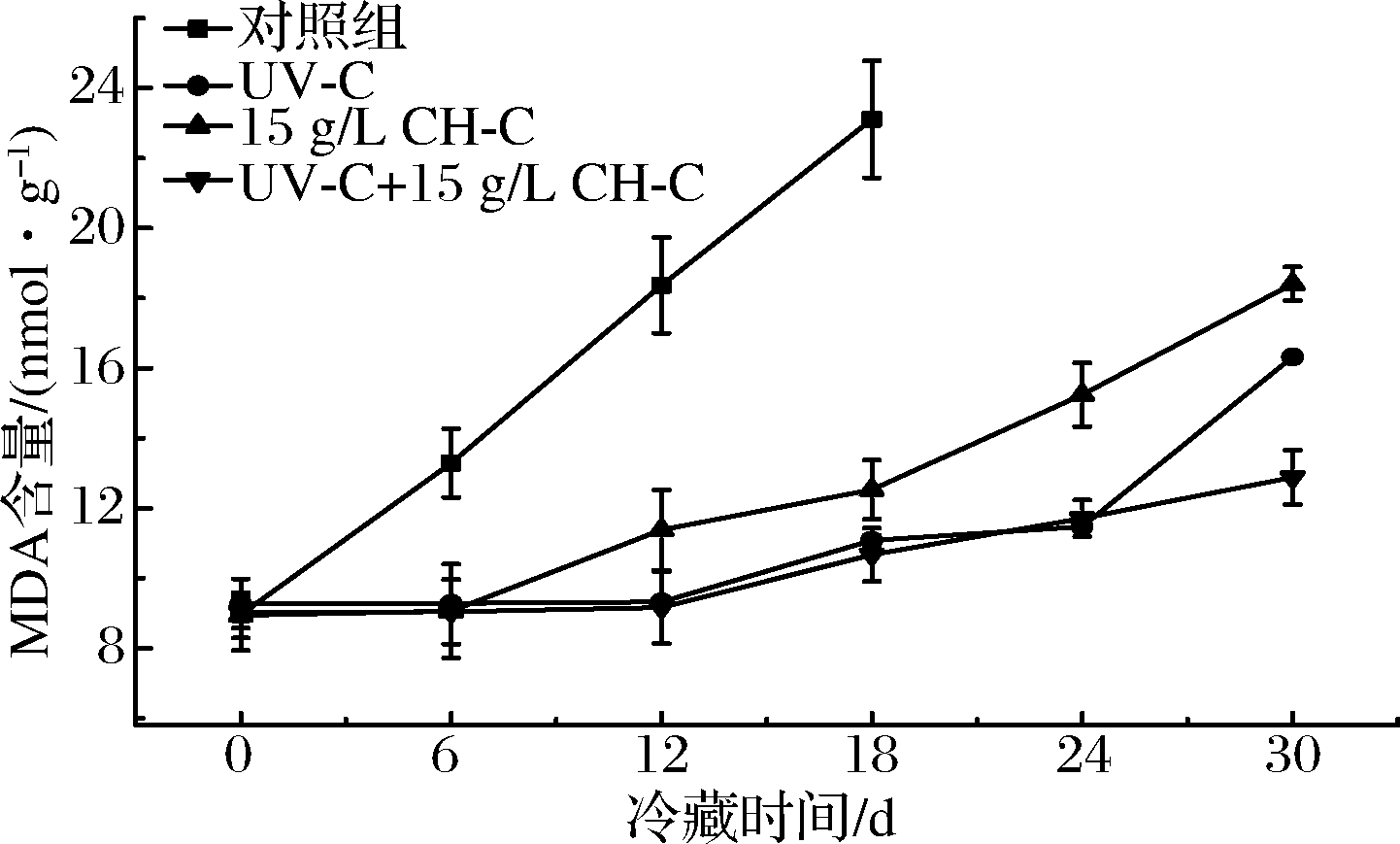
图7 UV-C和CH-C处理鲜切甘蔗冷藏期间MDA含量变化
Fig.7 MDA content changes of fresh-cut sugarcane treated by UV-C andCH-C during cold storage
2.7 UV-C和CH-C处理鲜切甘蔗冷藏期间PPO活性的变化
PPO能催化果蔬中多酚类物质氧化形成醌类物质,并进一步聚合产生深褐色或棕黑色沉淀物[24],即褐变反应。由图8可知,鲜切甘蔗的PPO活性均呈先升高后降低的趋势,其中CK组变化最为显著,这可能由于冷藏前期(0~12 d)甘蔗经鲜切处理后,与氧气接触和酚类物质增加,而后期因总酚物质的消耗和微生物代谢产物的积累致使PPO活性下降。这与对鲜切淮山、菠萝、马铃薯的PPO活性研究规律一致[13-14,24],而也有研究发现鲜切果蔬如鲜切茄子的PPO活性在贮藏期间呈单一下降趋势以及鲜切甘薯、香芋PPO活性呈单一上升趋势[25],可能与鲜切果蔬种类不同,其鲜切伤害应激反应机制不同有关。CH-C 组在0~12 d期间的增加程度虽低于CK组,但也增加了72%,说明其对抑制鲜切甘蔗PPO活性效果较差。而UV-C与UV-C+CH-C组PPO活性在贮藏期间被有效抑制,无显著增加(P>0.05),但结合褐变度结果,UV-C组鲜切甘蔗颜色变化较CH-C组更为明显,这可能由于后者更好地隔离了氧气,即使PPO活性较高,但褐变反应仍能被较好地控制。仅考虑酶活性抑制效果,UV-C与UV-C+CH-C效果均较好,后者最为理想。
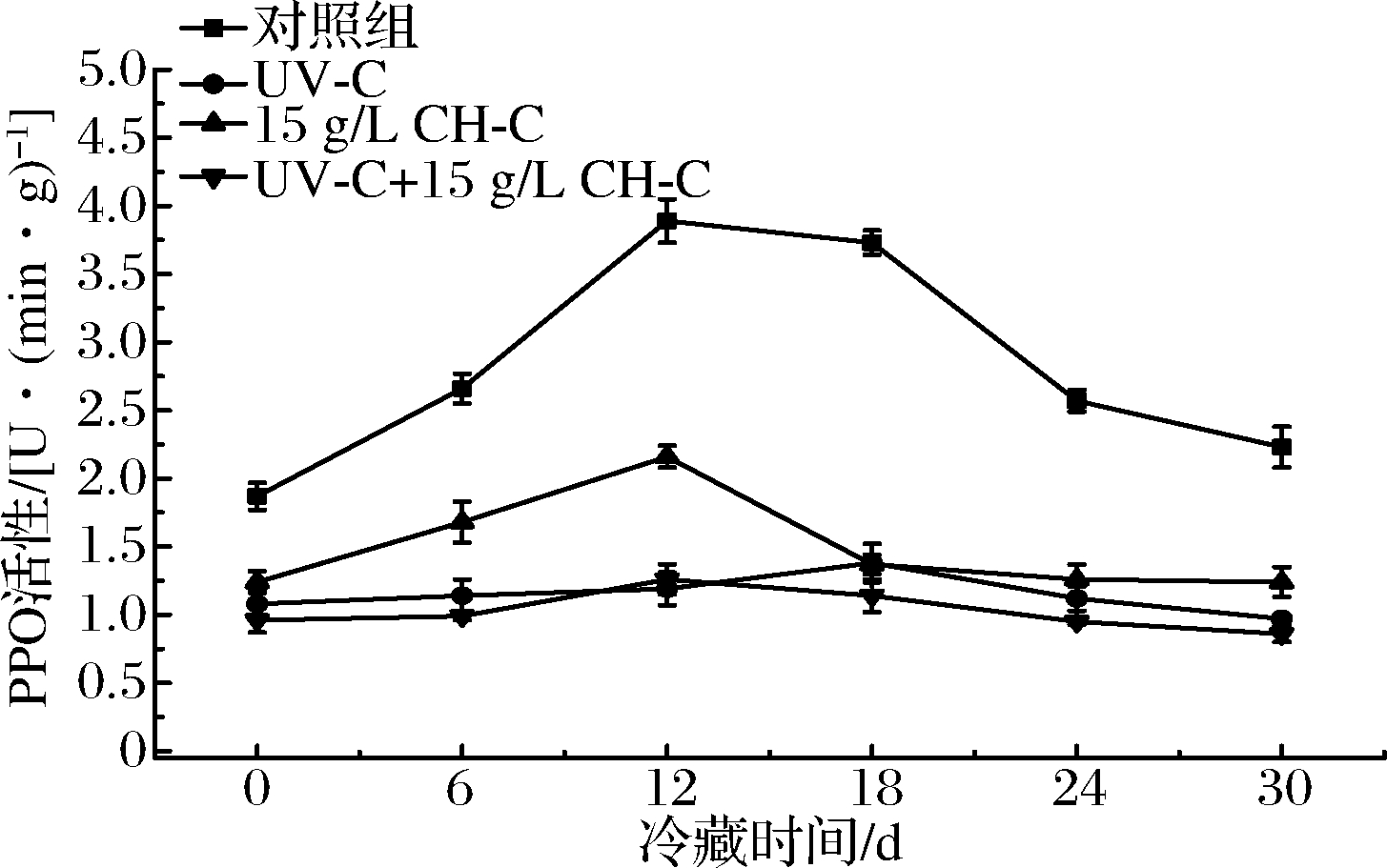
图8 UV-C和CH-C处理鲜切甘蔗冷藏期间PPO变化
Fig.8 PPO activity changes of fresh-cut sugarcane treated by UV-C and CH-C during cold storage
2.8 UV-C和CH-C处理鲜切甘蔗冷藏期间POD活性的变化
POD一般在果蔬的老化组织中活性较高,其可以利用过氧化氢释放出氧气,促进酶促褐变,因此POD在鲜切果蔬组织中具有增强褐变的作用[26]。由图9可知,0~24 d各组POD活性均呈增加趋势,24 d后出现下降,其中CK组有明显峰值,说明甘蔗经鲜切处理后出现了氧化应激,导致POD活性升高,而在冷藏后期急剧下降可能是由于甘蔗样品腐败变质,理化性质显著变化抑制了POD活性。UV-C、CH-C和UV-C+CH-C组变化较CK组较平缓,尤其是二者协同处理组在整个贮藏期间变化不显著(P>0.05),说明UV-C+CH-C有效抑制了鲜切甘蔗的氧化应激效应,也延缓了其褐变、氧化等品质变化。
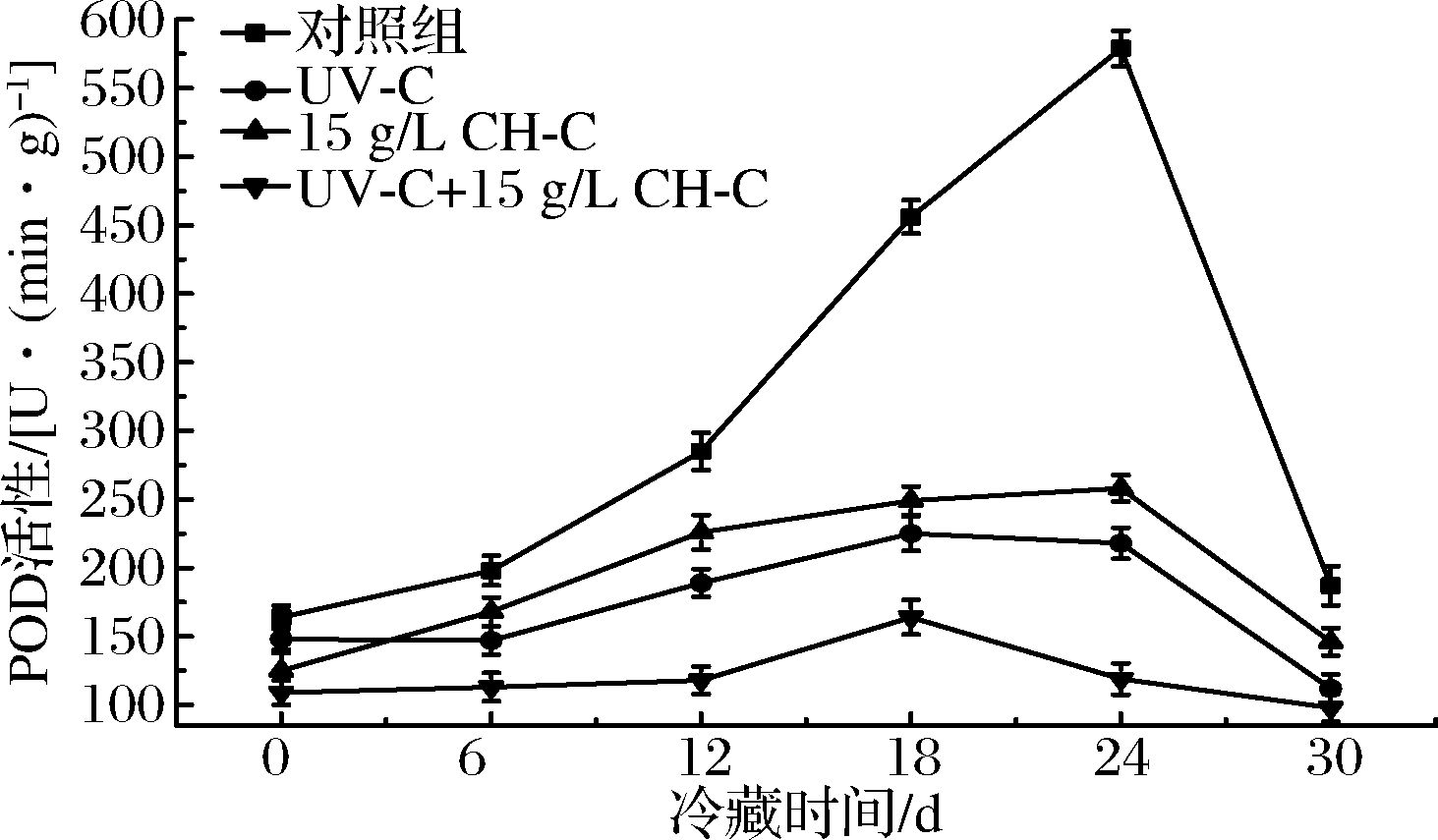
图9 UV-C和CH-C处理鲜切甘蔗冷藏期间POD变化
Fig.9 POD activity changes of fresh-cut sugarcane treated by UV-C and CH-C during cold storage
2.9 UV-C和CH-C处理鲜切甘蔗冷藏期间感官品质的变化
由表2可以看出,CK组鲜切甘蔗在冷藏过程中很快出现切面干燥,6 d时外观有褐变现象,呈弱酸味。经UV-C和CH-C单独或协同处理后,冷藏鲜切甘蔗的感官稳定性显著提升,18 d内外观均无明显变化,UV-C组的轻微弱酸味,此时对口感影响不大。24 d时UV-C和CH-C单独处理组出现外观变黄,有明显酸味和胀袋现象,这与其主要理化指标pH值、SSC、褐变度、微生物增殖情况有关。UV-C+CH-C组在冷藏至30 d时,外观无明显变化,无特殊异味,切面有轻微干燥,袋中有少量水汽,感官品质无明显降低,说明UV-C和CH-C协同处理可更好地保持鲜切甘蔗的冷藏品质,使其感官稳定性显著增加。因此,以感官品质、微生物指标、褐变度和pH值来看,与CK组相比,CH-C、UV-C和UV-C+CH-C处理可使真空包装鲜切甘蔗在4 ℃条件下,保藏期从6 d分别延长至18、18和30 d。
表2 UV-C和CH-C处理鲜切甘蔗冷藏期间感官变化
Table 2 Sensory changes of fresh-cut sugarcane treated by UV-C and CH-C during cold storage

处理方式贮藏时间0 d6 d12 d18 d24 d30 d对照组新鲜切面干燥、外观变黄,有弱酸味袋中有水珠,散发酸味、弱酒精味胀袋、严重酒精味 — —UV-C 新鲜外观无明显变化外观无明显变化外观无明显变化,有轻微弱酸味外观略黄,少量水汽,有弱酸味外观明显变黄,袋中有水珠,有酒精味15 g/L CH-C新鲜外观无明显变化外观无明显变化外观无明显变化,袋中有水汽切面干燥,轻微胀袋、有酸味和弱酒精味外观变黄,胀袋严重、重酒精味UV-C+15 g/L CH-C新鲜外观无明显变化外观无明显变化外观无明显变化外观无明显变化外观无明显变化,切面略干,袋中略有水汽
注:-表示无数据
3 结论
在4 ℃冷藏期间,甘蔗经鲜切处理后若不经保鲜处理(CK组),其pH值和SSC显著下降,PPO与POD活性和总酚物质快速增加,褐变速度急剧加大,微生物数量(TBC和MYC)增长速度快、MDA直线升高;分别经UV-C与CH-C单一和协同处理后,各项指标劣变程度均有改善,其中UV-C组pH值在12 d时显著下降、SSC在18 d时降低明显、褐变速度显著低于CK组但高于其他处理组、TBC和MYC在0~20 d内显著低于CK组与CH-C组、总酚含量在高于CK组和CH-C组、MDA值在0~24 d内增加较慢,24~30 d 显著升高、PPO和POD活性呈先增后降的趋势,变化不显著;CH-C组与UV-C组相比,褐变度抑制有较明显优势、总酚含量显著偏低、MDA值、PPO和POD活性显著偏高、pH值和SSC差异不显著;UV-C+CH-C组在0~30 d各项指标的稳定性均高于单一处理,说明二者协同比单一处理更适合于鲜切甘蔗的保鲜和贮藏,且以感官品质、微生物指标、褐变度和pH值来看,其可使真空包装鲜切甘蔗的冷藏保质期从6 d延长至30 d。
壳聚糖因具有良好的成膜性,可在果蔬表面形成一层阻氧层,从而抑制酶促褐变、延缓果蔬呼吸成熟,但对酶活性和微生物生长抑制效果不够理想;260 nm左右的UV-C可致微生物遗传物质损伤,杀菌效果好,且通过非生物胁迫促使果蔬产生毒物兴奋反应,延缓氧化损伤,降低PPO和POD酶活性,但也会造成果蔬失水、褐变等品质恶变,而二者协同,可弥补单处理的劣势,既可有效抑制酶促褐变、延缓果蔬衰老,又可高效杀菌和抑制关键酶活性,减少氧化损伤。
[1] 程丽林, 吴波, 袁海君, 等.鲜切果蔬贮藏保鲜技术研究进展[J].保鲜与加工, 2019, 19(1):147-152.
CHENG L L, WU B, YUAN H J, et al.Research progress in storage and preservation technologies of fresh-cut fruits and vegetables[J].Storage and Process, 2019, 19(1):147-152.
[2] 陈霞霞, 余雪芬, 叶仁凤, 等.真空纳米抗菌包装对鲜切去皮甘蔗的保鲜效果研究[J].食品工业科技, 2014, 35(2):304-307.
CHEN X X, YU X F, YE R F, et al.Effect of nano vacuum packaging on the preservation of fresh-cut peeled sugarcane[J].Science and Technology of Food Industry, 2014, 35(2):304-307.
[3] 耿亚娟, 王艳颖, 齐海萍, 等.紫外照射对鲜切苹果营养品质的影响[J].食品工业科技, 2016, 37(1):331-333;337.
GENG Y J, WANG Y Y, QI H P, et al.Effect of ultraviolet irradiation on the nutritional quality of fresh-cut apples[J].Science and Technology of Food Industry, 2016,37(1):331-333;337.
[4] MANZOCCO L, DA PIEVE S, MAIFRENI M.Impact of UV-C light on safety and quality of fresh-cut melon[J].Innovative Food Science & Emerging Technologies, 2011, 12(1):13-17.
[5] 黄镜如. 紫外线结合涂膜处理对鲜切萝卜贮藏品质的研究[D].天津:天津商业大学, 2019.
HUANG J R.Study on storage quality of fresh-cut radish treated with ultraviolet and coated film[D].Tianjin:Tianjin University of Commerce, 2019.
[6] 李静. 切割方式和UV-C处理对鲜切莴苣品质及抗氧化活性的影响[D].南京:南京农业大学, 2017.
LI J.Effect of cutting styles and UV-C treatment on quality and antioxidant activity of fresh-cut lettuce[D].Nanjing:Nanjing Agricultural University, 2017.
[7] GUAN W Q,FAN X T,YAN R X.Effects of UV-C treatment on inactivation of Escherichia coli O157∶H7, microbial loads, and quality of button mushrooms[J].Postharvest Biology and Technology, 2012, 64(1):119-125.
[8] ESCALONA V H, AGUAYO E, MART NEZ-HERN
NEZ-HERN NDEZ, et al.UV-C doses to reduce pathogen and spoilage bacterial growth in vitro and in baby spinach[J].Postharvest Biology Technology, 2010, 56(3):223-231.
NDEZ, et al.UV-C doses to reduce pathogen and spoilage bacterial growth in vitro and in baby spinach[J].Postharvest Biology Technology, 2010, 56(3):223-231.
[9] VELICKOVA E, WINKELHAUSEN E, KUZMANOVA S, et al.Impact of chitosan-beeswax edible coatings on the quality of fresh strawberries (Fragaria ananassa cv Camarosa) under commercial storage conditions[J].LWT-Food Science and Technology, 2013, 52(2):80-92.
[10] 胡位荣, 刘顺枝, 黄惠娟, 等.抗坏血酸与壳聚糖处理对鲜切香芋贮藏效果的研究[J].食品科学, 2010, 31(24):436-439.
HU W R, LIU S Z, HUANG H J,et al.Effects of ascorbic acid and chitosan treatments on physiological changes of fresh-cut taro during storage[J].Food Science, 2010, 31(24):436-439.
[11] 陈明媚. 鲜切果蔗生理生化特性及贮藏保鲜技术研究[D].桂林:广西师范大学, 2005.
CHEN M M.Studies on physiological characteristic and preservation techniques of fresh-cut sugarcane [D].Guilin:Guangxi Normal University, 2005.
[12] 齐红蓉, 田建文, 张彦军, 等.肉桂油复合涂膜对鲜切菠萝蜜果苞贮藏期间品质的影响[J].食品与机械, 2020, 36(4):126-131;201.
QI H R, TIAN J W, ZHANG Y J, et al.Effects of cinnamon oil coating on the quality of fresh-cut jackfruit during storage[J].Food & Machinery,2020,36(4):126-131;201.
[13] 冯可, 胡文忠, 姜爱丽, 等.壳聚糖涂膜与牛至精油复配对鲜切菠萝的保鲜作用[J].食品安全质量检测学报, 2015, 6(7):2 476-2 481.
FENG K, HU W Z, JIANG A L, et al.Effect of chitosan edible coating incorporated with origanum essential oil on preservation of fresh-cut pineapple [J].Journal of Food Safety and Quality, 2015,6(7):2 476-2 481.
刘容, 崔媛媛.UV-C 照射与壳聚糖涂膜对鲜切淮山的保鲜效果[J].食品科学,2021,42(3):289-295.
LIU R, CUI Y Y.The preservation effect of fresh-cut Chinese Yam by UV-C irradiation and chitosan coating[J].Food Science,2021,42(3):289-295.
[15] 尹琳琳, 杨建涛, 刘海涛, 等.中温协同超高压处理对草莓汁贮藏品质的影响[J].食品与机械, 2016, 32(7):106-111.
YIN L L, YANG J T, LIU H T, et al.Effect of ultra-high pressure combined with mild-temperature processing on quality of strawberry juice during storage[J].Food & Machinery, 2016,32(7):106-111.
[16] 李静, 聂继云, 李海飞, 等.Folin-酚法测定水果及其制品中总多酚含量的条件[J].果树学报, 2008, 25(1):126-131.
LI J, NIE J Y, LI H F, et al.On determination conditions for total polyphenols in fruits and its derived products by Folin-phenol methods[J].Journal of Fruit Science, 2008, 25(1):126-131.
[17] 曹建康,姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007.
CAO J K, JIANG W B, ZHAO Y M.Guidance for Physiological and Biochemical Experiments of Post-harvest Fruit and Vegetable[M].Beijing:China Light Industry Press, 2007.
[18] 李瑞美, 李海明, 潘世明.果蔗保鲜过程中可溶性固形物和氨基酸变化分析[J].江西农业学报, 2011, 23(8):141-143.
LI R M,LI H M,PAN S M.Analysis on changes of amino acid and soluble solid content during fresh-keeping of fruit sugarcane[J].Acta Agriculturae Jiangxi, 2011, 23(8):141-143.
[19] MART NEZ-HERN
NEZ-HERN NDEZ G B, G
NDEZ G B, G MEZ P A, PRADAS I, et al. Moderate UV-C pretreatment as a quality enhancement tool in fresh-cut Bimi® broccoli[J]. Postharvest Biology and Technology, 2011, 62(3):327-337.
MEZ P A, PRADAS I, et al. Moderate UV-C pretreatment as a quality enhancement tool in fresh-cut Bimi® broccoli[J]. Postharvest Biology and Technology, 2011, 62(3):327-337.
[20] 大东. 鲜切甘蔗和芋头抗褐变剂筛选及其抗褐变机理研究[D].武汉:华中农业大学, 2019.
MAMOUN ADAM.Study on screening anti-browning agents and mechanism of inhibiting the browning on fresh-cut sugarcane and taro[D].Wuhan:Huazhong Agriculture University,2019.
[21] ROBLES-S NCHEZ R M, ROIASGRAÜ M A, DRIOZOLASERANO I, et al.Influence of alginate-based edible coating as carrier of anti-browning agents on bioactive compounds and antioxidant activity in fresh-cut Kent mangoes[J].LWT-Food Science and Technology, 2013, 50(1):240-246.
NCHEZ R M, ROIASGRAÜ M A, DRIOZOLASERANO I, et al.Influence of alginate-based edible coating as carrier of anti-browning agents on bioactive compounds and antioxidant activity in fresh-cut Kent mangoes[J].LWT-Food Science and Technology, 2013, 50(1):240-246.
[22] OUHIBI C, ATTIA H, REBAH F, et al.Salt stress mitigation by seed priming with UV-C in lettuce plants:Growth, antioxidant activity and phenolic compounds[J].Plant Physiology and Biochemistry, 2014, 83:126-133.
[23] 李丽, 易萍, 孙健, 等.低温结合气调包装处理对鲜切胡萝卜品质的影响[J].食品与发酵工业,2021,47(4):159-165.
LI L, YI P, SUN J, et al.The effect of low temperature combined with modified atmosphere packaging on quality of fresh-cut carrots[J].Food and Fermentation Industries,2021,47(4):159-165.
[24] 王梅, 吴方佳, 徐俐, 等.乳酸预处理对鲜切马铃薯冷藏品质和生理特性的影响[J].中国食品学报, 2020, 20(8):207-215.
WANG M, WU F J, XU L, et al.Effects of lactic acid pretreatment on quality and physiological properties of fresh-cut potato during cold storage[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(8):207-215.
[25] 程双. 鲜切果蔬酶促褐变发生机理及其调控的研究[D].大连:大连工业大学, 2010.
CHENG S.Study on the enzymatic browning mechanism and the control of fresh-cut fruits and vegetables[D].Dalian:Dalian Polytechnic University, 2010.
[26] LUO Z, LI D D, XIE J W, et al.Effects of heat treatment on quality and browning of fresh-cut sugarcane[J].Journal of Food Processing and Preservation, 2015, 39(6):688-696.