宽皮柑橘(Citrus reticulata)是一类果皮宽松、皮薄易剥且风味独特的柑橘品种,主要分布在中国、欧盟和土耳其等国。据美国农业部数据统计[1],近5年全球宽皮柑橘产量约3 000万t/年,其中我国宽皮柑橘产量约占全球的70%。目前,我国宽皮柑橘主要用于鲜食,少量加工成果汁、罐头、精油和蜜饯等产品。随着我国宽皮柑橘鲜食市场的饱和,将宽皮柑橘鲜果加工成果汁,满足消费者的需求,实现我国宽皮柑橘产业升级,将具有重要的意义。宽皮柑橘品种繁多,其中,克里曼丁橘是一类具有代表性的宽皮柑橘品种,因果肉多汁、无籽、有特殊香味等特点,受到越来越多消费者的喜爱。目前,克里曼丁橘已广泛引种在我国湖南安化[2]、广西桂林[3]、重庆奉节[4]等地,品质稳定,具有很好的加工适宜性。
风味是衡量柑橘果汁品质的重要指标。近年来,针对宽皮柑橘风味的研究较多。XIAO等[5]采用气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)在5种宽皮柑橘汁中检测到49种挥发性组分,其中壬醛、己醛、芳樟醇和D-柠檬烯是对宽皮柑橘果汁整体风味具有重要贡献的化合物。FENG等[6]发现芳樟醇、辛醛、α-蒎烯、D-柠檬烯和(E,E)-2,4-癸二烯醛是宽皮柑橘汁区别于橙汁风味的关键组分。此外,本团队前期采用GC-MS结合脉冲火焰检测器(pulsed flame photometric detector,PFPD)在鲜榨宽皮柑橘汁中检测到4种具有特殊气味属性的挥发性硫化物(volatile sulfur compounds,VSCs):羰基硫、硫化氢、二甲基硫醚、二硫化碳,证明了具有浓度低、阈值低、化学性质活泼的VSCs是影响宽皮柑橘果汁风味的异味组分[7]。
在不同成长或成熟阶段,柑橘水果的大小、颜色、口感、风味,都发生显著变化。可溶性固形物(soluble solids content,SSC)和总酸(total acid,TA)作为柑橘水果成熟的标志。RANGANNA等[8]研究表明当SSC和TA比值在8.6~18.1时,可规定为宽皮柑橘的最佳成熟期(完熟期)。HIJAZ等[9]发现随着SSC/TA的增加,宽皮杂柑默科特、411、Temple、LB8-9水果的甜度、成熟度和多汁性增加,而酸味和苦味降低。随着消费者对柑橘水果的“高品质”追求,除SSC和TA外,风味成为消费者选择柑橘水果或产品的关键因素。柑橘风味呈现与挥发性组分的种类和含量密不可分,然而,关于水果成熟期间风味变化的研究多集中在桃[10]、番茄[11]、西番莲[12]等水果,针对不同成熟期宽皮柑橘汁风味变化的研究报道有限。康明丽等[13]采用GC-MS在未成熟、充分成熟、过熟的大叶尾张蜜柑汁中分别检测到34、32、33种挥发性成分,其中,醇类、醛类、酯类挥发性成分在充分成熟果中含量最高,而烃类成分在成熟果中含量最低。HIJAZ等[9]发现默科特柑橘果中醋酸甲酯和乙酸乙酯含量随着成熟度增加而增大。前期文献研究仅对不同成熟期宽皮柑橘水果中挥发性组分进行了测定,主要目的是为了明确具有良好风味品质宽皮柑橘的采摘期,促进鲜果销售,然而,关于不同完熟期宽皮柑橘鲜果的加工特性,尤其是风味特性,还未进行全面探究。
为了明确不同完熟期宽皮柑橘汁的特征风味组分及其在加工中的变化规律,本研究拟以5个不同完熟度克里曼丁橘为研究对象,利用顶空固相微萃取(head spcase solid phase micro extraction,HS-SPME)结合GC-MS/PFPD对克里曼丁橘汁中挥发性组分进行定性和定量分析,采用主成分分析(principal component analysis,PCA)和气味活性值(odor activity value,OAVs)探究完熟期与挥发性组分之间的关系、不同完熟期克里曼丁橘汁中特征风味组分及其加工中的变化规律,为明确我国具有加工适宜性的克里曼丁橘采摘期提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
5个不同成熟度的克里曼丁橘采自重庆市中国农业科学院柑桔研究(西南大学柑桔研究所)国家种植柑橘资源圃,采摘信息见表1。由于克里曼丁橘的SCC/TA为11.06~18.09,属于完熟期水果。
表1 柑橘样品采摘信息表
Table 1 The picking information of citrus sample
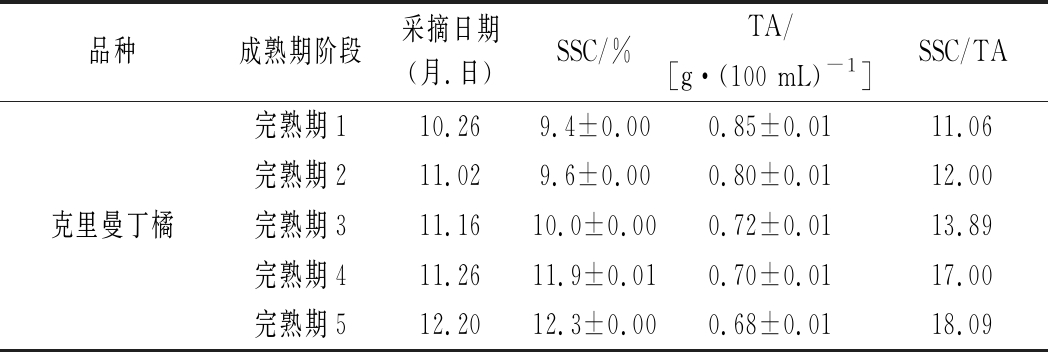
品种成熟期阶段采摘日期(月.日)SSC/%TA/[g·(100 mL)-1]SSC/TA完熟期110.269.4±0.000.85±0.0111.06完熟期211.029.6±0.000.80±0.0112.00克里曼丁橘完熟期311.1610.0±0.000.72±0.0113.89完熟期411.2611.9±0.010.70±0.0117.00完熟期512.20 12.3±0.000.68±0.0118.09
1.1.2 实验试剂
C5~C20正构烷烃,美国Honeywell公司;环己酮(纯度99%)、甲基乙基硫醚(纯度96%),上海阿拉丁公司。
1.2 仪器与设备
Agilent 7890B GC-5977A MS气相色谱-质谱联用仪、RTX-wax色谱柱(60 m×0.25 mm×0.25 μm),美国安捷伦科技有限公司;OI 5380 PFPD脉冲火焰光度检测仪,美国OI公司;H-100-DWBIA0惠人榨汁机,上海韩惠人爱家电科技有限公司;DouR@SPT-H氮空吹扫浓缩仪,北京斯珀特科技有限公司;Milli-Q超纯水系统,德国Merck-Millpore公司;SQP十万分之一天平,北京赛多利斯科学仪器有限公司;50/30 μm 二乙烯基苯/碳分子筛/聚二甲基硅氧烷萃取头(DVB/CAR/PDMS)萃取头,美国Supelco公司;DF-101S集热式恒温加热磁力搅拌器,上海力辰科技有限公司。
1.3 实验方法
1.3.1 样品制备
鲜榨柑橘汁的制备:将采摘的库里曼丁橘手动去皮,采用压榨机将果肉压榨出汁,果汁被分为2组:鲜榨组(F组)和加工组(H组),F组直接进行检测分析。H组:根据果汁工业加工条件[14],将果汁样品进行加热处理,使果汁中心温度达到98 ℃维持15 s,随后装瓶、冷却,置于-20 ℃待用。F1、F2、F3、F4、F5和H1、H2、H3、H4、H5分别表示完熟期1~晚熟期5的鲜榨组和加工组果汁。
1.3.2 挥发性组分的测定
将5 mL鲜榨果汁置于含有磁子的20 mL顶空瓶中,加入内标环己酮2.5 μL(9.423 mg/mL)和甲基乙基硫醚1.5 μL(8.42 mg/mL),混匀,采用聚四氟乙烯材质的隔垫密封。将顶空瓶置于40 ℃水浴中平衡20 min,采用2 cm的50/30 μm DVB/CAR/PDMS固相微萃取头插入顶空瓶中,萃取挥发性组分30 min。
GC-MS/PFPD测定条件,参考程玉娇[15]方法,略有修改。采用安捷伦7890B GC-5977A MS/OI5380 PFPD设备对果汁中的挥发性组分进行测定,将备好的萃取头置于GC进样口200 ℃解析5 min,挥发性组分在RTX-wax色谱柱上进行分离后进入MS和PFPD检测器进行测定。柱温设置程序:初始温度为35 ℃,保持6 min,7 ℃/min升至203 ℃,保持10 min。载气为氦气,流速为1.5 mL/min。EI离子源的电子能量为70 eV,传输线温度设置为280 ℃。m/z扫描范围为33~500 mau。PFPD检测器的温度设置为250 ℃,PMT电压为498 V,载气和燃气分别为氦气、空气和氢气。每个样品重复3次。
1.3.3 定性和定量分析
定性分析:克里曼丁果汁中的挥发性非硫组分的定性主要通过匹配NIST11、W10 N14库中MS总离子流、与已发表文献中的线性保留指数(linear retention index,LRI)比较,其中线性保留指数是通过正构烷烃C5~C20进行计算。克里曼丁果汁中的挥发性硫组分的定性方式除上述方法外,可通过PFPD进行再次定性。
定量分析:挥发性非硫组分的定量主要通过内标环己酮进行,而挥发性硫组分的定量主要通过内标甲基乙基硫醚进行。定量计算如公式(1)所示:
C待![]()
(1)
式中:C待,待测挥发性组分的质量浓度,μg/mL;A待,待测挥发性组分的峰面积;C,内标质量浓度;A内标,内标组分在MS或PFPD上的峰面积。
1.3.4 OAV计算
OAV为风味组分的浓度与感官阈值的比值。通常当OAV≥1时,表明该风味组分对果汁的整体风味具有贡献[16]。
1.3.5 数据处理
采用SPSS 25.0对数据进行方差分析和Duncan多重检验;化学工作站F.01.01.2317对挥发性组分进行定性分析。采用Origin 7.5绘图和Unscrambler 10.4软件进行PCA分析。
2 结果与分析
2.1 不同完熟期克里曼丁橘汁中挥发性组分的定性分析
采用MS和PFPD 2种不同检测器,对不同完熟期的克里曼丁橘汁中挥发性组分进行检测,其中MS检测器可对挥发性组分进行全面检测,而本文中PFPD检测器主要检测硫组分,且VSCs在PFPD的响应值远高于MS检测器。如图1所示,由于VSCs在克里曼丁橘汁中含量极低,仅能通过PFPD进行检测,而在MS检测器上无法检测到VSCs信号,此外,其他的挥发性非硫组分在MS检测器上都具有很好的响应。
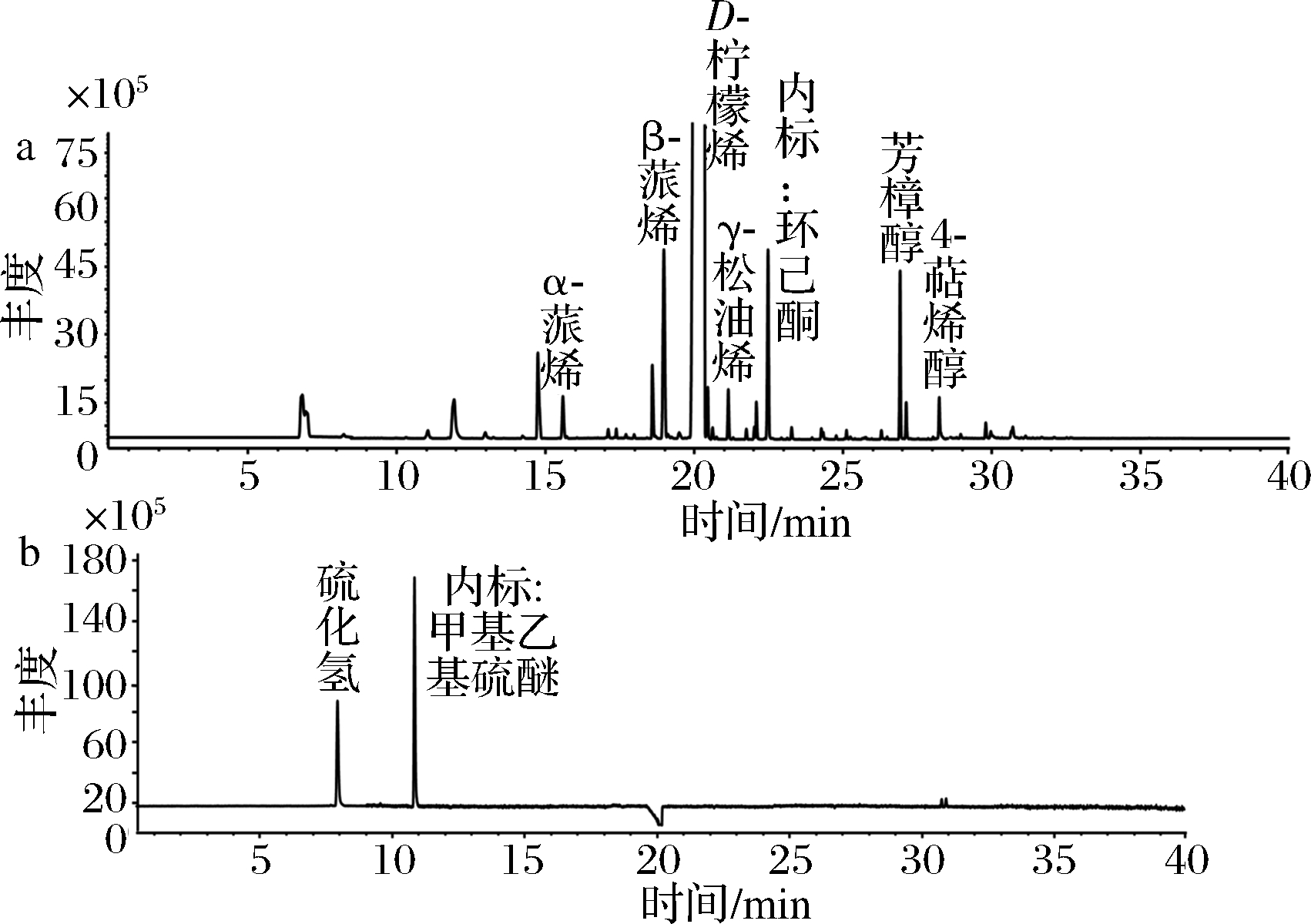
a-MS图谱:b-PFPD图谱
图1 采用GC-MS/PFPD对克里曼丁红橘果汁中挥发性组分检测色谱图
Fig.1 The chromatography of volatile compounds in clementine juice by GC-MS/PFPD
通过匹配检测的挥发性组分与NIST11、W10 N14库中MS总离子流、比较与已发表文献中的LRI及PFPD硫检测器信号值,不同完熟期间的克里曼丁橘汁中挥发性组分的定性分析结果如表2所示,共41种挥发性组分被检测,包括萜烯类(16种)、醇类(8种)、醛类(8种)、酮类(2种)、酯类(2种)、挥发性硫化物类(3种)及其他种类(2种)。在不同完熟期间,克里曼丁橘汁中挥发性组分种类呈现变化,如图2所示,萜烯类组分是宽皮橘汁中最主要的挥发性组分,其在F5组中种类最少(13种),在F3和H4中种类最高(16种);醛类和酯类组分对宽皮橘汁风味具有重要的贡献,这两类风味组分在完熟期4中种类最多,且(E)-己烯醛和辛醛仅在此完熟期检测到;醇类和VSCs在不同晚熟期间,克里曼丁橘汁中的种类并未发生变化。乙酸乙酯和丁酸甲酯2种酯类物质在克里曼丁橘汁中检测到。通过比较完熟期1和完熟期5阶段,随着成熟度增加,克里曼丁橘汁中萜烯类物质检测到的种类减少,醛类、酯类和酮类物质检测的种类增加,这也与前期的文献报道趋势一致[13]。此外,在鲜榨组F1、F2、F3、F4、F5中,分别检测到29种、33种、35种、37种、32种挥发性组分;在加工组H1、H2、H3、H4、H5中,分别检测到30种、34种、35种、39种、36种挥发性组分。除完熟期3阶段外,加工促进其他完熟期克里曼丁橘汁中挥发性组分种类的提高,主要体现在加工促进了甲硫醇和甲硫醚产生,导致异味形成[7]。
2.2 不同完熟期克里曼丁橘汁中挥发性组分的定量分析
采用内标环己酮和甲基乙基硫醚,分别对不同完熟期克里曼丁橘汁中挥发性组分进行定量分析,结果如图3所示,在5个不同的完熟阶段,乙酸乙酯的含量呈现上升趋势,罗勒烯的含量呈现下降趋势。此外,克里曼丁橘汁中的其他挥发性组分含量仅在某个成熟阶段呈现规律变化,这与CHAUDHARY等[17]研究红葡萄柚在可食成熟期挥发性组分的含量变化规律一致。
在5个不同完熟阶段中克里曼丁橘汁中挥发性组分含量变化呈现不同趋势。其中,萜烯类组分是宽皮橘汁中最主要的一类挥发性组分,对果汁的风味具有重要的影响[18],克里曼丁橘汁中萜烯类组分的含量约占所检测的所有挥发性组分的91.89%~96.63%,其占比在不同完熟期1~晚熟期4呈现降低趋势(96.63%至91.89%),而在完熟阶段5略有上升;在本研究中,D-柠檬烯(83.67%~87.94%)和β-月桂烯(3.65%~5.53%)是克里曼丁橘汁中含量最高的2种萜烯类组分,其中,在不同完熟期,这2种挥发性组分的变化呈现不同趋势,D-柠檬烯含量呈现下降趋势(完熟期1~完熟期4),且不同完熟期之间差异极显著(P<0.01),而β-月桂烯含量变化未呈现明显规律;此外,加工促进了克里曼丁橘汁中萜烯类组分含量增加,其中完熟期4萜烯类含量增加最为显著。柑橘中醇类、醛类和酮类3种含氧类的化合物均来自不饱和脂肪酸的过氧化作用[19],在本研究中,克里曼丁橘汁中醇类含量总和仅次于萜烯类化合物,其占比在不同完熟期(3~5)呈现上升趋势(3.47%~6.01%),其中芳樟醇是克里曼丁橘汁中含量最高(1.68%~3.63%)的醇类化合物,在不同完熟阶段均有检出;4-萜品烯醇和α-松油醇常被用来衡量柑橘汁在加工过程中风味品质变化,被认为是导致风味失衡的重要因素[20],本研究中,加工促进4-萜品烯醇和α-松油醇含量升高,在完熟期4含量增长最低。克里曼丁橘汁中醛类含量仅次于萜烯类和醇类组分,在完熟期1~完熟期4,其含量占比呈现上升趋势,在完熟期5稍有下降;乙醛常被认为是鲜果贮藏过程中重要的异味组分,是由丙酮酸经丙酮酸脱羧酶脱羧形成,在宽皮柑橘鲜果贮藏期间,乙醛含量逐渐升高[21]。在本研究中,克里曼丁橘汁中正己醛在完熟期1→完熟期4呈现上升趋势(30.90~165.63 μg/L);正庚醛仅在完熟期4和完熟期5中检测到,且含量逐渐升高。丁酸甲酯是克里曼丁橘汁中重要的酯类化合物,仅在完熟期4中检测到。VSCs在克里曼丁橘汁中浓度极低,在各完熟期呈现不同变化趋势,其中硫化氢含量在完熟期3达到最高值(1.66±0.02) μg/L,且加工降低了克里曼丁汁中硫化氢的含量;甲硫醇和甲硫醚仅在加工的克里曼丁橘汁中检测到,在完熟期1~完熟期3呈现上升趋势,完熟期3~完熟期4呈现下降趋势,而在完熟期4~完熟期5呈现上升趋势。柠檬烯环氧物在完熟期5含量最高(1 000±9.02) μg/L,且加工降低了柠檬烯环氧物的含量。此外,通过比较H1和H5中挥发性组分含量,萜烯类(114 218.43~75 290.97 μg/L)和挥发性硫化物化合物(1.68~1.49 μg/L)总含量呈现下降趋势,而醇类(3 743.87~4 871.99 μg/L)、醛类(334.80~568.42 μg/L)、酯类(0.00~86.19 μg/L)和酮类化合物(0.00~26.62 μg/L)的含量则呈现上升趋势,这与前期关于不同成熟阶段蜜柑果汁[13]、宽皮杂柑类果汁[9]中的变化趋势一致。
表2 不同成熟期克里曼丁果汁中挥发性组分定性分析
Table 2 The identification analysis of volatile compounds in clementine juice at different stages of complete maturity
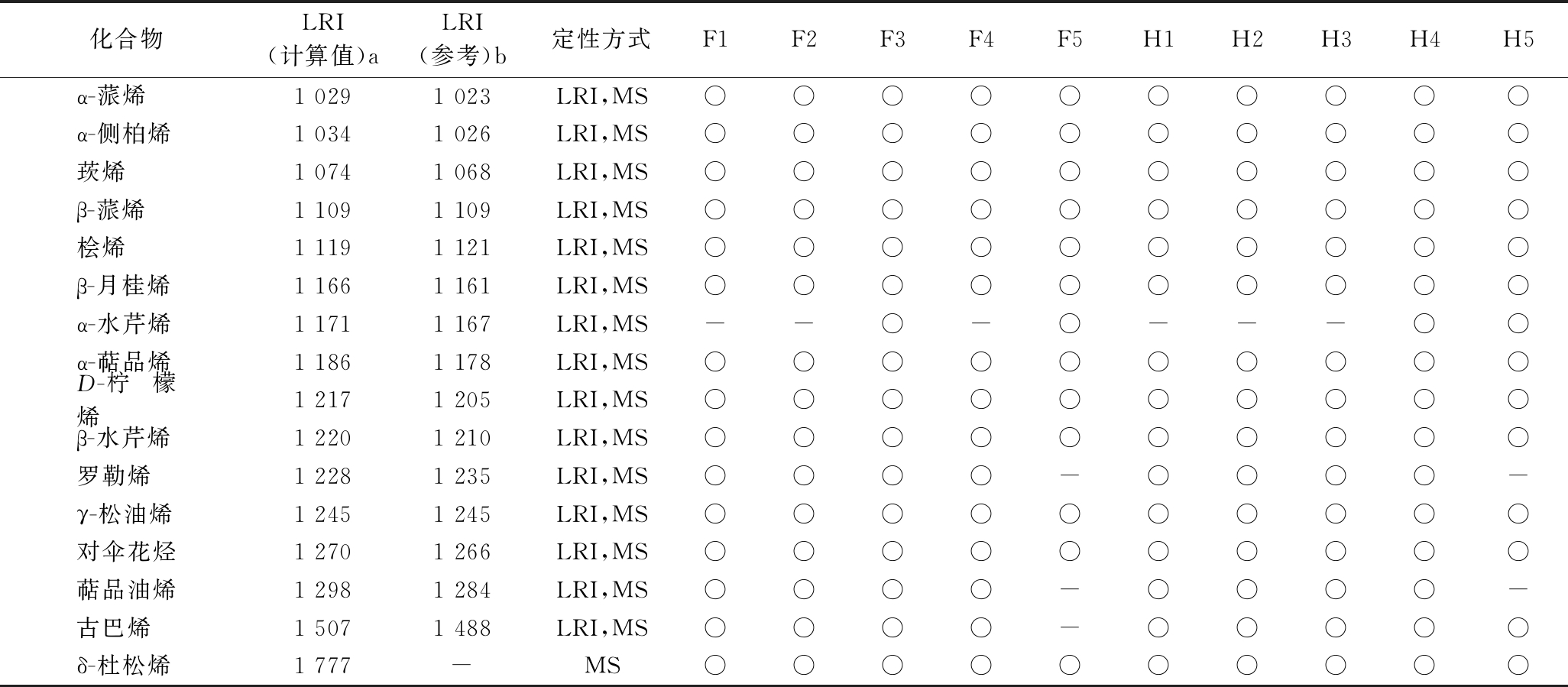
化合物LRI(计算值)aLRI(参考)b定性方式F1F2F3F4F5H1H2H3H4H5α-蒎烯1 0291 023LRI,MS○○○○○○○○○○α-侧柏烯1 0341 026LRI,MS○○○○○○○○○○莰烯1 0741 068LRI,MS○○○○○○○○○○β-蒎烯1 1091 109LRI,MS○○○○○○○○○○桧烯1 1191 121LRI,MS○○○○○○○○○○β-月桂烯1 1661 161LRI,MS○○○○○○○○○○α-水芹烯1 1711 167LRI,MS--○-○---○○α-萜品烯1 1861 178LRI,MS○○○○○○○○○○D-柠檬烯1 2171 205LRI,MS○○○○○○○○○○β-水芹烯1 2201 210LRI,MS○○○○○○○○○○罗勒烯1 2281 235LRI,MS○○○○-○○○○-γ-松油烯1 2451 245LRI,MS○○○○○○○○○○对伞花烃1 2701 266LRI,MS○○○○○○○○○○萜品油烯1 2981 284LRI,MS○○○○-○○○○-古巴烯1 5071 488LRI,MS○○○○-○○○○○δ-杜松烯1 777-MS○○○○○○○○○○
续表2
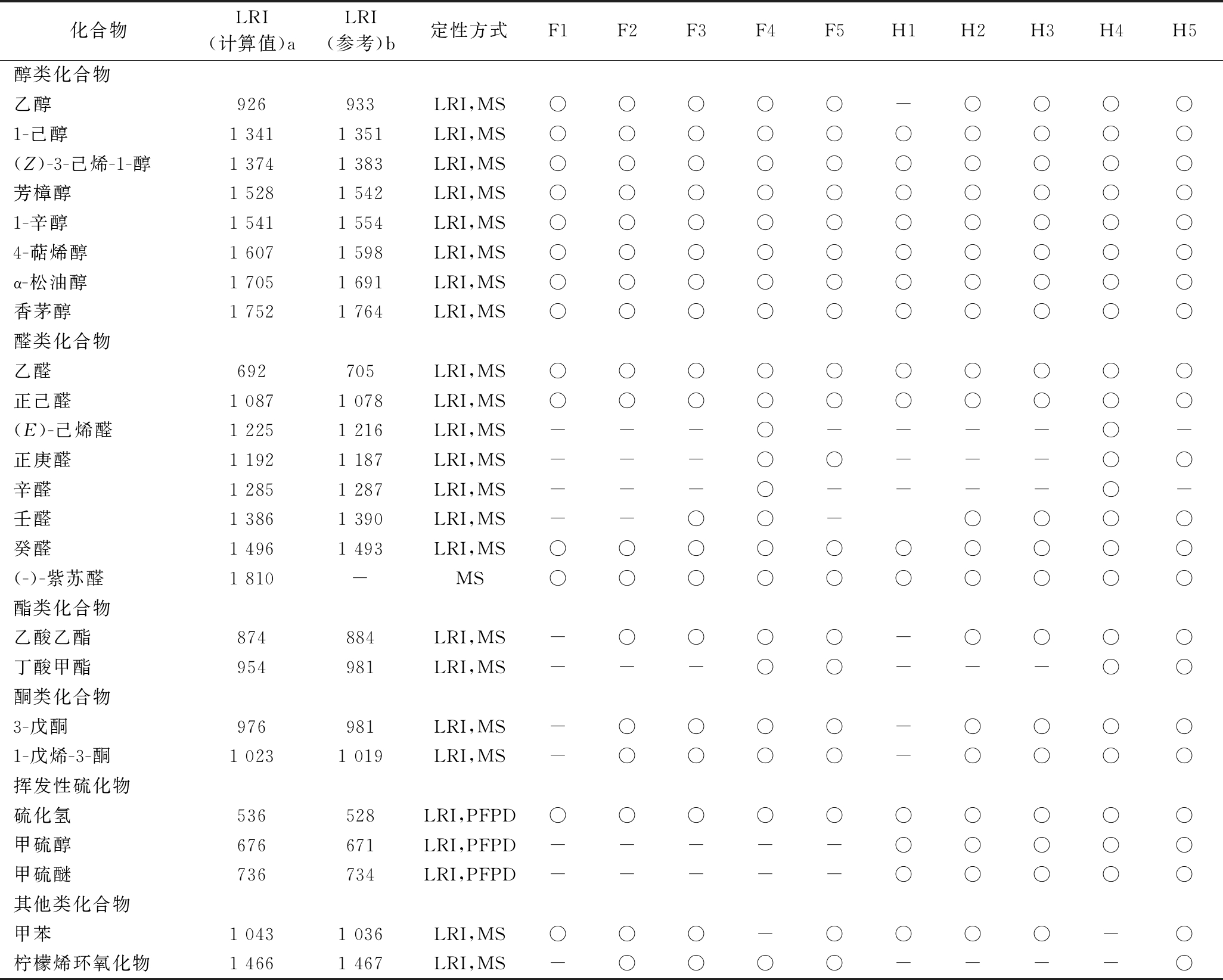
化合物LRI(计算值)aLRI(参考)b定性方式F1F2F3F4F5H1H2H3H4H5醇类化合物乙醇926933LRI,MS○○○○○-○○○○1-己醇1 3411 351LRI,MS○○○○○○○○○○(Z)-3-己烯-1-醇1 3741 383LRI,MS○○○○○○○○○○芳樟醇1 5281 542LRI,MS○○○○○○○○○○1-辛醇1 5411 554LRI,MS○○○○○○○○○○4-萜烯醇1 6071 598LRI,MS○○○○○○○○○○α-松油醇1 7051 691LRI,MS○○○○○○○○○○香茅醇1 7521 764LRI,MS○○○○○○○○○○醛类化合物乙醛692705LRI,MS○○○○○○○○○○正己醛1 0871 078LRI,MS○○○○○○○○○○(E)-己烯醛1 2251 216LRI,MS---○----○-正庚醛1 1921 187LRI,MS---○○---○○辛醛1 2851 287LRI,MS---○----○-壬醛1 3861 390LRI,MS--○○-○○○○癸醛1 4961 493LRI,MS○○○○○○○○○○(-)-紫苏醛1 810-MS○○○○○○○○○○酯类化合物乙酸乙酯874884LRI,MS-○○○○-○○○○丁酸甲酯954981LRI,MS---○○---○○酮类化合物3-戊酮976981LRI,MS-○○○○-○○○○1-戊烯-3-酮1 0231 019LRI,MS-○○○○-○○○○挥发性硫化物硫化氢536528LRI,PFPD○○○○○○○○○○甲硫醇676671LRI,PFPD-----○○○○○甲硫醚736734LRI,PFPD-----○○○○○其他类化合物甲苯1 0431 036LRI,MS○○○-○○○○-○柠檬烯环氧化物1 4661 467LRI,MS-○○○○----○
注:a,利用正构烷烃C5~C20进行计算LRI;b,LRI来自风味数据库https://www.vcf online.nl/VcfCompoundSearch.cfm 和http://www.odour.org.uk/index.htmL;○代表在该品种中检测出此化合物;-代表没有找到相应的LRI值或化合物在该品种没被检测到
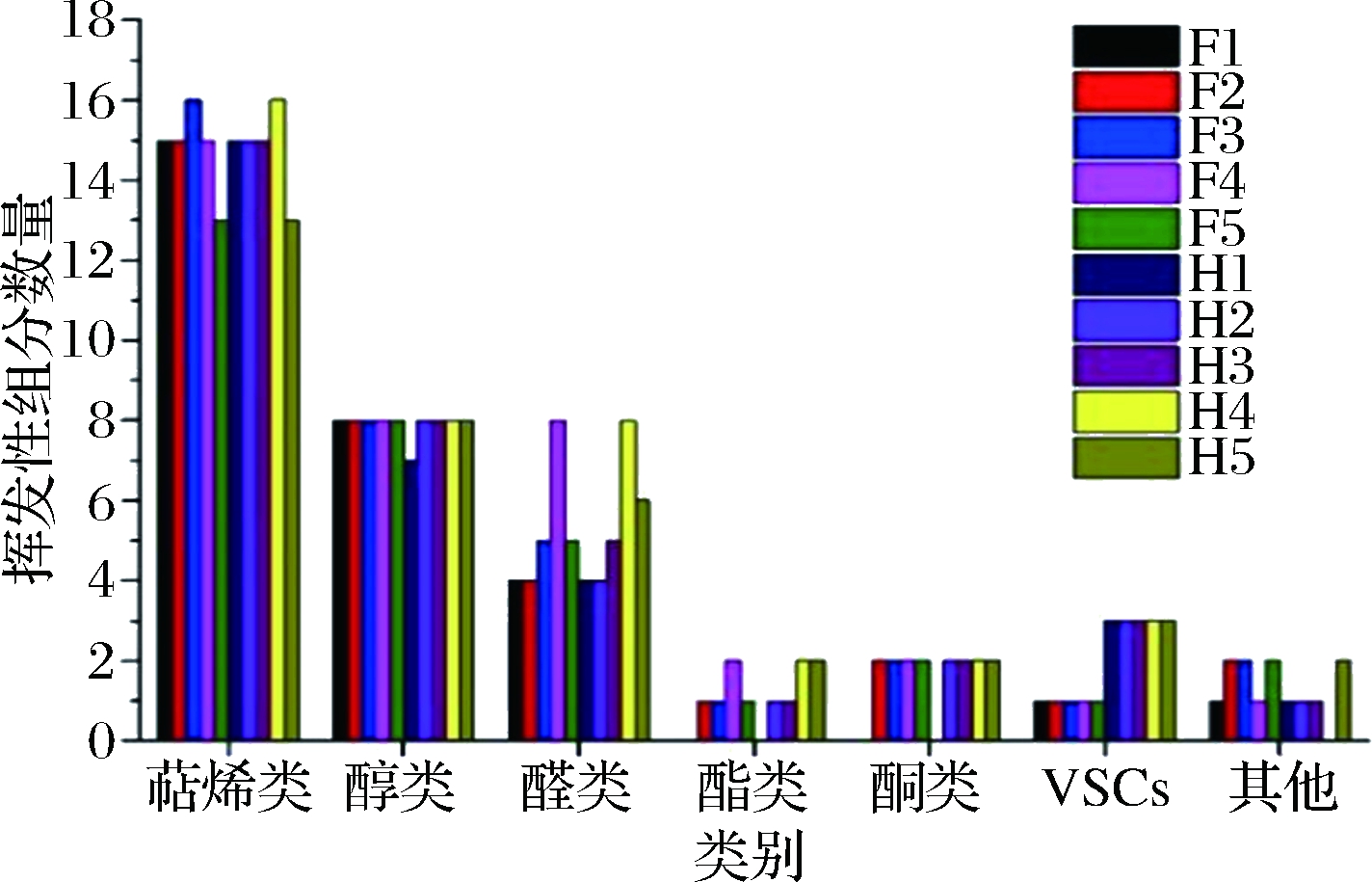
图2 不同完熟期克里曼丁橘汁中挥发性组分变化
Fig.2 The varieties change of volatile compounds in clementine juice at different stages of complete maturity

图3 不同成熟期克里曼丁红橘果汁中挥发性物质的热图
Fig.3 The heatmap of volatiles compounds in clementine juice at different stages of complete maturity
2.3 PCA
为进一步明确克里曼丁橘汁中挥发性组分浓度与各个完熟阶段之间的关系,采用PCA对各个不同完熟阶段的鲜榨果汁(F1、F2、F3、F4、F5)和加工果汁(H1、H2、H3、H4、H5)中挥发性组分进行分析。如图4所示,主成分1和主成分2的累计贡献率为72%,保证了数据分析的代表性。PCA结果图为双标图,由得分图和载荷图组成。其中得分图主要是表明哪些样品具有相似的挥发性组分刨面,即用于表明构造主成分的挥发性组分对能够区分样品是否有用。由图4可知,在PCA得分图中,除完熟期3外,其他完熟阶段的鲜榨果汁组和加工处理组的克里曼丁橘汁样品点比较集中,可以组合为1个集合且不同集合相互间距显著。载荷图主要用来确定用于区分样品的挥发性组分。在本研究中,32种挥发性组分在PC1和PC2相关分量呈现不同,其中,α-蒎烯(0.98)、D-柠檬烯(0.97)、β-月桂烯(0.96)、β-蒎烯(0.96)、δ-杜松烯(0.96)、4-萜烯醇(0.91)、γ-松油烯(0.88)、β-水芹烯(0.87)、1-辛醇(0.87)、α-松油醇(0.82)、古巴烯(0.78)、紫苏醛(0.76)、α-萜品烯(0.76)、罗勒烯(0.76)、对伞花烃(0.74)在PC1相关度绝对值分量达到0.7~1.0,对克里曼丁橘汁在X轴上的分布具有重要贡献,也是区分克里曼丁橘汁完熟期1~完熟期4的主要因素;桧烯(0.87)、α-水芹烯(0.85)、乙酸乙酯(0.85)、柠檬烯环氧化物(0.84)、香茅醇(0.82)、正庚醛(0.81)、芳樟醇(0.79)、1-己醇(0.77)、乙醛(0.76)在PC2上的相关分量绝对值达到0.7~1.0,对克里曼丁橘汁样品在Y轴上分布具有重要贡献,即这9种挥发性组分是区分成完熟期5与其他完熟期样品的主要因素。
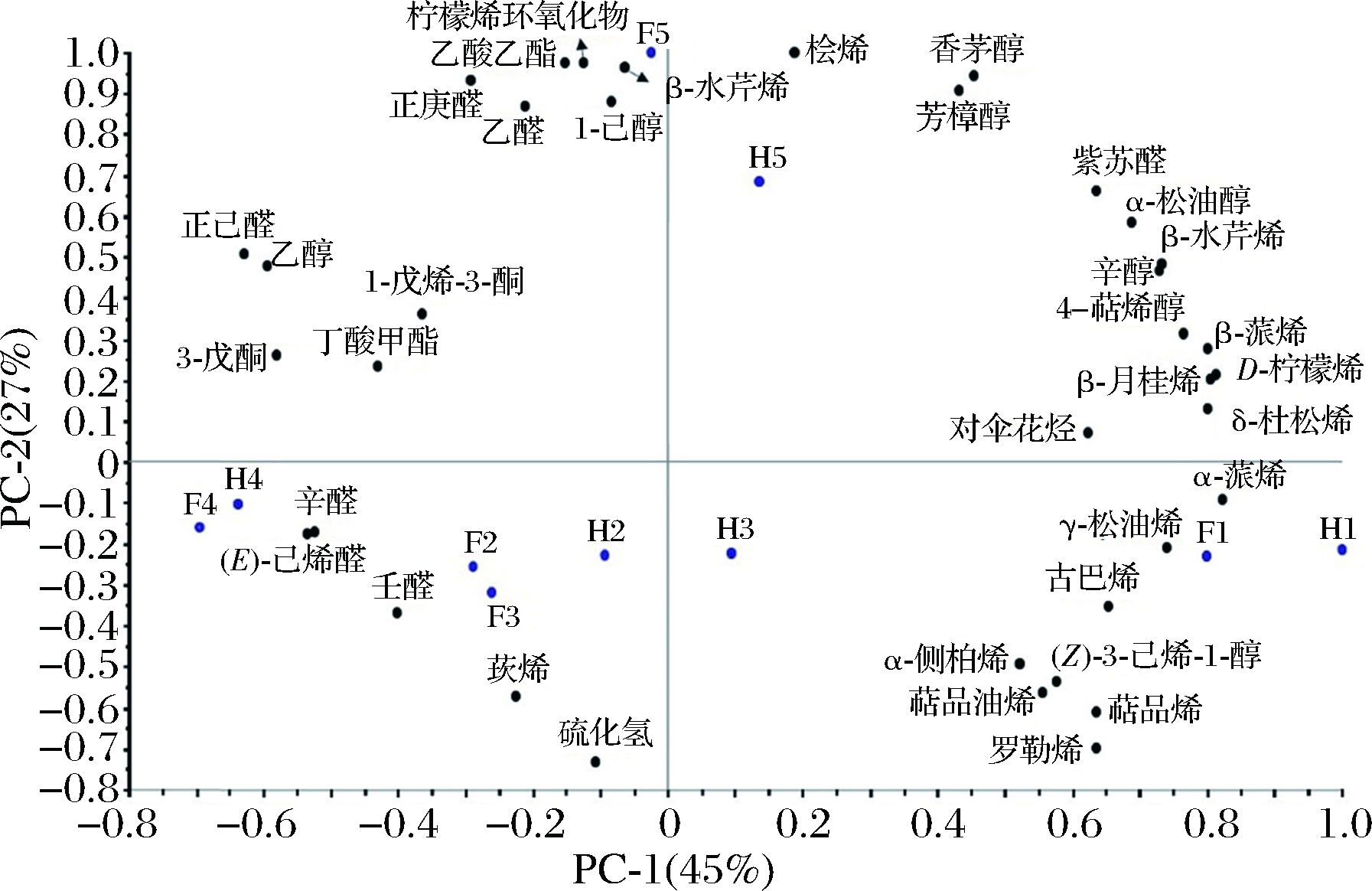
图4 不同完熟阶段克里曼丁橘汁中挥发性物质的PCA得分/载荷图
Fig.4 Principal component analysis biplot (score and load values) for volatile compounds in clementine juice at different stages of complete maturity
2.4 不同完熟期的克里曼丁橘汁中风味活性组分分析
为了筛选不同完熟期的克里曼丁橘汁中特征风味组分,明确其对果汁整体风味的贡献及在加工中变化规律,计算各个风味组分的OAV值,即其浓度与感官阈值的比值。一般认为,OAV值≥1时风味组分对果汁的整体风味具有贡献,也被认为是果汁的特征风味组分[22]。经查文献,获得各个挥发性组分在水中的感官阈值,其中不同完熟期克里曼橘中OAV≥1的挥发性组分如表3所示。克里曼丁红橘果汁中共检测到29种特征风味组分,其中包括萜烯类(12种)、醇类(4种)、醛类(8种)、酯类(1种)、酮类(1种)、苯类(1种)及其他类(2种)。特征风味组分表现出不同的气味属性,即橘香(9种)、花香(3种)、果香(2种)、松香(4种)、青草味(4种)、薄荷味(3种)和异味(4种),共同组成克里曼丁橘汁风味轮廓。D-柠檬烯(橘香)、β-月桂烯(香脂味)和芳樟醇(花香)是克里曼丁橘汁最主要的特征风味组分。特征风味组分的种类在克里曼丁不同完熟期呈现不同,在鲜榨组F1、F2、F3、F4、F5和加工组H1、H2、H3、H4、H5不同完熟期阶段,克里曼丁橘汁中分别检测到18、15、18、19、18和22、19、20、22、23种特征风味组分。其中,在不同完熟期,醛类特征组分种类变化最大,呈现先升高后降低的趋势,在完熟期4达到最大值。具有果香的酯类特征风味组分仅在完熟期4中检测到。此外,加工促进VSCs的产生,导致克里曼丁橘汁中出现异味,与其他3个完熟期相比,完熟期1和完熟期4中VSCs的OAV值明显降低,且差异显著(P<0.05)。
3 结论
采用HS-SPME结合GC-MS/PFPD对5个不同完熟阶段的克里曼丁鲜榨组和加工组橘汁进行测定,共41种挥发性组分被检测,萜烯类(91.89%~96.63%)、醇类(3.14%~6.01%)、醛类(0.21%~2.35%)是克里曼丁汁主要的挥发性组分。在不同完熟期间,挥发性组分种类发生变化,其中完熟期1挥发性组分种类最少,而在完熟期4中挥发性组分种类最多;不同完熟期挥发组分的含量不同,对于萜烯类和醇类组分,在完熟期1中含量最高,而在完熟期4中含量最低;对于醛类和酯类组分,在完熟期4含量最高,而完熟期1中含量最低;对于异味组分VSCs,在完熟期3含量最高,而在完熟期1中含量最低。克里曼丁橘汁的PCA可知,在完熟期1的果汁样品与萜烯类化合物密切相关,而其他完熟期果汁样品与萜烯类、醇类、醛类、酯类化合物密切相关。OAV明确了D-柠檬烯(橘香)、β-月桂烯(香脂味)、芳樟醇(花香)是克里曼丁橘汁中最主要的特征风味组分。在不同完熟期,醛类特征组分种类变化最大,呈现先升高后降低的趋势,在完熟期4达到最大值。此外,加工处理促进克里曼丁橘汁中异味组分甲硫醇和甲硫醚的产生,其在完熟期1和4中含量较低,且与其他完熟期VSCs相比,差异显著(P<0.05)。基于此,后续将利用GC-MS结合嗅辨仪对贮藏、货架期间的克里曼丁果汁中关键特征香气组分的变化规律进行研究,以解决贮藏和销售过程中克里曼丁果汁风味劣变问题。
表3 不同成熟期克里曼丁红橘果汁中挥发性物质的OAV值
Table 3 The OAV of volatile compounds in clementine juice at different stages of complete maturity
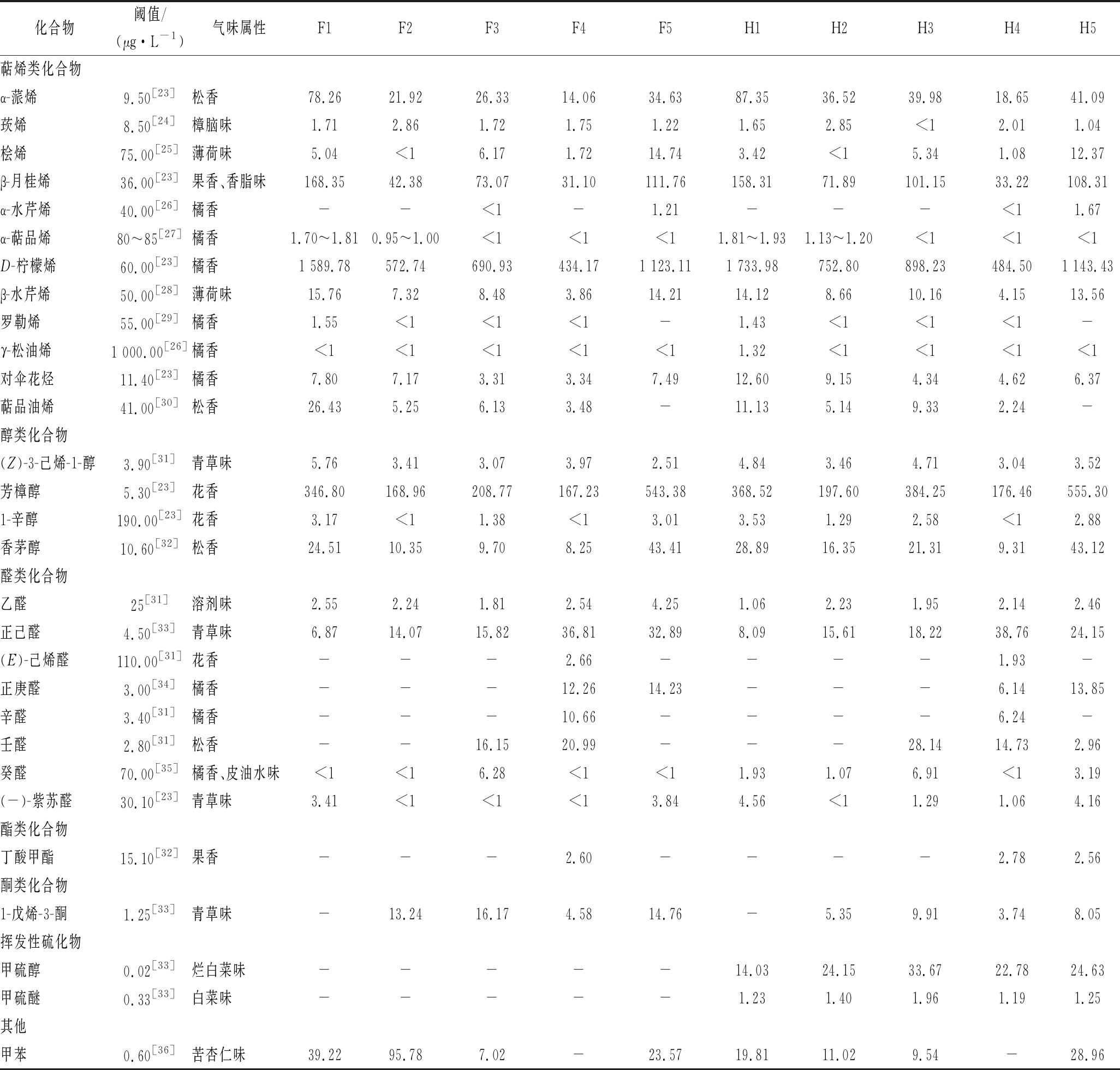
化合物阈值/(μg·L-1)气味属性F1F2F3F4F5H1H2H3H4H5萜烯类化合物α-蒎烯9.50[23]松香78.2621.9226.3314.0634.6387.3536.5239.9818.6541.09莰烯8.50[24]樟脑味1.712.861.721.751.221.652.85<12.011.04桧烯75.00[25]薄荷味5.04<16.171.7214.743.42<15.341.0812.37β-月桂烯36.00[23]果香、香脂味168.3542.3873.0731.10111.76158.3171.89101.1533.22108.31α-水芹烯40.00[26]橘香--<1-1.21---<11.67α-萜品烯80~85[27]橘香1.70~1.810.95~1.00<1<1<11.81~1.931.13~1.20<1<1<1D-柠檬烯60.00[23]橘香1 589.78572.74690.93434.171 123.111 733.98752.80898.23484.501 143.43β-水芹烯50.00[28]薄荷味15.767.328.483.8614.2114.128.6610.164.1513.56罗勒烯55.00[29]橘香1.55<1<1<1-1.43<1<1<1-γ-松油烯1 000.00[26]橘香<1<1<1<1<11.32<1<1<1<1对伞花烃11.40[23]橘香7.807.173.313.347.4912.609.154.344.626.37萜品油烯41.00[30]松香26.435.256.133.48-11.135.149.332.24-醇类化合物(Z)-3-己烯-1-醇3.90[31]青草味5.763.413.073.972.514.843.464.713.043.52芳樟醇5.30[23]花香346.80168.96208.77167.23543.38368.52197.60384.25176.46555.301-辛醇190.00[23]花香3.17<11.38<13.013.531.292.58<12.88香茅醇10.60[32]松香24.5110.359.708.2543.4128.8916.3521.319.3143.12醛类化合物乙醛25[31]溶剂味2.552.241.812.544.251.062.231.952.142.46正己醛4.50[33]青草味6.8714.0715.8236.8132.898.0915.6118.2238.7624.15(E)-己烯醛110.00[31]花香---2.66----1.93-正庚醛3.00[34]橘香---12.2614.23---6.1413.85辛醛3.40[31]橘香---10.66----6.24-壬醛2.80[31]松香--16.1520.99---28.1414.732.96癸醛70.00[35]橘香、皮油水味<1<16.28<1<11.931.076.91<13.19(-)-紫苏醛30.10[23]青草味3.41<1<1<13.844.56<11.291.064.16酯类化合物丁酸甲酯15.10[32]果香---2.60----2.782.56酮类化合物1-戊烯-3-酮1.25[33]青草味-13.2416.174.5814.76-5.359.913.748.05挥发性硫化物甲硫醇0.02[33]烂白菜味-----14.0324.1533.6722.7824.63甲硫醚0.33[33]白菜味-----1.231.401.961.191.25其他甲苯0.60[36]苦杏仁味39.2295.787.02-23.5719.8111.029.54-28.96
注:-表示无
[1] United States Department of Agriculture. Citrus: World Markets and Trade[EB/OL]. 2021. https://apps.fas.usda.gov/psdonline/circulars/citrus.pdf.
[2] 杨志新, 黄再安, 肖峰, 等.7个克里曼丁红橘品种在湖南安化引种表现[J].浙江柑橘, 2012, 29(1):15-17.
YANG Z X, HUANG Z A, XIAO F,et al.Introduced performance of 7 clemantina varieties in Anhua, Hunan [J].Zhejiang Ganju, 2012, 29 (1):15-17.
[3] 付慧敏, 邓崇岭, 陈传武, 等.6个克里曼丁红橘品种在广西桂林引种表现[J].南方园艺, 2018, 29(5):32-33.
FU H M, DENG C L, CHEN C W, et al. Introduction of six kliman red tangerine varieties in Guilin, Guangxi[J]. Southern Horticulture, 2018, 29(5):32-33.
[4] 颜家均, 张才健, 夏仁斌, 等.十六个克里曼丁橘在奉节县的品质表现[J].南方农业, 2013, 7(5):45-46.
YAN J J, ZHANG C J, XIA R B, et al.The quality performance of sixteen clementine varieties in Fengjie, Chongqing [J].South China Agricuture, 2013, 7(5):45-46.
[5] XIAO Z B, WU Q Y, NIU Y W, et al.Characterization of the key aroma compounds in five varieties of mandarins by gas chromatography-olfactometry, odor activity values, aroma recombination, and omission analysis[J].Journal of Agricultural and Food Chemistry, 2017, 65(38):8 392-8 401.
[6] FENG S,SUH J H,GMITTER F G,et al.Differentiation between flavors of sweet orange (Citrus sinensis) and mandarin (Citrus reticulata)[J].Journal of Agricultural and Food Chemistry, 2018, 66(1):203-211.
[7] CHENG Y J,ROUSEFF R,LI G J,et al.Methanethiol, an off-flavor produced from the thermal treatment of mandarin juices:A study of Citrus sulfur volatiles[J].Journal of Agricultural and Food Chemistry, 2020, 68(4):1 030-1 037.
[8] RANGANNA S, GOVINDARAJAN RETIRED V S, RAMANA K V R, et al.Citrus fruits-Varieties, chemistry, technology, and quality evaluation.Part II.Chemistry, technology, and quality evaluation.A.Chemistry[J].C R C Critical Reviews in Food Science and Nutrition, 1983, 18(4):313-386.
[9] HIJAZ F, GMITTER JR F G J, BAI J H, et al.Effect of fruit maturity on volatiles and sensory descriptors of four mandarin hybrids[J].Journal of Food Science, 2020, 85(5):1 548-1 564.
[10] 张序, 姜远茂, 彭福田, 等.‘红灯’甜樱桃果实发育进程中香气成分的组成及其变化[J].中国农业科学, 2007,40(6):1 222-1 228.
ZHANG X,JIANG Y M, PENG F T,et al.Changes of aroma components in ‘Hongdeng’ sweet cherry during fruit development[J].Scientia Agricultura Sinica, 2007,40(6):1 222-1 228.
[11] WANG L B, LUO W Q, SUN X X, et al.Changes in flavor-relevant compounds during vine ripening of tomato fruit and their relationship with ethylene production[J].Horticulture, Environment, and Biotechnology, 2018, 59(6):787-804.
[12] LI C B, XIN M, LI L, et al.Characterization of the aromatic profile of purple passion fruit (Passiflora edulis Sims) during ripening by HS-SPME-GC/MS and RNA sequencing[J].Food chemistry, 2021, 355:129685-129685.
[13] 康明丽, 潘思轶, 范刚, 等.HS-SPME-GC-MS法测定不同成熟度蜜柑果汁挥发性成分[J].食品工业科技, 2014, 35(19):326-330.
KANG M L, PAN S T, YAN G, et al.Changes of Aroma compounds in Satsuma mandsrins orange juice in different maturity[J].Science and Technology of Food Industry, 2014, 35(19):326-330.
[14] GARAITA M G, KENNEDY J F. Handbook of Citrus by-products and processing technology[J]. Carbohydrate Polymers, 2001, 46(4):393-394.
[15] 程玉娇. 宽皮柑橘果汁中挥发性硫化物和风味活性组分研究[D].重庆:西南大学, 2020.
CHENG Y J.Study on volatile sulfur compounds and aroma active volatiles in mandarin juice[D].Chongqing:Southwest University, 2020.
[16] CALLEJ N R M, MORALES M L, FERREIRA A C, et al.Defining the typical aroma of sherry vinegar:Sensory and chemical approach[J].Journal of Agricultural and Food Chemistry, 2008, 56(17):8 086-8 095.
N R M, MORALES M L, FERREIRA A C, et al.Defining the typical aroma of sherry vinegar:Sensory and chemical approach[J].Journal of Agricultural and Food Chemistry, 2008, 56(17):8 086-8 095.
[17] CHAUDHARY P R, JAYAPRAKASHA G K, PATIL B S.Identification of volatile profiles of Rio Red grapefruit at various developmental to maturity stages[J].Journal of Essential Oil Research, 2018, 30(2):77-83.
[18] TIETEL Z, PLOTTO A, FALLIK E, et al.Taste and aroma of fresh and stored mandarins[J].Journal of the Science of Food and Agriculture, 2011, 91(1):14-23.
[19] PEREZ-CACHO P R, ROUSEFF R.Processing and storage effects on orange juice aroma:A review[J].Journal of agricultural and food chemistry, 2008, 56(21):9 785-9 796.
[20] PÉREZ-L PEZ A J, SAURA D, LORENTE J, et al.Limonene, linalool, α-terpineol, and terpinen-4-ol as quality control parameters in mandarin juice processing[J].European Food Research and Technology, 2006, 222(3-4):281-285.
PEZ A J, SAURA D, LORENTE J, et al.Limonene, linalool, α-terpineol, and terpinen-4-ol as quality control parameters in mandarin juice processing[J].European Food Research and Technology, 2006, 222(3-4):281-285.
[21] TIETEL Z, LEWINSOHN E, FALLIK E, et al.Elucidating the roles of ethanol fermentation metabolism in causing off-flavors in mandarins[J].Journal of Agricultural and Food Chemistry, 2011, 59(21):11 779-11 785.
[22] 肖作兵, 李静, 牛云蔚, 等.GC-O/AEDA法结合OAV及香气重组试验鉴定玫瑰精油中特征香气化合物[J].中国食品学报, 2018, 18(4):319-324.
XIAO Z B, LI J, NIU Y W, et al.Characterization of the key odorants in rose oil by gas chromatography-olfactometry/aroma extract dilution analysis (AEDA), aroma recombination[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(4):319-324.
[23] AHMED E M, DENNISON R A, DOUGHERTY R H, et al.Flavor and odor thresholds in water of selected orange juice components[J].Journal of Agricultural and Food Chemistry, 1978, 26(1):187-191.
[24] CHOI H S, SAWAMURA M, KONDO Y.Characterization of the key aroma compounds of Citrus flaviculpus hort.ex Tanaka by aroma extraction dilution analysis[J].Journal of Food Science, 2002, 67(5):1 713-1 718.
[25] BUTTERY R G, SEIFERT R M, GUADAGNI D G, et al.Characterization of some volatile constituents of carrots[J].Journal of Agricultural and Food Chemistry, 1968, 16(6):1 009-1 015.
[26] PINO J A, MESA J.Contribution of volatile compounds to mango (Mangifera indica L.) aroma[J].Flavour and Fragrance Journal, 2006, 21(2):207-213.
[27] BOONBUMRUNG S, TAMURA H, MOOKDASANIT J, et al.Characteristic aroma components of the volatile oil of yellow Keaw mango fruits determined by limited odor unit method[J].Food Science and Technology Research, 2001, 7(3):200-206.
[28] BUTTERY R G, LING L C, LIGHT D M.Tomato leaf volatile aroma components[J].Journal of Agricultural and Food Chemistry, 1987, 35(6):1 039-1 042.
[29] TAKEOKA G R,GÜNTERT M,ENGEL K H. Aroma Active Compounds in Foods[M]. Washington: American Chemical Society, 2001.
[30] VAN-GEMERT L J.Complilations of Odour Threshold Values in Air, Water and Other Media[M].Van SettenKwadraat:Houten,the Netherlands, 2003.
[31] CZERNY M, CHRISTLBAUER M, CHRISTLBAUER M, et al.Re-investigation on odour thresholds of key food aroma compounds and development of an aroma language based on odour qualities of defined aqueous odorant solutions[J].European Food Research and Technology, 2008, 228(2):265-273.
[32] PINO J, TORRICELLA R, ORSI F.Correlation between sensory and gas-chromatographic measurements on grapefruit juice volatiles[J].Nahrung-Food, 1986, 30(8):783-790.
[33] BUTTERY R G, SEIFERT R M, GUADAGNI D G, et al.Characterization of additional volatile components of tomato[J].Journal of Agricultural and Food Chemistry, 1971, 19(3):524-529.
[34] PANG X L, GUO X F, QIN Z H, et al.Identification of aroma-active compounds in Jiashi muskmelon juice by GC-O-MS and OAV calculation[J].Journal of Agricultural & Food Chemistry, 2012, 60(17):4 179-4 185.
[35] TAMURA H, YANG R H, SUGISAWA H. Aroma Profiles of Peel Oils of Acid Citrus[M]. Washington, DC: American Chemical Society, 1993:121-136.
[36] PADRAYUTTAWAT A, YOSHIZAWA T,TAMURA H, et al.Optical isomers and odor thresholds of volatile constituents in Citrus sudachi[J].Food Science and Technology International, Tokyo, 1997, 3(4):402-408.