沙棘(Hippophae rhamnoides L.)是胡颓子科,沙棘属落叶性灌木[1-2]。在我国分布范围广,具有耐旱、抗风沙的特点,被广泛用于水土保持。沙棘果实大部分为圆球形、橙黄色[3]。沙棘具有止咳祛痰、消食化滞、活血化瘀等功效[4]。沙棘中营养和生物活性物质较丰富,广泛应用于食品、医药等其他国民经济领域[5-8]。沙棘中含有大量的有机酸,其中苹果酸和奎宁酸占总酸的90%以上[9-11]。沙棘为药食同源植物,抗氧化性能强,开发前景广[12-15]。
本研究通过展开条件的优化,建立专属性强、灵敏度高的高效薄层色谱扫描法对S1~S10产地沙棘果中苹果酸和奎宁酸进行定性和定量分析;采用紫外法测定了沙棘果对DPPH自由基、ABTS阳离子自由基、超氧阴离子自由基![]() 的清除率,为沙棘药食同源相关产品开发利用奠定基础。
的清除率,为沙棘药食同源相关产品开发利用奠定基础。
奎宁酸(批号:200303,纯度≥98%),成都植标化纯生物技术有限公司;DL-苹果酸(分析纯),天津市光复精细化工研究所;DPPH(批号:217-591-8),东京化工产业;二氯甲烷,分析纯,天津市北联精细化学品开发有限公司;乙酸乙酯、甲酸均为分析纯,上海山浦化工有限公司;实验室用水为蒸馏水;10 cm×20 cm高效硅胶G板,安徽良臣硅源材料有限公司;10 cm×20 cm高效硅胶G板、H板、GF254板,青岛海洋化工有限公司;聚酰胺薄膜,浙江省台州市路桥四甲生化塑料厂。
沙棘选自新疆青河(S1)、内蒙乌海(S2)、山西文水(S3)、陕西神木(S4)、青海祁连(S5)、甘肃陇县(S6)、山东滕州(S7)、吉林大安(S8)、河南淮阳(S9)、安徽亳州(S10)10个产地。S1~S10,亳州市华云中药饮片有限公司(经新疆医科大学中医学院李永和主任药师鉴定为胡颓子科、沙棘属)。
KQ3200DE型数控超声波清洗器,昆山超声仪器有限公司;HH-S4型恒温水浴锅,金坛市医疗仪器厂;TU-1810紫外可见分光光度计,北京普析通用仪器有限公司;Camag Linomat 5半自动点样仪、Camag TLC 3扫描仪、REPROTAR 3薄层色谱照相仪,瑞士卡马公司。
1.3.1 溶液的制备
1.3.1.1 对照品溶液的制备
分别精密称定10 mg苹果酸与奎宁酸,加甲醇配制成质量浓度为10 mg/mL的对照品溶液。
1.3.1.2 样品溶液的制备
参照文献[16]取沙棘果粉末2 g,加入20 mL乙醇,超声30 min后,过滤,滤液蒸干后加2 mL甲醇,过0.22 μm微孔滤膜,即为样品。
1.3.1.3 显色剂的制备
称取溴甲酚绿1 g,加乙醇至1 L,溶解制成1 g/L的溴甲酚绿乙醇溶液,调pH至5.4。
1.3.2 色谱程序
将硅胶G板在105 ℃下活化15 min。采用Camag Linomat 5半自动点样仪进行条带点样,点样量为2 μL,条带宽为6 mm,条带间距为10.9 mm,点样距底端为8 mm,左右边距40 mm,样品溶剂为甲醇,载气为氮气,速率为150 nL/s。点样后,在展开剂为V(二氯甲烷)∶V(乙酸乙酯)∶V(甲酸)=5∶6∶2.5的条件下,将点样后的硅胶G板饱和30 min,展开,取出,晾干,将其完全浸润至1 g/L溴甲酚绿乙醇溶液中,迅速捞出,热风吹干,加热至斑点明显后置日光灯下观察,结果见图1。由图1可知,苹果酸Rf值为0.59±0.05,奎宁酸Rf值为0.45±0.05,10个不同产地沙棘果样品中具有与苹果酸、奎宁酸Rf值相等的斑点,表明沙棘果中含有苹果酸和奎宁酸。采用CamagTLC3扫描仪,在200~700 nm进行双波长(540、618 nm)背景校正、全波长扫描,狭缝宽度4.00 mm×0.3 mm,扫描速度200 mm/s,展距85 mm,距底8 mm,灯为氘灯和钨灯。

Ma-苹果酸;Qa-奎宁酸;S1~S10-样品
图1 618 nm下高效薄层色谱图
Fig.1 High-performance thin-layer chromatogram at 618 nm
1.3.3 方法学考察
分别精密吸取对照品溶液在同一薄层板上点样6针,点样量为4 μL,点于同一块硅胶G板上,按照1.3.2方法展开后,扫描斑点,测定峰面积值,对其进行线性关系考察、精密度考察;分别在90 min内,每隔15 min测定一次苹果酸和奎宁酸的峰面积,考察稳定性;取同沙棘果样品(S6)溶液6份,考察重复性;取沙棘果样品(S6)6份,根据测得沙棘果样品的含量,加等量苹果酸、奎宁酸标准溶液,测定回收率。
1.3.4 含量测定
将沙棘果样品S1~S10点于同一薄层板上,根据1.3.2实验方法操作,以测得的峰面积值进行含量计算。
1.4.1 样品溶液的制备
取沙棘果粗粉2 g(过50目筛),第1次加60%(体积分数)乙醇30 mL加热回流2 h,过滤,剩余残渣再分别加热回流2次,每次1 h,合并3次滤液定容至100 mL,稀释50倍,即为供试品溶液。
1.4.2 DPPH自由基清除试验
参照文献[17-18]将沙棘果提取物溶液分别稀释成系列浓度,以维生素C为阳性对照,取3 mL沙棘果提取物溶液与2 mL的DPPH溶液混匀后,背光处静置30 min。用无水乙醇作空白,在516 nm下检测OD值。每个沙棘果样品平行测3次,DPPH自由基清除率计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:A2,取3 mL沙棘果提取物溶液与2 mL的DPPH溶液反应后测得的OD值;A1,取3 mL沙棘果提取物溶液与2 mL的无水乙醇溶液反应后测得的OD值;A0,取3 mL无水乙醇溶液与2 mL的DPPH溶液反应后测得的OD值。
1.4.3 ABTS阳离子自由基清除试验
参照文献[19-20]将沙棘果提取物溶液分别稀释成系列浓度,以维生素C为阳性对照,取0.2 mL沙棘果提取物溶液与3.9 mL的ABTS溶液混匀后,背光处静置15 min。用无水乙醇扣除空白,在734 nm处检测OD值。每个沙棘果样品平行测3次,ABTS阳离子自由基清除率计算如公式(2)所示:
ABTS阳离子自由基清除率![]()
(2)
式中:A2,取0.2 mL沙棘果提取物溶液与3.9 mL的ABTS溶液反应后测得的OD值;A1,取0.2 mL沙棘果提取物溶液与3.9 mL的无水乙醇溶液反应后测得的OD值;A0,取0.2 mL无水乙醇溶液与3.9 mL的ABTS溶液反应后测得的OD值。
![]() 清除试验
清除试验
参照文献[21]将沙棘果提取物溶液分别稀释成系列浓度,以维生素C为阳性对照,取1 mL沙棘果提取物溶液与2.5 mL的Tris-HCl溶液混匀后在25 ℃下水浴20 min,再加入1 mL的邻苯三酚溶液混匀后在25 ℃下水浴6 min,最后加入0.1 mL浓HCl(8 mmol/L)终结反应。用超纯水作空白,在320 nm处检测OD值。每个沙棘果样品平行测3次,![]() 清除率计算如公式(3)所示:
清除率计算如公式(3)所示:
![]() 清除率
清除率![]()
(3)
式中:A2,取1 mL沙棘果提取物溶液与2.5 mL的Tris-HCl溶液混匀后在25 ℃下水浴20 min,再加入1 mL的邻苯三酚溶液混匀后在25 ℃下水浴6 min,最后加入0.1 mL浓HCl(8 mmol/L)终结反应后测得的OD值;A1,在A2的基础上用1 mL的超纯水代替邻苯三酚,反应后测得的OD值;A0,在A2的基础上用1 mL的超纯水代替沙棘果提取物溶液,反应后测得的OD值。
根据1.3.2色谱程序操作,将标准品和样品用TLC扫描仪在200~700 nm处扫描,最终确定标准品和样品在618 nm处有最大吸收波长,结果见图2-a和图2-b。
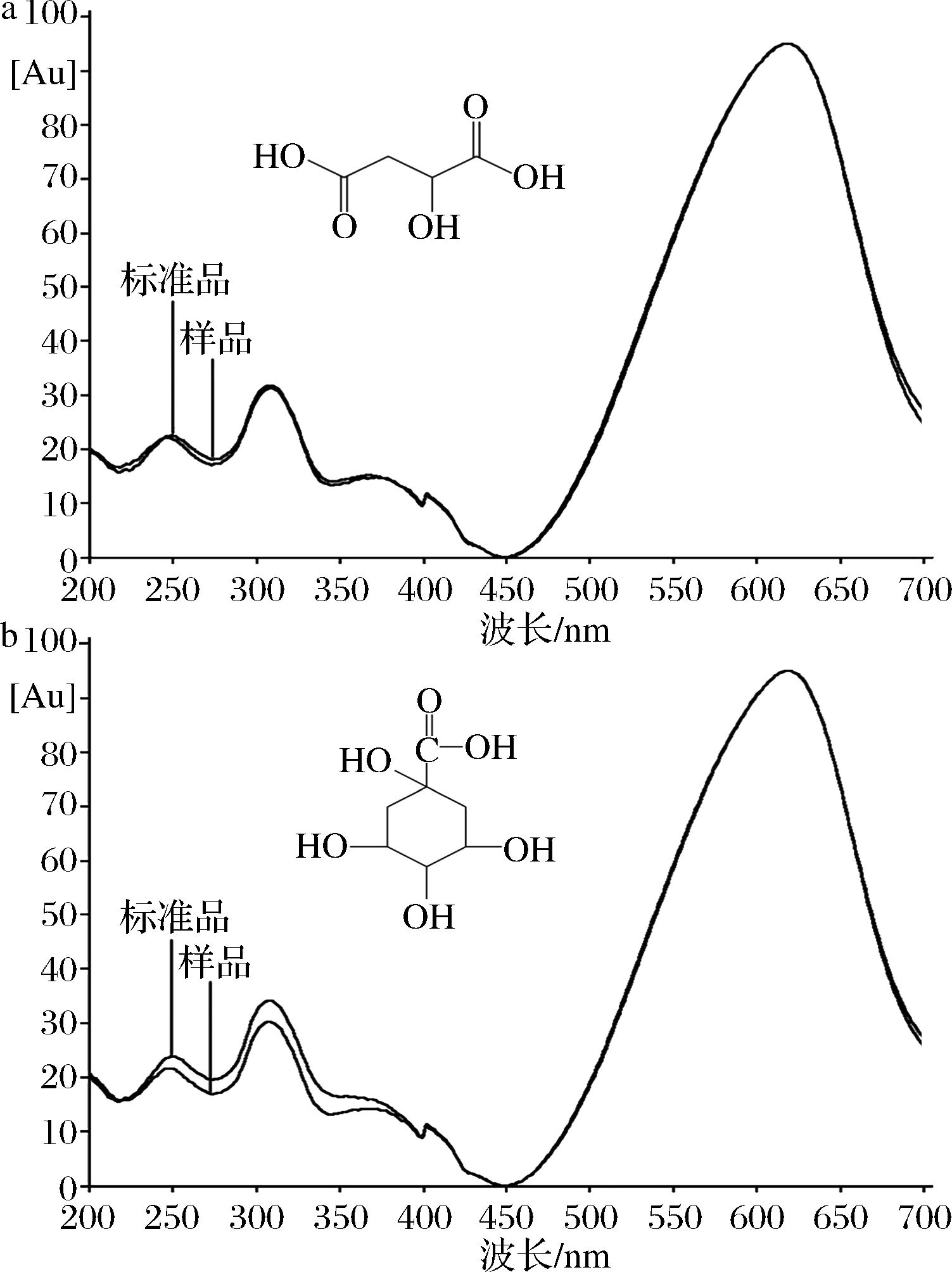
a-苹果酸;b-奎宁酸
图2 苹果酸和奎宁酸标准品和样品(S6)全波长扫描图
Fig.2 Full wavelength scans of malic acid and quinic acid standard and sample (S6)
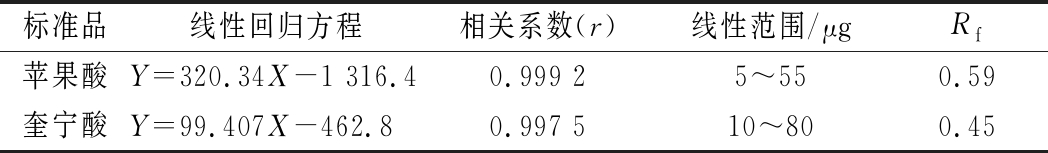
2.2.1 线性关系
试验结果见表1。结果表明,苹果酸在5~55 μg线性关系良好;奎宁酸在10~80 μg线性关系良好。
表1 标准品的线性关系
Table 1 Linear relationship of standard products
标准品线性回归方程相关系数(r)线性范围/μgRf苹果酸Y=320.34X-1 316.40.999 25~550.59奎宁酸Y=99.407X-462.80.997 510~800.45
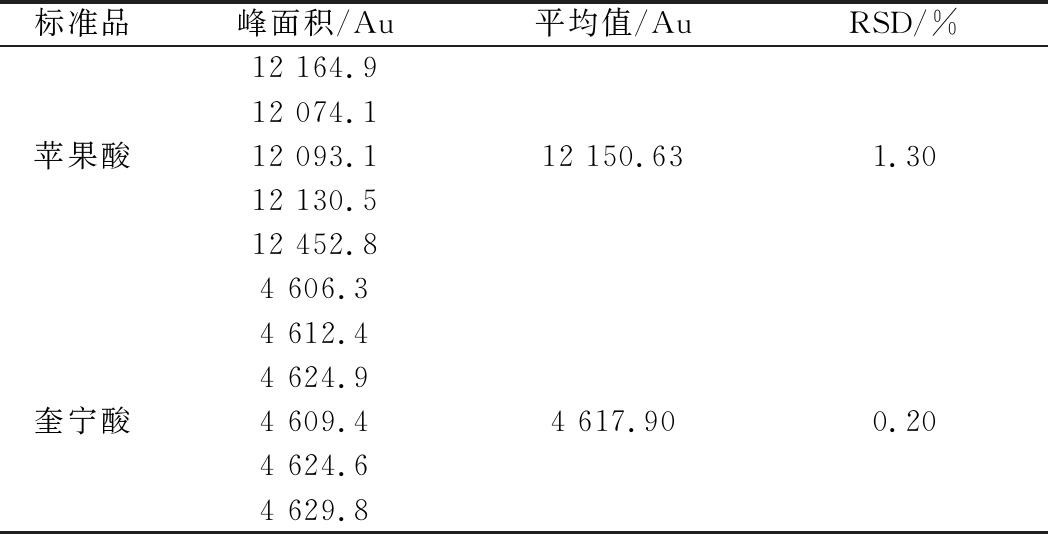
2.2.2 精密度
苹果酸峰面积平均值为12 150.63,相对标准偏差(relative standard deviation,RSD)值为1.3%;奎宁酸峰面积平均值为4 617.90,RSD值为0.2%。结果表明该仪器具有良好的精密度(表2)。
表2 精密度试验结果
Table 2 The results of precision test
标准品峰面积/Au平均值/AuRSD/%12 164.912 074.1苹果酸12 093.112 150.631.3012 130.512 452.84 606.34 612.44 624.9奎宁酸4 609.44 617.900.204 624.64 629.8
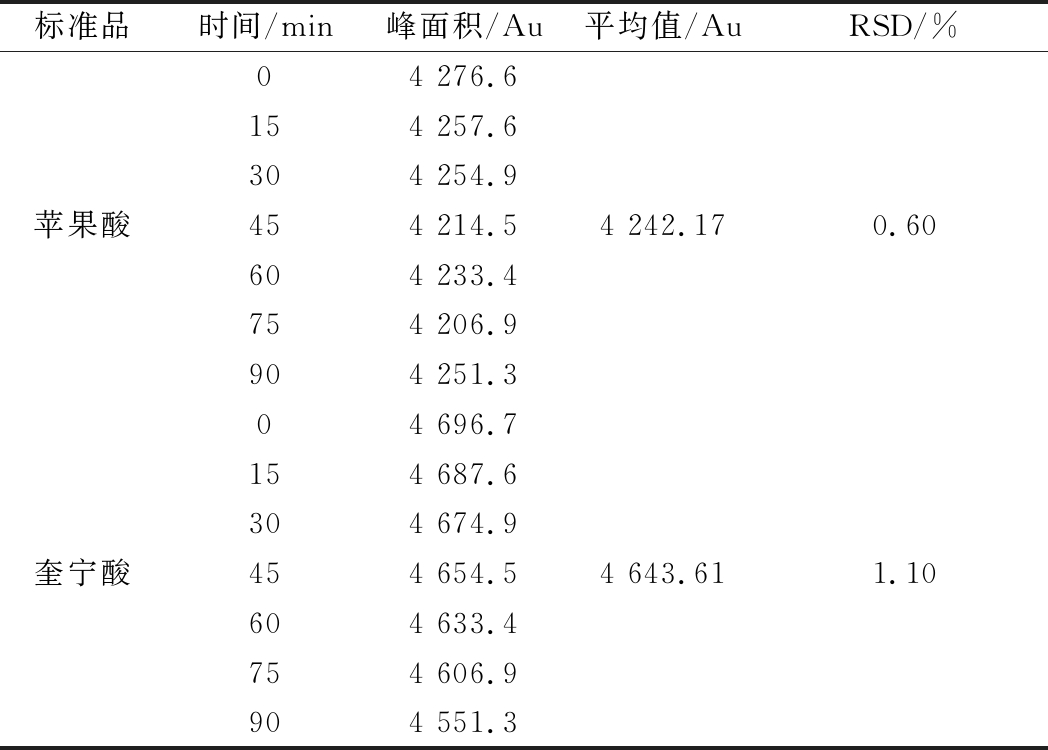
2.2.3 稳定性
苹果酸、奎宁酸RSD值分别为0.6%、1.1%。实验结果表明沙棘果样品溶液在90 min内显色稳定。结果见表3。
表3 稳定性试验结果
Table 3 The results of stability test
标准品时间/min峰面积/Au平均值/AuRSD/%04 276.6154 257.6304 254.9苹果酸454 214.54 242.170.60604 233.4754 206.9904 251.304 696.7154 687.6304 674.9奎宁酸454 654.54 643.611.10604 633.4754 606.9904 551.3
2.2.4 重复性
苹果酸和奎宁酸RSD值分别为1.1%、0.2%,实验结果表明沙棘果样品溶液重复性良好,结果见表4。
表4 重复性试验结果
Table 4 The results of repeatability test
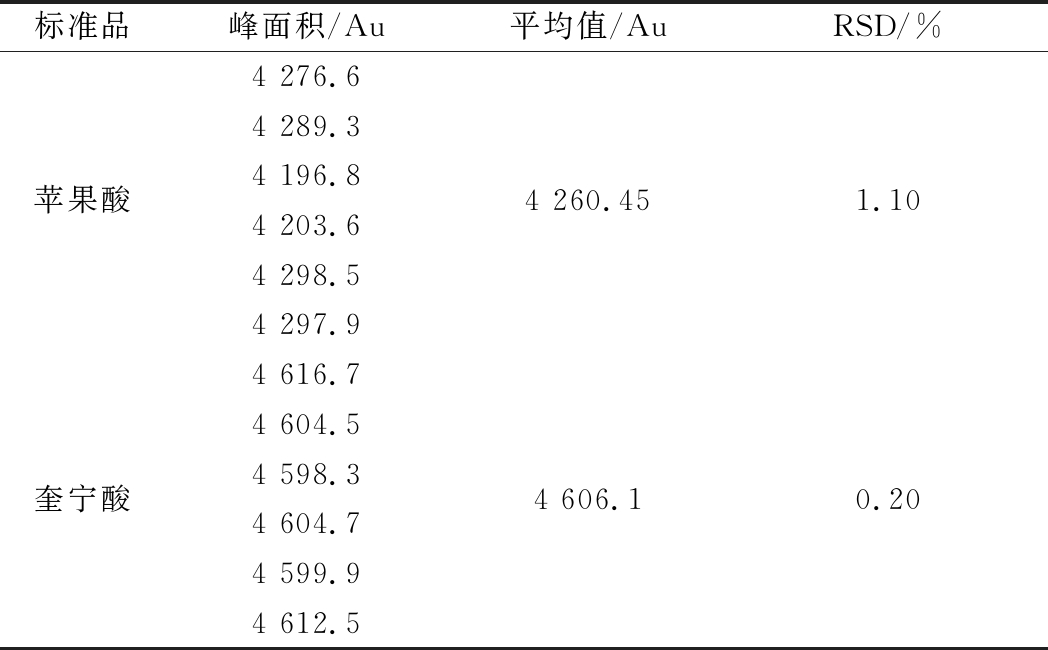
标准品峰面积/Au平均值/AuRSD/%4 276.64 289.3苹果酸4 196.84 260.451.104 203.64 298.54 297.94 616.74 604.5奎宁酸4 598.34 606.10.204 604.74 599.94 612.5
2.2.5 加标回收率
实验结果表明,苹果酸平均回收率为(99.71+1.76)%;奎宁酸平均回收率为(100.26+2.16)%。实验结果表明,苹果酸和奎宁酸回收率良好,结果见表5。
表5 回收率试验结果 单位:%
Table 5 The results of recovery experiment(n=9)
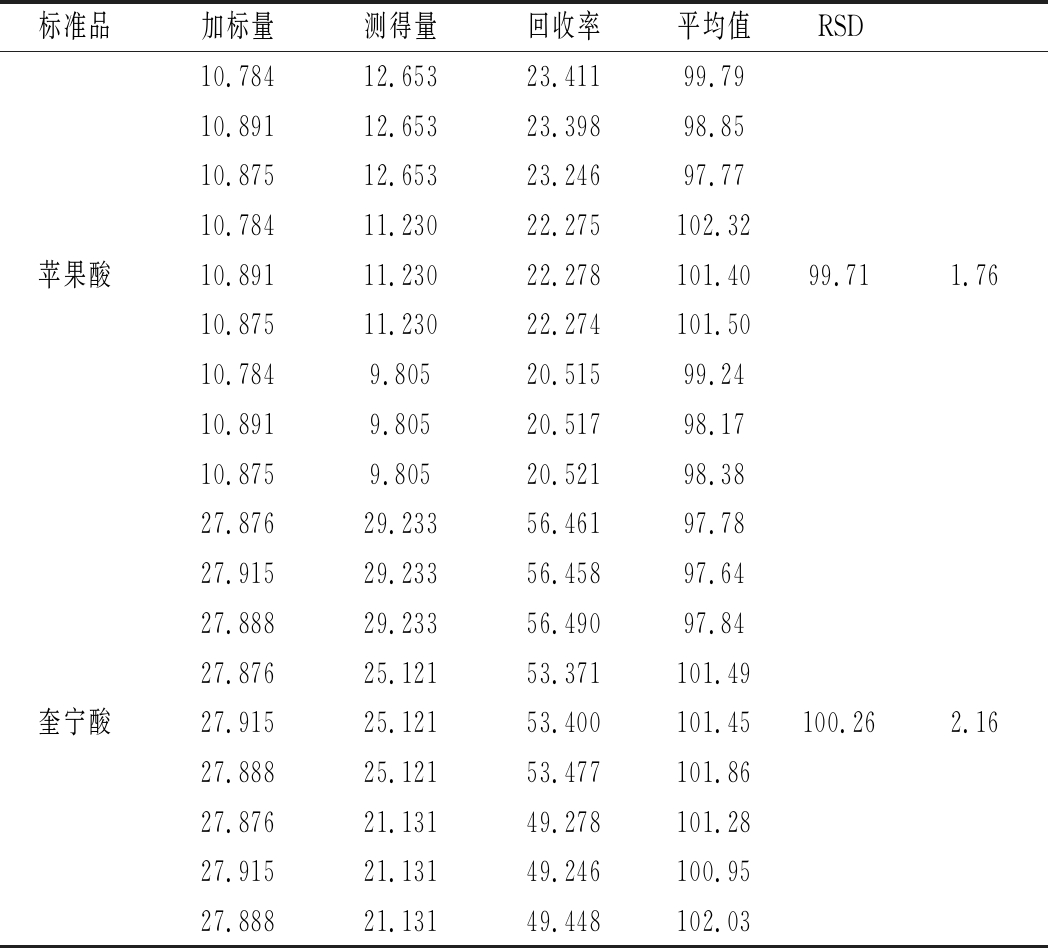
标准品加标量测得量回收率平均值RSD10.78412.65323.41199.7910.89112.65323.39898.8510.87512.65323.24697.7710.78411.23022.275102.32苹果酸10.89111.23022.278101.4099.711.7610.87511.23022.274101.5010.7849.80520.51599.2410.8919.80520.51798.1710.8759.80520.52198.3827.87629.23356.46197.7827.91529.23356.45897.6427.88829.23356.49097.8427.87625.12153.371101.49奎宁酸27.91525.12153.400101.45100.262.1627.88825.12153.477101.8627.87621.13149.278101.2827.91521.13149.246100.9527.88821.13149.448102.03
在618 nm处扫描标准品和样品,得到标准品和样品的扫描(图3、图4),以测得的峰面积值进行含量测定(表6)。利用SPSS 25.0软件对数据进行最小显著差别(least significant difference,LSD)方差分析,并在此基础上采用Origin绘图工具绘制显著性差异标记柱形图,结果见图5。通过分析比较,发现10个不同产地中,S1与S3产地,S2和S4、S6产地的沙棘果苹果酸含量无显著性差异(P>0.05),其余每2个产地之间均有显著性差异(P<0.05);其中S10产地苹果酸的含量最高为18.7 μg/g,S7产地苹果酸含量最低为6.09 μg/g;10个不同产地沙棘果中,S4与S5、S6产地,S5和S6、S8产地的奎宁酸含量无显著性差异(P>0.05),其余每2个产地之间均有显著性差异(P<0.05);S10产地奎宁酸的含量最高为44.95 μg/g,S1产地奎宁酸含量最低为13.69 μg/g。这可能与生长地区气候、土壤环境等有一定的关系。

a-混合标准品;b-样品
图3 双波长(540、618 nm)下苹果酸和奎宁酸混合标准品和样品(S6)扫描图
Fig.3 Scans of malic acid, quinic acid, and samples (S6) at dual wavelengths (540, 618 nm)
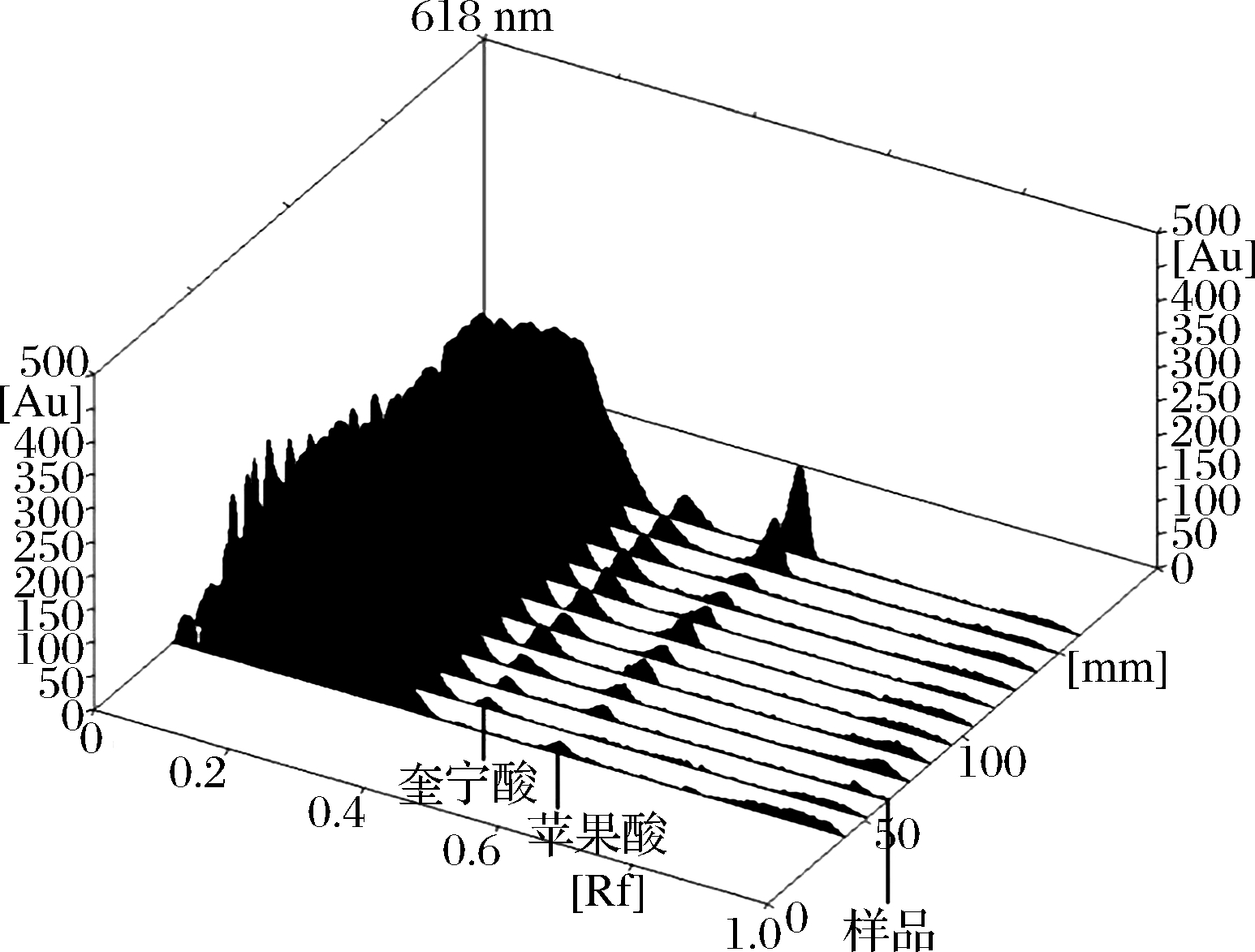
图4 双波长(540、618 nm)下标准品和样品(S1~S10)3D扫描图
Fig.4 3D scans of standards and samples (S1-S10) at dual wavelengths (540, 618 nm)
表6 样品含量测定结果
Table 6 The results of content determination in samples(n=3,X±SD)

产地样品苹果酸含量/(μg·g-1)奎宁酸含量/(μg·g-1)新疆S110.74±0.5613.69±0.93内蒙S28.53±0.0323.78±0.06山西S310.54±0.0539.23±0.13陕西S48.35±0.0324.65±0.07青海S59.79±0.0227.92±0.04甘肃S68.72±0.0325.67±0.17山东S76.09±0.0230.78±0.08吉林S87.28±0.0327.82±0.06河南S914.32±0.0137.29±0.20安徽S1018.70±0.0244.95±0.11
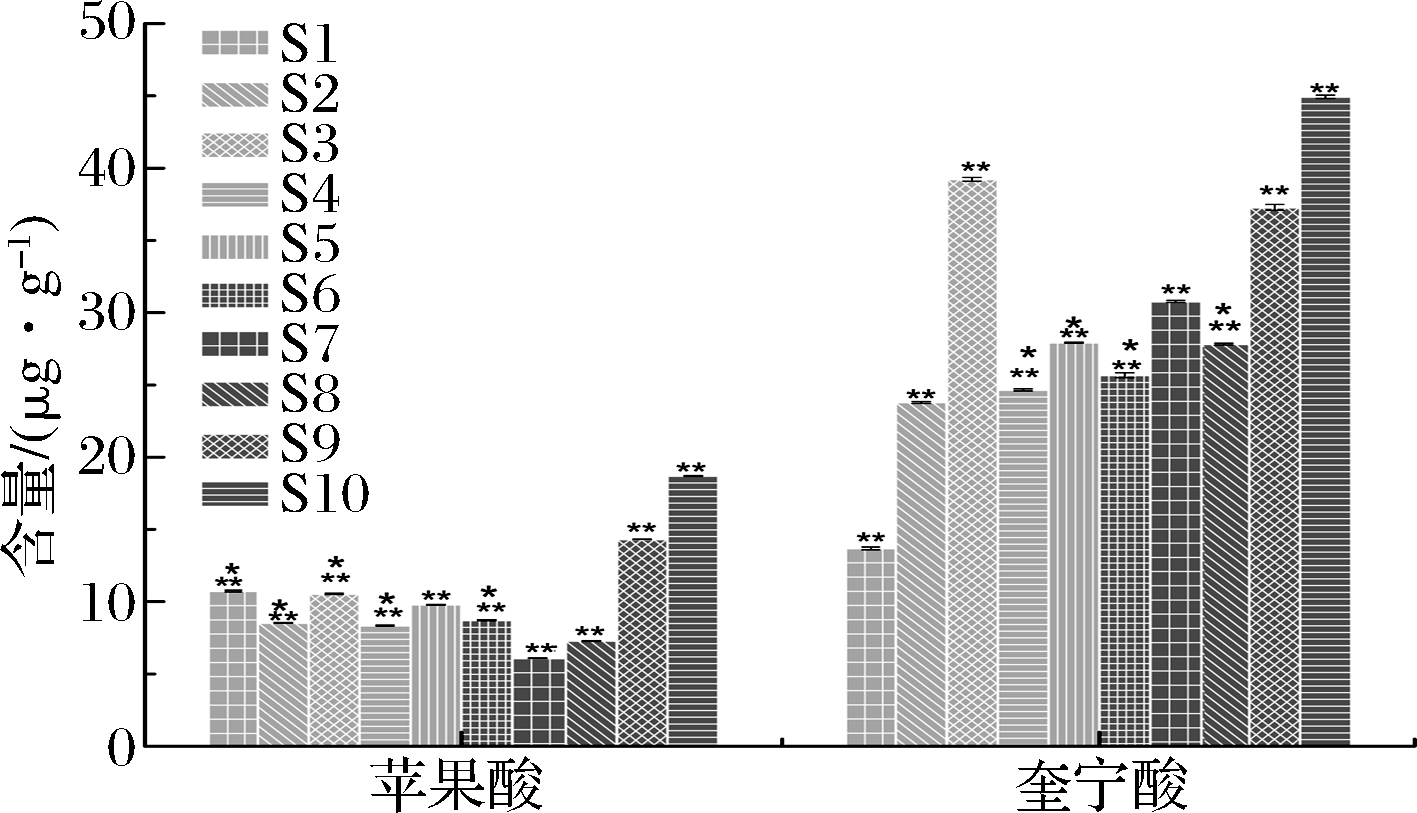
图5 S1~S10沙棘果中苹果酸和奎宁酸含量方差分析结果
Fig.5 Variance analysis results of malic acid and quinic acid contents in S1~S10 Hippophae rhamnoides L.fruits
注:*表示P>0.05,**表示P<0.05,对S1~S10进行两两比较
2.4.1 DPPH自由基抗氧化结果
根据1.4.2的试验方法考察S7~S10的DPPH自由基清除率,试验结果如图6所示。由图6可知,S7~S10沙棘果提取物对DPPH自由基具有较强的清除活性,且与其具有一定的量效关系。在试验浓度范围内,S7~S10沙棘果提取物DPPH自由基的IC50为0.11~0.13 mg/mL,其中S7~S10的最大清除率为93.71%~96.27%,仅次于维生素C,说明沙棘果提取物对DPPH自由基清除能力在一定浓度范围内确实具有较好的剂量依赖性。

图6 沙棘提取物对DPPH自由基的清除作用
Fig.6 The scavenging effect of Hippophae rhamnoides L.
extract on DPPH
2.4.2 ABTS阳离子自由基抗氧化结果
根据1.4.3的试验方法考察S7~S10的ABTS阳离子自由基清除率,试验结果如图7所示。由图7可知,S7~S10沙棘果提取物对ABTS阳离子自由基具有较强的清除活性,且与其具有一定的量效关系。在试验浓度范围内,S7~S10沙棘果提取物ABTS阳离子自由基的IC50为0.11~0.61 mg/mL,其中S7~S10的最大清除率为92.18%~99.39%,仅次于维生素C,说明沙棘果提取物对ABTS阳离子自由基清除能力在一定浓度范围内确实具有较好的剂量依赖性。
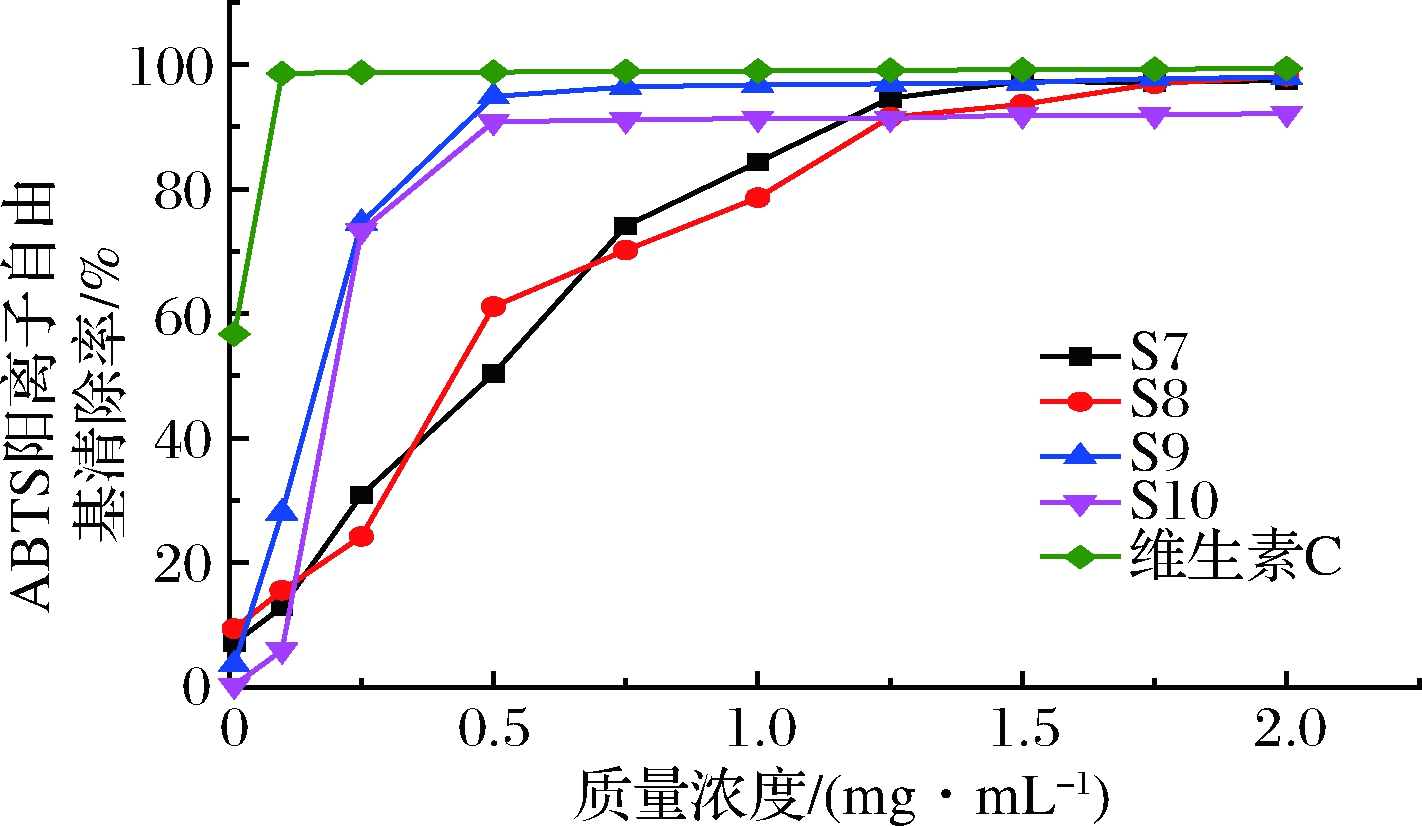
图7 沙棘提取物对ABTS阳离子自由基的清除作用
Fig.7 Scavenging effect of Hippophae rhamnoides L.
extract on ABTS
![]() 抗氧化结果
抗氧化结果
根据1.4.4的试验方法考察S7~S10的![]() 清除率,试验结果如图8所示。由图8可知,S7~S10沙棘果提取物对
清除率,试验结果如图8所示。由图8可知,S7~S10沙棘果提取物对![]() 具有较强的清除活性,且与其具有一定的量效关系。在试验浓度范围内,S7~S10沙棘果提取物
具有较强的清除活性,且与其具有一定的量效关系。在试验浓度范围内,S7~S10沙棘果提取物![]() 的IC50为1.80%~2.90 mg/mL,其中S7~S10的最大清除率为81.92%~100.07%,仅次于维生素C。说明沙棘果提取物对
的IC50为1.80%~2.90 mg/mL,其中S7~S10的最大清除率为81.92%~100.07%,仅次于维生素C。说明沙棘果提取物对![]() 清除能力在一定浓度范围内确实具有较好的剂量依赖性。
清除能力在一定浓度范围内确实具有较好的剂量依赖性。

图8 沙棘提取物对![]() 的清除作用
的清除作用
Fig.8 The scavenging effect of Hippophae rhamnoides L.![]()
前处理条件:试验操作过程中,待薄层板展开完全,将其浸润至1 g/L溴甲酚绿乙醇溶液中,迅速捞出,热风吹干,加热至斑点明显后置日光灯下观察,若采用喷雾瓶喷洒显色剂会导致显色不均匀从而使得双波长扫描时产生较大误差,故采用浸润显色。显色时应当将显色剂pH调至5.4,扫描时选择双波长扫描,保证处于背景校正模式,才能展现出良好的分离效果。
薄层板选择:本试验先后考察了高效薄层硅胶G板、H板、GF254板和聚酰胺薄膜对沙棘果中苹果酸和奎宁酸分离效果的影响,试验结果表明G板分离效果最佳。又分别考察了安徽良臣和青岛海洋高效薄层硅胶G板,表明安徽良臣硅胶G板分离效果最佳。
条件选择:以乙醇为溶剂对样品超声提取30 min,在V(二氯甲烷)∶V(乙酸乙酯)∶V(甲酸)=5∶6∶2.5条件下展开,其斑点信息多且清晰,分离效果较好。此外,试验过程中需将温度控制在5~20 ℃、湿度控制在10%~20%。此时,展开的斑点较多,分离效果好。不同产地沙棘果中苹果酸和奎宁酸含量具有一定差异,如S9、S10沙棘果的斑点颜色较深且清晰,而S1和S4沙棘果的斑点较小且颜色较淡,表明温度、湿度、光照等环境因素对沙棘果的化学成分影响较大[22]。
抗氧化试验过程中,DPPH溶液配制建议使用棕色容量瓶或者外层包裹锡纸,防止其分解;ABTS溶液配制时静置16 h后调整吸光度至0.7±0.02,且需尽快完成试验避免因溶液的稳定性造成较大的试验误差;![]() 试验中应遵守酸入水原则,防止过量产热造成安全隐患;以上试验均需避光反应。
试验中应遵守酸入水原则,防止过量产热造成安全隐患;以上试验均需避光反应。
本研究建立了一种利用高效薄层色谱扫描法对S1~S10产地沙棘果中苹果酸和奎宁酸进行定性和定量分析的方法,测定沙棘果中苹果酸和奎宁酸的含量。结果显示,10个产地沙棘果中苹果酸含量为7.28~18.70 μg/g;奎宁酸含量为13.69~44.95 μg/g。方法学考察结果均符合相关规定。抗氧化试验结果表明S7~S10产地DPPH自由基的IC50为0.11~0.13 mg/mL,其中S7~S10的最大清除率为93.71%~96.27%;ABTS阳离子自由基的IC50为0.11~0.61 mg/mL,其中S7~S10的最大清除率为92.18%~![]() 的IC50为1.80~2.90 mg/mL,其中S7~S10的最大清除率为81.92%~100.07%;DPPH自由基、ABTS阳离子自由基
的IC50为1.80~2.90 mg/mL,其中S7~S10的最大清除率为81.92%~100.07%;DPPH自由基、ABTS阳离子自由基![]() 清除率均仅次于维生素C,表明沙棘果是具有高抗氧化性能的药食同源植物。本研究所建立的方法更易于广泛推广沙棘果的快速检测,在一定程度上丰富沙棘果的鉴别方法,为沙棘果的质量控制提供一定参考。本研究采用试剂均为低毒性,对人体和自然环境友好。
清除率均仅次于维生素C,表明沙棘果是具有高抗氧化性能的药食同源植物。本研究所建立的方法更易于广泛推广沙棘果的快速检测,在一定程度上丰富沙棘果的鉴别方法,为沙棘果的质量控制提供一定参考。本研究采用试剂均为低毒性,对人体和自然环境友好。
[1] 郑鹏, 王波, 王前.沙棘果油对过氧化氢诱导氧化损伤的保护作用[J].广西植物, 2020, 40(9):1 349-1 356.
ZHENG P, WANG B, WANG Q.Protective effects of sea buckthorn fruit oil on oxidative damage induced by hydrogen peroxide[J].Guihaia, 2020, 40(9):1 349-1 356.
[2] 李娜, 胡月月, 葛亮.不同产地沙棘中总黄酮、总多酚含量测定及其抗氧化活性研究[J].化学与生物工程, 2021, 38(8):64-68.
LI N, HU Y Y, GE L.Determination of contents of total flavonoids and total polyphenols in Hippophae rhamnoides L.from different origins and their antioxidant activity[J].Chemistry & Bioengineering, 2021, 38(8):64-68.
[3] 盛艳, 吴泽柱.沙棘的营养保健功能及其开发利用研究进展[J].农产品加工, 2017(9):58-60;63.
SHENG Y, WU Z Z.Research progress in nutrition and health care functions of sea buckthorn and its development and utilization[J].Farm Products Processing, 2017(9):58-60;63.
[4] 米智, 刘荔贞, 武晓红.响应面法优化沙棘果粉黄酮提取工艺的研究[J].中国调味品, 2020, 45(10):148-152.
MI Z, LIU L Z, WU X H.Optimization of extraction process of flavonoids from Hippophae rhamnoides Linn.powder by response surface methodology[J].China Cindiment, 2020, 45(10):148-152.
[5] 黄海华, 胡辉, 龚华梦, 等.沙棘配方颗粒的色谱鉴定及含量测定[J].华西药学杂志, 2020, 35(2):191-197.
HUANG H H, HU H, GONG H M.Study on the quality standards of sea buckthorn dispensing granules[J].West China Journal of Pharmaceutical Sciences, 2020, 35(2):191-197.
[6] 魏晋梅, 刘彩云, 方彦, 等.沙棘果油脂肪酸与微量元素测定[J].食品与发酵工业, 2021, 47(2):268-273.
WEI J M, LIU C Y, FANG Y, et al.Determination of fatty acid compositions and trace elements in sea buckthorn fruit oil[J].Food and Fermentation Industries, 2021, 47(2):268-273.
[7] 陈春. 沙棘开发利用的研究现状[J].山西林业科技, 2017, 46(4):47-49.
CHEN C.Research status on development and utilization of Hippophae rhamnoides[J].Shanxi Forestry Science and Technology, 2017, 46(4):47-49.
[8] GE L, LI N, HU Y Y.Qualitative and quantitative analyses of quercetin and isorhamnetin in Hippophae rhamnoides L.fruits hydrolysis products by high-performance thin-layer chromatography[J].JPC-J Planar Chromat, 2012, 34:315-322.
[9] 周浩楠, 胡娜, 董琦, 等.沙棘化学成分及药理作用的研究进展[J].华西药学杂志, 2020, 35(2):211-217.
ZHOU H N, HU N, DONG Q, et al.Research progress on the chemical composition and pharmacological action of Hippophae rhamnoides[J].West China Journal of Pharmaceutical Sciences, 2020, 35(2):211-217.
[10] 冉贝贝, 李卫东.沙棘果与沙棘叶化学成分及其差异的研究进展[J].中国中药杂志, 2019, 44(9):1 767-1 773.
RAN B B, LI W D.Research progress on chemical constituents and their differences between sea buckthorn berries and leaves[J].China Journal of Chinese Materia Medica, 2019, 44(9):1 767-1 773.
[11] 吴紫洁, 阮成江, 李贺, 等.12个沙棘品种的果实可溶性糖和有机酸组分研究[J].西北林学院学报, 2016, 31(4):106-112.WU Z J, RUAN C J, LI H,et al.Compositions of soluble sugars and organic acids in berries of 12 sea-buckthorn cultivars[J].Journal of Northwest Forestry University, 2016, 31(4):106-112.
[12] 田建华, 张春媛, 魏璐.沙棘果渣总黄酮提取工艺优化及抗氧化活性研究[J].天然产物研究与开发, 2021, 33(1):65-72.
TIAN J H, ZHANG C Y, WEI L.Study on the extraction technology and antioxidant activity of total flavonoids from the pomace of sea buckthorn[J].Natural Product Research and Development, 2021, 33(1):65-72.
[13] 汪成, 王怀友, 汪蔓青, 等.不同产地沙棘果化学成分含量及抗氧化活性的研究[J].华西药学杂志, 2020, 35(5):513-517.
WANG C, WANG H Y, WANG M Q, et al. Study on content of major chemical constituents and anti-oxidation activities of sea buckthorn fruit[J].West China Journal of Pharmaceutical Sciences, 2020, 35(5):513-517.
[14] 董诗婷, 陈云, 高群玉.沙棘果生物活性成分及其功能的研究进展[J].中国酿造, 2020, 39(2):26-32.
DONG S T, CHEN Y, GAO Q Y.Research progress on bioactive compounds and function of sea buckthorn berry[J].China Brewing, 2020, 39(2):26-32.
[15] 田建华. 干燥温度对沙棘果渣中VC、VE和总黄酮含量的影响[J].食品工程, 2020(4):30-32.
TIAN J H.Effect of drying temperature on the content of VC, VE and total flavonoids in seabuckthorn fruit residue[J].Food Engineering, 2020(4):30-32.
[16] 江茶龙, 谢晓梅, 张玲, 等.木瓜中有机酸和鞣质类成分的薄层色谱鉴别[J].安徽中医学院学报, 2010, 29(1):58-60.
JIANG C L, XIE X M, ZHANG L, et al.Identification of organic acids and tannins in fructus chaenomelis by thin-layer chromatography[J].Journal of Anhui Traditional Chinese Medical College, 2010, 29(1):58-60.
[17] 张婷婷, 摆富叶, 李乔乔, 等.黑果腺肋花楸果微乳系统薄层色谱分析及生物自显影抗氧化活性研究[J/OL].食品与发酵工业,2021.htpp://doi.org/10.13995/j.cnki.11-1802/ts.028665.
ZHANG T T, BAI F Y, LI Q Q.Microemulsion system thin-layer chromatographic analysis in black chokeberry and bioautography for screening antioxidant components[J]. Food and Fermentation Industries,2021.htpp://doi.org/10.13995/j.cnki.11-1802/ts.028665.
[18] 孙纯勇, 王玲娜, 颜培正, 等.体外仿生消化对金银花醇提物成分及抗氧化活性的影响[J].食品与发酵工业,2022,48(1):117-123.
SUN C Y, WANG L N, YAN P Z, et al.Effects of biomimeticdigestion on composition and antioxidant activity of alcohol extracts from Lonicera japonica Thunb.in vitro[J].Food and Fermentation Industries,2022,48(1):117-123
[19] HAN J R, DU Y N, YAN J N, et al.Effect of non-covalent binding of phenolic derivatives with scallop (Patinopecten yessoensis) gonad protein isolates on protein structure and in vitro digestion characteristics[J].Food Chemistry, 2021, 357:129690.
[20] 王立抗, 陈鸿庚, 黄智霖, 等.牛大力不同部位总黄酮、多酚含量及其抗氧化活性研究[J/OL].中华中医药学刊, 2021.http://kns.cnki.net/kcms/detail/21.1546.R.20210910.1615.032.html.
WANG L K, CHEN H G, HUANG Z L, et al.Antioxidant activities and contents of total flavonoids and polyphenols from different parts of Millettia speciose champ[J/OL].Chinese Archives of Traditional Chinese Medicine, 2021.http://kns.cnki.net/kcms/detail/21.1546.R.20210910.1615.032.html.
[21] ZHAO L, JI Z H, LI K O, et al.HPLC-DAD analysis of Hyssopus cuspidatus Boriss extract and mensuration of its antioxygenation property[J].BMC Complementary Medicine and Therapies, 2020, 20(1):228
[22] 林赫杰, 陈钰.沙棘研究现状、开发利用及发展前景[J].天津农业科学, 2010, 16(2):128-130.
LIN H Z, CHEN Y.Research status, development and prospects of sea buckthorn[J].Tianjin Agricultural Sciences, 2010, 16(2):128-130.